一种用于超声引导下经胸经心外膜心肌内注射的三联微导管装置和方法与流程
本申请涉及心肌内注射药物的技术,尤其涉及超声引导下经胸经心外膜心肌内注射的三联微导管装置和方法。
背景技术:
心血管疾病约占人类全部死因的25%,多种心血管疾病均可导致心力衰竭,如心肌梗死,心脏瓣膜病、心肌病、高血压病等。成年人心力衰竭的发生率在欧美国家是1-2%,在我国是0.9-1.3%,呈上升趋势。对于心衰患者,即使纠正原发病因,由于绝大多数的心肌细胞都处于终末分化状态,细胞缺乏自我再生能力,一旦坏死就很难再生,所以心功能恶化很难逆转,死亡率居高不下,且大量消耗医疗资源。目前除药物治疗改善左室重构外,心衰的治疗方法还包括心脏再同步化治疗、左室辅助装置、心脏移植等,但均具有各自局限性。当前,心衰患者远期预后不容乐观,心衰首次发病后5年生存率小于50%,与恶性肿瘤相当。
近年来,以干细胞和细胞因子等为代表的生物治疗为心衰患者带来了希望,该治疗方法有直接修复受损心肌的潜力,具有巨大的社会应用价值。在科研相关的动物实验和临床实验中,目前主要有经外周静脉、经冠状动脉,通过导管经心内膜和开胸经心外膜心肌内注射给药等途径。其中经外周静脉和冠状动脉途径,药物经过血液循环进入局部心肌,使得受损心肌局部血药浓度低,效果差。通过导管经心内膜给药需要特殊手术器械,花费大,且导管穿刺针在立体的心腔内很难精确定位,通过电生理系统标测进一步增加了手术难度和费用,影响实际应用。而开胸经心外膜心肌内注射途径,虽然受损心肌局部血药浓度高,但开胸创伤大、麻醉风险高,直接破坏心包结构,术后瘢痕黏连进一步降低干预效果,临床应用困难,更多用于原本就计划开胸手术的患者。因此,探索一种创伤小、针对需要干预的局部心肌组织能准确定位,给药效率高的途径和方法具有很强的科研和临床应用价值。
高分辨率超声目前的空间分辨率已接近磁共振成像,高质量的图像让超声导引下穿刺临床应用日益增多,在肝脏肿瘤、甲状腺结节等多种疾病中广泛开展。由于心脏是一个持续跳动的器官,而超声具有高时间分辨率特点,因此在心脏影像领域超声具有独到优势。我们在前期的动物实验中发现,开胸或者利用高分辨率超声引导临床常用的斜面式穿刺针(18g或22g)穿刺心肌组织,只要不直接损伤血管和穿透室壁,局部心肌仅少量渗血,动物生命体征平稳。
心外膜分布有冠状动脉和静脉,穿刺过程中一旦损伤,有可能引起急性心包填塞危及生命。且心脏持续跳动,对穿刺注射给药位置的精确控制存在很大影响,当穿刺针完全固定,随着心脏收缩舒张运动,可能引起二次损伤,注射给药位置也会发生改变。常规使用的穿刺针为内带配套针芯的斜面式穿刺针,针体在超声下呈强回声,粗穿刺针,如18g穿刺针外径1.2mm,更利于穿透浅表质硬组织,以及在周围多骨性结构的组织中建立一条稳定的通道如胸壁,但损伤深部组织,尤其是重要组织的风险更高,如经胸经心外膜穿刺心肌时,损伤心外膜血管的风险更高,对局部心肌组织的直接损伤也更大。
技术实现要素:
鉴于上述问题,本申请旨在提出一种可以在超声引导下经胸经心外膜进行心肌内注射的微导管装置,其可以直接对心肌进行给药注射。本申请还旨在提出一种在超声引导下经胸经心外膜对心肌进行注射的方法。
本申请提出一种三联微导管装置,用于超声引导下经胸经心外膜进行心肌内注射,其包括:粗穿刺针、微导管、细针芯;
粗穿刺针形成为管体,其第一端为形成有斜面的尖端,用于穿刺胸壁;
微导管为具有柔韧性的管体,其第一端为形成有斜面的尖端,用于刺入受试者的心肌内;
细针芯形成为实心的,其第一端为形成有斜面的尖端;
微导管和细针芯的长度大于粗穿刺针的长度;
微导管插入于粗穿刺针中,微导管与粗穿刺针之间形成为气密的;
在穿刺过程中,细针芯插入于微导管中,且细针芯与微导管之间形成为气密的;在注射药物时,细针芯自微导管中撤出,微导管的第二端与药物注射装置连接。
优选地,所述微导管的第一端形成有标记物,该标记物在超声下具有强回声。
优选地,穿刺过程中,在穿刺胸壁时,所述粗穿刺针的第一端的斜面、微导管的第一端的斜面、细针芯的第一端的斜面对齐,构成一个平整的斜面。
优选地,在心肌穿刺时,所述微导管的第一端和细针芯的第一端一起自所述粗穿刺针的第一端延伸出。
优选地,所述微导管包括沿其长度分布的多个标记物,其中至少一个标记物位于所述微导管的第一端。
优选地,所述粗穿刺针外侧形成有刻度;所述微导管外侧形成有刻度。
优选地,所述粗穿刺针的第二端形成有端座;所述微导管的第二端形成有端座;所述细针芯的第二端形成有端座;所述微导管的端座的第二侧形成有凹穴;所述细针芯的端座的第一侧形成有凸头;所述凸头可拆卸地卡入所述凹穴中,使得所述微导管与细针芯形成为一体。
本申请提出一种超声引导下经胸经心外膜心肌内注射的方法,其利用前述的三联微导管装置进行注射;
细针芯微插入导管中,微导管插入粗穿刺针中,在粗穿刺针、微导管、细针芯的第一端对齐的情况下,进行胸壁穿刺;
在胸壁穿刺完成后,将微导管、细针芯一起延伸超出粗穿刺针的第一端,选择适当的心外膜穿刺点,以预定角度刺入左心室的心肌的预定深度,完成心肌穿刺;
撤去细针芯,将微导管的第二端与药物注射装置连接,将药物经由微导管而提供到心肌中;
给药完成后微导管先回撤入粗穿刺针,超声观察无心包积液且血液循环稳定,再连同粗穿刺针一起共同撤出胸壁,封闭皮口。
优选地,微导管的第一端进入心肌内的深度为1-5cm;
当微导管的第一端位于心内膜和心外膜中的心肌层,且在心脏舒张期与心内膜层的距离d1、与心外膜层的距离d2均大于2mm时进行药物注射。
优选地,心外膜穿刺点与左心室短轴中心线的连线与插在一起的微导管与细针芯之间的夹角为120°-150°。
本申请的超声引导下经胸经心外膜心肌内注射给药的超声引导下经胸经心外膜心肌内注射的三联微导管装置和方法,每次只需在实验动物或受试者胸壁上穿刺2-3个孔(每孔直径约1mm),即可在超声引导下将药物通过微导管经胸经心外膜注入到心肌内,且可克服心脏跳动对穿刺针定位的影响,精确给药,避免心肌二次损伤,具有局部给药浓度高、注射位置精确可控、创伤小、并发症少、可不同时间点多次给药等优点。该三联微导管装置和方法可用于科研及临床中不开胸微创心肌内注射给药,提供了一种便捷、安全、高效的心肌内给药方式,具有较强的临床转化价值。
附图说明
图1为本申请的三联微导管装置的各组成部分的剖面结构示意图;
图2为本申请的三联微导管装置进行胸壁穿刺时的示意图;
图3为本申请的三联微导管装置进行心肌穿刺时的示意图;
图4为本申请的三联微导管装置进行药物注射时的示意图;
图5为超声引导下经胸经心外膜给猪心肌注射药物的示意图;
图6为超声引导下经胸经心外膜给猪心肌注射药物注射过程中和注射后的示意图;
图7为超声引导下经胸经心外膜给猪心肌注射药物注射前后的对照图;
图8为动物术后穿刺部位图像。
具体实施方式
下面,结合附图对本申请的用于超声引导下经胸经心外膜心肌内注射的三联微导管装置和方法进行详细说明。
本申请提出一种三联微导管装置,用于超声引导下经胸经心外膜进行心肌内注射,其包括:粗穿刺针10、微导管20、细针芯30。
粗穿刺针10形成为管体,其第一端为形成有斜面的尖端11,用于穿刺胸壁。
微导管20为具有柔韧性的管体,其第一端为形成有斜面的尖端21,用于刺入受试者的心肌内。
细针芯30形成为实心的,其第一端为形成有斜面的尖端,其用于插入微导管20中,在穿刺过程中为微导管20提供刚性。
微导管20和细针芯30的长度大于粗穿刺针10的长度。
微导管20插入于粗穿刺针10中,微导管20与粗穿刺针10之间形成为气密的,例如通过微导管20的外表面与粗穿刺针10的内表面紧密接触而实现气密,也可以通过在微导管20和粗穿刺针10之间设置密封手段,例如密封圈或可穿刺的密封膜来实现。
微导管20表面可形成有刻度,以方便确定微导管刺入的深度。
粗穿刺针10外表面形成有刻度,以方便确定粗导管的穿刺深度。
在穿刺过程中,细针芯30插入于微导管20中,且细针芯30与微导管20之间形成为气密的,例如通过细针芯30的外表面与微导管20的内表面紧密接触而实现气密,也可以通过在细针芯30与微导管20之间设置密封手段,例如密封圈或密封垫等来实现;在注射药物时,细针芯30自微导管20中撤出,微导管20的第二端与药物注射装置连接。
微导管20的第一端形成有标记物24,该标记物24在超声下具有强回声,例如金属标记物或是在超声下具有强回声的其他物质,以便于在超声图像中可以清楚地观察到微导管20的第一端所处的位置,尤其是在心肌外膜的穿刺点的位置和在心肌中所处的位置,以方便判断穿刺点是否合适、注射点是否合适。标记物可以是沿微导管20分布的多个标记点,其中至少一个设置微导管20的第一端的附近。
穿刺过程中,在穿刺胸壁时,粗穿刺针10的第一端11的斜面、微导管20的第一端21的斜面、细针芯30的第一端31的斜面对齐,构成一个平整的斜面,如图2所示,便于穿刺胸壁。
在心肌穿刺时,微导管20的第一端21和细针芯30的第一端31一起自粗穿刺针10的第一端11延伸出,如图3所示。
粗穿刺针10的第二端形成有端座12,便于握持以对粗穿刺针进行相应操作。
微导管20的第二端形成有端座22,便于握持以对微导管进行操作。
细针芯30的第二端形成有端座32,便于握持以对细针芯进行操作。
微导管20的端座22的第二侧形成有凹穴23;细针芯30的端座32的第一侧形成有凸头;凸头可拆卸地卡入凹穴23中,使得所述微导管20与细针芯30形成为一体。
本申请提出一种超声引导下经胸经心外膜心肌内注射的方法,其前述的三联微导管装置进行注射。
具体使用步骤如下:
(1)通过超声诊断仪显示心脏左心室短轴切面,选择左室前壁和前侧壁为给药区域,穿刺针在超声完全可视情况下进行穿刺,在下一肋骨上缘进针,穿刺路径避开室间隔正对的前室间沟,以防损伤前降支血管。控制穿刺针避免平行于心肌在短轴上的收缩方向进针,降低穿透室壁的风险,且较长的心肌内针道利于增加给药空间。
(2)先应用超声探头配套的穿刺架固定粗穿刺针,穿入微导管和细针芯,三者在穿刺前形成一个整体。粗穿刺针携带微导管和细针芯保持尖端平齐,穿刺胸壁,有突破感,在穿刺心包及心肌前固定,如图2。
(3)利用超声自带的引导线确定进一步穿刺心肌的针道位置,进一步推送微导管和细针芯,因无需交换步骤,避免和减少气胸的发生。细针芯和微导管刚刚穿刺入心肌时心电监护会有室性早搏发生,可作为辅助判断。以细针芯携带微导管穿刺进入心肌内1-5cm,以微导管表面的刻度标记判断进针深度,以舒张期微导管尖端的金属标记位置确定给药位置,距离心内膜和心外膜保持2mm以上安全距离,观察无异常则退出细针芯。微导管随心肌跳动,尾端可直接连接注射器负压回抽后给药,避免心肌二次损伤,如图3和图4所示。
(4)逐渐回撤微导管,回撤过程中单个针道可以间断进行多点注射。给药完成后微导管先撤入粗穿刺针,超声观察无心包积液且血液循环稳定,再共同撤出胸腔,封闭皮口。在超声引导下重新选择胸壁进针位置和针道,同一患者可以选择两个或更多穿刺道进行给药。
(5)穿刺心肌给药结束后常规观察心电及心包1小时,维持心电稳定,必要时置管引流,提高安全保障。
实施例
1.仪器和器械准备,主要包括高分辨率超声诊断仪、心脏超声探头、探头穿刺架、本申请的三联微导管装置、2ml注射器。其中粗穿刺针、细针芯、微导管尖端的金属标记在超声下均呈强回声,以便于超声引导下定位。
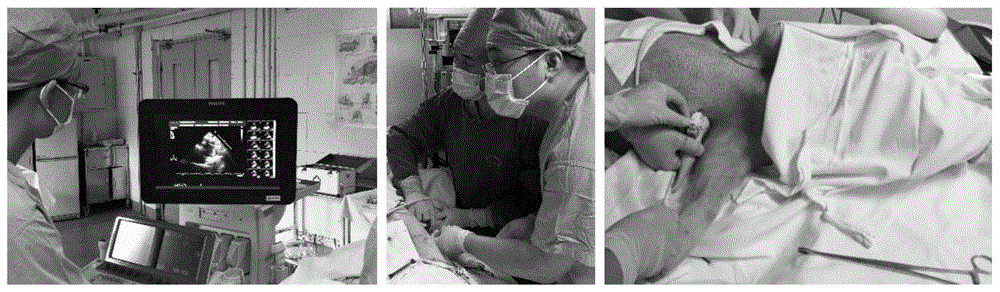
2.动物麻醉、脱毛后取仰卧位,调整超声探头位置,选择左心室短轴前壁和前侧壁为给药区域,于下一肋骨上缘进针,穿刺路径避开室间隔正对的前室间沟,以防损伤前降支。控制穿刺针避免平行于心肌在短轴上的收缩方向进针,降低穿透室壁的风险,且较长的心肌内针道利于增加给药空间。在针尖于超声完全可视情况下选择注射给药部位。对于心梗小型猪,选择心梗节段以上的缺血区域进行精确注射给药,如图6和图7所示。
3.先应用超声探头配套的穿刺架固定粗穿刺针,穿入微导管和细针芯,三者在穿刺前形成一个整体,如图2所示。粗穿刺针携带微导管和细针芯保持尖端平齐,穿刺胸壁,有突破感,在穿刺心包及心肌前固定。
4.利用超声自带的引导线确定进一步穿刺心肌的针道位置,进一步推送微导管和细针芯,无需交换,避免和减少气胸的发生。细针芯和微导管刚刚穿刺入心肌时心电监护会有室性早搏发生,可作为辅助判断。以细针芯携带微导管穿刺进入心肌内1-5cm,以微导管表面的刻度标记判断进针深度,以舒张期微导管尖端的金属标记位置确定给药位置,距离心内膜和心外膜保持2mm以上安全距离,观察无异常则退出细针芯。微导管随心肌跳动,尾端可直接连接注射器负压回抽后给药,避免心肌二次损伤,如图3和图4所示。
5.逐渐回撤微导管,回撤过程中单个针道可以间断进行多点注射。给药完成后微导管先撤入粗穿刺针,超声观察无心包积液且血液循环稳定,再共同撤出胸腔,封闭皮口。在超声引导下重新选择胸壁进针位置和针道,同一患者可以选择两个或更多穿刺道进行给药。注射给药结束后,穿刺局部仅遗留少量针眼,如图8所示。
6.整个穿刺操作过程中及术后1小时对受试者行心电、血压、血氧饱和度监测,当心电图发现频发室性早搏时即暂停穿刺,动态观察心律情况,减少发生室颤可能。当发生室颤或血流动力学不稳定时,停止穿刺,迅速明确病因。如为室颤,立即行非同步电除颤,不成功可静脉注射利多卡因并再次电除颤,直至恢复窦性心律。如出现心包积液,则通过超声监测积液动态变化。若积液较少且血流动力学稳定,则继续观察;若积液迅速增加或血流动力学不稳定,则通过超声明确积液最多的部位,并在超声引导下行心包穿刺置管术,术后持续引流,直至积液减少为少量且对血流动力学无影响。
本申请的用于超声引导下经胸经心外膜心肌内注射的三联微导管装置和方法具有如下优势:
1.以粗穿刺针引导穿透质硬且周围多骨性结构的胸壁,沿预设的导引线以细针芯携带微导管穿刺心肌,直接减少局部心肌损伤和心外膜血管损伤风险。微导管在粗穿刺针内腔中摩擦小,进出容易,同时粗穿刺针内径等于微导管外径,可避免气胸发生。微导管进入心肌组织,退出细针芯,微导管可随心肌组织有一定活动幅度,克服了心脏跳动对给药系统的影响,减少心肌二次损伤。微导管尾端可负压吸引后直接给药,操作流畅,节约手术时间,提高操作安全性。
2.不开胸,高分辨率超声指引下微创穿刺技术,微导管尖端有金属标记,超声下可以精确定位,操作安全可行,给药明确。
3.能够做到单针道不同深度给药,不同角度多针道多个部位给药,微创条件下不同时间点多次注射,从而实现心肌内不同节段、不同深度多点注射的目标,提高给药效率。
4.可实时动态观察心脏结构和功能,第一时间发现并发症,置管引流便捷,提高安全保障。
5.可直接应用于科研实践,如大动物心梗/心衰模型干预研究,操作安全可行。临床转化方面,更适合常规手术风险高的心衰患者的治疗,大幅度降低手术风险,使心梗后心衰的早期干预成为可能,从而改善预后,具有良好的科研应用价值和临床转化价值。
- 还没有人留言评论。精彩留言会获得点赞!