基于盐藻外泌体靶向药物递送载体的制备方法与应用与流程
本发明涉及生物医药领域,特别涉及一种基于盐藻外泌体靶向药物递送载体的制备方法与应用。
背景技术:
随着生物医学技术的发展,纳米级药物输送系统已经获得了令人瞩目的进展,各种基于纳米的药物制剂已被用于改善化学和生物分子药物的治疗功效。使用纳米药物载体进行癌症治疗的研究正在广泛进行,但是作为药物载体针对药物的装载尤其是基因治疗药物受限于弱靶向性,易于降解,从而影响疗效。因此,开发安全、高效、靶向的药物递送系统是实现肿瘤有效治疗的关键。
目前,常规使用的是合成的基于有机、无机材料的药物载体,在使用过程中观察到各种问题,包括毒性,免疫反应和快速清除。外泌体是指包含了多种rna和蛋白质及脂质分子的小膜泡(30-150nm),现今,其特指直径在40-100nm的盘状囊泡;多种细胞在正常及病理状态下均可分泌外泌体。外泌体具有纳米级尺寸,并且与受体细胞能很好的特异性结合,因此,通过使用外泌体递送来克服常规合成的药物载体的缺陷,已经成为了药物递送系统的研究热点,外泌体是一种理想的药物载体。然而,作为细胞分泌物的exosome,其来源与母细胞直接相关。不同细胞来源的外泌体,其组分有很大差异。因此,其稳定性、均一性,以及多组分的可控性均难以保证。更重要的是:目前,很难制备出大量的外泌体以满足临床试验的需要。为克服上述诸多不足,我们选择一种新型生物反应器——盐藻作为表达系统来大量生产外泌体作为靶向递送的载体。
盐藻外泌体来源于杜氏盐藻,杜氏盐藻是一种嗜盐的单细胞真核藻类,是迄今为止发现的最耐盐的真核生物之一,无毒无害,可直接作为一种天然保健品用以提高机体抵抗力和免疫力;盐藻属于单细胞真核藻类,具有转录和翻译后对蛋白加工的能力,能产生接近天然的高活性蛋白。盐藻中还含有丰富的β-胡萝卜素、不饱和脂肪酸、维生素e、叶绿素和硒等活性成分,具有较好的抗氧化、抗衰老效果。随着分子遗传学和基因工程理论水平和实验技术的发展,藻类基因工程得到了很快的发展,目前根据藻类基因工程已经成功构建高产、优质、抗逆的藻类新品种,用于生产大量的、廉价的蛋白和药物。基于上述这些优点,盐藻可以作为新型生物反应器来大量生产外泌体作为靶向递送的载体。而转基因盐藻植株来源的外泌体,与其他来源的外泌体相比,具有生物毒性小、高修饰性、转化稳定性等优点,为此,本发明选择盐藻作为生物反应器,大量产出盐藻外泌体以作为药物载体,公知的,对于各种肿瘤的治疗,都需要建立“点对点”精准治疗体系,为了达到对肿瘤治疗和诊断的协同性及一致性,所产出的盐藻外泌体在体外同时负载具有靶向功能的多肽和基因药物,通过优化、改进实验条件,制备一种新型的基于盐藻外泌体靶向药物递送载体,克服现有技术中常规递送载体存在的问题。
技术实现要素:
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种基于盐藻外泌体靶向药物递送载体的制备方法,通过化学偶联方法和电击法结合,使得盐藻外泌体同时负载靶向多肽和肿瘤治疗药物,可以精准靶向以及提高基因药物的表达。
本发明还有一个目的是提供一种利用基于盐藻外泌体靶向药物递送载体的制备方法制备的复合盐藻外泌体,能够实现特异靶向肿瘤以及具有保护基因药物或化学药物的特性。
本发明还有一个目的是提供一种复合盐藻外泌体在递送抗肿瘤药物中的应用,可以实现药物对肿瘤的点对点治疗,利于及时评估诊断和和治疗的协同性和一致性。
为了实现本发明的这些目的和其它优点,提供了一种基于盐藻外泌体靶向药物递送载体的制备方法,其特征在于,包括以下的步骤:
s1:培养盐藻,并从所述盐藻中提取盐藻外泌体;
s2:将s1中得到的盐藻外泌体与靶向多肽通过化学偶联方法反应,得到多肽偶联的盐藻外泌体;
s3:将s2所得多肽偶联的盐藻外泌体与药物通过电击法反应,生成基于盐藻外泌体靶向药物的递送载体。
优选的是,s1中提取盐藻外泌体的具体步骤包括:选取杜氏盐藻,在模拟天然海水中养殖,培养盐藻细胞至对数生长期,再采用差速离心法提取盐藻外泌体。
优选的是,培养盐藻细胞的上清液为离心去除死细胞和细胞碎片的上清液。
优选的是,s2中的化学偶联方法,具体包括以下步骤:
步骤1:将所述多肽溶于dmso溶液,并用cy5标记后,得到多肽溶液;
步骤2:将所述盐藻外泌体用dio染料标记,并溶于traut’s试剂中,室温反应30min,得到巯基化的盐藻外泌体;
步骤3:将步骤1所得的多肽溶液溶于mbs溶液中,室温反应30min,然后与步骤2中所得巯基化的盐藻外泌体混合,室温反应1h,经离心,收集沉淀,再过滤,得到所述多肽偶联的盐藻外泌体。
优选的是,步骤1中多肽dmso溶液的浓度为10-50μg/ml。
优选的是,dio染料标记的所述盐藻外泌体在所述traunt’s试剂中的终浓度为250μm;
所述多肽溶液在mbs溶液中的终浓度为200μm。
优选的是,s3中所述药物为基因药物(包括但不限于mirna、sirna或质粒dna)或化学药物,所述药物与所述多肽偶联的盐藻外泌体的质量比为1:100;
所述电击法的条件为:电压100-700v,电容125-500μf,放电时间1-5ms,放电次数1-2次;
电击后,还包括离心、收集沉淀、过滤纯化的步骤。
优选的是,在100000g条件下超速离心90min,收集沉淀后,用pbs溶液重悬沉淀,过pd-10过滤柱纯化。
本发明还提供一种利用所述的基于盐藻外泌体靶向药物递送载体的制备方法制备的复合盐藻外泌体。
本发明还提供一种所述的复合盐藻外泌体在递送抗肿瘤药物中的应用。
本发明至少包括以下有益效果:
本发明所述的盐藻外泌体与其他细胞来源外泌体相比,本发明选择了盐藻作为生物反应器可以产出大量、均一、稳定的盐藻外泌体作为药物载体,大大低了成本。盐藻无毒无害,可直接作为一种天然保健品和食品添加剂;盐藻来源的外泌体具有生物毒性极小、高修饰性等优点,最重要的是,盐藻外泌体由于其内部疏松的脂质结构可负载有基因治疗和化疗药物,与其他单纯的负载药物的外泌体相比,本发明一方面利用盐藻外泌体表面独特的基团,通过硫醇盐将蛋白质组的衍生化的半胱氨酸残基在特定的试剂作用下得到巯基化的盐藻外泌体,然后再通过特定试剂在一定条件下将靶向多肽进行氨基化,得到含酰胺键的靶向多肽,随后,将巯基化的外泌体与含酰胺键的靶向多肽在一定条件下反应,得到含有特定靶向多肽的盐藻外泌体,实现“精准制导”;另一方面通过电击法充分发挥盐藻外泌体保护药物和生物相容的特性,使盐藻外泌体表面负载多肽和基因药物,同时还能增加负载物的稳定性,降低了被免疫系统清除可能;此外,盐藻外泌体可以对肿瘤同时进行靶向成像与携带基因药物进入肿瘤细胞,促进表达,利于及时评估肿瘤诊断和治疗的协同性和一致性,在生物医学领域中有着广阔的应用前景,该发明已具有完善的实验流程体系,且实验步骤简便、易于实施。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
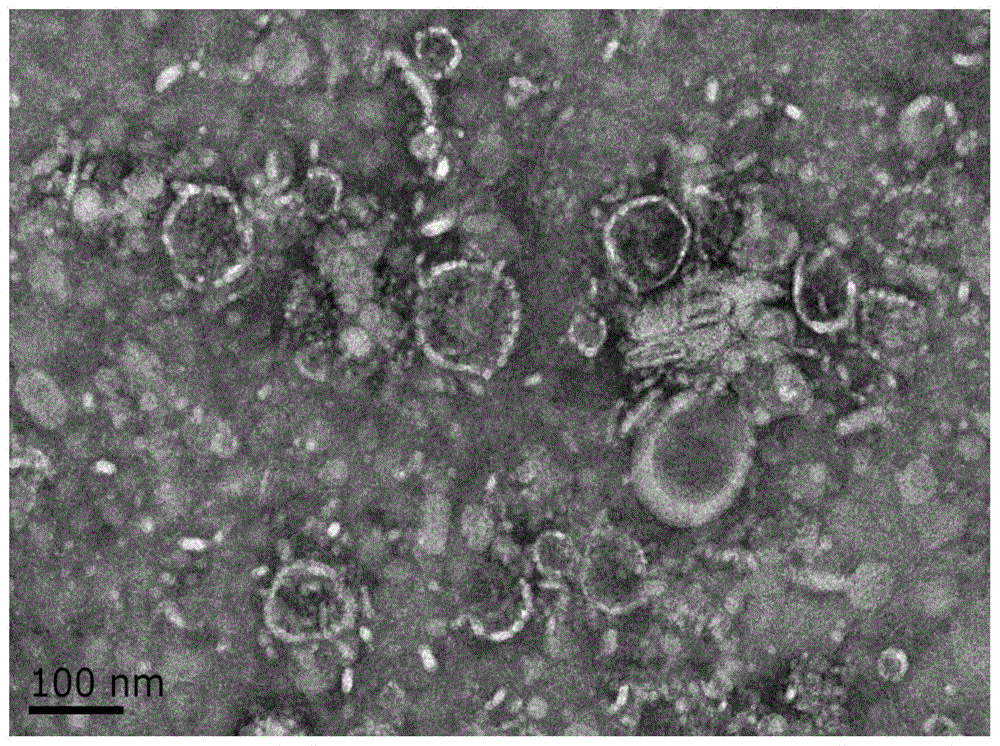
图1为本发明提取的盐藻外泌体的电镜图;
图2为本发明电穿孔前纳米动态光散射分析(dls)测量外泌体粒径大小及分布图;
图3为本发明电穿孔后纳米动态光散射分析(dls)测量外泌体粒径大小及分布图;
图4为本发明外泌体与靶向多肽的成功偶联;其中,a:dio绿色荧光标记的外泌体,b:cy5红色荧光标记的多肽,c:dio绿色荧光标记的盐藻外泌体与cy5红色荧光标记的多肽成功偶联的荧光显微镜照片;
图5为本发明不同电穿孔条件下盐藻外泌体加载质粒mir-375的加载率图;
图6为本发明不同电穿孔条件下盐藻外泌体加载sirna的加载率图;
图7为本发明通过尾静脉注射复合盐藻外泌体的裸鼠荷瘤模型小动物成像照片。
具体实施方式
下面对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
实施例1
基于盐藻外泌体靶向药物递送载体的制备方法
(1)外泌体的提取和纯化
杜氏盐藻(d.salina,utex1644teod)购自美国德州大学(theuniversityoftexas,usa),培养基为pks液体培养基,所述杜氏盐藻按1×106个/ml接种至培养瓶,采用模拟天然海水养殖,培养盐藻细胞至对数生长期(培养2周),收集上清液500ml,4℃条件下,采用经典差速超速离心法,具体为:500g,10min→2000g10min→10000g×30min→100000g×90min,最终沉淀物用500μl无菌pbs溶液重悬并通过0.22μm滤膜过滤,得到盐藻外泌体(如图1所示,盐藻外泌体电镜图),-20℃下保存备用。
(2)多肽溶液的配制
称取5mg靶向多肽anti-ptl,溶解于1mldmso中作为母液,分别按比例稀释,得到10-50μg/ml的多肽dmso溶液。
(3)基因药物提取:按照常规大肠杆菌转化法,将mir-375表达质粒导入,并在平板培养,挑选菌落在37℃、220rpm气浴培养摇床培养8-10h,使用质粒抽提试剂盒提取,并用可见紫外分光光度计测定浓度,调整浓度为30-50μg/ml。
(4)盐藻外泌体与多肽的化学偶联
配制traut‘s溶液:配制为250mm的溶液(1000×),备用;
配制mbs溶液:配制为100mm的溶液(500×),备用。
取500μl质量浓度为1.43mg/ml的用dio染料标记的盐藻外泌体,溶于traut‘s试剂至终浓度为250μm,室温下反应30min,得到巯基化的盐藻外泌体。
取500μl的cy5标记的多肽溶液加入到mbs溶液中至终浓度为200μm,室温反应30min,然后与上述所得巯基化的盐藻外泌体混合在一起,室温反应1h,经100000g超速离心90min,收集沉淀,用pbs溶液重悬后,过葡聚糖凝胶过滤柱pd-10柱纯化,除去游离的多肽和试剂,通过荧光显微镜观察,如图4所示,显示盐藻外泌体和多肽成功偶联,得到了多肽偶联的盐藻外泌体。
(5)盐藻外泌体通过电击法负载基因药物
在无菌pbs溶液中按一定比例加入多肽偶联的盐藻外泌体、基因药物或化学药物,混匀后,加入电穿孔皿中,放入电穿孔仪,按照一定的反应条件:电压100-700v,电容125-500μf,放电时间1-5ms,放电次数1-2次;进行电穿孔,电穿孔后室温反应1h,经100000g超速离心90min,收集沉淀,用pbs溶液重悬后,即可得到同时负载基因药物或化学药物并具有靶向功能盐藻外泌体,称之为复合盐藻外泌体。
在电击前后,通过透射电镜及dls动态光散射分析验证偶联后的盐藻外泌体在尺寸、形貌及分散性等方面的情况,如图2和图3所示,电击前后盐藻的粒径大小、分布情况均未发生变化,说明采用盐藻外泌体为载体负载靶向的基因药物的复合盐藻外泌体具有可靠性。
实施例2
基于盐藻外泌体靶向药物递送载体的制备方法
将100μg实施例1制备的多肽偶联的盐藻外泌体溶于1ml无菌pbs溶液中,与10μl质量浓度为50μg/ml的mir-375质粒溶液混合均匀,加入4mm电穿孔皿(容积750μl)中,放入电穿孔仪,在电压100v,电容125μf,放电时间1ms,放电次数1次。穿孔后即可将混悬液放入细胞培养箱中37℃孵育1h,再以100000g超速离心90min,小心弃尽上清,用pbs溶液重悬沉淀后,过pc-10过滤柱,即得到负载mir-375的靶向复合盐藻外泌体,-80℃保存,可用于后续检测实验。
上述pd-10过滤柱后,在260-280nm紫外分光光度计下测定药物(mir-375质粒溶液)浓度,浓度在100-1000ng/μl之间即可。
实施例3
与实施例2不同之处在于,采用不同的电击条件:电压200v,电容125μf,放电时间1ms,放电次数:1次。
实施例4
与实施例2不同之处在于,采用不同的电击条件:电压400v,电容125μf,放电时间1ms,放电次数:1次。
实施例5
与实施例2的不同之处在于,采用不同的电击条件:电压100v,电容250μf,放电时间1ms,放电次数:1次。
实施例6
与实施例2的不同之处在于,采用不同的电击条件:电压200v,电容250μf,放电时间1ms,放电次数:1次。
实施例7
与实施例2的不同之处在于,采用不同的电击条件:电压400v,电容250μf,放电时间1ms,放电次数:1次。
上述实施例2-7,在不同电穿孔条件下,盐藻外泌体加载质粒mir-375量的结果如表1所示。结果显示:在250μf、200v电穿孔条件下,加载质粒mir-375量最大。如图5所示,同样显示在在250μf、200v电穿孔条件下,加载质粒mir-375的加载率最大。
表1不同电穿孔条件下盐藻外泌体加载质粒mir-375量的结果
实施例8
与实施例2不同之处在于,选用sirna溶液替换mir-375质粒溶液,重复实施例2-7可以最后得到不同负载率sirna的靶向复合盐藻外泌体。
上述实施例8中,在不同电穿孔条件下盐藻外泌体加载sirna量的结果,如表2所示。结果显示:在250μf、200v电穿孔条件下,加载质粒sirna量最大。如图5所示,同样显示在在250μf、200v电穿孔条件下,加载质粒sirna的加载率最大。
表2不同电穿孔条件下盐藻外泌体加载sirna量的结果如下:
实施例9
取1ml含有100μg盐藻外泌体的复合盐藻外泌体无菌pbs溶液(由实施例2的方法制备),使用1.5μl的1mg/mldir染料进行标记,荷瘤裸鼠模型为异位肿瘤源(食管癌ky-30细胞),接种5×106个细胞约2周成瘤,通过尾静脉注射200μl在荷瘤裸鼠上,2小时后,使用小动物成像仪,观察荧光标记的盐藻外泌体在裸鼠信号分布,如图7所示,裸鼠的瘤细胞中有深红色荧光,说明复合盐藻外泌体可以准确定位到瘤细胞内,并有效表达。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与附图。
- 还没有人留言评论。精彩留言会获得点赞!