预防或治疗阿尔茨海默氏病的方法与流程
发明领域
本发明涉及使用达泮舒腈(dapansutrile)(3-甲磺酰基丙腈,3-methanesulfonylpropionitrile),或其药学上可接受的溶剂化物以预防和/或治疗阿尔茨海默氏病。
背景
阿尔茨海默氏病(ad)是一种退行性脑紊乱,在临床上以记忆力,认知,推理,判断力和情感稳定性的逐步丧失为特征,逐渐导致严重的精神衰退和最终的死亡。ad是老年人进行性(progressive)精神衰竭(痴呆)的非常常见的原因。
尽管每个人的阿尔茨海默氏病发展不同,但仍有许多常见症状。早期症状经常被错误地认为是与年龄有关的担忧,或压力的表现。在早期阶段,最常见的症状是运动能力下降和难以记忆近期的事件,即短期记忆力丧失(buchman等人,exprevneurother,11:665-76,2011)。如果怀疑患有ad,则通常可以通过评估行为和思维能力的测试以及通常后续进行的脑部扫描(如果有)来确认诊断。随着疾病的发展,症状可能包括困惑,易怒,攻击性,情绪波动,语言障碍,和长期记忆力丧失。随着人的情况恶化,他/她经常退出家庭和社会。逐渐地,身体功能逐渐丧失,最终导致死亡。
患有ad的个体的大脑表现出称作淀粉样蛋白斑块,淀粉样血管病(血管中的淀粉样沉积物)和神经原纤维缠结,以及神经炎症的特征性病变。通常在人脑的几个对ad患者的记忆和认知功能很重要的区域中发现大量此类病变,尤其是淀粉样蛋白斑块和神经原纤维缠结。目前,ad的明确诊断通常需要观察已死于该病的患者的脑组织中的上述病变,或者,少见地,在侵入性神经外科手术过程中采集的脑组织的少量活检样本中的上述病变。
神经炎症是神经组织的炎症。它可能响应于各种诱因而被引发,包括感染,创伤性脑损伤,毒性代谢产物,或自身免疫。在包括大脑和脊髓在内的中枢神经系统(cns)中,小胶质细胞是固有先天免疫细胞,会响应于这些诱因而被激活。cns通常是免疫学上优先的位点,因为周围免疫细胞通常被血脑屏障(bbb)阻断,所述血脑屏障是由星形胶质细胞和内皮细胞组成的特殊结构。但是,循环的外周免疫细胞可能会越过受损的bbb,并遇到表达主要组织相容性复合分子的神经元和神经胶质细胞,从而使免疫响应持续。尽管引发了响应以保护中枢神经系统免受传染源的侵害,但其效果可能是毒性和广泛的炎症,以及白血球穿过血脑屏障的进一步迁移。
ad的淀粉样蛋白斑块和淀粉样蛋白血管病特征的主要化学成分是约4.2千道尔顿的蛋白,具有约39-43个氨基酸,称为β-淀粉样肽。β-淀粉样肽是一个大得多的淀粉样前体蛋白(app)的小片段,源自蛋白酶系统(统称为分泌酶)对app的切割。app是在许多组织中表达并集中在神经元突触中的完整膜蛋白。其主要功能尚不明确,但已表明(implicated)其为突触形成,神经可塑性和铁输出(ironexport)的调节剂。app最被熟知的是作为前体分子,其蛋白水解产生β淀粉样蛋白(aβ),是37到49个氨基酸的肽,其淀粉样原纤维形式是在阿尔茨海默氏病患者的大脑中发现的淀粉样蛋白斑块的主要成分。app首先被β分泌酶切割,产生一个β-stub,然后被γ分泌酶切割以产生一个被分泌的β-淀粉样蛋白片段。
自1989年以来,关于ad患者的大脑已经报道了升高的白细胞介素-1beta(il-1β)水平,它是急性和慢性炎症的顶端促炎性介质,也是先天免疫响应的有力诱导剂(procnatlacadsciusa86:7611-5)。kitzawa等人(jimmunol.2011,187:6539-6549)报道阻断白细胞介素-1信号会挽救认知,减轻tau病理,并恢复ad模型中的神经元β-catenin通路功能。heneka等人(nature2013,493:7434)报告nlrp3在ad中被激活并参与了app/ps1小鼠的病理。
近期的研究表明ad的部分发病机理是“泄漏的血脑屏障(leakybloodbrainbarrier)”(iadecola,neuron,85:231-233,2015)。ad发病机理中最具争议的概念之一是是否存在障碍的破坏,从而使炎症细胞迁移到海马(记忆中心)中。正如iadecola在他的评论中所写,目前有数据支持与认知功能障碍相关的屏障的分解。
需要开发用于预防和治疗ad的方法和组合物。
附图简要说明
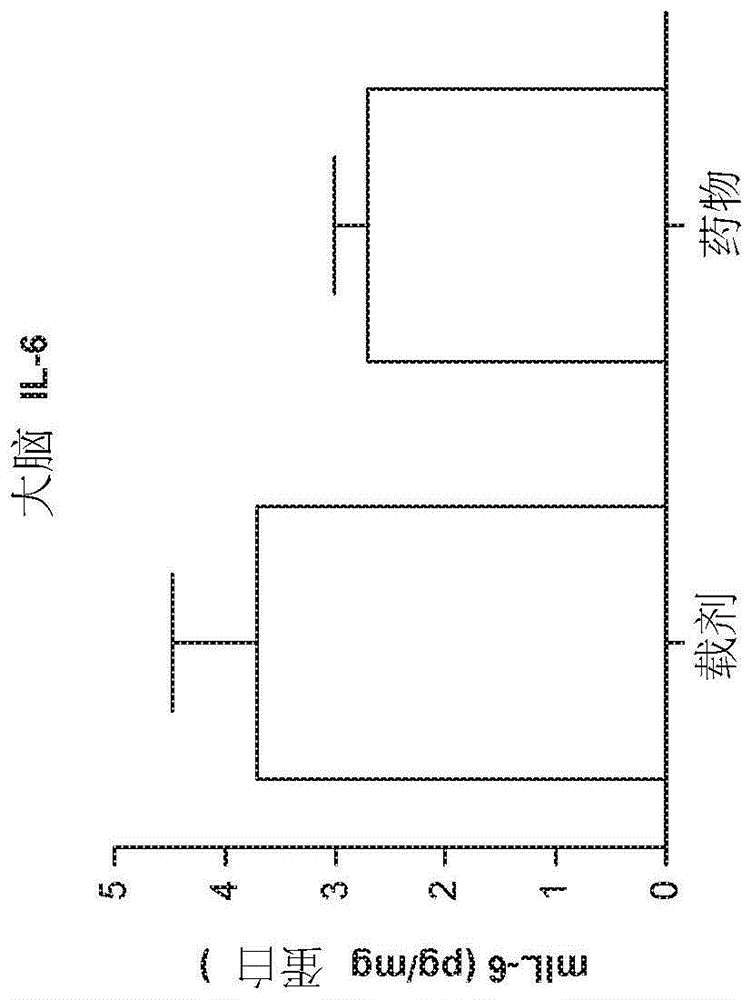
图1a和1b显示了在il-1β腹膜内刺激(challenge)后,载剂和达泮舒腈治疗的小鼠的离体样品的脑中il-6和mpo的水平。
图2a示出了促炎性细胞因子il-6的水平在用1000mg/kg/天的达泮舒腈治疗的转基因ad转基因小鼠(app/ps1品系)的脑裂解物中降低。图2b示出了促炎性细胞因子il-1β的水平在用500mg/kg/天和1000mg/kg/天的剂量的达泮舒腈治疗的ad转基因小鼠的脑裂解物中降低。
图3a示出了野生型小鼠,app/ps1小鼠,用500mg/kg/天的达泮舒腈治疗的app/ps1小鼠,和用1000mg/kg/天的达泮舒腈治疗的app/ps1小鼠在第1天至第8天的莫里斯水迷宫测试中逃脱的潜伏时间(秒)。图3b示出了野生型小鼠,app/ps1小鼠,用500mg/kg/天的达泮舒腈治疗的app/ps1小鼠,和用1000mg/kg/天的达泮舒腈治疗的app/ps1小鼠在第9天进行的探索试验中,小鼠在三个非靶标象限(nt)中的平均时间(%)和小鼠在靶标象限(tq)中的时间(%)。
图4显示了野生型小鼠,app/ps1小鼠,用500mg/kg/天的达泮舒腈治疗的app/ps1小鼠,和用1000mg/kg/天的达泮舒腈治疗的app/ps1在75-80分钟时(在tbs诱导后55-60分钟,并且是记录的最后5分钟)的平均ltp。n=动物数,n=海马切片数。
发明详述
发明人发现,在一些局部和全身性炎症的完整动物模型中,达泮舒腈一致地有效地降低包括il-1β和il-6在内的促炎性细胞因子的水平,可有效治疗阿尔茨海默氏病(ad),并且改善ad中的运动/行为障碍。发明人发现,达泮舒腈可有效减少il-1β的自发产生,减少il-6的诱导,减少全身性和神经炎症。体外,离体和体内研究表明,达泮舒腈可抑制il-1β的加工和释放,但不能抑制il-1β前体的合成。发明人认为,通过用达泮舒腈治疗外周细胞,自发il-1β减少,这导致血液来源的小胶质细胞的炎症水平降低。达泮舒腈通过不压制构成性细胞因子来保留基体的免疫监视,并保护其避免细胞死亡。达泮舒腈不直接抑制tnf-α,il-1α或球形(global)细胞因子,因此其脱靶活性很小。
发明人发现,一个用于阿尔茨海默氏病的发病机理的观点是,基本上形成血脑屏障的内皮细胞的紧密连接在ad中变得不那么有效,使得本不应进入海马的分子现在进入了海马。本发明人相信il-1β是不仅有助于“泄漏”而且“泄漏血脑屏障”允许il-1β(和若干细胞因子)进入海马区的分子中的一个。il-1β的存在导致炎症的发生和淀粉样蛋白的合成。淀粉样蛋白的合成增加是阿尔茨海默氏病的致病特性之一。通过降低全身和大脑的il-1β水平,达泮舒腈降低il-1β介导的全身性炎症和神经炎症,并能有效预防和治疗ad。
本发明涉及预防和/或治疗阿尔茨海默氏病的方法。该方法包括向有此需要的受试者施用有效量的达泮舒腈,或其药学上可接受的溶剂化物的步骤。
化合物
3-甲磺酰基丙腈,也称作达泮舒腈,是一种小分子,结构如下所示。
本发明使用达泮舒腈,或其药学上可接受的溶剂化物。如本文所用,“溶剂化物”是其中化合物以某种固定比例与可接受的助溶剂组合的加成络合物。助溶剂包括但不限于水,乙酸,乙醇,和其他合适的有机溶剂。
达泮舒腈的氢,氧,硫,和氮原子中的一个任选地被相应的同位素取代,包括但不限于2h(氘),3h(氚),13c,14c,15n,17o,18o,和35s。优选非放射性或稳定的同位素,例如2h(氘),13c,15n,17o,或18o,更优选2h(氘)。
药学组合物
本发明提供药学组合物,其包含一种或多种药学上可接受的载体和活性化合物达泮舒腈,或其药学上可接受的盐,或其溶剂化物。药学组合物中的活性化合物或其药学上可接受的溶剂化物通常的量对于局部制剂为约0.01-20%,或0.05-20%,或0.1-20%,或0.2-15%,或0.5-10%,或1-5%(w/w);对于可注射制剂为约0.1-5%,对于贴剂制剂为约0.1-5%,对于片剂制剂为约1-90%,对于胶囊制剂为约1-100%。用于药学组合物中的活性化合物通常的纯度为至少90%,优选95%,或98%,或99%(w/w)。
在一个实施方式中,药学组合物的剂型例如为片剂,胶囊剂,颗粒剂,细颗粒剂,粉剂,糖浆剂,栓剂,可注射溶液,贴剂,吸入剂等。在另一实施方式中,将活性化合物掺入任何可以使活性化合物稳定的可接受的载体中,包括乳膏,凝胶,洗剂或其他类型的悬浮液。上述药学组合物可以通过常规方法制备。
非活性成分的药学上可接受的载体可以由本领域技术人员使用常规标准选择。药学上可接受的载体包括但不限于非水基溶液,悬浮液,乳剂,微乳剂,胶束溶液,凝胶,和软膏剂(ointments)。药学上可接受的载体还可以包含成分,包括但不限于盐水和电解质水溶液;离子和非离子渗透剂,例如氯化钠,氯化钾,甘油,和葡萄糖;ph调节剂和缓冲剂,例如氢氧化物,磷酸盐,柠檬酸盐,乙酸盐,硼酸盐;和三乙醇胺;抗氧化剂,例如亚硫酸氢盐(bisulfite),亚硫酸盐,偏亚硫酸氢盐,硫代亚硫酸盐,抗坏血酸,乙酰半胱氨酸,半胱氨酸,谷胱甘肽,丁基化羟基茴香醚,丁基化羟基甲苯,生育酚,和抗坏血酸棕榈酸酯的盐,酸和/或碱;表面活性剂,例如卵磷脂,磷脂,包括但不限于磷脂酰胆碱,磷脂酰乙醇胺和磷脂酰肌醇;泊洛沙姆和泊洛沙明;聚山梨醇酯,例如聚山梨醇酯80,聚山梨醇酯60,和聚山梨醇酯20;聚醚,例如聚乙二醇和聚丙二醇;聚乙烯,例如聚乙烯醇和聚维酮;纤维素衍生物,例如甲基纤维素,羟丙基纤维素,羟乙基纤维素,羧甲基纤维素和羟丙基甲基纤维素及其盐;石油衍生物,例如矿物油和白凡士林;脂肪,例如羊毛脂,花生油,棕榈油,大豆油;甘油单,双,和三酯;丙烯酸的聚合物,例如羧基聚亚甲基凝胶,和疏水改性的交联丙烯酸酯共聚物;多糖,例如葡聚糖,和糖胺聚糖(glycosaminoglycans),如透明质酸钠。可以使用众所周知的防腐剂保存此类药学上可接受的载体以防止细菌污染,这些防腐剂包括但不限于苯扎氯铵(benzalkoniumchloride),乙二胺四乙酸及其盐,苄索氯铵,氯己定(chlorhexidine),氯代丁醇,对羟基苯甲酸甲酯(methylparaben),硫柳汞(thimerosal),和苯乙醇,或可以配制成单次或多次使用的非防腐(non-preserved)的制剂。
例如,活性化合物的片剂或胶囊剂可包含其他赋形剂,所述赋形剂不具有生物活性且不与活性化合物反应。片剂的赋形剂可包括填充剂,粘合剂,润滑剂和助流剂,崩解剂,湿润剂,和释放速率调节剂。粘合剂促进制剂颗粒的粘附,并且对于片剂制剂是重要的。粘合剂的实例包括但不限于羧甲基纤维素,纤维素,乙基纤维素,羟丙基甲基纤维素,甲基纤维素,卡拉胶,淀粉,淀粉,和黄芪胶,聚丙烯酸,和聚乙烯吡咯烷酮。
例如,活性化合物的贴剂制剂可以包含一些非活性成分,例如1,3-丁二醇,氨基乙酸二羟基铝(dihydroxyaluminumaminoacetate),乙二胺四乙酸二钠,d-山梨醇,明胶,高岭土,对羟基苯甲酸甲酯,聚山梨醇酯80,聚维酮(聚乙烯吡咯烷酮),丙二醇,对羟基苯甲酸丙酯,羧甲基纤维素钠,聚丙烯酸钠,酒石酸,二氧化钛,和纯净水。贴剂制剂还可以包含皮肤渗透性增强剂,例如乳酸酯(例如乳酸月桂酯)或二乙二醇单乙醚。
包括活性化合物的局部制剂的形式可以是凝胶,乳膏,洗剂,液体,乳剂,软膏,喷雾剂,溶液,和悬浮液。局部制剂中的非活性成分例如包括但不限于乳酸月桂酯(润肤剂/渗透促进剂),二乙二醇单乙醚(润肤剂/渗透促进剂),dmso(溶解度增强剂),有机硅弹性体(流变/质地改性剂),辛酸/癸酸甘油三酸酯,(润肤剂),辛酸盐,(润肤剂/紫外线过滤剂),硅油(润肤剂/稀释剂),角鲨烯(润肤剂),向日葵油(润肤剂),和二氧化硅氧烷(siliconedioxide)(增稠剂)。
本发明的药学组合物的形式可以是可吸入颗粒的气雾悬浮剂(aerosolsuspension)的形式,其包含受试者所吸入的活性化合物。可吸入颗粒可以是液体或固体,其粒径足够小,以至于在吸入时可以通过口腔和喉部。通常,尺寸为约1至10微米,优选1-5微米的颗粒被认为是可吸入的。
使用方法
本发明涉及预防和/或治疗阿尔茨海默氏病(ad)的方法。该方法包括以下步骤:首先鉴别患有ad或可能发展ad的受试者,并向该受试者施用有效量的活性化合物达泮舒腈。如本文所用,“有效量”是通过改善(ameliorating)病理状况或减少ad症状而能有效预防或治疗ad的量。
在一个实施方式中,该方法减少或减轻患有ad的受试者的疾病症状并改善其认知和运动功能。可以通过记忆力丧失的临床体征,或诊断ad的脑部扫描来鉴别受试者。该方法改善了患者的困惑,烦躁,攻击性,情绪波动,语言障碍,和/或长期记忆力丧失的症状。该方法还改善受试者的学习和记忆过程。
在另一实施方式中,该方法提供达泮舒腈的预防性使用,其停止或减缓疾病进展。对于预防性使用,通过家族病史,基因筛查,和/或记忆力丧失的早期迹象来选择受试者。该方法改善受试者的认知和/或运动功能,并改善学习和记忆过程。
在神经科学中,长时程增强(long-termpotentiation,ltp)是基于近期活动模式的突触的持续增强。这些是突触活动的模式,可产生两个神经元之间信号传递的长期持续增加。ad的突触衰竭主要通过关于长时程增强(ltp)的受损的长时程突触可塑性来反映。ltp被广泛认为是作为学习和记忆基础的主要细胞机制之一。本发明提供ltp的改善。
发明人已经证明,达泮舒腈减少与脑中的ad发病机理有关的两种主要细胞因子(il-1β和il-6)的产生。即,在用达泮舒腈治疗ad转基因小鼠3个月后,在脑内促炎性细胞因子il-1β和il-6水平显著降低。
在莫里斯水迷宫测试的表现中,与野生型小鼠相比,ad转基因动物显示了认知学习不足。相反,用合适剂量的达泮舒腈治疗的ad转基因动物与野生型动物的表现一样好。ltp测量显示了类似效果。ad转基因动物显示受损的ltp,但用合适剂量的达泮舒腈治疗的ad转基因动物展现出可匹敌野生型动物的ltp。
本发明的药学组合物可以通过全身施用或局部施用来施用。全身施用包括口服,肠胃外(例如静脉内,肌内,皮下,或直肠),吸入,和其他全身施用途径。在全身施用中,活性化合物首先到达血浆,然后分布到目标组织中。
组合物的剂量可以根据损伤程度和每个患者的个体反应而变化。对于全身施用,所递送的活性化合物的血浆浓度可以变化;但通常为1x10-10-1x10-4摩尔/升,优选为1x10-8-1x10-5摩尔/升。
在一个实施方式中,将药学组合物口服施用于受试者。口服施用剂量通常为至少0.1mg/kg/天且小于100mg/kg/天。例如,对于人类受试者,口服施用的剂量为0.1-100或0.5-50mg/kg/天,优选为1-10或1-20mg/kg/天。例如,对于人类受试者,口服施用的剂量为20-1000mg/天或100-2000mg/天,优选20-500,25-200,50-500,50-200,100-600,100-400,100-800,200-800,400-800,400-1200,500-2000,或800-2000mg/天。
在一实施方式中,将药学组合物静脉内施用于受试者。静脉内推注或静脉内输注的剂量通常为0.03至20和优选的0.03至10mg/kg/天。
在一实施方式中,将药学组合物皮下施用于受试者。皮下施用的剂量通常为0.3-20,优选0.3-3mg/kg/天。
在一实施方式中,药学组合物通过吸入来施用。吸入的方法包括液体滴注(instillation),经由定量剂量吸入器(metereddoseinhaler)或等同物的滴注,或经由喷雾器吸入加压流体制剂,吸入干燥粉末,以及在机械通风过程中将可溶或干燥材料导入空气流。通过吸入而递送的活性化合物的表面浓度可以变化,但通常为1x10-10-1x10-4摩尔/升,并优选1x10-8-1x10-5摩尔/升。
本领域技术人员将认识到,多种多样的递送机制可适用于本发明。
达泮舒腈在动物和人类中被良好地耐受,因此本方法适合于ad受试者的慢性治疗。该受试者可以每天或每1-3天治疗一次。治疗的持续时间可以是1个月至3个月,1个月至6个月,1个月至1年,1个月至2年,1个月至5年,3个月至6个月,3个月至1年,3个月至2年,3个月至5年,6个月至1年,6个月至2年,6个月至5年,6个月至10年,或至受试者终生。
达泮舒腈可用于间歇给药。例如,受试者可以用达泮舒腈治疗1-5年,然后停用达泮舒腈1-5年,然后再重复给药开始/停止方案。
本发明可用于治疗哺乳动物受试者,例如人,马,和狗。本发明在治疗人类时特别有用。
下列实施例进一步说明本发明。这些实施例仅旨在说明本发明,而不应理解为是限制性的。
实施例
实施例1.脱靶活性
为了研究达泮舒腈的潜在脱靶活性,通过体外筛选实验评估了次级药理作用。达泮舒腈对通过aim2或nlrc4炎性体途径的细胞因子生成没有抑制作用,并且达泮舒腈对pro-il-1或pro-il-18没有抑制作用。评估了68个临界跨膜和可溶性受体,离子通道和单胺转运蛋白对达泮舒腈的脱靶作用。在后续研究中,与达泮舒腈一起评估了额外的69个受体和酶的潜在活性,重点关注涉及炎症级联反应的酶。pde4酶是一个单一鉴别目标,其在≥100μm(13μg/ml)的浓度范围内受到抑制,并且效果具有剂量响应性,但后续研究尚无定论。筛选试验中未发现其他效果,包括对cox-1或cox-2没有直接效果,也没有与阿片受体的相互作用。
实施例2.治疗后il-6和mpo的水平
在4天内用200mg/kg达泮舒腈(olt1177tm)对小鼠进行8次注射以进行治疗。于第3天在转棒上训练小鼠。在最后一次注射后12小时,小鼠在转棒上跑动距离。转棒后一小时,用60ng的il-1β腹膜内刺激小鼠;然后4小时后处死小鼠。收集小鼠的全血,血浆,脑,和肺。培养全血,冷冻血浆。脑被处理以用于细胞因子分析。对全部样品进行细胞因子的elisa测量,结果在图1a和1b中示出。每组的n=5。
从接受载剂(vehicle)或达泮舒腈治疗的小鼠的大脑中获得离体样品,并进行了力竭运动。在il-1β刺激后,样品显示脑中il-6和髓过氧化物酶(mpo)水平降低(图1a和1b)。此外,在治疗的小鼠中,il-1β刺激后全身性il-1β,il-6和mpo的水平也降低(数据未在此处示出)。
实施例3.使用达泮舒腈治疗的转基因小鼠的治疗方案
app/ps1小鼠表达人类淀粉样蛋白前体蛋白和人类早老素-1,各自携带与家族性ad相关的突变,导致与年龄相关的aβ沉积,并伴有神经炎症和认知障碍。
在研究设计中,6个月大的野生型(wt),和ad转基因app/ps1[deltae9]小鼠通过任意颗粒饲料(feedpelletsadlibitum)口服达泮舒腈进行治疗(约0,50或100mg/kg/天,基于0,3.75或7.5g/kg的饲料浓度和4g/天的食物消耗),持续3个月。在9个月大时,进行了小鼠的行为测试。另外,提取小鼠的大脑,并收集血样。对每组小鼠的脑进行电生理和神经元形态分析,细胞因子水平和其他实验。
实施例4.脑匀浆的细胞因子水平
将每只小鼠的一个大脑半球在stkm缓冲液中均质化,并于4℃以13,000g离心10分钟。收集脑溶解产物的上清液,并以1∶2的比例稀释样品通过elisa来测定促炎性介质(mediators)il-6和il-1β。图2a和2b所示的结果证明神经炎症减少。相较于喂食不含达泮舒腈的对照食物的app/ps1小鼠,以中剂量(1000mg/kg/天,p值=0.0035)接受达泮舒腈治疗的app/ps1小鼠的脑裂解物中的il-6水平降低(图2a)。与饲喂对照食物的app/ps1小鼠相比,用低剂量(500mg/kg/天,p值=0.0287)和中剂量(1000mg/kg/天,p值=0.0368)达泮舒腈治疗的app/ps1小鼠中的il-1β降低。
实施例5.莫里斯水迷宫测试
目的:进行莫里斯水迷宫(mwm)测试,以测试与野生型动物以及没有治疗的app/ps1对照动物这两者相比,用达泮舒腈治疗的app/ps1动物是否能减少app/ps1动物的认知障碍表型(cognitiveimpairedphenotype)。
其中小鼠学会从不透明的水逃脱到隐藏的平台上的一种旷场水迷宫程序是为测试小鼠的认知功能的确立已久的模型(morris,jneuroscimethods.11:47-60,1984)。
使用莫里斯水迷宫(mwm)实验评估了空间记忆形成和保留。将一个10厘米的逃脱平台放入一个充满不透明水的圆形塑料水池中并浸入水面以下1厘米处。在水池周围的墙壁上放置了三个视觉提示。数码相机安装在迷宫中心上方。获取图像并传输至运行跟踪软件any-迷宫(any-maze)的pc。在前三天(预训练)中,使用可见平台(平台置于水面上方)训练小鼠。
为了评估空间记忆形成,对小鼠进行了连续8天的训练以定位隐藏平台。记录每个试验的逃脱潜伏期(latency)(每天4次,间隔3-5分钟),并通过跟踪软件进行分析。在训练的第3天和第9天,通过移去平台并分析每只小鼠在45秒的固定时间内使用的搜索模式而在探索试验中评估记忆保留。
对描述小鼠找到隐藏平台所需时间的逃避脱潜伏期进行测定,并分析其每天4次试验的平均值,示于图3a;从第1天到第8天,所有基因型均减少了逃脱潜伏期。例如,在第5天,野生型小鼠(n=8)需要23.59±4.08秒到达平台。app/ps1(500mg/kg/天的达泮舒腈治疗)小鼠(n=5)需要37.31±4.96秒,app/ps1(1000mg/kg的达泮舒腈治疗)小鼠(n=6)需要21.30±3.19秒(p值=0.021),相比之下,app/ps1(对照食物)小鼠(n=6)需要42.04±6.89秒。
为提供最后一次训练项目后24小时的认知学习的证据,在训练的第9天进行了一项尊重(reverence)测试(探索试验)。此处,在没有逃脱平台的水迷宫中对小鼠进行测试,并且测量了小鼠在象限中所花费的时间。我们比较三个非目标象限(nt)的平均时间的百分比和目标象限(tq,在训练期间放置有平台)的时间的百分比。结果(图3b)显示相比非目标象限(nt),野生型小鼠(p值=0.001)和app/ps11000mg/kg/天(中剂量)(p值=0.0001)更偏向目标象限(tq)。然而,相比nt,app/ps1(对照食物)和app/ps1500mg/kg/天(低剂量)没有对tq的偏向。
总而言之,图3a和3b显示,与野生型小鼠相比,app/ps1对照小鼠在莫里斯水迷宫测试中的表现具有认知学习不足。相反,用1000mg/kg/天的达泮舒腈治疗的app/ps1小鼠的表现与野生型小鼠同样好。
实施例6.电生理实验
长时程增强(ltp)是化学突触的高频刺激后突触强度的持续增加。ltp的研究通常在海马切片中进行,海马是学习和记忆的重要器官。在此类研究中,从细胞中获取电记录并绘制在图表中,该图表将经历ltp的突触与未经历ltp的突触对刺激的响应进行比较。经历了ltp的突触往往比其他突触对刺激具有更强的电响应。
鉴于在用1000mg/kg/天的达泮舒腈治疗的app/ps1小鼠中观察到的受损的学习和记忆过程的恢复(实施例5),我们有兴趣确定在中剂量的达泮舒腈施用后海马网络功能是否会恢复。为此,我们分析了连接ca3和ca1分区的schaffer侧支通路处的突触可塑性,ca1分区是中枢神经系统中研究最广泛的突触之一。在基线记录20分钟后,通过theta节律刺激(theta-burststimulation,tbs)诱导了长时程增强(ltp)作为schaffer侧支ca3到ca1通路处学习过程的细胞相关性。
从四组小鼠制备急性海马切片,包括野生型,app/ps1,500mg/kg/天的达泮舒腈治疗的app/ps1和1000mg/kg/天的达泮舒腈治疗的app/ps1。简而言之,将小鼠用100%co2深度麻醉,处死,然后迅速移去大脑,并将其转移到冰冷的碳气化(carbogenated)(95%o2和5%co2)人工csf(acsf)溶液中。然后,切开海马,使用手动组织切削器获得横向海马切片(400微米)。将海马切片转移至界面记录腔室,开始记录之前,于32℃以恒定流速(0.5ml/分钟)的碳气化acsf培育2h。在海马切片的ca1区的放射层中记录了场兴奋性突触后电位(fepsp)。通过使用两个电极刺激schaffer侧支通路引起响应。这些刺激电极(s1和s2)等距地位于记录电极的两侧,如此,对于同一ca1记录区可使用两个独立的刺激通路。为了记录fepsp(测量作为第一斜率函数),将记录电极放置在ca1顶树突层中,通过差分放大器放大信号并将信号数字化。在预培育期间结束后,生成一条输入-输出曲线(输入刺激vsfepsp斜率),用于评估基础突触传递。修改测试刺激强度进行调整,以提取fepsp斜率作为突触输入s1和s2这两者的最大fepsp响应的40%。为了研究ltp,在基线记录后20分钟,通过theta节律刺激(tbs)诱导ltp,包括以200ms的间隔以100hz重复10次的四个猝发(burst)。该刺激以10s的间隔重复3次。电生理数据分析中仅包括具有稳定基线的健康切片。测量了fepsp60分钟的斜率,并标准化为基线。使用intracell软件进行数据获取和离线分析。
在tbs后55-60分钟(记录的最后5分钟)时的不同组的小鼠的平均ltp在图4中示出。n=小鼠数,n=海马切片数。对于野生型小鼠(n=5,n=27),记录的最后5分钟的标准化平均ltp为1.553,app/ps1小鼠(n=2,n=12)为1.303,低剂量达泮舒腈治疗的app/ps1小鼠(n=2,n=8)为1.198,中剂量(n=1,n=7)为1.469。在1000mg/kg/天剂量的达泮舒腈治疗后,挽回了app/ps1小鼠的ltp损伤。但是,低剂量达泮舒腈(500mg/kg/天)施用未能改善app/ps1小鼠的ltp不足。
现以完整,清楚,简洁和准确的术语描述本发明及其制造和使用的方式和过程,以使所属领域的技术人员能够制造和使用本发明。应当理解,前述内容描述了本发明的优选实施方式,并且可以在不脱离权利要求所阐述的本发明的范围的情况下对其进行修改。为了特别指出并清楚地要求保护被视为发明的主题,以下权利要求结束本说明书。
- 还没有人留言评论。精彩留言会获得点赞!