脊髓损伤的治疗剂的制作方法
【技术领域】
本发明涉及再生医学中的细胞制剂。更具体地,本发明涉及含有能有效治疗脊髓损伤的多能干细胞的细胞制剂。
背景技术:
脊髓损伤(spinalcordinjury)主要是指强大的外力作用于脊柱而损坏脊椎、脊髓受到损伤的状态。另外,由于诸如脊髓肿瘤和疝等的内部原因也会产生类似的症状(在下文中,这些可以统称为脊髓损伤)。
目前,据说日本有超过10万脊髓损伤患者,每年有超过5干人新发生脊髓受损。受伤的原因按比例从高到低依次为:1.交通事故,2.从高处坠落,3.跌倒,4.碰撞/压伤,5.运动,6.其他,等。
根据损伤程度,分为″完全型″和″不完全型″。″完全型″被称为″脊髓完全损伤″,是指脊髓被横断并且神经传递功能被完全切断的状态,″不完全型″被称为“脊髓不完全损伤”,是指脊髓的一部分受损伤或受压迫并保留了某些功能。
据称与末梢神经不同,包含脊髓的中枢神经系统一旦受损伤就无法修复/再生。
因此,紧急治疗是为了预防对脊椎或脊髓的二次损伤,进行固定、氧化和维持脊髓灌注、支持疗法等。此外,据称在20世纪90年代的动物实验和临床试验中报告了大剂量急性期类固醇疗法(非专利文献1)具有有效抑制后遗症的效果。但是,据称其对除了再生能力强大的相对年轻的患者以外的患者效果较弱,这不是一概而论的。
因此,通常在受伤后,过了急性期就要尽早进行康复训练。但是,脊髓损伤的康复训练无法恢复失去的功能。
脊髓损伤患者希望再生受损脊髓并恢复其功能,并且各个领域的研究正在进行中。特别是,对于以前认为无法治疗的脊髓损伤等的中枢神经疾病,正在尝试研究由干细胞再生的医学。
例如,在动物实验中使用了神经干细胞(非专利文献2)、胚胎干细胞(非专利文献3)、骨髓间充质干细胞(非专利文献4至5)、鼻黏膜细胞(非专利文献6)等各种细胞,报告称其实际上对改善脊髓损伤的病理状态是有效的。尽管正在尝试其中一部分临床试验,但是迄今为止仅批准了自体骨髓间充质干细胞(非专利文献7)。
一方面,已知存在于间充质细胞级分中的、无需基因导入或细胞因子等诱导操作就能获得的、将ssea-3(阶段特异性胚胎抗原-3,stage-specificembryonicantigen-3)作为表面抗原表达的多能干细胞(多系分化持续应激细胞(muse细胞),multilineagedifferentiatingstressenduringcells)承担着间充质细胞级分所具有的多能性,有可能应用于以组织再生为目标的疾病治疗中(例如,专利文献1;非专利文献8至10)。但是,没有使用muse细胞治疗脊髓损伤并显示出获得预期治疗效果的例子。
【现有技术文献】
【专利文献】
【专利文献1】专利第5185443号说明书
【非专利文献】
【非专利文献1】brackenmb,shepardmj,collinswf,holfordtr,youngw,baskinds,eisenberghm,flamme,leo-summersl,maroon:nengljmed.322:1405-1411,1990.
【非专利文献2】okadas,ishiik,yamanej,iwanamia,ikegamit,katohh,iwamoto丫nakamuram,miyoshih,okanohj,contagch,toyama丫okanoh:fasebj.19:1839-1841,2005.
【非专利文献3】mcdonaldjw,liuxz,qu丫lius,mickeysk,turetskyd,gottliebdi,choidw:natmed.5:1410-1412,1999.
【非专利文献4】hofstettercp,schwarzej,hessd,widenfalkj,elmaniraa,prockopdj,olsonl:procnatlacadsciusa.99:2199-2204,2002.
【非专利文献5】kodam,okadas,nakayamat,koshizukas,kamadat,nishioysomeya丫yoshinagak,okawaa,moriyah,yamazakim:neuroreport.,16:1763-1767,2005.
【非专利文献6】ramom-cuetoa,corderomi,santos-benitoff,avilaj:neuron.25:425-435,2000.
【非专利文献7】honmouo:spinalsurgery30(3)248-250,2016
【非专利文献8】kurodayetal.procnatlacadsciusa,2010:107:8639-8643.
【非专利文献9】wakaoseta1.procnatlacadsciusa,2011:108:9875-9880.
【非专利文献10】kurodayetal.natprotc,2013:8:1391-1415.
技术实现要素:
【发明所要解决的技术问题】
本发明的目的是提供一种用于治疗脊髓损伤的细胞制剂。
【用于解决课题的手段】
本发明的发明人发现,在脊髓损伤模型大鼠中,通过从血管等或者直接向受试者的脊髓损伤部分及其周边施用人muse细胞,muse细胞在脊髓损伤部位游走/集结/生存,重构脊髓组织,从而改善或恢复运动功能,于是发现muse细胞可以用于治疗脊髓损伤,从而完成了本发明。
即,本发明如下:
[1]一种用于治疗脊髓损伤的细胞制剂,所述细胞制剂包含源自生物体间充质组织或培养的间充质细胞的ssea-3阳性多能干细胞。
[2]根据[1]所述的细胞制剂,所述脊髓损伤是脊髓完全损伤。
[3]根据[1]所述的细胞制剂,所述脊髓损伤是脊髓不完全损伤。
[4]根据上述[1]至[3]中任一项所述的细胞制剂,所述多能干细胞是具有以下所有性质的多能干细胞:
(i)端粒酶活性低或无;
(ii)具有分化为三胚层中任一胚层的细胞的能力;
(iii)不显示肿瘤性增殖;以及
(iv)具有自我更新能力。
[5]根据上述[1]至[3]中任一项所述的细胞制剂,所述多能干细胞是具有以下所有性质的多能干细胞:
(i)ssea-3阳性;
(ii)cd105阳性;
(iii)端粒酶活性低或无;
(iv)具有分化为三胚层中任一胚层的能力;
(v)不显示肿瘤性增殖;以及
(vi)具有自我更新能力。
[6]一种源自生物体间充质组织或培养的间充质细胞的ssea-3阳性多能干细胞在制造用于治疗脊髓损伤的细胞制剂中的用途。
[7]一种用于治疗脊髓损伤的方法,所述方法包括将治疗有效量的细胞制剂施用于需要治疗脊髓损伤的患者的步骤,所述细胞制剂包含源自生物体间充质组织或培养的间充质细胞的ssea-3阳性多能干细胞。
发明的效果
在本发明中,从脊髓损伤患者的血管等或者直接向受试者的脊髓损伤部位及其周边施用muse细胞,muse细胞在脊髓损伤部位游走/集结/生存,重构脊髓组织,从而能够改善或恢复运动功能。因此,本发明的细胞制剂可以用于治疗脊髓损伤。
muse细胞可以有效地游走于脊髓损伤发生部位、集结/生存,可以在生存的部位重构脊髓组织,因此在移植(施用)之前不需要分化诱导为治疗受试者细胞。此外,它是非致瘤性的,具有出色的安全性。另外,由于muse细胞不会被免疫排斥,因此也可以通过供体制造的异体制剂进行治疗。因此,显示出上述出色性能的muse细胞可以提供容易可行的手段来治疗脊髓损伤患者。
【附图说明】
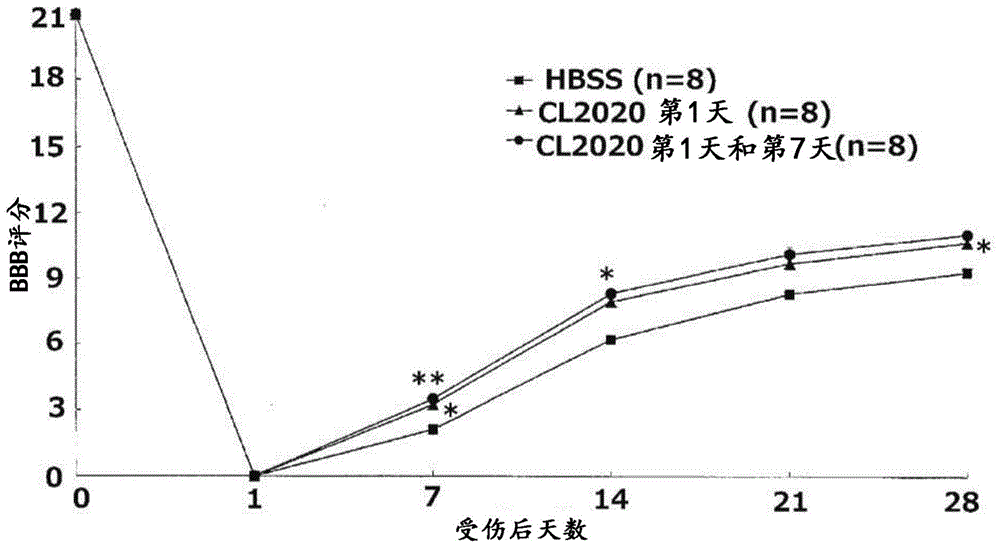
图1是示出在施用了介质(hbss)或muse细胞(cl2020)后的脊髓损伤模型大鼠中后肢运动功能的评估结果的图(实施例1-4)。*p<0.05**p<0.01vs.hbss
图2是示出在施用了介质或muse细胞后的脊髓损伤模型大鼠中后肢运动功能的评估结果的图(实施例2-1)。*p<0.05**p<0.01vs.hbss(对照)
图3是示出在施用了介质或muse细胞后的脊髓损伤模型大鼠中后肢运动功能的评估结果的图(实施例3-1)。*p<0.05vs.hbss(对照)
【具体实施方式】
本发明涉及一种用于治疗脊髓损伤的、包含ssea-3阳性多能干细胞(muse细胞)的细胞制剂。下面将详细说明本发明。
1.适用疾病
本发明的包含ssea-3阳性多能干细胞(muse细胞)的细胞制剂在治疗脊髓损伤中使用。
在本发明中,″脊髓损伤″主要是指强大的外力作用于脊柱而损坏脊椎、脊髓受到损伤的状态。另外,已知由于诸如脊髓肿瘤和疝等的内部原因也会产生类似的症状,本发明的细胞制剂也可适用于这种情况。根据损伤程度,脊髓损伤分为″完全型″和″不完全型″。″完全型″被称为″脊髓完全损伤″,是指脊髓被横断并且神经传递功能被完全切断的状态,″不完全型″被称为″脊髓不完全损伤″,是指脊髓的一部分受损伤或受压迫并保留了某些功能。
由于脊髓损伤的病理状态随着损伤后时间的推移会根据对损伤的生物体反应而复杂地变化,因此,各个时期都需要根据每种病理状态进行适当的治疗。
脊髓损伤的急性期被分类为外力引起的一次损伤和紧接着发生的生物化学/生物学反应的二次损伤。由血肿、缺血、浮肿、炎症细胞浸润及神经传递物质渗漏引起的细胞毒性等引起的神经/胶质细胞的细胞死亡而引起的症状范围扩大的过程总称为二次损伤。与一次损伤不同,二次损伤是可能成为各种治疗的主要目标的病理状态。因此,通过治疗抑制二次损伤,将组织障碍控制在最小限度,有可能改善功能预后。该急性期是发生上述二次损伤的时期,尽管其视患者而异,但例如是在受伤后约3周。
脊髓损伤的亚急性期是急性期炎症收敛并且血管新生/组织修复反应活跃的时期。该亚急性期是发生上述反应的时期,尽管其视患者而异,但例如是在受伤后约1至12周。
此外,在脊髓损伤的慢性期,在脊髓损伤部分中形成空腔造成组织缺损。集结在损伤部分周围的星形胶质细胞形成坚硬的胶质瘢痕,并成为轴突再生的屏障。此外,已知在脊髓损伤的慢性期,神经细胞的活性降低,导致细胞体萎缩,也暗示着对治疗的反应性下降的可能性。该慢性期是发生上述情况的时期,尽管其视患者而异,但例如是从受伤之后约4周开始。
2.细胞制剂
(1)多能干细胞(muse细胞)
在本发明的细胞制剂中使用的多能干细胞是已经在人体内发现其存在的、并被命名为″muse(多系分化持续应激)细胞″的细胞。已知muse细胞除了可以从骨髓液、脂肪组织(ogura,f.,等人,stemcellsdev.,nov20,2013(epub)(发表于2014年1月17日))和皮肤的真皮结缔组织等获得之外,还广泛存在于组织和器官的结缔组织中。此外,该细胞是兼具多能干细胞和间充质干细胞性质的细胞,例如,作为细胞表面标记物的″ssea-3″阳性细胞、优选地作为ssea-3阳性和cd-105阳性的双重阳性细胞被识别。因此,muse细胞或包含muse细胞的细胞集团例如,可以以ssea-3单独或ssea-3和cd-105的表达作为指标从生物体组织中分离出来。wo2011/007900中公开了诸如muse细胞的分离方法、识别方法、以及特征等的详细内容。此外,利用muse细胞对各种外部应激的高抗性,在蛋白水解酶处理、低氧条件、低磷酸条件、低血清浓度、低营养条件、暴露于热休克,有害物质存在下、活性氧存在下、机械刺激下和压力处理下等各种外部应激条件下对其进行培养,可以选择性地浓缩muse细胞。另外,在本说明书中,在作为用于治疗脊髓损伤的细胞制剂中使用ssea-3作为指标从生物体间充质组织或培养的间充质组织制备的多能干细胞(muse细胞)或包含muse细胞的细胞集团可简称为″ssea-3阳性细胞″。
可以以细胞表面标记物ssea-3或ssea-3和cd-105作为指标,从生物体组织(例如,间充质组织)中制备muse细胞或包含muse细胞的细胞集团。此处,″生物体″是指哺乳动物的生物体。在本发明中,生物体不包括受精卵以及发育阶段在囊胚期之前的胚胎,但包括胎儿以及包含囊胚的发育阶段在囊胚期之后的胚胎。对于哺乳动物没有特别限制,但可例举人、猴子等的灵长类;小鼠、大鼠、兔子和豚鼠等的啮齿;猫、狗、绵羊、猪、牛、马、驴、山羊、雪貂等。在本发明的细胞制剂中使用的muse细胞因其直接通过具有的标记物与生物体的组织分离而与胚胎干细胞(es细胞)和ips细胞有明显区别。此外,″间充质组织″是指骨、滑膜、脂肪、血液、骨髓、骨骼肌、真皮、韧带、肌腱、牙髓、脐带、脐带血、羊膜等组织和存在于各种器官中的组织。例如,muse细胞可获自骨髓、皮肤、脂肪组织、血液、牙髓、脐带、脐带血、羊膜等。例如,优选地采集生物体间充质组织,从该组织制备muse细胞并进行利用。此外,也可以使用上述制备手段从成纤维细胞和骨髓间充质干细胞等培养的间充质细胞制备muse细胞。
此外,包含本发明的细胞制剂中使用的muse细胞的细胞集团可以通过以下方法来制备:所述方法包括对生物体间充质组织或培养的间充质细胞施加外部应激刺激以选择性地增殖对该外部应激具有抗性的细胞并回收提高了其存在比例的细胞。
所述外部应激可以为蛋白酶处理、低氧浓度培养、低磷酸条件下培养、低血清浓度培养、低营养条件下培养、热休克暴露下培养、低温培养、冷冻处理、有害物质存在下培养、活性氧存在下培养、机械刺激下培养、振动处理中培养、压力处理下培养或物理冲击中的任何一个或多个组合。
为了对细胞施加外部应激,进行所述蛋白酶处理时间优选地合计为0.5至36小时。此外,蛋白酶浓度为将粘附于培养容器上的细胞剥离时使用的、将细胞团分散为单个细胞时使用的或从组织中回收单个细胞时使用的浓度即可。
所述蛋白酶优选地为丝氨酸蛋白酶、天冬氨酸蛋白酶、半胱氨酸蛋白酶、金属蛋白酶、谷氨酸蛋白酶或n-末端苏氨酸蛋白酶。此外,所述蛋白酶优选地为胰蛋白酶、胶原酶或中性蛋白酶。
另外,在本发明的细胞制剂中,所使用的muse细胞对于接受细胞移植的受体可以是自体的或异体的。
如上所述,已知muse细胞或包含muse细胞的细胞集团例如可以以ssea-3阳性或ssea-3和cd-105双重阳性作为指标从生物体组织制备,但人的成人皮肤中包含各种类型的干细胞和前体细胞。但是,muse细胞与这些细胞不同。这样的干细胞和前体细胞例如,皮肤源性前体细胞(skp)、神经嵴干细胞(ncsc)、成黑素细胞(mb)、血管周细胞(pc)、内皮前体细胞(ep)和脂肪源性干细胞(adsc)。可以以这些细胞特有的标记物的“非表达”作为指标来制备muse细胞。更具体地,muse细胞可以将从cd34(ep和adsc的标记物)、cd117(c-kit)(mb的标记物)、cd146(pc和adsc的标记物)、cd271(ngfr)(ncsc的标记物)、ng2(pc的标记物)、vwf因子(血管性血友病因子)(ep的标记物)、sox10(ncsc的标记物)、snail(skp的标记物)、slug(skp的标记物)、tyrp1(mb的标记物)和dct(mb的标记物)组成的组中选择的11种标记物中的至少一种,例如,2、3、4、5、6、7、8、9、10或11种标记物的非表达作为指标进行分离。例如但没有特别限制,可以以cd117和cd146的非表达作为指标进行制备,进一步地,可以以cd117、cd146、ng2、cd34、vwf和cd271的非表达作为指标进行制备,更进一步地,可以以上述11个标记物的非表达作为指标进行制备。
此外,在本发明的细胞制剂中使用的具有上述特征的muse细胞可以从如下:
(i)端粒酶活性低或无;
(ii)具有分化为三胚层中任一胚层的细胞的能力;
(iii)不显示肿瘤性增殖;以及
(iv)具有自我更新能力
组成的组中选择具有至少一种性质。优选地,本发明的细胞制剂使用的muse细胞具有所有上述性质。
此处,关于上述(i),″端粒酶活性低或无″是指,例如,当使用trapezexltelomerasedetectionkit(millipore公司)检测端粒酶活性时,其检测值低或不能被检测到。端粒酶活性″低″是指,例如,具有与作为体细胞的人成纤维细胞相同水平的端粒酶活性,或具有的端粒酶活性为hela细胞的1/5以下,优选地为1/10以下。
关于上述(ii),muse细胞具有在体外和体内分化为三胚层(内胚层系、中胚层系和外胚层系)的能力,例如,在体外进行诱导培养,可分化为肝细胞(包含肝芽细胞或表达肝细胞标记物的细胞)、神经细胞、骨骼肌细胞、平滑肌细胞、骨细胞、脂肪细胞等。此外,当体内移植到精巢中时,其也有显示出分化为三胚层的能力的情况。进一步地,其具有通过静脉注射移植到生物体中在受伤器官(心脏、皮肤、脊髓、肝、肌肉等)中游走和生存、并根据组织分化成细胞的能力。
关于上述(iii),muse细胞具有如下性质,即以增殖速度约为1.3天进行增殖,通过悬浮培养从1个细胞开始增殖,并形成胚状体样细胞团,当达到一定大小时,其会在14天左右停止增殖。当将这样的胚胎样细胞团转移到粘附培养时,细胞再次开始增殖,并且从细胞团中增殖的细胞以约1.3天的增殖速率扩增。进一步地,当移植到精巢中时,其具有至少半年不癌变的性质。
此外,关于上述(iv),muse细胞具有自我更新(自我复制)能力。此处,″自我更新″是指能够确认到由1个muse细胞通过悬浮培养而培养获得的胚状体样细胞团中所包含的细胞向3胚层性细胞进行分化,同时通过对胚状体样细胞团的细胞重新将其1个细胞转移至悬浮培养,使其形成下一代的胚状体样细胞团,并且确认到其重新向3胚层性的分化以及悬浮培养中的胚状体样细胞团。自我更新重复1次或者多次周期即可。
(2)细胞制剂的制备和使用
本发明的细胞制剂没有特别限制,可以将上述(1)中获得的muse细胞或包含muse细胞的细胞集团悬浮于生理盐水或适当的缓冲液(例如,磷酸盐缓冲生理盐水)中而获得。在这种情况下,如果在从自体或异体组织分离的muse细胞的数量少的情况下,则可以在细胞移植之前对其进行培养,直至增殖至获得预定的细胞数为止。另外,如已经报告的那样(国际公开第wo2011/007900号小册子),muse细胞不会肿瘤化,因此即使从生物体组织中回收的细胞包含未分化的状态,其癌化的可能性也很低,因此很安全。此外,回收的muse细胞的培养没有特别限制,可以在普通的增殖培养基(例如,包含10%小牛血清的α-最小必需培养基(α-mem)等)中进行。有关更多细节,请参见上述wo2011/007900小册子,并且在培养和增殖muse细胞时,适当地选择培养基、添加剂(例如,抗生素、血清)等,并可以制备包含预定浓度的muse细胞的溶液。当将本发明的细胞制剂施用于人受试者时,从人肠骨中采集骨髓液,例如,在培养作为来自骨髓液的粘结细胞的骨髓间充质干细胞、增加细胞数量直至获得达到有效治疗量的muse细胞后,可以将muse细胞以ssea-3的抗原标记物作为指标分离,将自体或异体的muse细胞作为细胞制剂进行制备。或者例如,将从骨髓液获得的骨髓间充质干细胞在外部应激条件下培养以增殖muse细胞直到达到有效治疗量并进行浓缩后,将自体或异体的muse细胞作为细胞制剂进行制备。
此外,当在细胞制剂中使用muse细胞时,为了保护该细胞,可以使细胞制剂中含有二甲基亚砜(dmso)和血清白蛋白等、含有抗生素等以防止细菌的混入和增殖。进一步地,细胞制剂中可以含有制剂上容许的其他成分(例如,载体、赋形剂、崩解剂、缓冲剂、乳化剂、悬浮剂、舒缓剂、稳定剂、防腐剂、抗菌剂、生理盐水等)。本领域技术人员可以将这些因子和试剂以适当的浓度添加到细胞制剂中。如上所述,muse细胞也可以作为包含各种添加剂的药物组合物使用。细胞制剂的剂型没有特别限制,但优选地为非口服施用制剂,更优选地为注射剂。
上述制备的细胞制剂中所含有的muse细胞数考虑了受试者的性别、年龄、体重、患处的状态、所用细胞的状态等,从而可以在治疗脊髓损伤中获得期望的效果,并且可以对其进行适当地调整。另外,作为受试者的个体包含但不限于人类等哺乳动物。此外,本发明的细胞制剂可以施用一次,也可以多次(例如,2至10次)以适当的间隔(例如,每天两次、每天一次、每周两次、每周一次、每两周一次、每月一次、每两个月一次、每三个月一次、每六个月一次)施用,直至获得期望的治疗效果。只要能得到治疗效果,施用时期可以是在急性期、亚急性期、慢性期中的任一时期,也可以从这些时期中选择的2种以上的时期。
作为治疗上的有效量,根据受试者的状态而定,例如,优选地每一个个体一次1×103个细胞至1×1010个细胞1至10次的施用量。对于每一个个体施用总剂量没有特别限制,例如,1×103个细胞至1×1011个细胞,优选地1×104个细胞至1×1010个细胞,更优选地1×105个细胞至1×109个细胞。
在本发明的细胞制剂中使用的muse细胞具有在脊髓损伤的损伤部位游走、生存的性质。因此,在细胞制剂的施用中,对细胞制剂的施用部位和施用方法没有特别限制,可以向患部局部施用,也可以通过静脉等向其施用。
本发明的细胞制剂可以重构脊髓损伤患者的脊髓组织,并且可以改善或恢复脊髓损伤丧失的功能。
通常使用动物模型来测定本发明的细胞制剂用于治疗脊髓损伤的效果。一般将大鼠和小鼠用作动物物种,也可以使用猴子、狗、兔子等。通过给这些动物的脊髓施加直接的损害,例如,切断、冲击造成的碰碎,电和热造成的伤害等,从而产生脊髓损伤的病态。
对于损伤程度和治疗后的恢复评估,使用bbb评分(脊髓损伤的行为学评分,basso-beattie-bresnahan)、腐蚀刺激(vfh考试:experimentalneurology225,issue2,366-376,(2010))、catwalk步态分析(abhirajd.bhiman等人,neuroscience&biobehavioralreviews83;540-546(2017))等为代表的四肢运动和姿势等或四肢感觉为指标的评估,以及组织病理学的评估。
临床上多采用frankel分类或asia(美国脊柱损伤协会减损,americanspinalinjuryassociationimpairment)量表等(脊椎/脊髓损伤治疗/管理指南制定委员会:脊椎脊髓损伤治疗管理指南,脊髓外科2005;19:(增刊1):1-41)。
在下文中,通过实施例对本发明进行进一步具体说明,但是本发明并非仅限于这些实施例。
【实施例】
实施例1-1:制备大鼠脊髓损伤模型
对处于麻醉中的11周龄雌性sd大鼠的第9至第10胸椎进行椎骨切除以暴露脊髓,然后立即使用脊髓损伤撞击器(mascisimpactor)(美国罗格斯大学)使砝码(直径2.5mm,重10克)从25mm高处落下,以损伤脊髓(3组,每组8只)。
实施例1-2:制备人muse细胞
根据涉及人muse细胞分离及识别的国际公开号wo2011/007900中记载的方法获得muse细胞。更具体地,muse细胞是通过在应激条件下培养间充质干细胞来扩增富集培养而获得的。
实施例1-3:向大鼠脊髓损伤模型施用各种细胞
将大鼠分成3组,每组8只,第一组在脊髓损伤第1天后通过尾静脉施用5×106个细胞/kg体重的muse细胞(单次施用组),第二组在脊髓损伤第1天后和第7天后分别通过尾静脉施用5×106个细胞/kg体重的muse细胞(多次施用组)。第三组在脊髓损伤1天后通过尾静脉施用介质(hbss)(对照组)。
实施例1-4:对后肢运动功能的评估
对于每组中的大鼠,按每周一次的频率直到脊髓损伤4周后,根据bbb(脊髓损伤的行为学评分,basso-beattie-bresnahan)评分(j.neurotrauma1995;12:1-21)检查后肢运动功能。其结果为:如图1所示,在muse细胞施用组中,bbb评分一直很高,并且在脊髓损伤后7天之后,与介质施用组相比,在muse细胞单次施用组和多次施用组中观察到明显更高的值,显示了muse细胞对后肢运动功能的改善效果。
实施例2-1:向大鼠脊髓损伤模型施用muse细胞(急性期施用)和对后肢运动功能的评估
以与实施例1-1至1-4相同的程序将muse细胞施用于大鼠脊髓损伤模型,并对后肢运动功能进行评估。然而,muse细胞的施用量为一次1×106个细胞/kg体重。bbb评分测定结果如图2所示。其结果为:在脊髓损伤急性期施用中,与对照组在脊髓损伤后立即观察到的运动功能的自发改善/恢复水平相比,muse细胞发挥了显著优异的运动功能改善或恢复效果。
实施例2-2:关于已施用muse细胞(急性期施用)的大鼠脊髓损伤模型的组织病理学分析
对于实施例2-1的muse细胞施用组和对照组,在自脊髓损伤后第28天进行了最终的bbb评分测定后,分离脊髓并进行组织病理学分析。具体地,将分离后的脊髓以福尔马林固定,按常规制备石蜡切片,进行苏木精-伊红(he)染色和kluver-barrera(kb)染色,并在光学显微镜下观察。对脊髓在其被制备的损伤的中央部分以及其喙侧/尾侧各5mm的部位冠状面切开,作为观察面。观察结果涵盖所有组织病理学变化,当观察到与正常情况不同的观察结果时,根据观察结果的程度分为:轻微变化为1级、中度变化为2级、重度变化为3级。例如,在形成空腔的情况下,变化占脊髓横截面的50%以上的情况为3级、10%-50%的情况为2级、10%以下的情况为1级。
其结果为:在对照组和muse细胞施用组中,泡沫状巨噬细胞的出现、胶质细胞的增殖以及轴突的肿胀都是显著的,并且部分地观察到了空腔的形成、脱髓以及含铁血黄素的沉着。当在脊髓的每个评估部分观察到泡沫状巨噬细胞的出现和胶质细胞的增殖时,在损伤部位,muse细胞施用组的变化倾向于比对照组稍高,而在损伤部分尾侧,muse细胞施用组的变化倾向于比对照组稍低。
实施例3-1:向大鼠脊髓损伤模型施用muse细胞(亚急性期至慢性期施用)和对后肢运动功能的评估
以与实施例1-1至1-4相同的程序将muse细胞施用于大鼠脊髓损伤模型,并对后肢运动功能进行评估。但是,muse细胞(1×106个细胞/kg体重)的施用时期为:第一组(单次施用组)为在脊髓损伤第14天后进行一次;第二组(多次施用组)为在脊髓损伤第14天和28天后分别进行1次;在第三组中,在脊髓损伤的第14天后,施用介质(hbss)(对照组)。
bbb评分测定结果如图3所示。其结果为:在从脊髓损伤的亚急性期到慢性期施用muse细胞的情况下,通常,即使是在脊髓损伤后运动功能的自然改善/恢复达到顶点的稳定期,也显示出了进一步的运动功能改善/恢复。而且,运动功能改善/恢复效果在脊髓损伤后持续了超过70天。
实施例3-2:关于已施用muse细胞(亚急性期至慢性期施用)的大鼠脊髓损伤模型的组织病理学分析
对于实施例3-1的muse细胞施用组和对照组,在自脊髓损伤后第70天进行了最终的bbb评分测定后,分离脊髓并进行组织病理学分析。具体地,将分离后的脊髓以福尔马林固定,按常规制备石蜡切片,进行苏木精-伊红(he)染色和kluver-barrera(kb)染色,并在光学显微镜下观察。对脊髓在其被制备的损伤的中央部分以及其喙侧/尾侧各5mm的部位冠状面切开,作为观察面。除了实施例2-2之外,还测量了再生髓磷脂髓鞘数。再生髓磷脂髓鞘数由一定视野中具有再生髓磷脂髓鞘的细胞数与细胞核数之比来确定。
其结果为:当观察脊髓的每个评估部位时,特别地,对于损伤部分中再生髓磷脂髓鞘数与在对照组中为0.2424±0.2328相比,在muse细胞多次施用组中呈0.3409±0.1836的增加趋势。
因此,暗示了施用muse细胞具有促进脊髓损伤的神经再生的作用。
【产业上的可利用性】
当施用于脊髓损伤患者时,本发明的细胞制剂可以重构脊髓损伤的损伤组织,改善或恢复其功能,并且可以应用于治疗脊髓损伤。
- 还没有人留言评论。精彩留言会获得点赞!