使用慢病毒基因构建体的递送的体内基因疗法的制作方法
fviii的基因中以增加其分泌,如具有226aa的b结构域变体序列的f8/n6(苗(miao)等人,血液(blood)103:3412-3419,2004)、密码子优化的bdd-fviii和f8/n6(沃德(ward)等人,血液117:798-807,2011)、具有取代f8/n6中的226aa/n6的17-aa肽编码序列的f8-v3(麦金托什(mcintosh)等人,血液121:3335-3344,2013)以及编码具有r1645h的bdd-fviii变体的f8-rh(赛纳(siner)等人,血液121:4396-4403,2013)。与bdd-fviii相比,一些fviii变体(如fviii-rh和弗林蛋白酶切割位点缺失的bdd-fviii变体(阮(nguyen)等人,血栓形成与止血杂志(j thromb haemostas.)15:110-121,2017))表现出生物活性增加,这可能是由于凝血酶活化时a2结构域的解离较慢。
[0010]
美国专利第5,779,708号描述了一种穿透硬组织并提供进入下面的组织的药物递送通道的骨内和/或硬组织药物递送装置和方法。所述装置包含中空钻头和可移除地插入中空钻头的管心针。在钻孔期间防止中空钻头的孔堵塞的管心针在钻孔后被移除,以允许操作者通过中空钻头的孔注射药物。
[0011]
尽管有先前的研究,但是仍然需要替代或补充受试者的功能性fviii的安全且可靠的方法。特别需要不依赖于预先调理或清髓治疗并且尽管在待治疗的受试者中存在抑制性抗fviii抗体但仍能提供治疗益处(如适当的凝结功能)的方法。
技术实现要素:
[0012]
本文描述了用于治疗hema的临床相关策略的改进方案。在这些策略的实例中,在不进行预先调理的情况下将携带由血小板特异性启动子gp1bα(g)驱动的各种不同fviii变体转基因(包含针对在此系统中表达而优化的变体)的自失活慢病毒载体(lv)递送到hema受试者体内。在一些实施例中,这种转基因通过骨内(io)施用(例如施用到胫骨或髂骨中)进行递送。在其它实施例中,递送为鼻内递送(或以其它方式递送至肺)或静脉内递送。所提供的fviii转基因可以有效地转导造血干细胞(hsc),而基本上不会引发抗fviii抑制性抗体(抗fviii抑制剂)。所产生的fviii表达并储存在血小板α-颗粒中,并且即使在存在预先存在的抗fviii抑制剂的情况下,也能至少部分校正免疫活性hema受试者的出血表型。
[0013]
本公开的实施例描述了实现包含用于治疗血友病的表达血小板靶向的经过修饰的fviii基因的lv的io递送的组合治疗的组合物和方法。用于在体内有效转导hsc的io递送的使用使得受试者的炎性应答和/或免疫应答较低,同时伴随的全身毒性较低。这对某些受试者尤其有益,包含例如患有如血友病等出血性病症的受试者。
[0014]
另外的实施例提供了一种治疗需要血浆因子viii的受试者的方法,所述方法包含:向所述受试者施用治疗有效量的炎症抑制剂(如地塞米松(dex));向所述受试者施用治疗有效量的cd8+ t细胞耗竭剂;以及向所述受试者施用治疗有效量的组合物,所述组合物包含慢病毒载体,所述慢病毒载体包含与巨核细胞特异性启动子以可表达的方式连接的经优化fviii表达盒,其中施用通过以下方式进行:骨内(io)输注;静脉(iv)递送;或鼻内(in)或吸入递送。
[0015]
在此治疗方法的实施例的实例中,所述地塞米松在施用lv前24小时、施用前4小时、施用后4小时和施用后24小时以100mg/kg的剂量施用。
[0016]
在所提供的实施例的实例中,所述cd8+ t细胞耗竭剂包含抗cd8抗体。例如,在实例中,所述cd8+ t细胞耗竭剂是抗cd8αmab,所述抗cd8αmab在lv递送前1天、递送后4天和递
送后11天以4mg/kg的剂量施用。
[0017]
在所提供的实施例的其它实例中,所述巨核细胞特异性启动子是gp1b-α启动子。
[0018]
在所提供的实施例的实例中具体设想的是不包含对受试者进行预先调理或清髓治疗的方法。
[0019]
在所提供的实施例的更多实例中,所述io输注以2μl/min到15μl/min、5μl/min到12μl/min或不超过10μl/min的速率进行。例如,在一些实例中,所述io输注以0.01ml/min到0.5ml/min、0.05ml/min到0.3ml/min、0.1ml/min到0.25ml/min或不超过0.4ml/min的速率进行。任选地,所述io输注在不超过45分钟的时段内进行。
[0020]
在又另外的实例中,所述经优化fviii表达盒包含hf8x10 k12(seq id no:1)或hf8/n6k12rh(seq id no:2)。在所提供的实施例中的任何一个实施例中,所述慢病毒载体可以包含seq id no:3或seq id no:4或其功能变体。
[0021]
还提供了本文提供的方法的实例,所述方法是用于治疗受试者的止血相关病症的方法,并且所述受试者需要此类治疗。举例来说,所述受试者可能患有a型血友病(hema)、血管性血友病、与创伤或损伤相关的出血、血栓形成、血小板减少症、中风、凝血病、弥散性血管凝固(dic)或过度抗凝治疗病症。
[0022]
在所提供的治疗方法的又另一个实施例中,所述受试者是具有预先存在的抗fviii抑制性抗体的hema受试者。
[0023]
还提供了治疗需要血浆因子viii的受试者的方法,所述方法基本上如本文所述。
附图说明
[0024]
与本文一起提交的附图中的至少一个附图可以以彩色形式更好地理解。申请人将一或多个附图的彩色版本视为原始提交的一部分,并保留在后续程序中呈现附图彩色图像的权利。
[0025]
图1a-1b:在免疫活性和免疫缺陷小鼠中io输注m-gfp-lv后骨髓细胞中的gfp表达。在第0天,在经过修饰的骨髓增生性肉瘤病毒启动子(mnd)(m-gfp-lv)(1.1
×
108ifu/动物)或无菌pbs(20μl/动物,模拟(mock))的控制下,向c57bl/6j(bl6)和b6(cg)-rag2
tm1.1cgn
/j(rag2-/-)小鼠骨内输注编码gfp的自失活lv。在第7天、第28天和第84天处死实验小鼠。然后分离骨髓细胞,并且通过流式细胞术检测总骨髓细胞(图1a和1b中的左图区)和骨髓造血干细胞(hsc,lin-c-kit
+
sca1
+
)(a和b中的右图区)中的gfp表达水平。数据示出为代表性流动图像(图1a)和随时间变化的汇总图(图1b)。每种符号表示单独的动物。数据以平均值
±
sed表示。差异在p<0.01(**)和p<0.001(***)时被认为是显著的。示出的数据来自两个独立的实验。
[0026]
图2a-2e:用于提高io输注m-gfp-lv后骨髓细胞的原位转导效率的短暂免疫抑制。(图2a)向通过腹腔注射地塞米松(dex,100mg/kg,4
×
,-24小时、-4小时、4小时和24小时)或抗cd8αmab(4mg/kg,3
×
,第-1天、第4天和第11天;或5
×
,第-1天、第4天、第11天、第16天和第21天)或组合药物(dex 4
×
+抗cd8αmab 5
×
)进行预处理的bl6小鼠io输注m-gfp-lv的示意图。通过流式细胞术测量总骨髓细胞和hsc(lin-c-kit
+
sca1
+
)中的gfp表达。(图2b)在io输注mnd-gfp-lv(8.8
×
108ifu/动物)或无菌pbs(20μl/动物,模拟)后,用dex预处理bl6小鼠。在第7天检测总骨髓细胞(左图区)和hsc(右图区)中的gfp表达。(图2c)用抗cd8αmab(3
×
)预处理bl6小鼠,随后io输注gfp-lv(8.8
×
107ifu/动物)或无菌pbs(20μl/动物,模拟)。在第9、30和63天检测总骨髓细胞(左图区)和hsc(右图区)中的gfp表达。(图2d)用组合药物对bl6小鼠进行预处理,随后io输注gfp-lv(3.6
×
108tu/动物)或无菌pbs(20μl/动物,模拟)。在第7、69和160天检测总骨髓细胞(左图区)和hsc(右图区)中的gfp表达。(图2e)将外周白细胞(左图区)或骨髓细胞(右图区)的基因组dna从(图2d)中第160天经处理小鼠中分离。通过实时qpcr对这些血细胞中gfp-lv拷贝数进行检测。数据以平均值
±
sed表示。差异在p<0.05(*)、p<0.01(**)和p<0.001(**)时被认为是显著的。示出的数据来自两个独立的实验。
[0027]
图3a-3c:用于增强a型血友病小鼠在io输注g-f8/n6-lv后的表型校正的短暂免疫抑制。用组合药物(dex 4
×
+抗cd8αmab 5
×
)对hema小鼠进行预处理,然后在第0天在gp1bα启动子(g-f8/n6-lv,2.2
×
106ifu/动物)的控制下给予io输注编码具有b结构域(f8/n6)的近侧226个氨基酸区域的hfviii变体的自失活lv。(图3a)在第70天,通过尾夹(tail clip)测定评估经g-f8/n6-lv或g-f8/n6-lv+药物处理的小鼠的hema表型校正(n=6-8/组)。将未经处理的hema小鼠的平均血液损失设定为100%。将野生型c57bl/6小鼠用作阳性对照。(图3b)还通过在第84天测量颈动脉血流速率评估了经g-f8/n6-lv+药物或g-f8/n6-lv处理的小鼠的hema表型校正。(图3c)在第84天从经g-f8/n6-lv+药物或g-f8/n6-lv处理的小鼠中收集血浆样品。分别通过aptt和bethesda测定测量了hfviii活性和抗fviii抗体。将未经处理的hema小鼠的hfviii活性水平校正为正常的0%,并且其抗fviii抗体水平为0bethesda单位。每种符号表示单独的动物。数据以平均值
±
sed表示。差异在p<0.01(**)、p<0.001(***)和p<0.0001(****)时被认为是显著的。
[0028]
图4a-4b:bddf8x10k12产生了更高的表达水平。(图4a)一种新型人fviii cdna变体的示意图。与f8/n6相比,f8x10k12的b结构域缺失,在a1结构域中有10个氨基酸变化,并且在轻链中有12个氨基酸变化。(图4b)bddf8x10k12和f8/n6都被克隆到受普遍存在的启动子ef1α(pef1α-f8x10k12和pef1α-f8/n6)控制的慢病毒转基因主链质粒中。然后用pef1α-f8x10k12(n=3)或pef1α-f8/n6(n=9)(50μg/动物)或无菌pbs(模拟,2ml/动物)对hema小鼠进行水动力学注射。在注射后第4天收集血浆样品,并通过aptt测量了hfviii活性。数据以平均值
±
sed表示。差异在p<0.0001(****)时被认为是显著的。(图4c)在第0天产生e-f8x10k12-lv和e-f8/n6-lv来转导293t细胞(moi=100)。第5天,通过流式细胞术检测293t细胞中的hfviii表达水平。
[0029]
图5a-5f:经药物预处理并且随后io输注g-f8x10k12-lv的hema小鼠实现了表型校正。(图5a)在血小板特异性糖蛋白1bα启动子(gp1bα)(g-f8x10k12-lv)控制下编码f8x10k12的自失活lv基因组的示意图。(图5b)在第0天将hema小鼠用药物(dex4
×
+抗cd8αmab 5
×
)预处理,然后io输注g-f8x10k12-lv(2.2
×
106ifu/动物),或仅给予g-f8/n6-lv(2.2
×
106ifu/动物)或g-f8x10k12-lv(2.2
×
106ifu/动物)或无菌pbs(模拟,20μl/动物)的io输注。在第90天,通过elisa测量经g-f8x10k12-lv+药物处理的小鼠或经仅g-f8x10k12-lv处理的小鼠或经仅g-f8/n6-lv处理的小鼠或模拟小鼠中的血小板裂解物中的hfviii水平。每种符号表示单独的动物。(图5c)在第120天,通过bethesda测定测量了从经处理小鼠和模拟小鼠收集的血浆样品中的抗fviii抗体。模拟小鼠的抗fviii抗体的水平为0bethesda单位。每种符号表示单独的动物。(图5d)在第120天,通过qpcr检测了经处理小鼠
或模拟小鼠的外周白细胞中的lv拷贝数。每种符号表示单独的动物。(图5e)在第120天通过尾夹测定对经处理小鼠的hema表型校正进行了监测。将未经处理的hema小鼠的平均血液损失设定为100%。将野生型c57bl/6小鼠用作阳性对照。每种符号表示单独的动物。(图5f)在第200天从经处理小鼠中分离出了富含血小板的血浆,并通过凝血酶生成测定评估了fviii的功能活性。通过以下三个参数对测定中产生的凝血酶进行了评估:滞后期时间、凝血酶峰值浓度和总凝血酶。数据以平均值
±
sed表示。差异在p<0.01(**)、p<0.001(***)和p<0.0001(****)时被认为是显著的。
[0030]
图6a-6d:短暂免疫抑制的hema小鼠在io输注g-f8/n6k12rh-lv之后实现了表型校正。(图6a)一种新型人fviii cdna变体—f8/n6k12rh的示意图。与f8/n6相比,f8/n6k12rh在轻链中具有12个氨基酸变化,并且在b结构域内的弗林蛋白酶切割位点(r1645h位置)处具有氨基酸变化。将f8/n6k12rh克隆到受普遍存在的启动子ef1α(pef1α-f8/n6k12 rh)控制的慢病毒转基因主链质粒中。然后用pef1α-f8/n6k12rh(n=3)(50μg/动物)或pef1α-f8/n6(n=5)(50μg/动物)或无菌pbs(n=3)(模拟,2ml/动物)对hema小鼠进行水动力学注射。在注射后第4天收集血浆样品,并通过aptt测量了hfviii活性。(图6b)在血小板特异性糖蛋白1bα启动子(gp1bα)(g-f8/n6k12rh-lv)控制下编码f8/n6k12rh的自失活lv基因组的示意图。(图6c)在第0天,用药物(dex 4
×
+抗cd8αmab 5
×
)对hema小鼠进行了预处理,随后io输注了g-f8/n6k12rh-lv(2.2
×
106ifu/动物)或g-f8/n6-lv(2.2
×
106ifu/动物)或无菌pbs(模拟,20μl/动物)。在第84天从经处理小鼠或模拟小鼠中收集血浆样品。分别通过aptt和bethesda测定测量了hfviii活性和抗fviii抗体。将未经处理的hema小鼠的hfviii活性水平校正为正常的0%,并且其抗fviii抗体水平为0bethesda单位。(图6d)通过在第84天测量颈动脉血流速率,还评估了经仅g-f8/n6-lv或经g-f8/n6k12rh-lv+药物处理的小鼠的hema表型校正。每种符号表示单独的动物。数据以平均值
±
sed表示。差异在p<0.05(*)时被认为是显著的。
[0031]
图7a-7b是hfviii变体和结合了编码gfp或hfviii变体的cdnas的lv的示意图。图7a:hfviii变体。与f8/n6相比,f8x10k12的b结构域缺失,在a1结构域中具有10个氨基酸变化,并且在轻链中具有12个氨基酸变化,而f8/n6k12rh在轻链中具有12个氨基酸变化,并且在b结构域内的弗林蛋白酶切割位点(位置r1645h)处具有氨基酸变化。图7b:在mnd启动子控制下编码gfp的自失活lv构建体或在普遍存在的ef1α启动子或血小板特异性gp1ba启动子控制下包含f8/n6、f8x10k12和f8/n6k12rh在内的各种hfviii变体的示意图。
[0032]
图8a-8b。抗cd8α单克隆抗体处理后bl6小鼠血液和骨髓中cd8α
+
cd3ε
+
细胞的表征。(图8a)第0天腹腔注射抗cd8αmab(4mg/kg,n=3)或无菌pbs(200μl/动物,n=3)。第7天,收集血细胞,并且通过流式细胞术对cd8α+cd3ε+的百分比进行了检测。(图8b)用抗cd8α单克隆抗体(4mg/kg,3
×
,第-1、4和11天)对bl6小鼠进行预处理,然后io输注mnd-gfp-lv(1.8
×
108ifu/动物,n=10)或无菌pbs(20μl/动物,模拟,n=4)。通过眶后出血收集血样,并且在不同时间点处死经处理小鼠或模拟小鼠后获得骨髓细胞。通过流式细胞术监测cd8α+cd3ε的百分比随时间的变化。数据以平均值表示。
[0033]
图9a-9b。图2c中总骨髓细胞(图9a)和骨髓造血干细胞(hsc,lin-c-kit
+
sca1
+
)(图9b)中的gfp表达的代表性流动图像。
[0034]
图10a-10b。图2d中总骨髓细胞(图10a)和骨髓造血干细胞(hsc,lin-c-kit
+
sca1
+
)
(图10b)中的gfp表达的代表性流动图像。
[0035]
图11a-11b展示了人源化nsg小鼠的原理验证研究模型。图11a是示出实例3中描述的方法的步骤的流程图。图11b是实例中所描述的研究中使用的两种慢病毒(lv)构建体的示意图。
[0036]
图12a-12b。将人cd34+细胞在补充有用于扩增人造血细胞的细胞因子混合物(cc110)或用于扩增人巨核细胞(meg)的无血清培养补充剂的sfem ii中培养7天和13天(图12a)。将在sfem ii+meg中培养的人cd34+细胞用m-gfp-lv或g-gfp-lv转导(图12b)。在第7天通过流式细胞术检测巨核细胞和gfp表达。
[0037]
图13a-13c。在用白消安(busulphan)(25mg/kg)预先调理后一天,用1
×
106个人cd34+细胞对6周龄的nsg小鼠进行眶后注射。13周后,收集骨髓(图13a)、脾脏(图13b)和血液(图13c)。通过流式细胞术对骨髓中的人cd34+细胞以及骨髓、脾脏和血液中的人cd45+细胞和鼠cd45+细胞进行了检测。
[0038]
图14a-14b。将m-gfp-lv骨内输注到人源化nsg小鼠中,所述小鼠是9周前通过眶后注射人cd34+细胞而产生的。四周后,处死小鼠,并且分离骨髓和脾脏。通过流式细胞术对骨髓(图14a)和脾脏(图14b)中总细胞、人cd45+和鼠cd45+细胞中的gfp表达进行了检测。
[0039]
图15。在io基因疗法之后,通过elisa评估了犬血小板中的fviii基因表达。
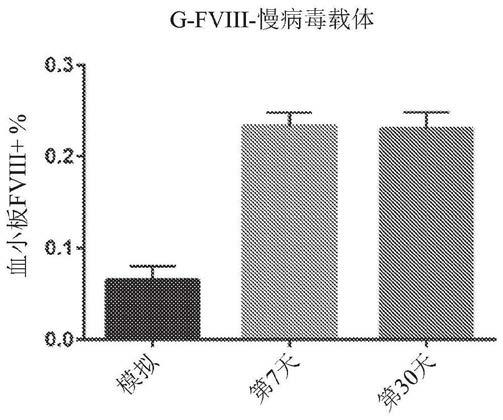
[0040]
图16a-16b。io输注后,在m80中通过(图16a)wbct和(图16b)teg检查hema表型校正。
[0041]
图17a-17h。在iv递送mnd-gfp-lv后在bm细胞中的gfp表达。(图17a)使用动员药物在小鼠体内将hsc从bm动员到血液中。在通过gsf和amd3100动员后外周血中lsk(谱系-、sca1+、c-kit+)的代表性流式细胞术绘图。(图17b)动员后,通过眶后注射注射由普遍存在的mnd启动子驱动的gfp慢病毒载体的iv递送。在不同时间点检测pbmc中的总gfp表达。(图17c)通过流式细胞术分析来自动员处理组或非动员组的lsk细胞。(图17d-17f)处理第4天到10周后通过流式细胞术检测在t、b和髓样细胞中确定的用gfp标记的细胞的百分比。(图17g)在不同组的总骨髓细胞中进行mnd-gfp-lv转导之后,分析mfi。(图17h)在不同组中的骨髓hsc中进行mnd-gfp-lv转导之后测定mfi。模拟n=3,动员组n=5,非动员组n=5,p<0.05(*)。
[0042]
图18a-18b。gp1bα启动子在经过动员小鼠中注射g-gfp-lv后驱动血小板中的gfp表达。(图18a)在注射g-gfp-lv后通过流式细胞术在总血小板中检测到了g-gfp阳性血小板。(图18b,第1部分和第2部分)2周和10周时gfp+血小板的流式细胞术示意图。模拟n=3,动员组n=5,非动员组n=5,p<0.01(**)。
[0043]
图19a-19b。动员处理和通过iv注射进行的e-fviii-lv递送后hema小鼠血浆中的循环fviii。(图19a)通过elisa测定检查血浆中循环fviii的量。(图19b)通过aptt测定检测血浆中循环fviii的活性。同时通过bethesda测定检测血浆中fviii的抑制。动员组n=3,非动员组n=3。
[0044]
图20a-20e。可以在g-fviii-lv处理后将fviii蛋白储存在血小板中。(图20a)第30天和第125天fviii+血小板的代表性流式细胞术示意图。(图20b)在第12、30、65、90和125天,通过流式细胞术测量血小板中的hfviii细胞内染色。(图20c)在第125天,通过elisa测定动员小鼠和未动员小鼠的血小板裂解物中的hfviii水平。(图20d)在处理6个月后通过
taqman q-pcr检测bm中的拷贝数。(图20e)处理6个月后,通过bethesda测定检测血浆中的fviii抑制。模拟n=3,动员组n=5,非动员组n=5。
[0045]
图21a-21e。g-fviii-lv基因疗法改善了动员hema小鼠模型的血液凝结功能。(图21a-21d)在宽型组、hema组、动员组和非动员组中通过测定检测凝结时间(ct)、凝结形成时间(cft)、最大凝结硬度(mcf)和α角。(图21e)动员组(右)和非动员组(左)中的凝结的代表性示意图。
[0046]
图22a-22e。用于治疗hsc动员小鼠模型中的a型血友病的慢病毒载体的静脉递送。(图22a)在mnd启动子或血小板特异性gp1ba启动子的控制下编码gfp并在普遍存在的ef1α启动子或血小板特异性gp1ba启动子的控制下编码hfviii/n6的自失活lv构建体的示意图。(图22b)a型血友病小鼠中hsc的动员方法和随后lv的静脉输注的示意图。(图22c)a型血友病小鼠中hsc的动员和随后lv的静脉输注的实验时间表。(图22d)通过动员和m-gfp-lv处理的小鼠中的gfp表达。模拟:未经处理小鼠,经过动员:通过动员和lv处理的小鼠,未经动员:仅用lv处理的小鼠。(图22e)不同组小鼠的rotem测定结果,包含:图区1-5:用hsc的hsc动员和静脉输注lv处理的a型血友病小鼠;图区:6-12:仅用静脉输注lv处理的a型血友病小鼠;图区13-15:a型血友病小鼠;以及图区16-18:正常野生型小鼠。
[0047]
图23a、23b。(图23a)如实例8所述,通过经由鼻内(in)递送编码因子viii的慢病毒载体治疗a型血友病来进行探究的方案的图示概述。(图23b)实例8中使用的载体的图示。
[0048]
图24a、24b:展示了通过经由鼻内递送的g-gfp-lv转导进行的血小板中的g-gfp表达。经由in向小鼠施用24μl g-fviii-lv(1
×
109ifu/ml)/小鼠/天,持续3天。(图24a)gfp+血小板的流式细胞术示意图。(图24b)慢病毒处理(n=4)后,通过流式细胞术测定血小板中的gfp表达。
[0049]
图25a-25c:通过经由鼻内递送的g-fviii-lv进行的血小板中的fviii表达。(图25a-25b)在in处理(n=4)后通过细胞内染色和在血小板中进行elisa测定检测fviii表达。(图25c)in给药后30天通过rotem测定的hema小鼠、宽型小鼠和经lv处理的小鼠的全血凝结的代表性示意图。
[0050]
图26a-26e:用以下说明的通过m-gfp-lv进行的肺hsc转导:对照小鼠图区图26a(样本001_lng对照_0003.fcs淋巴细胞7.19es;comp-pacific blue-a,ssc-a子集52.4);图26b(样本
–
1_肺对照_003.fcs comp-pacific blue-a,ssc-a子集377146;com-percp-cy5-5-a,ssc-a子集45.5);图26c(样本001_肺对照_003.fcs comp-percp-cy5-5-a,ssc-a子集171102;comp-pe-cy7-a,comp-apc-a子集1.06);以及图26d(comp-pe-cy7-a,comp-gfp-a子集:平均值:comp-gfp-a:10:样本001_肺对照_003.fcs comp-pe-cy7-a,comp-apc-a子集1811;comp-pe-cy7-a,comp-tfp-a子集0.44);以及鼻内递送d7图区图26e(样本001_肺mgfp_004.fcs淋巴细胞9.01es,comp-pacific blue-a,ssc-a子集63.8);图26f(样本_001_肺gfp_004.fcs com-pacific blue-a,ssc-a子集5.75es;comp-percp-cy5-5-a,ssc-a子集60.8);图26g(样本001_肺mgfp_004.fcs comp-percp-cy5-5-a,ssc-a子集349853,comp-pe-cy7-a,comp-apc-a子集1.06);以及图26e(样本001_肺mefp_004.fcs comp-pe-cy7-a,comp-apc-a子集3691,comp-pe-cy7-a,comp-gfp-a子集4.69)。每个图区上的x轴刻度为-103、0、103、104、105;每个图区上的y轴刻度是-103、0、103、104、105。
[0051]
序列表
[0052]
所公开的核酸和/或氨基酸序列如37c.f.r.1.822所定义用核苷酸碱基的标准字母缩写和氨基酸的一个或三个字母代码来示出。每个核酸序列只示出了一条链,但是通过对所显示的链的任何参考,互补链被理解为包含在内。在2019年4月26日或前后创建的文件大小为48kb、标题为“序列表.txt(sequence listing.txt)”的计算机可读文本文件含有本申请的序列表并通过引用以其全文在此并入。在随附的序列表中和/或如本文所提供的:
[0053]
seq id no:1是编码人fviii变体f8x10k12的插入片段bddfviiix10k12的核酸序列;它与变体f8/n6的不同之处在于b结构域缺失、a1结构域中具有10个氨基酸变化以及轻链中具有12个氨基酸变化。
[0054]
seq id no:2是编码人fviii变体f8/n6k12rh的插入片段bddfviiin6k12rh的核酸序列;它与变体f8/n6的不同之处在于在轻链中具有12个氨基酸变化,并且在b结构域内的弗林蛋白酶切割位点(位置r1645h)处具有氨基酸变化。
[0055]
seq id no:3是prrl-gp1bα-hf8x10k12-wpre的核酸序列;f8 cdna插入片段hf8x10k12(seq id no:1)位于此序列的2320-6738位置处,所述序列还包含慢病毒载体主链、血小板特异性gp1bα启动子和插入载体中以形成稳定的mrna的wpre元件。
[0056]
seq id no:4是prrl-gp1bα-hf8/n6k12rh-wpre的核酸序列;f8 cdna插入片段hf8/n6k12rh(seq id no:2)位于此序列的2308-7414位置处,所述序列还包含慢病毒载体主链、血小板特异性gp1bα启动子和插入载体中以形成稳定的mrna的wpre元件。
[0057]
seq id no:5和6分别是用于gag的正向和反向扩增引物的核苷酸序列。
[0058]
seq id no:7是用于gag的探针的核苷酸序列。
[0059]
seq id no:8和9分别是用于人因子viii的正向和反向扩增引物的核苷酸序列。
[0060]
seq id no:10和11分别是用于rpl19的正向和反向扩增引物的核苷酸序列。
具体实施方式
[0061]
a型血友病(hema)是一种伴有血浆因子viii(fviii)缺陷从而在发生内出血和/或外出血时导致hema患者形成不稳定的血凝块的x连锁遗传或获得性遗传病。本文描述了用于通过将携带经工程化的fviii基因的慢病毒载体(lv)(或其它表达单位)直接输注到骨髓中以有效转导造血干细胞(hsc)来治疗a型血友病和其它出血性病症的基因治疗方案。
[0062]
在示例实施例中,使用巨核细胞特异性启动子驱动转基因表达来将fviii表达特异性靶向血小板;这导致含fviii的血小板在血液中循环。血小板内的表达阻止或显著抑制fviii分泌到血液中,从而阻止以此方式治疗的受试者的抗fviii免疫应答。对fviii的免疫应答不利地导致血友病患者的抗fviii抗体中和这种因子(所以将所述抗体称为抗fviii抑制剂)。血小板内的表达维持血小板内的fviii,直到它们被凝结级联触发,从而导致出血时释放fviii。
[0063]
基于本文报告的结果,据信通过将巨核细胞特异性启动子驱动的g-f8-lv直接体内递送到骨髓中的单一基因疗法治疗将使hema患者受益,特别是具有抗fviii抑制剂的患者。
[0064]
有益地并且与传统的离体基因疗法相比,本文提供的io体内外递送系统避免了对离体细胞操纵以及使用完全或部分清髓性调理方案的要求。这种预先调理通常是成功的离体基因疗法所必需的。
[0065]
在本文所述的实施例中,精确控制io输注的速度(速率)可能是有益的,因为这影响io递送的lv转导至骨髓细胞(如hsc)中的效率。可以使用较低的递送速度,并且较低的递送速度对较小的受试者可能是有益的。相对较低的速度包含但不限于2μl/min到15μl/min、5μl/min到12μl/min或不超过10μl/min。一个特定的相对较低的速度是0.01ml/min。相对较高的递送速度(速率)可以用于较大的动物,包含人类。举例来说,以0.01ml/min到0.5ml/min、0.05ml/min到0.3ml/min、0.1ml/min到0.25ml/min或不超过0.4ml/min进行相对较高的递送速率。显然,较快的递送速率将缩短输注时间,并且因此,只要将其选择为仍将在所治疗的特定受试者体内实现有效转导的速率,就认为其是有益的。举例来说,用于治疗相对大型的受试者(如狗)的载体丸剂的总体积可以是2-20ml或更多,并且在20-40分钟内完成输注对受试者可能是有益的。
[0066]
与依赖于重组腺相关病毒(aav)载体(raav)的a型血友病或b型血友病的现有建议治疗相比,本文所述的慢病毒基因疗法具有几个优点。首先,在体内基因转移后,aav仍然作为附加型串联载体存在。在所述情况下,随着时间的推移,转基因表达可能会降低,并且预计将需要重复给药。这种重复给药是否可行或有效还有待证明。相比之下,慢病毒载体是结合到经过转导的细胞基因组中的整合载体。如本文所教导的,如果成功整合到长寿命骨髓hsc中,lv介导的基因疗法的单一治疗可能足以获得终身治疗益处。另外,相当大比例的人类受试者具有针对各种aav血清型的预先存在的中和抗体,并且几乎所有受试者都会产生针对用于初始治疗的血清型的抗体。如果不是不可能的话,这将使相同血清型的重复给药具有挑战性。
[0067]
aav也不适合表达fviii cdna,因为它的转基因能力太小。进一步地,与只能转导正在分裂的细胞的aav和传统的γ-逆转录病毒载体相比,lv可以有效地转导正在分裂和未分裂的细胞,从而使靶向原始hsc的效率显著增加。
[0068]
此外,最近对几种原发性缺乏疾病进行的体外慢病毒基因疗法的临床试验显示了显著的临床益处,而没有副作用或异常的克隆扩增。
[0069]
与其它体内lv介导的基因治疗方法相比,io递送是独特的。除了其它益处(包含本文其它地方具体描述的益处)之外,向骨髓腔中缓慢注射lv可以避免(基本上或完全)由aav和其它候选基因治疗载体的全身静脉(iv)递送引起的炎症和全身毒性。
[0070]
在某些实施例中,使用一或多种化合物来促进或增强靶标hsc的有效转导可能是有益的。例如,几种化合物(如地塞米松、抗cd8单克隆抗体和星形孢菌素)可以增强hsc的lv转导。另一种这样的化合物是雷帕霉素,并且因此示例方法涉及例如通过io共同施用lv和雷帕霉素,以提高转导速率。在病毒滴度可能较低或低于期望水平的情况下,这可能特别有益。另一种用于促进或提高lv转导效率的方法是将lv与可以特异性识别hsc上的受体的一或多种配体或一或多种抗体片段缀合,从而将lv靶向到优选的细胞进行转导。
[0071]
现在更详细地描述本公开的另外的选项和实施例。
[0072]
本文公开的任何组合物调配物可以有利地包含任何其它药学上可接受的载剂,包含不会产生超过施用的益处的明显不利的、过敏的或其它不良反应的载体(无论是用于研究、预防性治疗和/或治疗性治疗)。在雷明登药物科学(remington's pharmaceutical sciences)(第18版麦克印刷公司(mack printing company),1990)中公开了示范性的药学上可接受的载剂和调配物。此外,可以将调配物制备成满足美国食品和药物管理局生物标
准办公室(united states fda office of biological standards)和/或其它相关外国监管机构要求的无菌性、热原性、总体安全性和纯度标准。
[0073]
示范性的通常使用的药学上可接受的载剂包含任何和所有膨胀剂或填充剂、溶剂或共溶剂、分散介质、包衣、表面活性剂、抗氧化剂(例如,抗坏血酸、蛋氨酸、维生素e)、防腐剂、等渗剂、吸收延迟剂、盐、稳定剂、缓冲剂、螯合剂(例如,edta)、凝胶、粘合剂、崩解剂和/或润滑剂。
[0074]
示范性缓冲剂包含柠檬酸盐缓冲剂、琥珀酸盐缓冲剂、酒石酸盐缓冲剂、富马酸盐缓冲剂、葡萄糖酸盐缓冲剂、草酸盐缓冲剂、乳酸盐缓冲剂、乙酸盐缓冲剂、磷酸盐缓冲剂、组氨酸缓冲剂和/或三甲胺盐。
[0075]
示范性防腐剂包含苯酚、苯甲醇、间甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、十八烷基二甲基苄基氯化铵、苯扎氯铵、六甲基氯化铵、对羟基苯甲酸烷基酯如对羟基苯甲酸甲酯或丙酯、邻苯二酚、间苯二酚、环己醇和3-戊醇。
[0076]
示范性等渗剂包含多元糖醇,包含三元或更高级糖醇,如甘油、赤藓糖醇、阿拉伯糖醇、木糖醇、山梨醇或甘露醇。
[0077]
示范性稳定剂包含有机糖、多元糖醇、聚乙二醇;含硫还原剂、氨基酸、低分子量多肽、蛋白质、免疫球蛋白、亲水聚合物或多糖。
[0078]
鼻内施用是基因疗法递送的一种非侵入性途径,所述途径具有如施用容易、起效快、避免首过代谢、胃酸和酶降解等优点(格拉辛-德莱尔(grassin-delyle)等人,药理学和治疗学(pharmacol ther.)134:366-379,2012)。慢病毒载体可以很容易地鼻内施用。gp64-fiv慢病毒载体已经通过反复鼻内施用成功递送,而转基因表达没有显著下降(波多尔斯卡(podolska)等人,临床和实验医学进展(adv clin exp med.)21:525-34,2012)。鼻内递送的方法包含鼻沉积或滴注、使用导管或支气管镜直接滴注到气管或下呼吸道中、或雾化和吸入(魏斯(weiss),分子疗法(molecular therapy)6:148-152,2002)。
[0079]
在一些实施例中,慢病毒载体通过鼻内沉积施用,所述鼻内沉积是一种其中沉积位点可以影响吸收途径和靶器官分布的过程。例如,鼻瓣以外的粘膜处的吸收更有可能通过提供直接通向大脑的途径的颈动脉进行(朱佩斯兰(djupesland),药物递送与转化研究(drug deliv transl res)3:42-62,2013)。
[0080]
在其它实施例中,慢病毒载体通过例如使用导管或支气管镜直接滴注到气管或下呼吸道中来递送。可以通过支气管镜施用进行直接载体滴注,使得肺部的部分中产生不均匀沉积,并且使用通过支气管镜引导的喷雾装置可以改善载体分布和沉积(魏斯,分子疗法6:148-152,2002)。
[0081]
在一些实施例中,慢病毒载体通过雾化和吸入递送,所述雾化和吸入递送是一种可以在肺中产生扩散转基因分布的临床上方便的方法。在雾化和吸入期间,可以使用不同的雾化设备和方法来产生均匀大小的气溶胶微滴颗粒,所述微滴颗粒沉积在细支气管和远侧气道中(魏斯,分子疗法6:148-152,2002)。
[0082]
在一些实施例中,慢病毒载体作为气溶胶喷雾从含有合适的推进剂(如二氧化碳)的压力容器或分配器或喷雾器(例如,us 2005/0251872)递送,或通过包含蒸气吸入器、rhinyle导管、多剂量滴管、单位剂量移液管、挤压瓶、多剂量定量喷雾泵、单/双剂量喷雾泵、慢喷hfa pmdi、脉动膜喷雾器、粉末喷雾装置以及鼻吸入器和吹入器的其它方法递送
(朱佩斯兰(djupesland),药物递送与转化研究,3:42-62,2013)。
[0083]
携带转基因的慢病毒载体也可以通过静脉递送来治疗人类疾病。参见,例如us2000/70190030、us 2005/0251872、ca 2,296,319、us 2007/0190030;卡波纳罗(carbonaro)等人,分子疗法(mol ther.)13:1110-1120,2006。静脉(iv)施用是指使用针或管将化合物直接施用于患者或动物静脉中的过程。在需要快速起效的情况下或当由于化合物的特性或患者因素其它递送途径不可用时,使用静脉施用(金(jin)等人,患者偏好依从性(patient prefer adherence).9:923-942,2015)。因此,在注射后,可以将化合物或组合物绕过吸收屏障迅速递送到器官,但有可能引起毒性作用(马迪森(maddison)等人,小型动物临床药理学(small animal clinical pharmacology),第二版,第2章,27-40,2008)。
[0084]
静脉施用提供了几个优点,包含药物可获得性的最小延迟、以所需水平实现恒定血浆浓度的可能性、通过停止输注避免意外副作用、当化合物被胃肠道吸收不良时的替代性途径、以及当其它施用途径疼痛时避免疼痛(克拉森(claassen),药理学和神经科学研究中的忽略因素(neglected factors in pharmacology and neuroscience research),第2章,第5-22页;休斯顿(huston)编辑,1994)。
[0085]
大多数静脉注射是在通常用于采集血液的浅静脉中的一条浅静脉中进行的,但是静脉注射的静脉选择取决于几个因素(本领域技术人员熟知),包含静脉穿刺的容易程度、年龄、是否需要麻醉或慢性导管插入术以及注射的组合物的类型。在一些实施例中,将含有慢病毒载体的组合物注射到颈静脉、尾静脉、股静脉、侧缘静脉、跖背静脉、隐静脉、舌静脉或阴茎背静脉中。
[0086]
在一些实施例中,用于递送慢病毒载体的技术可以包含使用无菌注射器和针的清洁技术、用于慢性导管插入术的严格无菌技术以及当需要多次注射时在外周静脉中的远侧穿刺。在一些实施例中,化合物或组合物可以通过使用注射器快速注射到静脉中来递送、使用iv辅助管线在特定时间量内间歇施用或者在主iv溶液中连续混合。
[0087]
在其它实施例中,使用各种不同类型的导管之一递送慢病毒载体,所述导管包含外周iv(piv)、通过经皮静脉穿刺插入外周静脉用于短期iv治疗的静脉导管、或插入中央循环系统中的大静脉的中央静脉导管(cvc)。在一些实施例中,用于递送慢病毒载体的导管插入方法包含iv输注、泵输注、滴注、隧道导管、植入端口和外周插入的中心导管。
[0088]
适于可注射使用的药物组合物通常包含无菌水溶液或分散液和/或用于临时制备无菌可注射溶液或分散液的无菌粉末。在一些实施例中,用于静脉施用慢病毒载体的合适的载剂包含生理盐水、抑菌水、eltm(新泽西州帕西波尼的巴斯夫公司(basf,parsippany,nj))或磷酸盐缓冲盐水(pbs)。
[0089]
在所有情况下,组合物应该是无菌的,并且应具有达到易于注射的程度的流动性。在各个实施例中,药物调配物在制造和储存条件下是稳定的,并且抵抗微生物(如细菌和真菌)的污染作用而保存。通常,相关载剂可以是含有例如水、乙醇、多元醇(包含甘油、丙二醇和液体聚乙二醇)以及其适合的混合物的溶剂或分散介质。适当的流动性可以通过使用包衣(如卵磷脂)、保持所需的粒度(在分散液的情况下)和使用表面活性剂来保持。通过各种抗细菌剂和抗真菌剂,包含对羟基苯甲酸酯、三氯叔丁醇、苯酚、抗坏血酸,可以实现防止微生物的作用。在一些实施例中,可以向组合物中添加等渗剂,包含糖和多元醇(例如甘露醇、山梨醇和氯化钠)。通过在组合物中包含延迟吸收的药剂,如单硬脂酸铝和明胶,可以实现
可注射组合物的延长吸收(us 2005/0251872)。
[0090]
无菌可注射溶液可以通过将所需量的活性化合物(如慢病毒载体或另一种表达载体)根据需要与以上列举的成分中的一种成分或其组合一起结合到适当溶剂中、随后过滤灭菌来制备。通常,分散液通过将活性化合物结合到含有基础分散介质以及来自以上列举的那些成分的所需其它成分的无菌媒剂中来制备。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,这种方法从其先前的无菌过滤溶液中产生活性成分加上任何另外的期望成分的粉末(us 2005/0251872)。
[0091]
除非另有说明,否则本公开的实践可以采用免疫学、分子生物学、微生物学、细胞生物学和重组dna的常规技术。这些方法在以下出版物中有所描述。参见例如萨姆布鲁克(sambrook)等人,分子克隆:实验手册(molecular cloning:a laboratory manual),第2版(1989);f.m.奥苏贝尔(f.m.ausubel)等人编辑,当代分子生物学实验指南(current protocols in molecular biology)(1987);丛书酶学方法(methods in enzymology)(学术出版社公司(academic press,inc.));m.麦克弗森(m.macpherson)等人,pcr:实用方法(pcr:a practical approach),牛津大学出版社的irl出版社(1991);麦克弗森(macpherson)等人编辑,pcr 2:实用方法(pcr 2:practical approach)(1995);哈洛(harlow)和莱恩(lane)编辑,抗体实验室手册(antibodies,a laboratory manual)(1988);以及r.i.弗雷谢尼(r.i.freshney)编辑,动物细胞培养(animal cell culture)(1987)。
[0092]
可以使用由公共数据库提供的序列信息来鉴定靶标的基因序列和编码本文公开的表型改变蛋白的核酸序列。本文提供了示范性序列。
[0093]
本文公开和引用的序列的变体也包含在内。蛋白质的变体可以包含具有一或多个保守氨基酸取代的变体。如本文所用,“保守取代”涉及在下列保守取代组中一者中发现的取代:第1组:丙氨酸(ala)、甘氨酸(gly)、丝氨酸(ser)、苏氨酸(thr);第2组:天冬氨酸(asp)、谷氨酸(glu);第3组:天冬酰胺(asn),谷氨酰胺(gln);第4组:精氨酸(arg)、赖氨酸(lys)、组氨酸(his);第5组:异亮氨酸(ile)、亮氨酸(leu)、蛋氨酸(met)、缬氨酸(val);第6组:苯丙氨酸(phe)、酪氨酸(tyr)、色氨酸(trp)。
[0094]
另外,氨基酸可以通过相似的功能或化学结构或组成(例如,酸性、碱性、脂肪族、芳香族、含硫)分组为保守取代组。例如,出于取代的目的,脂肪族分组可以包含gly、ala、val、leu和ile。其它被认为是彼此的保守取代的含有氨基酸的组包含:含硫:met和半胱氨酸(cys);酸性:asp、glu、asn和gln;小的脂肪族、非极性或微极性残基:ala、ser、thr、pro和gly;极性带负电荷的残基及其酰胺:asp、asn、glu和gln;极性带正电荷的残基:his、arg和lys;大的脂肪族、非极性残基:met、leu、ile、val和cys;以及大的芳香族残基:phe、tyr和trp。另外的信息见克雷顿(creighton)(1984),蛋白质(proteins),w.h.弗里曼公司(w.h.freeman and company)。
[0095]
基因序列的变体可以包含密码子优化变体、序列多态性、剪接变体和/或不会在统计学上显著的程度上影响编码产物功能的突变。
[0096]
本文公开的蛋白质、核酸和基因序列的变体也包含与本文公开的蛋白质、核酸或基因序列具有至少70%的序列一致性、80%的序列一致性、85%的序列一致性、90%的序列一致性、95%的序列一致性、96%的序列一致性、97%的序列一致性、98%的序列一致性或
99%的序列一致性的序列。
[0097]“%序列一致性”是指如通过对序列进行比较而确定的两个或两个以上序列之间的关系。在本领域中,“一致性”也指如通过这些序列串之间的匹配度而确定的蛋白质、核酸或基因序列之间的序列相关度。“一致性”(通常称为“相似性”)可以通过已知的方法很容易地计算出来,所述方法包含(但不限于)在以下文献中描述的方法:计算分子生物学(computational molecular biology)(莱斯克,a.m.(lesk,a.m.)编辑)纽约州的牛津大学出版社(oxford university press,ny)(1988);生物计算:信息学和基因组计划(biocomputing:informatics and genome projects)(史密斯,d.w.(smith,d.w.)编辑),纽约州的学术出版社(1994);序列数据的计算机分析(computer analysis of sequence data),第i部分(格里芬,a.m.(griffin,a.m.)和格里芬,h.g.(griffin,h.g.)编辑)新泽西州的胡玛纳出版社(humana press,nj)(1994);分子生物学中的序列分析(sequence analysis in molecular biology),(冯
·
海涅,g.(von heijne,g.)编辑),学术出版社,(1987);以及序列分析引物(sequence analysis primer)(哥博斯科夫,m.(gribskov,m.)和德弗罗,j.(devereux,j.)编辑)纽约州的牛津大学出版社(1992)。用于确定一致性的优选方法被设计成给出所测试序列之间的最大匹配。用于确定一致性和相似性的方法已编入公共可获得的计算机程序中。序列比对和一致性百分比计算可以使用lasergene生物信息学计算套件(威斯康星州麦迪逊的dnastar公司(dnastar,inc.,madison,wisconsin))的magign程序进行。序列的多重比对也可以以默认参数(空位罚分(gap penalty)=10,空位长度罚分(gap length penalty)=10)使用clustal比对方法(希金斯(higgins)和夏普(sharp)cabios,5,151-153(1989))进行。相关程序还包含gcg程序套件(wisconsin软件包9.0版,威斯康辛州麦迪森的genetics computer集团(gcg)(genetics computer group(gcg),madison,wisconsin));blastp、blastn、blastx(阿尔舒尔(altschul)等人,分子生物学杂志(j.mol.biol.)215:403-410(1990));dnastar(威斯康星州麦迪逊的dnastar公司);以及并入史密斯-沃特曼算法(smith-waterman algorithm)的fasta程序(皮尔森(pearson),基因组研究中的计算方法(comput.methods genome res.),[国际研讨会论文集(proc.int.symp.)](1994),会议日期1992,111-20.编辑:舒豪伊(suhai)和桑德尔(sandor).出版商:纽约州纽约市的普莱南(plenum,new york,ny)。在本公开的上下文中,应当理解,当使用序列分析软件进行分析时,分析的结果基于所参考程序的“默认值”。如本文所使用的,“默认值”将表示在首次初始化时最初与软件一起加载的任何一组值或参数。
[0098]
示范性实施例
[0099]
第一个实施例提供了一种治疗需要血浆因子viii的受试者的方法,所述方法涉及向所述受试者施用治疗有效量的炎症抑制剂;向所述受试者施用治疗有效量的cd8+ t细胞耗竭剂;以及通过骨内(io)输注向所述受试者施用治疗有效量的组合物,所述组合物包含慢病毒载体(lv),所述慢病毒载体包含与巨核细胞特异性启动子以可表达的方式连接的经优化fviii表达盒。特别设想的是,炎症抑制剂和/或cd8+ t细胞耗竭剂的施用可以在io输注施用之前、之后或同时进行,并且可以在相同或不同的时间进行。
[0100]
值得注意的是,此类治疗方法的实例不涉及对所述受试者进行预先调理或清髓治疗。
[0101]
在此类方法的实例中,炎症抑制剂是地塞米松(dex)。作为非限制性实例,炎症抑
制剂(如地塞米松)以100mg/kg的剂量在lv io输注前24小时、4小时、io输注后4小时和24小时施用。
[0102]
在所提供方法的实例中,cd8+ t细胞耗竭剂包含抗cd8抗体,如抗cd8αmab。例如,在一些情况下,抗cd8αmab以4mg/kg的剂量在lv io输注前1天、io输注后4天和io输注后11天施用。
[0103]
在所提供的方法中的任何方法中,巨核细胞特异性启动子可以是gp1b-α启动子。
[0104]
通常,在所提供的治疗方法中,io输注是在受控的、相对较慢的速率下进行的,以便通过所提供的lv促进骨髓中细胞的有效转导。在具体的示例方法中,io输注以2μl/min到15μl/min、或5μl/min到12μl/min、或不超过10μl/min的速率进行。在另外的实例中,例如当对相对较大(超过2千克)的受试者进行治疗时,io输注以0.01ml/min到0.5ml/min、0.05ml/min到0.3ml/min、0.1ml/min到0.25ml/min或不超过0.4ml/min的速率进行。最佳地,在一些实施例中,io输注在不超过45分钟的时段内进行。
[0105]
有益地,使用本文提供的方法从骨内递送的lv表达的转基因fviii在血小板中以治疗相关(即,相对高)水平表达,并且在表达血小板的凝结级联触发时在被治疗的受试者体内中起作用。举例来说,经优化fviii表达盒包含hfviii变体hf8x10 k12(seq id no:1)或hfviii变体hf8/n6k12rh(seq id no:2)。尽管决不是限制性的,但在此类方法中使用的慢病毒载体可以包含seq id no:3或seq id no:4(分别)或其能够在受试者血小板中表达变异因子viii的功能变体。
[0106]
在提供的实施例中的任何实施例中,治疗需要血浆因子viii的受试者的方法可以是用于治疗受试者体内止血相关病症的方法,特别地,其中受试者需要此类治疗。举例来说,接受本文所述方法治疗的受试者包含患有a型血友病(hema)、b型血友病(hemb)、血管性血友病、与创伤或损伤相关的出血、血栓形成、血小板减少症、中风、凝血病、弥散性血管凝固(dic)或过度抗凝治疗病症的受试者。
[0107]
本文特别涵盖了受试者是具有预先存在的抗fviii抑制性抗体的hema受试者时的治疗方法。由申请人的方法提供的血小板限制的hfviii表达对此类受试者特别有益,因为表达的fviii变体未被暴露并在血液中循环,因此不会引起来自循环中的抗fviii抑制性抗体的免疫应答。
[0108]
将下面的示范性实施例和实例包含在内以说明本公开的特定实施例。根据本公开,本领域普通技术人员将理解,在不脱离本公开的精神和范围的情况下,可以对本文公开的具体实施例进行许多改变并且仍然获得相似或类似的结果。
[0109]
示范性实施例。
[0110]
1.一种治疗需要血浆因子viii的受试者的方法,所述方法包含:向所述受试者施用治疗有效量的炎症抑制剂;向所述受试者施用治疗有效量的cd8+ t细胞耗竭剂;以及向所述受试者施用治疗有效量的组合物,所述组合物包含慢病毒载体,所述慢病毒载体包含与巨核细胞特异性启动子以可表达的方式连接的经优化fviii表达盒,其中施用通过以下方式进行:骨内(io)输注;静脉(iv)递送;或鼻内(in)或吸入递送。
[0111]
2.根据实施例1所述的方法,其中所述炎症抑制剂包含地塞米松(dex)。
[0112]
3.根据实施例2所述的方法,其中所述地塞米松在施用lv前24小时、施用前4小时、施用后4小时和施用后24小时以100mg/kg的剂量施用。
[0113]
4.根据实施例1所述的方法,其中所述cd8+ t细胞耗竭剂包含抗cd8抗体。
[0114]
5.根据实施例4所述的方法,其中所述cd8+ t细胞耗竭剂是抗cd8αmab,所述抗cd8αmab在lv递送前1天、递送后4天和递送后11天以4mg/kg的剂量施用。
[0115]
6.根据实施例1所述的方法,其中所述巨核细胞特异性启动子是gp1b-α启动子。
[0116]
7.根据实施例1所述的方法,所述方法不包含对所述受试者进行预先调理或清髓治疗。
[0117]
8.根据实施例1所述的方法,其中所述io输注以2μl/min到15μl/min、5μl/min到12μl/min或不超过10μl/min的速率进行。
[0118]
9.根据实施例1所述的方法,其中所述io输注以0.01ml/min到0.5ml/min、0.05ml/min到0.3ml/min、0.1ml/min到0.25ml/min或不超过0.4ml/min的速率进行。
[0119]
10.根据实施例1所述的方法,其中所述io输注在不超过45分钟的时段内进行。
[0120]
11.根据实施例1所述的方法,其中所述经优化fviii表达盒包含hf8x10 k12(seq id no:1)或hf8/n6k12rh(seq id no:2)。
[0121]
12.根据实施例1所述的方法,其中所述慢病毒载体包含seq id no:3或seq id no:4或其功能变体。
[0122]
13.根据前述实施例中任一实施例所述的方法,所述方法是用于治疗所述受试者的止血相关病症的方法,并且所述受试者需要这种治疗。
[0123]
14.根据前述实施例中任一实施例所述的方法,其中所述受试者患有a型血友病(hema)、血管性血友病、与创伤或损伤相关的出血、血栓形成、血小板减少症、中风、凝血病、弥散性血管凝固(dic)或过度抗凝治疗病症。
[0124]
15.根据前述实施例中任一实施例所述的方法,其中所述受试者是具有预先存在的抗fviii抑制性抗体的hema受试者。
[0125]
16.一种治疗需要血浆因子viii的受试者的方法,所述方法基本上如本文所述。
[0126]
实例1.提高a型血友病的体内血小板靶向基因疗法的治疗功效
[0127]
先前描述的基于体内造血干细胞(hsc)的血小板靶向基因治疗方案部分校正了a型血友病(hema)小鼠的出血表型,持续超过五个月。在所述方案中,由巨核细胞特异性启动子(gp1bα)驱动的携带因子iii(fviii)转基因(g-f8/n6-lv)的慢病毒载体(lv)通过骨内(io)输注递送以转导hsc。顺着巨核细胞谱系转导的hsc的成熟导致了血小板中产生异位fviii。然而,仍然需要一种有效且临床可行的方案来提高lv转导效率和增加血小板-fviii功能。
[0128]
为了增强lv转导,此实例描述了地塞米松和抗cd8α单克隆抗体的组合药物方案,随后对小鼠进行lv的io输注。在经m-gfp-lv处理的(m=mnd:普遍存在的启动子)c57bl/6小鼠中,在第7天观察到gfp+骨髓细胞数量增加了2倍,并且在第160天观察到高达14%的gfp+hsc。在经g-f8/n6-lv处理的hema小鼠中,在第84天观察到表型校正的显著改善。
[0129]
另外,为了改善血小板-fviii功能,将f8x10k12结合到lv中(与f8/n6相比,表达和生物活性增加)。用g-f8x10k12-lv对hema小鼠进行处理产生了较高水平的血小板-fviii,但诱导了高滴度的抗fviii抑制剂。此实例还示出了结合仅对lv具有增强的生物活性的f8/n6k12rh。在用组合药物进行处理和io输注g-f8k12rh-lv后,hema小鼠显示出显著的表型校正,而没有形成抗fviii抑制剂。此方案可以为血友病提供一种易于转化的治疗方法。
[0130]
因此,在这里,通过提高lv转导效率和增加血小板-fviii功能,开发了一种有效且临床可行的方案。为了增强lv转导,施用地塞米松和抗cd8α单克隆抗体的组合药物方案,随后进行lv的io输注。在经m-gfp-lv处理的(m=mnd:普遍存在的启动子)c57bl/6小鼠中。在第7天观察到gfp+骨髓细胞数量增加了2倍,并且在第160天观察到高达14%的gfp+hsc。在经g-f8/n6-lv处理的hema小鼠中,在第84天观察到表型校正的显著改善。为了改善血小板-fviii功能,将与f8/n6相比表达和生物活性增加的f8x10k12结合到lv中。用g-f8x10k12-lv对hema小鼠进行处理产生了较高水平的血小板-fviii,但诱导了高滴度的抗fviii抑制剂。进一步地,在用组合药物进行处理和io输注g-f8k12rh-lv(其生物活性增强)后,hema小鼠显示出显著的表型校正,而没有形成抗fviii抑制剂。此方案可以为血友病提供一种易于转化的治疗方法。
[0131]
介绍。
[0132]
针对人因子viii(fviii)的抑制性抗体形成是a型血友病(hema)患者治疗中的一个重要并发症。血小板中的fviii的异位表达可能是用于治疗hema的有效方法。与循环血浆fviii不同,储存在血小板的α颗粒中的fviii受到保护而不会被抗原呈递细胞处理,因此显著减少了诱导抗fviii免疫应答的机会。此外,血小板fviii不被预先存在的抗fviii抑制性抗体(抑制剂)中和,这将有利于已经产生抑制剂的hema患者。在出血期间,活化的血小板局部分泌可以直接参与凝固级联并促进凝块形成的fviii。最近已经证明,低水平的血小板fviii可以部分校正动物模型中的血友病表型。
[0133]
一种用于引导血小板中的fviii长期表达的方法是骨内(io)输注携带由巨核细胞特异性启动子gp1bα(gp1bα-f8-lv)控制的fviii转基因的慢病毒载体(lv)(王(wang)等人,分子疗法(mol therapy)23:617-626,2015)。在hema的这种体内基因治疗方案中,造血干细胞(hsc)被lv原位有效转导,然后在巨核细胞分化的晚期进行fviii转基因表达,并且最后在血小板的α颗粒中储存fviii蛋白。以前的研究表明,单次io输注gp1bα-f8-lv产生超过3%的含有hfviii的血小板,从而导致在有或没有预先存在的抑制剂的情况下校正免疫活性hema小鼠中的部分表型。
[0134]
此外,体内递送lv可以避免体外基因疗法遇到的许多困难和潜在毒性,包含细胞转移后干细胞性质和移植潜力的丧失、体外细胞因子刺激的负面影响和受试者的预先调理。然而,体内基因治疗方案的一个潜在限制是诱导lv特异性免疫应答,这可能降低lv转导效率并消除lv转导的细胞。研究表明,地塞米松(dex)可以抑制在将lv静脉递送到免疫活性小鼠中之后的炎性应答,并且提高lv转导效率。研究还表明,雷帕霉素(rapa)可以提高体内和体外基因疗法的lv转导效率。
[0135]
用于血友病的有效体内基因疗法的经优化转基因将使得基因表达水平变高,并且转基因产物的生物活性增强。由于全长人fviii cdna的大小相当大(>7kbp),所以它不能容易地被包装在病毒载体中,从而经常导致病毒的滴度较低。因此,在基因疗法临床前研究中使用编码fviii变体的较短的cdna。重要的是,b结构域缺失的fviii(bdd-fviii)变体表现出与全长fviii相似的功能活性(皮特曼(pittman)等人,血液81:2925-2935,1993)。也将另外的突变结合到编码bdd-fviii的基因中以增加其分泌,如具有226aa的b结构域变体序列的f8/n6(苗等人,血液103:3412-3419,2004)、密码子优化的bdd-fviii和f8/n6(沃德等人,血液117:798-807,2011)、具有取代f8/n6中的226aa/n6的17-aa肽编码序列的f8-v3(麦金
托什等人,血液121:3335-3344,2013)以及编码具有r1645h的bdd-fviii变体的f8-rh(赛纳等人,血液121:4396-4403,2013)。与bdd-fviii相比,一些fviii变体(如fviii-rh和弗林蛋白酶切割位点缺失的bdd-fviii变体(阮等人,血栓形成与止血杂志15:110-121,2017))表现出生物活性增加,这可能是由于凝血酶活化时a2结构域的解离较慢。
[0136]
在此实例中,使用靶向血小板中fviii表达的lv的io输注来提高hema基因疗法的治疗功效。用dex预处理免疫活性小鼠以抑制炎性应答,并且用抗cd8α单克隆抗体(mab)预处理以通过cd8
+ t细胞的瞬时耗竭来抑制细胞毒性。采用dex和抗cd8 mab组合处理的药理干预提高了小鼠中的lv转导效率和长期转基因表达水平。此外,还在免疫活性hema小鼠中测试了两种具有更高表达和增强的生物活性的新型人fviii(hfviii)变体。结果表明,组合药物处理加io输注含有生物学活性增强的fviii变体基因的lv显著改善了血友病表型校正。
[0137]
材料和方法。
[0138]
动物:根据美国国家卫生研究院(national institutes of health)的动物护理指南和西雅图儿童研究机构(scri)的指南,将所有的小鼠保存在scri特定的无病原体环境中。所述方案得到了scri机构动物护理和使用委员会的批准。具有c57bl/6(bl/6)遗传背景的hema小鼠(因子viii外显子16敲除)通过将混合背景hema小鼠(sv129/bl6)与bl/6小鼠杂交八代而产生(苗等人,血液114:4034-4044,2009)。bl/6小鼠购自杰克逊实验室(jackson laboratory)。本研究中仅使用了雄性hema小鼠。
[0139]
人因子viii cdna变体:将三种人因子viii cdna变体结合到lv中,包含人因子viii的b结构域变体(hf8/n6)(派普(pipe),血友病(haemophilia)15:1187-1195,2009)、hf8x10k12(完整的慢病毒构建体:seq id no:3)以及hf8/n6k12rh(完整的慢病毒构建体:seq id no:4)。将hf8x10k12和hf8/n6k12rh插入片段的序列分别提供在seq id no:1和2中。人f8 cdna变体:将三种人f8 cdna变体结合到lv中,包含hfviii(hf8/n6)22、hf8x10k1223,24和hf8/n6k12rh19,24的b结构域变体(图1a)。
[0140]
骨内输注慢病毒载体:如先前的研究一样(王等人,分子疗法23:617-626,2015;王等人,血液124:913-923,2014;所述两个文献均通过引用并入本文),通过io输注将慢病毒载体递送到小鼠体内。下面提供了关于慢病毒载体的构建和产生以及慢病毒载体的io输注的详细信息。
[0141]
免疫抑制治疗:分别使用dex(mwivet)和抗cd8αmab(bioxcell;克隆yts169.4)来暂时耗竭先天免疫应答和细胞毒性。在第0天将lv输注到小鼠体内。通过腹膜内注射给予经单一药物预处理的小鼠dex(100mg/kg,-24小时、-4小时、4小时和24小时)或抗cd8αmab(4mg/kg,第-1天、第4天和第11天)。向经组合药物预处理的小鼠施用dex(100mg/kg,-24小时、-4小时、4小时和24小时)和抗cd8αmab(4mg/kg,第-1天、第4天、第11天、第16天和第21天)。
[0142]
转基因gfp/hfviii表达的表征:对于经m-gfp-lv处理的小鼠,通过流式细胞术检测了经m-gfp-lv3(携带由经过修饰的骨髓增生性肉瘤病毒(mnd)启动子(阿斯特拉罕(astrakhan)等人,血液119:4395-4407,2012;沙利塔(challita)等人,病毒学杂志(j.virol)69:748-755,1995);图7b驱动的gfp基因的lv)处理的bl6小鼠的骨髓细胞中的gfp表达和f8-lv转导的293t细胞中的hfviii表达。流式细胞分析使用facs lsrii(bd生物
科学公司(bd biosciences))进行,并且数据使用flowjo软件(8.8.1版;tree star)进行分析。如先前所描述的(王等,分子疗法23:617-626,2015),通过elisa测定了经f8-lv处理的hema小鼠的血小板中的hfviii表达。下面提供了分离骨髓细胞、白细胞和血小板的详细过程以及关于本研究中使用的抗体的详细信息。
[0143]
用于测量hfviii活性和抗hfviii抗体的测定:从实验小鼠的外周血中分离血浆样品,所述外周血通过眶后出血获得。使用改良的活化部分凝血活酶时间测定法(aptt)分析hfviii活性,并且如先前所描述的(苗等人,血液114:4034-4044,2009;卡斯帕(kasper)和阿伦森(aronson),thromb diath haemorp 34:612,1975)通过hfviii bethesda抑制剂测定法测量抗hfviii抗体。
[0144]
用于表征hema小鼠中的表型校正的测定:如先前所描述的(王等人,分子疗法23:617-626,2015),使用改良的尾夹测定评估了经g-f8-lv处理的hema小鼠的出血表型校正。通过使用tga试剂盒(奥地利的technoclone gmbh)的凝血酶生成测定(tga)和旋转血栓弹力图测定,评估了经lv处理的hema小鼠中的血小板储存的hfviii的功能。在氯化铁(fecl3)诱导的血栓形成模型中,测量了局部损伤后经g-f8-lv处理的hema小鼠的右颈动脉的血流速率。下面描述了tga、rotem和fecl3损伤模型的详细程序。
[0145]
统计分析:数据以平均值
±
平均值的标准误差(sem)表示。平均值之间差异的统计显著性是使用假设不相等方差的双样品t测试(two-sample assuming unequal variances t test)来确定的。差异在p小于0.05时被认为是显著的。
[0146]
抗体:小鼠造血谱系流动混合物(lineage)450、别藻蓝蛋白(apc)抗小鼠cd117(c-kit)和藻红蛋白-cy7(pe-cy7)抗小鼠ly-6a/e(sca-1)购自e生物科学公司(ebioscience)。多克隆绵羊抗人因子viii(saf8c)来自affinity生物制品公司(affinity biologicals inc)。兔抗羊igg抗体辣根过氧化物酶(hrp)来自伯乐实验室(bio-rad laboratories)。小鼠抗人因子viii单克隆抗体esh-8和gma-012分别获自美国diagnostica公司(american diagnostica inc.)和green mountain抗体公司(green mountain antibodies)。山羊抗小鼠ig fitc来自bd生物科学pharmingen(bd biosciences pharmingen)。
[0147]
慢病毒载体构建、产生和滴定:prrl
·
sin
·
gp1bα
·
hf8/n6
·
wpre(pgp1bα-f8/n6)和prrl
·
sin
·
ef1α
·
hf8/n6
·
wpre(pef1α-f8/n6)两者都是在以前的研究中克隆的(王等,分子疗法23:617-626,2015)。然后由hf8x10k12和hf8/n6k12rh替代pgp1bα-f8/n6和pef1α-f8/n6中的hf8/n6,以分别创建prrl
·
sin
·
gp1bα
·
hf8x10k12
·
wpre(pgp1bα-f8x10k12)和prrl
·
sin
·
gp1bα
·
hf8x/n6k12rh
·
wpre(pgp1bα-f8/n6k12rh),以及prrl
·
sin
·
ef1α
·
hf8x10k12
·
wpre(pef1α-f8x10k12)和prrl
·
sin
·
ef1α
·
hf8x/n6k12rh
·
wpre(pef1α-f8/n6k12rh)。prrl
·
sin
·
mnd
·
egfp
·
wpre获自scri的病毒核心。用于克隆和分离质粒的所有试剂均购自凯杰公司(qiagen)。lv(g-f8/n6-lv、g-f8x10k12-lv、g-f8/n6k12rh-lv、e-f8/n6-lv、e-f8x10k12-lv和m-gfp-lv)是通过使用聚乙烯亚胺(pei)和三个质粒(包含一个转基因lv构建体、pmd2.g和pax2g)瞬时转染人胚胎肾(hek)293t细胞而产生的。病毒滴度(ifu/ml)是如先前研究中所述(王等人,分子疗法23:617-626,2015;奥提(auti)等人,欧洲分子生物学会
·
分子医学(embo mol med.)9:737-740,2017)通过实时定
量pcr(qpcr)测定的。
[0148]
hek 293t细胞转导:将hek 293t细胞维持在具有10%胎牛血清(fbs,atlantic生物制剂公司(atlantic biologicals))、2mm l-谷氨酰胺(corning cellgro)、10mm hepes(corning cellgro)和100iu/ml青霉素/100μg/ml链霉素(corning cellgro)的dmem(corning cellgro)中。将5
×
104个细胞在200μl培养基中培养并且以4μg/ml的聚芳烃用e-f8/n6-lv(moi=100)和e-f8x10k12-lv(moi=100)转导过夜。24小时后,添加200μl培养基。将细胞再培养96小时并收集以通过流式细胞仪(lsrii,bd生物科学公司)检测fviii表达。
[0149]
骨内输注慢病毒载体:详细的骨内(io)输注程序在之前的研究中描述(王等人,细胞疗法23:617-626,2015)。简而言之,用2.5%异氟醚麻醉小鼠,刮去右膝周围的毛发,并且消毒并切除皮肤以暴露肌肉层。在将用胰岛素注射器固定的无菌27号针扭转并小心地通过关节插入右胫骨后,通过与微升注射器(汉密尔顿(hamilton))连接的新型无菌27号针以10μl/min的速度将20μl lv输注到胫骨中。通过泵精确地控制输注速度和体积(ne-1010,新时代泵系统公司(new era pump systems))。输注后缝合切口。
[0150]
分离骨髓细胞、白细胞和血小板的详细方法:通过用5ml rpmi 1640冲洗小鼠的股骨和胫骨来收集骨髓细胞。用氯化铵-钾(ack)裂解缓冲液(0.15m nh4cl,10mm khco3,1mm edta,ph 8.1)裂解红细胞后,通过孔大小为0.45μm的过滤器(飞世尔科技公司(fisher scientific))过滤培养基后获得其它细胞。将白细胞和血小板从肝素化血液中分离,所述肝素化血液是通过眶后出血收集的。用ack缓冲液裂解红细胞后收集白细胞。对于血小板,向140μl肝素化血液添加200μl rpmi 1640,并将混合物小心转移到300μl fico/lite
tm-血小板(亚特兰大生物制品公司(atlanta biologicals))的顶部,并以100g旋转10分钟。然后小心地除去透明的上层溶液,并收集浑浊的中间层,以1,000rpm旋转5分钟。用facs缓冲液(pbs,5%牛血清白蛋白)洗涤小的白色血小板颗粒两次。
[0151]
实时qpcr:对基因组dna(gdna)进行实时qpcr,所述gdna是使用凯杰公司的dneasy血液和组织试剂盒从实验小鼠的分离出的白细胞和骨髓细胞中提取的。使用两个引物/探针组(一组用于整合的慢病毒载体序列,并且一组用于鼠基本代谢功能调节β-肌动蛋白序列)和taqman通用pcr主试剂盒(应用生物系统公司(applied biosystems))对gdna进行实时qpcr,并在第一步加实时pcr系统(step one plus real-time pcr system)(应用生物系统公司)上运行。通过阈值循环来确定鼠拷贝数,将所述鼠拷贝数与使用从单个慢病毒拷贝a20细胞克隆中分离的gdna产生的标准曲线进行比较。
[0152]
凝血酶生成测定的详细方法:首先,校准曲线测量方案和样品测量方案都是在wallac manger中创建的。然后将全血从经麻醉小鼠的下腔静脉(ivc)抽取到3.8%柠檬酸钠溶液中。富含血小板的血浆(prp)是通过在100
×
g下离心5分钟并小心移液顶层获得的。未经处理的hema小鼠的贫血小板血浆(ppp)是通过在1,500g下离心prp 10分钟而收集的。通过qnaono(izon科学公司(izon science))测量prp中的血小板浓度。将混合有10μl hema ppp的30μl prp样品添加到黑色nunc maxisorp(飞世尔公司(fisher))中。在添加50μl tga底物(sub)后,立即在victor 3仪器(珀金埃尔默公司(perkin-elmer))中读取所述板。在单独的校准测量中,将四种不同稀释度(1:2、1:4、1:20、1:200)的40μl凝血酶校准品与50μl tga sub组合,并在37℃下以30秒的间隔检测凝血酶生成10分钟。使用technoclone公司(technoclone)提供的评估软件获得滞后期时间、凝血酶峰值和曲线下面
积(auc)。
[0153]
血流速率测量:用2.5%异氟醚麻醉实验小鼠。用手术刀在右侧颈总动脉上直接切开,并用钝性剥离术暴露动脉的区段。将微型doppler血流探头(型号0.5vb,美国纽约州伊萨卡的transonic系统公司(transonic system inc.,ithaca,ny,usa))附接到颈动脉以监测血流。通过应用两片用20%三氯化铁(fecl3)溶液浸透的滤纸(1
×
2mm)产生血管损伤。将滤纸片放在颈动脉顶部,与血管外膜表面接触。在暴露2分钟后,取出滤纸并用无菌生理盐水洗涤血管。在应用fecl3后,连续监测颈动脉血流30分钟。分别使用野生型c57bl/6j小鼠和hema小鼠作为阳性和阴性对照。使用fecl3处理后30分钟内的平均血流速率评估对防止闭塞的保护程度。测量后处死小鼠。
[0154]
结果。
[0155]
对免疫活性小鼠和免疫缺陷小鼠在io递送m-gfp-lv后gfp表达的比较为了评估免疫应答是否影响转基因表达,将m-gfp-lv(1.1
×
108感染单位(ifu)/动物)骨内递送到免疫缺陷rag2-/-小鼠和免疫活性bl6小鼠体内。输注后7天,rag2-/-小鼠的总骨髓细胞和hsc中的gfp表达水平与bl6小鼠的总骨髓细胞和hsc中的gfp表达水平相似(图1)。随后,从第7天到第28天,rag2-/-小鼠体内gfp水平增加,但bl6小鼠体内gfp水平降低。长期来看,输注后84天,rag2-/-小鼠的总骨髓细胞和hsc中的gfp水平明显高于bl6小鼠的总骨髓细胞和hsc中的gfp水平(图1)。总的来说,在骨髓中m-gfp-lv转导后,rag2-/-小鼠体内gfp表达保持相对稳定的高水平,而在免疫活性bl6小鼠体内gfp表达水平随着时间的推移逐渐降低。这些结果表明,由lv(可能包含细胞毒性淋巴细胞(ctl))引起的免疫应答可能会随着时间的推移减少经过转导的细胞的数量。
[0156]
用于io递送m-gfp-lv后增强免疫活性小鼠中的gfp表达的药理学方法基于从经lv处理的免疫活性和免疫缺陷小鼠获得的结果,对旨在非特异性或特异性阻断这些免疫应答的药理学药剂是否会限制经转导细胞的清除、从而产生更持久和更高水平的持续转基因表达进行了探索。首先,将bl6小鼠在io输注m-gfp-lv(8.8
×
108ifu/动物,第0天)之前和之后用dex(100mg/kg,-24小时、-4小时、4小时和24小时)处理。lv输注后7天,经dex+lv处理的小鼠在总骨髓细胞和hsc中的gfp表达水平明显高于经仅lv处理的小鼠(图2b)在总骨髓细胞和hsc中的gfp表达水平,这表明dex可以有效抑制早期免疫应答并增强gfp表达。此外,通过经dex+lv和仅lv处理的小鼠的总骨髓细胞中lv拷贝数分别为0.90和0.80来表明lv转导成功。
[0157]
其次,通过ip注射抗cd8αmab来瞬时耗竭cd8
+
cd3
+ t细胞,以抑制细胞毒性功能(图8a)。在io输注m-gfp-lv(1.1
×
108ifu/动物)之前和之后,用抗cd8αmab(4mg/kg,第-1天、第4天和第11天)对小鼠进行处理。io输注后9天,经抗cd8αmab+lv处理的小鼠的总骨髓细胞和hsc中的gfp表达水平明显高于经仅lv处理的小鼠的总骨髓细胞和hsc中的gfp表达水平(图2c)。30和63天后,尽管gfp表达水平随时间推移降低,但经抗cd8αmab+lv处理的小鼠的水平高于经仅lv处理的小鼠的水平(图2c和图9)。在抗cd8αmab处理后4天(io输注后第3天),cd8α
+
cd3ε
+ t细胞在经处理小鼠的血液和骨髓中完全耗竭,然后逐渐恢复到正常水平(图8b)。因此,经抗cd8αmab+lv处理的小鼠中的gfp表达部分被cd8α
+
cd3ε
+ t的瞬时耗竭所挽救。
[0158]
为了增加lv转导和保存经转导细胞的存活率,在io输注m-gfp-lv(3.6
×
108ifu/动物)之前和之后施用了dex(100mg/kg,-24小时、-4小时、4小时和24小时)和抗cd8αmab
(4mg/kg,第-1天、第4天、第11天、第16天和21天)的短期组合药物处理。io输注后7天,经药物+lv处理的小鼠的总骨髓细胞中的gfp表达水平显著高于经仅lv处理的小鼠的总骨髓细胞中的gfp表达水平。然而,在这两组小鼠中,hsc中的gfp表达水平是相似的,这可能是因为hsc转导在相对高剂量的lv下达到饱和。从长期来看,经药物+lv处理的小鼠的总骨髓细胞和hsc中的gfp表达水平明显高于经仅lv处理的小鼠的总骨髓细胞和hsc中的gfp表达水平(图2d和图10)。此外,在第160天,在两组小鼠中均可检测到血细胞和总骨髓细胞中的慢病毒拷贝数,其中经药物+lv处理的小鼠中的慢病毒拷贝数略高于经lv处理的小鼠中的慢病毒拷贝数(图2e)。这些结果表明,组合药物的瞬时施用部分抑制了免疫应答,并且在io输注m-gfp-lv后的五个月内,实现了超过10%的gfp
+
hsc。
[0159]
用于通过io递送g-f8/n6-lv改善免疫活性hema小鼠中的表型校正的药理学方法。接下来,应用同样的药理学方法来提高hema小鼠中io输注g-f8/n6-lv的治疗效果。给予hema小鼠组合药物处理(dex+抗cd8αmab)加io输注g-f8/n6-lv(2.2
×
106ifu/动物)。在输注io后10周,用以下两种损伤小鼠模型评估了血友病表型校正:尾夹和fecl3诱导的血栓形成。在尾夹测定中,经仅lv或经药物+lv处理的小鼠的血液损失比hema对照小鼠的血液损失显著减少(图3a)。在fecl3诱导的颈动脉损伤模型中,经仅lv或经药物+lv处理的小鼠的平均血流速率明显慢于hema对照小鼠的平均血流速率(图3b),这证实了向hema小鼠io输注g-f8/n6-lv可以增强其血液凝结功能。此外,在尾夹测定中,经药物+lv处理的小鼠的血液损失明显少于经仅lv处理的小鼠的血液损失(图3a)。与此相一致的是,经药物+lv处理的小鼠的平均血流速率比经仅lv处理的小鼠的平均血流速率慢(图3b)。这些结果表明,利用dex和抗cd8αab的组合药物处理可显著提高hema小鼠中io输注g-f8/n6-lv的治疗效果。另外,在血液中既没有检测到血浆fviii活性,也没有检测到抗fviii抑制剂(图3c),这表明没有检测到fviii分泌到血液中。
[0160]
具有更高表达和更高功能活性的f8x10k12与药物处理组合改善了a型血友病的表型校正。为了提高hema小鼠的体内基因疗法的治疗效果,接下来结合了编码具有高表达和高功能活性的fviii变体的cdna。f8x10k12是一种b结构域缺失、a1结构域发生突变以增强分泌(x10)、c1和c2结构域发生突变以增加功能活性(k12)的新型人fviii cdna变体(图4a)。通过将质粒pef1α-f8x10k12流体动力注射到hema小鼠体内对其表达进行了测试。与pef1α-f8/n6相比,pef1α-f8x10k12在第4天在经处理小鼠血浆中产生了显著高水平的fviii(图4b)。还制备了e-f8x10k12-lv以转导293t细胞(moi=100)。在第4天,在e-f8x10k12-lv转导的293t细胞中检测到fviii基因表达百分比和mfi高于e-f8/n6-lv转导的细胞的fviii基因表达百分比和mfi(图4c),从而证实f8x10k12在lv转导后增强了fviii产量。
[0161]
接下来,产生了g-f8x10k12-lv(图5a)并通过组合药物处理将其递送到hema小鼠体内。在第90天,经g-f8x10k12-lv+药物处理和经仅g-f8x10k12-lv处理的小鼠的平均血小板-hfviii抗原水平显著高于经g-f8/n6-lv处理的小鼠的平均血小板-hfviii抗原水平(图5b),从而表明f8x10k12产生了更高的血小板-fviii水平。在经g-f8/n6-lv处理的小鼠和11个经g-f8x10k12-lv+药物处理的小鼠中的8个小鼠中没有检测到抗fviii抗体(图5c),而所有经仅g-f8x10k12-lv处理的小鼠(n=9)和11个经g-f8x10k12-lv+药物处理的小鼠中的3个小鼠产生了抗hfviii抗体(图5c)。从经g-f8x10k12-lv+药物或经仅g-f8x10k12-lv处理
的小鼠中的平均血小板-hfviii抗原水平相似的事实来判断,怀疑在经g-f8x10k12-lv处理的小鼠中产生的fviii的很大一部分由于f8x10k12蛋白的增强表达和分泌而分泌到血浆中,从而促进了抗fviii抗体的产生。这些结果还表明,组合药物处理可以抑制经g-f8x10k12-lv+药物处理小鼠的抗fviii体液免疫应答。在第120天,在所有经处理小鼠的血细胞中检测到病毒拷贝数(图5d),从而表明lv成功转导了原始hsc。
[0162]
通过尾夹测定评估了组合药物+lv对hema小鼠的长期治疗效果。在io输注lv后的第120天,与hema对照小鼠相比,所有三组用f8x10k12-lv+药物或仅用g-f8x10k12-lv或仅用g-f8/n6-lv处理的小鼠显示血液损失显著减少(图5e),从而表明所有三种载体的io输注均可以校正hema小鼠的出血表型。此外,检测到这三个组的血液损失存在微小的差异,其趋势为经g-f8x10k12-lv+药物处理小鼠<经仅g-f8x10k12-lv处理小鼠<经仅g-f8/n6-lv处理小鼠(图5e)。
[0163]
也使用从hema小鼠分离的prp通过凝血酶生成测定在体外对血小板-fviii的功能活性进行了评估。虽然血小板在凝结级联中凝血酶生成的爆发中起主要作用,但储存在血小板中的fviii将此过程增强以促进纤维蛋白凝块形成。与hema对照相比,野生型对照具有更短的滞后期时间、更高的峰高凝血酶和更高的总生成凝血酶(曲线下面积(auc))(图5f)。在io输注lv后的第200天,来自经处理小鼠的所有prp样品的平均滞后期时间短于hema对照的平均滞后期时间,这证实了血小板-fviii在凝块形成的早期阶段起重要作用。另外,来自经g-f8x10k12-lv+药物处理的小鼠的样品的平均峰高凝血酶和总生成凝血酶相对高于来自经仅g-f8/n6-lv处理的小鼠的样品的平均峰高凝血酶和总生成凝血酶,从而表明用免疫抑制药物和f8x10k12-lv处理的小鼠产生了更多用于促进凝块形成的凝血酶。
[0164]
功能活性较高的f8/n6k12rh与药物处理组合显著增强了a型血友病的表型校正尽管经g-f8x10k12-lv处理的hema小鼠体内相对较高的血小板-fviii水平增强了血液凝结,但由于fviii分泌到循环中,诱导了高滴度的抑制性抗体。因此,将f8/n6rhk12(图6a)克隆到lv中,以减少分泌并保持fviii蛋白的较高功能活性和稳定性。如先前节段所示,f8/n6是一种b结构域缺失的fviii变体,它可以在不诱导抑制性抗fviii抗体的情况下增强fviii基因表达(图3和图5)。f8/n6rhk12中的rh表示用于产生更稳定的fviii单链分子的r1645h突变(赛纳等人,血液121:4396-4403,2013),并且与k12突变一起可以相较于bdd-fviii显著增强fviii的生物活性。正如预期的那样,用pef1α-f8/n6rhk12的流体动力注射处理的小鼠产生了显著高于用pef1α-f8/n6处理的小鼠的血浆fviii活性(图6a)。
[0165]
产生了g-f8/n6k12rh-lv,并通过组合药物处理将其递送至hema小鼠。正如预期的那样,经仅g-f8/n6k12rh-lv处理的小鼠和经仅g-f8/n6-lv处理的小鼠的平均血小板-fviii抗原水平相似。然而,在第84天,经g-f8/n6k12rh-lv+药物处理的小鼠的血小板-fviii水平显著高于经仅g-f8/n6k12rh-lv和经仅g-f8/n6-lv处理的小鼠的血小板-fviii水平(图6c),这表明组合药物处理增强了较高血小板-fviii水平的产生和维持。在第84天,在经处理小鼠的血液中既没有检测到血浆fviii活性,也没有检测到抗fviii抑制剂(图6c)。接下来通过在fecl3诱导的颈动脉损伤小鼠模型中的血流速率变化对经处理小鼠的表型校正进行了评估。在五个小鼠组中对平均血流速率进行了比较:在第84天,未经处理的野生型小鼠≤经g-f8/n6k12rh-lv+药物处理的小鼠<经仅g-f8/n6k12rh-lv处理的小鼠<经仅g-f8/n6-lv处理的小鼠<未经处理的hema小鼠(图6d),并且几只经g-f8/n6k12rh-lv+药物
处理的小鼠表现出的血流速率与在野生型小鼠中观察到的血流速率相同。也用rotem测定法对这五组小鼠的血小板fviii的功能进行了评估。结果与血流速率数据一致。值得注意的是,通过血小板fviii可以很容易地校正最大凝块硬度(mcf),而校正凝结时间(ct)则更加困难。
[0166]
还通过在第84天测量颈动脉血流速率评估了经仅g-f8/n6-lv或经g-f8/n6k12rh-lv+药物处理的小鼠的hema表型校正(图6d)。接下来通过在fecl3诱导的颈动脉损伤小鼠模型中的血流速率变化对经处理小鼠的表型校正进行了评估。在五个小鼠组中对平均血流速率进行了比较:在第84天,未经处理的野生型小鼠≤经g-f8/n6k12rh-lv+药物处理的小鼠<经仅g-f8/n6k12rh-lv处理的小鼠<经仅g-f8/n6-lv处理的小鼠<未经处理的hema小鼠(图6d),并且几只经g-f8/n6k12rh-lv+药物处理的小鼠表现出的血流速率与在野生型小鼠中观察到的血流速率相同。也用rotem测定法对这五组小鼠的血小板fviii的功能进行了评估。结果与血流速率数据一致(表1)。值得注意的是,通过血小板fviii可以很容易地校正最大凝块硬度(mcf),而校正凝结时间(ct)则更加困难。
[0167]
表1
[0168] ct(秒)cft(秒)α(度)mcf(mm)g-f8/n6k12rh-lv+药物146
±
4*104
±
2170
±
4**66
±
4g-f8/n6k12rh-lv388
±
193165
±
12362
±
15*61
±
7g-f8/n6-lv564
±
367261
±
18243
±
1362
±
6野生型164
±
49*57
±
10*79
±
2**63
±
1hema956
±
185*2370
±
1150*4
±
6***26
±
19*
[0169]
在第140天收集全血样品,使用rotem测定法评估血小板fviii功能。每次测定进行1小时,以获得凝结时间(ct)、凝块形成时间(cft)、α角和最大凝块硬度(mcf)的值。基于与经g-f8/n6-lv处理的小鼠组的相关性,对统计显著性进行了分析。*<0.05,**<0.01,***<0.001。
[0170]
讨论。目前使用重组腺相关病毒(aav)载体(raav)进行a型血友病或b型血友病基因疗法的临床试验显示了非常有前景的结果。然而,慢病毒基因疗法在几个方面是具有优越性的。首先,在体内基因转移后,aav仍然作为附加型串联载体存在。随着时间的推移,转基因表达可能会减少,并且需要重复给药。重复给药是否可行或有效还有待证明。相比之下,慢病毒载体是结合到经过转导的细胞的基因组中的整合载体。如果成功整合到长寿命骨髓hsc中,lv介导的基因疗法的单一治疗可能足以获得终身治疗益处。另外,与转基因容量为4.5kb的aav相比,lv可以轻松容纳更大的基因,如fviii cdna。lv可以有效地转导分裂细胞和非分裂细胞,从而有效地转导原始hsc。此外,最近的体外hsc基因疗法的临床试验显示对于患有严重遗传疾病(包含x连锁严重组合免疫缺陷、威斯科特-奥尔德里奇综合征(wiskott-aldrich syndrome)、脊髓性肌萎缩和镰状细胞病)的患者的显著的治疗益处和安全性记录。最重要的是,在这些患者中没有观察到克隆显性遗传毒性或载体整合的显著克隆扩增。
[0171]
在目前的研究中,针对hema开发的基因治疗方案旨在通过巨核细胞特异性启动子的表达控制下通过io输注含有fviii cdna的lv来治疗hema患者,这导致血小板中的基因的表达。这种基因治疗方案与包含靶向hsc转导的体外基因治疗方案或靶向肝细胞中fviii表
达的体内基因治疗方案在内的现有方案相比具有几个优点。与体外基因疗法相比,io输注可以有效地原位转导hsc,从而避免了冗长而复杂的细胞操纵和移植程序。重要的是,本文描述的方法避免了使用成功的体外基因疗法所需的完全或部分清髓性调理方案的要求。
[0172]
与其它体内lv介导的基因治疗方法相比,io递送是独特的。向骨髓腔内缓慢注射(例如,以2μl/min到13μl/min或10μl/min的速率)lv可最大程度的降低或甚至避免由lv、aav和其它候选基因治疗载体的静脉递送引起的全身毒性。另外,与在fviii从肝细胞分泌到循环中后诱导高抗体形成风险的肝细胞靶向的lv基因转移相比,血小板靶向的fviii基因疗法产生储存在血小板中的fviii,并防止被抗原呈递细胞处理和被抗fviii抑制剂中和。在出血期间,活化的血小板在现场释放fviii,以有效地促进凝块形成。在具有或不具有预先存在的抗fviii抑制剂的hema小鼠中,出血表型得到部分校正。另外,hema基因疗法将因子viii表达靶向血小板并未增加血栓形成风险,但促进了hema小鼠的免疫耐受性。因此,所描述的靶向血小板中fviii表达的io lv递送策略对于治疗具有或不具有抑制剂的hema患者是非常有前景的。
[0173]
然而,体内lv基因疗法产生了可能会降低lv转导效率并消除lv转导的细胞的相关免疫应答。在给予mnd-gfp-lv的io输注的免疫活性小鼠中,gfp
+
hsc的百分比随时间推移而降低(图1b)。当在io递送lv之前和之后给予免疫活性小鼠dex时,gfp
+
bm细胞的平均百分比是对照组小鼠的gfp
+
bm细胞的平均百分比的3倍(图b),这与dex治疗可以有效抑制静脉输注lv后炎性细胞因子产生的这一发现结果一致(阿古多(agudo)等人,分子疗法20:2257-2267,2012)。与对照小鼠相比,免疫活性小鼠体内抗cd8αmab对cd8
+ t细胞的瞬时耗竭(图8a、8b)在lv输注后经过7周也产生了较高百分比的gfp+hsc(图2c)。更重要的是,在病毒输注后5个多月,在免疫活性小鼠中用dex和抗cd8αmab进行的组合药物治疗在骨髓中实现了高达14%的gfp
+
hsc(图2d)。此外,在给予io输注g-f8/n6-lv的hema小鼠中,组合药物治疗改善了特别通过血流速率测定所评估的血友病表型校正(图3b)。这些药剂组合协同增强lv转导。然而,在经组合药物治疗的小鼠中经一段长时期仍然观察到gfp
+
hsc逐渐减少,这表明其它免疫调节方案可以在lv的io递送后潜在地进一步增强转基因表达的持久性。
[0174]
a型血友病的成功基因疗法需要产生表达水平更高、生物活性增强和半衰期更长的fviii蛋白的经修饰fviii cdna。与人fviii相比,犬fviii更具有功能活性,并且猪fviii以更高的水平进行表达。因此,设计了新型重组fviii cdna,其在特定位点处具有用猪或犬对应的氨基酸替代的突变,以增加人viii序列的基本框架的分泌和功能。与f8/n6相比,由普遍存在的启动子引导的f8x10k12在水动力注射后在hema小鼠中产生了25倍的fviii活性增加(图4b),并且在lv转导的293t细胞中表达了更高水平的fviii(图4c)。与用通过血小板特异性启动子引导的g-f8/n6-lv的io递送治疗的小鼠相比,经g-f8x10k12-lv治疗的小鼠在血小板中产生更高的fviii表达水平(图5b)。然而,抗fviii抗体的诱导可能是由于进入循环的fviii分泌水平较高(图5e)。
[0175]
据报道,血小板中高水平的fviii表达可诱导血小板凋亡。因此,所描述的a型血友病的血小板靶向基因疗法进一步关注于增强生物活性而非表达水平。将具有由r1645h突变(赛纳等人,血液121:4396-4403,2013)和轻链中k12突变带来的更高活性的fviii变体f8/n6k12rh的cdna并入到lv构建体中。与f8/n6相比,由普遍存在的启动子引导的f8/n6k12rh在hema小鼠中产生了2.7倍的fviii活性增加(图6a)。重要的是,与经g-f8/n6-lv治疗的小
鼠相比,经g-f8/n6k12rh-lv加组合药物治疗的小鼠中的血友病表型校正显著改善,而没有产生抗fviii抑制剂(图6b和6c)
[0176]
血小板中的fviii异位表达为hema患者的基因疗法提供了有效的途径,特别是对于由于频繁静脉输注fviii而具有预先存在的抗fviii抑制剂的患者。储存在血小板中的fviii不仅可以防止被外周血中的抑制剂中和,并且即使有低至1%-5%的外周血血小板含有fviii,也可以显著改善出血表型。血小板-fviii的治疗效果通过几项fviii功能测定来表征,所述测定包含体外测定如显色测定(石(shi)等人,分子遗传学与新陈代谢(mol gen metabol.)79:25-33,2003;鲍姆加特纳(baumgartner)等人,血栓形成与止血杂志13:2210-2219,2015)和凝血酶生成测定(门罗(monroe)等人,动脉硬化、血栓形成和血管生物学(arterios thromb vas biol.)22:1381-1389,2002)和体内测定如尾夹测定(王等人,分子疗法23:617-626,2015;石等人,临床研究杂志(j clin invest)116:1974-1982,2006)和fecl3颈动脉血栓测定(亚罗沃伊(yarovoi)等人,血液105:4674-4676,2005;亚罗沃伊等人,血液102:4006-4013,2003)。分离含fviii的血小板用于体外测定。将分离的含fviii的血小板裂解,并且使用coatest fviii:c/4试剂盒通过显色测定检测释放的fviii功能活性。然而,由于即使在转基因小鼠中血小板-fviii水平也非常低(lv18
tg+/+
小鼠中最高的血小板-fviii水平为11mu/108个血小板,在鲍姆加特纳(baumgartner)等人,血栓形成与止血杂志13:2210-2219,2015中有所描述),因此显色测定的结果不能准确预测治疗效果。代替显色测定,使用凝血酶生成测定,其中将含fviii的血小板直接添加到hema prp中并将功能表示为三个参数(滞后期时间、峰高凝血酶和总生成凝血酶)。与hema对照相比,经lv治疗的小鼠具有更短的滞后期时间,从而表明含fviii的血小板通过加速凝血酶的生成在凝块形成的早期起到了重要作用。经治疗小鼠的尾夹测定显示,与hema对照小鼠相比,lv的io输注显著校正了出血表型。然而,此测定无法区分组合药物方案+lv治疗和仅lv治疗之间的治疗效果。因此,使用fecl3颈动脉血栓形成测定,在所述测定中在颈动脉局部损伤后监测血流速率。与改良的尾夹测定相比,fecl3诱导的颈动脉血栓形成似乎对监测血小板-fviii在增强动脉中局部血液凝块形成中的作用更敏感,并且能够区分两个治疗组的治疗差异。此测定的结果表明,血小板-fviii对动脉凝结有效,并且使用新型fviii变体f8/n6rhk12的组合药物方案在小鼠中实现了hema的表型校正。
[0177]
总之,通过将g-f8/n6k12rh-lv io输注到用地塞米松和抗cd8α单克隆抗体组合预处理的hema小鼠中,实现了血小板中持久的fviii基因表达。对lv和lv转导的细胞的免疫应答的瞬时抑制增加了lv转导效率,并产生了长期稳定的转基因表达。生物活性增强的f8/n6k12rh在表型校正测定中有效地提高了含fviii的血小板的治疗效果。使用凝血酶生成测定证实了从经lv处理的小鼠中分离出的血小板-fviii的功能。通过使用尾夹和颈动脉损伤模型的血液凝结测定证明了血友病的表型校正。这种方法可以为大型动物的血友病和临床试验中的血友病提供一种可易于转化的治疗方法。
[0178]
实例2.慢病毒的骨内递送充当血友病的体内基因疗法的治疗策略
[0179]
如上所述,通过以精确控制的速度骨内(io)输注递送的慢病毒载体(lv)可以有效地转导小鼠的骨髓造血干细胞(hsc)。将携带由血小板特异性gp1bα启动子驱动的人fviii/n6转基因的lv io输注到a型血友病(hema)小鼠体内产生了储存在血小板α颗粒中的fviii。这些血小板fviii部分校正了具有或不具有预先存在的抗fviii抑制剂的hema小鼠在五个
月内的出血表型。
[0180]
在当前的实例中,将lv的io递送应用于人源化nsg小鼠,以建立用于血友病体内基因疗法的转化研究模型。首先,对在人巨核细胞(meg)中是否可以获得高水平的转基因表达进行了检查。用cocal-mnd-gfp-lv(m-gfp-lv,moi=25)或cocal-gp1bα-gfp-lv(g-gfp-lv,moi=25)转导人cd34
+
细胞,然后用巨核细胞扩增补充剂(mes)培养。lv转导后14天,在m-gfp-lv转导的meg(cd41
+
细胞)和非meg(cd41-细胞)中都检测到高水平的gfp表达(36%)。此外,在g-gfp-lv转导的人细胞中,gfp在meg中特异性表达,但在其它类型的来源于hsc的细胞中不表达。
[0181]
接下来,在cocal-gp1bα-f8/n6-lv(g-f8/n6-lv)转导的人cd34
+
细胞中评估了人meg中的fviii特异性表达。当lv转导后第21天lv剂量从moi=10增加到50时,fviii在g-f8/n6-lv转导的人细胞中的表达水平从7%增加到28%。这些结果表明血小板特异性启动子gp1bα可以特异地引导人meg中高水平的转基因表达。
[0182]
还研究了io递送lv后人源化nsg小鼠中的转基因表达。人源化nsg小鼠是通过向6周龄雌性nsg小鼠i.v.输注1
×
106个人cd34
+
细胞而产生的。8周后,通过io输注将g-gfp-lv、g-f8/n6-lv和cocal-gp1bα-f8x10-lv(g-f8x10-lv)递送到人源化小鼠体内,并评估了转基因(gfp或人fviii)在人血小板中的表达。然而,在人细胞移植后,人源化小鼠血液中的人血小板迅速降低到不可检测的水平,这可能是由于小鼠巨噬细胞的识别和破坏而造成的。
[0183]
为了对人血小板中的转基因表达进行检查,对小鼠进行了一系列氯膦酸盐脂质体处理(clt)(0.7mg/动物,第0天、第2天、第7天、第13天),据报道所述处理会瞬时耗竭小鼠巨噬细胞。clt处理诱导了人血小板从不可检测的水平恢复到与所移植的人细胞在总pbmc中所占的百分比相当的水平。另外,在经clt+g-gfp-lv处理的小鼠的人血小板和鼠血小板中都检测到相似水平的gfp表达。最重要的是,经clt+g-f8/n6-lv或经g-f8x10-lv处理的小鼠的血小板fviii水平高于经f8/n6-lv或g-f8x10-lv处理的小鼠的血小板fviii水平。当从经g-f8/n6-lv处理的人源化小鼠中分离出人cd34
+
细胞并用mes培养6天时,超过10%的人细胞表达了fviii。接下来,通过lam-pcr对分离出的人细胞中的lv整合位点进行了检查。
[0184]
基于所描述的研究,lv的io输注对于a型血友病和其它将从fviii表达中受益的血液凝结病症的体内基因疗法可能是一种有价值的策略。
[0185]
实例3.慢病毒的骨内递送在人源化nsg小鼠中产生人血小板特异性因子viii
[0186]
此实例在人源化nsg小鼠中建立了用于这种新策略在人类临床中的转化应用的原则证明研究模型。
[0187]
缺乏功能性血浆因子viii(fviii)的a型血友病(hema)对于用于达到长期治疗fviii水平的基因疗法是一种理想的候选疾病。
[0188]
本文描述了一种新的临床可转化的用于治疗hema的策略。在这种策略中,携带由血小板特异性启动子gp1bα(g)(g-fviii-lv)驱动的fviii转基因的自失活慢病毒载体(lv)在不进行预先调理的情况下通过骨内(io)施用递送到hema小鼠中。g-fviii-lv可以有效转导造血干细胞(hsc)。然后,在血小板α-颗粒中特异性表达并储存的fviii可以部分校正具有或不具有预先存在的抗fviii抑制剂的免疫活性hema小鼠在五个月内的出血表型(王等,分子疗法,23(4):617-626,2015)。
[0189]
将人cd34+细胞在补充有用于扩增人造血细胞的细胞因子混合物(cc110)或用于
扩增人巨核细胞(meg)的无血清培养补充剂的sfem ii中培养7天和13天(图12a)。将在sfem ii+meg中培养的人cd34+细胞用m-gfp-lv或g-gfp-lv转导(图12b)。在第7天通过流式细胞术检测巨核细胞和gfp表达。
[0190]
在用白消安(25mg/kg)预先调理后一天,用1
×
106个人cd34+细胞对6周龄的nsg小鼠进行眶后注射。13周后,收集骨髓(图13a)、脾脏(图13b)和血液(图13c)。通过流式细胞术对骨髓中的人cd34+细胞以及骨髓、脾脏和血液中的人cd45+细胞和鼠cd45+细胞进行了检测。
[0191]
将m-gfp-lv骨内输注到人源化nsg小鼠中,所述小鼠是9周前通过眶后注射人cd34+细胞而产生的。四周后,处死小鼠,并且分离骨髓和脾脏。通过流式细胞术对骨髓(图14a)和脾脏(图14b)中总细胞、人cd45+和鼠cd45+细胞中的gfp表达进行了检测。
[0192]
结论
[0193]
用sfem ii+meg培养的g-csf动员的人cd34+pbsc在体外成功分化为巨核细胞,并且在lv转导后转基因在人细胞中表达。
[0194]
人源化小鼠是通过将g-csf动员的人cd34+pbsc眶后注射到经过预先调理的nsg小鼠中而产生的。长期来看,人cd34+细胞在体内成功更新并分化为造血谱系细胞。
[0195]
骨内输注lv后,在人源化nsg小鼠的人细胞中表达了gfp。接下来,将通过骨内递送fviii-lv对人源化nsg小鼠进行处理。
[0196]
将lv技术的io递送应用于人源化nsg小鼠,以建立用于血友病的体内基因疗法的转化研究模型。证明了人cd34+细胞通过g-f8-lv有效转导产生巨核细胞特异性fviii表达。另外,证明了在将g-f8/n6-lv io递送到人源化nsg小鼠体内后,从经处理小鼠分离的人cd34
+
细胞显示出显著的fviii表达。所分离出的人细胞中的lv整合位点可以通过lam-pcr进行检查,从而证实了此策略的安全性。这些结果进一步证实了io输注lv可以是a型血友病的体内基因疗法的一种有价值的策略。
[0197]
实例4:对骨内递送血小板特异性因子viii-慢病毒载体作为人源化nsg小鼠的血友病的体内基因疗法的功效和安全性的评估
[0198]
a型血友病是一种会导致血浆中分泌的功能因子viii(fviii)缺乏的遗传性病症,并且是基因疗法的理想疾病模型。如上所述,已成功开发出用于递送由血小板特异性gpibα启动子驱动的fviii/n6慢病毒(g-f8viii-lv)的体内骨内注射(io)疗法。造血干细胞(hsc)的病毒转导确保了基因疗法的长期持续维持。然后,fviii产生并被储存在血小板的α颗粒中,从而避免被免疫系统检测到,这使得已经对fviii产生抑制性抗体的患者可以使用这种疗法。io递送g-f8-lv至少部分校正了小鼠在5个月内的血友病表型。本研究的目的是评定向人源化小鼠io递送g-fviii-lv的安全性和功效,以确保将这种疗法转化为临床模型的可行性。
[0199]
首先进行体外研究,以证实从g-csf动员的供体分离的人cd34+细胞中g-f8-lv和g-gfp-lv成功转导和适当表达。将细胞在stemspan
tm
无血清扩增培养基(sfem)中培养,所述培养基中补充有细胞因子混合物(cc110)以扩增造血干细胞,或者在转导后补充有巨核细胞扩增补充剂(meg)以促进向巨核细胞的分化。生长7天后,在meg中培养的细胞比在cc110中培养的细胞具有更高百分比的cd41a+巨核细胞和更高百分比的晚期分化的cd41a+cd42b+巨核细胞,这表明在这种培养基中优先分化为巨核细胞。在meg培养的细胞中也观察到较
高的fviii和gfp表达,这表明在gpibα启动子的引导下巨核细胞特异性表达成功。
[0200]
然后在人源化nsg小鼠体内测试这些lv。在通过眶后(ro)注射移植hcd34+细胞之前24小时,用白消安(25mg/kg)对在c-kit基因中发生或未发生w-41突变的nsg小鼠进行预先调理。八周后,与nsg小鼠相比,在w-41nsg队列中观察到更高的hcd34+细胞移植率,在骨髓中的移植率的平均值大于80%。w-41nsg小鼠体内的人血小板计数也更高。
[0201]
接下来在移植小鼠的队列中进行lv的io递送。氯膦酸盐脂质体处理增加了人血小板计数,从而允许检测从用g-fviii-lv处理的小鼠的pbmc分离的血小板中的显著的fviii表达。在io注射几周后分离骨髓,并且用automacs cd34 microbead试剂盒分离所移植的人hsc。随后将分离出的细胞在meg中培养,并在14天后表达了显著水平的fviii和gfp。
[0202]
以不同的moi分离分别通过g-gfp-lv和g-f8-lv转导的hcd34+细胞的基因组dna(gdna),并分别向两组小鼠的骨髓io注射这两种病毒载体,并且通过qpcr评定标记数。
[0203]
使用lam-pcr对慢病毒的整合位点进行了分析,以评定这种疗法的安全性。预计不会出现克隆扩增。预计整合位点是随机的和多克隆的。
[0204]
考虑到血小板特异性fviii的io递送在人源化小鼠模型中的功效,此种递送是一种有前景的用于校正血友病表型的体内基因疗法。
[0205]
实例5.通过骨内递送血小板特异性因子viii-慢病毒载体校正犬a型血友病
[0206]
此实例描述了使用骨间(io)递送慢病毒载体(lv)处理hema狗的临床前方案的开发。
[0207]
背景:a型血友病(hema)是由因子viii(fviii)缺乏引起的。传统的用于治疗hema的蛋白质输注成本高、不方便、持续时间短。通过将慢病毒载体(lv)递送到骨髓中并靶向血小板中fviii表达的骨内(io)基因疗法成功地处理了具有或不具有抑制剂的hema小鼠。为了将这一新策略转化为临床应用,研究了通过io基因疗法进行的对hema狗的处理。
[0208]
方法:将2.51*108ifu/kg或1.34*109ifu/kg的结合了血小板特异性启动子gp1bα和犬fviii基因的vsvg假型g-cfviii-lv分别注射到hema狗m80和r04的胫骨中。每只狗的lv注射体积为4.5ml。通过elisa测定和aptt测定在从经lv处理的狗分离的血小板和血浆中对cfviii的基因表达进行了检查。通过全血凝结时间(wbct)和血栓弹性描记法(teg)测试对hema表型的校正进行了评估。
[0209]
结果:在血小板中可以检测到犬fviii,最高表达为30mu/108个血小板(图15)。在狗血浆中没有检测到fviii表达。在io基因疗法后不久,wbct在多个时间点缩短(图16a)。类似地,通过teg检查的所有四个参数(r时间、k时间、α角和ma)表明部分校正了血液凝结(图16b)。此外,如通过cbc和血液化学分析所评估的,io基因疗法耐受性良好,并且未在经处理的犬体内产生任何毒性。
[0210]
结论:此实例建立了一个成功处理hema哺乳动物(通过狗进行了例证)的代表性io基因治疗方案。本研究为在体内安全有效地应用基因疗法治疗hema患者提供了策略。
[0211]
实例6:用于处理hsc动员小鼠模型的a型血友病的慢病毒载体的静脉递送
[0212]
此实例描述了通过慢病毒载体(lv)对外周血造血干细胞(hsc)进行遗传修饰以治疗a型血友病的体内新型方法的开发。
[0213]
首先通过对小鼠施用g-csf和amd3100的组合来动员从骨髓(bm)进入外周血的原始hsc,随后静脉注射(iv)携带fviii基因的慢病毒载体(lv)。然后通过使用编码gfp或
fviii基因的四种类型的慢病毒载体(lv)(其由普遍存在的启动子或巨核细胞特异性糖蛋白-1bα(gp1bα)启动子(mnd-gfp-lv、g-gfp-lv、ef-fviii-lv、g-fviii-lv)驱动)对基因递送效率进行了研究。结果表明,单一iv注射lv可显著增加经过hsc动员的小鼠的骨髓中经过转导的hsc。有意义的是,iv递送g-fviii-lv实现了血小板中的长期fviii表达,并且在没有fviii表达抑制的迹象的情况下部分校正了a型血友病表型。因此,体内慢病毒递送策略对于有效治疗患者fviii缺乏具有很大的潜力。
[0214]
介绍:具有fviii缺乏的a型血友病是世界卫生组织(world health organization)定义的一种罕见疾病。a型血友病(hema)是一种由因子viii基因缺乏引起的严重出血性病症。a型血友病患者反复出血,这可能导致慢性关节疾病。用重组活性fviii进行昂贵的治疗后,30%的患者产生了针对fviii的中和抗体形式的免疫原性应答(苗,血栓形成杂志(thrombosis journal)14:41,2016)。
[0215]
基因疗法是用于治疗hema的良好策略(roth(罗斯)等人,新英格兰医学杂志(new england journal med)344:1735-1742,2001;怀特(white),血栓形成与止血(thrombosis and haemostasis)86:172-177,2001;纳尔迪尼(naldini),自然(nature)526:351-360,2015;亚罗沃伊等人,血液102:4006-4013,2003)。最近,一些生物技术公司的临床试验显示了非常有前景的结果。使用aav载体递送fviii,杂交肝脏特异性启动子(hlp)特异性驱动fviii在肝脏中的表达以恢复血浆中的fviii(帕西(pasi)等人,血友病22:151-152,2016)。然而,存在引发免疫应答产生抗fviii抑制性抗体的风险,最终导致血浆中fviii的减少/消除(埃特尔(ertl)等人,人类基因疗法(human gene therapy)28:328-337,2017;多林(doering)等人,分子疗法:美国基因治疗学会杂志(molecular therapy:j amer soc gene therapy)15:1093-1099,2007)。另外,相当多的患者已经产生了针对aav载体的抑制剂,因此这种基因治疗方法将不起作用。
[0216]
血小板中fviii的特异性表达是用于治疗hema的一种良好的基因治疗方法。王等人通过骨内输注递送了含有gp1bα-fviii的慢病毒构建体(分子疗法:美国基因治疗学会杂志23:617-626,2015)。血液凝结可以通过用fviii的血小板特异性表达的处理进行部分校正。还有其它研究人员采用gp2ba启动子来驱动fviii表达。这两种方法都使得fviii储存在血小板中。然而,以骨内递送方式施用了lv或移植了经转导hsc的小鼠没有显示出fviii抑制剂。
[0217]
使用g-csf和amd3100动员原始祖细胞是使骨髓中的hsc强制进入外周血的有效方法。许多研究证实,经过动员的hsc可以在体内被整合腺病毒载体转导。另外,一些临床前研究使用动员来提高基因疗法的功效。例如,在患有x连锁严重组合免疫缺陷病的经过动员的狗中采用免疫重建。组合动员和iv递送慢病毒载体是一种很好的策略。因此,本研究的假设是从骨髓动员到外周血的hsc可以被携带gfp或fviii基因的慢病毒转导。此外,血小板特异性启动子驱动fviii在血小板中的表达可以避免fviii抑制剂的产生。
[0218]
材料和方法
[0219]
动物和细胞:所有体内研究和hema育种均已由西雅图儿童医院的机构动物护理和使用委员会(iacuc)根据iacuc协议第130001330号批准。所有动物程序和动物护理都是根据机构动物研究指南执行的并且还符合西雅图儿童医院动物管理条例。hek293t细胞获自atcc。将细胞在补充有10%(vol/vol)fbs、1%(vol/vol)p/s、1%(vol/vol)谷氨酰胺和1%
(vol/vol)hepes的相关细胞培养基中培养。通过elisa对潜在的支原体污染进行了测试。
[0220]
小鼠动员和体内转导:对雄性黑/6小鼠或雄性hema小鼠(6-8周龄)进行动员程序。皮下注射c-gsf,50ng/小鼠,持续4天。在第五天,经由sc将amd3100注射到小鼠体内(5mg/kg)。在第五天,在注射amd3100 30分钟后输注慢病毒。在慢病毒注射前16小时和2小时,向小鼠腹腔内给药地塞米松。更多细节参见图22b和22c。
[0221]
慢病毒产生:如先前所描述(王等,分子疗法23(4)617-626,2015)产生慢病毒载体(lv);简单地说,用12μg转基因(prrl-sin-mnd-egfp-wpre、prrl-sin-gp1bα-egfp-wpre、prrl-sin-ef-1α-hfviii/n6-wpre和prrl-sin-gp1bα-hfviii/n6-wpre)、6μg病毒包装质粒(pspax2)、3μg病毒包膜质粒(pmd2
·
g)转染含有33μg聚乙烯亚胺(线性,mw为~40,000,宾夕法尼亚州沃林顿的polysciences公司(polysciences,inc,warrington,pa))的hek293t细胞。将含lv的上清液通过在4℃下低速(8000g)离心16-18小时浓缩~2000倍。将感染性载体储液储存在-80℃下。通过如先前所描述的(克恩斯(kerns)等人,血液115:2146-2155,2010)实时定量pcr(qpcr)测定病毒滴度。简而言之,用浓缩病毒的连续稀释液转导2
×
105个nalm-6前b细胞。7天后收获细胞,用pbs洗涤两次并用于基因组dna(gdna)提取。根据通过gdna qpcr测定的转导速率计算了病毒滴度(ifu/ml)。m-gfp-lv、e-f8-lv、g-gfp-lv和g-f8-lv的平均滴度分别为2.2
×
109ifu/ml、2.5
×
109ifu/ml、2.5
×
109ifu/ml和1.1
×
109ifu/ml。
[0222]
流式细胞仪:对hsc或lsk进行染色,并在bm细胞或pbmc中通过谱系-ckit+scal+进行门控。通过离心法从pbmc中分离血小板。在90g/min、8分钟旋转后,通过分离缓冲液fico/litetm-血小板(亚特兰大生物制品公司(atlanta biologicals))分离血小板。通过cd42d对分离的血小板进行染色。通过表面标记b220、cd3和cd11b(加利福尼亚州圣地亚哥的e生物科学公司(ebioscience san diego,ca))对b、t和髓样细胞进行染色。对于血小板中的fviii表达,在表面染色后,用固定和破膜缓冲液(fix and perm buffer)(bd公司(bd))固定血小板。将小鼠抗hfviii单克隆抗体(esh8,德克萨斯州西布鲁克的美国diagnostica公司(american diagnostica,seabrook,tx))用作一级抗体,其次是二级抗体山羊抗小鼠ig fitc(bd生物科学公司)。使用lsrii(bd生物科学公司)进行流式细胞术分析,使用flowjo(俄勒冈州的亚什兰公司(ashland,or))对数据进行分析。
[0223]
血浆中的fviii活性和fviii抗体测定:使用aptt分析小鼠血浆中的hfviii活性,并且通过如前所述(苗等人,血液114:4034-4044,2009;卡斯帕等人,thromb diath haemorrh 34:612,1975)的hfviii bethesda抑制剂测定对抗hfviii抗体进行测量。
[0224]
凝结功能测定:使用计算机化四通道装置(美国仪器实验室公司(instrumentation laboratory,usa))采用旋转血栓弹力图功能凝结测定表征血液凝结功能。通过下巴出血收集小鼠血液,并与10%柠檬酸钠充分混合。在intem程序下通过迷你杯方案进行了测定。将从对照组和基因治疗组收集的血液运行一小时,以在上研究凝固时间(ct)、凝块形成时间(cft)、α角和最大凝块硬度(mcf)。
[0225]
拷贝数检测:通过qiagen dna mine试剂盒在bm细胞中分离基因组dna。将一份nalm-6细胞gdna拷贝稀释作为标准品。gag引物和探针由英杰公司(invitrogen)合成。正向序列:ggagctagaacgattcgcagtta (seq id no:5);反向序列:ggttgtagctgtcccagtatttgtc(seq id no:6)。探针:acagccttctgatgtttctaacaggccagg(seq id no:7)
[0226]
根据制造商的说明,使用power sybr绿色pcr主混合物(沃林顿英国的应用生物系统(applied biosystem,warrington,uk))通过qrt-pcr对小鼠肝脏、脾脏和肺中的hfviii mrna进行了定量。首先,用试剂(纽约州大岛的生命技术公司(life technologies,grand island,ny))从经水动力学注射(hd)(pbs-hcrhpi-fviiia48)的小鼠肝脏和经io处理(g-f8-lv)或原初小鼠肝脏、脾脏和肺中提取总rna。然后用cdna合成试剂盒(加利福尼亚州卡尔斯巴德的英杰公司(invitrogen,carlsbad,ca))生成cdna。在qrt-pcr实验中使用了用于评估fviii转录物的hfviii特异性引物(正向序列:ccagagttccaagcctccaaca(seq id no:8);反向序列:ggaagtcagtctgtgctccaatg(seq id no:9))和用于评定对照基本代谢功能调节基因转录物的rpl19引物(正向序列:gcatcctcatggagcacat(seq id no:10);反向序列:ctggtcagccaggagctt(seq id no:11))。将hd小鼠肝脏中的hfviii mrna表达用作阳性对照(rq=1),以校准在经io处理的或原初小鼠肝脏、脾脏和肺中的hfviii mrna表达水平。
[0227]
结果
[0228]
lv转导后动员小鼠中的gfp标记的造血谱系的增加
[0229]
用含有用于驱动动员小鼠模型中的gfp表达的普遍存在的启动子mnd的lv来评估通过iv递送慢病毒的转导效率。使用动员药物(g-csf和amd3100;参见图22c)将hsc从bm动员到外周血。动员使得进入血液的lsk细胞增加了100多倍(图17a)。然后,通过眶后注射开始iv递送mnd-gfp-lv。在施用mnd-gfp-lv后的第7天,动员组的整个pbmc中gfp表达最高(图17b)。即使在第10周也可以检测到血液中gfp阳性的lsk细胞(图17c)。mnd-gfp-lv也可以转导骨髓细胞、t细胞和b细胞,但在动员组的这些细胞类型中观察到gpf下降更快(图17d-17f)。
[0230]
还分析了在动员组和非动员组中注射mnd-gfp-lv后bm中的转导状态。bm中总单核细胞的gfp mfi(平均荧光强度)在lv递送后10周在动员组与非动员组之间显示出显著差异(图17g)。
[0231]
10周后,通过流式细胞仪可以在两组中检测到bm的hsc中的gfp表达。动员组中的gfp+信号的mfi比非动员组中的gfp+信号的mfi高5倍(图17h)。这些结果证实iv递送lv可以有效地转导外周血中动员的hsc,并且经过转导的hsc从循环中回到bm。
[0232]
在经过动员小鼠模型中注射g-gfp-lv后,gp1bα启动子驱动血小板中gfp的持续表达
[0233]
与lv在动员条件下通过系统递送成功转导hsc的这种情况一样。gp1bα启动子将驱动gfp在巨核细胞和储存血小板中的表达。为了评估可能性,通过iv向动员组和非动员组中注射g-gfp-lv。血小板中的gfp表达的峰值出现在g-gfp-lv后的第2周。在第10周,在动员组中约0.2%的血小板中观察到血小板中持续的gfp表达(图18a)。同时,lv递送后在非动员组中未检测到gfp表达。g-gfp不能在t细胞、b细胞和髓样细胞中检测到,这证明gp1bα启动子仅在巨核细胞中表达。这些结果表明,在动员后的hsc中,g-gfp-lv的转导效率显著提高,从而使得血小板中gfp的表达增加。图18b是代表性流动数据;图12a是结果的总结。
[0234]
通过iv注射进行的e-f8-lv载体的普遍存在的表达诱导体内fviii抗体的形成
[0235]
为了证明这种新的lv输注策略的治疗益处,通过iv注射ef-hfviii-lv对hema小鼠进行了处理。在动员组和非动员组中,在e-fviii-lv处理2周后通过aptt测定法对血浆中的
循环fviii活性进行了检测(图19a)。观察到fviii表达在lv输注后6周下降到不可检测的水平,这与抗fviii抑制性抗体的出现相关(图19b)。因此,似乎由普遍存在的启动子驱动的fviii表达倾向于诱导fviii抗体的形成。
[0236]
fviii蛋白可以在体内g-fviii-lv转导后储存在血小板中
[0237]
由于g启动子可以驱动gfp表达并储存在血小板中,因此出现了g-fviii-lv处理hema的方法。用于在血小板中表达fviii的g-fviii-lv的递送特别具有避免针对fviii的免疫应答的潜力。为了测试这种可能性,经由iv递送了g-fviii-lv;在3个月的实验期内,动员组中存在1.5-4%的含有fviii的血小板(图20a-20b)。通过elisa测定检测,fviii表达为约1.5mu/108个血小板(图20c)。通过q-pcr检测,bm中的拷贝数为0.3拷贝/细胞(图20d)。在动员组中,注射g-fviii-lv的小鼠没有在血浆中显示fviii抑制剂。
[0238]
血小板中的靶向fviii表达部分校正血友病表型。
[0239]
为了确定fviii在血小板中的表达是否可以在功能上补偿血友病,采用了(旋转热电测定法)测定法;这是一种通过检测凝结时间(ct)、凝块形成时间(cft)、最大凝结硬度(mcf)和α角来评估血液凝结功能的凝结测定法。基因治疗6个月后,对通过g-fviii-lv转导的小鼠进行测定。结果证实,与hema小鼠相比,动员组中的凝结时间更快,凝结形成时间更短并且α角更大。动员组和非动员组在α角和mcf参数上存在显著差异。与hema小鼠相比,在非动员组中,血液凝结功能没有明显改善(图21a-21d)。
[0240]
讨论
[0241]
为了在单一治疗后获得长期fviii表达,几个小组探索了基因治疗技术的不同方法。至少有四种基因治疗方法正处于临床试验阶段。bmn270和spark 8011处于第ii/iii临床试验阶段;这些是使用aav载体递送fviii的基于基因治疗的方法,其中hlp启动子特异性驱动肝脏中的表达以恢复血浆中的fviii(帕西等人,血友病22:151-152,2016)。治疗后,fviii在肝脏中表达并分泌到血液中,在血液中可能引发产生抗fviii抑制性抗体的免疫应答。另外,还存在人体内的天然抑制剂清洁avv的风险(埃特尔等人,人类基因疗法28:328-337,2017;多林等人,分子疗法:美国基因治疗学会杂志15:1093-1099,2007)。基因治疗离体研究也有一些缺点,甚至在将经过转导的hsc移植回受体动物模型后也观察到长期的fviii表达和校正血友病表型。因此,目前需要可以避免抑制剂的产生或hsc的体外培养的hsc动员小鼠模型中的慢病毒载体的本文所述的静脉递送。
[0242]
以前通过静脉注射递送了lv。2006年,卡波纳罗(carbonaro)和他的同事通过静脉注射在小鼠新生ada敲除小鼠中使用了lv载体,并检测了肝和肺中整合载体的拷贝数(卡波纳罗等人,分子疗法13(6):1110-1120,2006)。在成年小鼠中,进行了iv注射,其中在bm中检测到低拷贝数。从这些研究中了解到通过iv进行的慢病毒递送在bm的hsc中的转导效率较低。原因是慢病毒载体被外周血中的巨噬细胞或枯否细胞(kupffer cell)清除(布朗(brown)等人,血液109(7)2797-2805,2007),载体转移到骨髓中转导hsc的机会较少。hsc的动员与iv注射组合是一种很好的策略,它可以提高hsc转导的效率,因为转导的位置从bm转移到了外周血。那些被携带fviii的lv转导的hsc将回到bm,并留在bm的小生境中进行进一步的再生和分化。
[0243]
事实上,这种方法显著提高了lv转导的效率。本文的数据显示,在lv注射后,动员
组的mfi比非动员组的mfi高5倍。然而,当将普遍存在的启动子用于驱动血浆中分泌的fviii表达时,无论是动员组还是非动员组都表现出较高滴度的fviii抑制剂。
[0244]
由gp1b启动子驱动的fviii是有利的,因为它在巨核细胞中表达,并且fviii在血小板中的储存防止其暴露于免疫系统。当出血事件发生时,血小板将被活化以释放fviii,并且从而加入凝固途径。
[0245]
为了证明g-fviii-lv也可以对hema小鼠实现长期治疗,在小鼠模型中对功效研究进行了长达6个月的跟踪。血液凝结功能数据证明,hema表型在很长一段时间内得到了部分校正。在非动员组中观察到低滴度的fviii抑制剂,尽管与动员组相比没有显著差异。体外实验证明gp1b启动子可以在骨髓细胞中工作。
[0246]
本研究探索了一种经由通过静脉注射递送fviii-lv特异性转导的hsc来进行hema基因治疗的新策略。这是一种新方法并且与以前的策略相比具有几个优点,包含:iv递送直接并且方便。其不需要复杂的离体移植或体外细胞培养。另外,其通过靶向hsc来实现长期功效。fviii储存在血小板中,很少有机会诱导抗体中和fviii。
[0247]
实例7:用于通过鼻内递送编码因子viii的慢病毒载体治疗a型血友病的肺特异性基因疗法的新策略
[0248]
最近,新出现的证据表明,除骨髓外,肺也是造血祖细胞/干细胞(hsc)的贮器(法兰西斯(lefrancias)等人,自然544(7648):105-109,2017)。新的研究报告称,血小板可以由位于肺内血管外空间的巨核细胞产生。此外,上述实例中的数据证明,由特异性启动子gp1bα(g)驱动的外部因子viii(fviii)基因可以通过转导小鼠体内的hsc在巨核细胞中长期表达fviii蛋白。储存在血小板中的fviii蛋白可以在血小板活化时被释放以促进凝结。因此,鼻内(in)递送靶向肺中的巨核细胞中的fviii基因表达的慢病毒载体(lv)具有校正hema小鼠表型的潜力。
[0249]
使用g-gfp-lv对in递送是否能在小鼠血小板中产生gfp表达进行了测试。7天后,in递送24μl g-gfp-lv在血小板中产生了高达0.075%的gfp阳性表达。虽然效率较低,但gfp表达可以通过流式细胞仪检测到。与未经处理的对照组相比存在显著差异。
[0250]
为了提高转导效率,对用n-乙酰半胱氨酸和地塞米松预处理的小鼠使用了更高滴度/体积的lv。在根据优化的方案将增加剂量的g-fviii-lv in递送到hema小鼠体内之后:经由静脉注射用130mg/kg的n-乙酰半胱氨酸(nac)处理小鼠2天,并且在in前16小时和其后2小时通过腹膜内注射用10mg/kg的地塞米松处理小鼠。通过in向小鼠施用40μl的g-fviii-lv(1
×
109ifu/ml)/小鼠,然后使小鼠在异氟醚下睡眠5分钟。在处理后第7天,通过细胞内染色和fviii elisa对血小板中的fviii表达进行了检查。循环血小板中有0.23%的fviii阳性血小板,并且检测到fviii表达可以高达0.3mu/108个血小板。
[0251]
也通过测试了功能性凝结形成。从in基因治疗小鼠获得的凝结参数与野生型小鼠的凝结参数相当,所述参数包含凝结时间(ct)、凝结形成时间(cft)、α角和凝结形成最大值(mcf)。此外,处理7天后,观察到hema小鼠组和in基因治疗组的ct值存在显著差异(2641
±
1437(秒)对587
±
354(秒);p=0.032)。这些数据表明在in递送后肺中的巨核细胞的成功转导,从而实现hema的治疗校正。
[0252]
此外,fviii阳性血小板染色在处理后第7天至第30天保持在0.23%。与第7天处理后的数据相比,第30天处理后通过测试的凝结参数没有显著差异,这表明lv可能
转导造血干细胞。另外,通过bethesda测定未检测到抗fviii抑制剂的形成。
[0253]
这些数据表明,fviii表达性血小板成功产生并能够通过g-fviii-lv向肺中的in递送部分校正小鼠的hema表型。血小板α-颗粒中fviii表达和储存的益处是防止fviii中和抗体并降低诱导抑制性抗体的可能性。编码靶向肺的fviii基因的lv的in递送是血友病患者的治疗性治疗的一个有前景的选择。
[0254]
实例8:用于通过鼻内递送编码因子viii的慢病毒载体治疗a型血友病的肺特异性基因疗法的新策略
[0255]
在此实例中,使用lv的鼻内递送来处理a型血友病小鼠展示了本文所述治疗方法的实施例。
[0256]
a型血友病(hema)是一种功能性血浆因子viii(fviii)缺乏症。最近,新出现的证据表明,除骨髓外,肺也是造血祖细胞/干细胞(hsc)的贮器。新的研究报告称,血小板可以由位于肺内血管外空间的巨核细胞产生。
[0257]
利用gp1bα启动子驱动的慢病毒载体(lv)通过鼻内递送(in)来转导肺,以产生用于治疗a型血友病的血小板特异性fviii基因表达。
[0258]
图23中提供了本研究中使用的载体。通过鼻内递送转导lv,然后收获肺、骨髓和血小板并分析基因表达。
[0259]
结果:
[0260]
图24a、24b展示了通过经由鼻内递送的g-gfp-lv转导进行的血小板中的g-gfp表达。经由in向小鼠施用24μl g-fviii-lv(1
×
109ifu/ml)/小鼠/天,持续3天。(图24a)gfp+血小板的流式细胞术示意图。(图24b)慢病毒处理(n=4)后,通过流式细胞术测定血小板中的gfp表达。
[0261]
图25a-25c展示了通过经由鼻内递送的g-fviii-lv进行的血小板中的fviii表达。经由静脉注射用130mg/kg的n-乙酰半胱氨酸(nac)处理小鼠2天,并且在in前16小时和其后2小时通过腹膜内注射用10mg/kg的地塞米松处理小鼠。经由in向小鼠施用40μl的g-fviii-lv(1
×
109ifu/ml)/小鼠,然后使小鼠在异氟醚下睡眠5分钟。(图25a-25b)在in处理(n=4)后通过细胞内染色和在血小板中进行elisa测定检测fviii表达。(图25c)in给药后30天通过rotem测定的hema小鼠、宽型小鼠和经lv处理的小鼠的全血凝结的代表性示意图。
[0262]
图26展示了通过m-gfp-lv进行的肺hsc转导。m-gfp-lv可以通过鼻内递送转导肺中的造血干细胞。
[0263]
结论:通过鼻内递送用慢病毒载体转导肺中的巨核细胞实现了即时基因表达。nac和dex处理都提高了lv转导效率。m-gfp-lv可以通过鼻内递送转导肺中的造血干细胞。通过经由鼻内递送的g-fviii-lv转导肺中的造血干细胞以实现hema的长期部分治愈。
[0264]
如本领域普通技术人员将理解的,本文公开的每个实施例可以包括其特定陈述的要素、步骤、成分或组分、基本上由其组成或由其组成。如本文所用,过渡术语“包括(comprise/comprises)”是指包含但不限于,并允许包含未指定的要素、步骤、成分或组分,即使是主要量。过渡性短语“由
……
组成”不包含任何未指定的要素、步骤、成分或组分。过渡短语“基本上由
……
组成”将实施例的范围限制为指定的要素、步骤、成分或组分,并且限制为不实质上影响实施例的要素、步骤、成分或组分。如本文所用,在向受试者施用所公开的纳米载剂后的7天内,材料效应将使治疗性蛋白质的瞬时表达在统计学上显著降低。
[0265]
除非另有说明,否则说明书和权利要求书中使用的表示成分数量、性质(如分子量)、反应条件等的所有数字应理解为在所有情况下都被术语“约”修饰。因此,除非相反指出,否则说明书和所附权利要求中阐述的数值参数是可以根据本发明寻求获得的期望性质而变化的近似值。至少,并且并非试图将等同原则的应用限制于权利要求书的范围,每个数字参数至少应根据所报告的有效数字的数目并通过应用普通的舍入技术来解释。当需要进一步澄清时,术语“约”具有在与所陈述的数值或范围结合使用时本领域技术人员合理赋予它的含义,即表示比所述数值或范围稍大或稍小,在所陈述的数值的
±
20%的范围内;在所陈述的数值的
±
19%的范围内;在所陈述的数值的
±
18%的范围内;在所陈述的数值的
±
17%的范围内;在所陈述的数值的
±
16%的范围内;在所陈述的数值的
±
15%的范围内;在所陈述的数值的
±
14%的范围内;在所陈述的数值的
±
13%的范围内;在所陈述的数值的
±
12%的范围内;在所陈述的数值的
±
11%的范围内;在所陈述的数值的
±
10%的范围内;在所陈述的数值的
±
9%的范围内;在所陈述的数值的
±
8%的范围内;在所陈述的数值的
±
7%的范围内;在所陈述的数值的
±
6%的范围内;在所陈述的数值的
±
5%的范围内;在所陈述的数值的
±
4%的范围内;在所陈述的数值的
±
3%的范围内;在所陈述的数值的
±
2%的范围内;或在所陈述的数值的
±
1%的范围内。
[0266]
尽管阐述本发明的广泛范围的数值范围和参数是近似值,但具体实施例中阐述的数值尽可能精确地报告。然而,任何数值固有地含有必然由其相应的测试测量中发现的标准偏差引起的某些误差。
[0267]
除非本文中另有所指或明显与上下文相矛盾,否则在描述本发明的上下文中(特别是在以下权利要求的上下文中)使用的术语“一个/一种(a/an)”和“所述(the)”以及类似的指代词应被解释为涵盖单数和复数两者。本文中对值的范围的叙述仅旨在充当一种单独指代落入所述范围内的每个单独的值的简化方法。除非本文另外指明,否则将每个单独的值并入本说明书中,就好像每个单独的值是在本文中单独引用的一样。除非本文中另外指明或明显与上下文相矛盾,否则本文所述的所有方法均可以以任何合适的顺序执行。除非另外要求,否则本文提供的任何和所有实例或示范性语言(例如,“如”)的使用仅旨在更好地说明本发明并且不对本发明的范围构成限制。说明书中的任何语言都不应当解释为指示任何未要求保护的要素为实践本发明所必需的。
[0268]
本文公开的本发明的替代性要素或实施例的分组不应被解释为限制。每个组成员可以被单独地或者以与所述组中的其它成员或本文发现的其它要素进行任何组合的方式被引用和保护。出于便利性和/或专利性的目的,预计组中的一或多个成员可以被包含在组中或从组中删除。当进行任何这种包含或删除时,将说明书视为包含修改后的组,从而满足在所附权利要求中使用的所有马库什组的书面描述。
[0269]
本文描述了本发明的某些实施例,包含诸位发明人已知的用于执行本发明的最佳模式。当然,对于本领域普通技术人员来说,在阅读前述描述后,这些描述的实施例的变型将变得清楚。发明人期望熟练的技术人员在适当时采用这些变化,并且诸位本发明人的意图是以与本文具体描述的方式不同的方式来实践本发明。因此,在适用法律允许的情况下,本发明包含对所附权利要求书所叙述的主题的所有修改和等效物。此外,本发明涵盖以上描述的要素在其所有可能的变体中的任意组合,除非另外在本文中指出或另外明确地与上下文相矛盾。
[0270]
此外,在整个说明书中,大量参考了专利和印刷出版物。本文引用的参考文献和印刷出版物中的每一篇都用于其特定引用的教导通过引用单独并入本文。
[0271]
应当理解,本文公开的实施例是对本发明原理的说明。可以采用的其它修改也在本发明的范围内。因此,作为实例而非限制,根据本文的教导,可以利用本发明的替代性配置。因此,本发明不限于精确地如所示出和描述的那样。
[0272]
本文示出的细节仅作为实例,并且仅用于本发明的优选实施例的说明性讨论,并且是为了提供被认为是对本发明的各个实施例的原理和概念方面最有用和最容易理解的描述而呈现的。在此方面,并未试图以比对基本理解本发明所需的细节更详细地示出了本发明的结构细节,结合附图和/或实例进行的描述使得本领域技术人员清楚如何可以将本发明的几种形式体现在实践中。
[0273]
除非在实例中明确地修改,或者当含义的应用使任何构造无意义或基本上无意义时,本公开中使用的定义和解释意在并旨在控制任何未来的构造。如果术语的构造会使其无意义或本质上无意义,则定义应取自韦氏词典(webster's dictionary)第3版或本领域普通技术人员已知的词典,如牛津生物化学和分子生物学词典(oxford dictionary of biochemistry and molecular biology)(安东尼
·
史密斯(anthony smith)编辑,牛津的牛津大学出版社(oxford university press,oxford),2004)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1