具有改善的肠吸收的纳米粒形式的用于口服施用多硫酸戊聚糖的组合物的制作方法
具有改善的肠吸收的纳米粒形式的用于口服施用多硫酸戊聚糖的组合物
发明领域
[0001]
本发明涉及用于口服递送戊聚硫钠(pps)的药物组合物。具体而言,本发明公开了具有适合的聚合物的纳米粒形式的pps组合物,其旨在改善pps在小肠中的吸收并且减少或消除在结肠中的副作用。
背景技术:
[0002]
戊聚硫钠是一种半合成的硫酸化多糖,其在化学和结构上与肝素和糖胺聚糖(gag)相似。它作为抗炎药用于患有间质性膀胱炎(ic)的患者,从而修复尿道上皮内层的受损的糖胺聚糖(gag)层,以减少屏障受损部分的通透性并防止来自尿液的毒素刺激尿道上皮。它还可以通过抑制结缔组织和粘膜肥大细胞来减少炎性反应和组胺分泌。
[0003]
当口服施用时,它涉及多种副作用,这大大限制了其被患者接受。这些副作用主要是由于药物在胃肠道上部吸收不良所致;这导致大量药物暴露于结肠粘膜,从而产生主要以腹泻和出血为代表的不良作用。
[0004]
ep2101799公开了特别是pps在预防或治疗与结缔组织损伤相关的炎症中的用途。该文献中未要求保护或描述任何具体的配制方法。
[0005]
au2012284048b2公开了一种使用非抗凝硫酸化多糖(nasp)例如pps增强血液凝固的方法。通过增加口服施用含nasp和胃肠道上皮屏障渗透促进剂的制剂后的药物吸收实现该目的。脱乙酰壳多糖被描述为促进剂,浓度为0.3%-3%。
[0006]
us2017189443公开了用于施用pps的药物组合物,其包含渗透促进剂以改善口服施用后的肠吸收。在所述促进剂中未引用脱乙酰壳多糖。
[0007]
wo2016191698公开了含有pps的片剂,其用于治疗镰状细胞病。该文献中未提及具体的配制方法。
[0008]
wo2016199161公开了含有pps和α肾上腺素能阻断药的片剂制剂(无特定特征),其用于治疗膀胱出口阻塞。
[0009]
纳米粒药物递送系统是用于递送药物的纳米载体。与其它形式的药物载体相比,纳米粒在生物利用度、减少的酶促降解、毒性或副作用方面具有许多优势。通常利用带相反电荷的多糖之间的相互作用来形成水不溶性复合物(a.nakayama和k.shinoda j.colloidal and interface sciences,55,1976,126-132)。
[0010]
作为实例,grabovac和bernkop-schnurch提出通过与茎菠萝蛋白酶复合来改善低分子量肝素的肠膜通透性(v.grabovac和a.bernkop-schnurch int.j.pharm 326,2006,153-159)。
[0011]
在能够产生纳米粒的聚合物中,脱乙酰壳多糖作为最有希望的阳离子聚合物出现,其潜在地能与阴离子活性成分相互作用。例如,已经提出用脱乙酰壳多糖通过聚电解质复合与肝素形成纳米粒(z.liu等人j.biomed mat.res part a;s.boddoi等人biomacromolecules 10,2009,1402-1409)。
[0012]
脱乙酰壳多糖(cs)是一种聚阳离子、无毒、粘膜粘附性聚合物,其已经被证明是安全的。它可以粘附在粘膜表面,从而打开上皮细胞之间的紧密连接,并且因此潜在地能改善药物吸收。它使得递送系统与膜上皮之间的相互作用延长,从而促进药物更有效地扩散到粘液/上皮层中。
[0013]
h.abdel-haq和e.bossu已经证明了脱乙酰壳多糖与pps形成复合物的能力(j.chromatography a 1257,2012,125-130),但是没有公开形成所述复合物的具体条件。没有描述所公开的复合物的治疗应用。
[0014]
raspagni等人(j.controlled release 148,2010,e112-e124)已经描述了通过离子型(ionotropic)胶凝在pps与脱乙酰壳多糖之间形成复合物和药物的体外释放的初步研究。他们基于pps与脱乙酰壳多糖之间的重量比0.5:1、1.2:1、2.2:1提出了一种用于局部(阴道)应用的凝胶形式的组合物。
[0015]
发明详述
[0016]
本发明涉及包含戊聚硫钠(pps)与脱乙酰壳多糖的复合物的纳米粒的口服组合物。本发明的组合物优选是片剂、硬胶囊、颗粒剂或在小药囊中的粉末、用于临时制备溶液的粉末或糖浆剂的形式。由于pps与脱乙酰壳多糖的可电离官能团之间的离子相互作用,通过在溶液中自组装得到纳米粒。在水溶液中的这种相互作用导致粒子的自发形成,其尺寸取决于聚合物特性和参数,例如分子量、取代度、起始溶液中的浓度,以及取决于生产过程的参数。优选具有80-220nm的直径(通过动态光散射技术测定)的本发明的纳米粒以稳定的分子间复合物的形式直接渗透入肠上部的上皮,所述分子间复合物能通过整个纳米粒的胞吞作用、而不是通过游离药物的扩散携带活性成分通过上皮细胞膜(a.dube等人chitosan nanoparticles enhance the intestinal absorption of the green tea catechins(+)-catechin and(-)-epigallocatechin gallate,eur.j.phar,sci.41,2019-225,2010))。以此方式,到达大肠的未吸收药物的量显著减少并且结肠刺激性降低。该特征使得由于吸收改善而显著降低施用剂量。
[0017]
典型地从浓度为1-10mg/ml的pps在水中的溶液开始制备本发明的制剂。将ph为3-5.5的脱乙酰壳多糖的酸性水溶液滴加到所述pps溶液中。用于制备所述脱乙酰壳多糖溶液的酸可以选自盐酸、硫酸、谷氨酸、乳酸、抗坏血酸或任何其它能使聚合物以1-6.5mg/ml的浓度进入溶液的生理学上可接受的酸。
[0018]
当两种溶液均浓度为1mg/ml时,pps与脱乙酰壳多糖的溶液之比为3:6v/v和5:1.5,更优选为4:5v/v。在两种聚阴离子的更高浓度下,优选不同的比例,例如5:1.5、5:2、5:3、5:4v/v。
[0019]
在加入脱乙酰壳多糖溶液期间,将pps溶液保持在搅拌下。所述搅拌可以用桨、螺旋桨、磁搅拌器、涡轮分散器或任何其它类型的适合于获得高分散程度的混合设备得到。当使用桨、螺旋桨或磁搅拌器时,将转速保持在300-1500转/分钟,优选400-1200转/分钟,更优选500-1000rpm,而对于涡轮分散器,优选的转子转速为8000-30000rpm。
[0020]
分散过程在20-60℃、优选25-50℃、更优选在40℃的温度下进行。
[0021]
需要另外的制备步骤以将纳米粒尺寸减小至所关注的大小,尤其是当所述两种组分的初始浓度高于1mg/ml时。该步骤意味着使用例如如下方法:高压均化、纳米研磨或能以机械方式减小纳米粒尺寸的任何其它方法。
[0022]
该步骤对于本发明的可能的工业利用特别重要,因为它使得制备高pps浓度的纳米混悬液,从而显著减少随后将纳米混悬液转化成自由流动粉末所需的时间和能量。
[0023]
当使用高压均化时,可以在500巴至1500巴的压力下、更优选在1200巴的压力下得到期望范围内的粒子。该方法的温度可以在40-60℃范围内,优选在40-50℃范围内,更优选是40℃。均化循环的次数可以在5-50范围内,更优选在10-40范围内,更优选是35。
[0024]
从具有78-99%、优选85-97%、更优选92-96%的脱乙酰化度并且分子量(数均分子量)为30-400kda、优选65-300kda、更优选67-200kda的脱乙酰壳多糖得到尺寸为80-220nm的pps与脱乙酰壳多糖的复合物的纳米粒。
[0025]
本发明的纳米粒特征在于pps与脱乙酰壳多糖的特别高的复合度。经pps溶液与脱乙酰壳多糖溶液之间的相互作用根据本发明得到的纳米混悬液中的非复合的pps相对于所述纳米混悬液中pps的标称剂量低于20%重量。上述方面是双重重要的,因为从一个方面,可以保证制剂中的pps全部为纳米粒形式,从而其能全部通过小肠上皮转运,从另一个方面,如果部分纳米粒能避免不良肠吸收,则不会有游离的pps到达结肠。实际上,由于纳米粒在酸性溶液中形成,因此,如果考虑脱乙酰壳多糖的溶解特性,就会发现在结肠的略碱性环境中粒子的溶解度积(solubility product)将甚至更低。
[0026]
然后,通过冷冻干燥、喷雾干燥或在固体载体上的分散/吸收,将得到的匀化的纳米混悬液转化为自由流动的粉末。在所有情况下,将纳米混悬液与能促进纳米粒在水性流体例如胃肠液中再分散的药学上可接受的填充剂混合。
[0027]
所述填充剂可以是糖例如右旋糖、葡萄糖、果糖、乳糖、蔗糖、棉子糖、海藻糖、多元醇例如甘露醇、山梨醇、聚合物例如纤维素、低聚物例如糊精、无机盐例如磷酸钙、碳酸镁、膨润土、高岭土。
[0028]
混悬液的体积与填充剂的量之比可以在宽范围内变化,本领域技术人员可以根据公知常识容易地确定。
[0029]
然后通过标准方法将所得的自由流动的粉末转化为固体剂型,以获得片剂、硬胶囊、颗粒剂或粉末、用于临时制备溶液的粉末、溶液或糖浆剂。以提供治疗量的pps、典型地为50-200mg pps的剂量施用本发明的纳米粒。
[0030]
本发明的纳米粒的吸收可以根据i.hubatsch,e.ragnarrson,p.artursson在“determination of drug permeability and prediction of drug absorption in caco-2monolayers”,nature protocols vol.2n.9,2007,2111-2119中和meunier v等人在“the human intestinal epithelial cell line caco-2;pharmacological and pharmacokinetic applications”cell biol toxicol.1995年8月;11(3-4):187-94中公开的方法通过对caco-2细胞单层的体外渗透试验来评估。
[0031]
可以在通过管饲法口服施用粉末分散物以及与之相比较的未配制的pps溶液后在大鼠中评价pps从本发明的制剂中的生物利用度。
[0032]
在下面的实施例中报道了不同的脱乙酰壳多糖分子量、脱乙酰化度、浓度和方法参数对粒子大小的影响。
[0033]
实施例1
[0034]
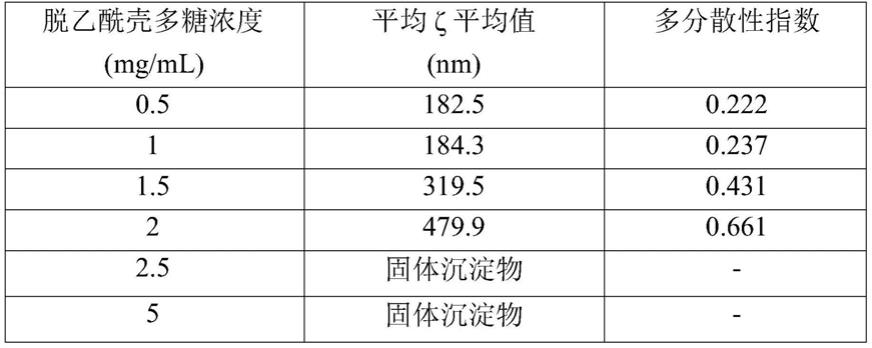
使用t10基础ultra-turrax分散器(ika,德国)将8ml体积的浓度为1mg/ml的pps溶液滴加到在16800rpm恒定搅拌下的10ml具有不同浓度(0.5-5mg/ml范围)的脱乙酰壳多糖
95/50(脱乙酰化度97%,分子量150kda,hmc,德国)溶液中。混合步骤在40℃下进行2分钟。
[0035]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0036]
将得到的数据报道在表1中。
[0037]
表1:使用t10基础ultra-turrax分散器16800rpm获得的作为脱乙酰壳多糖溶液的浓度的函数的粒子的粒子大小和粒子大小分布。
[0038][0039]
粒子大小以及粒子大小分布随脱乙酰壳多糖溶液浓度而增加。可以观察到,在采用的搅拌条件下,可以使用≤1mg/ml的脱乙酰壳多糖浓度得到在所关注的大小范围(<220nm)中的粒子。
[0040]
实施例2
[0041]
使用t10基础ultra-turrax分散器(ika,德国)将8ml体积的浓度为1mg/ml的pps溶液滴加到在16800rpm恒定搅拌下的10ml具有1mg/ml浓度的脱乙酰壳多糖75/50(脱乙酰化度76%,分子量1280kda,hmc,德国)溶液中。混合步骤在40℃下进行2分钟。
[0042]
经混合获得了由在μm范围中的粒子组成的固体沉淀物。
[0043]
实施例3
[0044]
使用c-mag磁力搅拌器(ika,德国)将16ml体积的浓度为1mg/ml的pps溶液滴加到在200-950rpm的可变磁力搅拌下的20ml具有1mg/ml浓度的脱乙酰壳多糖95/50(脱乙酰化度97%,分子量150kda,hmc,德国)溶液中。混合步骤在40℃下进行3分钟。
[0045]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0046]
将得到的数据报道在表2中。
[0047]
表2:从1mg/ml的脱乙酰壳多糖溶液开始使用磁力搅拌器在可变搅拌速率下获得的粒子的粒子大小和粒子大小分布。
[0048][0049]
粒子大小随搅拌速率的增加而降低,多分散性指数也同样如此。
[0050]
在高于300rpm的磁力搅拌下从1mg/ml的pps溶液开始可以获得在所关注的大小范围(<220nm)中的粒子。
[0051]
实施例4
[0052]
使用t10基础ultra-turrax分散器(ika,德国)将12ml体积的浓度为1mg/ml的pps溶液滴加到在800-25600rpm的可变转子转速下的15ml具有1mg/ml浓度的脱乙酰壳多糖95/50(脱乙酰化度97%,分子量150kda,hmc,德国)溶液中。混合步骤在40℃下进行2分钟。
[0053]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0054]
将得到的数据报道在表3中。
[0055]
表3:从具有1mg/ml浓度的脱乙酰壳多糖溶液开始使用t10基础ultra-turrax分散器从8000和25-600rpm获得的粒子大小和粒子大小分布。
[0056][0057]
粒子大小随搅拌速率的增加而降低,多分散性指数也同样如此。
[0058]
在测试的搅拌速度的整个范围内均获得了在所关注的大小范围(<220nm)中的粒子。
[0059]
实施例5
[0060]
使用t10基础ultra-turrax分散器(ika,德国)将8ml体积的浓度为1mg/ml的pps溶液滴加到在16800rpm恒定搅拌下的10ml具有不同浓度(0.5-5mg/ml范围)的tm1560(脱乙酰化度80%,分子量66kda,primex,冰岛)溶液中。混合步骤在40℃下进行2分钟。
[0061]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0062]
将获得的数据报道在表4中。
[0063]
表4:使用t10基础ultra-turrax分散器16800rpm获得的作为脱乙酰壳多糖溶液的函数的粒子大小和粒子大小分布。
[0064][0065]
粒子大小以及粒子大小分布随脱乙酰壳多糖溶液的浓度而增加。可以观察到,可以使用≤1mg/ml的脱乙酰壳多糖浓度获得在所关注的大小范围(<220nm)中的粒子。
[0066]
实施例6
[0067]
使用t10基础ultra-turrax分散器(ika,德国)将8ml体积的浓度为1mg/ml的pps溶液滴加到在16800rpm恒定搅拌下的10ml具有不同浓度(0.5-2mg/ml范围)的tm1854(脱乙酰化度60%,分子量529kda,primex,冰岛)溶液中。混合步骤在40℃下进行2分钟。
[0068]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0069]
将获得的数据报道在表5中。
[0070]
表5:使用t10基础ultra-turrax分散器16800rpm获得的作为脱乙酰壳多糖溶液的浓度的函数的粒子大小和粒子大小分布。
[0071][0072]
使用这种高分子量和低脱乙酰化度的脱乙酰壳多糖无法获得在所关注的大小范围(<220nm)中的粒子。
[0073]
实施例7
[0074]
使用t25基础ultra-turrax分散器(ika,德国)将71.5ml体积的浓度为6.5mg/ml的pps溶液滴加到在8000-30000rpm的可变转子转速下的28.5ml具有6.5mg/ml浓度的脱乙酰壳多糖95/50(脱乙酰化度97%,分子量150kda,hmc,德国)溶液中。混合步骤在40℃下进行10分钟,然后将纳米混悬液再保持搅拌10分钟。
[0075]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0076]
所有粒子均呈现出在所关注的范围之外的直径,即因为高于220nm。
[0077]
实施例8
[0078]
使用t25基础ultra-turrax分散器(ika,德国)将62.5ml体积的浓度为6.5mg/ml的pps溶液滴加到在8000-30000rpm的可变转子转速下的37.5ml脱乙酰壳多糖95/50(脱乙酰化度97%,分子量150kda,hmc,德国)溶液中。混合步骤在40℃下进行10分钟,然后将纳米混悬液再保持搅拌10分钟。
[0079]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0080]
因为所有粒子均呈现出高于1μm的直径,所以未获得在所关注的大小范围(<220nm)中的粒子。
[0081]
实施例9
[0082]
为了对比目的,根据raspagni等人(j.controlled release 148,2010,e112-e124)的教导,通过离子型胶凝如下制备了pps-脱乙酰壳多糖凝胶:将pps溶液加入到脱乙酰壳多糖95/50溶液(脱乙酰化度97%,分子量150kda,hmc,德国)中。脱乙酰壳多糖溶液的浓度(50mg/ml)和pps溶液的浓度(10mg/ml)保持恒定;采用pps与脱乙酰壳多糖之间的三种不同重量比,即0.5:1、1:1和2:1。
[0083]
将pps溶液(2.5、5或10ml)以0.5ml/min的恒定速率滴加到在9500rpm连续搅拌下的10ml脱乙酰壳多糖溶液中(t8基础ultra-turrax分散器,ika,德国)。
[0084]
在所有三种情况下均蝴蝶了粘性凝胶,未形成纳米粒或微粒。
[0085]
实施例10
[0086]
使用t25基础ultra-turrax分散器(ika,德国)将28.5ml体积的浓度为4.5mg/ml的脱乙酰壳多糖95/50(脱乙酰化度97%,分子量150kda,hmc,德国)溶液滴加到在8000-30000rpm的可变转子转速下的71.5ml具有8.5mg/ml浓度的pps溶液中(pps与脱乙酰壳多糖之比为4.74:1w/w或5:2v/v)。混合步骤在40℃下进行10分钟,然后将纳米混悬液再保持搅拌10分钟。
[0087]
然后在1200巴下以35个循环匀化得到的纳米混悬液(高压匀浆器,gea niro soavi,意大利)。
[0088]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0089]
得到的粒子呈现出201
±
3.1nm的大小和0.186
±
0.01的pdi。
[0090]
实施例11
[0091]
使用t25基础ultra-turrax分散器(ika,德国)将23ml体积的浓度为4.5mg/ml的脱乙酰壳多糖95/50(脱乙酰化度97%,分子量150kda,hmc,德国)溶液滴加到在8000-30000rpm的可变转子转速下的77ml具有10mg/ml浓度的pps溶液中(pps与脱乙酰壳多糖之比为7.44:1w/w或5:1.5v/v)。混合步骤在40℃下进行10分钟,然后将纳米混悬液再保持搅拌10分钟。
[0092]
在1200巴下以35个循环匀化得到的纳米混悬液(高压匀浆器,gea niro soavi,意大利)。
[0093]
通过动态光散射技术(zetasizer,malvern instrument,uk)测定了形成的粒子的粒子大小(平均ζ平均值)和粒子大小分布(多分散性指数,pdi)。
[0094]
结果显示得到的纳米粒具有204.1
±
4.3nm的大小和0.191
±
0.01的pdi。
[0095]
实施例12
[0096]
如实施例1中所述使用1mg/ml的pps浓度制备了纳米混悬液。
[0097]
通过对溶液中游离的(未复合的)pps的量进行定量测定了纳米粒中pps与脱乙酰壳多糖的复合程度。将纳米混悬液通过孔直径为0.1μm的过滤器过滤。通过电喷雾电离-质谱(4000qtrap,absciex,usa)测定了过滤的上清液中的游离pps的量。
[0098]
复合的pps如下计算:
[0099][0100]
结果显示复合的pps的量为纳米粒中标称pps剂量的99.6
±
0.14%。
[0101]
实施例13
[0102]
如实施例9中所述使用8.5mg/ml的pps浓度制备了纳米混悬液。
[0103]
通过对溶液中游离的(未复合的)pps的量进行定量来测定了纳米粒中pps与脱乙酰壳多糖的复合程度。将纳米混悬液通过孔直径为0.1μm的过滤器过滤。通过电喷雾电离-质谱(4000qtrap,absciex,usa)测定过滤的上清液中游离pps的量。
[0104]
复合的pps如下计算:
[0105][0106]
结果显示复合的pps的量为纳米粒中标称pps剂量的≥80%。
[0107]
实施例14
[0108]
在口服施用1ml浓度为4.64mg/ml的pps水溶液(形式i)或1ml pps/脱乙酰壳多糖纳米混悬液(pps浓度4.64mg/ml)后在用大鼠进行的体内药代动力学研究中评估了血浆浓度与时间的关系曲线。在所述纳米混悬液中,用于生产纳米粒的pps溶液(6.5mg/ml)与脱乙酰壳多糖溶液(6.5mg/ml)的体积比为55:2(v/v)。
[0109]
将得到的血浆浓度与时间关系曲线报道在图1中。
[0110]
纳米粒制剂的曲线下面积为2593min μg ml-1
,pps溶液的曲线下面积为1306min μg ml-1
。用纳米粒处理的大鼠比用pps溶液处理的大鼠还观察到了更高的t
max
(120min vs 60 min)。该值提供了约200%的相对生物利用度。
[0111]
实施例15
[0112]
基于pps重量以3:1的比例向按照实施例11制备的纳米混悬液中加入甘露醇(200sd,roquette,法国)。在甘露醇完全溶解后,将混悬液用装配了1mm直径的喷嘴的b
ü
chi b290设备进行喷雾干燥。应用的干燥条件是:
[0113]
入口温度140℃;
[0114]
气流600l/小时;
[0115]
混悬液进料速度2ml/min;
[0116]
抽吸器35m3/小时。
[0117]
将得到的粉末保留在采集器中15分钟,然后再使用。
[0118]
实施例16
[0119]
基于pps重量以3:1的比例向按照实施例10制备的纳米混悬液中加入甘露醇(200sd,roquette,法国)。在甘露醇完全溶解后,将混悬液倾入玻璃圆柱容器中,立即置于冷冻干燥机(alpha 2-4,martin christ,德国)的隔室中,然后将温度降至-40℃,并保持在该值1小时,以确保混悬液完全冻结。此后,使隔室中的压力降至0.1mbar。然后,在2小时中将板温度升高到-5℃,并保持在该值12小时(初步干燥)。此后,如下进行二次干燥:将压力降低到0.01mbar并在3小时中将温度升高至5℃。将这些条件保持恒定6小时。然后,通过打开排气阀将隔室的压力升高到环境值(1000mbar)。回收样品并储存直至进一步使用。
[0120]
实施例17
[0121]
0号硬明胶胶囊
–
定量组成
[0122]
实施例15中的粉末
ꢀꢀꢀꢀꢀꢀꢀ
413.44mg
[0123]
微晶纤维素
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
90mg
[0124]
硬脂酸镁
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.5mg
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1