一种生物降解聚酯纳米粒及其制备方法和应用与流程
本发明涉及一种生物降解聚酯纳米粒及其制备方法和应用,属于高分子化合物
技术领域:
。
背景技术:
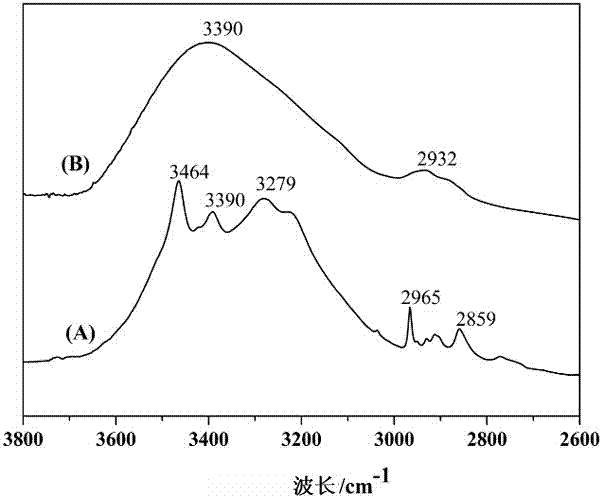
:众所周知,聚合物胶体颗粒的拓扑和空间效应在静脉药物递送中起主要作用,而聚合物中的静电电荷可引起血清蛋白的吸附(调理作用)和被单核巨噬细胞从体内消除。合成聚合物具有低细胞毒性,良好的蛋白质抗性,生物可降解性,这些特征在生物相容性聚乙二醇(peg)胶体颗粒的稳定化中已基本满足。通过peg的修饰导致电中性表面,与血清蛋白的最小相互作用,即“隐形样”性质,并因此延长体内循环。由于这些原因,peg及其衍生物已经成为药物递送研究中常用的亲水材料,以增强治疗剂的功效。中国专利200580021839.2将聚乙二醇与乙烯基甲基醚和马来酸酐共聚物共孵化,制备聚乙二醇化的纳米颗粒,并用于载药。中国专利201110174751.1采用乳化/溶剂蒸发法制备紫杉醇peg-ptmc纳米复合物,该复合物能有效增加紫杉醇的溶解度,且载体材料的peg长链可起到“隐形”的作用,具有长循环效果。然而,由于惰性ch2ch2o重复单元引入靶向结构或染料标记,也导致peg化缺乏足够的官能化位点。由于其生物降解性差,在人体内需较长时间降解,peg在组织中的积累可能在某些体内应用中引起副作用。尽管peg化的药物载体可以避免网状内皮系统的摄取,但是细胞内化也由于载体和细胞膜之间的弱相互作用而减慢。peg在某些生物流体中也易于氧化。因此,研究者期望找到在药物递送应用中可替代的生物相容性和生物可降解的聚合物。碳水化合物衍生物因为它们具有优异的生物可降解性,生物相容性和生物粘附性等,近来在药物递送领域受到极大关注。它们衍生自多种具有用于许多化学修饰的官能团的天然资源。通过缀合和修饰进行的聚合物的糖基化还赋予了广泛的优点,包括降低毒性和免疫原性,改善血清稳定性和促进生物粘附。壳聚糖或淀粉具有适于与生物组织相互作用的多个亲水性官能团,因此,由壳聚糖制成的载体在某些组织中具有长停留时间并且提高了装载药物的吸光度。中国专利201110423116.2选用生物可降解聚合物消旋聚乳酸pdlla,聚乳酸-羟基乙酸plga或聚己内酯pcl通过乳化-溶剂挥发法制备纳米粒子,应用于生物成像、药物传输等研究相结合的多功能生物可降解聚合物纳米粒子领域。中国专利201010023101.2报道了一种生物可降解纳米多孔聚l-谷氨酸/壳聚糖载药微胶囊及其制备方法,将聚l-谷氨酸和壳聚糖作为水溶性药物的负载材料,选用可除去的介孔二氧化硅为模板,制备内部具网络支撑结构的纳米多孔载药微胶囊。然而对于如何实现可替代的生物相容性良好的聚合物制备纳米粒与其作为药物载体的应用,仍然缺少措施与手段,报道也少。基于此,做出本申请。技术实现要素:针对现有负载药物纳米粒所存在的上述缺陷,本申请首先提供一种可生物降解的聚酯,该聚酯以葡萄糖酸-δ-内酯(gdl)为单体,其结构式为:反应产物pgdl具有高度支化的结构,作为药物载体时,有助于对水溶性抗癌药物的包覆负载。同时,本申请还提供了一种具有上述结构聚酯纳米粒的制备方法,其反应式为:反应所得聚酯经反向乳化法制得纳米粒。进一步的,作为优选:所述的引发剂为乙二醇,催化剂为钛酸四丁酯。以gdl为原料,乙二醇引发、聚合后,经洗涤、分离,得到纯化pgdl;pgdl制备纳米粒可采用喷雾干燥法、乳化法或溶剂蒸发法等,本申请以pgdl为载体材料通过反相乳化法制备纳米粒,形成乳剂,洗涤,分离后,得到聚酯纳米粒。所述的gdl与催化剂的质量比为50:1-25:2,引发剂与催化剂等量添加。所述的开环聚合反应条件为n2保护下,160℃下搅拌3h。所述的洗涤剂采用dmf与thf,dmf与thf依次洗涤。所述的分离后进行干燥,干燥采用真空干燥得到纯化pgdl。所述的反向乳化法的工艺为:将聚酯形成水相,液体石蜡为油相,司盘80为乳化剂加入油相中后,水相与油相搅拌混合回流形成乳剂,乳剂洗涤、离心干燥得到纳米粒。更优选的,所述的洗涤采用异丙醇和石油醚交互洗涤。同时,本申请还提供了一种上述pgdl的应用,将聚酯形成水相,在水相中溶解负载物,液体石蜡为油相,司盘80为乳化剂加入油相中后,水相与油相搅拌混合回流形成乳剂,乳剂洗涤、离心干燥得到载药pgdl纳米粒,建立了负载抗癌药物的方法。更优选的,所述的洗涤采用异丙醇和石油醚交互洗涤,所述的负载物为5-fu。本申请提出一种新颖的碳水化合物衍生的聚合物,具有优异的生物相容性。葡萄糖酸-δ-内酯(gdl)是d-葡萄糖酸的环状酯,通过葡萄糖的发酵制造。gdl作为“通常被认为是安全的”(gras)物质,广泛用作食品添加剂并与一些葡萄糖酸盐形式的药物一起给药。聚(葡萄糖酸-δ-内酯)(pgdl)适宜官能化,能呈现出很低的细胞毒性。对载药pgdl纳米粒能够可控制释放5-氟尿嘧啶(5-fu)说明pgdl是有效治疗卵巢肿瘤的有前景的平台。本申请中,生物可降解聚酯纳米粒的制备方法可描述为:(1)葡萄糖酸内酯(gdl)在引发剂与催化剂条件下经开环聚合生成聚葡萄糖酸内酯(pgdl);(2)n,n-二甲基甲酰胺(dmf)与四氢呋喃(thf)洗涤,真空干燥,得到纯化聚合物;(3)将(2)中制备的聚合物以司盘80为乳化剂通过反向乳化法形成油包水型乳剂;(4)异丙醇与石油醚交互洗涤,离心,干燥,得到纳米粒;(5)细胞毒性与亲和性检测试验证明此类纳米粒安全无毒;(6)负载抗癌药物5-氟尿嘧啶的pgdl纳米粒对癌细胞有明显的抑制效果。上述方法制备的聚酯pgdl(也可直接以gdl作为合成单体)与pcl(也可直接以cl作为合成单体)在钛酸四丁酯、乙二醇作用下共聚合成两亲性嵌段共聚酯pgdl-cl,其结构式为:。所述的共聚酯溶于水形成分散液,称取负载物并溶二甲基亚砜中,逐滴加入到上述分散液中,继续搅拌得载药纳米粒分散液,离心除去未负载上的利福平,冷冻干燥,得到载药共聚酯纳米粒。所述的负载物为利福平。本发明制备可生物降解的gdl为原料制备纳米粒,具有制备方法简单,原料价廉易得,生物相容性好等特点,具体分析如下:1)制备方法简单。gdl安全无毒,可生物降解,gdl的开环聚合反应在无溶剂条件下进行;pgdl以本体聚合的方式合成,无溶剂参与,制备及纯化方法简单,且原料来源丰富,价格低廉。纳米粒是的制备采用反相乳化法,制备过程污染小,易操作。2)本申请可以适用于制备多种分子量规格的pgdl,该pgdl是高度支化的聚合物;通过反向乳化法制备聚酯纳米粒,操作简单,粒子粒径小,检测所制备的聚酯纳米粒的生物相容性,细胞毒性小,细胞亲和性好,极易进入细胞,细胞吸收性好,安全无毒,为该纳米粒应用于临床提供良好的参考。3)本申请检测了所制备的负载抗癌药物的释放效果,药物的释放可控,实现了药物的释放可控。它对卵巢癌细胞具有良好的抑制效果。负载5-氟尿嘧啶具有载药量高的特点。附图说明图1为本申请中聚酯的核磁共振(1hnmr)谱图(其中,(a)为单体gdl的1hnmr分析,(b)为聚合物pgdl的1hnmr分析);图2为本申请中聚酯在3800-2600cm-1波段的红外光谱(ftir)图(其中,(a)为单体gdl的ftir分析,(b)为聚合物pgdl的ftir分析);图3是申请中聚酯在1900-800cm-1波段的红外光谱(ftir)图(其中,(a)为单体gdl的ftir分析,(b)为聚合物pgdl的ftir分析);图4是本申请中纳米粒的扫描电子显微镜(sem)谱图;图5是本申请中纳米粒的透射电子显微镜(tem)谱图;图6是本申请中纳米粒负载5-氟尿嘧啶(5-fu)在ph7.4与ph6.5的释放曲线图;图7是本申请中纳米粒负载5-fu在ph7.4与ph6.5释放曲线的释放动力学分析(peppas拟合);图8是本申请中纳米粒对卵巢癌细胞(ovcar-3)的细胞毒性;图9是本申请中纳米粒被ovcar-3细胞摄入荧光显微镜图(其中,(a)为未标记纳米粒与ovcar-3细胞共孵化,(b)为r-123标记纳米粒与ovcar-3细胞孵化0.5h,(c)为r-123标记纳米粒与ovcar-3细胞孵化1h,(d)为r-123标记纳米粒与ovcar-3细胞孵化2h);图10为本申请中pgdl共聚酯分子的gpc图谱;图11为本申请中pgdl(a)及共聚酯(b)的1hnmr谱图(谱峰上的原子编号见其结构式);图12为本申请中pcl(a)、pgdl(b)及共聚酯(c)的ftir分析;图13为本申请中pgdl共聚酯纳米粒载药前后在水中分散的粒径分布;图14为本申请中pgdl共聚酯纳米粒的tem照片;图15为本申请中pgdl负载利福平的共聚酯纳米粒体外释放曲线;图16为本申请中pgdl的peppas方程分析利福平释放过程图17为本申请中pgdl的higuchi方程分析利福平释放过程。具体实施方式实施例1按照单体gdl与催化剂钛酸四丁酯质量比25:2,将10.0ggdl,0.8ml钛酸四丁酯,0.8ml乙二醇混合加入到100ml三口圆底烧瓶中,加搅拌子后置于硅油浴中,中间接口接冷凝回流管,左口通入n2保护,右口密封,160℃下磁力搅拌3h。停止加热与搅拌,产物在n2保护下冷却,得红褐色蜡状固体。于三口瓶中加入20mln,n-二甲基甲酰胺(dmf),80℃加热至完全溶解,冷却至室温,瓶中液体倒入250ml烧杯中,加入3-4倍量四氢呋喃(thf)沉淀,稍静置,去除上层液体,再用thf连续洗涤3-4次,真空干燥除去thf,得终产品pgdl。上述反应过程可表示为:,所制备的pgdl结构为:。称取100.0mgpgdl溶于5ml水中,配成2%(w/v)pgdl溶液,静置,取上层清液4ml作为水相。40ml液体石蜡与5%(v/v)的乳化剂span-80均匀混合作为油相。在50℃,600r/min机械搅拌及回流条件下,将水相经0.22μm针式过滤器逐滴加入油相,继续搅拌4h后停止,倾入250ml烧杯中,加入等体积的石油醚,搅拌,静置,弃去大部分上层液,剩下部分装入离心管,3500r/min离心5min,弃上层液,然后按石油醚、异丙醇、异丙醇、石油醚、异丙醇的加入顺序依次洗涤,离心,产物以异丙醇分散,常温真空干燥,得到pgdl纳米粒。实施例2-5实施例2-5与实施例1的制备条件相同,区别在于:分别对不同gdl与钛酸四丁酯质量比下所制备成品聚酯进行试验,具体参见表1所示。实施例6:负载5-fu的pgdl的纳米粒的制备负载5-fu的pgdl的纳米粒的制备方法:利用上述实施例制备所得纳米粒,负载5-fu后释放,方法如下:称取100.0mgpgdl(gdl与钛酸四丁酯质量比为25:1,引发剂与催化剂体积用量相同,具体参见实施例3)溶于5ml水中,配成2%(w/v)pgdl溶液,静置,取上层清液4ml作为水相;在4ml水相中溶解10mg5-fu;40ml液体石蜡与5%(v/v)的乳化剂span-80均匀混合作为油相;在50℃,600r/min机械搅拌及回流条件下,将溶解有5-fu的水相经0.22μm针式过滤器逐滴加入油相,继续搅拌4h后停止,倾入250ml烧杯中,加入等体积的石油醚,搅拌,静置,弃去大部分上层液,剩下部分装入离心管,3500r/min离心5min,弃上层液,然后按石油醚、异丙醇、异丙醇、石油醚、异丙醇的加入顺序依次洗涤,离心,产物以异丙醇分散,常温真空干燥,制备载药pgdl纳米粒。实施例7:两亲性嵌段共聚物pgdl-cl及其在水中自组装成纳米粒给药体系两亲性共聚物在水中自组装形成的纳米粒,具有疏水内核与亲水外壳。目前临床上使用的一线抗结核药需长期和频繁给药,具有严重的不良反应,通过纳米粒子系统包埋一线抗结核药制备的缓控释制剂,能有效克服药物的不良反应,将有助于改善患者依从性和规避肝肾毒性、耳毒性等,并改善药物的生物利用度,溶解性,稳定性和生物相容性,使其成为递送抗结核药物的理想选择。本实施例制备两亲性嵌段共聚物pgdl-cl及其在水中自组装成纳米粒给药体系,ftir与1hnmr进行表征,tem观察粒径形态,纳米激光粒度仪测定粒径分布。以利福平为模型药物,研究了pgdl-cl纳米粒负载药物在37℃,ph7.4磷酸盐缓冲液(含0.5%v/vtween-80)中的体外释放,并对药物释放进行动力学分析。其中,gdl与cl共聚的产物pgdl-cl的结构示意图为:。(1)仪器与试剂冷冻干燥机(型号:alpha1-2ldplus,生产厂家:德国christ公司)。ε-己内酯(cl)(ar,上海阿拉丁试剂有限公司);利福平(ar,上海阿拉丁试剂有限公司);自配20mmph7.4磷酸盐缓冲液加0.5%v/vtween-80(本文中简称为缓冲液);其余试剂均为分析纯。(2)实验部分①pgdl-cl共聚酯的合成移液枪移取cl5.0ml、钛酸四丁酯、乙二醇各0.8ml于100ml三口烧瓶中,加搅拌子后置于硅油浴中,中间接口接冷凝回流管,左口通入n2保护,右口密封,160℃磁力搅拌下反应2h,称取gdl16.0763g,用漏斗加入烧瓶中,继续搅拌3h。停止加热与搅拌,产物在n2保护下冷却。于三口瓶中加入20mln,n-二甲基甲酰胺(dmf),70℃加热至完全溶解,冷却至室温,瓶中液体倒入250ml烧杯中,加入3-4倍量四氢呋喃(thf)沉淀,稍静置,去除上层液体,再用thf连续洗涤3-4次,真空干燥除去thf,得终产品,并对其进行1hnmr与ftir表征及粒径分布测定。②共聚酯载药纳米粒的制备称取0.40g共聚酯,溶于20ml蒸馏水中,加入搅拌子,常温下磁力搅拌5h,即得共聚酯纳米粒分散液。tem观察粒子形态,纳米激光粒度仪测定纳米粒粒径分布。称取20mg利福平,溶于3ml二甲基亚砜(dmso)中,逐滴加入到上述分散液中,继续搅拌10h,得载药纳米粒分散液,纳米激光粒度仪测定纳米粒粒径分布。3000r/min(rcf1018×g)离心5min,除去未负载上的利福平,冷冻干燥20h,得到载药共聚酯纳米粒。③共聚酯分子量测定共聚酯分子量测定与前述的gpc测定pgdl的分子量的方法一致。④载药纳米粒的体外释放实验及动力学模型分析(a)利福平标准曲线绘制精密称取30.0mg利福平,用少量0.020mph7.4磷酸盐缓冲液(加入0.5%v/v的tween-80)(以下简称缓冲液)溶解后,于500ml容量瓶中以缓冲液定容,配制成质量浓度60μg/ml的利福平溶液。分别移取0.5ml、1ml、1.5ml、2ml、2.5ml上述溶液于10ml容量瓶中,以缓冲液定容,配制为3μg/ml、6μg/ml、9μg/ml、12μg/ml、15μg/ml的5-fu溶液。于258nm处测定吸光度a,并进行回归分析得到标准曲线回归方程。y=0.0592x-0.002,r2=0.999。(b)药物负载率及包封率测定称取一定量载药共聚酯纳米粒,加二甲基亚砜(dmso)溶解后,10000r/min(rcf10280×g)离心30min,使纳米粒破碎,药物完全从纳米粒中释放出来,取上清液少许,稀释后,测定吸光度a。负载利福平纳米粒的负载率及包封率测定均在避光条件下进行。根据公式(1)、公式(2)分别计算共聚酯纳米粒的载药率及包封率。(c)药物的体外释放精密称取载药共聚酯纳米粒50mg于一端封口的透析袋(截留mw﹥1000)中,加入5ml缓冲液,密封夹封口,置于装有150ml缓冲液的250ml烧杯中,37℃下搅拌,每隔一定时间取烧杯中透析袋外缓冲液5ml,再补加5ml新鲜缓冲液,取出的含利福平缓冲液2ml于比色皿中以缓冲液稀释至3ml,测定吸光度a。利福平的体外释放均在避光条件下进行。利福平的累计释放率按照公式(3)的方法计算。(d)动力学模型分析peppas经验方程,higuchi模型及平均释放时间(mdt)均以动力学模型分析公式计算。分析检测结果(1)pgdl分子量分布用凝胶渗透色谱法(gpc)测定上述实施例1-15所制备聚酯的分子量分布,参见表1所示。表1不同实施条件下的产物分子量及多分散系数d实施例gdl与钛酸四丁酯质量比mnmwd125:22.42×1045.43×1042.24250:31.73×1044.19×1042.43325:11.40×1041.58×1041.13450:10.45×1040.65×1041.45510:10.90×1041.84×1042.05从表1中可以看出,不同配比的单体与催化剂条件下,所制备的产品分子量(mn、mw为例)以及多分散系数d也不相同,催化剂选用钛酸四丁酯、引发剂选用乙二醇时,单体gdl可以通过接枝共聚反应得到pgdl;而在聚合过程中,当单体gdl添加量明显高于催化剂量时,聚合度偏低,分散系数较大,以实施例4为例,可以看出,其分子量分布即多分散系数d虽然不是很大,但数均分子量和重均分子量低于1×104(参见实施例4);对比实施例2和4、实施例1和3可以看出,相同单体添加量和反应条件下,增加催化剂的含量,则数均分子量和重均分子量均得到明显提高,但相应的多分散系数d也增加显著;对比实施例3-5可以看出,相同催化剂添加量和反应条件下,当单体gdl逐渐由低增高时,数均分子量逐渐增加,重均分子量和多分散系数则逐渐降低,当单体添加量与催化剂量质量比在15:1-30:1,尤其是当单体添加量与催化剂量质量比在25:1,数均分子量和重均分子量分布相对较为一致,其多分散系数在1.0左右;继续增加单体量,则数均分子量和重均分子量差距再次加大,对应的多分散系数也增大至2左右。pgdl-cl共聚酯分子量测定与前述的gpc测定pgdl的分子量的方法一致。(2)单体及共聚产物pgdl贺词共振谱图分析对单体及聚合产物pgdl进行核磁共振h谱图分析(1hnmr分析,以实施例3为例),具体参见图1,单体gdl的1hnmr中,δ4.7-6.0的三处波峰均归属为gdl游离氢,根据图1中gdl上的c位标号,c5(δ4.00,m,1h),c2(δ3.79-3.77,d,1h),c3(δ3.57-3.56,1h),c4(δ3.67-3.64,1h),c6(δ3.53-3.50,2h)。gdl聚合生成pgdl后,内酯环打开,c5,c4,c6,c9(δ3.38),c2,c8,c11(δ4.25-4.20),c3(δ3.99),c10,c12(δ3.91),c14(δ5.58),c15(δ5.44),c16,c17(δ5.04),c18(δ4.63),thf溶剂峰(δ3.60)。(3)pgdl红外光谱分析对单体以及制备的聚酯及其纳米粒做红外光谱分析(ftir分析),检测分析得图2与图3,结果表明:gdl开环聚合生成pgdl后,在高波数(图2)区,gdl多个羟基峰消失,在3390cm-1处形成单一强宽峰,2965cm-1-2859cm-1峰强及位移相应发生变化,合并为在2932cm-1处的峰;在低波数区(图3),出现在1727cm-1处的gdl羰基峰经聚合后迁移到1744cm-1处,在1109cm-1-1025cm-1处的c-o峰合并为在1076cm-1的强峰。pgdl的ftir谱图中出现在1646cm-1处的波峰为残留dmf的羰基峰。(4)pgdl电镜测试分析对所制备的纳米粒进行电镜测试,参见图4和图5,结果表明:聚酯纳米粒颗粒均匀,基本保持在5nm左右。(5)5-fu标准曲线绘制5-fu标准曲线绘制:精密称取25.0mg5-fu用少量0.020mph7.4磷酸盐缓冲液溶解后,于500ml容量瓶中以磷酸盐缓冲液定容,配制成质量浓度50μg/ml的5-fu溶液。分别移取0.5ml、1ml、1.5ml、2ml、2.5ml、3ml上述溶液于10ml容量瓶中,以磷酸盐缓冲液定容,配制为2.5μg/ml、5μg/ml、7.5μg/ml、10μg/ml、12.5μg/ml、15μg/ml的5-fu溶液。于267nm处测定吸光度a,并进行回归分析得到标准曲线回归方程。y=0.0508x+0.0023,r2=0.9997。(6)药物释放测试载药率及包封率测试:称取一定量载药pgdl纳米粒,乙醇溶解后,10000r/min离心30min,使纳米粒破碎,5-fu完全从纳米粒中释放出来,取上清液少许,稀释后,测定吸光度a。根据式(1)、式(2)分别计算pgdl纳米粒的载药率及包封率。载药率=纳米粒中药物量/载药纳米粒总量×100%(1)包封率=纳米粒中药物量/投药量×100%(2)药物释放动力学测试:精密称取载药pgdl纳米粒45.0mg于一端封口的透析袋(截留mw﹥1000)中,加入5mlph7.4磷酸缓冲液(pbs),密封夹封口,置于装有150mlpbs的250ml烧杯中,37℃下搅拌,每隔一定时间取烧杯中透析袋外pbs5ml,再补加5ml新鲜pbs,取出的pbs于比色皿中稀释3倍后测定吸光度a。用以下公式用于计算5-fu的累计释放量:mt为累积释放量,v为释放池中溶液的体积,ρn是第n次取缓释溶液时所测得的吸光度对应的浓度,ρi是第i次取缓释溶液时所测得的吸光度对应的浓度,vi是每次取缓释溶液的体积。负载5-fu的pgdl纳米粒在ph7.4与ph6.5的体外释放结果参见图6,结果表明:载药pgdl纳米粒在ph6.5磷酸缓冲液中的释放操作与在ph7.4中的释放一致。peppas经验方程lnmt=nlnt+c(4)可用于描述释放机理未知的过程,以lnmt对lnt作图,所得斜率为n。其中mt是药物释放时的累积释放量,c是动力学常数,t是释放时间,n是药物释放指数。精密称取载药pgdl纳米粒9mg在5ml乙醇中超声分散30min,10000r/min离心30min,取上清液1ml用乙醇稀释至10ml,测吸光度a。测得吸光度为0.71403,根据标准曲线方程y=0.0508x+0.0023及式(1)与式(2),得出载药率为7.7836%,包封率为70.05%(参见图7和表2)。表2peppas方程分析5-fu释放过程peppas方程拟合曲线相关系数r2纳米粒在ph6.5下的体外释放y=0.7769x+7.12380.9655纳米粒在ph7.4下的体外释放y=0.6163x+6.62760.9915从图7和表2可以看出,载药纳米粒在ph7.4中的释放曲线较平缓,无明显突释现象,且释放时间较长。直线斜率即其释放指数n为0.6163。根据peppas经验公式,药物释放指数0.45<n<0.89,其输送机理遵循非fick传输机理,释放过程中存在着药物的扩散和聚合物链的弛豫的共同作用,且5-fu的释放机制符合peppas方程。载药纳米粒在ph6.5中的释放较快,纳米粒的颜色在0.5h后逐渐变淡,说明纳米粒在此ph下可能存在降解。(7)负载5-fu载药纳米粒的生物相容性测试利用上述实施例制备所得纳米粒,进行生物相容性实验:①未标记的空白纳米粒的制备:选取状态良好的ovcar-3细胞以4×104cell/ml接种于96孔板中,于37℃5%co2培养箱中培养24h,将聚酯纳米粒以dmem培养基稀释成具有一定梯度的浓度,0.22μm微孔滤膜过滤除菌,各取200ul加入小孔中,平行样品做六个,对照组加入200μldmem培养基,于37℃﹑5%co2培养箱中培养24h,取出后,每孔加入10μlmtt(5mg/ml),继续培养4h,去除上清,每孔加入150μldmso,100r/min震荡10min,酶标仪570nm测定吸光度a。根据式(5)计算纳米粒的细胞活性。细胞活性(%)=(a-a空白)/(a对照-a空白)×100%(5)根据改良寇氏法计算纳米粒对ovcar-3细胞的50%抑制浓度(ic50),如式(6)。lgic50=xm-i(p-(3-pm-pn)/4)(6)xm=lg(最大剂量),i=lg(最大剂量/相邻剂量),p=阳性反应率之和,pm=最大阳性反应率,pn=最小阳性反应率。②荧光分子罗丹明123标记的pgdl纳米粒的制备:罗丹明123(r-123)溶于4ml水相中,其余操作与前述空白纳米粒制备方法相同,制备得到r-123标记pgdl纳米粒。将制备的纳米粒以dmem培养基稀释,配成浓度为50μg/ml的溶液,0.22μm微孔滤膜过滤除菌。选取状态良好的ovcar-3细胞以4×104cell/ml接种于96孔板中,于37℃5%co2培养箱中培养24h,加入用dmem培养基分散的r-123标记pgdl纳米粒溶液,分别培养0.5h、1h、2h后,用pbs洗涤3次,荧光显微镜观测。对比pgdl纳米粒载药前后的细胞活性,参见图8,空白pgdl纳米粒ic50为4587±58μg/ml,说明pgdl纳米粒的细胞毒性极小,生物相容性好,载药pgdl纳米粒ic50为1556±34μg/ml,负载5-fu后的pgdl纳米粒对ovcar-3细胞表现出一定的抑制作用。结合图9,pgdl纳米粒与ovcar-3细胞本身无荧光,荧光标记的pgdl纳米粒与ovcar-3细胞共孵化后,细胞发出的荧光强度与孵化时间相关,在0.5h-2h时间内,孵化时间越长,荧光强度越强,且在孵化0.5h时,细胞即表现出一定的荧光强度,表明ovcar-3细胞对pgdl纳米粒有很强的亲和性。细胞对纳米粒的亲和性强,说明纳米粒被ovcar-3细胞摄取几率高,有利于药物在细胞内释放,提高药物的生物利用率。(7)pgdl-cl共聚酯分子量测定(7)pgdl-cl共聚酯分子量测定本实施例所合成的gdl与cl共聚的产物pgdl-cl结构式可表示为:。pgdl支链与pcl上开环出现的功能官能团通过酯化接枝,达到共聚的目的。将均聚产物pgdl与共聚产物pgdl-cl以d6-dmso溶解后测定1hnmr。对图10中样品出峰区间进行积分,根据标准曲线计算数均分子量(mn)、重均分子量(mw)和多分散系数(d),如表3所示。表3共聚酯分子量测定结果峰值/minmnmwd8.60522.63×1043.30×1041.26由图10及表3,可知,共聚酯数均分子量(mn)为2.63×104,表明pgdl与pcl共聚后分子量较第二章中的均聚pgdl分子量增大,且gpc测定结果仅出现一个单峰,说明共聚酯的分子量分布较均匀。(8)pgdl-cl共聚酯的1hnmr与ftir表征pgdl、pcl及pgdl-cl通过溴化钾压片法测定ftir,具体参见图11和图12,图中,a表示pgdl,b表示pgdl-cl共聚酯。pgdl及共聚酯的1hnmr分析如图11,gdl与cl共聚后,pgdl上的4、5、6、9位与24号位峰重合,峰增强,共聚酯的谱图上在δ1.5及2.3左右出现cl的特征直链c-h峰,c20(δ2.28),c21,23(δ1.50-1.54),c22(δ1.29),c4,5,6,9,24(δ3.36-3.38)。图中标有“﹡”的位移处为残留溶剂峰,thf(δ1.76与δ3.60),dmf(δ2.73与δ2.89)。pcl、pgdl及共聚酯的ftir分析如图12,与pcl及前述pgdl的红外谱图对比,pgdl-pcl在2000cm-1以上高波数区,pgdl的3390cm-1处强宽峰迁移至3423cm-1处,2932cm-1甲基、亚甲基峰由于pcl的存在明显增强,在2000cm-1以下低波数区,1207cm-1处峰增强,可归属到pcl的c-o峰。共聚酯ftir谱图中出现在1652cm-1处的波峰为dmf的羰基峰。由1hnmr及ftir分析可得,gdl与cl发生了共聚,生成共聚产物pgdl-cl。(9)pgdl-cl共聚酯纳米粒在水中分散时的粒径测定共聚酯纳米粒在水中的粒径分布如图13,载药前纳米粒粒径分布x10=127.15nm,x50=150.52nm,x90=177.48nm,多分散指数d=(x90-x10)/x50=0.334。载药后纳米粒粒径分布x10=149.28nm,x50=174.00nm,x90=202.55nm,多分散指数d=0.306。由载药前后粒径分布状态可知,纳米粒粒径分布较均匀,且载药后粒径略有所增大。(10)pgdl-cl共聚酯纳米粒的tem表征由共聚酯纳米粒的粒径分布图13及tem电镜图14,分析可得,纳米粒冷冻干燥后,粒径尺寸有一定程度的缩小,粒径范围在50-110nm,这是由于纳米粒具有亲水性较强的链段pgdl,使其在水中分布时出现吸水膨胀,粒径增大。(11)载药共聚酯纳米粒的体外释放及动力学模型分析①载药量与包封率的测定精密称取载药共聚酯纳米粒10mg在5mldmso中超声分散30min,10000r/min(rcf10280×g)离心30min,取上清液1ml用dmso稀释至10ml,测吸光度a。测得吸光度为0.2933,根据标准曲线方程y=0.0592x-0.002及公式(1)与式(2),得出载药率为2.494%,包封率为52.38%。②载药共聚酯纳米粒的体外释放及动力学模型分析如图15、16与图17,药物的释放曲线较平缓,且释放时间较长。peppas方程中,直线斜率即其释放指数n为0.4867。由药物释放指数0.45<n<0.89,其输送机理遵循非fick传输机理,释放过程中存在着药物的扩散和聚合物链的弛豫的共同作用。对比peppas方程与higuchi方程对药物体外释放的模拟曲线,利福平的释放机制更符合higuchi方程。③药物的平均释放时间(mdt)计算mdt是药物分子在释放之前停留在骨架片中的时间总和除以总分子数,其计算为公式(7):其中,n和k是peppas方程的常数:ln(mt/m∞)=nlnt+lnk公式(8)mt是药物释放在t时刻的累积释放量,m∞是药物释放在t=∞时的累积释放量(最终的累积释放量)。上述公式(8)可改写为lnmt=nlnt+ln(km∞)公式(9)因此,以lnmt对lnt作图,所得截距c(动力学常数)=ln(km∞)。利福平从共聚酯纳米粒中的最终累积释放量m∞=2.38mg,平均释放时间(mdt)、动力学常数(c)和释放指数(n)可以根据公式(7)、(4)、(9)计算得到,结果见表4。可见,利福平的平均释放时间有35.66小时。表4利福平从共聚酯纳米粒中的平均释放时间(mdt)物理量cknmdt/h载药共聚酯纳米粒中利福平释放5.48020.10080.489735.66本实施例在pgdl聚合的基础上,引入可生物降解疏水链pcl链段,形成共聚酯,并在水中自组装成纳米粒,对制备的共聚酯及其纳米粒进行了表征,以利福平为模型药物,研究了在缓冲液中的体外释放动力学。结果表明,pgdl-pcl共聚酯聚合成功,由其形成的纳米粒粒径在50-110nm范围,负载利福平后,其体外释放显示出良好的缓释性能,且平均释放时间达到35h。说明该共聚酯纳米粒为负载难溶性药物提供了较好的载药平台。以上内容是结合本发明创造的优选实施方式对所提供技术方案所作的进一步详细说明,不能认定本发明创造具体实施只局限于上述这些说明,对于本发明创造所属
技术领域:
的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明创造的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1