A21G人胰岛素的热稳定制剂的制作方法
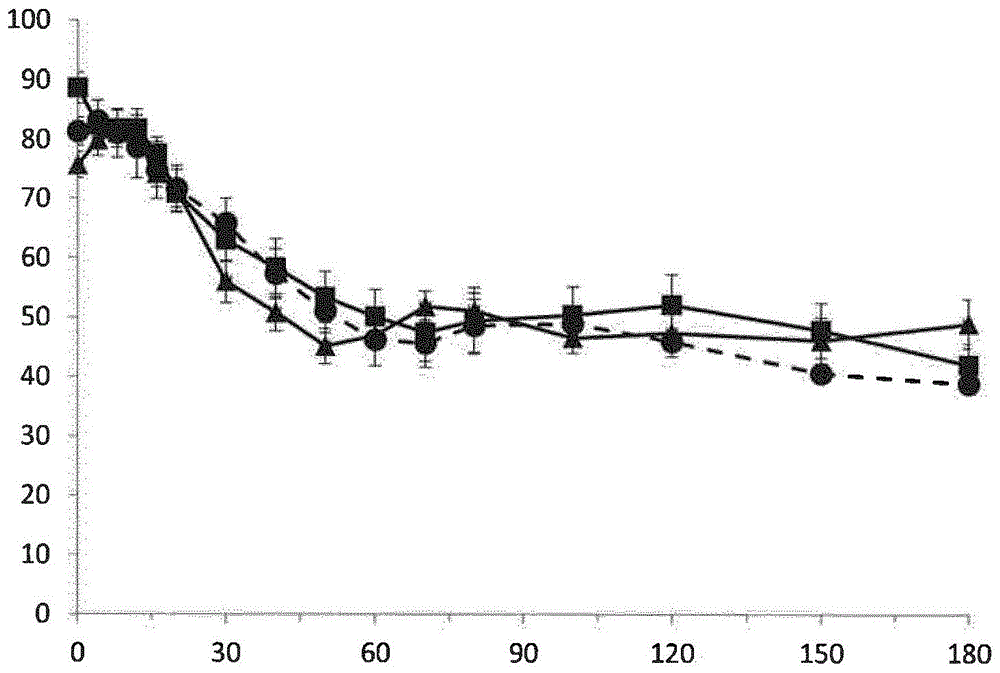
本发明涉及可注射水溶液形式的组合物,其ph为7.2至8.0,其包含至少a21g人胰岛素。所述组合物具有提高的物理和/或化学稳定性,特别是在40和50℃下。自20世纪80年代初以来,通过基因工程产生的人胰岛素及其类似物已彻底改变了需要基于胰岛素治疗的糖尿病患者的治疗。通过选择迅速或基础的胰岛素以及通过选择注射装置(例如预填充笔或泵)可进一步改善顺应性和治疗。在大多数发达国家,获得胰岛素是容易的,并且患有糖尿病的人通常可过“正常”的生活。所有当前销售的胰岛素必须在2至8℃的温度下储存。首次使用之后,大多数胰岛素可在30℃的最高温度下储存约1个月(grajoweretal.diabetescare2003,26,2665-2669)。当使用泵型的注射装置时,包含胰岛素的储器可与温度大于30℃的表面接触。在使用其储器置于皮肤下的可植入泵时,情况尤其如此。本发明旨在解决的问题之一可以是开发热稳定的胰岛素制剂,特别是在高于30℃的温度下,并且特别是在37℃左右的温度下。另外,在世界上的某些地区,一天中平均温度为约25℃,并且可非常经常地超过30℃,并且甚至局部达到40℃至45℃。使用在一些炎热国家中常见的陶制罐使得可将平均温度降低3至8℃,但这通常不足以使基于胰岛素的组合物储存超过一个月(ogleetal.al.diabet.med.2016,33,1544-1553)。因此,在某些情况下,由于胰岛素的价格和维持冷链的问题,其对于部分群体来说难以获得。这在以下地区的情况下尤其明显:所述地区生活水平低、气候炎热甚至热带气候和/或远离受益于使得胰岛素能够良好保存的基础设施的中心地区。因此,待解决的问题之一是:借助于在高温下具有提高的稳定性的胰岛素制剂(特别是与当前销售的胰岛素相比)来改善更多数量患者对胰岛素的获取。如果该制剂可以是便宜的,则也是有利的。在相对长的时间段内热稳定的胰岛素制剂也可用于没有电的区域、战区或自然灾害的情况。已知胰岛素的化学和物理稳定性可部分取决于其一级结构或序列、ph和赋形剂的性质。作为选自商业化产品的实例,可提及以下产品。人胰岛素,在小瓶中销售并在ph7.4下配制,由于其物理上不稳定,因此不可能获得在40℃下稳定3周以上的制剂。因此,在此期间之后,不再遵守欧洲药典对胰岛素的规范。特别地,化学聚集体的水平快速超过2%,并且回收率少于90%。在50℃下,基于化学稳定性,人胰岛素在数天之后不稳定。在50℃下的物理稳定性小于两周。制造商建议将该产品在不超过30℃的温度下储存最多31天。赖脯胰岛素,人胰岛素的类似物并且在ph7.4下配制,其b28位为赖氨酸残基并且b29位为脯氨酸残基,是以名称销售的餐时胰岛素,并且在50℃下物理稳定小于一周。制造商建议将该产品在不超过30℃的温度下储存最多28天。谷赖胰岛素,人胰岛素的类似物并且在ph7.3下配制,其b3位为赖氨酸残基并且b29位为谷氨酸残基,是以名称销售的餐时胰岛素。制造商建议将该产品在不超过25℃的温度下储存最多28天。甘精胰岛素,人胰岛素的类似物并且在ph4.0下配制,其a21位为甘氨酸残基并且b30和b31位为两个精氨酸残基,是以名称销售的基础胰岛素,并且在50℃下物理稳定小于一周。制造商建议将该产品在不超过30℃的温度下储存最多28天。许多研究已经集中于赋形剂在提高包含胰岛素的组合物的稳定性中的作用。更具体地,其描述了锌和防腐剂在这方面可发挥重要作用。有关胰岛素稳定性的综述,可参考brangej.etal.的以下出版物:-insulinstructureandstability.in:wangy.j.,pearlmanr.(eds)stabilityandcharacterizationofproteinandpeptidedrugs.pharmaceuticalbiotechnology,vol5.springer,boston,ma)1993,-chemicalstabiliyofinsulin.1.pharmaceuticalresearch1992,9,715-726,-chemicalstabilityofinsulin.2.pharmaceuticalresearch1992,9,727-734,-chemicalstabilityofinsulin。3。acta.pharm.nord.1992,4,149-158,-chemicalstabilityofinsulin.4.acta.pharm.nord.1992,4,209-222.已知的人胰岛素化学降解途径特别是b3和a21处天冬酰胺的脱酰胺作用、共价聚集体的形成以及二硫键的断裂和重排。这些降解模式至少部分取决于制剂的ph和赋形剂的存在。在酸性ph下,a21处的脱酰胺作用是主要的,而在中性ph下,b3处的脱酰胺作用则更大。关于物理稳定性,已知胰岛素可形成原纤维或聚集体,特别是通过加热或摇动。由于这些原纤维或聚集体可具有免疫原性,因此必须避免它们。在高于30℃的温度下,特别是在40和/或50℃的温度下,在较长的时间段内获得物理和化学稳定的胰岛素是一个挑战,因为化学降解以及原纤维或聚集体的形成归因于不同的现象,其机制、动力学和触发因素并不全是已知的。实际上,即使已知由胰岛素降解产生的主要杂质,也仍然有许多不能确定并且因此由未知机制引起的杂质。理解一些降解模式使得可提供用于提高物理和/或化学稳定性的某些解决方案。然而,迄今为止尚未公开具有实际利益的显著改善,特别是导致在40℃下超过1个月的物理稳定性并且允许至少餐后胰岛素治疗。在这种情况下,将非常令人感兴趣的是在高于30℃的温度(例如40和50℃)下具有良好的物理和/或化学稳定性的餐时胰岛素制剂。特别地,与当前销售的所有产品相比,具有以下特征的“热稳定”餐时胰岛素制剂将是非常有利的产品:-具有在40℃下至少一个月以及在50℃下至少两周的物理和化学稳定性,-与抗微生物防腐剂良好的相容性,-可在小瓶(瓶)和/或药筒中使用,-在相同浓度下与人胰岛素类似的药代动力学谱,以及-容易制备。出乎意料的是,本申请人已经开发了ph为7.2至8.0的包含a21g人胰岛素的可注射水溶液形式的组合物,其具有在40℃下至少3周和/或在50℃下至少一周的物理和/或化学稳定性。应注意,ph值的测量精度为±0.1。根据一个实施方案,组合物的ph为7.2至8.0。根据另一个实施方案,组合物的ph为7.2至7.8。根据又一个实施方案,组合物的ph为7.2至7.6。根据一个实施方案,组合物在40℃下至少一个月(即4周)以及在50℃下至少两周物理和/或化学稳定。根据一个实施方案,组合物在40℃下至少一个月以及在50℃下至少两周物理稳定。根据一个实施方案,组合物在40℃下至少一个月(即4周)以及在50℃下至少两周化学稳定。根据一个实施方案,组合物在40℃下化学稳定至少4周。根据一个实施方案,组合物在40℃下化学稳定至少8周。根据一个实施方案,组合物在40℃下化学稳定至少12周。根据一个实施方案,组合物在50℃下化学稳定至少两周。根据一个实施方案,组合物在40℃下物理稳定至少8周。根据一个实施方案,组合物在40℃下物理稳定至少12周。根据一个实施方案,组合物在40℃下物理稳定至少16周。根据一个实施方案,组合物在50℃下物理稳定至少4周。根据一个实施方案,组合物在50℃下物理稳定至少6周。根据一个实施方案,组合物在50℃下物理稳定至少8周。根据一个实施方案,组合物在50℃下物理稳定至少12周。术语“热稳定制剂”应理解为意指具有在40℃下至少4周以及在50℃下至少2周的物理和化学稳定性的制剂。术语“化学稳定的组合物”应理解为意指其中胰岛素回收率为至少90%并且其中hmwp水平(“聚集体”)小于2%的组合物。术语“物理稳定的组合物”应理解为意指符合欧洲、美国和国际药典中描述的目视检查标准的组合物,即澄清且不包含可见颗粒但也是无色的组合物。术语“可注射水溶液”应理解为意指符合ep和us药典的条件的基于水的溶液。根据本发明的可注射水溶液形式的组合物是澄清溶液。术语“澄清溶液”应理解为意指符合美国和欧洲药典中涉及可注射溶液描述的标准的组合物。在美国药典中,这些溶液在涉及注射(<1>)的<1151>部分中进行了定义(参照根据usp35的<788>,并且在根据usp35的<788>以及在根据usp38的<787>、<788>和<790>usp38(自2014年8月1日起)中规定)。在欧洲药典中,可注射溶液必须符合2.9.19和2.9.20部分中制定的标准。术语“每月”或“一个月”应理解为意指4周的时间。术语“每半月”应理解为意指2周的时间。在实施例中,术语“db3杂质”应理解为意指其中位于b链第三位的天冬酰胺被脱去酰胺基并转化为天冬氨酸的胰岛素。在实施例中,术语“disob3杂质”应理解为意指其中位于b链第三位的天冬酰胺被脱去酰胺基并转化为异天冬氨酸的胰岛素。a21g人胰岛素是具有与人胰岛素相同的序列但是其中a21位的天冬酰胺突变为甘氨酸的胰岛素。换言之,除了a21位之外,该a21g人胰岛素具有与人胰岛素相同的序列,在所述a21位处,甘氨酸残基替换了人胰岛素中存在的天冬酰胺残基。链a的序列为seqidno:1giveqcctsicslyqlenycg,并且链b的序列为seqidno:2fvnqhlcgshlvealylvcgergffytpkt。这种a21g人胰岛素是甘精胰岛素的主要代谢物,以名称(sanofi)销售(bollietal.diabetescare2012,35,2626-2630)。该胰岛素的作用持续时间与人胰岛素类似并且因此可在进餐期间使用,因此它是所谓的“餐时”胰岛素。获得在高于30℃的温度和接近7的ph下与在现有技术中公开的餐时胰岛素相比具有提高的物理和化学稳定性特性的可注射水溶液形式的组合物是引人注目的,因为本领域技术人员公知的是,物理和化学稳定性特性非常难以预测,尤其是在组合的情况下。本发明还涉及包含根据本发明组合物的容器。这些容器可以是小瓶、药筒、预填充注射器和储器。所述容器可被包括或包封在注射笔或胰岛素泵中。本发明还涉及用作药物的组合物。本发明还涉及用于治疗糖尿病的组合物。根据一个实施方案,其是i型糖尿病。根据一个实施方案,其是ii型糖尿病。本发明还涉及包含这样的组合物的药物制剂。本发明还涉及根据本发明组合物的用途。本发明还涉及用于治疗糖尿病的方法,其包括施用根据本发明的组合物。更特别地,本发明涉及方法,其包括施用根据本发明的组合物作为餐时胰岛素。根据一个实施方案,其是旨在治疗人的治疗方法。本发明还涉及旨在用于治疗糖尿病的方法的根据本发明的组合物,其特征在于其在餐前以推注施用。更特别地,本发明涉及旨在用于治疗糖尿病的方法的组合物,其特征在于其作为餐时胰岛素施用。根据一个实施方案,a21g人胰岛素为六聚体形式。在本申请中,100u的a21g人胰岛素对应于3.5mg。在一个实施方案中,a21g人胰岛素的浓度为240至6000μm或40至1000u/ml。在一个实施方案中,a21g人胰岛素的浓度为240至3000μm或40至500u/ml。在一个实施方案中,a21g人胰岛素的浓度为600μm或100u/ml。在一个实施方案中,a21g人胰岛素的浓度为1200μm或200u/ml。在一个实施方案中,a21g人胰岛素的浓度为1800μm或300u/ml。在一个实施方案中,a21g人胰岛素的浓度为2400μm或400u/ml。在一个实施方案中,a21g人胰岛素的浓度为3000μm或500u/ml。在一个实施方案中,a21g人胰岛素的浓度为3600μm或600u/ml。在一个实施方案中,a21g人胰岛素的浓度为4200μm或700u/ml。在一个实施方案中,a21g人胰岛素的浓度为4800μm或800u/ml。在一个实施方案中,a21g人胰岛素的浓度为5400μm或900u/ml。在一个实施方案中,a21g人胰岛素的浓度为6000μm或1000u/ml。在一个实施方案中,根据本发明的组合物还包含锌盐。在一个实施方案中,锌来自zncl2或zno。在一个实施方案中,根据本发明的组合物包含浓度为50至600μm/100ua21g人胰岛素的锌盐。在一个实施方案中,根据本发明的组合物包含浓度为100至500μm/100ua21g人胰岛素的锌盐。在一个实施方案中,根据本发明的组合物包含浓度为150至400μm/100ua21g人胰岛素的锌盐。在一个实施方案中,根据本发明的组合物包含浓度为200至350μm/100ua21g人胰岛素的锌盐。在一个实施方案中,根据本发明的组合物包含浓度为200至300μm/100ua21g人胰岛素的锌盐。在一个实施方案中,根据本发明的组合物包含浓度为230μm/100ua21g人胰岛素的锌盐。在一个实施方案中,根据本发明的组合物还包含至少一种缓冲液。在一个实施方案中,根据本发明的组合物包含选自乙酸钠缓冲液和tris缓冲液(三羟甲基氨基甲烷的缩写)的缓冲液。在一个实施方案中,根据本发明的组合物包含tris缓冲液。在一个实施方案中,三羟甲基氨基甲烷以2至100mm的浓度存在。在一个实施方案中,三羟甲基氨基甲烷以4至80mm的浓度存在。在一个实施方案中,三羟甲基氨基甲烷以5至50mm的浓度存在。在一个实施方案中,三羟甲基氨基甲烷以6至40mm的浓度存在。在一个实施方案中,三羟甲基氨基甲烷以6至20mm的浓度存在。在一个实施方案中,根据本发明的组合物包含精氨酸。在一个实施方案中,精氨酸以5至100mm的浓度存在。在一个实施方案中,精氨酸以10至90mm的浓度存在。在一个实施方案中,精氨酸以20至80mm的浓度存在。在一个实施方案中,精氨酸以30至70mm的浓度存在。在一个实施方案中,精氨酸以40至60mm的浓度存在。在一个实施方案中,根据本发明的组合物包含精氨酸和tris缓冲液。在一个实施方案中,根据本发明的组合物还包含防腐剂。在一个实施方案中,防腐剂是酚类防腐剂。在一个实施方案中,酚类防腐剂选自单独或作为混合物的间甲酚和苯酚。在一个实施方案中,酚类防腐剂的浓度为10至100mm。在一个实施方案中,酚类防腐剂的浓度为15至100mm。在一个实施方案中,酚类防腐剂的浓度为20至75mm。在一个实施方案中,酚类防腐剂的浓度为20至60mm。在一个实施方案中,防腐剂是苯酚。在一个实施方案中,苯酚的浓度为30至75mm。在一个实施方案中,苯酚的浓度为40至60mm。在一个实施方案中,苯酚的浓度为50mm。在一个实施方案中,防腐剂是间甲酚。在一个实施方案中,间甲酚的浓度为15至50mm。在一个实施方案中,间甲酚的浓度为20至30mm。在一个实施方案中,间甲酚的浓度为25mm。在一个实施方案中,组合物包含间甲酚和苯酚的混合物。在一个实施方案中,间甲酚和苯酚的总浓度为20至75mm。根据一个实施方案,组合物不含锌螯合剂。术语“锌螯合剂”应理解为意指能够络合锌的试剂。该试剂对于锌的金属结合稳定性常数logk可以为至少4.5(在25℃下确定)。可使用在“国家标准与技术研究所参考数据库46(nationalinstituteofstandardsandtechnologyreferencedatabase46)(严格选择的金属络合物稳定性常数(criticallyselectedstabilityconstantsofmetalcomplexes))”中列出的金属结合稳定性常数。该数据库列出了在25℃下确定的logk常数。因此,本发明意义内的螯合剂的顺应性可根据在25℃下测量的其对于锌的结合稳定性常数并如该数据库中所述来确定。在锌螯合剂中,可提及多齿有机阴离子。根据一个实施方案,螯合剂选自以下化合物:edta(logk=14.5)、柠檬酸盐(logk=4.93)、egta(logk=12.6)、焦磷酸盐(logk=8.71)和藻酸盐(logk=6.91)。根据另一个实施方案,螯合剂是包含一对自由电子或允许与离子锌相互作用的电子密度的化合物。这样的化合物可以是多齿胺。这些可选自以下化合物:乙二胺、芳族或杂芳族物质,特别是包含咪唑单元的那些,例如组氨酸(logk=6.91)。在一个实施方案中,根据本发明的组合物还包含表面活性剂。在一个实施方案中,表面活性剂选自poloxamer188和聚山梨酯,特别是20(也称为聚山梨酯20)和80(也称为聚山梨酯80)。在一个实施方案中,表面活性剂选自聚山梨酯。在一个实施方案中,聚山梨酯的浓度为4至20μm(4μm≤聚山梨酯浓度≤20μm)。在一个实施方案中,表面活性剂选自20(也称为聚山梨酯20)和80(也称为聚山梨酯80)。在一个实施方案中,表面活性剂是20,也称为聚山梨酯20。在一个实施方案中,20的浓度为4至20μm。在一个实施方案中,20的浓度为5至10μm。在一个实施方案中,20的浓度为8μm。在一个实施方案中,poloxamer188的浓度为0.5至2.5mg/ml。在一个实施方案中,poloxamer188的浓度为0.8至1.6mg/ml。在一个实施方案中,poloxamer188的浓度为1.2mg/ml。根据一个实施方案,组合物不含聚山梨酯80。根据一个实施方案,组合物不含至少一种锌螯合剂和聚山梨酯80。在一个实施方案中,组合物包含20和tris缓冲液。在一个实施方案中,本发明涉及ph为7.2至7.6的可注射水溶液形式的组合物,其包含至少a21g人胰岛素、表面活性剂和缓冲液。根据一个实施方案,它是20和tris缓冲液。在一个实施方案中,本发明涉及ph为7.4的可注射水溶液形式的组合物,其包含至少a21g人胰岛素、表面活性剂和缓冲液。根据一个实施方案,它是20和tris缓冲液。根据本发明的组合物还可包含添加剂,例如张度剂,也称为渗透剂。在一个实施方案中,张度剂选自甘油、氯化钠、甘露醇、海藻糖和甘氨酸。在一个实施方案中,张度剂是甘油。在一个实施方案中,组合物包含渗透剂的浓度为20至500mm。在一个实施方案中,张度剂的浓度为30至400mm。在一个实施方案中,张度剂的浓度为50至250mm。在一个实施方案中,根据本发明的组合物包含3.5mg/ml至10.5mg/ml的a21g人胰岛素、50mm的苯酚、50至250mm的甘油,ph为7.4。该组合物还可包含200至900μm的锌。在一个实施方案中,根据本发明的组合物包含3.5mg/ml的a21g人胰岛素、50mm的苯酚、150至250mm的甘油、10mm的tris缓冲液,ph为7.4。该组合物还可包含200至250μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。在一个实施方案中,根据本发明的组合物包含3.5mg/ml的a21g人胰岛素、50mm的苯酚、50至100mm的甘油、50mm的tris缓冲液,ph为7.4。该组合物还可包含200至250μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。在一个实施方案中,根据本发明的组合物包含7.0mg/ml的a21g人胰岛素、50mm的苯酚、150至250mm的甘油,ph为7.4。该组合物还可包含400至500μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。在一个实施方案中,根据本发明的组合物包含10.5mg/ml的a21g人胰岛素、50mm的苯酚、150至250mm的甘油,ph为7.4。该组合物还可包含600至750μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。在一个实施方案中,根据本发明的组合物包含3.5mg/ml至10.5mg/ml的a21g人胰岛素、25mm的间甲酚、150至250mm的甘油,ph为7.4。该组合物还可包含200至1000μm的锌。在一个实施方案中,根据本发明的组合物包含3.5mg/ml的a21g人胰岛素、50mm的苯酚、150至250mm的甘油、10mm的tris缓冲液,ph为7.4。该组合物还可包含200至250μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。在一个实施方案中,根据本发明的组合物包含3.5mg/ml的a21g人胰岛素、25mm的间甲酚、150至250mm的甘油、10mm的tris缓冲液,ph为7.4。该组合物还可包含200至250μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。在一个实施方案中,根据本发明的组合物包含7.0mg/ml的a21g人胰岛素、25mm的间甲酚、150至250mm的甘油,ph为7.4。该组合物还可包含400至500μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。在一个实施方案中,根据本发明的组合物包含10.5mg/ml的a21g人胰岛素、25mm的间甲酚、150至250mm的甘油,ph为7.4。该组合物还可包含600至750μm的锌。该组合物还可包含聚山梨酯20,特别是8μm的聚山梨酯20,或者poloxamer188,特别是浓度为1.2mg/ml的poloxamer188。根据一个实施方案,上述组合物包含聚山梨酯20,特别是8μm的聚山梨酯20。在一个实施方案中,本发明涉及可注射水溶液形式的组合物,其包含至少a21g人胰岛素和glp-1受体激动剂或glp-1类似物。在一个实施方案中,glp-1、glp-1类似物或glp-1ra选自艾塞那肽(astra-zeneca)、利西那肽(lixisenatide)(sanofi)、其类似物或衍生物及其可药用盐。分别在申请us2004/0023871和wo0104156中公开的艾塞那肽和利西那肽通常被认为是glp-1受体激动剂。在一个实施方案中,glp-1、glp-1类似物或glp-1ra是艾塞那肽或其类似物或衍生物及其可药用盐。在一个实施方案中,glp-1、glp-1类似物或glp-1ra是利西那肽或其类似物或衍生物及其可药用盐。一个实施方案中,本发明涉及ph为7.2至8.0的可注射水溶液形式的组合物,其包含至少a21g人胰岛素和glp-1受体激动剂或glp-1类似物。根据一个实施方案,所述glp-1受体激动剂是艾塞那肽。根据另一个实施方案,所述glp-1受体激动剂是利西那肽。在一个实施方案中,本发明涉及ph为7.2至7.6的可注射水溶液形式的组合物,其包含至少a21g人胰岛素和glp-1受体激动剂或glp-1类似物。根据一个实施方案,所述glp-1受体激动剂是艾塞那肽。根据另一个实施方案,所述glp-1受体激动剂是利西那肽。在一个实施方案中,本发明涉及ph为7.4的可注射水溶液形式的组合物,其包含至少a21g人胰岛素和glp-1受体激动剂或glp-1类似物。根据一个实施方案,所述glp-1受体激动剂是艾塞那肽。根据另一个实施方案,所述glp-1受体激动剂是利西那肽。在一个实施方案中,组合物还包含烟碱化合物或其衍生物。在一个实施方案中,组合物包含烟酰胺。在一个实施方案中,烟酰胺的浓度为10至160mm。在一个实施方案中,烟酰胺的浓度为20至150mm。在一个实施方案中,烟酰胺的浓度为40至120mm。在一个实施方案中,烟酰胺的浓度为60至100mm。在一个实施方案中,药物组合物还包含至少一种吸收促进剂,其选自单独或作为混合物的吸收促进剂、扩散促进剂或血管扩张剂。吸收促进剂包括但不限于单独或组合的:表面活性剂,例如胆盐、脂肪酸盐或磷脂;烟碱剂,例如烟酰胺(nicotinamide)、烟酸(acidenicotinique)、烟酸(niacine)、烟酰胺(niacinamide)、维生素b3及其盐;胰腺胰蛋白酶抑制剂;镁盐;多不饱和脂肪酸;二癸酰基磷脂酰胆碱;氨基聚羧酸盐;托美汀(tolmétine);癸酸钠;水杨酸;油酸;亚油酸;二十碳五烯酸(epa);二十二碳六烯酸(dha);苯甲酸;一氧化氮供体,例如3-(2-羟基-1-(1-甲基乙基)-2-亚硝基肼基)-1-丙胺、n-乙基-2-(1-乙基-羟基-2-1-亚硝基肼基)乙胺、或s-亚硝基-n-乙酰青霉胺;胆汁酸,与胆汁酸缀合形式的甘氨酸;抗坏血酸钠、抗坏血酸钾;水杨酸钠、水杨酸钾、乙酰水杨酸、水杨酰水杨酸、乙酰水杨酸铝、水杨酸胆碱、水杨酰胺、赖氨酸乙酰水杨酸;依沙酰胺(exalamide);二氟尼柳;乙水杨胺;edta。在一个实施方案中,药物组合物还包含至少一种扩散促进剂。扩散促进剂的一些实例包括但不限于糖胺聚糖酶,例如透明质酸酶。在一个实施方案中,药物组合物还包含至少一种血管扩张剂。在一个实施方案中,药物组合物还包含至少一种通过阻断钙离子通道而引起超极化的血管扩张剂。在一个实施方案中,通过阻断钙离子通道而引起超极化的血管扩张剂是腺苷、内皮来源的超极化剂、5型磷酸二酯酶(pde5)抑制剂、钾通道开放剂、或其任意组合。在一个实施方案中,药物组合物还包含至少一种camp介导的血管扩张剂。在一个实施方案中,药物组合物还包含至少一种cgmp介导的血管扩张剂。在一个实施方案中,药物组合物还包含至少一种血管扩张剂,其选自包含以下的组:通过阻断钙离子通道而引起超极化来发挥作用的血管扩张剂、camp介导的血管扩张剂和cgmp介导的血管扩张剂。所述至少一种血管扩张剂选自包含单独或组合的以下的组:一氧化氮供体,例如硝化甘油、二硝酸异山梨酯、单硝酸异山梨酯、硝酸戊酯、赤藓醇基、四硝酸酯和硝普盐(nitroprussiate);前列环素及其类似物,例如依前列醇钠、伊洛前列素、依前列醇、曲前列环素或赛乐西帕(selexipag);组胺、2-甲基组胺、4-甲基组胺;2-(2-吡啶基)乙胺、2-(2-噻唑基)乙胺;罂粟碱、盐酸罂粟碱;米诺地尔;双嘧达莫、肼屈嗪;腺苷、三磷酸腺苷;尿苷三磷酸;gplc;l-肉碱;精氨酸;前列腺素d2;钾盐;以及在一些情况下,α1和α2受体拮抗剂,例如哌唑嗪、酚苄明、酚妥拉明、地苯那明(dibénamine)、盐酸莫西赛利(chlorhydratedemoxisylyte)和妥拉唑林(tolazoline);倍他唑、达美酮(dimaprit);β2受体激动剂,例如异丙肾上腺素、多巴酚丁胺、沙丁胺醇、特布他林、氨茶碱、茶碱、咖啡因;前列地尔、安贝生坦;卡麦角林;二氮嗪;甲磺酸双肼屈嗪(mesilatededihydralazine);盐酸地尔硫(chlorhydratedediltiazem);依洛昔酮(énoximone);盐酸氟桂利嗪(chlorhydratedeflunarizine);银杏叶提取物;左西孟旦;吗多明;草酸萘呋胺(oxalateacidedenaftidrofuryl);尼可地尔;己酮可可碱;酚苄明氯化物(chloruredephenoxybenzamine);吡贝地尔碱(piribédilbase);甲磺酸吡贝地尔(mesilatedepiribédil);瑞加德松一水合物(regadenosonmonohydrate);利奥西呱(riociguat);枸橼酸西地那非、他达拉非、三水合盐酸伐地那非(chlorhydratetrihydratédevardenafil);盐酸曲美他嗪(chlorhydratedetrimetazidine);三硝酸甘油酯(trinitrine);盐酸维拉帕米(chlorhydratedevérapamil);内皮素受体拮抗剂,例如阿伐那非(avanafil)和波生坦一水合物(bosentranmonohydrate);以及钙通道阻滞剂,例如氨氯地平、阿雷地平、阿折地平、巴尼地平(barnidipine)、贝尼地平(benidipine)、西尼地平、氯维地平、伊拉地平(isradipine)、依福地平(efonidipine)、非洛地平、拉西地平、乐卡地平、马尼地平(manidipine)、尼卡地平、硝苯地平、尼伐地平、尼莫地平、尼索地平、尼群地平、普拉地平(prandipine)。根据本发明的组合物还可包含根据药典(特别是ep和/或us)并且与以通常浓度使用的胰岛素相容的所有赋形剂。根据一个实施方案,组合物可以为固体或冻干形式。然后可将该组合物用于重构溶液或制剂。考虑的施用方式是通过静脉内、皮下、皮内或肌内途径。根据一个特别的实施方案,施用方式是皮下途径。还考虑了经皮、经口、鼻、阴道、眼、含服、肺施用途径。本发明还涉及包含根据本发明组合物的泵,其可被植入或运输。本发明还涉及根据本发明组合物旨在置于可植入或可运输的泵中的用途。在一个实施方案中,泵是皮肤下的可植入泵。在这些泵中,可提及允许通过腹膜内途径施用胰岛素的泵。在一个实施方案中,腹膜内递送根据本发明组合物的泵是minimedmedtronicmip2007泵。本发明还涉及单剂量制剂。在一个实施方案中,制剂为可注射溶液的形式。根据本发明组合物的制备具有能够通过简单地将为水溶液或冻干形式的a21g人胰岛素混合来进行的优点。在赋形剂(例如甘油、间甲酚和/或苯酚、氯化锌、和聚山梨酯20(20))中调整混合物的组成。该添加可通过添加所述赋形剂的浓缩溶液来进行。在一个实施方案中,组合物的特征在于所述组合物在ph7.4下是澄清的,并且具有在40℃下至少一个月的物理和化学稳定性。在一个实施方案中,组合物的特征在于所述组合物的物理和化学稳定性大于商业化餐时胰岛素的物理和化学稳定性。胰岛素和胰岛素类似物可通过重组dna技术的方法在细菌(例如大肠杆菌(escherichiacoli))或在酵母(例如酿酒酵母(saccharomycescerevisiae))中获得(参见,例如,g.walshappl.microbiol.biotechnol.2005,67,151-159)。通常,产生胰岛素原,然后将其用酶(例如胰蛋白酶和羧肽酶b)消化以获得期望的序列。为了制备a21g人胰岛素,对胰岛素原编码以在a21处具有甘氨酸,并且在用胰蛋白酶和羧肽酶b消化之后,获得期望的胰岛素。kohnetal在peptides2007,28,935-948中描述了操作方法。在一个实施方案中,根据本发明组合物的特征在于a21g胰岛素获自a21g人胰岛素、b31r、b32r(甘精胰岛素)。在一个实施方案中,根据本发明组合物的特征在于a21g胰岛素获自a21g人胰岛素、b31r、b32r(甘精胰岛素),其与大鼠羧肽酶b以500至2000的胰岛素/羧肽酶比在7.5至8.5的ph下并且在20至30℃的温度下反应10至20小时。然后可将产物进行纯化。该纯化可通过液相色谱进行。因此,用于制备a21g人胰岛素的途径可以是通过用羧肽酶b消化从甘精胰岛素中除去两个精氨酸。酶消化之后,a21g人胰岛素可通过色谱进行纯化,然后通过常规方法通过冻干或通过结晶来分离。附图说明图1表示组合物b5-1在t0周(即在4℃下储存)和在t12周(组合物b5-1在40℃下“老化”12周)以及组合物b4(人胰岛素的商业化制剂)的药效学。在该图中,x轴代表注射之后的时间(以分钟计),并且y轴代表血液血糖(以mg/dl计)。图1:图1中示出了与用组合物b4(参考人胰岛素)(用圆以虚线绘制的曲线)获得的药效学结果相比,用在t0周(用正方形绘制的曲线)和在40℃下t12周(用三角形绘制的曲线)施用的组合物b5-1获得的药效学结果。以下实施例以非限制性方式举例说明本发明。实施例a化学实施例a1:a21g人胰岛素(a21g胰岛素)的制备在ph8.0(通过添加三羟甲基氨基甲烷缓冲液调节的ph)下将甘精胰岛素(5g;gan&leepharmaceuticals)与酶羧肽酶b(参考08039852001;sigma-aldrich)以1∶500的比例(w/w)混合。最终的甘精胰岛素浓度为约4mg/ml。在25℃下将溶液在温和搅拌下放置17小时。然后将混合物通过液相色谱纯化,针对0.01n盐酸进行透析,然后冻干。获得纯度为98%并且产率为约90%的a21g人胰岛素。通过质谱(maldi-tof)测量的a21g胰岛素的摩尔质量为5752da。b组合物实施例b2:100u/ml的迅速胰岛素类似物组合物该组合物是由elililly以名称销售的商业化赖脯胰岛素溶液。该产品是迅速胰岛素类似物。中的赋形剂为间甲酚(3.15mg/ml)、甘油(16mg/ml)、磷酸二钠(1.88mg/ml)、氧化锌(以获得0.0197mg锌离子/ml)、用于ph调节(ph7至7.8)的氢氧化钠和盐酸、以及水。实施例b3:100u/ml的慢速胰岛素类似物组合物该组合物是由sanofi以名称销售的商业化甘精胰岛素溶液。该产品是慢速胰岛素类似物。中的赋形剂为氯化锌(30μg/ml)、间甲酚(2.7mg/ml)、甘油(20mg/ml)、聚山梨酯20(16μm)、用于ph调节(ph4)的氢氧化钠和盐酸、以及水。实施例b4:100iu/ml的人胰岛素(r)组合物该组合物是由elililly以名称r销售的商业化人胰岛素溶液。该产品是人胰岛素。r的赋形剂是甘油、间甲酚、用于ph调节(ph7.0至7.8)的氢氧化钠和盐酸、以及水。实施例b5:浓度为100至300u/ml的a21g胰岛素和赋形剂的组合物的制备根据以下方案制备a21g人胰岛素组合物。由实施例a1中获得的冻干物和ph调节所需量的氢氧化钠或盐酸来制备ph为7.3±0.2的a21g人胰岛素的水溶液。将该溶液添加至赋形剂(氯化锌、防腐剂、渗透剂、三羟甲基氨基甲烷、精氨酸)的浓缩溶液的混合物。然后将表面活性剂溶液添加至混合物。测量ph,并且(如果有必要的话)通过添加氢氧化钠或盐酸的浓缩溶液将ph调节至7.1±0.1至8.0±0.1。获得不包含可见颗粒的澄清溶液。该检查是根据欧洲药典(ep2.9.20)和美国药典(usp<790>)的建议进行的。防腐剂是苯酚(25至50mm)或间甲酚(25mm)。选择储备溶液的浓度以便在最终组合物中获得0至50mm的三羟甲基氨基甲烷浓度和/或0至50mm的精氨酸浓度。选择渗透剂储备溶液(在此为甘油)的浓度,以便在最终组合物中获得50至210mm的甘油浓度。在最终组合物中使用的表面活性剂可以是浓度为至少8μm的20或浓度为1.2mg/ml的188。a21g人胰岛素ciha21g的浓度为100至300u/ml。氯化锌浓度(μm)对应于a21g人胰岛素浓度(u/ml)的2至3倍,即czncl2(μm)=2至3ciha21g(u/ml)。这些组合物在下表1中给出。实施例b6:浓度为100至300u/ml(对应于3.5至10.5mg/ml)的a21g人胰岛素和赋形剂的组合物(ph4)的制备根据实施例b5中所述的方案,从由实施例a1中获得的冻干物和使得能够调节ph的量的氢氧化钠或盐酸制备的ph为4.0±0.2的a21g人胰岛素的水溶液来产生这些组合物。在最终组合物中三羟甲基氨基甲烷的浓度为0至50mm。其他赋形剂的浓度类似于实施例b5中提到的那些。这些组合物在下表1中给出。表1:根据方案b5(b5-1至b5-13)和b6(b6-1至b6-3)制备的a21g胰岛素组合物c稳定性实施例c1:与小瓶中浓度为100u/ml的商业化胰岛素相比,制备的组合物在50℃下物理稳定性的研究。将至少五个装有1ml组合物的3-ml小瓶垂直放置在维持在50℃下的烘箱中。至少每周对小瓶进行对于可见颗粒或浑浊的出现的目视检查。该检查根据欧洲药典(ep2.9.20)和美国药典(usp<790>)的建议进行:对小瓶进行至少2000lux的光照并在白色背景和黑色背景下进行观察。稳定性的周数对应于在检查中至少一半的小瓶保持澄清并且不包含可见颗粒的时间。用不同组合物获得的物理稳定性结果在下表中给出。表2:组合物b5-1至b5-3、b5-9、b5-12、b6-1至b6-3和b2至b4在50℃下物理稳定性研究的结果。ph为4.0的人胰岛素组合物a21g(b6-1至b6-3)和商业化制剂(b2至b4)在50℃下的稳定性低于ph为7.4的包含a21g人胰岛素的组合物(b5-1至b5-3、b5-9和b5-12)。这些组合物(b5-1至b5-3、b5-9和b5-12)使得可获得在50℃下至少6周的物理稳定性。实施例c2:在40℃和50℃下的化学稳定性研究将下表中给出的组合物置于维持在40℃或50℃下的烘箱中。在40℃下4、8、12周和在50℃下2周对组合物进行分析。在每个时间间隔结束时,通过用c18柱和在存在庚烷磺酸钠的情况下的磷酸盐/乙腈缓冲液洗脱梯度的rp-hlpc-uv(214nm)对样品进行分析,以表面百分比来确定脱去酰胺基的产物db3/disob3以及其他杂质(指定为总杂质)的比例。在每个时间间隔结束时,还通过用覆盖有孔的硅胶柱和水/乙腈/三氟乙酸流动相的se-hplc-uv(276nm)对样品进行分析,以表面百分比来确定高分子量产物(hmwp)的比例。结果在下表中以百分比给出。表3:溶液b5-1至b5-3、b5-9和b5-12以及商业化人胰岛素组合物r的化学稳定性结果“*”“总杂质”意指除db3/disob3和hmwp之外的所有杂质“-”意指未测量到在40℃下4、8、12周之后和在50℃下2周之后对商业化组合物r(b4)进行分析。在这些时间间隔时,该组合物在物理稳定性(参见以上)方面或在杂质的百分比方面均不再符合欧洲药典的规范。制剂b5-1至b5-3、b5-9和b5-12则稳定得多。实施例c3:ph对包含a21g人胰岛素的组合物的物理和化学稳定性的作用除ph之外,制剂b5-4至b5-7具有与制剂b5-1相同的组成。表4:ph对溶液b5-4至b5-7的物理和化学稳定性的作用结果“*”“总杂质”意指除db3/disob3和hmwp之外的所有杂质“-”意指未测量到组合物在7.2至8.0之间具有良好的稳定性。应注意,在ph范围为7.2至7.5的情况下获得在40℃下甚至更好的稳定性。实施例c4:ph为7.4的100和300u/ml(即3.5和10.5mg/ml)的a21g人胰岛素的物理和化学稳定性表5:100和300u/mla21g胰岛素的组合物(b5-3和b5-8)在50℃下的物理稳定性的结果。表6:100和300u/mla21g胰岛素的组合物(b5-3和b5-8)在40和50℃下的化学稳定性的结果。“*”“总杂质”意指除db3/disob3和hmwp之外的所有杂质结果在下表中以百分比表示。以上给出的结果显示,组合物b5-8(u300)具有良好的物理稳定性和优异的化学稳定性。实施例c5:药筒(3ml)中的100和300u/ml(即3.5和10.5mg/ml)a21g人胰岛素在40℃下的物理和化学稳定性将a21g人胰岛素的组合物b5-1和b5-13插入3-ml药筒中,并在静态条件下置于40℃的烘箱中。每两周对药筒进行对于可见颗粒或浑浊的出现的目视检查。该检查根据欧洲药典(ep2.9.20)和美国药典(usp<790>)对小瓶中溶液描述的建议进行。因此,对药筒进行至少2000lux的光照并在白色背景和黑色背景下进行观察。稳定性的周数对应于在检查中至少一半的药筒保持澄清并且不包含可见颗粒的时间。在40℃下4、8、12周对药筒进行分析。在每个时间间隔结束时,取药筒并通过用c18柱和在存在庚烷磺酸钠的情况下的磷酸盐/乙腈缓冲液洗脱梯度的rp-hlpc-uv(214nm)对等分试样进行分析,以表面百分比来确定脱去酰胺基的产物db3/disob3以及其他杂质(指定为总杂质)的比例。在每个时间间隔结束时,还通过用覆盖有孔的硅胶柱和水/乙腈/三氟乙酸的流动相的se-hplc-uv(276nm)对等分试样进行分析,以表面百分比来确定高分子量产物(hmwp)的比例。结果在下表中以百分比给出。表6a:100和300u/mla21g胰岛素的组合物(b5-1和b5-13)在40℃下的物理稳定性的结果。组合物a21g胰岛素(mg/ml)40℃b5-13.512周无颗粒b5-1310.510周无颗粒表6b:溶液b5-1和b5-13的化学稳定性的结果。“*”“总杂质”意指除db3/disob3和hmwp之外的所有杂质结果在下表中以百分比表示。以上给出的结果显示,组合物b5-1(u100)和b5-13(u300)具有优异的物理和化学稳定性。d药效学实施例d1:用于测量胰岛素溶液的药效学的方案在实验开始之前2.5小时,将预先在颈静脉插入导管的约50kg的家猪禁食。在胰岛素注射之前的一小时内,采集3个血液样品以确定基础葡萄糖水平。使用配备有31g针的胰岛素笔(novo、sanofi或lilly)在动物的胁腹皮下进行0.2iu/kg剂量的胰岛素m1或人胰岛素制剂的注射。然后在以下时间采集血液样品:4、8、12、16、20、30、40、50、60、70、80、100、120、150和180分钟。在每次采样之后,用稀肝素溶液清洗导管。取一滴血液以使用血糖仪确定血糖水平。然后绘制以mg/dl表示的平均血糖曲线。实施例d2:在零时间(t0,即储存在4℃)和在40℃下12周之后的胰岛素溶液a21gb5-1以及人胰岛素溶液的药效学结果。表7:用于药效学的组合物组合物a21g人胰岛素(u/ml)人胰岛素(u/ml)猪的数目b5-1100-12b4-10011用组合物b5-1获得的药效学结果在图1中示出。对这些曲线的分析表明,用在t0周(用正方形绘制的曲线)和在40℃下t12周(用三角形绘制的曲线)施用的组合物b5-1获得了类似的降血糖作用。另一方面,在t0或在40℃下t12周施用的组合物b5-1具有与用组合物b4(参考人胰岛素)(用圆以虚线绘制的曲线)获得的类似的降血糖作用。序列表<110>adocia<120>a21g胰岛素的热稳定制剂<130>b1458pc00<150>fr1856479<151>2018-07-13<160>2<170>bissap1.3.6<210>1<211>21<212>prt<213>智人(homosapiens)<400>1glyilevalgluglncyscysthrserilecysserleutyrglnleu151015gluasntyrcysgly20<210>2<211>30<212>prt<213>智人<400>2phevalasnglnhisleucysglyserhisleuvalglualaleutyr151015leuvalcysglygluargglyphephetyrthrprolysthr202530当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1