靶向LUCAT1的反义寡核苷酸及在癌症治疗中的应用的制作方法
expression.oncotarget,8(17),28297-28311.doi:10.18632/oncotarget.16044
13.thai,et.al.(2013).characterization of a novel long noncoding rna,scal1,induced by cigarette smoke and elevated in lung cancer cell lines.american journal of respiratory cell and molecular biology,49(2),204-211.
14.zheng et al.(2019).long non-coding rna lucat1/mir-5582-3p/tcf7l2 axis regulates breast cancer stemness via wnt/beta-catenin pathway.j exp clin cancer res,38(1), 305.
15.zhou et al.,(2019).lucat1 promotes colorectal cancer tumorigenesis by targeting the ribosomal protein l40-mdm2-p53 pathway through binding with uba52.cancer science, 110(4),1194-1207.
16.sun y et.al.,(2017).long non-coding rna lucat1 is associated with poor prognosis in human non-small lung cancer and regulates cell proliferation via epigenetically repressing p21 and p57 expression.oncotarget.8(17):28297-28311.
17.jung-hoyoon et.al.(2018).the long noncoding rna lucat1 promotes tumorigenesis by controlling ubiquitination and stability of dna methyltransferase 1in esophageal squamous cell carcinoma.cancer letters,volume 417,pages 47-57
技术实现要素:
18.发明要解决的问题
19.基于现有技术存在的缺陷,本公开的目的之一是制作一个能高效的降细胞中lucat1,从而实现抗癌效果的药物。在一个具体的实施方式中,所述药物中含有aso作为活性成分。在另一个具体的实施方式中,所述药物中含有如seq id no:4-6中的任一序列所述的aso作为活性成分。
20.本公开的另一目的是提供一种治疗癌症的方法,所述方法施用一种药物用于治疗癌症,所述药物含有aso作为活性成分。在另一个具体的实施方式中,所述药物中含有如 seq id no:4-6中的任一序列所述的aso作为活性成分。
21.用于解决问题的方案
22.本公开涉及的技术方案如下。
23.(1)反义寡核苷酸在制备用于治疗或预防癌症的药物中的应用,其中,所述反义寡核苷酸靶向lucat1。
24.(2)根据权利要求1所述的应用,其中,所述反义寡核苷酸选自由如下(i)-(ii) 任一项所组成的组:
25.(i)如seq id no:4-6中任一项所示的序列编码的反义寡核苷酸;
26.(ii)能够和如(i)所示的序列在高严格性或非常高的严格性条件下杂交的序列的互补序列编码的反义寡核苷酸。
27.(3)根据(1)-(2)任一项所述的应用,其中,所述反义寡核苷酸具有至少一个修饰;
可选的,所述修饰选自核苷间键修饰、甲基化修饰或胆固醇修饰中的一种或多种;优选的,所述核苷间键修饰为硫代磷酸酯键修饰。
28.(4)根据(1)-(3)任一项所述的应用,其中,所述癌症选自黑素瘤、肉瘤、淋巴瘤、脑癌、乳癌、肝癌、胃癌、肺癌、结肠癌;优选的,所述癌症选自肝细胞癌。
29.(5)一种核苷酸,其中,所述核苷酸选自由如下(i)-(ii)任一项所组成的组:
30.(i)如seq id no:4-6中任一项所示的序列编码的核苷酸;
31.(ii)能够和如(i)所示的序列在高严格性或非常高的严格性条件下杂交的序列的互补序列编码的核苷酸。
32.(6)根据(5)所述的核苷酸,其中,所述核苷酸具有至少一个修饰;可选的,所述修饰选自核苷间键修饰、甲基化修饰或胆固醇修饰中的一种或多种;优选的,所述核苷间键修饰为硫代磷酸酯键修饰。
33.(7)一种药物组合物,其中,所述组合物包含根据(5)-(6)任一项所述的核苷酸。
34.(8)根据(7)所述的药物组合物,其中,所述核苷酸为所述药物组合物的活性成分;可选的,所述核苷酸存在于脂质体中或连接到药学上可接受的载体上。
35.(9)一种缓慢持续杀伤细胞的方法,包括将所述细胞与(5)-(6)任一项所述的核苷酸或(7)-(8)所述的药物组合物接触。
36.(10)根据(9)所述的方法,其中,所述细胞选自增生性的、瘤性的、前癌性的或转移性的细胞;优选的,所述细胞选自转移性的细胞;更优选的,所述转移性的细胞选自转移性的肿瘤细胞。
37.(11)根据(9)-(10)任一项所述的方法,其中,(5)-(6)任一项所述的核苷酸或(7)-(8)任一项所述的药物组合物可以通过口服、腹膜内、静脉内、动脉内、肌肉内、皮内、皮下、经皮、鼻腔、经直肠,肿瘤体内注射、肿瘤腔内留置、神经鞘内注射、蛛网膜下腔注射或系统性施用;可选的,所述系统性施用包括通过血管内施用;优选的,所述血管内施用选自注射、灌注。
38.(12)根据(9)-(11)任一项所述的方法,所述方法进一步包括施用第二抗癌疗法;优选的,所述第二种抗癌疗法可以是化学疗法、放射疗法、免疫疗法、手术疗法或上述疗法的一种或多种的组合。
39.(13)一种治疗或预防癌症的方法,其中,给受试者施用如(5)-(6)任一项所述的核苷酸或(7)-(8)所述的药物组合物。
40.(14)根据(13)所述的方法,其中,所述癌症选自黑素瘤、肉瘤、淋巴瘤、脑癌、乳癌、肝癌、胃癌、肺癌、结肠癌;优选的,所述癌症选自肝细胞癌。
41.(15)根据(13)-(14)任一项所述的方法,其中,(5)-(6)任一项所述的核苷酸或(7)-(8)任一项所述的药物组合物可以通过口服、腹膜内、静脉内、动脉内、肌肉内、皮内、皮下、经皮、鼻腔、经直肠,肿瘤体内注射、肿瘤腔内留置、神经鞘内注射、蛛网膜下腔注射或系统性施用;可选的,所述系统性施用包括通过血管内施用;优选的,所述血管内施用选自注射、灌注。
42.(16)根据(13)-(15)任一项所述的方法,所述方法进一步包括施用第二抗癌疗法;优选的,所述第二种抗癌疗法可以是化学疗法、放射疗法、免疫疗法、手术疗法或上述疗法的一种或多种的组合。
43.发明的效果
44.在一个实施方式中,本公开的反义寡核苷酸能够通过高效地清除癌细胞中的lucat1,进而达到良好的抗癌效果。
45.在一个实施方式中,本公开的反义寡核苷酸能够通过清除癌细胞中50%以上的 lucat1,进而达到良好的抗癌效果。
46.在一个优选的实施方式中,本公开的反义寡核苷酸能够通过清除癌细胞中80%以上的lucat1,进而达到良好的抗癌效果。
附图说明
47.图1示出了针对lucat1的三种sirna的敲低(knock down)百分比。
48.图2示出的针对lucat1的三种aso的敲低(knock down)百分比。
49.图3示出了抗-lucat1 aso可明显抑制细胞增殖。
50.图4示出了抗-lucat1 aso在动物实验中的结果(肿瘤体积)。
51.图5示出了抗-lucat1 aso在动物实验中的结果(血清中afp含量)。
52.图6示出了在动物实验中,抗-lucat1 aso对肿瘤组织中lucat1表达水平的影响。
具体实施方式
53.定义
54.在本公开的权利要求和/或说明书中,词语“一(a)”或“一(an)”或“一(the)”可以指“一个”,但也可以指“一个或多个”、“至少一个”以及“一个或多于一个”。
55.如在权利要求和说明书中所使用的,词语“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。与此同时,“包含”、“具有”、“包括”或“含有”也可以表示封闭式的,排除额外的、未引述的元件或方法步骤。
56.在本公开中,术语“约”表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。
57.虽然所公开的内容支持术语“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
58.本公开中,术语“小分子干扰核糖核酸(sirna)”也被称为短干扰rna或沉默rna,是一类双链rna分子,长度为20-25个碱基对,类似于mirna,并且在rna干扰(rnai) 途径内操作。它干扰了表达与互补的核苷酸序列的特定基因的转录后降解的mrna,从而防止翻译。
59.在本公开中,术语“反义寡核苷酸(aso)”表示体内表达的或人工合成的,与靶基因或mrna某一区段互补的核酸片断,可以通过碱基互补原则结合于靶基因/mrna上,从而封闭基因的表达。
60.本公开使用的术语“癌症”包括任何癌症,包括但不限于黑素瘤、肉瘤、淋巴瘤、癌(例如脑癌、乳癌、肝癌、胃癌、肺癌和结肠癌)及白血病。
61.本公开使用的术语“预防”、“治疗”或这些术语的任何变形,包括为实现期望结果 (例如癌症治疗)的任何可测量的减少或完全抑制。期望结果包括但不限于癌症或增生性病症或癌症相关症状的缓解、降低、减慢或根除,以及改善的生活质量或生命延长。
62.在一些技术方案中,本公开涉及用于限定两个多核苷酸互补程度的杂交条件严格
(current protocols in molecular biology,wiley出版)”,“分子克隆实验指南(molecular cloning:a laboratory manual,冷泉港实验室出版)”等公开出版物中记载的相应方法。
71.本公开中的反义寡核苷酸的合成方法没有特别限定,可使用已知的寡核苷酸合成仪,例如通过phosphoroamidite法,硫代磷酸酯法,磷酸三酯法等方法进行合成。
72.在本公开的一种实施方式中,反义寡核苷酸包括含有修饰的骨架或非天然的核苷间键的寡核苷酸。如本说明书所确定的,具有修饰的骨架的寡核苷酸包括在骨架中保留了磷原子的那些寡核苷酸和骨架中不含有磷原子的那些寡核苷酸。为了本说明书的目的,以及如本领域有时所引用的,核苷间骨架中不含有磷原子的修饰的寡核苷酸也可被看作是寡核苷。
73.在本公开的一种实施方式中,修饰的寡核苷酸骨架包括,例如,硫代磷酸酯 (phosphorothioate),手性硫代磷酸酯,二硫代磷酸酯,磷酸三酯,氨烷基磷酸三酯,甲基和其它烷基磷酸酯,包括3
′-
烯烃基磷酸酯和手性磷酸酯,膦,氨基磷酸酯,包括3
′ꢀ-
氨基磷酸酯和氨烷基氨基磷酰酯,硫羰氨基磷酸酯,硫羰烷基磷酸酯,硫羰烷基磷酸三酯,和具有正常3
′-5′
键的硼烷基磷酸酯,其2
′-5′
连接的类似物,以及具有反转极性,其中相邻配对核苷单位为3
′-5′
至5
′-3′
或2
′-5′
至5
′-2′
连接。还包括多种盐,混合盐和游离酸形式。
74.在本公开的一种实施方式中,不包括磷原子的优选修饰的寡核苷酸骨架为由短链烷基或环烷基核苷间键,混合的杂原子和烷基或环炔基核苷间键,或一个或多个短链杂原子或杂环核苷间键形成的骨架。它们包括含有吗啉代键(由核苷的糖部分部分形成的);硅氧烷骨架;硫化物,亚砜和砜骨架;甲酰乙酰基和硫代甲酰乙酰基骨架;亚甲基甲酰乙酰基和硫代甲酰乙酰基骨架;包含烯的骨架;氨基磺酸酯骨架;亚甲基亚胺基和亚甲基肼基骨架;磺酸酯和氨苯磺胺骨架;酰胺骨架;和含有混合的n,o,s和ch2构成部分的骨架的那些骨架。
75.在其它优选的寡核苷酸模拟物中,糖和核苷间键,亦即,核苷酸单位的骨架被新基团取代。碱基单位被保留以便与适宜的核酸靶化合物杂交。一种所述寡聚化合物,已显示出具有优良杂交特性的寡核苷酸模拟物,被称为核酸肽(pna)。在pna化合物中,寡核苷酸的糖骨架被包含胺酰胺的骨架,特别是氨基乙基甘氨酸骨架置换。核碱基被保留,并直接或间接与骨架的酰胺部分的氮杂氮原子结合。
76.本公开优选的实施方案是具有硫代磷酸酯骨架的寡核苷酸和具有杂原子骨架的寡核苷,尤其是-ch
2-nh-o-ch
2-,-ch
2-n(ch3)-o-ch
2-[已知是亚甲基(甲基亚胺基)或 mmi骨架],-ch
2-o-n(ch3)-ch
2-,-ch
2-n(ch3)-n(ch3)-ch
2-和-o-n(ch3)
ꢀ-
ch
2-ch
2-[其中天然磷酸二酯骨架用-o-p-o-ch
2-表示]。具有吗啉代基骨架结构的寡核苷酸也是优选的。
[0077]
修饰的寡核苷酸还可包含一个或多个取代的糖部分。优选的寡核苷酸在2
′
位包含: oh;f;o-、s-或n-烷基;o-、s-或n-烯基;o-、s-或n-炔基;或o-烷基-o-烷基之一,其中烷基,烯基和炔基可以是取代的或未取代的c
1-c
10
烷基或c
2-c
10
烯基和炔基。特别优选的是o[(ch2)
n
o]mch3,o(ch2)
n
och3,o(ch2)
n
nh2,o(ch2)
n
ch3,o(ch2) n
onh2,和o(ch2)
n
on[(ch2)
n
ch3)]2,其中n和m为1-约10。其它优选的寡核苷酸在2
′
位包含:c
1-c
10
低级烷基,取代的低级烷基,烷芳基,芳烷基,o-烷芳基或o-芳烷基,sh,sch3,ocn,cl,br,cn,cf3,ocf3,soch3,so2ch3,ono2,no2,n3, nh2,杂环烷基,杂环烷芳基,氨基烷基氨基,多烷基氨基,取代的甲硅
烷基,rna剪切基团,报告基团,插入子,改善寡核苷酸药物代谢动力学特性的基团,或改善寡核苷酸的药效学特性的基团,和具有相似特性的其它取代基。优选的修饰包括2
′-
甲氧基乙氧基(2
′-
o-ch2ch2och3,也称为2
′-
o-(2-甲氧乙基)或2
′-
moe)(martin等,helv. chini.acta.,1995,78,486-504)亦即,烷氧基烷氧基基团。进一步优选的修饰包括2
′ꢀ-
二甲氨基氧乙氧基,亦即,o(ch2)2on(ch3)2基团,也称为2
′
dmaoe,如下面实施例中所述。
[0078]
在本公开中,其它优选的修饰包括2
′-
甲氧基(2
′
o-ch3),2
′-
氨基丙氧基(2
′ꢀ-
och2ch2ch2nh2)和2
′-
氟(2
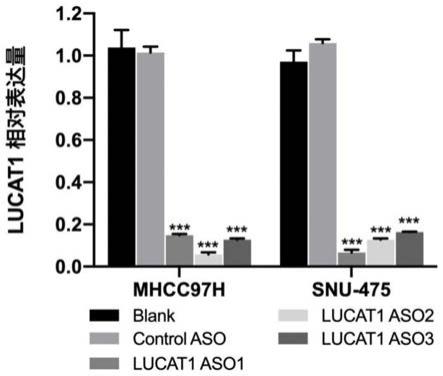
′-
f)。相似的修饰还可在寡核苷酸上的其它位置进行,所述其它位置特别是3
′
端核苷酸上糖的3
′
位或在2
′-5′
连接的寡核苷酸中和5
′
端核苷酸的5
′
位。寡核苷酸还可具有诸如以环丁基部分代替戊呋喃糖的糖模拟物形式。寡核苷酸还可包括核碱基(在本领域中通常被简称为“碱基”)修饰或取代。如此处所使用的,“未修饰”或“天然”核碱基包括嘌呤碱基腺嘌呤(a)和尿嘌呤(g),以及嘧啶碱基胸腺嘧啶(t),胞嘧啶(c)和尿嘧啶(u)。修饰的核碱基包括其它合成和天然核碱基,诸如5-甲基胞嘧啶(5-me-c),5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-甲基和其它烷基衍生物,腺嘌呤和鸟嘌呤的2-丙基和其它烷基衍生物,2-硫尿嘧啶,2-硫胸腺嘧啶和2-硫胞嘧啶,5-卤代尿嘧啶和胞嘧啶,5-丙炔基尿嘧啶和胞嘧啶,6-偶氮尿嘧啶,胞嘧啶和胸腺嘧啶,5-尿嘧啶(假尿嘧啶),4-硫尿嘧啶,8-卤素,8-氨基,8-硫醇,8-硫烷基,8-羟基和其它8-取代的腺嘌呤和鸟嘌呤,5-卤素特别是5-溴代,5-三氟甲基和其它5-取代的尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤, 8-氮杂鸟嘌呤和8-氮杂腺嘌呤,7-脱氮鸟嘌呤和7-脱氮杂腺嘌呤和7-脱氮杂鸟嘌呤和3-脱氮杂腺嘌呤。特定核碱基特别适用于增加本公开的寡聚体化合物的结合亲和力。它们包括5-取代的嘧啶,6-氮杂嘧啶和n-2,n-6和o-6取代的嘌呤,包括2-氨基丙基腺嘌呤,5
-ꢀ
丙炔基尿嘧啶和5-丙炔基胞嘧啶。5-甲基胞嘧啶取代已显示出能增加核酸双链复合体稳定性0.6-1.2℃,其是本公开优选的碱基取代,当与2
′-
o-甲氧乙基糖修饰时,甚至是更为特别优选的。
[0079]
本公开的寡核苷酸的其它修饰包括将能增强寡核苷酸的活性、细胞分布或细胞摄取的一个或多个部分或结合物化学连接至寡核苷酸。所述部分包括(但不限于)脂质部分,诸如胆固醇部分,胆酸,硫醚,例如,己基-s-三苯甲基硫醇,硫代胆固醇,脂肪族链,例如,癸二酸或十一烷基残基,磷脂,例如,二-十六烷基-外消旋-甘油或三乙基铵1,2
-ꢀ
二-邻-十六烷基外消旋甘油-3-h-磷酸酯,多胺或聚乙二醇链,或金刚烷乙酸、棕榈基部分,或十八胺或己基氨基-羰基-氧胆甾醇部分。
[0080]
在本公开中,反义寡核苷酸的所有位置无须被全部均匀修饰,事实上在单个化合物中或甚至是在寡核苷酸内的单个核苷上可以掺入多于一个的上述修饰。本公开还包括是嵌合化合物的反义寡核苷酸。在本公开中,“嵌合”反义寡核苷酸或“嵌合体”是反义寡核苷酸,特别是寡核苷酸,其包含两个或多个可化学区分的区域,各由至少一个单体单位构成,比如寡核苷酸化合物中的的核苷酸。这些寡核苷酸典型地包括至少一个其中寡核苷酸被修饰的区域,以便赋予寡核苷酸对核酸酶降解抗性的增加,细胞摄取的增加,和/或对靶核酸结合亲和力的增加。寡核苷酸的附加区域可作为能剪切rna:dna或rna: rna杂合体的酶的底物。举例来说,rnaseh是剪切rna:dna双链体的rna链的细胞内切核酸酶。因此,rnaseh的活化会导致剪切rna靶,由此极大地增强了寡核苷酸抑制基因表达的效能。因此,当使用嵌合寡核苷酸时,与和相同靶区域杂交的硫代磷酸酯脱氧寡核苷酸相比,采用较短寡核苷酸
通常可获得相当的结果。rna靶的剪切可通过凝胶电泳,以及(如有需要)本领域已知的相关核酸杂交技术进行常规检测。
[0081]
本公开的嵌合反义寡核苷酸可被构建为上述两个或多个寡核苷酸,修饰的寡核苷酸,寡核苷和/或寡核苷酸模拟物的复合结构。在本领域中所述反义寡核苷酸还被称为杂合体。
[0082]
在一个具体的实施方式中,为了增加本公开中的反义寡核酸的稳定性和其对细胞的亲和性,可在不显著降低其活性的前提下通过用另一种更稳定的基团替换磷酸基或者核糖部分中的羟基所得的衍生物。这种反义寡核苷酸衍生物的特定实施例包括硫代磷酸基,甲基磷酸基团等替代磷酸基,或核糖部分的羟基被烷氧基例如甲氧基,烯丙氧基等或氨基,氟原子等代替的衍生物。
[0083]
本公开的反义寡核苷酸的分子设计中,组成反义寡核苷酸的核苷酸序列是很重要的。寡核苷酸成了包括天然存在的核苷酸分子及上述非天然的修饰寡核苷酸外,肽核酸类的修饰的修饰化合物。本公开中的翻译官核苷酸优选地是在其结构中具有糖(优选的是戊糖。这么做的目的是有利于穿透细胞膜,核膜等结构。
[0084]
在一个具体的实施方式中,本公开的反义寡核苷酸优选地可带有胆固醇修饰,以便增强对癌细胞膜和细胞核膜的穿透性。
[0085]
本公开中的反义寡核苷酸也可以单独使用。因此,本公开提供癌症细胞生长抑制剂和癌症的治疗或预防制剂(下文中有时指所有药物制品)可以由所述的反义寡核苷酸组成,但优选地是通过已知方法将反义寡核苷酸与药学上接受的物质混合,从而形成混合物而得到的药物制剂。此处,虽然癌细胞生长抑制剂与癌症治疗或预防制剂没有在组成、生产过程等方面进行特别区分,但二者是不同的,因为癌细胞生长抑制剂除了用于减轻或改善癌症症状或治疗或预防癌症外,还用于抑制癌细胞生长,例如在通常的实验过程中作为普通的试剂。药物制剂可通过下述方式进行制备。
[0086]
例如,注射剂可通过将本公开中的反义寡核苷酸溶解到水、生理盐水、葡萄糖溶液等溶剂中而进行制备,如果需要,可含有缓冲剂、防腐剂、稳定剂等物质。
[0087]
药膏可通过将本公开中的反义寡核苷酸溶解或分散在脂油性、乳剂性或水溶性物质中而进行制备,如果需要,可含有稳定剂、ph调节剂、可塑剂、乳化剂、表面活性剂、增溶剂、保湿剂、防腐剂、杀菌剂、溶剂、吸收加速剂等物质。
[0088]
乳剂、洗剂等可通过将本公开中的反义寡核苷酸溶解或分散到水相中,然后用油相成分,例如烃或高级醇乳化而进行制备,如果需要,可含有稳定剂、ph调节剂、可塑剂、乳化剂、表面活性剂、增溶剂、保湿剂、防腐剂、杀菌剂、溶剂、吸收加速剂等物质。
[0089]
本公开中的细胞生长抑制剂可制备成干燥型产品,当加入溶剂,例如作为通用溶剂的水后则可很容易地形成溶液。
[0090]
当需要将本公开中的反义寡核苷酸更有效地整合到活体中或期望具有持续作用时,则反义寡核苷酸优选地与药学上接受的已知载体一起形成药物制剂。载体包括例如基于脂类例如脂质体的载体、脂肪乳化剂及微囊,肽类载体例如多聚赖氨酸,多聚鸟氨酸合成的多聚体载体例如聚乙烯亚胺及聚乳酸/乙二醇共聚物。特别地,与脂质体联合的药物制剂是优选的。在药物制剂中,本公开的反义寡核苷酸优选地以包埋在脂质体中的形式存在。可通过已知方法用这些载体进行配制。
[0091]
例如,用脂质体配制的方法在gregory,g.(ed),liposome technology:liposome preparation and related techniques,2
nd ed.,crc pr.,1992等中进行了描述。与脂质体联合的药物制剂不仅可以包括通常用于形成脂质体的脂类,例如磷脂、糖脂和中性脂,而且也可以包括提供阳离子电荷以形成脂质体的物质,例如联十六烷基磷酸、硬脂酰胺等,及防止脂质体氧化的物质,例如α-生育酚等。对于增强对细胞的整合和增强对靶向细胞的导向性的目的,可以使用修饰后的上述载体。
[0092]
此处,这些药物制剂可以包括其它已知具有抗癌作用的组分。
[0093]
在上述药物制剂中,本公开中的反义寡核苷酸可在连接到载体上,例如整合到任意载体上后进行使用。在这种情况下,反义寡核苷酸优选地是可操作地连接到合适的启动子上。术语“可操作地”是指反义寡核苷酸(rna)可在该启动子的作用下在活体细胞中进行表达。载体包括但不限于,例如腺病毒载体、痘病毒载体、逆转录病毒载体等。这些载体可用作基因治疗的载体。对于构建这些载体的方法、其特定的用途等可参考文献例如sambrook,j.,et al.,molecular cloning:a laboratory manual;2nd ed.,cold spring harbor laboratory,cold spring harbor,ny.,1989等。
[0094]
本公开的药物制剂中的反义寡核苷酸含量没有特别限定,可以进行适当的调整以达到每种药物制剂所需的效果。通常含量约为质量的1%到10%是合适的。
[0095]
本公开中的癌细胞生长抑制剂和癌症治疗或预防制剂可通过上述方法获得。因此,用本公开中的反义寡核苷酸生产本公开中的癌细胞生长抑制剂和癌症治疗或预防制剂的方法作为本公开的另一个实施方案进行提供。
[0096]
对活体施用本公开中的癌症治疗或预防制剂的方法根据治疗或预防制剂的形式可包括但不特别限定于,例如口服给药、静脉内给药、经皮给药、局部给药、腹膜内给药等。作为给药本公开的癌症治疗或预防制剂的方法,更有效的方法可根据个体和疾病的状况进行选择,通常静脉内给药是优选的。癌症治疗或预防制剂的给药剂量根据症状等进行确定,并不特别限定。在静脉内给药的情况下,癌症治疗或预防制剂的剂量以本公开中的反义寡核苷酸的量来说,优选地是每人每天0.1到1mg/(体重)kg,更优选地是0.1到 0.5mg/(体重)kg。可以每天一次给药或每天多次分部给药。给药周期也不进行特别限定。
[0097]
此处,给药本公开中的癌症治疗或预防制剂的活体并不限定于上述的人,而且包括例如哺乳动物等其它动物。本公开中的癌细胞生长抑制剂也与本公开中的癌症治疗或预防制剂的使用方式相同。
[0098]
作为本公开的癌细胞生长抑制剂和癌症治疗或预防制剂靶点的癌细胞的部位无特别限定,特别优选地是癌细胞来源于身体表面例如皮肤;消化道例如食道、胃和大肠;抑制剂或制剂可进行动脉内施用于肝脏等部位。
[0099]
实施例
[0100]
本公开的其他目的、特征和优点将从以下详细描述中变得明显。但是,应当理解的是,详细描述和具体实施例(虽然表示本公开的具体实施方式)仅为解释性目的而给出,因为在阅读该详细说明后,在本公开的精神和范围内所作出的各种改变和修饰,对于本领域技术人员来说将变得显而易见。
[0101]
实施例中采用的所有试剂,除非另有强调,否则均可以通过商业途径购买获得。
[0102]
实验方法:
[0103]
细胞系培养
[0104]
hep3b(atcc号:hb-8064)、hepg2(atcc号:hb-8065)、和snu-475(atcc 号:crl-2236)细胞系购自atcc。l-02、huh7、mhcc97h、和smmc-7721细胞系由清华大学zhen xie教授友情提供。其中,snu-475、l-02、和smmc-7721细胞系在含有 10%胎牛血清(fbs,biological industries,israel)的rpmi 1640(gibco,grand island,new york,usa)中培养。hepg2和huh7在含有10%fbs的达尔伯克改良伊格尔培养基 (dulbecco's modified eagle medium)(gibco,grand island,ny,usa)中培养。hep3b和 mhcc97h在含有10%fbs的eagle最低必需培养基(minimum eagle’s medium)(gibco, grand island,new york,usa)中培养。所有细胞均用支原体去除试剂(mycoplasma elimination reagent)(invitrogen,ca,usa)预处理3代以避免支原体感染并且通过str 测序验证。
[0105]
rna提取、逆转录和qpcr
[0106]
按照trizol(invitrogen,ca,usa)试剂的方案从组织或细胞中提取总rna。使用 nonodrop(thermofisher,rockford,usa)测量rna浓度。通过使用hiscript逆转录酶 (hiscript reverse transcriptase)(vazyme,nanjing,china)来逆转录rna。通过使用aceq qpcr sybr green master mix(vazyme,nanjing,china)在applied biosystems 7500中进行实时qpcr试验。甘油醛-3-磷酸脱氢酶(gapdh)用作内部对照。
[0107]
sirna或aso的转染
[0108]
基于建议浓度和指示剂量,在opti-mem(gibco,grand island,ny,usa)中稀释 rnaimax(invitrogen,ca,usa),同时在opti-mem中稀释sikeap1、sinrf2、silucat1 (genepharma,shanghai,china)、lucat1 aso(ribobio,guangzhou,china)、或相应对照,其后在室温下用稀释的rnaimax培养5分钟。最后,将sirna或aso-脂质复合物均匀滴入之前根据实验要求制备的细胞中。
[0109]
用于ffpe和细胞玻片的rnascope
[0110]
对于ffpe样品,在本研究的148例hcc样品中,我们随机选择8个福尔马林固定石蜡包埋(ffpe)试样切至4mm切片。在60℃下烘烤1小时后,将ffpe切片脱蜡20分钟并用过氧化氢溶液处理10分钟。在进行后续步骤之前,ffpe切片需要常规预处理(靶修复试剂,100℃,15分钟;蛋白酶加(protease plus),40℃,30分钟)。对于细胞玻片样品,将接种在细胞培养玻片(biologix,jinan,shandong,china)上的5种hcc细胞系(mhcc97h、 snu-475、smmc-7721、hepg2、和huh7)以及正常肝细胞系(l-02)在培养箱(37℃, 5%co2)中过夜以充分附着。在室温下将细胞玻片浸渍于10%中性缓冲福尔马林(nbf) 中30分钟,其后在室温下依次用过氧化氢溶液处理10分钟并用蛋白酶iii处理10分钟。应注意的是,各个步骤间都需要用磷酸盐缓冲生理盐水(pbs)冲洗。其后的实验过程遵循rnascope multiplex fluorescent reagent kit v2(biolink biotechnology,beijing,china) 的说明书。简而言之,将预处理的样品与探针混合物在hybez杂交炉中在40℃下杂交2小时。需要常规操作(amp1,40℃,30分钟;amp2,40℃,30分钟;amp3,40℃,30 分钟;hrp-c1,40℃,30分钟;opal 570,40℃,30分钟;hrp阻断剂,40℃,15分钟) 并且各个步骤间应用洗涤缓冲液清洗两次。在用苏木精重染色细胞核以后,在显微镜下拍照ffpe切片。用含有dapi的gold antifade reagent(cell signaling technology,danvers, ma,usa)处理细胞玻片,然后用共焦激光显微镜拍照。点信号的强度表示结合探针的数量,并且点信号的数量表示rna的丰度。
[0111]
细胞增殖和凋亡的动态观察
[0112]
将mhcc97h接种在96-孔板中过夜并且用对照aso和lucat1转染。向培养基添加荧光染料(活细胞:hoechst;死细胞:pi)后,每1小时在biotek显微成像系统(cytation5) 中进行动态视频记录,持续48小时。gene5软件用于分析数据。
[0113]
cck8用于细胞生长
[0114]
如细胞计数试剂盒-8(cell counting kit-8)(medchemexpress,nj,usa)的说明书所述,将hcc细胞系接种在96-孔板中并且按指示进行处理。在第0h、24、48h、72h、和 96h在每个孔中添加cck8溶液,缓慢添加以避免气泡。培养1小时后,在450nm处检测板的吸光度值。
[0115]
患者-源性肿瘤异种移植物模型的建立和体内实验
[0116]
将新鲜切除的hcc样品制备成单细胞悬浮液并且皮下注射至balb/c裸小鼠(雄性, 6-8周龄)中来建立带有hcc的小鼠模型。根据ffpe的rnascope结果,选择来自高 lucat1表达的患者1的患者-源性肿瘤异种移植(pdx)模型用于进一步的动物实验来证明lucat1 aso的潜在治疗价值。选择移植后2周的肿瘤形成小鼠并且根据肿瘤大小分组。经过另一周的观察后,将具有相同生长速度的三只小鼠分成一组。每3天瘤内注射10光密度(od)胆固醇改性的lucat1 aso2、对照aso(ribobio,guangzhou,china)、或pbs,持续2周。从第2周开始,记录肿瘤的大小并且每周计算肿瘤体积直至牺牲小鼠的第5周。在第3、第4和第5周收集小鼠的眼眶内眼角血以通过酶联免疫吸附测定法(elisa, proteintech,chicago,usa)进行afp检测。所有的动物实验按照美国国立卫生研究院实验动物的护理和使用指南进行,并得到首都医科大学的科学研究委员会(beijing,china) 的批准。
[0117]
统计学分析
[0118]
对于所有的实验,以生物学的一式三份进行分析,并且数据基于三个独立实验以平均值
±
标准差显示。graphpad prism 8.0(la jolla,ca,usa)软件用于分析两个实验组是否具有显著性。除非另外指出,否则p<0.05的水平视为重要标准。
[0119]
实验结果:
[0120]
lucat1的核定位证明可以使用反义寡核苷酸(aso)作为其抑制剂
[0121]
已知小干扰rna(sirna)更有效地敲低细胞核rna以外的细胞质rna。与此相反,反义寡核苷酸(aso)专门降解细胞核rna。为了得到lucat1的最大化敲低,我们尝试了sirna和aso两者。在使用sirna的实验中,我们设计了针对lucat1的三种sirna 并且发现它们的敲低百分比为约50%(图1),这远远不够。值得一提的是,已报道的数据也发现了sirna不能有效清除肿瘤细胞中的lucat1(sun y et.al.,2017; jung-hoyoon et.al.)。
[0122]
但当我们使用aso进行lucat1敲低时,全部三种aso在hcc细胞系中消除总 lucat1的80%以上(图2),其足以进行进一步的功能验证实验。
[0123]
其中,三种sirna 1-3的序列如下:
[0124]
lucat1 sirna1(seq id no:1):cagaagatgtcagaagata;
[0125]
lucat1 sirna2(seq id no:2):gtgttctacttcttaaaaa;
[0126]
lucat1 sirna3(seq id no:3):cagcaacaatggtatttct。
[0127]
三种aso1-3的序列如下:
[0128]
lucat1 aso1(seq id no:4):ggacagctggtaagt;
[0129]
lucat1 aso2(seq id no:5):gtaagtgtagcatcag;
[0130]
lucat1 aso3(seq id no:6):agaaagccaagtcaga。
[0131]
进一步的,导致上述结果的其深层次原因是lucat1主要表达在细胞核内,而受 sirna引导的,能够降解靶rna的酶却主要在细胞质内。所以sirna清除lucat1的效率很低。相反aso引导的,能够降解靶rna的酶主要在细胞核内,所以aso清除lucat1 的效率很高。另外值得注意的是,aso在药代动力学上容易在肝脏中积聚。这个特殊的属性对癌症的治疗,特别是肝癌的治疗是一大利好。
[0132]
图1示出了sirna对lucat1的低敲低效率。转染后24小时处,用指定的sirna转染 mhcc97h和snu-475细胞。
[0133]
图2示出了aso对lucat1的高敲低效率。转染后24小时处,用指定aso转染 mhcc97h和snu-475细胞。
[0134]
分离rna以进行qpct分析,并且归一化至内部对照gapdh(图1-图2)。结果是来自以一式三份进行的三个独立实验(平均值
±
sd)(图1-图2)。通过单因素方差分析接着dunnett事后多重比较(图1-图2)来计算统计学显著性。**p<0.01,***p<0.001。
[0135]
综上所述,lucat1主要位于hcc细胞的细胞核中,这使得其易受aso介导的降解的影响。
[0136]
针对lucat1的aso在hcc中具有强治疗潜能
[0137]
本公开对每个反义寡核苷酸对癌细胞生长的作用做了检测。方法是先将癌细胞 (snu475)接种到96孔细胞培养板中,然后用control aso,lucat1 aso1,lucat1 aso2和lucat1 aso3处理肿瘤细胞,并在第0h、24、48h、72h、和96h在每个孔中添加cck8溶液,缓慢添加以避免气泡。培养1小时后,在450nm处检测板的吸光度值。
[0138]
其中,control aso的序列为(seq id no:7):aacacgtctatacgc。
[0139]
实验结果如图3所示。其显示lucat1 aso1,2,3均可以显著移植癌细胞的增殖。
[0140]
在pdx动物模型验证中验lucat1 aso的抗肿瘤作用
[0141]
然后,我们使用高lucat1表达的hcc患者肿瘤组织建立患者源性异种移植(pdx) 模型来评价体内的抗-lucat1 aso效果。从肿瘤成形的第3周起,我们每3天将抗lucat1 aso2注射至肿瘤中。在此实验中运用的反义寡核苷酸是经胆固醇修饰过的反义寡核苷酸,具体修饰方法参照tomoko公开的技术方案(tomoko nishina et.al.,2015)。目的是增强细胞穿透性。
[0142]
结果显示(在实验结果图中,lucat1 aso2也被简写成lucat1 aso),抗-lucat1 aso显著缩小肿瘤(图4)并且降低血清afp水平(图5)。在本实验结束时,我们收集肿瘤组织并且提取总rna来进行qpcr。结果表明,与pbs或对照aso组相比,lucat1在抗-lucat1 aso处理组中显著下调(图6)。
[0143]
综上所述,lucat1 aso在hcc pdx模型中具有抗肿瘤效果。
[0144]
具体的,在上述图4-5中,aso介导的lucat1敲低在患者源性异种移植动物模型中显著抑制hcc肿瘤生长。肿瘤移植2周后,将具有相同肿瘤生长速度的三只小鼠分为一组。在第3周,每3天瘤内注射10光密度(od)胆固醇修饰的对照aso、lucat1 aso2或pbs,持续2周。在第5个周末,剥离肿瘤组织并且拍照。从第2周到第5周,每周测量肿瘤大小。在第3、第4、和第5周,收集小鼠的眶内眼角血。通过酶联免疫吸附测定法检测afp浓度。
[0145]
结果如图6所示。在上述图6中,aso瘤内注射能够有效降低hcc肿瘤组织中的 lucat1表达。从在第5个周末收集的肿瘤分离rna并且通过qpct法分析(归一化至内部对照gapdh)。
[0146]
在上述图中,通过单因素方差分析接着dunnett事后多重比较来计算统计学显著性。 *p<0.05,**p<0.01,***p<0.001。
[0147]
综上所述,靶向lucat1是一个很好的抗癌手段。该策略可以阻遏多个癌基因,从而杀伤癌细胞。
[0148]
本公开的上述实施例仅是为清楚地说明本公开所作的举例,而并非是对本公开的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本公开的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本公开权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1