仿真胆囊壁合成材料及其制备方法和应用以及仿真胆囊壁与流程
本发明涉及医疗生物材料技术领域,尤其涉及仿真胆囊壁合成材料的制备方法、仿真胆囊壁合成材料和仿真胆囊壁,以及仿真胆囊壁合成材料在制备仿真胆囊壁中的应用。
背景技术:
目前,在中国的胆囊疾病患者已经达到人群的20%。胆囊常见病包括胆囊结石、胆囊息肉,这两种病多同时伴有胆囊炎。胆囊结石发病率为10%-12%,其中30%-50%的起因是例如胆囊壁折叠、胆囊壁环状增厚伴狭窄、胆囊壁分隔等胆囊形态异常所致。对此,目前最常用胆囊切除术来进行治疗,但是在术后常会出现例如消化功能不良、腹胀、腹泻、便秘、胃食管反流、术后疼痛、胆管损伤等诸多并发症,其发生率在20%-40%,将会严重影响患者的健康和生活质量。
近年来,已有医院开展了保胆取石手术,然而对于胆囊壁病变没有消除的保胆患者,术后结石复发率较高,最终仍难避免切除胆囊。如果仅切除形态异常及有病变的胆囊壁,剩余的健康胆囊容积小于正常胆囊的一半(正常胆囊的容积是60ml-80ml),就会失去胆囊的正常功能,从而失去了保胆的意义。另外,对于胆囊息肉问题,其发病率在国内是4%-8%,如果息肉大小超过1cm,就必须进行胆囊切除术,这主要是因为担心息肉会发生癌变。如果只是摘除息肉,不处理息肉蒂部的胆囊壁,就不能完全消除残留息肉蒂部癌变的可能。同样,如果切除了有病变的胆囊壁而导致剩余胆囊过小,则也没有保胆的意义。
技术实现要素:
有鉴于此,本发明提供了仿真胆囊壁合成材料的制备方法、仿真胆囊壁合成材料和仿真胆囊壁,以及仿真胆囊壁合成材料在制备仿真胆囊壁中的应用,从而可以解决或者至少缓解了现有技术中存在的上述问题和其他方面的问题中的一个或多个。
首先,根据本发明的一个方面,它提供了一种仿真胆囊壁合成材料的制备方法,包括步骤:
a.通过将壳聚糖溶解在酸性液体中,制成壳聚糖质量浓度范围为0.5%-12%的壳聚糖溶液;
b.基于所述壳聚糖溶液,制成壳聚糖支架;
c.将经过第一培养基培养后的脂肪干细胞加入到水凝胶中以获得具有预设细胞密度的混合物,并且将所述混合物浇注于所述壳聚糖支架上;以及
d.将丝素蛋白溶液浇注在已浇注于所述壳聚糖支架上的所述混合物之上以形成复合支架,然后将所述复合支架与质量浓度范围为0.5%-10%的cacl2溶液交联反应5-60分钟后置于第二培养基中,从而制成仿真胆囊壁合成材料。
在根据本发明的仿真胆囊壁合成材料的制备方法中,可选地,还包括步骤:将所述复合支架从所述第二培养基中取出,然后在温度范围为-30℃-5℃的环境下进行冷冻后去除水分。
在根据本发明的仿真胆囊壁合成材料的制备方法中,可选地,还包括步骤:对已去除水分的所述复合支架使用射线进行消毒灭菌处理。
在根据本发明的仿真胆囊壁合成材料的制备方法中,可选地,在步骤a中,所述壳聚糖是由甲壳素经过碱性脱乙酰作用制成,并且/或者所述酸性液体是体积占比为1%的醋酸,并且/或者所述壳聚糖溶液的质量浓度为2.5%;并且/或者
在步骤b中,使所述壳聚糖溶液通过沉淀形成微水凝胶并进行清洗,然后将其浇注在模具上进行自沉淀后再去除残留水分,从而获得所述壳聚糖支架;并且/或者
在步骤c中,所述脂肪干细胞使用以下步骤制成:
获得与母体分离的脂肪组织,并将其在质量浓度范围为0.1%-1%的氯霉素溶液中进行浸泡洗涤;
将经过浸泡洗涤后的所述脂肪组织切成小块并置于质量浓度范围为0.05%-0.2%的i型胶原酶中,并且在温度范围为35℃-39℃的环境下消化0.5-2小时后使用滤网进行过滤,并且在温度范围为35℃-39℃的环境下进行离心处理5-20分钟;
将经过离心处理获得的细胞冲悬在所述第一培养基中;以及
将所获得的细胞接种在培养皿上,在常规培养条件下培养,当细胞融合度达到80%-90%时以预设比例传代,将培养液每间隔1-3天进行更换,并将得到的脂肪干细胞进行流式细胞检测,并且进行成骨成脂分化鉴定;并且/或者
在步骤c中,所述水凝胶是通过将经高碘酸盐氧化后的海藻酸与明胶进行交联反应后制成;并且/或者
在步骤d中,所述丝素蛋白溶液使用以下步骤制成:
将家蚕蛹在碳酸钠中煮沸20-60分钟,然后使用去离子进行清洗以去除胶状的丝胶蛋白;
在室温下进行干燥后,将脱丝胶后的丝素蛋白纤维溶解在溴化锂溶液中2-6小时;
然后进行透析2-4天,从而获得所述丝素蛋白溶液;并且/或者
在步骤d中,所述复合支架与质量浓度范围为2%的cacl2溶液交联反应10分钟。
在根据本发明的仿真胆囊壁合成材料的制备方法中,可选地,在步骤a中,所述甲壳素是提取自甲壳类动物外骨骼和/或真菌的细胞壁;并且/或者
在步骤b中,使用三蒸水对所述壳聚糖溶液通过沉淀所形成的微水凝胶进行清洗,所述模具是多孔板;并且/或者
在步骤c中,所述脂肪组织在质量浓度为0.25%的氯霉素溶液中浸泡洗涤3次,并且/或者所述离心处理的加速度为160g,并且/或者所述滤网是直径为200mm的尼龙滤网,并且/或者所述培养皿的直径为10cm,并且/或者所述预设比例是1:3,并且/或者所述脂肪干细胞通过cd29、cd9、cd105和cd45进行流式细胞检测;并且/或者
在步骤c中,将所述水凝胶在温度范围为35℃-39℃的环境下以50-110rpm范围内的搅拌速度进行搅拌预热后,再将所述脂肪干细胞加入到经搅拌预热后的水凝胶中。
在根据本发明的仿真胆囊壁合成材料的制备方法中,可选地,所述水凝胶中的海藻酸和水的质量占比分别是30%和70%,并且所述海藻酸的氧化度为30%。
在根据本发明的仿真胆囊壁合成材料的制备方法中,可选地,所述预设细胞密度为1×106个细胞/ml,并且/或者所述第一培养基和/或所述第二培养基是含有质量浓度为10%的胎牛血清和质量浓度为1%的青霉素-链霉素溶液的dmem培养基。
其次,根据本发明的第二方面,还提供了一种仿真胆囊壁合成材料,它是根据如以上任一项所述的仿真胆囊壁合成材料的制备方法制成的仿真胆囊壁合成材料。
此外,根据本发明的第三方面,还提供了一种如以上所述的仿真胆囊壁合成材料在制备仿真胆囊壁中的应用。
另外,根据本发明的第四方面,进一步提供了一种仿真胆囊壁,其包括根据以上所述的仿真胆囊壁合成材料。
从与附图相结合的以下详细描述中,将会清楚地理解根据本发明的各技术方案的原理、特点、特征以及优点等。例如,本发明创新性地提供了可用于修复胆囊壁缺损的组织再生材料,由此能够避免胆囊结石和息肉复发的可能,有效“恢复”胆囊壁的缺损而不是传统医学意义上的简单“修补”,可保留形态和功能均正常的胆囊,从而保留了胆囊收缩、储存、浓缩、调控等功能,避免了由于切除胆囊而可能带来的各种并发症。本发明具有显著的实用性和安全性,非常有助于提升人类健康医疗质量。
附图说明
以下将结合附图和实施例来对本发明的技术方案作进一步的详细描述,但是这些附图只是出于解释目的而设计的,仅意在概念性地说明此处的结构构造,而不必要依比例进行绘制。
图1是一个根据本发明的仿真胆囊壁合成材料的制备方法实施例的处理流程示意图。
图2是一个根据本发明的仿真胆囊壁合成材料实施例中的合成支架的立体结构示意图。
具体实施方式
首先,需要说明的是,以下将以示例方式来具体说明根据本发明的仿真胆囊壁合成材料的制备方法、仿真胆囊壁合成材料和仿真胆囊壁,以及仿真胆囊壁合成材料在制备仿真胆囊壁中的应用的结构、步骤、特点和优点等,然而所有描述仅是用来进行说明而不构成对本发明的任何限制。在本文中,技术术语“第一”、“第二”仅是用于进行区分性表述目的而无意于表示它们的顺序以及相对重要性;技术术语“基本上”旨在包括与特定量的测量相关联的非实质性误差(例如可包括给定值的±8%、±5%或±2%等范围),除非明确指出以外,在本文中的各处针对特定数值的表述也应理解为已经包含了这种非实质性误差;技术术语“上”、“下”、“顶”、“底”、“内”、“外”及其派生词等应联系附图中的定向,除非明确指出以外,本发明可采取多种替代定向。
此外,对于在本文所提及的实施例中予以描述或隐含的任意单个技术特征,本发明仍然允许在这些技术特征(或其等同物)之间继续进行任意组合或者删减,从而获得可能未在本文中直接提及的本发明的更多其他实施例。另外,为了简化图面起见,相同或相类似的特征在同一附图中可能仅在一处或若干处进行标示。
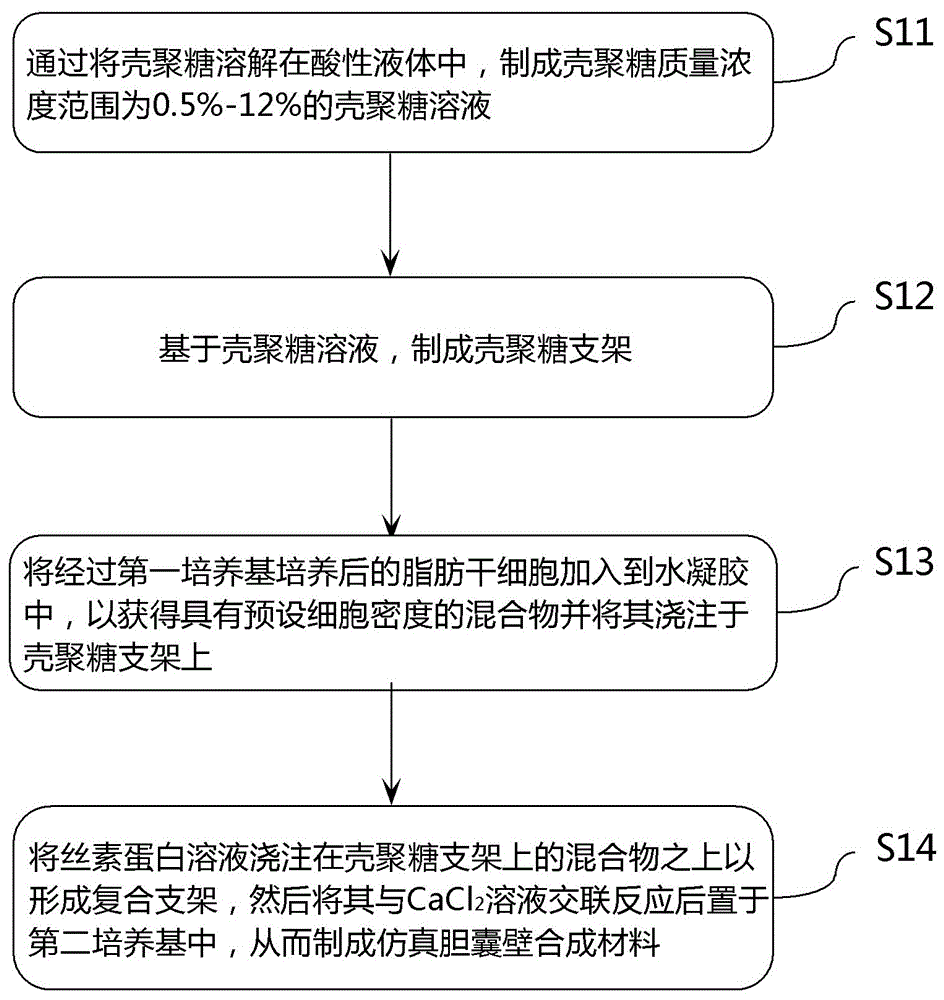
请首先参考图1,在该图中示出了一个根据本发明的仿真胆囊壁合成材料的制备方法实施例的基本处理流程。如图1所示,在这个制备方法示例中可以包括以下这些步骤:
在步骤s11中,可制备壳聚糖质量浓度范围为0.5%-12%(如可选为2.5%等)的壳聚糖溶液,这可以通过将壳聚糖溶解到根据具体应用情况所选用的任何合适的酸性液体(例如体积占比为1%的醋酸等)中来实现。对于壳聚糖来讲,它是一种自然来源的共聚体,可以例如由甲壳素经过碱性脱乙酰作用来制成,它不仅支持原位组织再生,还有较高的安全性、生物相容性、可塑性和可控的生物降解性。对于上述的甲壳素,它也常被称为甲壳质或几丁质,通常可以从甲壳类动物外骨骼和/或真菌的细胞壁来提取获得。
然后,可以在步骤s12中,通过以上得到的壳聚糖溶液来制成壳聚糖支架。具体来讲,可以使壳聚糖溶液通过沉淀来形成微水凝胶,然后可使用例如三蒸水等任何适用的处理液来对其进行清洗处理,随后可将其浇注在模具上以便进行自沉淀后再去除其中的残留水分,就可以获得壳聚糖支架。通常来讲,这样的壳聚糖支架一般具有比较致密的结构,因此可提供良好的结构支撑作用。通过形成壳聚糖支架,能够为在下文中将详细介绍的脂肪干细胞构建出生物仿生微环境来促进干细胞定值、分化和生长,它不但能给脂肪干细胞提供足够的空间,而且还有利于细胞黏附生长、基质沉积、氧气养分进入,并且有利于血管和神经长入。
应当指出的是,在实际应用过程中,本发明方法允许采用具有各种可能结构的模具用于供浇注在其上的壳聚糖溶液进行自沉淀,例如此类模具可采用多孔板形式(如36孔板、48孔板等),本发明对此不作任何限制。
继续参考图1,在步骤s13中,可以将经过培养基进行培养后的脂肪干细胞加入到水凝胶中,直到获得所期望的具有预设细胞密度的混合物(例如细胞密度达到1×106个细胞/ml等,这可以根据实际应用需求情况来进行设定),然后可将所获得的混合物浇注到在步骤12中得到的上述壳聚糖支架上,即使用了包含脂肪干细胞的水凝胶来对壳聚糖支架进行了充填操作。
在本发明方法中使用了脂肪干细胞(adipose-derivedstemcells,adscs)存在众多优点。例如,可以避免应用自体成体细胞时存在的缺点,即这些自体细胞在体外培养中容易进入静止状态,缺乏完全再生胆囊内皮细胞、平滑肌细胞和血管内皮细胞以及神经细胞的能力。另外,与胚胎干细胞和骨髓来源干细胞相比,使用脂肪干细胞的伦理限制较少,而且容易通过抽脂、腹部手术取材等方式来获得。此外,脂肪组织包含比每立方厘米骨髓多100至1000倍的多能干细胞,并且它易于体外培养、免疫原性低、具备自我更新和多能分化等能力,还具有调节血管化、组织再生和炎症细胞反应的作用。
应当理解的是,根据不同的应用需求情况,可以采用许多方式来获取可供本发明方法中使用的脂肪干细胞。例如,作为举例说明,可以按照以下步骤来制成可在步骤s13中使用的脂肪干细胞:
首先,获得与母体(如待进行胆囊手术的病患者或其亲属等)分离的脂肪组织,然后将它在质量浓度范围为0.1%-1%的氯霉素溶液中进行浸泡洗涤处理,例如可将分离后的脂肪组织在质量浓度为0.25%的氯霉素溶液中浸泡洗涤1次、2次、3次或更多次,这允许根据具体应用情况来进行选择处理。
然后,可以将经过浸泡洗涤处理后的脂肪组织切成小块,具体的切块数量、实际大小等都可以按照需要来灵活实施,然后再将这些脂肪组织切块放置在质量浓度范围为0.05%-0.2%(如0.1%等)的i型胶原酶中,并且在温度范围为35℃-39℃(如37℃等)的环境下进行消化0.5-2小时(如1小时等),然后使用例如直径为200mm的尼龙滤网等滤网来对其进行过滤处理,并且在温度范围为35℃-39℃(如37℃等)的环境下进行离心处理5-20分钟(如10分钟等),在可选情形下可将离心加速度选择为例如160g或者其他任何适宜数值。
接下来,将经过离心处理获得的细胞冲悬在培养基中,该培养基可以可选地使用例如含有质量浓度为10%的胎牛血清和质量浓度为1%的青霉素-链霉素溶液的dmem(dulbecco'smodifiedeaglemedium)培养基,也可以使用任何其他的适宜培养基,这将根据实际的应用需求情况来进行相应的选择设置。
然后,可以将通过以上步骤获得的细胞接种在例如直径为10cm等的培养皿上,并且在常规培养条件下进行培养,可以在细胞融合度达到80%-90%时以例如1:3的比例(具体比例数值可根据应用需求进行设置)传代,并且可将培养液每间隔1-3天(如2天)进行更换,并将所得到的脂肪干细胞进行流式细胞检测(如通过cd29、cd9、cd105和cd45进行流式细胞检测),并且对其进行成骨成脂分化鉴定,从而可通过例如以上所述的分离、培养、鉴定、标记等过程来获得可供使用的脂肪干细胞。
在步骤s13中是将脂肪干细胞加入到水凝胶中,这样的水凝胶可以是采用物理交联的聚合物,并且允许采用诸多方式来提供。仅作为示例性说明,例如可以通过将经高碘酸盐氧化后的海藻酸(ada)与明胶进行交联反应后来形成,明胶中胶原能够促进细胞粘附。在可选情形下,上述水凝胶中的海藻酸和水之间的质量比值可以是30/70。此外,本案发明人已经发现,当其中的海藻酸的氧化度为30%时能够尤其令人惊讶地最佳促进干细胞增殖,从而能够获得令人满意的效果。
再作为示例性说明,在实际使用时,可以将水凝胶倒入无菌玻璃瓶中,并且可选地控制在温度范围为35℃-39℃的环境下(如设置成37℃等),并在搅拌速度范围为50-110rpm(如采用80rpm等任何适宜的搅拌速度)条件下进行搅拌预热处理(如使用加热磁力搅拌器等设备)之后,再将以上示例性讨论的脂肪干细胞加入到经搅拌预热处理后的水凝胶中。
接着参考图1,在步骤s14中,在已将含有脂肪干细胞和水凝胶的混合物浇注在壳聚糖支架上后,可以将丝素蛋白溶液进一步浇注在上述的混合物之上,从而形成具有“壳聚糖-水凝胶(脂肪干细胞)-丝素蛋白”合成结构的复合支架,然后可将复合支架与质量浓度范围为0.5%-10%(如2%等)的cacl2溶液进行交联反应5-60分钟(如10分钟等),这可以例如在室温环境下进行。随后,再将经过以上交联反应后的复合支架放置在培养基中进行培养待用,该培养基可例如同样采用含有质量浓度为10%的胎牛血清和质量浓度为1%的青霉素-链霉素溶液的dmem培养基,或者也可以按照需要来采用任何其他的适宜培养基。
由此,通过以上过程可以制成仿真胆囊壁合成材料,该合成材料可介导干细胞的增殖、分化、蛋白表达、细胞外基质形成等细胞行为,可通过诱导组织再生来实现损伤组织的修复和功能重建,可以将其作为用来修复胆囊壁缺损的生物组织再生材料。
在以上步骤s14中使用了丝素蛋白溶液,这样的丝素蛋白溶液可根据不同的应用情况来进行设置。作为举例说明,在一些实施方式下,可采用如下步骤来制成可供使用的丝素蛋白溶液:
首先,可以从家蚕蛹中提炼出来丝素蛋白,这样的丝素蛋白通常具有三维多孔结构、良好的生物相容性、较高的力学强度和弹性等特性,并且生物降解速率可以进行调控。举例而言,可将家蚕蛹在碳酸钠中煮沸20-60分钟(如30分钟等),然后使用例如去离子等来进行清洗,以便去除掉胶状的丝胶蛋白。
在经过上述清洗后,可在例如室温等环境下进行干燥,然后再将脱丝胶后的丝素蛋白纤维溶解在溴化锂溶液中2-6小时(如4小时等)。
接下来,进行透析处理2-4天(如3天等),从而可以获得丝素蛋白溶液。
以上已经通过图1所示的仿真胆囊壁合成材料的制备方法实施例来对本发明方法进行了示范性说明。然而,应当理解的是,本发明方法允许根据不同的应用场合针对例如其中的温度、时间、搅拌速度、离心加速度、搅拌速度、材料选择、步骤之间操作顺序等进行改变、替换或调整以及进行组合,例如对于脂肪干细胞的准备以及将它加入到水凝胶等这些操作步骤来讲,可以使其与壳聚糖溶液和/或壳聚糖支架的制备同步、之前或者之后进行,并且还可以根据需要来对本发明方法进行更多的扩展设计,以此来充分满足各种可能的实际需求。
例如,在一些实施方式下,可以将上述的具有“壳聚糖-水凝胶(脂肪干细胞)-丝素蛋白”合成结构的复合支架从培养基中取出,然后在温度范围为-30℃-5℃的环境下进行冷冻后去除水分,例如可将其在-20℃的环境条件下冷冻2天后去除水分。
又比如,在一些实施方式下,可以采用例如co60射线等射线来对以上获得的已经去除水分的复合支架进行消毒灭菌处理,进一步保证和提高材料使用时的安全性等。
另外,根据本发明的设计思想,它还提供了一种仿真胆囊壁合成材料,该仿真胆囊壁合成材料可使用例如以上示例性讨论的由本发明提出的仿真胆囊壁合成材料的制备方法来制成。如前所述,这样的仿真胆囊壁合成材料可以用作修复胆囊壁缺损的组织再生材料,因此可以将其称为“胆囊补片”。
在图2中仅以示意方式大致展示出了一个根据本发明的仿真胆囊壁合成材料实施例中的合成支架的立体结构。如图2中所示,该合成支架100包括了彼此融合的三个部分,即壳聚糖10、水凝胶20(其中包裹了脂肪干细胞30)和丝素蛋白40,其中的壳聚糖10可以为脂肪干细胞等提供足够的空间并支撑原位组织的再生,而且有利于细胞的黏附生长、基质沉积、氧气养分进入,并且有利于血管和神经生长,它具有较高的安全性、生物相容性、可塑性和可控的生物降解性;水凝胶20可以吸收大量的水分,并且用于包裹和运送脂肪干细胞的生物材料;脂肪干细胞30可作为胆囊的粘膜细胞、平滑肌细胞、血管内皮细胞、神经细胞再生的来源细胞,它在壳聚糖10的支撑作用下能实现自我更新和多能分化,并且可以提供调节血管化、组织再生和炎症细胞反应的作用;丝素蛋白40则具有三维多孔结构、良好的生物相容性、较高的力学强度和弹性以及可调控的生物降解速率,能够增强整个支架的机械强度、弹性等性能。本发明创新性地提供了以上“壳聚糖-水凝胶(脂肪干细胞)-丝素蛋白”的复合结构,其中各部分所呈现出的如上所述的这些特性和优势,能够使得应用这种合成结构材料来完美地修复生物组织和器官等成为可能。
如上所述,由于本发明的仿真胆囊壁合成材料具有这些相当突出的技术优势,因此非常适合将其应用在制备仿真胆囊壁中,并且具有很强的应用价值和实用性。
根据本发明技术方案,进一步提供了一种仿真胆囊壁,其中可以使用如上所述的仿真胆囊壁合成材料而形成“胆囊补片”。在实际应用场合下,可根据不同的需求情形来使用仿真胆囊壁合成材料制成仿真胆囊壁,使其允许具有不同的结构形状、尺寸等(如厚度、长度、宽度、面积等),并且还允许可能结合其他的适宜生物材料一起使用。
通过提供本发明的仿真胆囊壁,可以在临床上治疗胆囊结石及胆囊息肉时切除已经发生病变的胆囊壁,然后应用本仿真胆囊壁来完全再生胆囊壁,从而能够达到保留胆囊形态和功能的最终目的,这对于显著提高医疗水平、减少病患者痛苦、促进康复等都是非常有益的。这种仿真“胆囊壁”能够充分利用胆囊组织再生技术,彻底“恢复”胆囊壁的缺损,而不是传统医学进行的简单“修补”,其技术优势和效果是相当明显的,并且是采用现有技术根本不能实现的。
为了能够进一步促进对于本发明方案的理解,下面将结合一个基于动物实验的仿真胆囊壁放置操作示例进行说明。具体操作过程如下:
a.切开动物的腹壁,显露出胆囊;
b.切除胆囊底部,完成胆囊壁缺损模型;
c.使用8-0可吸收线将根据本发明制备成的一种仿真胆囊壁(其尺寸为10mm×10mm)以连续缝合方式缝合在上述的胆囊壁缺损处;
d.完成缝合后,检查缝合处理的密封性。
根据以上动物实验的结果显示:所采用的上述仿真胆囊壁在修复初期覆盖在胆囊缺损处,逐渐被自体组织替代,纤维化和支架挛缩轻微。周围大网膜和肠道与支架轻度粘连,经过钝性分离可以轻松分开。胆囊壁基本上纵向切片和再生区域放大显示,该仿真胆囊壁从术后2周至术后12周逐渐促进胆囊缺损发展为完整的包括胆囊上皮、平滑肌和浆膜的完整胆囊结构。在再生过程中,水凝胶残留物逐渐吸收,在术后12周消失。随着平滑肌逐渐再生,胶原组织比例逐渐降低至生理水平。中性粒细胞修复初期聚集在该生物支架周围,逐渐消散直至术后12周。巨噬细胞聚集在术后4周达到顶峰,在术后12周恢复至正常水平。
通过以上这些结果,能够充分显示出根据本发明的仿真胆囊壁能够有效地促进胆囊形态学再生、生物支架自行降解,并且纤维化和炎症发生不明显,以上方面都是采用现有技术方案所不具备的。
以上仅以举例方式来详细阐明根据本发明的仿真胆囊壁合成材料的制备方法、仿真胆囊壁合成材料和仿真胆囊壁,以及仿真胆囊壁合成材料在制备仿真胆囊壁中的应用,这些个例仅供说明本发明的原理及其实施方式之用,而非对本发明的限制,在不脱离本发明的精神和范围的情况下,本领域技术人员还可以做出各种变形和改进。因此,所有等同的技术方案均应属于本发明的范畴并为本发明的各项权利要求所限定。
- 还没有人留言评论。精彩留言会获得点赞!