谷氨酰胺在制备抑制大肠杆菌产生基因突变药物中的应用的制作方法
本发明属于医药技术领域。更具体地,涉及谷氨酰胺在制备抑制大肠杆菌产生基因突变药物中的应用。
背景技术:
基因突变属于一种自然现象,是千百年来生物进化的结果,其中微生物的基因突变较为常见。一些致病菌如大肠杆菌,在生长繁殖的过程中会产生基因突变,在使用抗生素的选择压力下,突变后可以继续生长的细菌被筛选出来并优势繁殖,并随着一次次的传代,抗生素对细菌的抑制作用逐渐减弱,甚至还产生了超级细菌,针对细菌感染的治疗更加困难。另外在实验用菌的培养中,被抗生素污染的细菌产生基因突变后,随着传代培养的进行,其基因型与原代细菌差异显著,对实验的结果容易产生较大的影响。
目前针对基因突变的细菌,主要采用提高突变后细菌对抗生素的敏感性等方法来抑制其生长繁殖。如中国专利申请cn102973542a公开了一种提高细菌对抗生素敏感性的小分子物质,所述小分子物质谷氨酰胺可以提高突变细菌对抗生素的敏感性,并且与葡萄糖连用具有明显的协同作用,最终达到杀菌效果。但是该技术方案主要是提高现有抗生素的杀菌效率,对于如何抑制细菌产生基因突变,减慢细菌耐药性产生,现有技术尚无相关的研究报道。而相对于提高抗生素的杀菌作用,从根本上抑制细菌基因突变的产生,具有更加重要的意义。
技术实现要素:
本发明要解决的技术问题是克服现有技术缺少针对抑制大肠杆菌产生基因突变研究的缺陷和不足,提供一种全新的谷氨酰胺在制备抑制大肠杆菌产生基因突变药物中的应用。
本发明的目的是提供一种谷氨酰胺在制备抑制大肠杆菌产生基因突变药物中的应用。
本发明上述目的通过以下技术方案实现:
谷氨酰胺在制备抑制大肠杆菌产生基因突变药物中的应用。
进一步地,所述大肠杆菌为大肠杆菌敏感菌。
更进一步地,所述大肠杆菌为大肠杆菌耐药菌。
进一步地,所述基因突变是在抗生素存在情况下传代产生的。
更进一步地,所述抗生素包括氨苄青霉素包括氨苄青霉素、羟氨苄青霉素、青霉素g、羧苄青霉素。
优选地,所述抗生素为氨苄青霉素。
进一步地,所述谷氨酰胺与抗生素的剂量比例按重量计为1:(0.001~0.3)。
优选地,所述谷氨酰胺与抗生素的剂量比例按重量计为1:(0.01~0.3)。
谷氨酰胺,学名2-氨基-4-氨甲酰基丁酸,英文glutamine(gln),是生物体内重要的氨基酸,有提供氮源促进蛋白质合成、增强力量和耐力、增强免疫系统、合成中药抗氧化剂谷胱甘肽等多方面作用。发明人经过大量的创造性劳动发现,临床大肠杆菌敏感菌或耐药菌在含有抗生素培养基的传代过程中,添加谷氨酰胺后,可以抑制大肠杆菌产生耐药基因突变,显著降低耐药基因的突变几率,减小传代后细菌对氨苄青霉素最低抑菌浓度的增加倍数,降低生存率,减慢大肠杆菌对氨苄青霉素产生耐药性;将添加或不添加谷氨酰胺传代30代后的细菌,感染小鼠,经谷氨酰胺和氨苄青霉素用治疗后,添加谷氨酰胺传代菌的小鼠血液、肝脏、肾脏和脾脏的细菌数量显著低于不添加谷氨酰胺传代菌,表明添加谷氨酰胺与氨苄青霉素的传代菌更容易被机体清除,也说明了谷氨酰胺加入后的传代菌对氨苄青霉素和谷氨酰胺联用的治疗不容易产生耐药性基因突变。
另外的,本申请还提供了一种减慢大肠杆菌耐药性产生的方法,将谷氨酰胺与抗生素联用。
本发明具有以下有益效果:
本发明提供了谷氨酰胺在制备抑制大肠杆菌产生基因突变药物中的新应用,谷氨酰胺和氨苄青霉素连用,经多次传代后可以抑制大肠杆菌产生耐药基因突变,显著降低耐药基因的突变几率,减小传代后细菌对氨苄青霉素最低抑菌浓度的增加倍数,降低生存率,动物实验也证明添加谷氨酰胺与氨苄青霉素的传代菌更容易被机体清除,达到减慢大肠杆菌对氨苄青霉素产生耐药性基因突变的效果。
附图说明
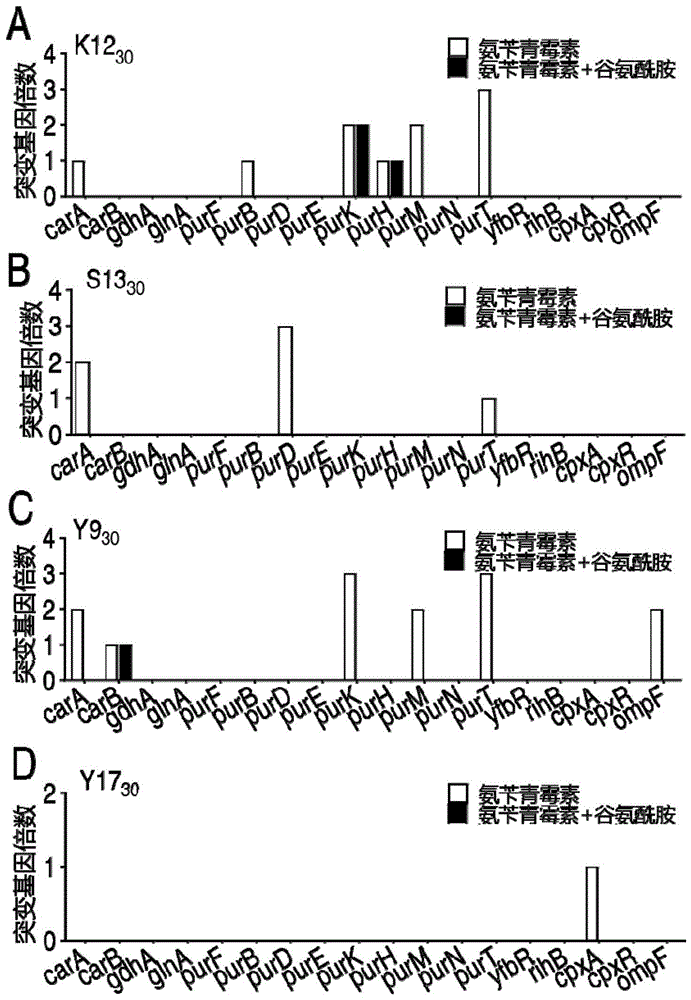
图1为实施例2大肠杆菌临床敏感菌和临床耐药菌体外传代30代菌的谷氨酰胺代谢通路和嘌呤代谢通路相关基因序列测定结果;
其中,图1a为大肠杆菌临床敏感菌k12;图1b为大肠杆菌临床敏感菌s13;图1c为大肠杆菌临床耐药菌y9;图1d为大肠杆菌临床耐药菌y17。
图2为实施例3大肠杆菌临床敏感菌和临床耐药菌体外传代菌最低抑菌浓度(mic)的测定结果;
其中,图2a为大肠杆菌临床敏感菌k12;图2b为大肠杆菌临床敏感菌s13;图2c为大肠杆菌临床敏感菌s14;图2d为大肠杆菌临床耐药菌y9;图2e为大肠杆菌临床耐药菌y17;图2f为大肠杆菌临床耐药菌y23。
图3为实施例3大肠杆菌临床敏感菌和临床耐药菌体外传代菌生存率的测定结果;
其中,图3a为大肠杆菌临床敏感菌k12;图2b为大肠杆菌临床敏感菌s13;图3c为大肠杆菌临床敏感菌s14;图3d为大肠杆菌临床耐药菌y9;图3e为大肠杆菌临床耐药菌y17;图3f为大肠杆菌临床耐药菌y23。
图4为实施例4大肠杆菌临床敏感菌和临床耐药菌体外传代30代菌的小鼠体内器官细菌存活数量的实验结果;
其中,图4a为大肠杆菌临床敏感菌k12;图4b为大肠杆菌临床耐药菌y9。
图5为对比例1苏氨酸体外传代菌株耐药性研究中最低抑菌浓度的测定结果。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
其中,所用细菌样品具体信息详见表1。
表1细菌样品信息
上述细菌均由厦门大学附属中山医院提供,保藏于中山大学生命科学学院细菌耐药研究实验室。其中,大肠杆菌y9,y17,y23来源:中山大学博士毕业论文《代谢物逆转多重耐药大肠埃希菌对氨苄青霉素抗性的研究》,2014年,赵贤亮;大肠杆菌k12、y17、y23来源:中国专利申请cn107929741b。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1临床敏感菌和临床耐药菌的体外传代实验
1.1样品制备
挑取临床分离的大肠杆菌敏感菌k12、s13、s14和耐药菌y9、y17、y23单克隆(初始株wt),分别接种于lb液体培养基中,37℃、200rpm培养16h,8000g离心5min,收集细菌,再用无菌生理盐水悬浮洗涤菌体,重复三次。将制备好的细菌用生理盐水重悬至od600为0.2,分装5ml于试管中备用。
1.2临床敏感菌和临床耐药菌的传代
将每个菌株分成2组,一组为氨苄青霉素单用组(amp,简写为a),添加抗生素浓度分别为k12:0.003125mg/ml,s13:0.003125mg/ml,s14:0.0125mg/ml,y9:0.8mg/ml,y17:0.8mg/ml,y23:0.8mg/ml;另一组为同浓度的氨苄青霉素和20mm谷氨酰胺联用组(amp+glutamine,简写为ag)。上述各组于37℃、200rpm培养6h,试管中存活的细菌分别称为抗生素单用传代的第1代细菌(a1)与抗生素和谷氨酰胺联用传代的第1代细菌(ag1);将第1代细菌分别再接种于仅含抗生素或同时含抗生素和谷氨酰胺的lb培养基中过夜培养,然后按照相同方法分装、培养,分别获得a2和ag2;由此类推直至获得a30和ag30。随着传代次数增加,需按照最低抑菌浓度(mic)变化相应提高添加抗生素的浓度,而谷氨酰胺的浓度不变。
实施例2传代菌谷氨酰胺代谢通路和嘌呤代谢通路主要基因序列分析
对临床敏感菌k12、s13菌株和临床耐药菌y9、y17菌株的初始菌(wt)及各自第30代细菌(氨苄青霉素传代菌和谷氨酰胺协同氨苄青霉素传代菌)的谷氨酰胺代谢(cara,carb,gdha,glna)、嘌呤代谢(purf,purb,purd,pure,purk,purh,purm,purn,purt,yfbr,rihb)、双调节系统(cpxa,cpxr)和外膜抗生素进入通道蛋白(ompf)通路主要耐药基因的进行序列测定。所用测序引物参见表2。
表2测序引物
测序后所得序列进行blast分析,与相应细菌初始菌的基因序列进行比较发现:对于k12菌株,k12-30a中cara、purb、purk、purh、purm、purt等基因发现1~3个错义突变位点,而k12-30ag只有purk和purh发现错义突变(图1a);对于y9菌株,y9-30a中cara、carb、purk、purt、purm、ompf等基因发现1~3个错义突变位点,而k12-30ag只有carb发现错义突变;对于s13和y17菌株,只有s13-30a的cara、purd和purt以及y17-30a的cpxa基因发现1~3个错义突变位点,而s13-30ag和y9-30ag却没有发生突变(图1b)。这些结果说明,谷氨酰胺协同氨苄青霉素传代可以抑制大肠杆菌产生耐药基因突变。
实施例3体外传代菌株耐药性研究
3.1.最低抑菌浓度的测定
取6种细菌(k12、s13、s14、y9、y17、y23)按照实施例1的2种传代方式(抗生素单用或抗生素和谷氨酰胺联用)获得的第0、5、10、15、20、25和30传代细菌,采用微量肉汤稀释法分别测定对氨苄青霉素的最低抑菌浓度,具体方法如下:
将各代传代菌,分别接种于lb液体培养基中,37℃、200rpm培养16h;分别转接于5mllb培养基中,培养至od600为0.5,稀释10倍;氨苄青霉素倍比稀释加到无菌96孔板中的第1至第11列,每孔100μl,第12列不加抗生素作为对照;每孔中加10μl菌液(约105cfu细菌,即菌落形成单位);密封后置37℃培养箱中16~20h后,以不生长孔的抗生素浓度为最低抑菌浓度(mic)。生物学重复3次。
结果参见图2,可见,随着传代代数增加,两种传代方式培养的细菌,其对抗生素的最低抑菌浓度都是逐渐增加的,但是谷氨酰胺协同抗生素传代组(ag组)比仅仅添加抗生素传代组(a组)的最低抑菌浓度明显要低,说明谷氨酰胺会抑制细菌产生对抗生素耐药性的基因突变。
具体结果如下:k12的mic从最初的0.00625mg/ml分别增加到0.2mg/ml(a组,添加抗生素组)和0.05mg/ml(ag组,添加抗生素和谷氨酰胺组),仅添加抗生素组耐药性增加了32倍,而添加抗生素和谷氨酰胺组耐药性仅增加了8倍,耐药性下降了4倍(图2a);s13的mic从最初的0.00625mg/ml增加到0.8mg/ml(仅仅添加抗生素)和0.05mg/ml(添加抗生素和谷氨酰胺),仅添加抗生素组耐药性增加了128倍,而添加抗生素和谷氨酰胺组耐药性仅增加了8倍,耐药性下降16倍(图2b);s14的mic从最初的0.0125mg/ml增加到1.6mg/ml(仅仅添加抗生素)和0.1mg/ml(添加抗生素和谷氨酰胺),仅添加抗生素组耐药性增加了128倍,而添加抗生素和谷氨酰胺组耐药性仅增加了5倍,耐药性下降25.6倍(图2c);y9的mic从最初的0.4mg/ml增加到3.2mg/ml(仅仅添加抗生素)和0.8mg/ml(添加抗生素和谷氨酰胺),仅添加抗生素组耐药性增加了8倍,而添加抗生素和谷氨酰胺组耐药性仅增加了2倍,耐药性下降4倍(图2d);y17的mic从最初的1.6mg/ml增加到6.4mg/ml(仅仅添加抗生素)和3.2mg/ml(添加抗生素和谷氨酰胺),仅添加抗生素组耐药性增加了4倍,而添加抗生素和谷氨酰胺组耐药性仅增加了2倍,耐药性下降2倍(图2e);y23的mic从最初的1.6mg/ml变为3.2mg/ml(仅仅添加抗生素)和1.6mg/ml(添加抗生素和谷氨酰胺),仅添加抗生素组耐药性增加了2倍,而添加抗生素和谷氨酰胺组耐药性仅增加了1倍,耐药性下降2倍(图2f)。
3.2杀菌率的测定
采用杀菌实验分别测定6种细菌2种传代方式产生的的第1、5、10、20和30代细菌对氨苄青霉素的耐药性,具体方法如下:
将这些各代传代菌,分别接种于lb液体培养基中,37℃、200rpm培养16h;8000g,离心5min收集,再用无菌m9培养基悬浮菌体,重复三次操作;用m9培养基重悬菌体至5×106cfu/ml,分装4ml于试管中;每种传代细菌都分成3组:1组为空白对照,加入1ml生理盐水;2组仅仅加入同体积生理盐水溶解的抗生素;3组加入同体积生理盐水溶解的抗生素和谷氨酰胺;生物学重复3次;其中,加入的抗生素含量依次为:两种k12的传代菌为0.2mg/ml,两种s13的传代菌为0.8mg/ml,两种s14的传代菌为1.6mg/ml,两种y9的传代菌为3.2mg/ml,两种y17的传代菌为6.4mg/ml,两种y23的传代菌为3.2mg/ml,加入或不加入谷氨酰胺20mm。所有试管均在37℃、200rpm孵育,6h后各取100μl样品,进行系列稀释,最后取10μl各梯度稀释菌液点在lb固体培养板上,37℃培养16h,计数菌落形成单位(colony-formingunits,cfu);空白对照样品作为起始细菌数,每平板含20~200个菌落的数据可用于统计分析;细菌生存率是处理后的细菌cfu与空白对照组细菌cfu的百分比。
结果参见图3,可见,随着传代代数增加,两种传代方式培养的细菌在抗生素中存活细菌数量都增加,生存率都升高,说明传代使细菌对抗生素的耐药基因突变是逐渐增加的。尤其需要注意的是,同一代的传代细菌如仅抗生素传代30代菌k12-30a和谷氨酰胺协同抗生素传代30代菌k12-30ag,不论是仅仅加入抗生素,或是加入谷氨酰胺和抗生素后,k12-30ag的生存率都比k12-30a的生存率要低,说明谷氨酰胺协同抗生素传代菌的耐药性要比单用抗生素的传代菌低。
添加抗生素和谷氨酰胺传代组比仅仅添加抗生素传代组生存率要明显降低,说明添加了谷氨酰胺,在抗生素存在情况下,其耐药性的产生会变慢,表明谷氨酰胺可抑制细菌耐药突变的产生。
具体结果如下:对于k12菌株,氨苄青霉素传代菌(k12-a)的第1、5、10、20和30代细菌,在只加氨苄青霉素杀菌时细菌存活率依次为4.32%、12.34%、34.63%、85.67%和96.9%,谷氨酰胺协同氨苄青霉素杀菌时细菌存活率为0.01%、0.05%、0.26%、2.52%和12.48%。添加抗生素和谷氨酰胺组传代菌(k12-ag)的第1、5、10、20和30代细菌,只加氨苄青霉素杀菌时细菌存活率为4.32%、8.25%、11.25%、26.17%和56.74%,谷氨酰胺协同氨苄青霉素杀菌时细菌存活率为0.01%、0.03%、0.06%、0.3%和1.18%。该数据说明:1)抗生素传代后细菌耐药性增加,但如果传代时加入了谷氨酰胺,则会抑制细菌对抗生素的耐药基因突变,其减缓程度可按照如下公式计算:同一传代细菌减缓抗生素耐药性的倍数=氨苄青霉素传代细菌存活率/添加抗生素和谷氨酰胺组传代菌存活率。因而,当用氨苄青霉素杀菌时,第1、5、10、20和30代谷氨酰胺和抗生素联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.5倍、3倍、2.7倍和1.7倍。2)谷氨酰胺使其耐药性消减程度增加。当用谷氨酰胺协同抗生素杀菌时,第1、5、10、20和30代抗生素和谷氨酰胺联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.83倍、4.54倍、8.32倍和10.55倍(图3a)。
其他菌株也有类似的结果,概述如下:
对于s13菌株,1)当用氨苄青霉素杀菌时,第1、5、10、20和30代谷氨酰胺和抗生素联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、2.03倍、3.47倍、3.65倍和4.34倍。2)谷氨酰胺使其耐药性消减程度增加。当用谷氨酰胺协同抗生素杀菌时,第1、5、10、20和30代抗生素和谷氨酰胺联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、2.45倍、5.55倍、7.75倍和13.24倍(图3b)。
对于s14菌株,1)当用氨苄青霉素杀菌时,第1、5、10、20和30代谷氨酰胺和抗生素联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.5倍、2.11倍、4.62倍和4.73倍。2)谷氨酰胺使其耐药性消减程度增加。当用谷氨酰胺协同抗生素杀菌时,第1、5、10、20和30代抗生素和谷氨酰胺联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、2.23倍、3.8倍、12.07倍和32.45倍(图3c)。
对于y9菌株,1)当用氨苄青霉素杀菌时,第1、5、10、20和30代谷氨酰胺和抗生素联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.68倍、1.87倍、2.02倍和1.97倍。2)谷氨酰胺使其耐药性消减程度增加。当用谷氨酰胺协同抗生素杀菌时,第1、5、10、20和30代抗生素和谷氨酰胺联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.73倍、2.74倍、5.38倍和4.73倍(图3d)。
对于y17菌株,1)当用氨苄青霉素杀菌时,第1、5、10、20和30代谷氨酰胺和抗生素联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.5倍、1.54倍、1.84倍和1.79倍。2)谷氨酰胺使其耐药性消减程度增加。当用谷氨酰胺协同抗生素杀菌时,第1、5、10、20和30代抗生素和谷氨酰胺联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.5倍、2.57倍、5.49倍和5.44倍(图3e)。
对于y23菌株,1)当用氨苄青霉素杀菌时,第1、5、10、20和30代谷氨酰胺和抗生素联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.29倍、1.51倍、1.6倍和1.49倍。2)谷氨酰胺使其耐药性消减程度增加。当用谷氨酰胺协同抗生素杀菌时,第1、5、10、20和30代抗生素和谷氨酰胺联用组传代菌比氨苄青霉素单用组的敏感性分别提高了1倍、1.73倍、2.72倍、5.92倍和6.24倍(图3f)。
实施例4体外传代菌小鼠体内实验
临床敏感菌k12菌株和临床耐药菌y9菌株的初始菌(wt)、两者的氨苄青霉素传代30代细菌(30a)、两者的添加抗生素和谷氨酰胺组传代30代菌(30ag)合计6株细菌,分别感染小鼠。然后,感染小鼠分别采用4种方式进行处理,并对小鼠体内不同器官细菌残留的数量进行研究,具体方法如下:
balb/c小鼠(六周,体重约20g左右)由中山大学实验动物中心提供,每株细菌需要24只小鼠,雌雄各半;将小鼠随机分为4组(每组6只),分别为:生理盐水对照组,100mg/kg谷氨酰胺处理组,320mg/kg氨苄青霉素处理组,100mg/kg谷氨酰胺协同320mg/kg氨苄青霉素处理组。
将每种细菌,分别接种于lb液体培养基中,37℃、200rpm培养16h,8000g,离心5min收集,再用无菌生理盐水悬浮菌体,重复三次操作。用生理盐水重悬菌体至2×107cfu/ml,每只小鼠腹腔注射菌液200μl;注射菌液1h和12h后按照上述分组分别进行相应处理;最后一次治疗后24h,取小鼠血清100μl、肝以及肾脏和脾脏100mg,加入0.85%生理盐水制备为5%的匀浆液,充分研磨后进行倍比稀释,取10μl点板计数,然后换算为cfu/毫升血液或肝脏、肾脏和脾脏/克,然后采用对数作图。
结果参见图4,比较k12和y9野生型(wt)及其第30代细菌(30a和30ag)在不同处理下小鼠组织中的细菌数量发现,生理盐水对照组、谷氨酰胺处理组和氨苄青霉素处理组的wt、30a和30ag的细菌数量没有显著差别,而谷氨酰胺协同氨苄青霉素治疗后,wt、30a和30ag三个组中的细菌含量均显著下降。具体地,k122感染后的治疗试验中,与只加氨苄青霉素组相比较,谷氨酰胺协同氨苄青霉素治疗后,血清中细菌含量下降3.3、2.3和3.2倍;肝脏中细菌含量下降11、3.2和5.8倍;脾脏中细菌含量下降7.4、2.2和3.6倍;肾脏中细菌含量下降6.9、2.8和4.2倍(图4a)。y9感染后的治疗试验中,与只加氨苄青霉素组相比较,谷氨酰胺协同氨苄青霉素治疗后,血清中细菌含量下降37.2、1.7和24.7倍;肝脏中细菌含量下降9.1、3.1和6.4倍;脾脏中细菌含量下降8.9、2.1和4.4倍;肾脏中细菌含量下降10.4、2.4和5.4倍(图4b)。同时也发现,在谷氨酰胺协同氨苄青霉素抗生素治疗组中,k12-30a比k12-wt,y9-30a比y9-wt在血清、肝脏、肾脏和脾脏中的细菌含量显著增加(p<0.01或0.05),而k12-30ag与k12-wt,y9-30ag与y9-wt组却无显著性变化。
这些结果说明:1)谷氨酰胺和氨苄青霉素联用的传代菌不易使细菌产生对抗生素的抗性,2)谷氨酰胺协同抗生素更容易清除小鼠体内细菌,尤其是对谷氨酰胺和氨苄青霉素联用的传代菌表现更为显著,说明谷氨酰胺加入后的传代菌对抗生素和谷氨酰胺联用的治疗可以抑制大肠杆菌产生耐药基因突变。
对比例1苏氨酸体外传代菌株耐药性研究
据文献(yejz,linxm,chengzx,etal.identificationandefficacyofglycine,serineandthreoninemetabolisminpotentiatingkanamycin-mediatedkillingofedwardsiellapiscicida[j].journalofproteomics,2018:s1874391918302082.doi:10.1016/j.jprot.2018.05.006.)报道,苏氨酸具有促进卡那霉素杀菌效果的作用。参考本发明实施例1、3的实验方法,测定苏氨酸的体外传代菌株最低抑菌浓度。其中,所用菌种为大肠杆菌敏感菌k12和耐药菌y9。结果参见图5。
由图5可见,随着传代代数增加,单独采用氨苄青霉素和氨苄青霉素+苏氨酸的传代方式培养的细菌,对抗生素的最低抑菌浓度都是逐渐增加的,其中,针对大肠杆菌敏感菌k12,苏氨酸+氨苄青霉素传代菌与仅仅氨苄青霉素传代菌是一样的,并且,大肠杆菌耐药菌y9的10代、20代、25代和30代的苏氨酸+氨苄青霉素传代菌的最低抑菌浓度均高于单用氨苄青霉素的传代菌。这些结果均表明苏氨酸并不能减慢细菌耐药性的产生。可见,具有促进抗生素杀菌作用的小分子物质不一定能减慢细菌耐药性的产生,其效果无法预料。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!