莫诺苷结合干细胞在制备软骨修复材料中的应用的制作方法
本发明涉及莫诺苷的应用,尤其是涉及中药提取物莫诺苷诱导骨髓间充质干细胞向成软骨细胞方向分化,并且在动物体内验证通过植入包裹骨髓间充质干细胞的含莫诺苷水凝胶可促进骨软骨损伤修复的莫诺苷结合干细胞在制备软骨修复材料中的应用。
背景技术:
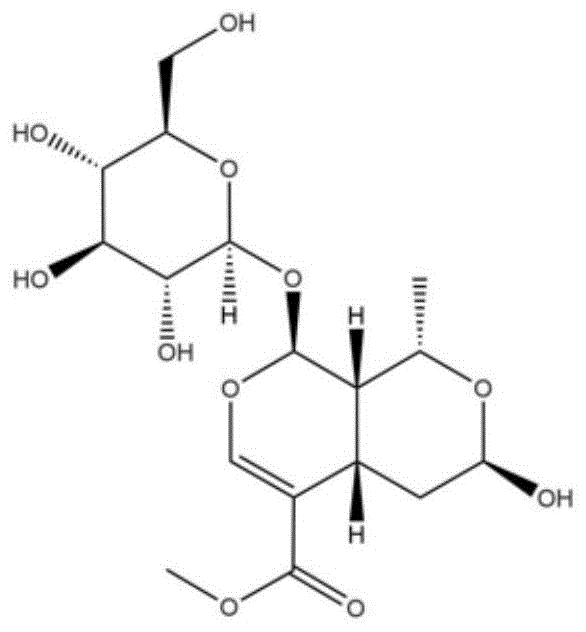
莫诺苷(morroniside),分子式c17h26o11(图1),是一种环烯醚萜苷类化合物,最早从山茱萸科(cornaceae)植物山茱萸(cornus)的果肉中提炼出来,后陆续在金银花(lonicerajaponica)、灰毡毛忍冬(loniceramacranthoides)、接骨木(sambucuswilliamsiihance)等中药材中,也发现莫诺苷的存在。作为一种中药单体,莫诺苷是中药六味地黄丸、莲花清瘟胶囊、归右丸等多种中成药的有效成分之一,具有多种生物学作用。
截止到目前研究,莫诺苷的生物学作用主要体现在以下方面:
1、抗凋亡作用:莫诺苷可抑制过氧化氢导致的神经细胞凋亡;抑制雷公藤导致的肝细胞凋亡及急性心肌梗死导致的心肌细胞凋亡;并且可抑制高糖环境导致的心肌细胞、人脐静脉内皮细胞的凋亡;还可抑制一氧化碳导致的神经细胞凋亡。
2、促增殖、分化作用:莫诺苷可促神经干细胞增殖,并在一定条件下分化为神经元;可促进局灶性缺血后的脑组织、心肌组织周围血管再生。
3、抗炎作用:莫诺苷可参与肝脏细胞、神经细胞、软骨细胞、成骨细胞、心肌细胞的炎症代谢。可通过抑制炎症反应对心肌组织、脑组织的缺血再灌注损伤起到保护作用;对骨关节炎有治疗作用。
4、对损伤后血液流变学的影响:在缺血再灌注损伤动物模型中,莫诺苷可抑制血小板聚集,并降低血液黏度、血浆黏度、红细胞聚集率、血浆纤维蛋白含量,改善损伤后血液流变学异常。
5、抗肿瘤作用:莫诺苷可抑制人恶性黑色素瘤细胞增殖并促进其凋亡,并且作为有效组分应用于抗甲状腺肿瘤、抗膀胱癌的药物中,但其具体生物学作用仍有待研究。
6、其他:莫诺苷还作为有效组分被应用于治疗腮腺炎、支气管炎、支气管哮喘、慢性肾衰药物及阵痛药物中,但其在相关的药物中的具体生物学作用仍有待研究。
关节软骨是一种覆盖于人或动物关节表面的,具有独特的组织构成和结构的生物组织,用于肢体活动时的应力承载,并减少运动时关节面的摩擦力,因此在生物体的运动过程中具有十分重要的作用。关节软骨属于透明软骨,由软骨细胞以及其细胞外基质构成,是一种高度分化的组织。尽管软骨细胞在体外细胞培养中具有增殖能力,但由于成熟的关节软骨中所含有细胞密度并不高,且其缺乏血液、神经、或淋巴液为其提供营养,因此其自我修复及再生能力极差。关节软骨可由于急性损伤、慢性磨损、年龄及全身性质疾病等发生损害,随着软骨损伤的进展以及软退化的加剧,将造成关节不可逆的退变,并导致骨关节炎(osteoarthritis,oa)的发生,最终导致关节功能的丧失,并对生物个体的运动功能造成重大影响。
关节软骨由软骨细胞和细胞外基质构成,呈现一种多层次的结构:其表面层细胞体积较小,呈扁平状,被大量的稠密的细胞外基质包绕,沿关节表面的运动方向切线排列。表面层细胞可分泌人润滑素(lubricin)以减少运动时所带来的摩擦力。在中间层及深层,软骨细胞体积较大,呈圆型,沿垂直于关节表面的纵轴排列。中间层细胞可分泌典型的软骨细胞外基质组分,并为关节软骨提供了稳定的生化环境,而深层的软骨细胞相对于中间层的细胞体积更大,同样具有很高的分泌活性,并且同软骨下骨具有相互作用,从而维持关节生物学结构的稳定。关节软骨由大约(重量比)75%的水分,15%的胶原(collagen),10%的蛋白多糖(proteoglycan)以及小于2%的软骨细胞所构成。正常关节软骨中胶原纤维主要表达ⅱ型胶原,其也是软骨组织中特异性表达的胶原类型,为关节软骨提供主要的抗牵张能力。大分子的软骨中特异性表达的蛋白多糖被称为聚集蛋白聚糖(aggrecan),其被稳定地固定于胶原纤维形成的网状结构中,使得关节软骨能够承受压力变化所造成的负荷。在成熟的关节软骨中,软骨基质纤维结构在关节表面层平行于关节面,并在中间层及深层呈纵型垂直于关节表面的结构,从而更好地适应关节软骨所承受的力学环境。
在关节软骨的生成中,其软骨细胞由gdf-5(growthanddifferentiationfactor-5)基因表达阳性的间充质干细胞(mesenchymalstemcell,msc)分化而成。msc向软骨细胞的分化受到多种细胞因子、化学因子及信号通路的调节:诸如转化生长因子(transforminggrowthfactorβ,tgf-β)超家族、成纤维细胞生长因子(fibroblastgrowthfactors,fgfs)、胰岛素样生长因子(insulin-likegrowthfactors,igfs)、骨形态发育蛋白(bonemorphogeneticproteins,bmps)等多种细胞因子及活性物质,均可通过相关的信号通路调控软骨细胞的生成。sma-mad相关(smaandmadrelated,smad)蛋白所参与的smad信号通路是软骨细胞生成过程中的关键信号通路。smad蛋白分为受体活化型(receptor-regulatedsmads,r-smads)、共同通路型(common-mediatorsmads,co-smads)和抑制性(inhibitorysmads,i-smads)三类。tgf-β和bmp可同其细胞膜受体的胞外段结合,并通过其胞内段的具有丝氨酸/苏氨酸激酶活性的区域(serine/threoninekinaseactivitydomains),磷酸化相应的r-smads(tgf-β通路需要smad2和smad3,而bmp通路需要smad1,5,8)。磷酸化的r-smads同smad4(为co-smad)形成复合体并入核,激活sox9(sryrelatedhmgbox9)基因,并启动间充质干细胞向软骨细胞分化的过程。当软骨细胞发育成熟,即开始合成并分泌相应的细胞外基质,并在多种因素的调控下排列其结构,形成成熟的软骨组织。有文献表名,smad3蛋白在msc向软骨细胞方向分化的过程中其核心作用。
节软骨损伤可由创伤、软骨或软骨下骨病变、全身系统性疾病(如风湿免疫性疾病)等多种原因造成;此外,年龄及关节软骨的磨损也可导致关节软骨的退行性变,导致软骨细胞代谢的失衡,并最终可引发oa。软骨损伤可根据是否穿过软骨下骨抵达骨髓区而将损伤分为部分厚度软骨损伤和全厚度软骨损伤。对于部分厚度软骨损伤,由于损伤部位缺乏血液营养及干细胞的聚集,其损伤区域通常很难自我修复。而对于全厚度软骨损伤,由于损伤抵达骨髓区,含有丰富营养成分和间充质干细胞的骨髓血可进入损伤区域并启动自我修复程序,但其生成的软骨通常为纤维软骨而非关节结构正常的透明软骨。修复损伤的纤维软骨缺乏良好的力学性能,往往在持久的力学负荷中退变更快,最终导致损伤再现。
在人体内,关节软骨损伤通常不会在最初就累及甚至穿过软骨下骨,从而缺乏自我修复的能力。因此,采用临床治疗手段对于软骨损伤进行修复是有必要的。药物疗法,包括口服药物及关节腔注射药物疗法,目前在治疗关节软骨损伤及退行性病变时仍广泛应用。非甾体抗炎药物,在治疗急慢性炎症性骨关节病变时仍属于一线药物,但其副作用同样值得关注。软骨保护类药物,如葡萄糖胺类及硫酸软骨素类药物等,目前仅应用于慢性退变性软骨病变,且其治疗效果具有争议性。类似的,关节腔内润滑剂,目前也基本只应用退变性骨关节病变,且在其应用过程中需进行有创操作。上述药物的应用基本只能缓解症状或延缓软骨退变的进一步发生,并无明显的促软骨修复作用。对应的,一些生物制剂及小分子化合物,如富血小板血清(plateletrichplasma,rpr)、tgf-βs、kartogenin(kgn)等,则在动物实验及临床试验中被证明对软骨修复具有一定的作用,但其进一步的应用仍有待推广。值得注意的是,一些传统中药,如黄连素、骨碎补等,在实验中被证明具有软骨保护作用,且作为有效组分被应用于针对软骨损伤病变的中药方剂中。
手术治疗被用于严格的保守治疗后仍遗留症状的患者,包括关节清创术、截骨矫形术、骨髓刺激手术、自体骨软骨移植手术等。关节清理手术及调整关节力线的手术可去除对应的软骨损伤因素,对减缓软骨的进一步损伤具有中药作用,但无明显的促软骨修复作用。骨髓刺激手术,如钻孔减压术,在年轻患者小面积软骨损伤的治疗中具有一定效果,但针对大面积软骨损伤及高龄患者效果较差。自体软骨移植、骨软骨移植及软骨细胞移植同样适用于小面积的软骨损伤患者,但其应用在较大面积的软骨损伤中受到限制,且存在软骨供区并发症等负面影响。
不同于软骨细胞,msc在人体内具有丰富的来源,且具有良好的增殖分化能力,可以分化为包括软骨组织在内的多种组织,因此被认为是一种极佳的选择以应用于软骨损伤修复。无论是单纯应用间充质干细胞,或是结合其他软骨损伤修复方法(如截骨矫形术、prp关节腔内注射等),间充质干细胞在软骨损伤治疗上的应用均取得了一定效果。在msc移植治疗软骨损伤的应用中,其普遍问题表现在如何将细胞稳定地维持在损伤区域避免其泄漏,给他们提供良好的稳定的成长环境以避免周围有害环境对细胞的侵袭,以及如何为、使细胞保持良好的成软骨分化趋向并在分化后维持软骨细胞的功能。因此,在最新的研究中,结合医学、生物学与材料学技术的组织工程技术成为了解决问题的必须方案。在目前的软骨组织工程研究中,不同的细胞支架、水凝胶以及各种生物活性物质及小分子化合物的应用,在实验研究中给予了人们在软骨损伤修复上很多的提示,考虑到我国在中药研究中的独特优势,将中药研究同组织工程研究相结合,可以为今后的研究提供新的思路。
技术实现要素:
本发明的目的在于提供莫诺苷结合干细胞在制备软骨修复材料中的应用。
莫诺苷结合干细胞在制备软骨修复材料中的应用,所述莫诺苷(morroniside)的分子式为c17h26o11,结构式如下:
本发明从大鼠骨髓中提取了大鼠msc,并检测了其成脂、成软骨、成骨方向的三细胞系分化能力,检测了其表面cd34、cd44、cd45、cd90分子(参见图2和3),符合msc特性。莫诺苷可促进体外培养的大鼠msc增殖(参见图4),并诱导大鼠msc向软骨细胞方向分化,表现为提高其分化后aggrecan、ⅱ型胶原α1(col2a1)、sox9的基因表达(参见图5)及其蛋白表达,并抑制其ⅰ型胶原α1(col1a2)、ⅹ型胶原的蛋白表达(参见图6)。
体外细胞实验表明,莫诺苷可通过促进体外培养的大鼠msc的smad3信号通路的磷酸化,提高其sox9蛋白水平的表达(参见图7),但并不影响其内源性tgf-β3基因的表达水平(参见图8),通过ly2157299抑制tgf-β受体,将抑制体外培养的大鼠msc的smad3信号通路的磷酸化作用,并降低其sox9蛋白水平的表达。对施以ly2157299的大鼠msc施以莫诺苷,则可部分逆转ly2157299对smad3磷酸化的抑制作用(参见图9)。通过u0126抑制erk信号通路的因酸化,将抑制体外培养的大鼠msc的smad3信号通路磷酸化作用,并降低其sox9蛋白水平的表达,对施以u0126的大鼠msc施以莫诺苷,则可部分逆转u0126对smad3磷酸化的抑制作用(参见图10)。通过(e)-sis3抑制smad3信号通路的因酸化,将抑制体外培养的大鼠msc的smad3信号通路磷酸化作用,并降低其sox9蛋白水平的表达,对施以(e)-sis3的大鼠msc施以莫诺苷,并不能逆转(e)-sis3对smad3磷酸化的抑制作用(参见图11)。
本发明制备含50μm莫诺苷的2%海藻酸钠水凝胶(参见图12),并检测其于37℃时在pbs缓冲液中的降解速率及其对浸泡pbs液的ph改变(参见图13和14)。在后续的处理中,所选用的载莫诺苷海藻酸钠水凝胶,其海藻酸钠浓度均为2%,其莫诺苷浓度均为50μm。
本发明所制备的载莫诺苷海藻酸钠水凝胶对大鼠msc无细胞毒性(参见图15)。
实验表明,通过对大鼠膝关节股骨髁间进行钻孔,构建了大鼠的骨软骨损伤模型,并通过注射包裹msc的载莫诺苷海藻酸钠水凝胶系统(msc+morroniside+gel组别),注射包裹msc的单纯海藻酸钠水凝胶系统(msc+gel组别),或不予任何处理措施(control组别),对莫诺苷结合干细胞在制备骨软骨损伤修复材料中的应用潜力进行了探索(附图16)。msc+morroniside+gel组别相比较于msc+gel组别或control组别,其关节在大体外观上修复的更为良好,表现在其关节面更为平整、光滑,无明显残留的损伤,而另外两组均多少残留损伤痕迹,其关节表面不够光滑、平整,表面软骨存在缺损或裂隙(参见图17)。msc+morroniside+gel组别相比较于msc+gel组别或control组别,其软骨缺损修复的更为良好,表现在其原软骨缺损区域在显微镜下,可以看到更多、更厚的软骨细胞外基质的合成,而另外两组的软骨细胞外基质更薄或仍存在缺损(参见图18)。msc+morroniside+gel组别相比较于msc+gel组别或control组别,其骨缺损修复的更为良好,表现在其原骨缺损区域的micro-ct显像相较于另外两组,无论是2d显像或是3d重建显像,均可以看到更多的骨量生成(参见图19),通过软件统计,可见其骨小梁数量、骨密度均较另外两组均更高,但骨小梁厚度无明显区别(参见图20)。
本发明在实施对软骨损伤的治疗中可达到下列效果:
(1)有效促进体外培养的大鼠msc向软骨细胞方向分化。
(2)有效促进大鼠骨软骨损伤的修复,包括使骨损伤区域更多的生成新骨,使软骨损伤区域生成更多、更厚的软骨基质,从而获得更为平整光滑的关节面,更好的修复损伤区域。
附图说明
图1为莫诺苷的分子结构式。
图2为骨髓来源的大鼠msc向成脂的显微镜下100倍及400倍放大图像。在图2中,a成脂,为油红o染色;b成骨,为茜素红染色;c成软骨,为阿利新蓝染色。
图3为骨髓来源的大鼠msc表面cd分子流式细胞学鉴定,其cd34、cd45呈阴性,cd44、cd90呈阳性。
图4为cck8试剂盒检测不同浓度莫诺苷(10μm、50μm、100μm)对大鼠msc促增殖作用的统计分析结果(*p<0.05,****p<0.0001)。
图5为rt-pcr技术检测不同浓度莫诺苷(10μm、50μm、100μm)诱导大鼠msc向软骨细胞方向分化14天后其aggrecan、col2a1、sox9基因水平变化的统计分析结果(*p<0.05,**p<0.01,***p<0.001,****p<0.0001)。
图6为westernblotting技术检测不同浓度莫诺苷(10μm、50μm、100μm)诱导大鼠msc向软骨细胞方向分化14天后其aggrecan、col2a1、col1a2、col10蛋白水平变化。
图7为westernblotting技术检测不同浓度莫诺苷(10μm、50μm、100μm)诱导大鼠msc向软骨细胞方向分化14天后其sox9蛋白水平及smad3磷酸化水平的变化。
图8为rt-pcr技术检测不同浓度莫诺苷(10μm、50μm、100μm)诱导大鼠msc向软骨细胞方向分化14天后其内源性tgf-β3的基因水平变化的统计分析结果(p>0.05)。
图9为westernblotting技术检测加入tgf-β受体抑制剂ly2157299(5μm)的同时,加入莫诺苷(50μm)诱导大鼠msc向软骨细胞方向分化14天后其sox9蛋白水平,smad3磷酸化水平的变化。
图10为westernblotting技术检测加入erk信号通路抑制剂u0126(10μm)的同时,加入莫诺苷(50μm)诱导大鼠msc向软骨细胞方向分化14天后其sox9蛋白水平,erk1/2磷酸化水平以及smad3磷酸化水平的变化。
图11为westernblotting技术检测加入smad3受体抑制剂(e)-sis3(5μm)的同时,加入莫诺苷(50μm)诱导大鼠msc向软骨细胞方向分化14天后其sox9蛋白水平,smad3磷酸化水平的变化。
图12为含50μm莫诺苷的2%海藻酸钠水凝胶凝结后外观。
图13为含50μm莫诺苷的2%海藻酸钠水凝胶在37℃恒温条件下,浸泡入pbs缓冲液后其剩余质量(g)受其浸泡时间(h)的影响的变化关系。
图14为含50μm莫诺苷的2%海藻酸钠水凝胶在37℃恒温条件下,浸泡入pbs缓冲液后其浸泡液ph受其浸泡时间(h)的影响的变化关系。
图15为采用live/dead试剂盒对植入含50μm莫诺苷的2%海藻酸钠水凝后0天及3天的大鼠msc进行检测,红色(ethidiumhomodimer-1染色)为死亡细胞,绿色(calceinam染色)为存活细胞,merged为前两者合成后图像。
图16为大鼠膝关节股骨髁间骨软骨缺损模型构建及包裹msc的载莫诺苷海藻酸钠水凝胶系统植入的手术过程。
图17为大鼠膝关节股骨髁间骨软骨缺损模型构建后,分别采取不处理(control),注射包裹msc的单纯海藻酸钠水凝胶系统(msc+gel)以及注射包裹msc的载莫诺苷海藻酸钠水凝胶系统(msc+morroniside+gel)的处理措施并饲养4周后,大鼠膝关节股骨髁手术钻孔部位的大体观,sham为未予髁间钻孔,暴露膝关节后直接缝合的假手术组。
图18为大鼠膝关节股骨髁间骨软骨缺损模型构建后,分别采取不处理(control)、注射包裹msc的单纯海藻酸钠水凝胶系统(msc+gel)以及注射包裹msc的载莫诺苷海藻酸钠水凝胶系统(msc+morroniside+gel)的处理措施并饲养4周后,大鼠膝关节股骨髁手术钻孔区域的he切片染色及番红o-固绿联合染色切片镜下观(40倍放大,虚线a之间部分为钻孔部位)。
图19为大鼠膝关节股骨髁间骨软骨缺损模型构建后,分别采取不处理(control)、注射包裹msc的单纯海藻酸钠水凝胶系统(msc+gel)以及注射包裹msc的载莫诺苷海藻酸钠水凝胶系统(msc+morroniside+gel)的处理措施并饲养4周后,大鼠膝关节股骨端micro-ct表现。2d图像为垂直钻孔方向断面图像,3d重建图像包括关节整体重建(overall,红色部分为钻孔区域)及钻孔区于单独重建(hole)。
图20为大鼠膝关节股骨髁间骨软骨缺损模型构建后,分别采取不处理(control)、注射包裹msc的单纯海藻酸钠水凝胶系统(msc+gel)以及注射包裹msc的载莫诺苷海藻酸钠水凝胶系统(msc+morroniside+gel)的处理措施并饲养4周后,大鼠膝关节股骨髁间钻孔区域的骨密度(g/cm2)、骨小梁数量(mm-1)以及骨小梁厚度(mm)的统计分析结果(*p<0.05,**p<0.01,***p<0.001,****p<0.0001)。
图21为莫诺苷诱导大鼠msc向成软骨方向分化的分子生物学机制示意图,提示莫诺苷直接作用于smad3靶点。
具体实施方式
以下实施例将结合附图对本发明作进一步的说明。
有学者研究已经证实莫诺苷可以对体外培养的软骨细胞起到保护作用,促进炎症环境下软骨细胞的存活,并在大鼠动物模型中对骨关节炎具有治疗作用。本申请在这些学者研究的基础上,通过体外培养骨髓来源的大鼠msc,并通过细胞与分子生物学技术检测莫诺苷对大鼠msc的促增殖作用,以及其对大鼠msc向软骨细胞方向分化的促进作用;并通过不作用位点的抑制剂,探索了其诱导大鼠msc向软骨细胞方向分化的分子生物学基质,初步判断其诱导作用,作用于smad信号通路的smad3这一靶点,是通过提高smad3磷酸化水平来促进msc向软骨细胞方向分化。另一方面,本申请通过手术构建大鼠骨软骨损伤模型,验证了通过在骨软骨损伤区域注射包裹msc的载莫诺苷海藻酸钠水凝胶系统,可对大鼠骨软骨损伤起到良好的修复作用,对莫诺苷诱结合干细胞制备软骨损伤修复材料的可行性做出了证实。未来通过结合更优化的生物学材料与生物学技术,以莫诺苷结合干细胞作为基础方案,可在构建治疗软骨损伤的生物学材料上实现更大的价值。
第一部分:体外细胞实验
一、材料:于sd大鼠(由厦门大学实验动物中心订购)提取分离骨髓来源的msc;成都瑞芬思生物科技有限公司购买>98%纯度莫诺苷标准品粉剂溶于dmso中制成储存液;实验所需试剂、试剂盒及抗体等购于cellsignalingtechnology公司、sigma公司、thermofishher公司、takara公司、赛业生物科技有限公司、武汉博士德生物工程有限公司等。
二、方法:
1、msc培养与分化:取自3周龄sd大鼠长骨骨髓血,采取贴壁法培养并传代3代以纯化细胞,并通过验证其成脂、成骨、成软骨三系分化能力及表面cd分子流式细胞学鉴定,明确其符合msc标准。msc培养扩增采取常规培养基常规培养,诱导分化实验采用不同分化方向的诱导分化培养基按照培养基使用说明进行培养,如需添加药物,即在每次换液的同时添加药物,所有实验用细胞均为3~5代。
2、细胞染色:不同条件处理的细胞直接去除培养基,4%多聚甲醛固定后,根据不同试剂盒染色要求进行染色,倒置光学显微镜观察并拍摄图片。
3、细胞增殖检测:细胞无血清培养12h后加入不同浓度莫诺苷,处理24h后按照cck8试剂盒说明,加入相应试剂,在酶标仪450nm波长(参考波长650nm)检测不同处理组细胞od值。
4、rna提取、反转录并通过rt-pcr检测各种相关细胞基因表达水平:不同条件处理的细胞根据试剂盒说明,采取层析柱法提取总rna,反转录cdna后,通过rt-pct对诸如aggrecan基因、col2a1基因、sox9基因等软骨方向分化相关基因的表达水平进行检测。
5、蛋白提取并通过westernblotting检测分析各种相关细胞信号分子蛋白表达水平:不同条件处理的细胞消化、裂解、提取蛋白,行蛋白凝胶电泳,并转膜结合相关抗体检测诸如aggrecan蛋白、col2a1蛋白、col1a2、col10等软骨基质相关蛋白的表达含量,并对成软骨相关信号通路,如smad3、erk信号通路的相关信号分子蛋白进行检测以分析莫诺苷促进msc向软骨细胞方向分化的分子生物学机制。
6、载莫诺苷海藻酸钠水凝胶的制备及相关性质检测:配置恰当浓度的海藻酸钠溶液后,加入适量莫诺苷存储液配置成含恰当浓度莫诺苷的海藻酸钠溶液,采取钙离子缓释法获得海藻酸钠凝胶,并进行后续实验。等量载莫诺苷海藻酸钠凝胶浸泡于pbs缓冲液中,在恰当时间点,采用ph计测定浸泡液的ph。吸净凝胶浸泡液,采用万分之一克精度天平测定剩余凝胶质量。所制备凝胶试剂及耗材均可靠灭菌处理,制备过程于无菌环境。
7、live/dead检测细胞毒性:将适量msc悬浮于海藻酸钠溶液后,通过钙离子缓释法制得包裹msc的载莫诺苷海藻酸钠水凝胶系统,将其置于常规培养基内培养0或3天,完全去除培养基,根据试剂盒要求染色后,采用共聚焦显微镜于适当波长观察并拍摄不同细胞着色情况。对比0天或3天培养后细胞的死亡情况。
8、统计方法:上述每个实验重复3~5次,使用graphpadprism7.0软件统计,在检测数据符合正态分布及方差齐性的基础上,采用单因素方差分析进行结果统计,p<0.05具有统计学意义。
三、结果:
1、提取的细胞符合msc条件,可用于后续实验。
图2可见所提取的细胞经不同方向诱导分化培养基培养后,可向成脂(油红o染色,可见细胞内脂滴)、成骨(茜素红染色,可见细胞外钙结节)、成软骨(阿利新蓝染色,可见细胞内外酸性蛋白多糖)方向分化,这一现象符合msc细胞具备成脂、成骨及成软骨三系分化能力的鉴定金标准。
图3可见所提取的细胞表面cd34、cd45分子成阴性表达,表面cd44、cd90分子呈阳性表达,符合msc表面cd分子的分布特征。
以上这些结果表明:于3周龄sd大鼠长骨骨髓血中提取并纯化的细胞为大鼠msc,可用于后续实验。
2、莫诺苷可促大鼠msc增殖并诱导其向软骨细胞方向分化。
图4表明:通过cck8技术检测到不同浓度莫诺苷(10μm、50μm、100μm)都能够明显促进大鼠msc的增殖。(*p<0.05,****p<0.0001)。
图5表明:50μm莫诺苷处理14天后,大鼠msc的aggrecan基因、col2a1基因、sox9基因均明显表达上调,表现为向软骨细胞方向分化,此外,10μm的莫诺苷处理14天也可提高col2a1及sox9的表达(*p<0.05,**p<0.01,***p<0.001,****p<0.0001)。
图6表明:不同浓度莫诺苷(10μm、50μm、100μm)处理14天后,大鼠msc的aggrecan蛋白、col2a1蛋白表达均明显增加,且50μm组表现得最为明显,提示细胞向软骨细胞方向分化,活跃的分泌软骨细胞外基质蛋白。同时,50μm的莫诺苷处理14天还可降低col1a2、col10蛋白的表达,表明该细胞未向肥大的软骨细胞方向进一步变化。
以上结果显示50μm的莫诺苷在促进大鼠msc增殖的同时,可明确促进其向软骨细胞方向分化,这一现象在基因水平及蛋白水平均可得到证实。并且50μm的莫诺苷还可以抑制该细胞进一步向肥大的软骨细胞方向转化。在后续实验中,50μm是最为恰当的莫诺苷给药浓度。
3、莫诺苷对大鼠msc向软骨细胞方向分化的诱导作用,其作用靶点为smad信号通路的smad3,是通过提高smad3的磷酸化水平实现的。
因为smad信号通路是msc向软骨细胞分化的核心信号通路,因此本申请检测了莫诺苷对smad信号通路的作用。
图7表明:50μm浓度莫诺苷处理14天后,大鼠msc的smad信号通路的smad3蛋白磷酸化水平明显提高,且sox9蛋白表达明显提高,表明莫诺苷大鼠msc向软骨方向的诱导作用经过smad信号通路的传到,其作用位点可能为smad3或其上游蛋白。
考虑到tgf-β3是促进msc向软骨细胞方向分化的关键生物因子,我们验证了莫诺苷是否刺激msc提高内源性的tgf-β3的产生。
图8表明:不同浓度(10μm、50μm、100μm)的莫诺苷处理14天后,大鼠msc的tgf-β3基因并未收到明显激活,说明莫诺苷并不能刺激其提高内源性tgf-β3的产生。
为了进一步验证莫诺苷促msc向软细胞方向分化的作用机制,本申请使用了smad信号通路的一些相关调控点的抑制剂进行进一步研究。首先使用了tgf-β受体的抑制剂ly2157299,明确莫诺苷是否作用于细胞膜表面的tgf-β受体。
图9表明:当tgf-β受体被抑制后,smad3蛋白的磷酸化水平明显受到抑制,相应的sox9蛋白水平的降低,表明大鼠msc向软骨细胞方向分化能力也受到了抑制。但当对其施以ly2157299的大鼠msc同时施以莫诺苷后,其smad3蛋白磷酸化水平受到的抑制作用及sox9蛋白水平的降低均可被部分逆转,表明莫诺苷的直接作用位点可能并非tgf-β受体。
有文献表明,erk信号通路会对smad信号通路产生影响,而莫诺苷对细胞的erk信号通路具有调控作用,因此使用了erk信号通路上游的抑制剂u0126对erk信号通路进行了抑制。
图10表明:当erk信号通路受到抑制后,smad3蛋白的磷酸化水平明显受到抑制,相应的sox9蛋白水平的降低,表明大鼠msc向软骨细胞方向分化能力也受到了抑制。但当对其施以u0126的大鼠msc同时施以莫诺苷后,其smad3蛋白磷酸化水平受到的抑制作用及sox9蛋白水平的降低均可被部分逆转,表明莫诺苷的直接作用位点可能并非erk信号通路。
随后,直接使用了(e)-sis3对大鼠msc的smad3蛋白的磷酸化作用进行了抑制。
图11表明:当施以(e)-sis3直接抑制smad3的磷酸化作用后,其sox9蛋白水平的降低,表明大鼠msc向软骨细胞方向分化能力也受到了抑制。且当对施以(e)-sis3的大鼠msc同时施以莫诺苷后,(e)-sis3对其smad3蛋白磷酸化水平受到的抑制作用及sox9蛋白水平的降低均不可被逆转,表明莫诺苷的作用位点可能为smad3蛋白。
以上结果显示在莫诺苷对大鼠msc向软骨细胞分化的诱导作用,受到smad信号通路的调节,其直接作用位点初步考虑为smad3蛋白。
4、载莫诺苷海藻酸钠水凝胶具备良好的生物适应性,可用于后续实验。
图12显示载50μm的2%海藻酸钠水凝胶凝结后形态。
图13和14表明:载海藻酸钠水凝胶具有良好的生物学降解性能,2周时间可基本完成降解(图13),其降解产物为酸性,对等体积pbs缓冲液可将其ph降解至约6.6(图14)。
图15表明:载莫诺苷海藻水凝胶对包裹期内的msc培养0天及3天,其细胞存活无明显差异,且细胞存活率均较高。对细胞无明显毒性。
以上结果提示载莫诺苷的海藻酸钠水凝胶具有良好的生物学特性,可作为大鼠msc植入体内的良好载体。
第二部分:动物模型实验
一、材料:6周龄雄性sd大鼠,体重190~210g,饲养于厦门大学动物中心。成都瑞芬思生物科技有限公司购买>98%纯度莫诺苷标准品粉剂溶于dmso中制成储存液;实验所需试剂与试剂盒购于sigma公司、工生物工程(上海)股份有限公司等。
二、方法:
1、大鼠分组及骨软骨损伤模型构建:雄性sd大鼠14只,随机取2只大鼠作为假手术对照后,剩余12只大鼠随机分为3组,每组4只。取大鼠膝关节前内测切口,逐层切开,推开髌骨,暴露股骨关节滑车,于前交叉韧带股骨指点上方2.5mm处为中心点,垂直关节面钻取直径2mm,深2mm的孔洞,按照分组,分别予以采取不处理(control)、注射包裹msc的单纯海藻酸钠水凝胶系统(msc+gel)以及注射包裹msc的载莫诺苷海藻酸钠水凝胶系统(msc+morroniside+gel)的处理方式,逐层关闭切口(附图16)。术后大鼠饲养4周,处死并切取膝关节股骨端进行后续实验。
2、关节钻孔区域骨修复检测:将切取的关节股骨端固定后直接拍摄microct图像,予3d结构重建并检测新生骨量参数。
3、组织病理学检测:将固定后的切取的关节股骨端脱钙后,石蜡包埋,平行于钻孔方向,切取冠状位石蜡切片。石蜡切片行h.e.染色与番红o染色其中h.e.显示软骨组织的形态学结构变化;番红o显示软骨基质内聚多糖的含量。
三、结果
1、包裹msc的载莫诺苷海藻酸钠水凝胶系统可良好的修复大鼠软骨损伤
图17表明:相对于control组及msc+gel组,msc+morroniside+gel关节损伤区域的软骨修复效果更佳,其关节面平整,光滑,同sham组关节面外观相近。与之对应,control组损伤区域关节面软骨仍有大部分区域未修复,呈现软骨缺损状态。msc+gel组损伤区域关节面软骨大部分已修复,但髁间软骨裂隙。
图18表明:he染色提示相对于control组及msc+gel组,msc+morroniside+gel关节钻孔区域的表面修复组织具备更佳的软骨组织形态,细胞外基质丰富,细胞呈球形散布其中。control组损伤区域表面未见明显软骨组织形态,可见纤维结构。msc+gel组可见少量软骨样组织,但较菲薄。番红o-固绿联合染色提示相对于control组及msc+gel组,msc+morroniside+gel关节钻孔区域的表面修复组织具有较厚而致密的聚多糖染色,符合软骨细胞外基质染色特点。control组损伤区域表面未见聚多糖染色,提示无软骨组织生成。msc+gel组可见少而菲薄聚多糖染色,提示较少量的软骨组织生成。
以上结果表明包裹msc的载莫诺苷海藻酸钠水凝胶系统对大鼠骨软骨损伤具有良好的修复作用,提示莫诺苷可通过诱导msc向软骨方向分化,从而修复软骨损伤。
2、包裹msc的载莫诺苷海藻酸钠水凝胶系统可良好的修复大鼠骨损伤
图19表明:在2d图像及3d重建图像提示相对于control组及msc+gel组,msc+morroniside+gel关节钻孔区域新生骨骨量最多,钻孔区域的骨缺损基本完全修复;msc+gel组新生骨骨量次之,部分钻孔区的骨缺损未完全修复;域而control组新生骨骨量最少,钻孔区域骨缺损大部分仍未修复。
图20表明:通过对microct拍摄标本钻孔区域的新生骨进行统计学分析,可见相对于control组及msc+gel组,msc+morroniside+gel关节钻孔区域新生骨骨密度及骨小梁数量均有所增高,骨小梁厚度无明显变化。
以上结果表明莫诺苷在体内还具备一定的促骨生成作用,亦可对骨损伤的修复提供帮助,结合之前结果,提示莫诺苷可应用于骨软骨修复生物学材料的制备。
第三部分:讨论
干细胞的应用在软骨损伤的治疗中已经被充分的证实了其临床价值。但因为单纯应用单细胞的种种局限性,干细胞结合小分子化合物、生物因子以及生物材料等,通过组织工程技术实现对软骨损伤的治疗,成为了目前新的研究热点。研究发现,莫诺苷可以促进大鼠msc的增殖,并诱导其向软骨细胞方向分化,表现为经过莫诺苷诱导分化的大鼠msc,其sox9基因被更强的激活,并且表达更多的ⅱ型胶原及蛋白多糖,促进了软骨基质的合成,可以充分证明莫诺苷结合干细胞在构建软骨损伤修复材料中的应用潜力。
msc在向软骨细胞方向分化的过程中,受多条信号通路的调控。而这些信号通路亦存在彼此间的相互作用,形成网状结构,共同影响msc的分化过程。既往研究表明,smad信号通路,作为tgf-β受体激活的信号传导通路,是msc向软骨细胞方向分化的核心信号通路,而smad3蛋白在其中起着关键性作用。为研究莫诺苷促进大鼠msc向成软骨细胞方向分化的分子生物学机制,本申请以smad信号通路为核心,设计了相关实验,发现莫诺苷可加强smad3蛋白的磷酸化作用。smad3蛋白的磷酸化水平,可受其上游信号通路的关键位点调控,如tgf-β受体、erk信号通路等。本申请通过抑制tgf-β受体及抑制erk1/2的磷酸化作用发现,莫诺苷对大鼠msc向成软骨方向的诱导作用的靶点并不在tgβ受体或erk信号通路,表现在对抑制上述关键位点后,尽管其可降低大鼠msc向成软骨细胞方向分化的能力,但当对施以抑制剂的大鼠msc施以莫诺苷后,莫诺苷可部分逆转其抑制作用,说明莫诺苷仍发挥了其促成软骨的作用。又通过直接应用(e)-sis3直接抑制smad3的磷酸化作用,可明确抑制大鼠msc向成软骨细胞方向分化。发现施以(e)-sis3后,在对大鼠msc施以莫诺苷,并不能逆转上述的抑制效果,说明莫诺苷的直接作用位点,可能位于smad3蛋白,其作用机制是通过提高smad3蛋白的磷酸化水平从而诱导大鼠msc向成软骨细胞方向分化(参见图21)。
以上结果首次明确了莫诺苷可诱导msc向成软骨细胞方向分化,且初探了其分子生物学机制,有利于更好的实现以莫诺苷结合msc为基础的软骨损伤修复生物材料的制备。
在干细胞治疗软骨损伤中,合理的导入方式同样是影响其治疗效果的重要因素。构建了包裹msc的载莫诺苷海藻酸钠水凝胶系统,在验证了其生物安全性后,将其注射入构建的大鼠骨软骨损伤模型中。实验发现,该方案相对于对照组别,都具有更好的软骨修复作用,表现为大体观上损伤区域更为平滑的关节面修复,以及切片镜下观察更厚更成熟的新生软骨层。同时,实验还发现,该方案对骨损伤的修复,也有一定的促进作用,表现为相对于对照组别,损伤区域更多的新生骨生成。
尽管通过大鼠股骨髁间钻孔构建的骨软骨损伤模型不能完美的模拟人体的软骨损伤实际情况具,但考虑到结合目前临床上治疗人软骨损伤的应用方案,本申请认为其仍具有十分明确的参考价值。在目前的人软骨损伤治疗方案中,损伤区域的钻孔或微骨折,仍然被广泛的应用。上述操作人为的构建了骨软骨损伤区域,同本申请的动物建模状态基本相符合,因此将本申请构建的包裹msc的载莫诺苷海藻酸钠水凝胶系统同上述手术相结合,在钻孔或微骨折区域注射入凝胶系统,具有良好的可操作性和较高的临床应用价值。
总之,本申请的结果首次证明了莫诺苷对大鼠msc向软骨细胞方向分化的促进作用,并发现其作用机制是通过直接提高smad3蛋白的磷酸化水平产生作用;同时本申请首次构建了包裹msc的载莫诺苷海藻酸钠水凝胶系统,明确了其对大鼠膝关节骨软骨损伤的良好修复作用,证明了莫诺苷结合干细胞在构建软骨损伤修复生物材料中的应用潜能,具备较高的临床应用价值。
- 还没有人留言评论。精彩留言会获得点赞!