杂环黄酮类化合物在制备预防或治疗急性肺损伤和/或急性呼吸窘迫综合征的药物中的应用的制作方法
1.本发明涉及医药研发技术领域,具体涉及一种杂环黄酮类化合物在制备预防或治疗急性肺损伤和/或急性呼吸窘迫综合征的药物中的应用。
背景技术:
2.急性肺损伤(acute lung injury,ali)/急性呼吸窘迫综合征(ards)是一种临床常见危重症,病死率极高,严重威胁重症患者的生命。据统计,有超过10%的ali患者需进入重症监护病房治疗,病死率高达32%-55%,近年来还有逐步增高的趋势,明显增加了社会与经济负担,可与胸部肿瘤、aids、支气管哮喘或心肌梗死等相提并论。als/ards的基本病理生理改变是肺泡上皮细胞和肺毛细血管内皮通透性增加所致的非心源性肺水肿,由于肺泡水肿、肺泡塌陷导致严重通气/血流比例失调,特别是肺内分流明显增加,从而产生严重的低氧血症,导致急性低氧性呼吸功能不全或衰竭。临床上表现为进行性低氧血症和呼吸窘迫,肺部影像学表现为非均一性的渗出性病变。
3.多种危险因素可诱发ali/ards,主要包括(1)直接肺损伤因素:严重肺部感染、胃内容物吸入、肺挫伤、吸入有毒气体、淹溺、氧中毒等;(2)间接肺损伤因素:严重感染、严重非胸部创伤、急性重症胰腺炎、大量输血、体外循环、弥漫性血管内凝血等,参见《急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南(2006)》。
4.严重病毒感染会引起急性肺损伤或者急性呼吸窘迫综合征,例如2019新型冠状病毒(covid-19病毒),新型冠状病毒感染主要累及肺,患者的肺脏有不同程度的实变,主要引起深部气道和肺泡损伤为特征的炎性反应,伴随大量黏稠的分泌物从肺泡内溢出,引起肺水肿和细胞凋亡,加速肺损伤,临床表现为呼吸困难、胸闷、气短,甚至会出现急性肺损伤、呼吸窘迫等严重症状,影像学检查会发现肺部有磨玻璃一样的肺间质的改变。
5.普通的抗炎治疗虽然能够在一定程度上降低急性肺损伤和/或急性呼吸窘迫综合征的炎性反应,但是无法有效抑制急性肺损伤和/或急性呼吸窘迫综合征患者肺部水肿问题,对于急性肺损伤和/或急性呼吸窘迫综合征导致的严重炎症反应治疗的有效性也非常有限,还容易产生耐药性,并具有一定的副作用,比如引起严重的胃肠道反应的阿司匹林。
6.随着天然药物化学的发展,研发人员从鸢尾属植物中分离出来的大量射干异黄酮类化合物,可作为天然抗炎物质,例如,专利文献cn101301287a中记载了射干异黄酮类化合物在制备抗肝炎病毒的药物或保健食品中的应用,然而,这些天然抗炎物质仅对肝炎病毒等少数病毒性炎症有拮抗作用。王彪等研究了野黄芩素对内毒素血症大鼠急性肺损伤的保护作用(王彪等,《野黄芩素对内毒素血症大鼠急性肺损伤的保护作用》,中国现代医学杂志[j].2016,26(12):15-20.),发现只有高剂量的野黄芩素(1mmol/kg,28.6mg/kg)对脂多糖诱导的急性肺损伤具有保护作用,而中低剂量下的野黄芩素并不能影响肿瘤坏死因子a(tnf-a)、白细胞介素-6(il-6)和白细胞介素-10(il-10)等细胞因子以及一氧化氮合成酶(inos)的表达,并不具有治疗或者有效治疗急性肺损伤和/或急性呼吸窘迫综合征的作用,
用量过大又会增大出现副作用的风险,野黄芩素也无法有效抑制急性肺损伤和/或急性呼吸窘迫综合征导致的肺水肿,因此开发新型的用药量低且疗效显著的预防和治疗急性肺损伤和/或急性呼吸窘迫综合征的药物仍是当前的关注重点。
技术实现要素:
[0007]
因此,本发明的目的在于解决现有技术中的药物无法在抗炎的同时改善肺部水肿的缺陷且存在用药量高、疗效低的问题,从而提供一种异黄酮化合物在制备预防或治疗急性肺损伤和/或急性呼吸窘迫综合征的药物中的应用。
[0008]
为此,本发明提供如下技术方案:
[0009]
本发明提供了一种杂环黄酮类化合物在制备预防或治疗急性肺损伤和/或急性呼吸窘迫综合征的药物中的应用,所述杂环黄酮类化合物具有式i所示的结构:
[0010][0011]
其中,r1、r3、r4、r5独立地选自h、c
1-c8的烷基、c
3-c
10
的环烷基和c
1-c8的烷氧基中的一种;
[0012]
r2选自h、c
1-c8的烷基、c
3-c
10
的环烷基和c
1-c8的酰基中的一种。
[0013]
进一步地,r1、r3、r4、r5独立地选自h、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、甲氧基、乙氧基、正丙氧基、异丙氧基中的一种;
[0014]
r2选自h、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、甲氧基、乙氧基、正丙氧基、异丙氧基、甲酰基、乙酰基、丙酰基中的一种。
[0015]
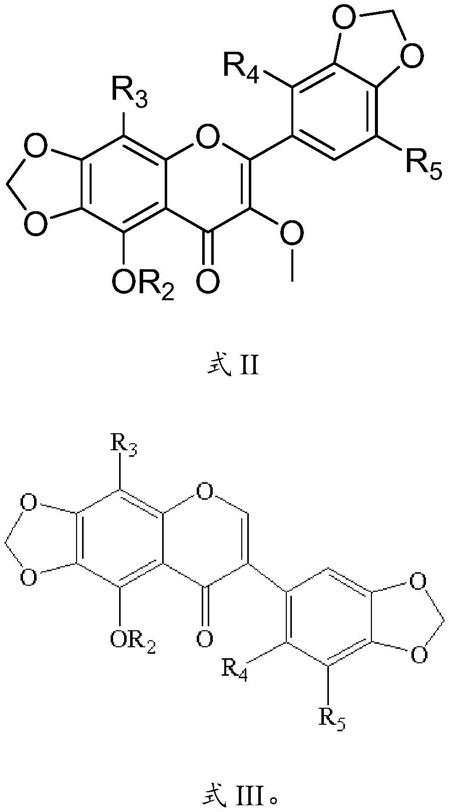
进一步地,所述杂环黄酮类化合物具有式ii所示的结构:
[0016][0017]
进一步地,所述杂环黄酮类化合物具有式iii所示的结构:
[0018][0019]
进一步地,r4和r5中至少有一个为h。
[0020]
进一步地,所述杂环黄酮类化合物选自如下任一化合物:
[0021]
[0022][0023]
进一步地,所述急性肺损伤和/或急性呼吸窘迫综合征为肺部缺血再灌注损伤、肺部栓塞、细菌感染、病毒感染、非典型病原体感染、休克和异物吸入中的至少一种导致的。
[0024]
进一步地,所述病毒选自选自流感病毒、冠状病毒、巨细胞病毒、腺病毒和单纯疱疹病毒中的至少一种。
[0025]
进一步地,所述冠状病毒选自sars病毒(严重急性呼吸道综合症病毒)、mers病毒(中东呼吸系统综合征病毒)、229e病毒(冠状病毒hcov-229e病毒)、nl63病毒(冠状病毒hcov-nl63)、oc43病毒(冠状病毒hcov-oc43)、hku1病毒(冠状病毒hcov-hku1)和covid-19病毒(2019新型冠状病毒)中的至少一种。
[0026]
本发明还提供了上述任一所述的杂环黄酮类化合物在制备药物中的应用,所述药物具有如下用途中的至少一种:
[0027]
(1)抑制急性肺损伤和/或急性呼吸窘迫综合征导致的肺水肿,减少肺积液;
[0028]
(2)抑制急性肺损伤和/或急性呼吸窘迫综合征导致的炎症反应。
[0029]
进一步地,所述药物还包括药学上可接受的载体;所述药学上可接受的载体选自药学上可接受的溶剂、增溶剂、助溶剂、乳化剂、着色剂、粘合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗粘合剂、整合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂、高分子骨架材料和成膜材料中的至少一种;所述药物为凝胶剂、乳霜剂、片剂、胶囊剂、散剂、合剂、丸剂、颗粒剂、溶液剂、糖浆剂、煎膏剂、贴膏剂、栓剂、气雾剂、吸入剂、软膏剂、注射剂、喷剂、搽剂、酊剂、湿敷剂、糊剂或洗剂。
[0030]
本发明技术方案,具有如下优点:
[0031]
本发明提供的杂环黄酮类化合物,通过该种结构的杂环黄酮类化合物能够明显抑
制炎症反应,抑制炎性因子il-1β、il-6、tnf-α、mpo的释放,降低急性肺损伤小鼠肺泡灌洗液和血清中的炎性因子含量,同时还能明显抑制肺水肿,减少肺积液的产生,降低肺脏湿重,抑制急性肺损伤导致的肺脏湿重与干重比的升高程度,从而起到在抗炎的同时抑制肺部水肿的作用,且具有用量低、疗效显著的优点,可以作为潜在的预防或者治疗急性肺损伤的药物,可有效减少肺部急性损伤、推迟或减弱呼吸窘迫的出现,缓解重型和危重型患者症状,有利于患者治愈,减少死亡。
具体实施方式
[0032]
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
[0033]
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
[0034]
实施例1化合物1-3的制备
[0035]
本实施例提供3种杂环黄酮类化合物,分别为化合物1、化合物2和化合物3,其反应结构式及制备方法如下:
[0036][0037]
称取新鲜美国豆科植物ateleia herber smithii pittier树叶15kg,切成小块,加3倍量乙醚浸泡提取3次,每次24h,收集提取液浓缩,浓缩液加甲醇溶解后硅胶拌样,硅胶柱(柱直径6cm
×
高60cm,柱体积1.7l)分离,依次用体积比为20:1、10:1、2:1的氯仿-甲醇梯度洗脱,每个梯度3个柱体积,收集10:1部位,浓缩干燥,得干燥物10g,用半制备型hplc纯化,己烷-乙酸乙酯(体积比为1:1)洗脱,根据tlc结果收集相同组分(254nm下显荧光),得到六个馏分:fr.a-f。
[0038]
其中,fr.b-c经ods制备色谱以体积百分数为75%的甲醇水溶液为洗脱剂进行分离得到化合物1(671mg);fr.d经ods制备色谱以体积百分数为75%的甲醇水溶液为洗脱剂进行分离得到化合物2(264mg);fr.e经ods制备色谱以体积百分数为80%的甲醇水溶液为洗脱剂进行分离得到化合物3(289mg)。
[0039]
实施例2化合物4-6的制备
[0040]
本实施例提供3种杂环黄酮类化合物,分别为化合物4、化合物5和化合物6,其反应结构式及制备方法如下:
herbert-smithii.j nat prod.2003;66(2):210
–
216;
[0051]
化合物4-5结构鉴定的参考文献为:刘婷.蜜茱萸地上部分化学成分研究[d].郑州大学;
[0052]
化合物6:higa m,imamura m,shimoji k,et al.isolation of six new flavonoids from melicope triphylla[j].chemical&pharmaceutical bulletin,2012,60(9):1112-1117;
[0053]
化合物7-8结构鉴定的参考文献为:fukui k,matsumoto t.synthetic studies of the flavone derivatives.ii.the synthesis of meliternatin and some3,5-dimethoxy-6,7-methylenedioxyflavones[j].bulletin of the chemical society of japan,1963,36(7):806-809。
[0054]
实验例
[0055]
1、受试药物、试剂和仪器
[0056]
受试药物为分别按照实施例1-3的方法制得化合物1-8,脂多糖(lps),含量》97%,规格500mg,购自sigma公司;醋酸地塞米松片,规格0.74mg
×
100片,购自广东华南药业集团有限公司;mouse il-1βelisa试剂盒和mouse il-6elisa试剂盒购自碧云天生物技术有限公司,mouse tnf-αelisa试剂盒购自biovision公司,mouse myeloperoxidase(mpo)elisa试剂盒购自艾恩斯生物科技有限公司。主要仪器包括气体麻醉机,离心机,电子天平,bio-rad酶标仪等,均为市购。
[0057]
2、药物溶液的配制
[0058]
化合物1-8的受试药物溶液:取化合物1-8分别采用质量百分数为0.5%的cmc-na的水溶液配制成药物浓度均为0.1mg/ml的受试药物溶液。
[0059]
lps溶液:采用生理盐水将lps配制成浓度为0.5mg/ml的lps溶液。
[0060]
地塞米松溶液:采用质量百分数为0.5%的cmc-na的水溶液将醋酸地塞米松片配制成浓度为0.1mg/ml的地塞米松溶液,备用。
[0061]
3、动物分组、造模及给药
[0062]
icr小鼠,spf级,6-8周龄,雄性110只,体重18-22g。小鼠采用异氟烷诱导麻醉后绑定于斜面操作台上,其中100只为造模小鼠,用小鼠气管内雾化装置进行气管内喷雾给予浓度为0.5mg/ml的lps溶液造成小鼠急性肺损伤,以lps质量计,每kg小鼠体重的给药量为5mg的lps;剩余10只为空白小鼠,用相同方法喷雾给予生理盐水5mg/kg动物体重。
[0063]
将100只造模小鼠随机分成10组,每组10只,分别为模型对照组、地塞米松阳性药组、化合物组1-8;另外10只空白小鼠作为空白对照组。造模当日为第一日,造模后开始给药,每天1次,连续3天,其中空白对照组和模型对照组灌胃给予生理盐水5mg/kg动物体重;阳性药组灌胃给予浓度为0.1mg/ml的地塞米松溶液,以地塞米松的质量计,每kg小鼠体重给予地塞米松的质量为5mg,化合物组1-8分别灌胃给予浓度0.1mg/ml的化合物1-8的受试药物溶液,以化合物1-8的质量计,每kg小鼠体重给予化合物1-8的质量均为5mg。
[0064]
4、实验内容
[0065]
造模72小时后,将动物安乐死,采集小鼠外周血,分离血清,零下80度冻存;采集双侧肺脏,称重(湿重);用1ml注射器吸取0.5ml生理盐水从肺静脉灌洗肺脏(反复抽吸3次),收集双肺肺泡灌洗液,分离上清液,零下80度冻存;灌洗后肺脏用滤纸吸干,称重(干重)。
test检验);***表示与模型组相比,p《0.001(t-test检验)
[0078]
表3血清中炎性因子(n=10,平均值
±
sd)
[0079]
组别编号tnf-αil-6il-1βmpo对照组0.96
±
0.390.66
±
0.2320.74
±
3.150.62
±
0.08模型组13.05
±
2.482.39
±
0.47208.24
±
55.147.68
±
1.06化合物组14.35
±
1.24
***
0.96
±
0.34
***
76.2
±
19.89
***
2.66
±
0.71
***
化合物组26.12
±
1.44
**
1.07
±
0.37
***
93.62
±
33.62
***
3.75
±
0.87
**
化合物组36.49
±
1.84
**
1.13
±
0.44
**
99.66
±
21.15
**
3.61
±
1.04
**
化合物组44.26
±
1.41
***
0.83
±
0.4
***
72.32
±
15.44
***
2.42
±
0.88
***
化合物组54.6
±
1.56
***
0.9
±
0.32
***
80.55
±
24.09
***
2.89
±
0.4
***
化合物组66.72
±
1.38
**
1.32
±
0.36
*
111.69
±
22.95
**
3.93
±
0.75
**
化合物组74.65
±
1.7
***
0.88
±
0.3
***
85.56
±
31.74
***
2.79
±
0.73
***
化合物组86
±
1.19
***
1.46
±
0.61
*
98.71
±
25.99
**
3.34
±
1.08
***
阳性药组4.3
±
0.78
***
0.84
±
0.2
***
71.15
±
20.8
***
2.54
±
0.37
***
[0080]
注:*表示与模型组相比,p《0.05(t-test检验);**表示与模型组相比,p《0.01(t-test检验);***表示与模型组相比,p《0.001(t-test检验)
[0081]
由表1-3可知:造模后,相比于对照组,模型组小鼠中血清和灌洗上清液各炎性因子均有显著升高,肺脏湿重与干重之比显著升高,表明造模成功;化合物组1-8给药3天后与模型对照组相比,各化合物组均能显著降低促炎细胞因子(il-1β、il-6、tnf-α、mpo)的产生(与模型组相比p《0.05或p《0.01或p《0.001),显著降低肺脏湿重与干重之比(与模型组相比p《0.05或p《0.01或p《0.001),具有统计学意义。
[0082]
其中化合物组1、化合物组4、化合物组5、和化合组物7的炎性因子含量与模型组相比p<0.001,说明其对急性肺损伤模型的抗炎作用更佳。
[0083]
化合物组3、化合物组4、化合物组5、化合物组7和化合组物8的肺脏湿重/干重比与模型组相比p<0.001,说明其对急性肺损伤模型的改善肺水肿的作用更佳。
[0084]
7、实验结论
[0085]
本发明提供的杂环黄酮类化合物能够明显缓解急性肺损伤模型小鼠的炎症反应,降低肺泡灌洗液上清液和血清中的炎性因子含量,减少肺积液的产生,降低肺脏的湿重,降低模型小鼠的肺脏湿重与干重比,在抗炎的同时抑制急性肺部损伤导致的肺部水肿,具有用量低、疗效显著的优点,可以作为潜在的预防或者治疗急性肺损伤的药物。
[0086]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1