胃滞留片的制作方法
胃滞留片
1.领域
2.本公开大体上涉及医药领域。更具体地,本申请涉及药物制剂领域。
3.背景
4.胃内滞留释药系统是利用胃肠道局部ph值、胃肠道酶、制剂在胃肠道的转运机制等生理学特性,通过改变制剂的物理化学性质以延长药物在胃内滞留时间的给药系统。
5.概述
6.一方面,本公开涉及胃滞留片,其包含片芯和缓释层,其中所述片芯含有第一活性药物成分和膨胀剂,所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
7.另一方面,本公开涉及制备胃滞留片的方法,其包括制备含有第一药物活性成分和膨胀剂的片芯;以及对所述片芯进行缓释层包衣,从而得到所述胃滞留片,其中所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
8.再一方面,本公开涉及由包括以下步骤的方法制备得到的胃滞留片,制备含有第一药物活性成分和膨胀剂的片芯;以及对所述片芯进行缓释层包衣,从而得到所述胃滞留片,其中所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
9.又一方面,本公开涉及改善个体的顺应性的方法,其包括向需要所述方法的所述个体给予胃滞留片,其中所述胃滞留片包含片芯和缓释层,其中所述片芯含有第一活性药物成分和膨胀剂,所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
10.附图简要说明
11.图1示出了本公开实施例1的盐酸二甲双胍缓释片棱角处的电子显微镜照片。
12.图2示出了本公开实施例1的盐酸二甲双胍缓释片平滑处的电子显微镜照片。
13.图3示出了本公开实施例2的盐酸二甲双胍缓释片棱角处的电子显微镜照片。
14.图4示出了本公开实施例2的盐酸二甲双胍缓释片平滑处的电子显微镜照片。
15.图5示出了本公开实施例3的盐酸二甲双胍缓释片棱角处的电子显微镜照片。
16.图6示出了本公开实施例3的盐酸二甲双胍缓释片平滑处的电子显微镜照片。
17.图7示出了本公开实施例4的盐酸二甲双胍缓释片棱角处的电子显微镜照片。
18.图8示出了本公开实施例4的盐酸二甲双胍缓释片平滑处的电子显微镜照片。
19.图9示出了本公开实施例5的盐酸二甲双胍缓释片棱角处的电子显微镜照片。
20.图10示出了本公开实施例5的盐酸二甲双胍缓释片平滑处的电子显微镜照片。
21.图11示出了本公开实施例6的盐酸二甲双胍缓释片棱角处的电子显微镜照片。
22.图12示出了本公开实施例6的盐酸二甲双胍缓释片平滑处的电子显微镜照片。
23.图13示出了本公开实施例7的西格列汀盐酸二甲双胍缓释片棱角处的电子显微镜照片。
24.图14示出了本公开实施例7的西格列汀盐酸二甲双胍缓释片平滑处的电子显微镜照片。
25.图15示出了本公开实施例8的恩格列净盐酸二甲双胍缓释片棱角处的电子显微镜
照片。
26.图16示出了本公开实施例8的恩格列净盐酸二甲双胍缓释片平滑处的电子显微镜照片。
27.图17示出了本公开实施例9的阿昔洛韦缓释片棱角处的电子显微镜照片。
28.图18示出了本公开实施例9的阿昔洛韦缓释片平滑处的电子显微镜照片。
29.图19示出了本公开实施例10的普瑞巴林缓释片棱角处的电子显微镜照片。
30.图20示出了本公开实施例10的普瑞巴林缓释片平滑处的电子显微镜照片。
31.图21示出了本公开实施例12和13的盐酸二甲双胍缓释片的累积释放曲线。
32.详述
33.在以下的说明中,包括某些具体的细节以对各个公开的实施方案提供全面的理解。然而,相关领域的技术人员会认识到,不采用一个或多个这些具体的细节,而采用其它方法、部件、材料等的情况下仍实现实施方案。
34.除非本申请中另有要求,在整个说明书和所附的权利要求书中,词语“包括”、“包含”、“含有”和“具有”应解释为开放式的、含括式的意义,即“包括但不限于”。
35.在整个说明书中提到的“一实施方案”、“实施方案”、“在另一实施方案中”或“在某些实施方案中”意指在至少一实施方案中包括与该实施方案所述的相关的具体参考要素、结构或特征。因此,在整个说明书中不同位置出现的短语“在一实施方案中”或“在实施方案中”或“在另一实施方案中”或“在某些实施方案中”不必全部指同一实施方案。此外,具体要素、结构或特征可以任何适当的方式在一个或多个实施方案中结合。
36.定义
37.在本公开中,术语“药物可接受的盐”包括“可以接受的酸加合盐”和“可以接受的碱加合盐”。
38.在本公开中,术语“可以接受的酸加合盐”系指保持游离碱的生物学有效性和性质的那些盐,所述酸加合盐是在生物学或其它方面合适的并且是使用无机酸或有机酸来形成的,所述无机酸例如但不限于盐酸、氢溴酸、硫酸、硝酸、磷酸等,所述有机酸例如但不限于乙酸、2,2
‑
二氯乙酸、己二酸、褐藻酸、抗坏血酸、天冬氨酸、苯磺酸、苯羧酸、4
‑
乙酰胺基苯羧酸、樟脑酸、樟脑
‑
10
‑
磺酸、癸酸、己酸、辛酸、碳酸、肉桂酸、柠檬酸、环己烷基氨基磺酸、十二烷基硫酸、乙烷
‑
1,2
‑
二磺酸、乙烷磺酸、2
‑
羟基乙烷磺酸、甲酸、富马酸、粘酸、龙胆酸、葡庚糖酸、葡糖酸、葡糖醛酸、谷氨酸、戊二酸、2
‑
氧代
‑
戊二酸、甘油磷酸、乙醇酸、马尿酸、异丁酸、乳酸、乳糖醛酸、月桂酸、马来酸、苹果酸、丙二酸、扁桃酸、甲烷磺酸、黏酸、萘
‑
1,5
‑
二磺酸、萘
‑2‑
磺酸、1
‑
羟基
‑2‑
萘甲酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、焦谷氨酸、丙酮酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、酒石酸、硫氰酸、对甲苯磺酸、三氟乙酸、十一碳烯酸等。
39.在本公开中,术语“可以接受的碱加合盐”系指保持游离酸的生物学有效性和性质的那些盐,所述碱加合盐是在生物学或其它方面合适的。向游离酸中加入无机碱或有机碱来制备这些盐。由无机碱衍生的盐包括但不限于钠、钾、锂、铵、钙、镁、铁、锌、铜、锰、铝盐等。在某些实施方案中,无机盐为铵、钠、钾、钙及镁盐。由有机碱衍生的盐包括但不限于伯、仲和叔胺的盐、包括天然存在的取代的胺在内的取代的胺、环胺和碱性离子交换树脂的盐,例如氨、异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、二乙醇胺、乙醇胺、2
‑
二甲氨基乙醇、2
‑
二
乙氨基乙醇、二环己胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、海巴明、胆碱、甜菜碱、苄胺、苯乙二胺、乙二胺、葡萄糖胺、甲基葡糖胺、可可碱、三乙醇胺、氨基丁三醇、嘌呤、哌嗪、哌啶、n
‑
乙基哌啶、聚胺树脂等。在某些实施方案中,有机碱是异丙胺、二乙胺、乙醇胺、三甲胺、二环己胺、胆碱和咖啡因。
40.在本公开中,术语“活性药物成分(active pharmaceutical ingredient)”系指一种化学实体,它可以有效地治疗目标紊乱、疾病或病症。
41.在本公开中,术语“膨胀剂”系指置于含水环境中可吸收水分并发生体积膨胀的辅料。
42.在本公开中,术语“致孔剂”系指分散在缓释衣膜的高分子材料中的水溶性辅料,当片剂接触水性液体后溶解,使缓释衣膜具有微孔和通透性。
43.在本公开中,术语“粘合剂”系指使物料贴结,方便制粒的辅料。
44.在本公开中,术语“助流剂”系指降低颗粒之间的摩擦力,从而改善粉体流动性的辅料。
45.在本公开中,术语“遮光剂”系指可以吸收、散射或反射光线的物质。
46.在本公开中,术语“消泡剂”系指能够降低水、溶液、悬浮液等的表面张力,防止泡沫形成,或使原有泡沫减少或消灭的物质。
47.在本公开中,术语“表面活性剂”系指能使液体表面张力发生明显降低的物质。
48.在本公开中,术语“润滑剂”系指降低颗粒之间的摩擦力,从而改善粉体流动性的辅料。
49.在本公开中,术语“增塑剂”系指在结构上具有极性或部分具有极性的辅料,其具有高沸点、难挥发与聚合物有良好混溶性等特点,增塑剂分布在大分子链之间,能降低分子间作用力,使聚合物粘度降低,柔韧性增强。
50.在本公开中,术语“水性介质”系指水或以水为溶媒的液体体系。
51.在本公开中,术语“短径”系指胃内滞留制剂最短的直径。
52.在本公开中,术语“顺应性”系指个体按医生规定进行治疗,其行为与医嘱一致;反之则称为非顺应性。
具体实施方式
53.一方面,本公开涉及胃滞留片,其包含片芯和缓释层,其中所述片芯含有第一活性药物成分和膨胀剂,所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
54.在某些是实施方案中,所述缓释层含有包含聚醋酸乙烯酯和聚维酮的混合物以及丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物。
55.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:4。
56.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:6。
57.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:8。
58.在某些实施方案中,能够用于本公开的第一药物活性成分的示例性实例包括但不限于左旋多巴、盐酸甲氨二氮卓、地西泮、呋喃苯胺酸、卡托普利、琥珀酸美托洛尔、马来酸罗格列酮、维拉帕米、阿替洛尔、氯沙坦、己酮可可碱、尼莫地平、桂利嗪、地尔硫卓、吡咯他尼、硝酸异山梨酯、索他洛尔、普萘洛尔、盐酸塞利洛尔、消胆胺、硝苯地平、双嘧达莫、葡萄糖酸奎尼丁、洛伐他汀、盐酸曲美他嗪、尼卡地平、单硝酸异山梨酯、甲硝唑、克拉霉素、呋喃妥因、氧氟沙星、头孢氨苄、齐多夫定、环丙沙星、灰黄霉素、氨苄西林、酮洛芬、布洛芬、吡罗昔康、氟比洛芬、吲哚美辛、双氯芬酸钠、马来酸氯苯那敏、茶碱、氟尿嘧啶、核黄素
‑5’‑
磷酸钠、米索前列醇、熊去氧胆酸、牛磺熊去氧胆酸、胃酶抑素、曲尼司特、特非那定、奥利司他、阿苯达唑、氢化泼尼松、氯雷他定、卡比多巴与左旋多巴、左旋多巴与苄丝肼、普瑞巴林、盐酸二甲双胍、阿莫西林、阿昔洛韦和加巴喷丁。
59.在某些实施方案中,能够用于本公开的第一药物活性成分的示例性实例包括但不限于卡比多巴与左旋多巴、左旋多巴与苄丝肼、普瑞巴林、盐酸二甲双胍、阿莫西林、阿昔洛韦和加巴喷丁。
60.在某些实施方案中,所述第一药物活性成分为盐酸二甲双胍。
61.在某些实施方案中,能够用于本公开的膨胀剂的示例性实例包括但不限于交联聚维酮、羧甲基淀粉钠、预胶化淀粉、交联羧甲基纤维素钠、交联羧甲基纤维素钙和低取代羟丙基纤维素。
62.在某些实施方案中,能够用于本公开的聚乙二醇(peg)具有至少约4,000的相对分子量。
63.在某些实施方案中,能够用于本公开的聚乙二醇(peg)具有至少约6,000的相对分子量。
64.在某些实施方案中,能够用于本公开的聚乙二醇(peg)具有至少约8,000的相对分子量。
65.在某些实施方案中,能够用于本公开的聚乙二醇的示例性实例包括但不限于4000、6000、8000、4000、6000、8000、e 4000、e 6000和e 8000。
66.在某些实施方案中,能够用于本公开的聚乙烯醇
‑
聚乙二醇接枝聚合物的示例性实例包括但不限于ir。
67.在某些实施方案中,本公开的缓释层包含助流剂。
68.在某些实施方案中,能够用于本公开的片芯中的助流剂的示例性实例包括但不限于胶态二氧化硅、微粉硅胶、聚乙二醇、硬脂酸镁、硬脂酸、滑石粉和淀粉。
69.在某些实施方案中,本公开的缓释层包含遮光剂。
70.在某些实施方案中,能够用于本公开的遮光剂的示例性实例包括但不限于二氧化钛和滑石粉。
71.在某些实施方案中,本公开的缓释层包含消泡剂。
72.在某些实施方案中,能够用于本公开的消泡剂的示例性实例包括但不限于二甲基硅油以及二甲基硅油和二氧化硅的混合物。
73.在某些实施方案中,本公开的缓释层包含表面活性剂。
74.在某些实施方案中,能够用于本公开的表面活性剂的示例性实例包括但不限于阿拉伯胶、黄原胶、明胶、单硬脂酸丙二醇酯、单硬脂酸甘油酯、二硬脂酸乙烯酯、单甘油酸二甘油酯、十二烷基硫酸钠、span 20、span 40、span 60、span 65、span 80、span 83、span 85、油酸钾、油酸钠、三乙醇胺油酸酯、卵磷脂、蔗糖酯、泊洛沙姆188、atlas g
‑
263、吐温20、吐温21、吐温40、吐温60、吐温61、吐温65、吐温80、吐温81、吐温85、myrj 45、myrj 49、myrj 51、myrj 52、聚氧乙烯400单月桂酸酯、聚氧乙烯400单硬脂酸酯、聚氧乙烯400单油酸酯、brij 35、brij 30、鲸蜡甲基萘酚、聚氧乙烯氢化蓖麻油、聚氧乙烯烷基酚和聚氧乙烯壬基酚醚。
75.在某些实施方案中,本公开的缓释层包含增塑剂。
76.在某些实施方案中,能够用于本公开的增塑剂的示例性实例包括但不限于邻苯二甲酸酯、脂族二元酸酯、磷酸酯、环氧化物、脂肪酸酯和聚乙二醇。
77.在某些实施方案中,能够用于本公开的邻苯二甲酸酯的示例性实例包括但不限于邻苯二甲酸二甲酯(dmp)、邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)、邻苯二甲酸二辛酯(dop)和邻苯二甲酸辛酯(dnop)。
78.在某些实施方案中,能够用于本公开的脂族二元酸酯的示例性实例包括但不限于己二酸双(2
‑
乙基己基)酯(doa)、己二酸二异癸基酯(dida)、重氮二酸(2
‑
乙基己酯)(doz)、癸二酸二乙基己酯(dos)和癸二酸二丁酯(dbs)。
79.在某些实施方案中,能够用于本公开的磷酸酯的示例性实例包括但不限于磷酸三丁酯(tbp)、磷酸三(2
‑
乙基己基)酯(top)、磷酸二苯辛基酯(dpop)、三苯基磷酸酯(tpp)和三异丙基苯基磷酸酯(ippp)。
80.在某些实施方案中、能够用于本公开的环氧化物的示例性实例包括但不限于环氧大豆油(eso)、环氧化亚麻籽油、环氧脂肪酸丁酯(ebst)、油酸辛酯环氧化物和二(2
‑
乙基己基)4,5
‑
环氧四氢邻苯二甲酸酯(eps)。
81.在某些实施方案中,能够用于本公开的聚乙二醇(peg)具有至少约4,000的相对分子量。
82.在某些实施方案中,能够用于本公开的聚乙二醇(peg)具有至少约6,000的相对分子量。
83.在某些实施方案中,能够用于本公开的聚乙二醇(peg)具有至少约8,000的相对分子量。
84.在某些实施方案中,能够用于本公开中的聚乙二醇(peg)的示例性实例包括但不限于4000、6000、8000、4000、6000、8000、e4000、e 6000和e 8000。
85.在某些实施方案中,本公开的片芯包含粘合剂。
86.在某些实施方案中,能够用于本公开的片芯中的粘合剂的示例性实例包括但不限于聚乙烯醇、羧甲基纤维素钠、淀粉桨类、聚维酮、共聚维酮、蔗糖溶液、羟丙甲纤维素、羟丙基纤维素、甲基羟乙基纤维素、羟乙基纤维素、甲基纤维素、麦芽糊精、淀粉、羧甲基淀粉钠、
预胶化淀粉、羟丙基纤维素、羧甲基淀粉钠、明胶、阿拉伯胶、瓜尔胶、槐豆胶、罗望子多糖胶、田菁胶、亚麻籽胶、皂荚糖胶、果胶、黄蜀葵胶、卡拉胶、琼脂、海藻酸钠、海藻酸钾、明胶、甲壳素、黄原胶、β
‑
环状糊精、聚葡萄糖、结冷胶和丙烯酸树脂。
87.在某些实施方案中,本公开的胃滞留片包含在缓释层外的第一包衣层。
88.在某些实施方案中,本公开的第一包衣层包含水溶性聚合物。
89.在某些实施方案中,能够用于本公开的第一包衣层的水溶性聚合物的示例性实例包括但不限于包含聚乙二醇和聚乙烯醇的混合物、海藻酸钠、羟丙甲纤维素、聚乙烯醇和聚乙烯醇
‑
聚乙二醇接枝聚合物。
90.在某些实施方案中,能够用于本公开的第一包衣层的水溶性聚合物的示例性实例包括但不限于包含聚乙二醇和聚乙烯醇的混合物和聚乙烯醇
‑
聚乙二醇接枝聚合物。
91.在某些实施方案中,能够用于本公开的包含聚乙二醇和聚乙烯醇的混合物的示例性实例包括但不限于ii。
92.在某些实施方案中,能够用于本公开的聚乙烯醇
‑
聚乙二醇接枝聚合物的示例性实例包括但不限于ir。
93.在某些实施方案中,本公开的第一包衣层包含第二活性药物成分。
94.在某些实施方案中,能够用于本公开的第二活性药物成分的示例性实例包括但不限于二肽基肽酶
‑
4(dipeptidyle peptidase
‑
4,dpp
‑
4)抑制剂、钠
‑
葡萄糖共转运体2(sodium/glucose cotranspoter 2,sglt
‑
2)抑制剂、磺酰脲类药物(sulfonylureas)、非磺酰脲类药物(non
‑
sulfonylurea)、α
‑
糖苷酶抑制剂(glucosidase inhibitor)和胰岛素增敏剂(insulin sensitizer)。
95.在某些实施方案中,能够用于本公开的二肽基肽酶
‑
4(dipeptidyle peptidase
‑
4,dpp
‑
4)抑制剂的示例性实例包括但不限于西格列汀(sitagliptin)、维格列汀(vildagliptin)、沙格列汀(saxagliptin)、阿格列汀(alogliptin)、利格列汀(linagliptin)、吉格列汀(gemigliptin)和替格列汀。
96.在某些实施方案中,能够用于本公开的钠
‑
葡萄糖共转运体2(sodium/glucose cotranspoter 2,sglt
‑
2)抑制剂的示例性实例包括但不限于托格列净(tofogliflozin)、恩格列净(empagliflozin)、依格列净l
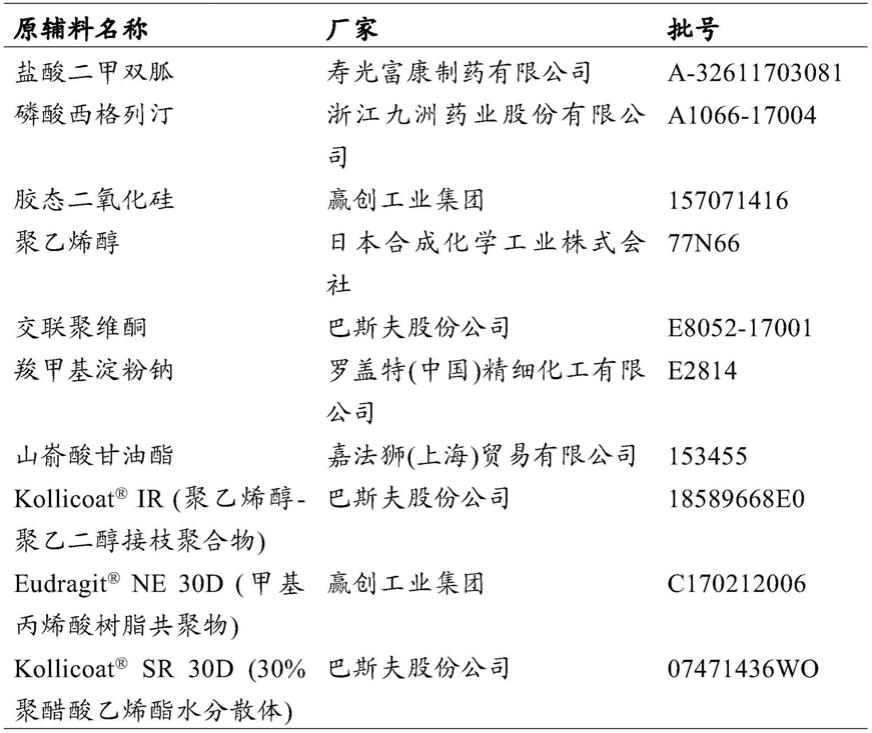
‑
脯氨酸(ipragliflozin l
‑
proline)、鲁格列净(luseogliflozin)、达格列净丙二醇(dapagliflozin propanediol)、卡格列净(canagliflozin)、埃格列净(ertugliflozin)。
97.在某些实施方案中,能够本公开的磺酰脲类药物(sulfonylureas)的示例性实例包括但不限于:格列吡嗪(glipizide)、格列齐特(gliclazide)、格列本脲(glibenclamide)、格列波脲(glibornuride)、格列美脲(glimepiride)和格列喹酮(gliquidone)。
98.在某些实施方案中,能够用于本公开的非磺酰脲类药物(non
‑
sulfonylureas)的示例性实例包括但不限于瑞格列奈(repaglinide)和那格列奈(nateglinide)。
99.在某些实施方案中,能够用于本公开的α
‑
糖苷酶抑制剂(glucosidase inhibitor)的示例性实例包括但不限于阿卡波糖(acarbose)和伏格列波糖(voglibose)。
100.在某些实施方案中,能够用于本公开的胰岛素增敏剂(insulin sensitizer)的示
例性实例包括但不限于罗格列酮(rosiglitazone)和吡格列酮(pioglitazone)。
101.在某些实施方案中,本公开的胃滞留片包含在缓释层外的第二包衣层。
102.在某些实施方案中,本公开的第二包衣层包含水溶性聚合物。
103.在某些实施方案中,能够用于本公开的第二包衣层的水溶性聚合物的示例性实例包括但不限于海藻酸钠、羟丙甲纤维素、聚乙烯醇、聚乙烯醇
‑
聚乙二醇接枝聚合物以及包含聚乙二醇和聚乙烯醇的混合物。
104.在某些实施方案中,能够用于本公开的包含聚乙二醇和聚乙烯醇的混合物的示例性实例包括但不限于ii。
105.在某些实施方案中,能够用于本公开的聚乙烯醇
‑
聚乙二醇接枝聚合物的示例性实例包括但不限于ir。
106.在某些实施方案中,本公开的胃滞留片包含在缓释层外的第一包衣层以及在第一包衣层外的第二包衣层。
107.在某些实施方案中,本公开的胃滞留片的片芯还包含填充剂。
108.在某些实施方案中,能够用于本公开的填充剂的示例性实例包括但不限于乳糖、葡萄糖、蔗糖、木糖醇、甘露醇、山梨醇、麦芽糊精、糖粉、糊精类、微晶纤维素、无机盐类、甘露醇和淀粉。
109.在某些实施方案中,本公开的胃滞留片的片芯还包含助流剂。
110.在某些实施方案中,能够用于本公开的片芯中的助流剂的示例性实例包括但不限于胶态二氧化硅、微粉硅胶、peg、硬脂酸镁、硬脂酸、滑石粉和淀粉。
111.在某些实施方案中,本公开的胃滞留片的片芯还包含粘合剂。
112.在某些实施方案中,能够用于本公开的片芯中的粘合剂的示例性实例包括但不限于聚乙烯醇、羧甲基纤维素钠、淀粉桨类、聚维酮、共聚维酮、蔗糖溶液、羟丙甲纤维素、羟丙基纤维素、甲基羟乙基纤维素、羟乙基纤维素、甲基纤维素、麦芽糊精、淀粉、羧甲基淀粉钠、预胶化淀粉、羟丙基纤维素、羧甲基淀粉钠、明胶、阿拉伯胶、瓜尔胶、槐豆胶、罗望子多糖胶、田菁胶、亚麻籽胶、皂荚糖胶、果胶、黄蜀葵胶、卡拉胶、琼脂、海藻酸钠、海藻酸钾、明胶、甲壳素、黄原胶、β
‑
环状糊精、聚葡萄糖、结冷胶和丙烯酸树脂。
113.在某些实施方案中,本公开的胃滞留片的片芯还包含润滑剂。
114.在某些实施方案中,能够用于本公开的片芯中的润滑剂的示例性实例包括但不限于山嵛酸甘油酯、脂肪酸及其金属皂类、酯类、氢化植物油、聚乙二醇类和月桂醇硫酸镁。
115.在某些实施方案中,能够用于本公开的脂肪酸及其金属皂类的示例性实例包括但不限于硬脂酸镁、硬脂酸、硬脂酸锌、硬脂酸钙、硬脂酸铅、硬脂酸钡和硬质富马酸钠。
116.在某些实施方案中,能够用于本公开的酯类的示例性实例包括但不限于山嵛酸甘油酯、三硬脂酸甘油酯、硬脂酸单甘油酯和硬脂酸丁酯。
117.在某些实施方案中,本公开的胃滞留片的片芯为单层。
118.在某些实施方案中,本公开的胃滞留片的片芯为双层。
119.在某些实施方案中,本公开的胃滞留片的片芯为三层。
120.在某些实施方案中,本公开的胃滞留片的片芯为单室。
121.在某些实施方案中,本公开的胃滞留片的片芯为双室。
122.在某些实施方案中,本公开的胃滞留片的片芯为三室。
123.在某些实施方案中,本公开的胃滞留片的片芯的硬度约为5至15kp。
124.在某些实施方案中,本公开的胃滞留片在水性介质中能够在10分钟内起漂。
125.在某些实施方案中,本公开的胃滞留片在水性介质中能够立即起漂。
126.在某些实施方案中,本公开的胃滞留片的短径不大于约9mm,其厚度不大于短径。
127.在某些实施方案中,本公开的胃滞留片的片重不大于约800mg。
128.在某些实施方案中,本公开的胃滞留片在水性介质中膨胀后的短径不小于约11mm。
129.在某些实施方案中,本公开的胃滞留片在水性介质中膨胀后,缓释层包衣具有良好的张力。
130.另一方面,本公开涉及制备胃滞留片的方法,其包括
131.制备含有第一药物活性成分和膨胀剂的片芯;以及
132.对所述片芯进行缓释层包衣,从而得到所述胃滞留片,
133.其中所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
134.在某些实施方案中,本公开所述的制备胃滞留片方法,还包括在进行所述缓释层包衣后进行第一包衣,从而得到具有第一包衣层的片,其中第一包衣层含有第二活性药物成分。
135.在某些实施方案中,本公开的第一包衣层包含水溶性聚合物。
136.在某些实施方案中,能够用于本公开的第一包衣层的水溶性聚合物的示例性实例包括但不限于包含聚乙二醇和聚乙烯醇的混合物、海藻酸钠、羟丙甲纤维素、聚乙烯醇和聚乙烯醇
‑
聚乙二醇接枝聚合物。
137.在某些实施方案中,能够用于本公开的第一包衣层的水溶性聚合物的示例性实例包括但不限于包含聚乙二醇和聚乙烯醇的混合物和聚乙烯醇
‑
聚乙二醇接枝聚合物。
138.在某些实施方案中,能够用于本公开的包含聚乙二醇和聚乙烯醇的混合物的示例性实例包括但不限于ii。
139.在某些实施方案中,能够用于本公开的聚乙烯醇
‑
聚乙二醇接枝聚合物的示例性实例包括但不限于ir。
140.在某些实施方案中,能够用于公开的第二活性药物成分的示例性实例包括但不限于二肽基肽酶
‑
4(dipeptidyle peptidase
‑
4,dpp
‑
4)抑制剂、钠
‑
葡萄糖共转运体2(sodium/glucose cotransporter 2,sglt
‑
2)抑制剂、磺酰脲类药物(sulfonylureas)、非磺酰脲类药物(non
‑
sulfonylureas)、α
‑
糖苷酶抑制剂(glucosidase inhibitor)、胰岛素增敏剂(insulin sensitizer)。
141.在某些实施方案中,能够用于本公开的二肽基肽酶
‑
4(dipeptidyle peptidase
‑
4,dpp
‑
4)抑制剂的示例性实例包括但不限于西格列汀(sitagliptin)、维格列汀(vildagliptin)、沙格列汀(saxagliptin)、阿格列汀(alogliptin)、利格列汀(linagliptin)、吉格列汀(gemigliptin)和替格列汀。
142.在某些实施方案中,能够用于本公开的钠
‑
葡萄糖共转运体2(sodium/glucose cotranspoter 2,sglt
‑
2)抑制剂的示例性实例包括但不限于托格列净(tofogliflozin)、
恩格列净(empagliflozin)、依格列净l
‑
脯氨酸(ipragliflozin l
‑
proline)、鲁格列净(luseogliflozin)、达格列净丙二醇(dapagliflozin propanediol)、卡格列净(canagliflozin)、埃格列净(ertugliflozin)。
143.在某些实施方案中,能够本公开的磺酰脲类药物(sulfonylureas)的示例性实例包括但不限于:格列吡嗪(glipizide)、格列齐特(gliclazide)、格列本脲(glibenclamide)、格列波脲(glibornuride)、格列美脲(glimepiride)和格列喹酮(gliquidone)。
144.在某些实施方案中,能够用于本公开的非磺酰脲类药物(non
‑
sulfonylureas)的示例性实例包括但不限于瑞格列奈(repaglinide)和那格列奈(nateglinide)。
145.在某些实施方案中,能够用于本公开的α
‑
糖苷酶抑制剂(glucosidase inhibitor)的示例性实例包括但不限于阿卡波糖(acarbose)和伏格列波糖(voglibose)。
146.在某些实施方案中,能够用于本公开的胰岛素增敏剂(insulin sensitizer)的示例性实例包括但不限于罗格列酮(rosiglitazone)和吡格列酮(pioglitazone)。
147.在某些实施方案中,本公开的第二包衣层含有水溶性聚合物。
148.在某些实施方案中,能够用于本公开的第二包衣层的水溶性聚合物的示例性实例包括但不限于海藻酸钠、羟丙甲纤维素、聚乙烯醇、聚乙烯醇
‑
聚乙二醇接枝聚合物以及包含聚乙二醇和聚乙烯醇的混合物。
149.在某些实施方案中,能够用于本公开的包含聚乙二醇和聚乙烯醇的混合物的示例性实例包括但不限于ii。
150.在某些实施方案中,能够用于本公开的聚乙烯醇
‑
聚乙二醇接枝聚合物的示例性实例包括但不限于ir。
151.在某些实施方案中,能够用于本公开的膨胀剂的示例性实例包括但不限于羧甲淀粉钠、预胶化淀粉、交联羧甲基纤维素钠、交联羧甲基纤维素钙和低取代羟丙基纤维素。
152.在某些实施方案中,能够用于本公开的制备包含二甲双胍或其药物可接受的盐的颗粒的方法的示例性实例包括但不限于湿法制粒和干法制粒。
153.在某些实施方案中,能够用于本公开的湿法制粒的实例包括但不限于流化床制粒、湿法制粒机制粒和手工湿法制粒。
154.在某些实施方案中,能够用于本公开的干法制粒的示例性实例包括但不限于干法制粒机制粒。
155.再一方面,本公开涉及由包括以下步骤的方法制备得到的胃滞留片,制备含有第一药物活性成分和膨胀剂的片芯;以及
156.对所述片芯进行缓释层包衣,从而得到所述胃滞留片,
157.其中所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
158.在某些是实施方案中,所述缓释层含有包含聚醋酸乙烯酯和聚维酮的混合物以及丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物。
159.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:4。
160.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙
烯酯和聚维酮的混合物的重量比约为1:6。
161.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:8。
162.在某些实施方案中,本公开的方法包括在进行缓释衣包衣后进行第一包衣,从而具有得到第一包衣层的片。
163.在某些实施方案中,本公开的第一包衣层包含水溶性聚合物。
164.在某些实施方案中,本公开的第一包衣层含有第二活性药物成分。
165.在某些实施方案中,本公开的胃滞留片包含在进行缓释衣包衣后进行第二包衣,从而得到具有第二包衣层的片。
166.在某些实施方案中,本公开的第二包衣层包含水溶性聚合物。
167.在某些实施方案中,本公开的胃滞留片的片芯为单层。
168.在某些实施方案中,本公开的胃滞留片的片芯为双层。
169.在某些实施方案中,本公开的胃滞留片的片芯为三层。
170.在某些实施方案中,本公开的胃滞留片的片芯为单室。
171.在某些实施方案中,本公开的胃滞留片的片芯为双室。
172.在某些实施方案中,本公开的胃滞留片的片芯为三室。
173.在某些实施方案中,本公开的胃滞留片的片芯的硬度约为5至15kp。
174.在某些实施方案中,本公开的胃滞留片在水性介质中能够在10分钟内起漂。
175.在某些实施方案中,本公开的胃滞留片在水性介质中能够立即起漂。
176.在某些实施方案中,本公开的胃滞留片的短径不大于约9mm,其厚度不大于短径。
177.在某些实施方案中,本公开的胃滞留片的片重不大于约800mg。
178.在某些实施方案中,本公开的胃滞留片在水性介质中膨胀后的短径不小于约11mm。
179.在某些实施方案中,本公开的胃滞留片在水性介质中膨胀后,缓释层包衣具有良好的张力。
180.又一方面,本公开涉及改善个体的顺应性的方法,其包括向需要所述方法的所述个体给予胃滞留片,其中所述胃滞留片包含片芯和缓释层,其中所述片芯含有第一活性药物成分和膨胀剂,所述缓释层含有聚乙二醇、聚乙烯醇
‑
聚乙二醇接枝聚合物或其混合物。
181.在某些是实施方案中,所述缓释层含有包含聚醋酸乙烯酯和聚维酮的混合物以及丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物。
182.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:4。
183.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:6。
184.在某些实施方案中,丙烯酸乙酯和甲基丙烯酸甲酯单体的聚合物与包含聚醋酸乙烯酯和聚维酮的混合物的重量比约为1:8。
185.在某些实施方案中,本公开的胃滞留片包含在缓释层外的第一包衣层。
186.在某些实施方案中,本公开的第一包衣层包含水溶性聚合物。
187.在某些实施方案中,本公开的第一包衣层含有第二活性药物成分。
188.在某些实施方案中,本公开的胃滞留片包含在缓释层外的第二包衣层。
189.在某些实施方案中,本公开的第二包衣层包含水溶性聚合物。
190.在某些实施方案中,能够用于本公开的个体的示例性实例包括但不限于哺乳动物。
191.在某些实施方案中,能够用于本公开的哺乳动物的示例性实例包括但不限于狗、猫、牛、羊、马和人类。
192.在某些实施方案中,哺乳动物是人类。
193.下文中,本公开将通过如下实施例进行详细解释以便更好地理解本申请的各个方面及其优点。然而,应当理解,以下的实施例是非限制性的而且仅用于说明本公开的某些实施方案。
194.实施例
195.本公开的实施例中使用的试剂和设备均为常规的并且可商购的。例如:
196.表1原辅料来源
197.[0198][0199]
表2实验主要仪器设备
[0200][0201]
实施例1
[0202]
500mg盐酸二甲双胍缓释片
[0203]
(1)制粒
[0204]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0205]
(2)混合、压片
[0206]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表3。
[0207]
(3)缓释层包衣
[0208]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0209]
表3盐酸二甲双胍缓释片处方
[0210][0211][0212]
实施例2
[0213]
500mg盐酸二甲双胍缓释片
[0214]
(1)制粒
[0215]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0216]
(2)混合、压片
[0217]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表4。
[0218]
(3)缓释层包衣
[0219]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0220]
表4盐酸二甲双胍缓释片处方
[0221][0222][0223]
实施例3
[0224]
500mg盐酸二甲双胍缓释片
[0225]
(1)制粒
[0226]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0227]
(2)混合、压片
[0228]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表5。
[0229]
(3)缓释层包衣
[0230]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0231]
表5盐酸二甲双胍缓释片处方
[0232][0233][0234]
实施例4
[0235]
500mg盐酸二甲双胍缓释片
[0236]
(1)制粒
[0237]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0238]
(2)混合、压片
[0239]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表6。
[0240]
(3)缓释层包衣
[0241]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0242]
表6盐酸二甲双胍缓释片处方
[0243][0244]
实施例5
[0245]
500mg盐酸二甲双胍缓释片
[0246]
(1)制粒
[0247]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0248]
(2)混合、压片
[0249]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表7。
[0250]
(3)缓释层包衣
[0251]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0252]
表7盐酸二甲双胍缓释片处方
[0253][0254][0255]
实施例6
[0256]
500mg盐酸二甲双胍缓释片
[0257]
(1)制粒
[0258]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0259]
(2)混合、压片
[0260]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表8。
[0261]
(3)缓释层包衣
[0262]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0263]
表8盐酸二甲双胍缓释片处方
[0264][0265][0266]
实施例7
[0267]
50mg/500mg西格列汀盐酸二甲双胍缓释片
[0268]
(1)制粒
[0269]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0270]
(2)混合、压片
[0271]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表9。
[0272]
(3)缓释层包衣
[0273]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0274]
(4)西格列汀包衣上药
[0275]
称取磷酸西格列汀至纯水中,边加边搅拌溶解,西格列汀完全溶解后,称取pva和peg 3350加入其中,搅拌1小时。包衣过程中,控制物料温度为30至40℃,包衣增重5至15%。
[0276]
表9西格列汀盐酸二甲双胍缓释片处方
[0277][0278]
实施例8
[0279]
5mg/500mg恩格列净盐酸二甲双胍缓释片
[0280]
(1)制粒
[0281]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0282]
(2)混合、压片
[0283]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表10。
[0284]
(3)缓释层包衣
[0285]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0286]
(4)恩格列净包衣上药
[0287]
称取恩格列净至纯水中,边加边搅拌溶解,恩格列净完全溶解后,称取opadry 00f690002
‑
cn包衣粉加入其中,搅拌1小时。包衣过程中,控制物料温度为30至40℃,包衣增重5至15%。
[0288]
表10恩格列净盐酸二甲双胍缓释片处方
[0289]
[0290][0291]
实施例9
[0292]
400mg阿昔洛韦缓释片
[0293]
(1)制粒
[0294]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的阿昔洛韦,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备阿昔洛韦颗粒,流化床物料温度控制在35至45℃。
[0295]
(2)混合、压片
[0296]
将制备的阿昔洛韦颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表11。
[0297]
(3)缓释层包衣
[0298]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0299]
表11阿昔洛韦缓释片处方
[0300][0301]
实施例10
[0302]
330mg普瑞巴林缓释片
[0303]
(1)制粒
[0304]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的普瑞巴林,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备普瑞巴林颗粒,流化床物料温度控制在35至45℃。
[0305]
(2)混合、压片
[0306]
将制备的普瑞巴林颗粒与处方量甘露醇40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表12。
[0307]
(3)缓释层包衣
[0308]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0309]
表12普瑞巴林缓释片处方
[0310][0311][0312]
实施例11
[0313]
缓释层膜膨胀性能测定
[0314]
(1)介质:0.1n hcl溶液,900ml;
[0315]
(2)将实施例1
‑
11的缓释片置于上述介质中,恒温37℃,100rpm搅拌16小时,得到膨胀的缓释片;
[0316]
(3)按如下操作操作用扫描电子显微镜扫描各实施例缓释片的棱角处和平滑处(图1至20):
[0317]
将膨胀的缓释片取出,吸干缓释片表面水分后,用离子溅射仪对缓释片进行镀膜(喷金)处理,真空度<10pa,电流15ma;
[0318]
将镀膜后的缓释片放入扫描电子显微镜的样品仓,关闭样品仓,抽真空;
[0319]
设定加速电压、工作距离、束斑电流,选择合适的放大倍数(各实施例参数见表13所示),获取图像,保存。
[0320]
表13
[0321][0322][0323]
实施例12
[0324]
500mg盐酸二甲双胍缓释片
[0325]
(1)制粒
[0326]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0327]
(2)混合、压片
[0328]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表14。
[0329]
(3)缓释层包衣
[0330]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0331]
表14盐酸二甲双胍缓释片处方
[0332][0333][0334]
实施例13
[0335]
500mg盐酸二甲双胍缓释片
[0336]
(1)制粒
[0337]
称取处方量的聚醋酸乙烯酯(polyvinyl acetate,pva),用纯化水配制成4%的溶液,称取过30目筛的盐酸二甲双胍,至于流化床中,加入处方量的胶态二氧化硅和羧甲淀粉钠,采用顶喷制粒的方式制备盐酸二甲双胍颗粒,流化床物料温度控制在35至45℃。
[0338]
(2)混合、压片
[0339]
将制备的盐酸二甲双胍颗粒与处方量胶态二氧化硅混合40转,加入处方量交联聚维酮,混合100分钟,最后加入处方量山嵛酸甘油酯,润滑50转,压片。处方如表15。
[0340]
(3)缓释层包衣
[0341]
称取缓释层辅料分散或溶解至纯水中,搅拌至均匀作为缓释层包衣液。缓释层包衣过程中,控制物料温度为30至45℃,包衣增重5至15%。
[0342]
表15盐酸二甲双胍缓释片处方
[0343][0344]
实施例14
[0345]
盐酸二甲双胍缓释片释放度测定
[0346]
待测样品:
[0347]
实施例12到13制备得到的盐酸二甲双胍缓释片;
[0348]
实施例12样品设置6个平行样;
[0349]
实施例13样品设置3个平行样。
[0350]
释放度实验采用sotax溶出仪和岛津紫外分光光度计测定。
[0351]
释放度测定
[0352]
参考fda、《美国药典》和《中国药典》的盐酸二甲双胍缓释片的释放度检测方法,以及《普通口服固体制剂溶出度试验技术指导原则》,建立样品释放度测定方法:转速200rpm,水浴温度(37.0
±
0.5)℃,溶出介质为ph 1.2盐酸溶液,介质体积1000ml。
[0353]
溶出介质ph 1.2盐酸溶液配制方法:量取浓盐酸53.55ml,加水稀释至7000ml,混合均匀,即得ph 1.2盐酸溶液。
[0354]
将待测样品置于溶出仪转篮中,分别于1h,2h,4h,6h,8h,10h,12h,14h和16h取样9ml,用0.45μm微孔滤膜过滤,取滤液用紫外分光光度计测定吸光度。分别计算盐酸二甲双胍在不同释放时间的累积释放度,如表16和17所示。
[0355]
表16实施例12的二甲双胍缓释片释放度结果
[0356][0357]
表17实施例13的二甲双胍缓释片释放度结果
[0358][0359][0360]
在本公开中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。
[0361]
从前述中可以理解,尽管为了示例性说明的目的描述了本公开的具体实施方案,但是在不偏离本公开的精神和范围的条件下,本领域所述技术人员可以作出各种变形或改
进。这些变形或修改都应落入本公开所附权利要求的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1