包含依泽替米贝和氯沙坦的药物组合制剂的制作方法
1.本发明涉及包含依泽替米贝和氯沙坦的药物组合制剂。更具体地,本发明涉及包含依泽替米贝和氯沙坦的药物组合制剂,其中每种药物之间的溶出度受到最小影响。
2.本技术要求基于于2019年4月18日提交的韩国专利申请no.10
‑
2019
‑
0045295的优先权的权益,其全部内容通过引用并入本文。
背景技术:
3.氯沙坦(losartan)是2
‑
丁基
‑4‑
氯
‑1‑
[2
′‑
(1h
‑
四唑
‑5‑
基)[1,1
′‑
联苯基]
‑4‑
基]甲基]
‑
1h
‑
咪唑
‑5‑
甲醇的通用名称,并在美国专利no.5,608,075、5,138,069、5,153,197等中公开,并且特别地,氯沙坦钙目前以商品名市售。氯沙坦通过阻断血管紧张素ii(其为血管收缩剂物质)与其受体的结合而用于治疗高血压和心力衰竭、治疗缺血性外周循环病症和心肌缺血(心绞痛)、防止心肌梗死之后心力衰竭的进展以及治疗糖尿病性神经病变、青光眼等。
[0004]
依泽替米贝(ezetimibe)是氮杂环丁酮衍生物,化学名称为1
‑
(4
‑
氟苯基)
‑
3(r)
‑
[3
‑
(4
‑
氟苯基)
‑
3(s)
‑
羟丙基]
‑
4(s)
‑
(4
‑
羟苯基)
‑2‑
氮杂环丁酮,在治疗和预防动脉硬化中用作抑制胆固醇吸收的药物,并且也与在肝中抑制胆固醇合成的他汀类药物组合使用。这样的依泽替米贝是几乎不溶于水的物质,从而在水性介质例如胃液中表现出低溶解度,并因此经口施用时表现出低生物利用度。
[0005]
为了有效治疗心血管疾病,临床领域中越来越需要使用不同机制例如氯沙坦和依泽替米贝的组合制剂,但由于药物之间存在相互作用,溶出速率和稳定性容易降低,并且开发难度高,使得它们不会被商业化。
[0006]
为了制备有效的组合制剂,必须确保活性成分的高生物利用度。来自经口固体制剂的活性成分的溶出模式与制剂的生物利用度密切相关,并且高生物利用度预示了高溶出速率。一般而言,构成片剂的颗粒的颗粒尺寸越小,溶出速率越有提高的趋势,但颗粒的颗粒尺寸越小,颗粒的流动性越低,并因此休止角越小。如果颗粒的流动性低,则在片剂和胶囊剂的制造期间存在生产率降低的问题。
[0007]
因此,在技术领域中,需要开发即使在包含氯沙坦和依泽替米贝的组合制剂中也具有优异药学特性的组合制剂,并且正在对其进行持续研究。
技术实现要素:
[0008]
技术问题
[0009]
本发明人试图通过实验确定包含依泽替米贝和氯沙坦作为活性成分的药物组合制剂中每种药物的溶出度相关性,并且提供其中在包含依泽替米贝和氯沙坦的药物组合制剂中每种药物之间的溶出度受到最小影响的药物组合制剂,从而提供与单一依泽替米贝制剂相比具有相似药代动力学参数的药物组合制剂。
[0010]
技术方案
[0011]
根据本发明的第一方面,
[0012]
本发明提供了药物组合制剂,其包含依泽替米贝或其可药用盐以及氯沙坦或其可药用盐,其中当所述药物组合制剂在ph 4.0至5.0的溶液中溶解10分钟时,氯沙坦的溶解量为5,700μg或更少,并且依泽替米贝的溶解量为270μg或更多。
[0013]
在本发明的一个实施方案中,对于包含20mg依泽替米贝和183mg氯沙坦的药物组合制剂,根据美国药典在37℃温度和50rpm桨法的条件下在500ml乙酸盐缓冲液中进行在ph 4.0至5.0溶液中的溶解。
[0014]
在本发明的一个实施方案中,当药物组合制剂在ph 4.0至5.0的溶液中溶解10分钟时,氯沙坦的溶解量为5,200μg或更少,并且依泽替米贝的溶解量为300μg或更多。
[0015]
在本发明的一个实施方案中,依泽替米贝或其可药用盐与氯沙坦或其可药用盐彼此物理分离。
[0016]
在本发明的一个实施方案中,依泽替米贝或其可药用盐以及氯沙坦或其可药用盐各自以颗粒形式存在。
[0017]
在本发明的一个实施方案中,包含依泽替米贝或其可药用盐的颗粒中直径大于250μm的颗粒的含量为按重量计15%或更少。
[0018]
在本发明的一个实施方案中,包含氯沙坦或其可药用盐的颗粒中直径超过250μm的颗粒的含量为按重量计35至55%,并且直径超过500μm的颗粒的含量为按重量计10至30%。
[0019]
在本发明的一个实施方案中,所述药物组合制剂包含如转化成依泽替米贝游离酸形式为5至10mg的依泽替米贝或其可药用盐,并且包含如转化成氯沙坦游离酸形式为40至100mg的氯沙坦或其可药用盐。
[0020]
在本发明的一个实施方案中,包含依泽替米贝或其可药用盐的颗粒还包含增溶剂。
[0021]
在本发明的一个实施方案中,增溶剂为月桂基硫酸钠。
[0022]
在本发明的一个实施方案中,基于100重量份的依泽替米贝,增溶剂以5至50重量份的量包含在包含依泽替米贝或其可药用盐的颗粒中。
[0023]
在本发明的一个实施方案中,基于100重量份的氯沙坦,包含氯沙坦或其可药用盐的颗粒还包含1至30重量份的崩解剂。
[0024]
在本发明的一个实施方案中,药物组合制剂以双层片剂的形式存在,所述双层片剂由以下组成:第一层,其包含依泽替米贝或其可药用盐;和第二层,其包含氯沙坦或其可药用盐。
[0025]
根据本发明的第二方面,
[0026]
本发明提供了具有双层片剂形式的药物组合制剂,所述双层片剂由以下组成:第一层,其包含依泽替米贝或其可药用盐、氨氯地平或其可药用盐、和瑞舒伐他汀或其可药用盐;以及第二层,其包含氯沙坦或其可药用盐,其中当所述药物组合制剂在ph 4.0至5.0的溶液中溶解10分钟时,氯沙坦的溶解量为5,700μg或更少,并且依泽替米贝的溶解量为270μg或更多。
[0027]
在本发明的一个实施方案中,依泽替米贝或其可药用盐以颗粒形式包含在第一层
中,并且氯沙坦或其可药用盐以颗粒形式包含在第二层中。
[0028]
有益效果
[0029]
本发明提供了包含依泽替米贝和氯沙坦的药物组合制剂,其中依泽替米贝或其可药用盐以与氯沙坦或其可药用盐物理分离的状态存在,并且控制氯沙坦的溶出速率,从而能够提供其中每种药物之间的溶出度受到最小影响的药物组合制剂,并且能够提供其生物学等同性得到确保的药物组合制剂。
[0030]
另外,如果提供除依泽替米贝和氯沙坦之外还包含氨氯地平和瑞舒伐他汀的药物组合制剂,则依泽替米贝分别与氨氯地平、氯沙坦和瑞舒伐他汀物理分离,并且控制氯沙坦的溶出速率,从而能够确保药物组合制剂的生物学等同性。
附图说明
[0031]
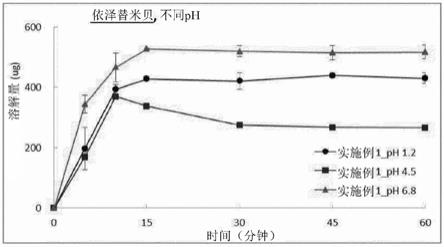
图1是示出了在根据实施例1的片剂中在ph(ph 1.2、4.5和6.8)下依泽替米贝的溶解结果的图。
[0032]
图2是示出了在根据实施例1和比较例1的片剂以及根据实施例3和比较例2的胶囊剂中在ph 4.5下依泽替米贝的溶解结果的图。
[0033]
图3是示出了在根据实施例1和比较例1的片剂以及根据实施例3和比较例2的胶囊剂中在ph 4.5下氯沙坦的溶解结果的图。
[0034]
图4是示出了在根据实施例1和2的片剂以及根据比较例3和4的片剂中在ph 4.5下依泽替米贝的溶解结果的图。
[0035]
图5是示出了在根据实施例1和2的片剂以及根据比较例3和4的片剂中在ph 4.5下氯沙坦的溶解结果的图。
[0036]
图6是示出了在根据实施例1和4的片剂中在ph 4.5下依泽替米贝的溶解结果的图。
[0037]
图7是示出了在根据实施例1和4的片剂中在ph 4.5下氯沙坦的溶解结果的图。
[0038]
图8是示出了在根据实施例1以及比较例1和3的片剂中依泽替米贝的血浆浓度模式的图。
[0039]
最佳实施方式
[0040]
根据本发明提供的实施方案全部可通过以下说明实现。应当理解,以下说明描述了本发明的一些优选实施方案,并且本发明不必限于此。
[0041]
本发明提供了包含依泽替米贝或其可药用盐以及氯沙坦或其可药用盐的药物组合制剂。
[0042]
根据本发明的药物组合制剂包含依泽替米贝或其可药用盐作为第一活性成分。依泽替米贝主要用于抑制胆固醇吸收,以用于治疗和预防动脉硬化。依泽替米贝或其可药用盐的日剂量为5mg至15mg。在本发明的一个实施方案中,药物组合制剂包含如转化成依泽替米贝游离酸形式为5至10mg的依泽替米贝或其可药用盐。其中,活性成分的游离酸形式意指未结合其他化合物例如碱的活性成分本身。
[0043]
根据本发明的药物组合制剂可包含氯沙坦或其可药用盐作为第二活性成分。氯沙坦的可药用盐的一些实例包括但不必限于氯沙坦钾盐。氯沙坦有助于阻断血管紧张素ii(其为血管收缩剂物质)与其受体结合,以治疗高血压和心力衰竭、治疗缺血性外周循环病
症和心肌缺血(心绞痛)、防止心肌梗死之后心力衰竭的进展以及治疗糖尿病性神经病变、青光眼等。氯沙坦或其可药用盐的日剂量为40mg至100mg。在本发明的一个实施方案中,药物组合制剂包含如转化成氯沙坦游离酸形式为40至100mg的氯沙坦或其可药用盐。
[0044]
在包含依泽替米贝和氯沙坦作为活性成分的药物组合制剂中,氯沙坦的溶出度可影响依泽替米贝的溶出度。由于影响并非在所有条件下都同等出现,因此选择特定条件来确定这些影响可能是更为重要的。本发明人通过以下实例等确定,当包含依泽替米贝和氯沙坦的药物组合制剂溶解在ph 4.0至5.0的溶液中时,依泽替米贝的溶解量很大程度上取决于氯沙坦的溶解量,并且下面提供了其中依泽替米贝与氯沙坦之间的溶出度受到最小影响的药物组合制剂。
[0045]
当根据本发明的包含依泽替米贝和氯沙坦的药物组合制剂在ph 4.0至5.0的溶液中溶解10分钟时,氯沙坦的溶解量为5,700μg或更少,优选5,450μg或更少,并且更优选5,200μg或更少。当药物组合制剂在ph 4.0至5.0的溶液中溶解10分钟时,依泽替米贝的溶解量为270μg或更多,优选285μg或更多,并且更优选300μg或更多。对于包含20mg依泽替米贝和183mg氯沙坦的药物组合制剂,根据美国药典,在37℃温度和50rpm桨法的条件下在500ml乙酸盐缓冲液中进行溶出测试,并且溶解量为5次或更多次、优选10次或更多次测量的平均值。溶解量可通过多种方法来控制,所述方法例如使用添加剂、颗粒或制剂的形式等。
[0046]
如上所述,由于氯沙坦可影响依泽替米贝的溶出度和饱和溶解度,因此优选的是,依泽替米贝和氯沙坦以物理分离的状态存在以控制氯沙坦的溶出速率。在这种情况下,物理分离状态意指进行将参考活性成分与其他活性成分分离的加工步骤,并且在通过该加工步骤获得的最终组合制剂中,参考活性成分以区别于其他活性成分的状态维持,但是其中在无该加工步骤的情况下预先在混合过程中混合成分本身的情况不符合这个含义。物理分离状态可通过例如使用制粒的物理分离、通过多层压片的物理分离、通过各自分开压片的片剂的物理分离、使用核
‑
壳结构的物理分离等来实现。根据本发明的一个实施方案,为了在物理上分离依泽替米贝和氯沙坦,可进行将依泽替米贝和氯沙坦生产成单独的颗粒形式并随后将其混合的过程。此时,在甚至在组合制剂完成之后也如在加工步骤中那样维持其中除依泽替米贝之外的活性成分(氯沙坦)基本上不存在于颗粒中的状态的情况下,即使在组合制剂中在每个依泽替米贝颗粒的表面上存在依泽替米贝与氯沙坦接触的界面,也可以认为如本发明中所述在组合制剂中依泽替米贝与氯沙坦以物理分离的状态存在。同样地,在另一个实施方案中,组合制剂可通过将瑞舒伐他汀和氨氯地平与对依泽替米贝进行制粒加工之后产生的依泽替米贝颗粒混合来获得,其中在依泽替米贝颗粒中基本上不存在其他活性成分(瑞舒伐他汀和氨氯地平)的情况下,依泽替米贝可被视为以与瑞舒伐他汀和氨氯地平物理分离的状态存在。在本发明的一个实施方案中,药物组合制剂可以以双层片剂的形式存在,所述双层片剂由以下组成:第一层,其包含依泽替米贝或其可药用盐;和第二层,其包含氯沙坦或其可药用盐。
[0047]
用于产生依泽替米贝颗粒的方法不受特别限制,但是可优选地以湿状态产生颗粒。依泽替米贝是在酸性至弱碱性条件(例如体液)下具有约1ppm的低饱和溶解度的难溶性药物。从溶出开始到饱和点的饱和溶解度和溶出速率可以是用于评价难溶性药物的生物利用度的重要指标,并且湿颗粒可以以更快的速率达到饱和溶解度,使得可确保难溶性药物依泽替米贝的高生物利用度。用于产生氯沙坦颗粒的方法不受特别限制,但是可优选通过
压缩制粒方法来产生颗粒。当依泽替米贝颗粒通过250μm的筛孔尺寸(尺寸60)进行筛分时,直径大于250μm的颗粒(残余物)的含量可以为按重量计15%或更少,优选按重量计10%或更少。当氯沙坦颗粒通过250μm的筛孔尺寸进行筛分时,直径大于250μm的颗粒(残余物)的含量可以为按重量计35至55%,优选按重量计40至50%,并且当其通过500μm的筛孔尺寸(尺寸35)进行筛分时,直径大于500μm的颗粒(残余物)的含量可以为按重量计10至30%,优选按重量计15至25%。如果将依泽替米贝颗粒和氯沙坦颗粒调节在以上范围内,则可以将依泽替米贝颗粒和氯沙坦的溶解量调节在合适水平。
[0048]
除以上活性成分之外,本发明的组合制剂还可包含制剂所需的一种或更多种可药用添加剂。具体地,依泽替米贝颗粒部分或氯沙坦颗粒部分可包含选自以下的一种或更多种可药用添加剂:赋形剂、黏合剂和崩解剂。根据本发明的一个实施方案,基于100重量份的依泽替米贝,赋形剂可以以50至5,000重量份、优选500至4,000重量份、更优选1,000至3,000重量份的量包含在依泽替米贝颗粒部分中。基于100重量份的依泽替米贝,黏合剂可以以10至1,000重量份、优选20至500重量份、更优选30至100重量份的量包含在依泽替米贝颗粒部分中。基于100重量份的依泽替米贝,崩解剂可以以10至1,000重量份、优选20至500重量份、更优选30至300重量份的量包含在依泽替米贝颗粒部分中。根据本发明的一个实施方案,基于100重量份的氯沙坦,赋形剂可以以50至1,000重量份,优选100至500重量份,更优选150至300重量份的量包含在氯沙坦颗粒部分中。由于氯沙坦的溶出度可影响依泽替米贝的溶出度,因此氯沙坦颗粒部分中崩解剂的含量可以是制备根据本发明药物组合制剂的重要要素。在本发明的一个实施方案中,基于100重量份的氯沙坦,崩解剂可以以1至30重量份,优选10至25重量份的量包含。如果崩解剂以小于1重量份的量包含,则氯沙坦的溶出度可降低,并且如果崩解剂以大于30重量份的量包含,则依泽替米贝的溶出度可能会由于氯沙坦的溶出度而降低。在制备颗粒之后,可将依泽替米贝颗粒部分或氯沙坦颗粒部分与助流剂混合。根据本发明的一个实施方案,基于100重量份的依泽替米贝,助流剂可以以5至300重量份,优选10至200重量份,更优选15至100重量份的量与依泽替米贝颗粒部分混合,并且基于100重量份的氯沙坦,助流剂可以以0.1至20重量份,优选0.5至15重量份,更优选1至10重量份的量与氯沙坦颗粒部分混合。
[0049]
这样的添加剂的种类和含量可由本领域技术人员根据待制备的特定制剂的类型适当地选择。例如,赋形剂选自但不限于:乳糖、淀粉、甘露糖醇、微晶纤维素、羧甲基纤维素,及其组合;黏合剂选自但不限于:聚维酮、羟丙甲纤维素、羟丙基纤维素、共聚维酮,及其组合;崩解剂选自但不限于:交联聚维酮、交联羧甲基纤维素钠、羟基乙酸淀粉钠、低取代羟丙基纤维素,及其组合;以及助流剂选自但不限于:硬脂酸镁、滑石、轻质无水硅酸、硬脂富马酸钠,及其组合。
[0050]
由于依泽替米贝是难溶性药物,如上所述,因此依泽替米贝颗粒部分可还包含增溶剂。在本发明的一个实施方案中,基于100重量份的依泽替米贝,所述增溶剂可以以5至50重量份、优选10至40重量份、更优选15至30重量份的量包含在依泽替米贝颗粒部分中。如果增溶剂的量小于5重量份,则依泽替米贝的溶出速率显著降低,而如果增溶剂的量大于50重量份,则由于增溶剂的提高引起的依泽替米贝溶出速率的提高效果是不显著的。另外,如果增溶剂以过多的量使用,则依泽替米贝颗粒的稳定性可降低。月桂基硫酸钠(sodium lauryl sulfate,sls)可优选地用作增溶剂。
[0051]
根据本发明的药物组合制剂可还包含选自以下的成分:氨氯地平或其可药用盐、瑞舒伐他汀或其可药用盐,及其组合。
[0052]
根据本发明的药物组合制剂可包含氨氯地平或其可药用盐作为第三活性成分。氨氯地平的可药用盐的一些实例包括但不必限于:盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、乙酸盐、苹果酸盐、富马酸盐、乳酸盐、酒石酸盐、柠檬酸盐、葡糖酸盐、苯磺酸盐和樟脑磺酸盐,优选氨氯地平苯磺酸盐和氨氯地平樟脑磺酸盐。另外,本发明的氨氯地平包括氨氯地平外消旋体和(s)
‑
氨氯地平。氨氯地平通过阻断钙通道而用于治疗心血管疾病,例如心绞痛、高血压和充血性心力衰竭。氨氯地平或其可药用盐的日剂量为5mg至20mg。
[0053]
根据本发明的药物组合制剂包含瑞舒伐他汀或其可药用盐作为第四活性成分。瑞舒伐他汀的可药用盐的一些实例包括但不限于钙盐、镁盐、锶盐等,并且优选瑞舒伐他汀钙盐。瑞舒伐他汀通过抑制合成胆固醇所必需的hmg
‑
coa还原酶而有助于治疗血脂异常,从而降低血液ldl胆固醇水平,同时提高hdl胆固醇水平。瑞舒伐他汀或其可药用盐的日剂量为10mg至20mg。
[0054]
依泽替米贝以分别与瑞舒伐他汀、氨氯地平和氯沙坦物理分离的状态存在。其中,物理分离状态遵循以上说明。如果药物组合制剂包含依泽替米贝、瑞舒伐他汀、氨氯地平和氯沙坦中的全部作为活性成分,则药物组合制剂可以以由以下组成的双层片剂的形式存在:第一层,其包含依泽替米贝或其可药用盐、瑞舒伐他汀或其可药用盐、和氨氯地平或其可药用盐;以及第二层,其包含氯沙坦或其可药用盐。在第一层中,依泽替米贝或其可药用盐以颗粒形式与瑞舒伐他汀或其可药用盐以及氨氯地平或其可药用盐以混合物存在。在第二层中,氯沙坦或其可药用盐以颗粒形式存在。双层片剂中的第一层和第二层可包含选自以下的一种或更多种可药用添加剂:赋形剂、黏合剂、崩解剂和助流剂。
[0055]
本发明提供了制备包含依泽替米贝或其可药用盐以及氯沙坦或其可药用盐的药物组合制剂的方法。
[0056]
制备根据本发明的药物组合制剂的方法包括以下步骤:i)产生包含依泽替米贝或其可药用盐的依泽替米贝颗粒;ii)产生包含氯沙坦或其可药用盐的氯沙坦颗粒;以及iii)控制依泽替米贝或氯沙坦的溶解量。步骤iii)是根据上述标准来控制依泽替米贝或氯沙坦的溶解量,并且依泽替米贝或氯沙坦的溶解量可通过使用添加剂、颗粒或制剂的形式等来控制。制备方法的细节通过上述说明和以下实施例来补充。
具体实施方式
[0057]
在下文中,将提供一些优选实施例以帮助理解本发明,但提供以下实施例不是为了限制本发明而是为了促进对本发明的理解。
[0058]
实施例
[0059]
实施例1:包含依泽替米贝和氯沙坦的双层片剂的制备
[0060]
根据下表1中所示的组成制备包含依泽替米贝和氯沙坦作为活性成分的经包衣双层片剂。
[0061]
具体地,将依泽替米贝与乳糖水合物、微晶纤维素、交联羧甲基纤维素钠和月桂基硫酸钠一起置于流化床制粒机中并混合3分钟。向其中添加其中聚维酮溶解在水中的黏合剂溶液,并将输送泵设置为2rpm并组合以进行约50分钟的制粒。将所得产物在流化床干燥
机中于45℃下干燥,并随后通过0.6mm筛孔尺寸进行筛分,以产生依泽替米贝颗粒。此时,依泽替米贝颗粒中直径大于250μm的颗粒的含量为按重量计5%。
[0062]
将氯沙坦钾与乳糖水合物、微晶纤维素和交聚维酮一起置于混合器中,并混合20分钟。使用辊式压缩机(tf
‑1‑
a60,freund vector),在2mpa的油压、5rpm的进料速度和1rpm的辊速度的条件下,将所得产物压制以形成片状物,并随后通过0.8mm的筛孔尺寸进行筛分来产生氯沙坦颗粒。此时,氯沙坦颗粒中直径大于250μm的颗粒的含量为按重量计45%,而直径大于500μm的颗粒的含量为按重量计20%。
[0063]
向依泽替米贝颗粒添加硬脂酸镁并在混合器中进一步混合5分钟以制备双层片剂的上层混合物。另外,向氯沙坦颗粒添加硬脂酸镁,并在混合器中进一步混合5分钟以制备双层片剂的下层混合物。将上层和下层混合物用压片机(autotab
‑
200tr,ichihashi seiki)加压以制备硬度为约12kp的双层片剂。
[0064]
根据下表1中所示的包衣层配方,使用包衣机(sfc
‑
30f,sejong)对双层片剂进行包衣。
[0065]
实施例2:包含依泽替米贝和氯沙坦的双层片剂的制备
[0066]
根据下表1中所示的组成以与实施例1中相同的方式制备包含依泽替米贝和氯沙坦作为活性成分的经包衣双层片剂。
[0067]
实施例3:含有包含依泽替米贝和氯沙坦的微片剂的胶囊剂的制备
[0068]
根据下表1中所示的组成制备含有各自包含依泽替米贝和氯沙坦作为活性成分的经包衣微片剂的胶囊剂。
[0069]
具体地,以与实施例1中相同的方式制备依泽替米贝颗粒和氯沙坦颗粒。用压片机分别从每种颗粒制备含氯沙坦的微片剂(303mg/30t)和含依泽替米贝的微片剂(157mg/10t)(其直径为2mm并且硬度为约1.5kp)。使用流化床包衣机根据表1中所示的包衣层配方分别对含氯沙坦的微片剂和含依泽替米贝的微片剂进行包衣,并将其填充到尺寸0硬胶囊中。
[0070]
实施例4:包含依泽替米贝、瑞舒伐他汀、氨氯地平和氯沙坦的双层片剂的制备
[0071]
根据下表1中所示的组成制备包含依泽替米贝、瑞舒伐他汀、氨氯地平和氯沙坦作为活性成分的经包衣双层片剂。
[0072]
具体地,以与实施例1中相同的方式产生氯沙坦颗粒,并将硬脂酸镁与氯沙坦颗粒混合以制备上层混合物。
[0073]
另外,以与实施例1中相同的方式产生依泽替米贝颗粒,并随后将依泽替米贝颗粒与具有表1混合部分中所述组成的混合物一起置于混合器中并混合15分钟。此后,向其中添加硬脂酸镁并在混合器中进一步混合5分钟以制备下层混合物。将上层和下层混合物用压片机加压,以制备硬度为约20kp的双层片剂。
[0074]
根据下表1中所示的包衣层配方使用包衣机对双层片剂进行包衣。
[0075]
根据实施例1至4的药物组合制剂的具体组成示于下表1中。
[0076]
[表1]
[0077]
[0078][0079]
*纯化水在该过程期间被去除。
[0080]
比较例1:包含依泽替米贝的片剂的制备
[0081]
根据下表2中所示的组成制备包含依泽替米贝作为活性成分的经包衣片剂。
[0082]
具体地,以与实施例1中相同的方式制备包含依泽替米贝颗粒的混合物并将其用
压片机加压以制备硬度为约7kp的片剂。
[0083]
根据下表2中所示的包衣层配方使用包衣机对片剂进行包衣。
[0084]
比较例2:包含依泽替米贝微片剂和氯沙坦颗粒的胶囊剂的制备
[0085]
将包含实施例1中获得的氯沙坦颗粒和实施例3中获得的依泽替米贝的经包衣微片剂(157mg/10t)填充到尺寸0硬胶囊中。
[0086]
比较例3和4:包含依泽替米贝和氯沙坦的双层片剂的制备
[0087]
根据下表2中所示的组成以与实施例1中相同的方式制备包含依泽替米贝和氯沙坦作为活性成分的经包衣双层片剂。
[0088]
根据比较例1、3和4的药物组合制剂的具体组成示于下表2中。
[0089]
[表2]
[0090]
[0091][0092]
*纯化水在该过程期间被去除。
[0093]
测试例
[0094]
测试例1:溶出测试
[0095]
在以下溶出条件和分析条件下,分别测量根据实施例1至4和比较例1至4的片剂或胶囊剂中依泽替米贝和氯沙坦的溶出速率,并将结果示于图1至7中。
[0096]
<溶出条件>
[0097]
溶出介质:获取两个片剂或两个胶囊剂(依泽替米贝20mg,氯沙坦183mg)并在500ml以下溶液中进行测试。
[0098]
‑
ph 1.2:无酶的模拟胃液usp
[0099]
‑
ph 4.5:乙酸缓冲液usp
[0100]
‑
ph 6.8:无酶的模拟肠液usp
[0101]
装置:桨法,50
±
2rpm
[0102]
温度:37
±
0.5℃
[0103]
溶出时间:5、10、15、30、45、60分钟
[0104]
(在45分钟之后,将桨速改为150rpm,并搅拌15分钟,并随后在60分钟时获取溶出介质。)
[0105]
<分析条件>
[0106]
柱:内径为4.6mm并且长度为15cm的不锈钢管装有3μm的十八烷基甲硅烷基化硅胶,以用于液相色谱。
[0107]
流动相:*9mm己烷磺酸钠/0.13%(v/v)磷酸∶乙腈(52∶48,v/v)
[0108]
将(*9mm己烷磺酸钠/0.13%(v/v)磷酸∶1.86g己烷磺酸钠(1
‑
己烷磺酸钠一水合物)置于1l烧瓶中,并向其中小心地添加1.3ml磷酸。向其中添加纯化水,并将其溶解、稀释并充分混合。
[0109]
检测器:紫外吸收分光光度计(测量波长254nm)
[0110]
流量:1.3ml/分钟
[0111]
进样量:10μl
[0112]
柱温:45℃
[0113]
图1示出了在根据实施例1的片剂中在ph下的依泽替米贝的溶解结果。根据图1,确定了当根据实施例1的片剂在ph 1.2和ph 6.8下溶解时,主要成分的溶解量得以维持,而当其在ph 1.2与ph 6.8之间的ph 4.5下溶解约10分钟时,主要成分的溶解量在达到最大值之后逐渐降低至保持低于最大值。
[0114]
图2和3示出了在根据实施例1和比较例1的片剂以及根据实施例3和比较例2的胶囊剂中在ph 4.5下依泽替米贝和氯沙坦的溶解结果。首先,对根据实施例1的包含依泽替米贝和氯沙坦的片剂与根据比较例1的仅包含以相同方式制备的依泽替米贝而不含氯沙坦的片剂的溶出模式进行比较。根据图2,确定了在根据比较例1的不包含氯沙坦的片剂的情况下,在ph 4.5下依泽替米贝的溶解量保持在最大值。依泽替米贝是难溶性药物,并且已知在不含表面活性剂的溶出介质中表现出低溶解度,但依泽替米贝在溶出之后再次沉积被认为是一种不寻常的现象,并且确定了这是因为氯沙坦影响了依泽替米贝的溶出度和饱和溶解度。
[0115]
随后,尽管包括了以相同方式制备的依泽替米贝,但仍对根据实施例3的通过包含作为经包衣微片剂形式的氯沙坦而具有受控溶出速率的胶囊剂与根据比较例2的通过包含作为颗粒形式的氯沙坦而具有快速溶出的胶囊剂进行了比较。根据图2和3,确定了当氯沙坦的溶出快速时,依泽替米贝的初始溶出速率和饱和溶解度低,如在根据比较例2的胶囊剂中。通过这些结果,确定了氯沙坦影响依泽替米贝的溶出模式,如在根据实施例1的片剂与根据比较例1的片剂的先前比较中。
[0116]
图4和5示出了在根据实施例1和2的片剂以及根据比较例3和4的片剂中在ph 4.5下依泽替米贝和氯沙坦的溶解结果。根据实施例1和2的片剂以及根据比较例3和4的片剂分别在氯沙坦层中崩解剂的量方面不同。确定了当崩解剂分别以15mg和20mg的量包含在氯沙坦层中,如在根据实施例1和2的片剂中,氯沙坦和依泽替米贝的溶出模式显示出相似。相反地,确定了当崩解剂分别以30mg和45mg的量包含在氯沙坦层中,如在根据比较例3和4的片剂中,与根据实施例1和2的片剂相比,氯沙坦的溶出速率提高,但依泽替米贝的最大溶解量小。
[0117]
图6和7示出了在根据实施例1和4的片剂中在ph 4.5下依泽替米贝和氯沙坦的溶解结果。根据图6和7,确定了即使氨氯地平和瑞舒伐他汀与依泽替米贝颗粒混合,如在根据实施例4的片剂中,与根据实施例1的片剂相比,依泽替米贝的最大溶解量也没有显著性差异。通过这些结果,确定了依泽替米贝的溶出模式直接受氯沙坦影响,而不是受氨氯地平和瑞舒伐他汀影响。
[0118]
测试例2:依泽替米贝的药代动力学评价
[0119]
对于实施例1、比较例1和比较例3的组合物,在比格犬中评价依泽替米贝的药代动力学参数。将十八只比格犬(雄性,20个月龄,12
±
2kg)随机分配为三组,并且针对六只比格犬/组进行三元交叉研究。对于前一天预禁食14小时的各组比格犬,分别经口施用实施例1、比较例1和比较例3,并随后强制施用40ml水。通过在经口施用之前(0小时)和在经口施用之后0.25、0.5、1、1.5、2、3、4、5、6、7、8、10和24小时,从头静脉采集2ml血液置于包含抗凝血剂(1,000iu/ml,肝素5μl)的管中进行血液收集。将血液样品离心(12,000rpm,2分钟,eppendrof)以分离血浆并将其储存在
‑
20℃的冷冻箱中。
[0120]
对于分析,向100μl血浆添加15μl β
‑
葡萄糖醛酸酶(helix pomatia)并混合30秒。向其中添加100μl蒸馏水并混合30秒,并随后在50℃下反应1小时。在1小时酶反应之后,向血浆添加15μl内标溶液(ezetimibe
‑
d4,50ppb)并混合30秒。向其中添加1ml甲基叔丁基醚(methyl tert
‑
butyl ether,mtbe)并混合10分钟,并随后离心(15,000rpm,3分钟)。获取上清液并用45℃氮蒸发器进行蒸发。将残余物再溶解在1ml50%acn中,并随后使用液相色谱
‑
质谱(lc
‑
ms)进行分析。
[0121]
<分析条件>
[0122]
使用的装置:xevo tq
‑
s(waters)
[0123]
电离模式:[m
‑
h]+(负)
[0124]
柱:chs c18(2.1*150mm,1.8μm,waters)
[0125]
柱温:35℃
[0126]
流动相:acn/2mm乙酸铵=70/30(v/v)
[0127]
流量:0.18ml/分钟
[0128]
进样量:5μl
[0129]
结果示于下表3中并且图8示出了以线性标度对依泽替米贝的算术平均血浆浓度(ng/ml)相对于时间(小时)的记录。
[0130]
[表3]
[0131][0132]
如表3和图8中所示,确定了与根据比较例1的片剂相比,根据实施例1的片剂在auc和cmax的
±
10%内具有等同水平,但根据比较例3的片剂具有接近于下限标准的不等水平。
[0133]
结合测试例1和2的结果,依泽替米贝的溶出模式根据氯沙坦的溶出速率而发生变化,并因此确定了药代动力学参数的变化。因此,确定了在开发包含依泽替米贝和氯沙坦的药物组合制剂时,氯沙坦的溶出速率应控制在ph 4.5。
[0134]
应当理解,本发明的所有简单修改和变化均在本发明的范围内,并且本发明的待保护的具体范围将由所附权利要求书限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1