miRNA-6766-3p在制备预防和/或治疗肝纤维化药物中的应用
mirna
‑
6766
‑
3p在制备预防和/或治疗肝纤维化药物中的应用
技术领域
1.本发明属于基因工程与生命科学领域,具体涉及mirna
‑
6766
‑
3p在制备预防和/或治疗肝纤维化药物中的应用。
背景技术:
2.肝纤维化是指因各种致病因子作用下,产生以静息的肝星状细胞(hepatic stellate cells,hsc)发生活化增殖作为中心环节,表现为以胶原为主的细胞外基质过量产生和沉积,从而逐渐形成纤维组织,进一步继发为破坏正常肝组织为主要特征的病理改变。早期肝纤维化的过程是可逆的,是各种慢性肝病向肝硬化发展的必经途径。寻找与肝纤维化相关的基因,了解肝纤维化发生、发展的分子机制,进而为肝纤维化的诊断、治疗提供理论依据,是目前的研究热点。
3.微小rna(microrna,mirna)是一类长约21~22nt的内源性非编码调控rna,可作用于靶mrna导致其降解或抑制其翻译,对基因表达起重要的负性调控作用,参与体内如发育、细胞分化、细胞增殖、细胞死亡等众多重要的生物学进程。大量生物学数据表明,mirna可以调节人体约30%的基因,参与多种生物调节途径,参与了诸多人类疾病的发生发展过程,是疾病重要的候选诊断标志和潜在的治疗靶点。近年研究表明,mirna这一转录后水平调控分子在肝纤维化发生发展中也起着重要的作用。然而,这些研究结果均是来自基于芯片的实时定量pcr技术,获得数据的完整性和准确性均有待证实,高通量测序技术为高效敏感的检测mirna的表达谱提供了有效的策略。已发现若干mirna可调控参与肝纤维化形成的细胞因子或通过调控hsc的活化增殖、凋亡等,促进或减缓纤维化进程。有研究发现,mirna
‑
27通过抑制hsc的增殖,使hsc恢复至静息状态,从而抑制肝纤维化的发生。mir
‑
1273g
‑
3p也被认为是一个与肝纤维化密切相关的mirna分子,把mir
‑
1273g
‑
3p转让进hsc可以通过影响hsc的活化和凋亡来调节肝纤维化。此外,mir
‑
203在肝纤维化的组织及转化生长因子
‑
β(transforming growth factor
‑
β,tgf
‑
β)诱导的hsc
‑
t6细胞中表达均下调,并可作为调节器来调节hsc的增殖。上调mir
‑
9a
‑
5p可引起hsc的增殖、迁移和活化。上述研究均可说明mirna与肝纤维化的发生发展紧密相关,并提示mirna调控hsc的活化、增殖、凋亡和迁移是肝纤维化发生发展的机制之一。在ccl4诱导的肝纤维化模型中,下调mir
‑
125a
‑
5p、mir
‑
29a可抑制hsc的活化、增殖,其可能为肝纤维化治疗的新靶点。目前,尚无研究表明mirna
‑
6766
‑
3p可作为肝纤维化治疗的靶点。
技术实现要素:
4.本发明第一方面的目的,在于提供mirna
‑
6766
‑
3p及相关生物材料的新用途。
5.本发明第二方面的目的,在于提供一种药物。
6.为了实现上述目的,本发明所采取的技术方案是:
7.本发明的第一个方面,提供mirna
‑
6766
‑
3p及相关生物材料的新用途。
8.第一、本发明提供了如下(1)~(5)所示物质中任一种在制备预防和/或治疗肝纤
维化的药物中的应用。
9.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体;(3)mirna
‑
6766
‑
3p模拟物;(4)编码(1)中所述mirna
‑
6766
‑
3p或(2)中所述mirna
‑
6766
‑
3p的前体的dna分子;(5)含有(4)中所述dna分子的表达盒、重组载体或转基因细胞。
10.优选地,(1)、(2)、(3)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
11.第二,本发明提供了如下(1)~(5)所示物质中任一种在如下(a)~(d)至少一种中的应用。
12.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体;(3)mirna
‑
6766
‑
3p模拟物;(4)编码(1)中所述mirna
‑
6766
‑
3p或(2)中所述mirna
‑
6766
‑
3p的前体的dna分子;(5)含有(4)中所述dna分子的表达盒、重组载体或转基因细胞。
13.(a)制备用于抑制tgfβii型受体表达的产品;(b)制备用于抑制collagen i、α
‑
sma和ki67表达的产品;(c)制备用于抑制timp3和timp1表达的产品;(d)制备用于促进mmp2和mmp9表达的产品。
14.优选地,(1)、(2)、(3)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
15.优选地,(a)、(b)、(c)、(d)中所述表达为mrna表达和蛋白表达中的至少一种。
16.第三,本发明提供了如下(1)~(5)所示物质中任一种在如下(e)~(f)至少一种中的应用。
17.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体;(3)mirna
‑
6766
‑
3p模拟物;(4)编码(1)中所述mirna
‑
6766
‑
3p或(2)中所述mirna
‑
6766
‑
3p的前体的dna分子;(5)含有(4)中所述dna分子的表达盒、重组载体或转基因细胞。
18.(e)制备用于抑制星状细胞增殖的产品;(f)制备用于抑制星状细胞迁移的产品。
19.优选地,(1)、(2)、(3)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
20.优选地,(e)、(f)中所述星状细胞来源于肝脏。
21.第四,本发明提供了如下(1)~(5)所示物质中任一种在如下(h)~(j)至少一种中的应用。
22.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体;(3)mirna
‑
6766
‑
3p模拟物;(4)编码(1)中所述mirna
‑
6766
‑
3p或(2)中所述mirna
‑
6766
‑
3p的前体的dna分子;(5)含有(4)中所述dna分子的表达盒、重组载体或转基因细胞。
23.(h)制备用于抑制p38 mapk、smad4、smad3、erk1、smad2 mrna表达的产品;(i)制备用于抑制smad3、smad4、p38 mapk和erk蛋白表达的产品;(j)制备用于抑制smad2和smad3磷酸化的产品。
24.优选地,(1)、(2)、(3)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
25.第五,本发明提供了能够抑制(1)或(2)表达的物质在如下(a’)~(d’)至少一种中的应用。
26.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体。
27.(a’)制备用于促进tgfβii型受体表达的产品;(b’)制备用于促进collagen i、α
‑
sma和ki67表达的产品;(c’)制备用于促进timp3和timp1表达的产品;(d’)制备用于抑制mmp2和mmp9表达的产品。
28.优选地,(1)、(2)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
29.优选地,所述能抑制(1)表达的物质为mirna
‑
6766
‑
3p抑制剂。
30.优选地,所述mirna
‑
6766
‑
3p抑制剂为如seq id no.3所示的核酸分子。
31.优选地,(a’)、(b’)、(c’)、(d’)中所述表达为mrna表达和蛋白表达中的至少一种。
32.第六,本发明提供了能够抑制(1)或(2)表达的物质在如下(e’)~(f’)至少一种中的应用。
33.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体。
34.(e’)制备用于促进星状细胞增殖的产品;(f’)制备用于促进星状细胞迁移的产品。
35.优选地,(1)、(2)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
36.优选地,所述能抑制(1)表达的物质为mirna
‑
6766
‑
3p抑制剂。
37.优选地,所述mirna
‑
6766
‑
3p抑制剂为如seq id no.3所示的核酸分子。
38.优选地,(e’)、(f’)中所述星状细胞来源于肝脏。
39.第七,本发明提供了能够抑制(1)或(2)表达的物质在如下(h’)~(j’)至少一种中的应用。
40.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体。
41.(h’)制备用于促进p38 mapk、smad4、smad3、erk1、smad2 mrna表达的产品;(i’)制备用于促进smad3、smad4、p38 mapk和erk蛋白表达的产品;(j’)制备用于促进smad2和smad3磷酸化的产品。
42.优选地,(1)、(2)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
43.优选地,所述能抑制(1)表达的物质为mirna
‑
6766
‑
3p抑制剂。
44.优选地,所述mirna
‑
6766
‑
3p抑制剂为如seq id no.3所示的核酸分子。
45.本发明的第二个方面,提供一种药物,包含药学上可接受的载体及如下(1)~(5)所示物质中任一种;
46.(1)mirna
‑
6766
‑
3p;(2)mirna
‑
6766
‑
3p的前体;(3)mirna
‑
6766
‑
3p模拟物;(4)编码(1)中所述mirna
‑
6766
‑
3p或(2)中所述mirna
‑
6766
‑
3p的前体的dna分子;(5)含有(4)中所述dna分子的表达盒、重组载体或转基因细胞。
47.优选地,(1)、(2)、(3)中所述mirna
‑
6766
‑
3p的核酸序列如seq id no.1所示。
48.优选地,所述药学上可接受的载体包括脂质体、纳米颗粒。
49.优选地,所述药物的给药方式包括口服、静脉注射。
50.本发明的有益效果是:
51.本发明首次发现了mirna
‑
6766
‑
3p及相关生物材料可用于预防和/或治疗肝纤维化,通过抑制肝脏星状细胞的增殖、迁移以及纤维化指标,从而达到预防和/或治疗肝纤维化的效果,可作为预防和/或治疗肝纤维化的药物。
52.本发明提供了一种包含mirna
‑
6766
‑
3p或相关生物材料的药物,该药物与传统的治疗药物相比,具有易于合成,易于检测,定量精确,经化学修饰后能増加其稳定性并提高亲和力,可通过特殊药物递送系统有效定位到靶器官等优点,将大大提高肝纤维化疾病治疗的特异性和靶向性。
附图说明
53.图1是3
‑
d培养的人胚胎干细胞的外泌体(3d
‑
hesc
‑
exosomes)与2
‑
d培养的人胚胎干细胞的外泌体(2d
‑
hesc
‑
exosomes)相比,不同mirna表达结果图:其中,a是微阵列热图(倍数变化≥2,p<0.05);b是3d
‑
hesc
‑
exosomes与2d
‑
hesc
‑
exosomes差异表达显著的mirnas的散点图;c是3d
‑
hesc
‑
exosomes与2d
‑
hesc
‑
exosomes差异表达显著的mirnas的火山图。
54.图2是不同mirna在2d
‑
hesc
‑
exosomes和3d
‑
hesc
‑
exosomes中的表达量结果图:其中,a是hsa
‑
mir
‑
5194、hsa
‑
mir
‑
6511b
‑
5p、hsa
‑
mir
‑
500a
‑
5p、hsa
‑
mir
‑
6793
‑
5p、hsa
‑
mir
‑
4259在2d
‑
hesc
‑
exosomes和3d
‑
hesc
‑
exosomes中的相对表达量图;b是在hsa
‑
mir
‑
4690
‑
5p、hsa
‑
mir
‑
6734
‑
5p、hsa
‑
mir
‑
6785
‑
5p、hsa
‑
mir
‑
6766
‑
3p、hsa
‑
mir
‑
4728
‑
5p、hsa
‑
mir
‑
3652在2d
‑
hesc
‑
exosomes和3d
‑
hesc
‑
exosomes中的相对表达量图;c是2d
‑
hesc
‑
exosomes和3d
‑
hesc
‑
exosomes中的hsa
‑
mir
‑
5194、hsa
‑
mir
‑
6511b
‑
5p、hsa
‑
mir
‑
500a
‑
5p、hsa
‑
mir
‑
6793
‑
5p、hsa
‑
mir
‑
4259qpcr后的ct值图;d是2d
‑
hesc
‑
exosomes和3d
‑
hesc
‑
exosomes中的hsa
‑
mir
‑
4690
‑
5p、hsa
‑
mir
‑
6734
‑
5p、hsa
‑
mir
‑
6785
‑
5p、hsa
‑
mir
‑
6766
‑
3p、hsa
‑
mir
‑
4728
‑
5p、hsa
‑
mir
‑
3652qpcr后的ct值图:*表示p<0.05;**表示p<0.01;***表示p<0.001;ns表示p>0.05。
55.图3是mir
‑
6766
‑
3p mimic(mir
‑
6766
‑
3p模拟物)/mir
‑
6766
‑
3p mimic nc(mir
‑
6766
‑
3p模拟物阴性对照)分别与h
‑
tgfbr2
‑
3utr
‑
wt/h
‑
tgfbr2
‑
3utr
‑
mut双荧光载体共转染hek
‑
293t细胞的结果图:其中,a是mir
‑
6766
‑
3p分别与h
‑
tgfbr2
‑
3utr
‑
wt/h
‑
tgfbr2
‑
3utr
‑
mut的假定结合位点示意图;b是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc分别与h
‑
tgfbr2
‑
3utr
‑
wt/h
‑
tgfbr2
‑
3utr
‑
mut双荧光载体共转染hek
‑
293t细胞后的荧光素酶报告活性图:***表示p<0.001;ns表示p>0.05。
56.图4是mir
‑
6766
‑
3p mimic和mir
‑
6766
‑
3p inhibitor对lx2细胞的tgfβr ii表达影响的结果图:其中,a是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc与lx2细胞转染后mir
‑
6766
‑
3p的相对表达量图;b是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的tgfβr ii mrna的相对表达量的影响图;c是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对tgfβrii mrna表达的影响图;d是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的tgfβr ii蛋白表达影响的细胞免疫荧光染色结果图;e是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对tgfβr ii蛋白表达影响的统计结果图;f是mir
‑
6766
‑
3pinhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的tgfβr ii蛋白表达影响的细胞免疫荧光染色结果图;g是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对tgfβr ii蛋白表达影响的统计结果图:*表示p<0.05;**表示p<0.01;***表示p<0.001;****表示p<0.0001;ns表示p>0.05。
57.图5mir
‑
6766
‑
3p mimic和mir
‑
6766
‑
3p inhibitor对lx2细胞的collagne i,α
‑
sma和ki67蛋白表达影响的结果图:其中,a是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的collagne i,α
‑
sma和ki67蛋白表达影响的细胞免疫荧光染色结果图;b是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的collagne i蛋白表达影响的统计结果图;c是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的α
‑
sma蛋白表达影响的统计结果图;d是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的ki67蛋白表达影响
的统计结果图;e是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的collagne i,α
‑
sma和ki67蛋白表达影响的细胞免疫荧光染色结果图;f是mir
‑
6766
‑
3pinhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的collagne i蛋白表达影响的统计结果图;g是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的α
‑
sma蛋白表达影响的统计结果图;h是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的ki67蛋白表达影响的统计结果图:*表示p<0.05;**表示p<0.01;***表示p<0.001;ns表示p>0.05。
58.图6是mir
‑
6766
‑
3p mimic和mir
‑
6766
‑
3p inhibitor对lx2细胞的collagne i,α
‑
sma、timp3、timp1、mmp2、mmp9 mrna表达的影响结果图:其中,a是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的collagne i,α
‑
sma、timp3、timp1、mmp2、mmp9 mrna表达的影响图;b是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的collagne i,α
‑
sma、timp3、timp1、mmp2、mmp9 mrna表达的影响图:*表示p<0.05;**表示p<0.01;ns表示p>0.05。
59.图7是mir
‑
6766
‑
3p mimic和mir
‑
6766
‑
3p inhibitor对lx2细胞增殖和迁移的影响:其中,a是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对lx2细胞的生长速度的影响图;b是mir
‑
6766
‑
3pinhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的生长速度的影响图;c是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3pmimic nc对lx2细胞的创面恢复的迁移指数图;d是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对lx2细胞的创面恢复的迁移指数图:*表示p<0.05;ns表示p>0.05。
60.图8是mir
‑
6766
‑
3p mimic对tgfβrii纤维化通路相关蛋白(tgfβrii、smad2、p
‑
smad2、smad3、p
‑
smad3、smad4、p38 mapk和erk)表达的影响结果图:其中,a是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3pmimic nc对tgfβrii纤维化通路相关蛋白(tgfβrii、smad2、p
‑
smad2、smad3、p
‑
smad3、smad4、p38 mapk和erk)表达影响的免疫印迹结果图;b是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对smads通路相关蛋白(p
‑
smad2、p
‑
smad3、smad4)表达影响的细胞免疫荧光染色结果图;c是mir
‑
6766
‑
3pmimic/mir
‑
6766
‑
3p mimic nc对smads通路相关蛋白(p
‑
smad2、p
‑
smad3、smad4)表达影响的统计结果图;d是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对非smads通路相关蛋白(p38 mapk和erk1)表达影响的细胞免疫荧光染色结果图;e是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对非smads通路相关蛋白(p38 mapk和erk1)表达影响的统计结果图:*表示p<0.05;**表示p<0.01;***表示p<0.001;ns表示p>0.05。
61.图9是mir
‑
6766
‑
3p inhibitor对tgfβrii纤维化通路相关蛋白(tgfβrii、smad2、p
‑
smad2、smad3、p
‑
smad3、smad4、p38 mapk和erk)表达的影响结果图:其中,a是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3pinhibitor nc对tgfβrii纤维化通路相关蛋白(tgfβrii、smad2、p
‑
smad2、smad3、p
‑
smad3、smad4、p38 mapk和erk)表达影响的免疫印迹结果图;b是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对smads通路相关蛋白(p
‑
smad2、p
‑
smad3、smad4)表达影响的细胞免疫荧光染色结果图;c是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对smads通路相关蛋白(p
‑
smad2、p
‑
smad3、smad4)表达影响的统计结果图;d是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对非smads通路相关蛋白(p38mapk和erk1)表达影响的细胞免疫荧光染色结果图;e是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对非smads通路相关蛋白(p38 mapk和erk1)表达影响的统计结果图:*表示p<0.05。
62.图10是mir
‑
6766
‑
3p mimic和mir
‑
6766
‑
3p inhibitor对p38 mapk、smad4、smad3、erk1、smad2mrna表达的影响结果图:a是mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc对p38 mapk、smad4、smad3、erk1、smad2 mrna表达的影响结果图;b是mir
‑
6766
‑
3p inhibitor/mir
‑
6766
‑
3p inhibitor nc对p38 mapk、smad4、smad3、erk1、smad2 mrna表达的影响结果图:*表示p<0.05;**表示p<0.01;***表示p<0.001;ns表示p>0.05。
具体实施方式
63.以下通过具体的实施例对本发明的内容作进一步详细的说明。
64.应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
65.下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
66.本实施例中所使用的试剂均为分析纯级试剂,且可从正规渠道商购获得。
67.本实施例中细胞实验转染用的转染试剂及mir
‑
6766
‑
3p mimic nc(购于广州锐博生物,由锐博生物提供并负责解释),mir
‑
6766
‑
3p mimic(5
’‑
ugauugucuucccccacccuca
‑3’
,seq id no.2),mir
‑
6766
‑
3p inhibitor nc(购于广州锐博生物,由锐博生物提供并负责解释),mir
‑
6766
‑
3p inhibitor(3
’‑
acuaacagaagggggugggagu
‑5’
,seq id no.3)。
68.实施例1 2d培养的人胚胎干细胞的外泌体(2d
‑
hesc
‑
exosomes)和3d培养的人胚胎干细胞的外泌体(3d
‑
hesc
‑
exosomes)mirnas含量的芯片测序
69.1.2d培养人胚胎干细胞:预铺matrigel制备人胚胎干细胞专用培养板:在六孔板中以2ml/孔的体积预铺稀释好的matrigel(dmem/f12:matrigel=100:1),将孔板放回co2培养箱中孵育24小时以上;消化传代:选取状态良好的人胚胎干细胞(状态良好:在hesc传代后4~5天时,细胞覆盖率达70%~80%,克隆边缘规整且无分化细胞的人胚胎干细胞(hesc),吸弃培养基后加入1ml无钙镁pbs清洗细胞,吸弃后加入1ml relesr
tm
(stemcell),并在1分钟内吸出,再将细胞放回co2培养箱中孵育2分钟,之后每孔加入1ml mtesr1培养基,轻轻拍打培养板,尽量将消化好的细胞从板底脱落下来,再用1ml的一次性移液管轻轻地将细胞吸打成小的细胞团(约十几个hescs)。接种:取出预铺好matrigel的孔板,吸弃matrigel稀释液,加入3ml mtesr1并加入10μm的y
‑
27632(rocki)以提高细胞接种的存活率,吸取细胞团悬液并在包被好并加入2.5ml无血清mtesr
tm
1培养基的孔内1:6的比例)进行培养,十字交叉摇晃孔板以使细胞均匀悬浮在培养液中,每天换液。上清收获:从第三天开始,收取细胞上清,存放于
‑
80℃,用于外泌体的分离。
70.2.3d培养人胚胎干细胞:预铺pluronic
‑
f68制备低粘附孔:采用dmem/f12培养基稀释pluronic
‑
f68,获得稀释的pluronic
‑
f68(dmem/f12:pluronic
‑
f68=1:1(体积比));将稀释的pluronic
‑
f68铺在孔板中,将孔板置于co2培养箱中孵育。消化传代:选取覆盖率达70%~80%,克隆边缘规整且无分化细胞的培养孔,吸弃培养基后加入1ml无钙镁pbs清洗细胞,吸弃后加入1ml gcdr(细胞解离试剂),放回co2培养箱中孵育5分钟,之后吸弃孔中的gcdr,加入1ml mtesr1培养基,将细胞吹打下来并用移液器吹成单细胞悬液。接种:吸取
10μl单细胞悬液,台盼蓝染色后使用血球计数板进行计数;取出预铺好pluronic
‑
f68的孔板,吸弃pluronic
‑
f68稀释液,加入2ml mtesr1并加入10μm的y
‑
27632(rocki)以提高细胞接种的存活率,吸取含50万单细胞的细胞悬液接种到孔中,十字交叉摇晃孔板以使细胞均匀悬浮在培养液中;换液:在48h后每孔每天半量换液,在随后的培养过程中,rocki不再加入培养基中;上清收获:培养到第3天开始,收集每次换液的废旧培养基,0.22μm无菌膜过滤后,装入到50ml无菌离心管中,进行后续外泌体的分离纯化。
71.3.外泌体的提取方法:收集过滤的2d培养的人胚胎干细胞和3d培养的人胚胎干细胞条件培养基4℃,1000g离心10min,收集上清;收集的上清液4℃,2000g离心20min,收集上清;收集的上清液4℃,10000g离心30min,收集上清;收集的上清液,110000g离心70min,弃上清,使用磷酸盐缓冲液重悬沉淀;再次110000g离心70min,弃上清,少量磷酸盐缓冲液重悬沉淀,0.22μm滤膜过滤除菌,得到2d和3d培养人胚胎干细胞来源外泌体。
72.4.分别取2d
‑
hesc
‑
exosomes、3d
‑
hesc
‑
exosomes提取外泌体中的mirna上机测序。具体步骤如下:样品rna抽提;rna质量检测;制备荧光标记探针,mirna 3’端进行cy荧光标记,采用sureprint原位喷墨合成技术合成60
‑
mer用于与芯片杂交的荧光探针;芯片杂交,取一定量的质检达标样本,与mirna芯片进行杂交;图像采集和数据分析。结果如图1所示:与2d
‑
hescs
‑
exosomes相比,3d
‑
hescs
‑
exosomes中有39个mirna上调,29个mirna下调(>1.5倍),而963个mirna的表达没有变化。
73.实施例2 qrt
‑
pcr验证mirna的表达
74.根据说明书,使用rnaiso plus(takara,9109)从2d
‑
hesc
‑
exosomes和3d
‑
hesc
‑
exosomes mirnas中提取总rna。
75.通过rna逆转录反应得到cdna,逆转录反应体系总体积10μl,包括2μl 5
×
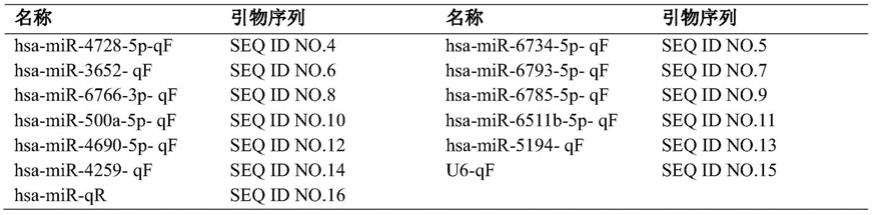
primescript buffer(for real time)、0.5μl primescript rt enzyme mix i、0.5μl specific primer(2μm)、1μl总rna(500ng/μl)及6μl rnase free dh2o。反应步骤为42℃反应15min,85℃反应5sec,4℃存放;反应结束后加入20μl rnase free dh2o,补足终体积至30μl。使用仪器为veriti 96。逆转录引物由上海生工生物工程股份有限公司设计和合成(具体序列如表1所示)。
76.表1实施例2中逆转录引物序列
[0077][0078]
qrt
‑
pcr反应:反应体系总体积5μl,包括:2.5μl premix ex taq ii(tli rnaseh plus),0.1μl 50
×
rox reference dye,0.1μl pcr forward primer(10μm)、0.1μl pcr reverse primer(10μm)、1.2μl rnase free dh2o及1μl逆转录得到的cdna。使用abi prism 7900荧光定量pcr仪,pcr反应条件是:95℃、30sec进行一个循环;95℃、0.05sec,60℃、1min进行40个循环。扩增反应正向引物和反向引物均由上海生工生物工程股份有限公司设计和合成(具体序列如表2所示)。将u6丰度标准化后,通过2
‑
δδct
方法计算基因表达的相对水平。
以u6为内对照,比较各组mirna的相对变化。结果如图2所示:根据venny工具的分析,选择前11个表达量相对较高的mirnas,并通过qrt
‑
pcr进行验证;在这些mirnas中,mir
‑
6766
‑
3p(序列为:ugauugucuucccccacccuca,seq id no.1)的表达明显上调,在3d
‑
hescs
‑
exosomes中相对丰度最高,与图1所示前期mirnas芯片结果一致。
[0079]
表2实施例2中qrt
‑
pcr引物序列
[0080][0081]
实施例3双荧光素酶实验验证mir
‑
6766
‑
3p靶向结合tgfβii型受体(tgfβr ii)
[0082]
为了阐明mir
‑
6766
‑
3p在肝纤维化中的作用,发明人首先使用targetscan进行了生物信息分析,结果表明作为tgfβ的受体,tgfβii参与了纤维化的形成。采用双荧光素酶报告基因检测,进一步研究mir
‑
6766
‑
3p是否直接靶向tgfβrii。即通过构建h
‑
tgfbr2
‑
3utr
‑
wt和h
‑
tgfbr2
‑
3utr
‑
mut双荧光载体(购于汉恒生物科技(上海)有限公司),分别与5pmol hsa
‑
mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc充分混匀后共转染到hek
‑
293t细胞中,收集细胞后加入luciferase assay reagent ii(荧光素酶检测试剂ii),测定记录firefly luciferase值,此值为内参值;加入100μl stop&reagent,测定记录renilla luciferase值,此值即为报告基因发光值。结果如图3所示:异位过表达mir
‑
6766
‑
3p显著抑制野生型tgfβrii 5’utr荧光素酶活性,但不影响突变型荧光素酶活性。上述数据表明mir
‑
6766
‑
3p可通过直接与tgfβrii的5'utr序列结合而负调控tgfβr ii的表达,从而发挥抗纤维化作用。
[0083]
实施例4上调人源肝脏星状细胞中mir
‑
6766
‑
3p水平的实验
[0084]
(1)细胞分组
[0085]
在lx2细胞的对数增殖期,用胰蛋白酶消化并传代。以1.25
×
105个细胞/孔(融合度为30%)种植于6孔板中,将聚赖氨酸处理过的0.5cm微载玻片置于孔中。当细胞贴壁(大于6h),根据要求实验分组设对照组(不做任何处理正常lx2细胞);处理组(tgfβ处理lx2细胞48小时);mir
‑
6766
‑
3p mimic nc+处理组(细胞转染25nm阴性对照mir
‑
6766
‑
3p mimic nc后经tgfβ处理lx2细胞48小时);mir
‑
6766
‑
3p mimic+处理组(细胞转染25nm mir
‑
6766
‑
3p mimic后经tgfβ处理lx2细胞48小时)共四组。
[0086]
(2)细胞转染
[0087]
待细胞生长密度达40%时进行转染处理,提前将5nm干粉状mir
‑
6766
‑
3p mimic/mir
‑
6766
‑
3p mimic nc用消毒后的250μl depc水溶解,存储终浓度为20μm,分装保存;接种2
×
105个lx2细胞至含有适量完全培养基的24孔板培养孔中,使转染时的细胞密度能够达到30~50%;用30μl 1x ribofect
tm
cp buffer稀释1.25μl 20μm mirna mimic,轻轻混匀;加入3μl ribofect
tm
cp reagent,轻轻吹打混匀,室温孵育15min,得到ribofect
tm
cp混合液;将ribofect
tm
cp混合液加入到无双抗完全培养基中,轻轻混匀;之后对相应的各组lx2细胞添加终浓度为10ng/ml的tgfβ进行诱导激活处理;将培养板置于37℃的co2培养箱中培养
48h后收取各组细胞进行检测。
[0088]
(3)细胞rna的提取及qpcr实验
[0089]
用胰酶消化各组细胞,至细胞可以被轻轻用移液管或枪头吹打下来时,吹打下所有的贴壁细胞,并轻轻吹散细胞;再次收集到离心管内;1000g左右离心5分钟,沉淀细胞;向各组细胞沉淀加入适量的rnaiso plus(750μl)后,室温静置5分钟,然后再12000g的转速下于4℃离心5分钟;小心吸取上清液,移入新的离心管中(切勿吸取沉淀);向裂解液中加入氯仿(rnaiso plus的1/5体积量),盖紧离心管盖,混合至溶液乳化呈乳白色,室温静置5分钟;12000g 4℃离心15分钟,从离心机中小心取出离心管,小心吸取最上层的上清液转移至另一新的离心管中;向上清中加入0.5倍rnaiso plus体积的异丙醇,上下颠倒离心管充分混合均匀后在室温下静置10分钟;12000g 4℃离心10分钟,取试管底部的rna沉淀小心清洗去上清,加入等量的75%乙醇,轻轻上下颠倒洗涤离心管壁,7500g 4℃离心5分钟后小心弃去上清;打开离心管盖,室温干燥沉淀几分钟。然后加入适量的rnase
‑
free水溶解沉淀;用nanodrop测定rna浓度,od260/od280比值在1.7
‑
2.1为佳。将rna逆转录成cdna,rna逆转录反应体系如下:primescript rt enzyme mix i 2微升;rna 500纳克;rnase free dh2o to 10微升;反应程序如下:37℃15分钟;85℃5秒;最后4℃。所得到的cdna可冻存于
‑
80℃超低温冰箱或直接进入实时定量pcr实验。
[0090]
所得的cdna使用无酶水稀释10倍,接下来进行rt
‑
qpcr检测:核苷酸序列设计引物由上海生工技术服务有限公司合成,具体如表3所示,rt
‑
qpcr反应体系如下:green pcr master mix 10μl,forward primer 0.5μl,reverse primer 0.5μl,cdna 5μl,rnase free ddh2o 4μl,反应程序如下:预变性95℃,5min;95℃15sec,60℃15sec,72℃32sec,循环40次;溶解曲线:60℃
‑
95℃。以gapdh作为内参,目的基因相对内参的表达水平分析选择2
‑△△
ct
方法进行计算。
[0091]
表3实施例4中rt
‑
qpcr反应体系引物
[0092][0093]
最后进行qpcr数据分析:所有检测均采用三个生物样本重复,每个生物样本进行三次重复检测,利用内参基因,以2
‑△△
ct
进行数据处理,graphpad作图,mir
‑
6766
‑
3p mimic对tgfβrii基因表达影响的结果如图4所示:图4中a可见,mir
‑
6766
‑
3p mimic+处理组转染mir
‑
6766
‑
3p mimic成功;图4中b表明:感染mir
‑
6766
‑
3p mimic后,tgfβrii mrna表达显著降低。上述数据与实施例3数据表明mir
‑
6766
‑
3p可通过直接与tgfβrii的5'utr序列结合而负调控tgfβrii的表达,从而发挥抗纤维化作用。
[0094]
mir
‑
6676
‑
3p对星状细胞活化相关指标α
‑
sma、i型胶原,抗纤维降解相关指标timp3和timp1,纤维降解相关指标mmp2、mmp9 mrna表达的影响结果如图6中a所示:mir
‑
6676
‑
3p对α
‑
sma、i型胶原、timp3和timp1的mrna表达具有负调控作用,对mmp2和mmp9的
mrna表达具有正调控作用,表明上调lx2细胞中mir
‑
6676
‑
3p在抗纤维化方面具有显著的促进作用。
[0095]
(4)细胞免疫荧光染色
[0096]
将四组lx2细胞收集后用pbs浸洗3次,每次3分钟;用4%的多聚甲醛固定爬片15分钟,pbs浸洗玻片3次,每次3分钟;0.5%triton x
‑
100(pbs配制)室温通透20分钟;pbs浸洗玻片3次,每次3分钟,在玻片上滴加正常山羊血清,室温封闭30分钟;吸水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的抗tgfβrii+抗α
‑
tubulin、抗ki67、抗collagen i和抗α
‑
sma一抗并放入湿盒,4℃孵育过夜;pbst浸洗爬片3次,每次3分钟,吸干液体后滴加稀释好的alexa fluor 488山羊抗兔igg/alexa fluor 488山羊抗鼠igg(cst)荧光二抗,37℃孵育1小时,pbst浸洗3次,每次3分钟;复染核:滴加dapi避光孵育5分钟,对标本进行染核,pbst洗4次,洗去多余的dapi;吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在激光共聚焦显微镜下观察采集图像。结果如图4中d所示:免疫荧光分析显示,tgfβrii的蛋白表达水平因mir
‑
6676
‑
3p过表达而降低。结果如图5中a所示:免疫荧光分析显示,促纤维化标记物a
‑
sma和i型胶原的蛋白水平因mir
‑
6676
‑
3p过表达而降低。上述结果表明tgfβrii的表达和tgfβrii的下游促纤维化标记物是由mir
‑
6676
‑
3p介导的。
[0097]
(5)cck8测定细胞增殖
[0098]
消化各组细胞制备细胞悬液:细胞计数,接种到96孔板中(约2
×
104/孔),37℃培养箱中培养至贴壁大约4小时。加入10μlcck8,或者直接配置含10%cck8的培养基(现用现配),以换液的形式加入,分别培养1小时、2小时、4小时和6小时。将96孔板取出,放入酶标仪检测,波长设为450nm。结果如图7中a所示:mir
‑
6766
‑
3p过表达显著降低tgfβ处理的lx2细胞的生长速率。
[0099]
(6)伤口愈合实验
[0100]
为判断比较各组细胞的迁移与修复能力,我们进行了细胞划痕实验。具体的操作步骤如下:先用marker笔在6孔板背后,用直尺比着,均匀的划横线,大约每隔0.5~1厘米一道,横穿过孔。每孔穿过5条线。在孔中加入约5
×
105个细胞,培养细胞至汇合度达到90%以上。用头比着直尺,垂直于背后的横线划痕。pbs洗细胞3次,去除划下的细胞,加入无血清dmem高糖培养基。放入37℃5%co2培养箱培养。按0h和48h时间点取样,100倍镜下拍照。迁移指数的计算方法指的是相比于0h时,在24h时细胞向划痕区域迁移的每平方厘米的细胞数量。结果如图7中c所示:伤口愈合试验结果表明,mir
‑
6766
‑
3p mimic显著抑制了lx2细胞的迁移,在一定程度上降低了lx2细胞的活化水平。
[0101]
实施例5下调人源肝脏星状细胞中mir
‑
6766
‑
3p水平的实验
[0102]
(1)细胞分组
[0103]
在lx2细胞的对数增殖期,用胰蛋白酶消化并传代。以1.25
×
105个细胞/孔(融合度为30%)种植于6孔板中,将聚赖氨酸处理过的0.5厘米微载玻片置于孔中。当细胞贴壁(大于6h),根据要求实验分组设对照组(不做任何处理正常lx2细胞);处理组(tgfβ处理细胞48h);mir
‑
6766
‑
3p inhibitor nc+处理组(细胞转染25nm阴性对照mir
‑
6766
‑
3p inhibitor nc后经tgfβ处理lx2细胞48小时);mir
‑
6766
‑
3p inhibitor+处理组(细胞转染25nm mir
‑
6766
‑
3p inhibitor后经tgfβ处理lx2细胞48小时)共四组。
[0104]
(2)细胞转染
[0105]
待细胞生长密度达40%时进行转染处理,提前将5nm干粉状mir
‑
6766
‑
3p inhibitor试剂/mir
‑
6766
‑
3pinhibitor抑制剂阴性对照nc用消毒后的250μl depc水溶解,存储终浓度为20μm,分装保存。转染过程与实施例4中(2)相同。
[0106]
(3)相关指标的检测
[0107]
细胞rna的提取及qpcr实验、细胞免疫荧光染色、cck8测定细胞增殖、伤口愈合实验的具体实验步骤与实施例4中(3)~(6)相同。
[0108]
mir
‑
6766
‑
3p inhibitor对tgfβrii影响的结果如图4中c,f和g所示:mir
‑
6676
‑
3p inhibitor促进tgfβrii蛋白/基因表达。
[0109]
mir
‑
6766
‑
3p inhibitor对星状细胞活化相关指标α
‑
sma、i型胶原蛋白表达的影响结果如图5中e所示:mir
‑
6766
‑
3p inhibitor促进了星状细胞活化相关指标α
‑
sma、i型胶原蛋白的表达。
[0110]
mir
‑
6766
‑
3p inhibitor对α
‑
sma、i型胶原,抗纤维降解相关指标timp3和timp1,纤维降解相关指标mmp2、mmp9 mrna表达的影响结果如图6中b所示:mir
‑
6766
‑
3p inhibitor促进α
‑
sma、i型胶原、timp3和timp1,抑制mmp2和mmp9的mrna表达。
[0111]
上述结果表明:上调lx2细胞中mir
‑
6676
‑
3p在抗纤维化方面具有显著的促进作用,tgfβrii和tgfβ的下游促纤维化标记物的表达是由mir
‑
6676
‑
3p介导的。
[0112]
mir
‑
6766
‑
3p inhibitor对tgfβ处理的lx2细胞的增殖和迁移的影响如图7所示:图7中b表明:敲低mir
‑
6766
‑
3p表达的lx2细胞增殖速度显著上调;图7中d表明:mir
‑
6766
‑
3p inhibitor对lx2细胞的伤口恢复的影响,即mir
‑
6766
‑
3p inhibitor抑制剂促进了lx2细胞的迁移。
[0113]
上述结果表明:mir
‑
6766
‑
3p不仅调控lx2细胞促纤维化标志物的表达,而且调控细胞增殖、迁移等次生反应,最终调控肝纤维化的进展。
[0114]
实施例6 mir
‑
6766
‑
3p通过tgfβrii/smads途径抑制lx2细胞活化
[0115]
为进一步阐明mir
‑
6766
‑
3p/tgfβrii轴调控肝纤维化的机制,将mir
‑
6766
‑
3p mimic模拟物、mir
‑
6766
‑
3p inhibitor抑制剂及其阴性对照分别转染lx2细胞,检测tgfβrii的表达水平。smads作为tgfβ1的重要下游信号转导分子,已被证实能破坏ecm合成和降解的平衡,导致纤维化。因此,我们进一步评估mir
‑
6766
‑
3p对smads的活化和磷酸化的影响。
[0116]
(1)细胞分组
[0117]
在lx2细胞的对数增殖期,用胰蛋白酶消化并传代。以1.25
×
105个细胞/孔(融合度为30%)种植于6孔板中,将聚赖氨酸处理过的0.5cm微载玻片置于孔中。当细胞贴壁(大于6h),根据要求实验分组设对照组(不做任何处理正常lx2细胞);处理组(tgfβ处理细胞48h);mir
‑
6766
‑
3p mimic nc+处理组(细胞转染50nm阴性对照mir
‑
6766
‑
3p mimic nc后经tgfβ处理lx2细胞48小时);mir
‑
6766
‑
3p mimic+处理组(细胞转染50nm mir
‑
6766
‑
3p mimic后经tgfβ处理lx2细胞48小时);mir
‑
6766
‑
3p inhibitor nc+处理组(细胞转染100nm阴性对照mir
‑
6766
‑
3p inhibitor nc后经tgfβ处理lx2细胞48小时);mir
‑
6766
‑
3pinhibitor+处理组(细胞转染100nm mir
‑
6766
‑
3p inhibitor后经tgfβ处理lx2细胞48小时)共六组。
[0118]
(2)细胞转染
[0119]
细胞转染过程与实施例4、5中(2)相同。
[0120]
(3)细胞rna的提取及qpcr实验
[0121]
细胞rna的提取及qpcr实验的过程与实施例4中(3)~(4)相同,区别仅在与引物不同,核苷酸序列设计引物,由上海生工技术服务有限公司合成,具体如表4所示。
[0122]
mir
‑
6766
‑
3p mimic对p38 mapk、smad4、smad3、erk1、smad2 mrna表达的影响结果如图10中a所示:mir
‑
6766
‑
3p过表达后p38 mapk、smad4、smad3、erk1、smad2 mrna表达显著下调。
[0123]
mir
‑
6766
‑
3p inhibitor对p38 mapk、smad4、smad3、erk1、smad2 mrna表达的影响结果如图10中b所示:mir
‑
6766
‑
3p inhibitor使p38 mapk、smad4、smad3、erk1、smad2 mrna表达均显著上调。
[0124]
mir
‑
6766
‑
3p mimic对smads通路相关蛋白(p
‑
smad2、p
‑
smad3、smad4)表达的影响结果如图8中b、c所示:mir
‑
6766
‑
3p过表达后smads通路相关蛋白表达显著下调。
[0125]
mir
‑
6766
‑
3p mimic对非smads通路相关蛋白(p38 mapk和erk1)表达的影响结果如图8中d、e所示:mir
‑
6766
‑
3p过表达后非smads通路相关蛋白表达显著下调。
[0126]
mir
‑
6766
‑
3p inhibitor对smads通路相关蛋白(p
‑
smad2、p
‑
smad3、smad4)表达的影响结果如图9中b、c所示:mir
‑
6766
‑
3p inhibitor使smads通路相关蛋白表达显著上调。
[0127]
mir
‑
6766
‑
3p inhibitor对非smads通路相关蛋白(p38 mapk和erk1)的影响结果如图9中d、e所示:mir
‑
6766
‑
3p inhibitor使非smads通路相关蛋白表达显著上调。
[0128]
表4实施例6中rt
‑
qpcr反应体系引物(内参gapdh引物同seq id no.44和seq id no.45)
[0129][0130]
(4)细胞总蛋白的提取及western blot实验
[0131]
配制细胞裂解液(1ml ripa裂解液,临用前加入10μlpmsf,使终浓度为1mmol),六孔板每孔弃培养液后用1ml pbs清洗1次,每孔加入上述配好的裂解液80μl,4℃摇床裂解30分钟。4℃,12,000rpm,离心15min,取上清,使用bca法测定总蛋白浓度,采用western blot实验检测细胞tgfβrii下游smads通路蛋白及非smads通路蛋白的相关表达。
[0132]
mir
‑
6766
‑
3p mimic对tgfβrii纤维化通路相关蛋白(tgfβrii、smad2、p
‑
smad2、smad3、p
‑
smad3、smad4、p38 mapk和erk)的影响结果如图8中a所示:mir
‑
6766
‑
3p过表达后tgfβrii纤维化通路相关蛋白表达显著下调。
[0133]
mir
‑
6766
‑
3p inhibitor对tgfβrii纤维化通路相关蛋白(tgfβrii、smad2、p
‑
smad2、smad3、p
‑
smad3、smad4、p38 mapk和erk)的影响结果如图9中a所示:mir
‑
6766
‑
3p inhibitor使tgfβrii纤维化通路相关蛋白表达显著上调。
[0134]
因此,上调人肝脏星状细胞中mir
‑
6766
‑
3p的表达水平对肝纤维化相关指标的表达均具有明显的抑制作用。因此,将其应用于肝纤维化药物的研发,具有较好的应用前景。
[0135]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1