用于冷冻保存免疫细胞的组合物和方法与流程
用于冷冻保存免疫细胞的组合物和方法
1.相关申请的交叉引用
2.本技术要求2019年4月8日提交的美国临时专利申请第62/830,950号的优先权的权益,其全部内容通过引用并入本文。
技术领域
3.本技术涉及通过在冷冻前用ptd
‑
myc融合蛋白(例如,hiv tat
‑
myc融合多肽)预处理细胞来冷冻保存免疫细胞,如外周血单核细胞(pbmc)的组合物和方法。本文还提供了用于实施所述方法的试剂盒。
背景技术:
4.冷冻保存是一种通过将细胞冷却至低的温度而对细胞进行保存的过程。在这些低的温度下,生物活性(包括在正常条件下会导致细胞死亡的生化反应)被有效地阻止。然而,如果控制不当,冷冻保存可以导致细胞损伤和细胞存活率的下降。此外,在冷冻
‑
解冻过程之后,通常需要培养细胞以确保适当的恢复。目前,对于在冷冻保存的细胞已经被解冻后增加细胞存活率和恢复的冷冻保存方法存在未满足的需求。
技术实现要素:
5.在一个方面中,本公开提供了一种冷冻组合物,其包括:(a)myc融合多肽,所述myc融合多肽包含(i)蛋白质转导结构域,(ii)myc多肽序列;和(b)从供体受试者分离的一或多种外周血单核细胞(pbmc),其中与从受试者分离的对照pbmc细胞相比,所述组合物表现出增加的细胞存活率。在一些实施例中,蛋白质转导结构域序列是tat蛋白质转导结构域序列。在一些实施例中,蛋白质转导结构域是tat
[48
‑
57]
。在一些实施例中,蛋白质转导结构域是tat
[57
‑
48]
。在一些实施例中,myc融合多肽包含seq id no:1。在一些实施例中,所述一或多种外周血单核细胞包含t细胞、b细胞、nk细胞、单核细胞、粒细胞、巨噬细胞或其任意组合。在一些实施例中,组合物进一步包括细胞悬浮液培养基。在一些实施例中,细胞悬浮液培养基包含chb培养基、cs5培养基或cs10培养基。在一些实施例中,在冷冻
‑
解冻循环后与不存在myc融合多肽的对照pbmc相比,所述组合物在解冻时表现出增加的细胞恢复。在一些实施例中,在冷冻
‑
解冻循环后与不存在myc融合多肽的对照pbmc相比,所述组合物在细胞活化后表现出增加的cd25表达。在一些实施例中,本公开提供了一种包含冷冻组合物的免疫细胞库。
[0006]
在一个方面中,本公开提供了一种冷冻保存外周血单核细胞(pbmc)的方法,所述方法包括(a)使包含从供体受试者分离的一或多种pbmc的组合物与有效量的myc融合多肽接触,所述myc融合多肽包含(i)蛋白质转导结构域;(ii)myc多肽序列;和(b)将pbmc冷却到足以冷冻所述组合物的温度。在一些实施例中,蛋白质转导结构域序列是tat蛋白质转导结构域序列。在一些实施例中,蛋白质转导结构域是tat
[48
‑
57]
。在一些实施例中,蛋白质转导结构域是tat
[57
‑
48]
。在一些实施例中,myc融合多肽包含seq id no:1。在一些实施例中,所
述一或多种外周血单核细胞包含t细胞、b细胞、nk细胞、单核细胞、粒细胞或其任意组合。在一些实施例中,所述方法进一步包括将pbmc悬浮在细胞悬浮液培养基中。在一些实施例中,细胞悬浮液培养基包含chb培养基、cs5培养基或cs10培养基。
[0007]
在一些实施例中,使包含一或多种pbmc的组合物与浓度为约0.5μg/ml至约500μg/ml的myc融合多肽接触。在一些实施例中,使包含一或多种pbmc的组合物与浓度为约0.5μg/ml至约10μg/ml的myc融合多肽接触。在一些实施例中,在步骤(b)之前,使包含一或多种pbmc的组合物与myc融合多肽接触少于24小时。在一些实施例中,在步骤(b)之前,使包含一或多种pbmc的组合物与myc融合多肽接触约1小时。在一些实施例中,在步骤(a)之后且在步骤(b)之前,洗涤pbmc。
[0008]
在一些实施例中,使用受控速率低温冷冻机冷却pbmc。在一些实施例中,以约
‑
1℃/分钟的速率冷却pbmc。在一些实施例中,足以冷冻组合物的温度为约
‑
80℃至约
‑
190℃。
[0009]
在一些实施例中,所述方法进一步包括解冻所述冷冻保存的细胞,使得与不与有效量的myc融合多肽接触的对照pbmc相比,所述细胞表现出增加的细胞存活率、增加的细胞恢复、细胞活化或在细胞活化后增加的cd25表达中的一或多种。
[0010]
本文还提供了使用已使用myc融合多肽冷冻保存的细胞的方法。
[0011]
本文还提供了试剂盒,所述试剂盒包含本文所述任何实施例的本技术的myc融合多肽、myc融合多肽修饰的免疫细胞和/或冷冻组合物和使用说明书。
[0012]
在一个方面中,本公开提供了一种免疫细胞库,其包含:(a)myc融合多肽,所述myc融合多肽包含(i)蛋白质转导结构域;(ii)myc多肽序列;和(b)从供体受试者分离的一或多种外周血单核细胞(pbmc)。
附图说明
[0013]
图1示出了在用ptd
‑
myc融合多肽(tbx
‑
3400)或媒介物对照(pbmc)预处理、在各种条件下冷冻保存和解冻之后,免疫细胞(例如外周血单核细胞(pbmc))的细胞存活率。用7
‑
氨基放线菌素d(7
‑
aad)或台盼蓝对细胞进行染色,并经由流式细胞术或血细胞计数器进行分析,以确定解冻后活细胞的范围。如所指示的,将细胞冷冻在chb培养基、cs5培养基或cs10培养基中,并且冷冻在via freeze
tm
受控速率冷冻机的容器中。
[0014]
图2示出了在用ptd
‑
myc融合多肽预处理、在各种条件下冷冻保存和解冻之后免疫细胞(pbmc)的细胞恢复(%)。如所指示的,将细胞冷冻在chb培养基、cs5培养基或cs10培养基中,并且冷冻在容器中。
[0015]
图3示出了在用ptd
‑
myc融合多肽或媒介物对照进行预处理、在各种条件下冷冻保存和解冻之后,恢复的从供体受试者分离的免疫细胞(t细胞、b细胞、单核细胞、粒细胞和nk细胞)的细胞群的相对量。如所指示的,将细胞冷冻在chb培养基、cs5培养基或cs10培养基中,并且冷冻在via freeze
tm
受控速率冷冻机的容器中。通过流式细胞术和各种细胞群的免疫表型分型测定细胞群。
[0016]
图4示出了在用ptd
‑
myc融合多肽或媒介物对照进行预处理、在各种条件下冷冻保存和解冻之后,对照细胞和免疫细胞的细胞活化,其被表达为cd25表达的中位荧光强度(中位fi)。如所指示的,将细胞冷冻在chb培养基、cs5培养基或cs10培养基中,并且冷冻在via freeze
tm
受控速率冷冻机的容器中。用单独的单个刺激分子(cd3)或与共刺激分
子(cd28)组合来活化细胞。
[0017]
图5示出了在用ptd
‑
myc融合多肽或媒介物对照进行预处理、在各种条件下冷冻保存和解冻之后,对照细胞和免疫细胞的细胞活化,其被表达为cd25阳性细胞%。如所指示的,将细胞冷冻在chb培养基、cs5培养基或cs10培养基中,并且冷冻在via freeze
tm
受控速率冷冻机的容器中。用单独的单个刺激分子(cd3)或与共刺激分子(cd28)组合来活化细胞。
具体实施方式
[0018]
本公开不限于本技术中描述的特定实施例,这些实施例旨在作为本公开的各个方面的单个说明。在本文中将不描述本公开的所有各种实施例。在不脱离本公开的精神和范围的情况下,可以对本公开进行许多修改和变化,如对于本领域技术人员来说将是显而易见的。根据前面的描述,除了本文列举的那些之外,本公开范围内的功能等同的方法和装置对于本领域技术人员而言是显而易见的。此类修改和变化旨在落入所附权利要求的范围内。本公开仅受所附权利要求的条款以及这些权利要求所赋予的等同物的全部范围的限制。
[0019]
应当理解,本公开不限于特定的用途、方法、试剂、化合物、组合物或生物系统,这些当然可以变化。也应当理解的是,本文所用的术语仅用于描述特定实施例的目的,并不旨在进行限制。
[0020]
此外,本公开的特征或方面是根据马库什组的情况来描述的,本领域技术人员将认识到,本公开也因此是根据马库什组的任意单个成员或成员的子组来描述的。
[0021]
如本领域技术人员将理解的,出于任何目的和所有目的,特别是就提供书面描述而言,本文公开的所有范围还涵盖任何和所有可能的子范围及其子范围的组合。任何列出的范围都可以容易地被识别为充分描述并且使得相同的范围被分解为至少相等的两等份、三等份、四等份、五等份、十等份等。作为非限制性实例,本文讨论的每个范围可以容易地分解为下三分之一、中三分之一和上三分之一等。如本领域技术人员还将理解的,所有用语,例如“最多”、“至少”、“大于”、“小于”等包括所记载的数字,并且指的是可以随后分解成如上所讨论的子范围的范围。最后,如本领域技术人员将理解的,范围包括每个单独的数字。因此,例如,具有1
‑
3个细胞的组是指具有1、2或3个细胞的组。类似地,具有1
‑
5个细胞的组是指具有1、2、3、4或5个细胞的组,等等。
[0022]
除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同含义。
[0023]
i.定义
[0024]
本文使用的术语只是用于描述特定实施例,并且不用于限制本公开。如本文所使用的,除非上下文另外清楚地指出,否则单数形式“一(a)”、“一(an)”和“该(the)”也旨在包括复数形式。
[0025]
如本文所使用的,术语“约”表示值可以变化+/
‑
20%、+/
‑
15%、+/
‑
10%或+/
‑
5%,并且保持在本公开的范围内。例如,“约200iu/ml的浓度”涵盖在160iu/ml与240iu/ml之间的浓度。
[0026]
如本文所使用的,术语向受试者“施用”药剂包括将药剂引入或递送至受试者以执
行其预期功能的任何途径。施用可以通过任何合适的途径进行,包括静脉内、肌内、腹膜内或皮下施用。施用包括自我施用和由他人施用。
[0027]
术语“氨基酸”是指天然存在的氨基酸和非天然存在的氨基酸,以及以类似于天然存在的氨基酸的方式起作用的氨基酸类似物和氨基酸模拟物。天然编码的氨基酸为20种常见氨基酸(丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸)以及焦赖氨酸(pyrolysine)和硒代半胱氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构的药剂,即与氢、羧基基团、氨基基团和r基团结合的碳,如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。此类类似物具有经修饰的r基团(如,正亮氨酸)或经修饰的肽主链,但保留了与天然氨基酸相同的基本化学结构。在一些实施例中,形成多肽的氨基酸是d形式。在一些实施例中,形成多肽的氨基酸是l形式。在一些实施例中,形成多肽的第一多个氨基酸是d形式,并且第二多个氨基酸是l形式。
[0028]
氨基酸在本文中通过它们通常已知的三个字母符号或通过iupac
‑
iub生物化学命名委员会(iupac
‑
iub biochemical nomenclature commission)推荐的一个字母符号来提及。核苷酸同样地通过它们普遍接受的单字母代码来提及。
[0029]
术语“多肽”、“肽”和“蛋白质”在本文中可互换地用于指氨基酸残基的聚合物。该术语适用于天然存在的氨基酸聚合物以及其中一或多个氨基酸残基是非天然存在的氨基酸(例如氨基酸类似物)的氨基酸聚合物。该术语涵盖任何长度的氨基酸链,包括全长蛋白质,其中氨基酸残基通过共价肽键链接。
[0030]
如本文所使用的,“对照”是在实验中用于比较目的的替代样品。对照可以是“阳性”的或“阴性”的。例如,在实验的目的是确定用于治疗特定类型疾病的治疗剂的疗效的相关性的情况下,通常使用阳性对照(一种已知表现出所需的治疗效果的组合物)和阴性对照(未接受疗法或接受安慰剂的受试者或样品)。
[0031]
如本文所使用的,术语“有效量”或“治疗有效量”是指足以实现所需的治疗效果的药剂的量。在治疗应用的上下文中,施用于受试者的治疗肽的量可以取决于感染的类型和严重程度以及个体的特征,例如一般健康状况、年龄、性别、体重和对药物的耐受性。它也可以取决于疾病的程度、严重程度和类型。熟练的技术人员将能够根据这些和其它因素确定适当的剂量。
[0032]
如本文所使用的,术语“表达”是指多核苷酸被转录成mrna的过程和/或转录的mrna随后被翻译成肽、多肽或蛋白质的过程。如果多核苷酸来自基因组dna,则表达可以包括真核细胞中mrna的剪接。基因的表达水平可以通过测量细胞或组织样品中mrna或蛋白质的量来确定。在一个方面中,来自一个样品的基因的表达水平可以直接与来自对照或参考样品的该基因的表达水平进行比较。在另一个方面中,在施用本文公开的组合物后,来自一个样品的基因的表达水平可以直接与来自同一样品的该基因的表达水平进行比较。术语“表达”还指一或多种下列事件:(1)从细胞内的dna序列(例如,通过转录)产生rna模板;(2)在细胞内加工rna转录物(例如,通过剪接、编辑、5'帽形成和/或3'末端形成);(3)在细胞内将rna序列翻译成多肽或蛋白质;(4)细胞内多肽或蛋白质的翻译后修饰;(5)多肽或蛋白质在细胞表面上的呈递;和(6)从细胞分泌或呈递或释放多肽或蛋白质。
[0033]
术语“接头”是指连接或链接两个序列(例如链接两个多肽结构域)的合成序列(例
如,氨基酸序列)。在一些实施例中,接头含有1、2、3、4、5、6、7、8、9或10个氨基酸序列。
[0034]
如本文所使用的,术语免疫细胞是指在免疫应答中起作用的任何细胞。免疫细胞是造血来源的,并且包括淋巴细胞,如b细胞和t细胞;自然杀伤细胞;髓样细胞,如单核细胞、巨噬细胞、树突细胞、嗜酸性粒细胞、中性粒细胞、肥大细胞、嗜碱性粒细胞和粒细胞。
[0035]
术语“淋巴细胞”是指所有未成熟的、成熟的、未分化的和分化的白淋巴细胞群体,包括组织特异性的和特化的品种。作为非限制性实例,其涵盖b细胞、t细胞、nk t细胞和nk细胞。在一些实施例中,淋巴细胞包括所有b细胞谱系,包括前b细胞、祖b细胞、早期前b细胞、晚期前b细胞、大的前b细胞、小的前b细胞、未成熟b细胞、成熟b细胞、血浆b细胞、记忆b细胞、b
‑
1细胞、b
‑
2细胞和无能an1/t3细胞群。
[0036]
如本文所使用的,术语t细胞包括幼稚t细胞、cd4+t细胞、cd8+t细胞、记忆t细胞、活化的t细胞、无能t细胞、耐受t细胞、嵌合t细胞、抗原特异性t细胞和调节性t细胞。
[0037]
作为非限制性实例,术语“b细胞(b cell或b cells)”是指前b细胞、祖b细胞、早期前b细胞、晚期前b细胞、大的前b细胞、小的前b细胞、未成熟b细胞、成熟b细胞、幼稚b细胞、血浆b细胞、活化的b细胞、无能b细胞、耐受b细胞、嵌合b细胞、抗原特异性b细胞、记忆b细胞、b
‑
1细胞、b
‑
2细胞和无能an1/t3细胞群。在一些实施例中,术语b细胞包括在其细胞表面上表达免疫球蛋白重链和/或轻链的b细胞。在一些实施例中,术语b细胞包括表达和分泌免疫球蛋白重链和/或轻链的b细胞。在一些实施例中,术语b细胞包括在其细胞表面上结合抗原的细胞。在本文公开的一些实施例中,在所述过程中使用b细胞或an1/t3细胞。在某些实施例中,此类细胞任选地被任何适合于表达、能够表达(例如诱导型表达)或能够被分化成适合于表达抗体的细胞的动物细胞替代,所述细胞包括例如造血干细胞、幼稚b细胞、b细胞、前b细胞、祖b细胞、早期前b细胞、晚期前b细胞、大的前b细胞、小的前b细胞、未成熟b细胞、成熟b细胞、血浆b细胞、记忆b细胞、b
‑
l细胞、b
‑
2细胞、无能b细胞或无能an1/t3细胞。
[0038]
如本文所使用的,“外周血单核细胞”是指任何具有圆形核的外周血细胞,包括淋巴细胞,如t细胞、b细胞、nk细胞、单核细胞、巨噬细胞和树突细胞。
[0039]
如本文所使用的,“过继细胞治疗组合物”是指包含适合于过继细胞转移的细胞的任意组合物。在示例性的实施例中,过继细胞治疗组合物包含选自由肿瘤浸润淋巴细胞(til)、tcr(即异源t细胞受体)修饰的淋巴细胞和car(即嵌合抗原受体)修饰的淋巴细胞组成的群组的细胞类型。在另一个实施例中,过继细胞治疗组合物包含选自由t细胞、cd8+细胞、cd4+细胞、nk细胞、δ
‑
γt细胞、调节性t细胞和外周血单核细胞(pbmc)组成的群组的细胞类型。在另一个实施例中,til、t细胞、cd8+细胞、cd4+细胞、nk细胞、δ
‑
γt细胞、调节性t细胞或外周血单核细胞形成过继细胞治疗组合物。在一个实施例中,过继细胞治疗组合物包含t细胞。在一个实施例中,过继细胞治疗组合物可以是包含一或多种从供体受试者分离的免疫细胞和/或pbmc的冷冻组合物,所述免疫细胞和/或pbmc已经与myc融合多肽接触,所述myc融合多肽包含(i)蛋白质转导结构域;(ii)myc多肽序列。
[0040]
术语“myc”和“myc基因”是同义词。它们是指编码myc多肽的核酸序列。myc基因包含至少120个核苷酸的核苷酸序列,所述核苷酸序列与ncbi登录号nm—002467的序列至少60%至100%相同或同源,例如,至少60%、65%、70%、75%、80%、85%、86%、87%、88%、90%、91%、92%、94%、95%、96%、97%、98%,或从约70%至约100%的任何其它百分比相同。在一些实施例中,myc基因是原癌基因。在某些情况下,在8q24.21处在8号染色体上发现
myc基因。在某些情况下,myc基因从pter的128,816,862bp处开始,并且在pter的128,822,856bp处结束。在某些情况下,myc基因约为6kb。在某些情况下,myc基因编码至少八个独立的mrna序列—5个交替剪接的变体和3个非剪接的变体。
[0041]
术语“myc蛋白”、“myc多肽”和“myc序列”是同义词,并且是指ncbi登录号uniprotkb/swiss
‑
prot:p01106.1(myc同种型1)或np_002458.2(uniprotkb/swiss
‑
prot:p01106.2;myc同种型2)中公开的氨基酸残基的聚合物,及其功能性同系物、类似物或片段。uniprotkb/swiss
‑
prot:p01106.1的序列为:
[0042][0043]
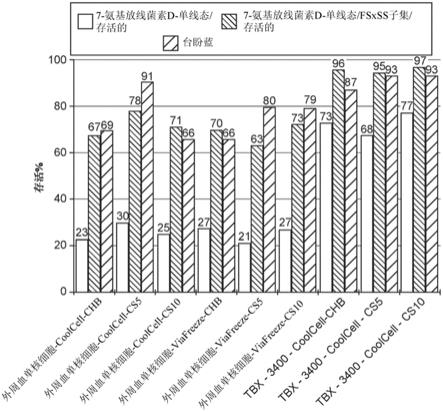
np_002458.2(uniprotkb/swiss
‑
prot:p01106.2)的序列为:
[0044][0045]
在一些实施例中,myc多肽是完整的myc多肽序列。在一些实施例中,myc多肽是部分myc多肽序列。在一些实施例中,myc多肽包含seq id no:2或11的至少400个连续氨基酸。在一些实施例中,myc多肽包含seq id no:2或11的至少400个连续氨基酸,并保留至少一种myc活性。在一些实施例中,myc多肽包含seq id no:2或11的至少400、至少410、至少420、至少430或至少450个连续氨基酸。在一些实施例中,myc多肽包含seq id no:2或11的至少400、至少410、至少420、至少430或至少450个连续氨基酸,并保留至少一种myc活性。在一些实施例中,myc多肽是c
‑
myc。在一些实施例中,myc多肽序列包含如下所示的序列:
[0046][0047][0048]
在一些实施例中,myc多肽序列包含如下所示的序列:
[0049][0050]
在一些实施例中,myc多肽包含与ncbi登录号np002458.2或uniprotkb/swiss
‑
prot登录号p01106.1的序列至少40%至100%相同的氨基酸序列,例如,至少40%、45%、50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、90%、91%、92%、94%、95%、96%、97%、98%、99%,或从约40%至约100%的任何其它百分比相同。在一些实施例中,myc多肽是指439个氨基酸的聚合物,一种没有经历任何翻译后修饰的myc多肽。在一些实施例中,myc多肽是指经历翻译后修饰的439个氨基酸的聚合物。在一些实施例中,myc多肽为48,804kda。在一些实施例中,myc多肽含有碱性螺旋
‑
环
‑
螺旋亮氨酸拉链(bhlh/lz)结构域。在一些实施例中,bhlh/lz结构域包含下列序列:亮氨酸拉链(bhlh/lz)结构域。在一些实施例中,bhlh/lz结构域包含下列序列:在一些实施例中,myc多肽是转录因子(例如,转录因子64)。在一些实施例中,myc多肽含有e
‑
盒dna结合结构域。在一些实施例中,myc多肽与包含cacgtg的序列结合。在一些实施例中,myc多肽促进细胞存活和/或增殖中的一或多种。在一些实施例中,myc多肽包括上面描述的那些中的一或多种,并且包括一或多种翻译后修饰(例如,乙酰化)。在一些实施例中,myc多肽在多肽的n末端或c末端包含一或多个额外的氨基酸残基。在一些实施例中,myc多肽是融合蛋白。在一些实施例中,myc多肽在多肽的n末端或c末端处与一或多种额外的肽链接。
[0051]
适用于本文所述的方法的蛋白质还包括功能性变体,包括与本文所述的任何蛋白质的氨基酸序列相比具有1至15个氨基酸改变(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸取代、缺失或添加)的蛋白质。在其它实施例中,改变的氨基酸序列与本文所述的任何蛋白质抑制剂的氨基酸序列至少75%相同,例如,75%、76%、77%、78%、79%、
80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同。此类序列变体蛋白质适合于本文所述的方法,只要改变的氨基酸序列保持足够的生物活性以在本文所述的组合物和方法中起作用。在进行氨基酸取代的情况下,取代可以是保守氨基酸取代。例如,在常见的天然存在的氨基酸中,“保守氨基酸取代”通过以下各组中的氨基酸之间的取代来说明:(1)甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸,(2)苯丙氨酸、酪氨酸和色氨酸,(3)丝氨酸和苏氨酸,(4)天冬氨酸和谷氨酸,(5)谷氨酰胺和天冬酰胺,以及(6)赖氨酸、精氨酸和组氨酸。blosum62表是由约2,000个蛋白质序列区段的局部多重比对得到的氨基酸取代矩阵,代表了多于500组相关蛋白质的高度保守区域(亨尼科夫(henikoff)等人(1992),美国国家科学院院刊(proc.natl acad.sci.usa),89:10915
‑
10919)。因此,blosum62取代频率用于定义保守氨基酸取代,在一些实施例中,所述保守氨基酸取代被引入到本文所述或所公开的氨基酸序列中。尽管可以仅根据化学性质(如上所讨论)设计氨基酸取代,但语言“保守氨基酸取代”优选地是指由大于
‑
1的blosum62值表示的取代。例如,如果氨基酸取代的特征是blosum62值为0、1、2或3,则该取代是保守的。根据这一系统,优选的保守氨基酸取代的特征在于blosum62值为至少1(例如,1、2或3),而更优选的保守氨基酸取代的特征在于blosum62值为至少2(例如,2或3)。
[0052]
短语“e
‑
盒序列”和“增强子盒序列”在本文中可互换使用,并且意指核苷酸序列canntg,其中n是任何核苷酸。在某些情况下,e
‑
盒序列包含cacgtg。在某些情况下,由myc编码的转录因子的基本螺旋
‑
环
‑
螺旋结构域与e
‑
盒序列结合。在某些情况下,e
‑
盒序列位于基因(例如,p21、bc1
‑
2或鸟氨酸脱羧酶)的上游。在某些情况下,myc多肽含有e
‑
盒dna结合结构域。在某些情况下,e
‑
盒dna结合结构域包含krrthnvlerqrrn(seq id no:6)的序列。在某些情况下,由myc编码的转录因子与e
‑
盒序列的结合允许rna聚合酶转录e
‑
盒序列下游的基因。
[0053]
术语“myc活性”或“myc生物活性”或“生物活性的myc”包括增强或诱导细胞存活、细胞增殖和/或抗体产生中的一或多种。作为示例而非限制,myc活性包括增强抗cd3和抗cd28活化的t细胞的扩增和/或增加长期自我更新的造血干细胞的增殖。myc活性还包括进入细胞核、与核酸序列结合(例如,与e
‑
盒序列结合)和/或诱导myc靶基因的表达。
[0054]
术语“患者”、“受试者”、“个体”等在本文中可互换使用,并且是指动物,通常是哺乳动物。在一个实施例中,患者、受试者或个体是哺乳动物。在一个实施例中,患者、受试者或个体是人。在一些实施例中,患者、受试者或个体是动物,例如但不限于家养动物,如马科动物、牛科动物、鼠科动物、羊科动物、犬科动物和猫科动物。
[0055]
术语“蛋白质转导结构域(ptd)”或“转运肽序列”(也被称为细胞可渗透蛋白质(cpp)或膜易位序列(mts))在本文中可互换地用于指能够独立于经典的内吞作用将大得多的分子转运到细胞中的小肽。在一些实施例中,可以在蛋白质转导结构域内发现核定位信号,其介导分子进一步易位到细胞核中。
[0056]
如本文所用的术语“治疗(treating或treatment)”覆盖对受试者,如人的疾病的治疗,并且包括:(i)抑制疾病,即阻止其发展;(ii)缓解疾病,即引起疾病的消退;(iii)减慢疾病的进展;和/或(iv)抑制、缓解或减慢所述疾病的一或多种症状的进展。关于肿瘤,“治疗(treating或treatment)”还涵盖肿瘤的消退、减慢肿瘤生长、抑制肿瘤的转移、抑制复发或复发性癌症和/或维持缓解。
[0057]
还应当理解,所述的治疗或预防医学疾病和病症的各种模式旨在意指“实质性的”,其包括全部但也少于全部的治疗或预防,并且其中实现一些生物学或医学相关的结果。治疗可以是对慢性病的持续长期治疗,或者是对急性病症的治疗的单次或几次施用。
[0058]
如本文使用的术语“治疗性”意指治疗和/或预防。治疗效果通过抑制、减轻或根除疾病状态获得。
[0059]
ii.概述
[0060]
在一个方面中,本公开部分地涉及包含从供体受试者分离的一或多种免疫细胞(例如,外周血单核细胞(pbmc))的组合物的冷冻保存,其中在将所述组合物冷却至足以冷冻所述组合物的温度之前,在体外使所述一或多种免疫细胞与有效量的ptd
‑
myc融合多肽接触。
[0061]
在另一个方面中,本公开部分地涉及包含从供体受试者分离的一或多种外周血单核细胞(pbmc)的组合物的冷冻保存,其中在将所述组合物冷却至足以冷冻所述组合物的温度之前,在体外使所述一或多种pbmc与有效量的ptd
‑
myc融合多肽接触。
[0062]
本公开至少部分基于以下发现:与未用myc融合多肽处理的对照免疫细胞和/或pbmc相比,使一或多种从供体受试者分离的免疫细胞和/或pbmc与含有myc多肽和蛋白质转导结构域(ptd)(如,hiv tat蛋白质转导结构域)的myc融合多肽接触,并将经处理的免疫细胞和/或pbmc冷却至足以冷冻细胞的温度,显著地增加了细胞存活率和/或细胞恢复,以及显著地增加了细胞活化后cd25的表达。本文提供的实例证明,与冷冻
‑
解冻循环后的对照pbmc相比,冷冻保存前已与tat
‑
myc融合蛋白接触的从供体受试者分离的免疫细胞和/或pbmc在解冻时表现出增加的细胞存活率、增加的细胞恢复、增加的cd3和cd28的细胞活化或在细胞活化后增加的cd25表达中的一或多种。
[0063]
在一些实施例中,本公开提供了一种用于冷冻保存免疫细胞的方法,所述方法包含:使包含从供体受试者分离的一或多种pbmc的组合物与有效量的myc融合多肽接触,所述myc融合多肽包含(i)蛋白质转导结构域(ptd)、(ii)myc多肽序列;以及将pbmc冷却至足以冷冻所述组合物的温度。
[0064]
在一些实施例中,本公开提供了一种用于冷冻保存外周血单核细胞(pbmc)的方法,所述方法包含:使包含从供体受试者分离的一或多种pbmc的组合物与有效量的myc融合多肽接触,所述myc融合多肽包含(i)蛋白质转导结构域(ptd)、(ii)myc多肽序列;以及将pbmc冷却至足以冷冻所述组合物的温度。
[0065]
在一些实施例中,蛋白质转导结构域序列是tat蛋白质转导结构域序列。在一些实施例中,myc多肽序列包含seq id no:2或11中列出的氨基酸序列。在一些实施例中,ptd
‑
myc融合多肽包含seq id no:1中列出的氨基酸序列。
[0066]
在一些实施例中,从供体受试者分离的一或多种免疫细胞可以包括b细胞、t细胞、自然杀伤(nk)细胞、骨髓细胞或其任意组合。在一些实施例中,从供体受试者分离的一或多种骨髓细胞可以包括单核细胞、巨噬细胞、树突细胞、嗜酸性粒细胞、嗜中性粒细胞、肥大细胞、嗜碱性粒细胞、粒细胞或其任意组合。
[0067]
在一些实施例中,从供体受试者分离的一或多种b细胞可以包括前b细胞、祖b细胞、早期前b细胞、晚期前b细胞、大的前b细胞、小的前b细胞、未成熟b细胞、成熟b细胞、幼稚b细胞、血浆b细胞、活化的b细胞、无能b细胞、耐受b细胞、嵌合b细胞、抗原特异性b细胞、记
忆b细胞、b
‑
1细胞、b
‑
2细胞、无能an1/t3细胞群或其两种或更多种的组合。
[0068]
在一些实施例中,从供体受试者分离的一或多种t细胞可以包括幼稚t细胞、cd4+t细胞、cd8+t细胞、记忆t细胞、活化的t细胞、无能t细胞、耐受t细胞、嵌合t细胞和抗原特异性t细胞、调节性t细胞或其任意组合。
[0069]
在一些实施例中,一或多种外周血单核细胞可以是t细胞、b细胞、nk细胞、单核细胞、粒细胞或其任意组合。
[0070]
在一些实施例中,所述方法进一步包含将所述一或多种免疫细胞(包括一或多种pbmc)悬浮在细胞悬浮液培养基中。在一些实施例中,细胞悬浮液培养基适合于哺乳动物细胞的冷冻保存。在一些实施例中,细胞悬浮液培养基适合于免疫细胞(包括pbmc)的冷冻保存。在一些实施例中,细胞悬浮液培养基包含chb培养基、cs5培养基或cs10培养基。
[0071]
在一些实施例中,使用受控速率的低温冷冻机来冷却免疫细胞。在一些实施例中,免疫细胞以约
‑
1℃/分钟的速率冷却。在一些实施例中,使用受控速率的低温冷冻机来冷却pbmc。在一些实施例中,以约
‑
1℃/分钟的速率冷却pbmc。
[0072]
在一些实施例中,足以冷冻组合物的温度是约
‑
80℃至约
‑
190℃。在一些实施例中,足以冷冻组合物的温度是约
‑
80℃、约
‑
82℃、约
‑
84℃、约
‑
86℃、约
‑
88℃、约
‑
90℃、约
‑
92℃、约
‑
94℃、约
‑
96℃、约
‑
98℃、约
‑
100℃、约
‑
105℃、约
‑
110℃、约
‑
115℃、约
‑
120℃、约
‑
125℃、约
‑
130℃、约
‑
135℃、约
‑
140℃、约
‑
145℃、约
‑
150℃、约
‑
155℃、约
‑
160℃、约
‑
165℃、约
‑
170℃、约
‑
175℃、约
‑
180℃、约
‑
185℃、约
‑
190℃或其间的任何整数值。
[0073]
在一些实施例中,所述方法进一步包含解冻所述冷冻保存的细胞,使得与不与有效量的myc融合多肽接触的对照细胞相比,所述细胞表现出增加的细胞存活率、增加的细胞恢复或在细胞活化后增加的cd25表达中的一或多种。
[0074]
在另一个方面中,本公开提供了一种冷冻组合物,所述冷冻组合物包含:myc融合多肽,所述myc融合多肽包含(i)蛋白质转导结构域、(ii)myc多肽序列;和一或多种从供体受试者分离的免疫细胞,其中与从受试者分离的对照免疫细胞相比,所述组合物表现出增加的细胞存活率。
[0075]
在另一个相关的方面中,本公开提供了一种冷冻组合物,所述冷冻组合物包含:myc融合多肽,所述myc融合多肽包含(i)蛋白质转导结构域、(ii)myc多肽序列;和一或多种从供体受试者分离的外周血单核细胞(pbmc),其中与从受试者分离的对照pbmc相比,所述组合物表现出增加的细胞存活率。在一些实施例中,蛋白质转导结构域序列是tat蛋白质转导结构域序列。在一些实施例中,myc多肽序列包含seq id no:2或11中列出的氨基酸序列。在一些实施例中,ptd
‑
myc融合多肽包含seq id no:1中列出的氨基酸序列。
[0076]
在一些实施例中,从供体受试者分离的一或多种免疫细胞可以包括b细胞、t细胞、自然杀伤(nk)细胞、骨髓细胞或其任意组合。在一些实施例中,从供体受试者分离的一或多种骨髓细胞可以包括单核细胞、巨噬细胞、树突细胞、嗜酸性粒细胞、嗜中性粒细胞、肥大细胞、嗜碱性粒细胞、粒细胞或其任意组合。
[0077]
在一些实施例中,从供体受试者分离的一或多种b细胞可以包括前b细胞、祖b细胞、早期前b细胞、晚期前b细胞、大的前b细胞、小的前b细胞、未成熟b细胞、成熟b细胞、幼稚b细胞、血浆b细胞、活化的b细胞、无能b细胞、耐受b细胞、嵌合b细胞、抗原特异性b细胞、记忆b细胞、b
‑
1细胞、b
‑
2细胞、无能an1/t3细胞群或其两种或更多种的组合。
[0078]
在一些实施例中,从供体受试者分离的一或多种t细胞可以包括幼稚t细胞、cd4+t细胞、cd8+t细胞、记忆t细胞、活化的t细胞、无能t细胞、耐受t细胞、嵌合t细胞和抗原特异性t细胞、调节性t细胞或其任意组合。
[0079]
在一些实施例中,一或多种外周血单核细胞可以是t细胞、b细胞、nk细胞、单核细胞、粒细胞或其任意组合。
[0080]
在一些实施例中,组合物进一步包含细胞悬浮液培养基。在一些实施例中,细胞悬浮液培养基包含chb培养基、cs5培养基或cs10培养基。
[0081]
在一些实施例中,与冷冻
‑
解冻循环后的对照pbmc相比,当解冻时所述组合物表现出增加的细胞恢复。
[0082]
在一些实施例中,与冷冻
‑
解冻循环后的对照pbmc相比,所述组合物在细胞活化后表现出增加的cd25表达。
[0083]
在一些实施例中,本技术的组合物可以有利地增加免疫细胞和/或pbmc在过继细胞转移(act)中的利用。过继细胞转移(act)是一种免疫疗法,其涉及将具有抗肿瘤活性的免疫细胞转移到患者体内。act通常涉及从供体受试者中分离具有抗肿瘤活性的淋巴细胞,体外培养淋巴细胞以扩增群体,然后将淋巴细胞输注到需要其的患者中。在一些实施例中,免疫细胞和/或pbmc是从供体分离的原代细胞。
[0084]
在一些实施例中,分离后修饰免疫细胞和/或pbmc。例如,在一些实施例中,所述细胞是被修饰以表达一或多种异源受体或经修饰的受体(例如,嵌合抗原受体)的免疫细胞(例如,t细胞)。在一些实施例中,所述细胞是工程改造的嵌合抗原受体(car)t细胞。在一些实施例中,所述细胞是工程改造的嵌合抗原受体(car)treg
‑
细胞。
[0085]
在一些实施例中,根据本文提供的方法冷冻保存的免疫细胞和修饰的免疫细胞可以用于增加受试者的免疫应答。这些细胞的示例性用途包括但不限于癌症免疫疗法和治疗病原性感染(如病毒、细菌或真菌感染)。
[0086]
在一些实施例中,根据本文提供的方法冷冻保存的免疫细胞和修饰的免疫细胞可以用于降低受试者的免疫应答。这些细胞(例如,tregs和修饰的treg细胞)的示例性用途包括但不限于治疗自身免疫性和过敏性疾病和病症,如多发性硬化(ms)、红斑狼疮、哮喘、自身免疫性葡萄膜炎、克罗恩病、结肠炎、移植物抗宿主病(gvhd)、类风湿性关节炎、炎性肠病、糖尿病以及器官或组织移植排斥。
[0087]
在一些实施例中,本技术的组合物可以用于体外或体内免疫学研究。
[0088]
在一些实施例中,本技术的组合物可以用于产生用于免疫疗法和过继细胞转移的免疫细胞库的方法中。
[0089]
iii.在冷冻保存前获得和制备免疫细胞和/或pbmc的方法
[0090]
用于本文提供的方法的免疫细胞和/或外周血单核细胞可以使用本领域已知的任何合适的方法获得。在一些实施例中,免疫细胞是原代免疫细胞。在一些实施例中,免疫细胞是淋巴细胞,如t细胞和b细胞。在一些实施例中,免疫细胞是自然杀伤(nk)细胞。在一些实施例中,免疫细胞是淋巴细胞和nk细胞的混合物。在一些实施例中,免疫细胞是外周血单核细胞(pbmc)。在一些实施例中,在受试者的肿瘤或转移性肿瘤的手术期间去除t细胞。例如,在一些实施例中,在通过活检去除肿瘤组织之后分离t细胞。在一些实施例中,外周血单核细胞(pbmc)可以是t细胞、b细胞、nk细胞、单核细胞、粒细胞或其任意组合。
[0091]
在一些实施例中,免疫细胞可以从含有细胞群体的样品(如血液、淋巴或组织活检样品)中分离。可以通过本领域中已知的任何手段从细胞群体中分离免疫细胞。
[0092]
在一些实施例中,免疫细胞可以从全血样品(如外周血样品)中分离。在一些实施例中,免疫细胞可以从白血病单位中分离。在一些实施例中,外周血单核细胞可以从白血病单位中分离。在一些实施例中,外周血单核细胞级分可以通过使用任何合适的密度梯度培养基的梯度分离而从全血样品中分离。在一些实施例中,例如,用于分离外周血单核细胞级分的密度梯度培养基是plus或premium。在一个实施例中,通过使用plus培养基的梯度分离从全血样品中分离pbmc级分。在一些实施例中,使用血液抗凝血剂乙二胺四乙酸(edta)来防止血样品的凝结。因此,在一些实施例中,所述方法使用包被有edta的收集小瓶。edta通过螯合血液样品中负责凝血和凝固的ca
2+
离子而充当血液抗凝剂。在一些实施例中,从样品中耗尽样品的红细胞。
[0093]
在一个实施例中,所述方法包含通过本领域中已知的任何合适的方法从肿瘤样品中获得大量群体的免疫细胞。例如,通过将肿瘤样品解离成可以从中选择特定细胞群体的细胞悬浮液,可以从肿瘤样品中获得大量群体的免疫细胞。获得大量群体的免疫细胞的合适的方法可以包括但不限于机械解离(例如,绞碎)肿瘤、酶促解离(例如,消化)肿瘤和抽吸(例如,如用针)中的任何一或多种。
[0094]
从样品获得的免疫细胞的群体可以包含任何合适类型的免疫细胞,包括但不限于b细胞、t细胞、自然杀伤(nk)细胞、骨髓细胞或其任意组合。在一些实施例中,从样品获得的大量群体的骨髓细胞可以包括单核细胞、巨噬细胞、树突细胞、嗜酸性粒细胞、嗜中性粒细胞、肥大细胞、嗜碱性粒细胞、粒细胞或其任意组合。
[0095]
从样品中获得的t细胞的群体可以包含任何合适类型的t细胞。在一些实施例中,从样品获得的t细胞可以包含幼稚t细胞、cd4+t细胞、cd8+t细胞、记忆t细胞、活化的t细胞、无能t细胞、耐受t细胞、嵌合t细胞和抗原特异性t细胞,或其任意组合。
[0096]
从样品中获得的b细胞的群体可以包含任何合适类型的b细胞。在一些实施例中,从样品获得的b细胞可以包含前b细胞、祖b细胞、早期前b细胞、晚期前b细胞、大的前b细胞、小的前b细胞、未成熟b细胞、成熟b细胞、幼稚b细胞、血浆b细胞、活化的b细胞、无能b细胞、耐受b细胞、嵌合b细胞、抗原特异性b细胞、记忆b细胞、b
‑
l细胞、b
‑
2细胞、无能an1/t3细胞群或其两种或更多种的组合。
[0097]
从样品获得的免疫细胞的群体可以包含外周血单核细胞(pbmc)。在一些实施例中,从样品获得的pbmc可以包含t细胞、b细胞、nk细胞、单核细胞、粒细胞或其任意组合。
[0098]
样品可以从任何哺乳动物获得。除非另有说明,否则如本文所使用的,术语“哺乳动物”是指任何哺乳动物,包括但不限于,logomorpha目哺乳动物,如兔;食肉目哺乳动物,包括猫科动物(猫)和犬科动物(狗);偶蹄目哺乳动物,包括牛科动物(牛)和猪科动物(猪);或奇蹄目哺乳动物,包括马科动物(马)。哺乳动物可以是非人类灵长类动物,例如灵长目、ceboids目或simoids(猴子)目或类人猿目(人和猿)。在一些实施例中,哺乳动物可以是啮齿动物目的哺乳动物,如小鼠和仓鼠。优选地,哺乳动物是非人类灵长类动物或人类。示例性的哺乳动物是人。
[0099]
在一些实施例中,可以通过阳性或阴性选择技术进一步分离免疫细胞。通过阴性选择富集免疫细胞群体可以用针对阴性选择的细胞特有的表面标记物的抗体的组合来完
成。通过细胞分选和/或选择,通过使用针对阴性选择的细胞上存在的细胞表面标记物的单克隆抗体的鸡尾酒的负磁性免疫粘附或流式细胞术,可以富集细胞。例如,为了通过阴性选择来富集cd4+细胞,一个单克隆抗体的鸡尾酒通常包括抗体:cd14、cd20、cd11b、cd16、hla
‑
dr和cd8。
[0100]
此外,单核细胞群(即cd14+细胞)可以通过各种方法从血液制剂中耗竭,包括但不限于抗cd14包被的珠或柱,或利用这些细胞的吞噬活性来促进清除。
[0101]
为了通过阳性或阴性选择分离所需要的细胞群,细胞和表面的浓度(例如,颗粒,如珠)可以变化。在某些实施例中,可以期望显著地减小珠和细胞混合在一起的体积(即,增加细胞的浓度),以确保细胞和珠的最大接触。例如,在一个实施例中,可以使用20亿个细胞/ml的浓度。在一个实施例中,使用10亿细胞/ml的浓度。在另外的实施例中,可以使用大于1亿个细胞/ml。在另外的实施例中,可以使用约1000万个细胞/ml、约1500万个细胞/ml、约2000万个细胞/ml、约2500万个细胞/ml、约3000万个细胞/ml、约3500万个细胞/ml、约4000万个细胞/ml、约4500万个细胞/ml或约5000万个细胞/ml的细胞浓度。在另一个实施例中,可以使用约7500万个细胞/ml、约8000万个细胞/ml、约8500万个细胞/ml、约9000万个细胞/ml、约9500万个细胞/ml或约1亿个细胞/ml的细胞浓度。在另外的实施例中,可以使用约1.25亿细胞/ml或约1.5亿细胞/ml的浓度。使用高浓度可致使增加细胞产率、促进细胞活化和细胞增殖。此外,使用高细胞浓度允许更有效地捕获可以弱表达目标靶抗原的细胞,如cd28
‑
阴性t细胞,或从存在许多肿瘤细胞的样品(例如白血病血液、肿瘤组织等)中捕获细胞。此类细胞群体可以具有治疗价值,因此可能期望获得。例如,使用高浓度的细胞能够更有效地选择通常比cd28的表达更弱的cd8+t细胞。
[0102]
在另一个相关的实施例中,可能期望使用较低浓度的细胞。通过显著地稀释免疫细胞和表面(例如,颗粒,如珠)的混合物,颗粒与细胞之间的相互作用被最小化。这种方式用于选择表达大量所需抗原结合到颗粒上的细胞。例如,cd4+t细胞表达更高水平的cd28并在稀的浓度下能比cd8+t细胞更有效地被捕获。在一些实施例中,所使用的细胞的浓度可以是5
×
106/ml。在一些实施例中,所使用的浓度可以是约1
×
105/ml至1
×
106/ml,或其间的任何整数值。因此,所使用的浓度可以是约1
×
105/ml、约1.1
×
105/ml、约1.2
×
105/ml、约1.3
×
105/ml、约1.4
×
105/ml、约1.5
×
105/ml、约1.6
×
105/ml、约1.7
×
105/ml、约1.8
×
105/ml、约1.9
×
105/ml、约2
×
105/ml、约2.2
×
105/ml、约2.4
×
105/ml、约2.6
×
105/ml、约2.8
×
105/ml、约3
×
105/ml、约3.2
×
105/ml、约3.4
×
105/ml、约3.6
×
105/ml、约3.8
×
105/ml、约4
×
105/ml、约4.2
×
105/ml、约4.4
×
105/ml、约4.6
×
105/ml、约4.8
×
105/ml、约5
×
105/ml、约5.5
×
105/ml、约6
×
105/ml、约6.5
×
105/ml、约7
×
105/ml、约7.5
×
105/ml、约8
×
105/ml、约8.5
×
105/ml、约9
×
105/ml、约9.5
×
105/ml、约1
×
106/ml或其间的任何整数值。
[0103]
在一些实施例中,用表位特异性试剂直接标记细胞,以用于通过流式细胞术分离,然后表征细胞表型。在一些实施例中,通过接触免疫细胞特异性抗体来分离免疫细胞。在一些实施例中,通过接触pbmc特异性抗体来分离pbmc。抗原特异性t细胞或通常本技术的任何细胞的分选可以使用多种商业上可获得的细胞分选仪中的任何一种来进行,包括但不限于moflo分选仪(dakocytomation,科罗拉多州柯林斯堡(fort collins,colo.))、facsaria
tm
、facsarray
tm
、facsvantage
tm
、bd
tm
lsr ii和facscalibur
tm
(bd生物科学(biosciences),加利福尼亚州圣何塞(san jose,calif.))。
[0104]
iv.myc融合蛋白
[0105]
在一些实施例中,ptd
‑
myc融合多肽包含蛋白质转导结构域(ptd)、促进细胞存活或增殖中的一或多种的myc多肽和任选地蛋白质标签结构域,例如促进融合蛋白的纯化的一或多个氨基酸序列。在一些实施例中,与myc多肽接触的细胞表现出增加的存活时间(例如,与未与myc接触的相同类型的相同或相似细胞相比)和/或增加的增殖(例如,与未与myc接触的相同类型的相同或相似细胞相比)。
[0106]
在一些实施例中,融合多肽包含(a)蛋白质转导结构域;和(b)myc多肽序列。在一些实施例中,融合多肽是式(i)的多肽:
[0107]
蛋白质转导结构域
‑
myc多肽序列。
[0108]
在一些实施例中,本文公开的融合多肽包含(a)蛋白质转导结构域;(b)myc多肽序列;和(c)一或多种链接蛋白质转导结构域和myc多肽序列的分子。在一些实施例中,融合多肽是式(ii)的多肽:
[0109]
蛋白质转导结构域
‑
x
‑
myc多肽序列,
[0110]
其中
‑
x
‑
是链接蛋白质转导结构域和myc多肽序列的分子。在一些实施例中,
‑
x
‑
是至少一个氨基酸。
[0111]
在一些实施例中,本文公开的融合多肽包含(a)蛋白质转导结构域;(b)myc多肽序列;(c)至少两个蛋白质标签;和(d)任选地接头。在一些实施例中,融合多肽是式(iii
‑
vi)的多肽:
[0112]
蛋白质转导结构域
‑
x
‑
myc多肽序列
‑
x
‑
蛋白质标签1
‑
x
‑
蛋白质标签2(式(iii)),或蛋白质转导结构域
‑
myc多肽序列
‑
x
‑
蛋白质标签1
‑
x
‑
蛋白质标签2(式(iv)),或蛋白质转导结构域
‑
myc多肽序列
‑
蛋白质标签1
‑
x
‑
蛋白质标签2(式(v)),或蛋白质转导结构域
‑
myc多肽序列
‑
蛋白质标签1
‑
蛋白质标签2(式(vi)),
[0113]
其中
‑
x
‑
是接头。在一些实施例中,
‑
x
‑
是一或多个氨基酸。
[0114]
在一些实施例中,本文公开的融合多肽包含(a)蛋白质转导结构域;(b)myc多肽序列;(c)6
‑
组氨酸标签;(d)v5表位标签;和(e)任选地接头。在一些实施例中,融合多肽是式(vii
‑
xiv)的多肽:
[0115]
蛋白质转导结构域
‑
x
‑
myc多肽序列
‑
x
‑6‑
组氨酸标签
‑
x
‑
v5表位标签(式(vii)),或蛋白质转导结构域
‑
myc多肽序列
‑
x
‑6‑
组氨酸标签
‑
x
‑
v5表位标签(式(viii)),或蛋白质转导结构域
‑
myc多肽序列
‑6‑
组氨酸标签
‑
x
‑
v5表位标签(式(ix)),或蛋白质转导结构域
‑
myc多肽序列
‑6‑
组氨酸标签
‑
v5表位标签(式(x)),蛋白质转导结构域
‑
x
‑
myc多肽序列
‑
x
‑
v5表位标签
‑
x
‑6‑
组氨酸标签(式(xi)),或蛋白质转导结构域
‑
myc多肽序列
‑
x
‑
v5表位标签
‑
x
‑6‑
组氨酸标签(式(xii)),或蛋白质转导结构域
‑
myc多肽序列
‑
v5表位标签
‑
x
‑6‑
组氨酸标签(式(xiii)),或蛋白质转导结构域
‑
myc多肽序列
‑
v5表位标签
‑6‑
组氨酸标签(式(xiv)),
[0116]
其中
‑
x
‑
是接头。在一些实施例中,
‑
x
‑
是一或多个氨基酸。
[0117]
如上所述,在一些实施例中,myc融合蛋白包含一或多个接头序列。接头序列可以用于链接融合蛋白的蛋白质转导结构域、myc多肽序列、v5表位标签和/或6
‑
组氨酸标签。在一些实施例中,接头包含一或多个氨基酸。在一些实施例中,接头的氨基酸序列包含kgelnskle。在一些实施例中,接头包含rtg的氨基酸序列。
[0118]
蛋白质转导结构域(ptd)
[0119]
在一些实施例中,myc融合蛋白包括蛋白质转导结构域。肽转运为小分子、蛋白质或核酸跨过细胞膜递送至细胞的细胞内隔室提供了替代方案。一个非限制性实例和良好表征的蛋白质转导结构域(ptd)是tat衍生的肽。弗兰克尔(frankel)等人(参见,例如,美国专利第5,804,604号、美国专利第5,747,641号、美国专利第5,674,980号、美国专利第5,670,617号和美国专利第5,652,122号)证明了通过将含有tat的氨基酸48
‑
57的肽与货物蛋白(β
‑
半乳糖苷酶或辣根过氧化物酶)缀合将货物蛋白转运到细胞中。在一些实施例中,tat包含mrkkrrqrrr(seq id no:7)的氨基酸序列。
[0120]
ptd的另一个非限制性实例是渗透素(penetratin)。渗透素可以将亲水性大分子转运穿过细胞膜(代洛西(derossi)等人,细胞生物学的趋势(trends cell biol.),8:84
‑
87(1998),其通过引用以其整体并入本文)。渗透素是一种16个氨基酸的肽,其对应于触角足突变(一种在培养中被细胞内化的果蝇(drosophila)转录因子)的同源结构域的氨基酸43
‑
58。
[0121]
ptd的又一非限制性实例是vp22。vp22(一种来自1型单纯疱疹病毒(hsv
‑
1)的被膜蛋白)具有跨细胞膜转运蛋白和核酸的能力(埃利奥特(elliot)等人,细胞(cell)88:223
‑
233,1997,其通过引用以其整体并入本文)。vp22的残基267
‑
300是必需的,但不足以用于转运。由于负责转运功能的区域尚未确定,因此整个vp22蛋白通常用于跨细胞膜转运货物蛋白和核酸(施瓦策(schwarze)等人,药理学趋势(trends pharmacol sci),21:45
‑
48,2000)。
[0122]
在一些实施例中,ptd
‑
myc融合多肽包括蛋白质转导结构域。作为示例,但不是作为限制,在一些实施例中,蛋白质转导结构域包含tat、渗透素、vp22、vpr、eptd、r9、r15、vp16和触角足突变中的一或多种的蛋白质转导结构域。在一些实施例中,蛋白质转导结构域包含tat、渗透素、vp22、vpr和eptd中的一或多种的蛋白质转导结构域。在一些实施例中,蛋白质转导结构域包含tat、渗透素、vp22、vpr、eptd、r9、r15、vp16和触角足突变中至少一种的蛋白质转导结构域。在一些实施例中,蛋白质转导结构域包含合成的蛋白质转导结构域(例如,多精氨酸或ptd
‑
5)。在特定实施例中,蛋白质转导结构域包含tat蛋白质转导结构域。在一些实施例中,蛋白质转导结构域与myc多肽共价链接。在一些实施例中,蛋白质转导结构域经由肽键与myc多肽链接。在一些实施例中,蛋白质转导结构域经由接头序列与myc多肽链接。在一些实施例中,接头包含短氨基酸序列。作为示例,但不是作为限制,在一些实施例中,接头序列的长度为1、2、3、4、5、6、7、8、9或10个氨基酸。
[0123]
本技术的myc融合蛋白可以以任何期望的顺序排列。例如,在一些实施例中,myc融合蛋白可以按以下顺序排列:a)与myc多肽框内链接的蛋白质转导结构域,b)与v5结构域框内链接的myc多肽,和c)与6
‑
组氨酸表位标签框内链接的v5结构域。在一些实施例中,myc融合蛋白具有以下组分的顺序:a)与蛋白质转导结构域框内链接的myc多肽,b)与v5结构域框内链接的蛋白质转导结构域,和c)与6
‑
组氨酸表位标签框内链接的v5结构域。在一些实施例中,在每个序列之间可以包括一或多个额外的氨基酸序列或接头。在一些实施例中,额外的氨基酸可以被包括在多肽序列的开始和/或结束处。
[0124]
在一些实施例中,蛋白质转导结构域是tat蛋白质转导结构域。在一些实施例中,蛋白质转导结构域是tat
[48
‑
57]
。在一些实施例中,蛋白质转导结构域是tat
[57
‑
48]
。
[0125]
蛋白质标签结构域
[0126]
在一些实施例中,myc融合蛋白包含蛋白质标签结构域,所述蛋白质标签结构域包含一或多个促进融合蛋白的纯化的氨基酸序列。在一些实施例中,蛋白质标签结构域包含聚组氨酸标签和表位标签中的一或多种。作为示例,但不是作为限制,示例性的标签包括v5、组氨酸标签(例如,6
‑
组氨酸标签)、ha(血凝素)标签、flag标签、cbp(钙调蛋白结合肽)、cyd(共价但可解离的norpd肽)、strepll或hpc(蛋白质c的重链)中的一或多种。在一些实施例中,蛋白质标签结构域包含约10至约20个氨基酸的长度。在一些实施例中,蛋白质标签结构域包含2个氨基酸至40个氨基酸的长度,例如6
‑
20个氨基酸的长度。在一些实施例中,蛋白质标签结构域包含2个氨基酸、3个氨基酸、4个氨基酸、5个氨基酸、6个氨基酸、7个氨基酸、8个氨基酸、9个氨基酸、10个氨基酸、11个氨基酸、12个氨基酸、13个氨基酸、14个氨基酸、15个氨基酸、16个氨基酸、17个氨基酸、18个氨基酸、19个氨基酸、20个氨基酸、21个氨基酸、22个氨基酸、23个氨基酸、24个氨基酸、25个氨基酸、26个氨基酸、27个氨基酸、28个氨基酸、29个氨基酸、30个氨基酸、31个氨基酸、32个氨基酸、33个氨基酸、34个氨基酸、35个氨基酸、36个氨基酸、37个氨基酸、38个氨基酸、39个氨基酸或40个氨基酸。在一些实施例中,上面列出的标签中的两个(例如,v5和his标签)一起用于形成蛋白质标签结构域。
[0127]
在一些实施例中,组氨酸标签是6
‑
组氨酸标签。在一些实施例中,组氨酸标签包含序列hhhhhh(seq id no:8)。在一些实施例中,本文公开的融合多肽包含v5表位标签。在一些实施例中,v5标签包含gkpipnpllgldst(seq id no:9)的氨基酸序列。在一些实施例中,v5标签包含ipnpllgld(seq id no:10)的氨基酸序列。
[0128]
蛋白质标签可以通过任何合适的方法被添加到本文公开的融合蛋白中。作为示例,但不作为限制,在一些实施例中,将tat
‑
myc多肽序列克隆到编码一或多种蛋白质标签(例如聚his标签和/或v5标签)的表达载体中。在一些实施例中,通过pcr来添加聚组氨酸标签和/或v5标签(即,pcr引物包含聚组氨酸序列和/或v5序列)。
[0129]
ptd
‑
myc融合多肽的构建
[0130]
本文公开的ptd
‑
myc融合多肽(例如,tat
‑
myc融合多肽)可以通过本领域中熟知的方法来构建。作为示例,但不作为限制,编码tat
‑
myc融合多肽的核苷酸序列可以通过pcr产生。在一些实施例中,用于人myc序列的正向引物包含tat蛋白质转导结构域(例如rkkrrqrrr)的框内n末端9氨基酸序列。在一些实施例中,用于人myc序列的反向引物被设计成去除终止密码子。在一些实施例中,pcr产物被克隆到任何合适的表达载体中。在一些实施例中,表达载体包含聚组氨酸标签和v5标签。
[0131]
在一些实施例中,本文公开的融合多肽包含(a)tat和(b)c
‑
myc。在一些实施例中,本文公开的融合多肽包含(a)tat
[48
‑
57]
和(b)c
‑
myc。在一些实施例中,本文公开的融合多肽包含(a)tat
[57
‑
48]
和(b)c
‑
myc。
[0132]
在一些实施例中,本文公开的融合多肽包含(a)tat、(b)c
‑
myc、(c)接头、(d)v5标签和(e)6
‑
组氨酸标签。在一些实施例中,本文公开的融合多肽包含(a)tat
[48
‑
57]
、(b)c
‑
myc、(c)接头、(d)v5标签和(e)6
‑
组氨酸标签。在一些实施例中,本文公开的融合多肽包含(a)tat
[57
‑
48]
、(b)c
‑
myc、(c)接头、(d)v5标签和(e)6
‑
组氨酸标签。
[0133]
在一些实施例中,ptd
‑
myc融合多肽包含seq id no:1;在一些实施例中,ptd
‑
myc融合多肽是seq id no:1。
[0134][0135]
融合蛋白可以在合成期间或在合成之后被修饰以包括一或多个官能团。作为示例但不是作为限制,蛋白质可以被修饰以包括乙酰基、磷酸酯、乙酸酯、酰胺、烷基和/或甲基基团中的一或多种。这一列表并不旨在是穷举的,并且仅是示例性的。在一些实施例中,蛋白质包括至少一个乙酰基基团。
[0136]
ptd
‑
myc融合多肽可以通过本领域已知的任何合适方法产生,例如通过在细胞(如细菌细胞、昆虫细胞或哺乳动物细胞)中的重组蛋白表达。在一些实施例中,通过微生物发酵以重组方式产生ptd
‑
myc融合多肽。在一些实施例中,微生物发酵在约1至约10,000升的发酵体积(例如约10至约1000升的发酵体积)中进行。发酵可以利用任何合适的微生物宿主细胞和培养基。在示例性的实施例中,大肠杆菌被用作微生物宿主细胞。在替代的实施例中,可以使用其它微生物,例如酿酒酵母(s.cerevisiae)、毕赤酵母(p.pastoris)、乳酸杆菌(lactobacilli)、芽孢杆菌(bacilli)和曲霉(aspergilli)。在一个示例性的实施例中,微生物宿主细胞是bl
‑
21star
tm
大肠杆菌菌株(英杰公司(invitrogen))。在一个示例性的实施例中,微生物宿主细胞是blr de3大肠杆菌菌株。
[0137]
在一些实施例中,修饰宿主细胞以提供稀有密码子的trna,其用于克服宿主微生物细胞密码子偏向以改善所表达蛋白质的翻译。在示例性的实施例中,宿主细胞(例如大肠杆菌)用质粒转化,如prare(camr),其表达agg、aga、aua、cua、ccc、gga密码子的trna。用于为特定密码子提供trna的另外的合适的质粒或构建体是本领域已知的,并且可以用于所提供的方法中。
[0138]
整合的或自复制的载体可以用于将ptd
‑
myc融合多肽表达盒引入到所选宿主细胞中的目的。在表达盒中,ptd
‑
myc融合多肽的编码序列与启动子(如诱导型启动子)可操作地链接。诱导型启动子是响应于培养条件的一些变化(例如营养物的存在与否或温度的变化)从其控制下的dna启动增加水平的转录的启动子。在一些实施例中,编码ptd
‑
myc融合多肽的核酸被密码子优化以用于细菌表达。
[0139]
被多种潜在的宿主细胞识别的示例性启动子是熟知的。这些启动子可以通过限制性酶消化从源dna中去除启动子(如果存在的话)并将分离的启动子序列插入载体中而被可操作地链接到编码ptd
‑
myc融合多肽的dna上。适用于微生物宿主的启动子包括但不限于p
‑
内酰胺酶和乳糖启动子系统(常(chang)等人(1978)自然(nature),275:617
‑
624;格德尔(goeddel)等人(1979)自然,281:544)、碱性磷酸酶(一种色氨酸(trp)启动子系统)(格德尔(1980)核酸研究(nucleic acids res).8:4057;ep 36,776)和杂合启动子如tac启动子(德
波尔(deboer)等人.(1983)美国国家科学院院刊80:21
‑
25)。可以使用适合于由所选的宿主细胞表达的任何启动子。公布了适用的核苷酸序列,从而使技术人员能够使用接头或衔接子将它们可操作地连接到编码ptd
‑
myc融合多肽的dna上(参见,例如,西本利特(siebenlist)等人.(1980)细胞,20:269),以提供任何所需的限制性位点。在示例性的实施例中,用于细菌系统的启动子可以含有与编码序列可操作链接的夏因
‑
达尔加诺(shine
‑
dalgarno)(s.d.)序列。在一些实施例中,诱导型启动子是lacz启动子,其用异丙基β
‑
d
‑1‑
硫代半乳糖苷(iptg)诱导,如本领域中熟知的。启动子和表达盒也可以使用用于合成目标dna序列的熟知的技术从头合成。在一个示例性的实施例中,用于表达本文的ptd
‑
myc融合多肽的表达载体是pet101/d
‑
topo(英杰公司)。
[0140]
为了表达ptd
‑
myc融合多肽,含有编码ptd
‑
myc融合多肽的表达载体的微生物宿主通常在发酵反应器中生长至高密度。在一些实施例中,反应器具有葡萄糖的受控进料。在一些实施例中,发酵罐接种物首先在补充有抗生素的培养基中培养(例如,过夜培养)。然后使用发酵罐接种物来接种发酵罐培养物以用于表达蛋白质。在发酵罐培养物的至少约15、通常至少约20、至少25、至少约30或更高的od600下,诱导重组蛋白的表达。在其中诱导型启动子是lacz启动子的示例性实施例中,将iptg添加到发酵培养基中以诱导ptd
‑
myc融合多肽的表达。一般而言,在od600(其代表对数生长期)下将iptg添加到发酵罐培养物中。
[0141]
在所提供的方法的某些实施例中,诱导的蛋白表达在诱导后保持约2至约5小时,并且可以在诱导后约2至约3小时。由于重组蛋白的降解,较长的诱导期可能是不期望的。在诱导期间反应混合物的温度优选地为约28℃至约37℃,通常为约30℃至约37℃。在特定实施例中,诱导为约37℃。
[0142]
ptd
‑
myc融合多肽在微生物细胞中通常以胞质包涵体的形式表达。为了收获包涵体,在诱导后通过离心发酵培养物来收集细胞沉淀物,在
‑
70℃或更低温度下冷冻,解冻并重新悬浮在破碎缓冲液中。细胞通过常规的方法(例如超声处理、匀浆等)裂解。然后将裂解物重新悬浮在增溶缓冲液中,通常在尿素的存在下,尿素的浓度可有效溶解蛋白质,例如约5m、6m、7m、8m、9m或更高。重新悬浮可能需要机械破碎沉淀并搅拌以达到均匀性。在一些实施例中,将细胞沉淀物直接重新悬浮在尿素缓冲液中并混合直到均匀。在一些实施例中,重新悬浮/增溶缓冲液为8m尿素、50mm磷酸盐ph 7.5,并且使悬浮液通过均化器。
[0143]
在一些实施例中,均质化的悬浮液被磺酰化。例如,在一些实施例中,将均质化的悬浮液调节为包括200mm亚硫酸钠和10mm四硫代硫酸钠。然后在室温下混合溶液,直到均匀。然后将混合的裂解物混合持续额外的时间段以完成磺酰化(例如,在2
‑
8℃下持续≥12小时)。然后将磺酰化的裂解物离心1小时。然后通过离心来收集含有磺酰化的ptd
‑
myc融合多肽的上清液,并丢弃细胞沉淀物。然后使上清液通过过滤器,例如0.22μm膜过滤器,以澄清裂解物。
[0144]
然后纯化溶解的蛋白质。纯化方法可以包括亲和层析、反相层析、凝胶排阻层析等。在一些实施例中,使用亲和层析。例如,蛋白被提供有表位标签或组氨酸6标签以方便纯化。在本方法中,示例性的ptd
‑
myc融合多肽包含组氨酸6标签,用于使用ni亲和层析(使用ni树脂)进行纯化。
[0145]
在示例性的实施例中,ni树脂柱在包含尿素的缓冲液中平衡。在一些实施例中,平衡缓冲液是6m尿素、50mm磷酸盐、500mm的nacl和10%甘油溶液。然后将包含ptd
‑
myc融合多
肽的磺酰化的和澄清的上清液加载到ni树脂柱上。然后用洗涤缓冲液(例如,6m尿素,50mm磷酸盐,10%甘油,500mm的nacl,ph 7.5)洗涤柱。然后用盐浓度降低的顺序洗涤缓冲液洗涤柱。例如,示例性的后续洗涤可以包括6m尿素、50mm磷酸盐、10%甘油和2m的nacl(ph 7.5),随后是6m尿素、50mm磷酸盐、10%甘油、50mm的nacl和30mm咪唑(ph 7.5)的另一次洗涤。
[0146]
在连续应用洗涤缓冲液后,通过添加洗脱缓冲液(例如6m尿素、50mm磷酸盐、10%甘油和50mm的nacl,ph 7.5,梯度为100
‑
300mm咪唑)从柱中洗脱ptd
‑
myc融合多肽,并收集组分。然后通过0.22pm膜来过滤待汇集的含蛋白质的级分。蛋白质产量的评估可以使用任何合适的方法进行测量,例如,在uv波长280处使用分光光度法。
[0147]
在一些实施例中,可以采用一或多种另外的纯化方法来进一步纯化分离的ptd
‑
myc融合多肽。在示例性的实施例中,来自ni
‑
琼脂糖层析步骤的混合级分通过使用q
‑
琼脂糖树脂的阴离子交换色谱法被进一步纯化。在一些实施例中,通过使用来自ni琼脂糖层析步骤的第二种洗涤缓冲液(例如,6m尿素,50mm磷酸盐,10%甘油,2mnacl,ph 7.5)将样品稀释至q琼脂糖缓冲液的电导率(17.52+/
‑
1ms/cm)来制备池,以用于装载到q
‑
琼脂糖柱上。然后将稀释的池装载到q
‑
琼脂糖柱中,然后使用追踪缓冲液(chase buffer)(例如,6m尿素、50mm磷酸盐、300mm的nacl和10%甘油)进行两个追踪步骤,并进一步连续应用追踪缓冲液,直到uv迹线达到基线,从而表明蛋白质已从柱中洗脱。
[0148]
v.冷冻保存的方法
[0149]
如先前所提供的,本公开涉及用于冷冻保存免疫细胞的方法,其中所述方法包含:(a)使包含从供体受试者分离的一或多种免疫细胞的组合物与有效量的myc融合多肽接触,所述myc融合多肽包含(i)蛋白质转导结构域、(ii)myc多肽序列;以及将免疫细胞冷却至足以冷冻所述组合物的温度。本文提供了示例性的myc融合多肽。在一些实施例中,蛋白质转导结构域序列是tat蛋白质转导结构域序列。在一些实施例中,myc融合多肽包含seq id no:1。
[0150]
在一些实施例中,免疫细胞是外周血单核细胞(pbmc)。因此,本公开还涉及用于冷冻保存pbmc的方法,其中所述方法包含:(a)使包含从供体受试者分离的一或多种pbmc的组合物与有效量的myc融合多肽接触,所述myc融合多肽包含(i)蛋白质转导结构域、(ii)myc多肽序列;以及将pbmc冷却至足以冷冻所述组合物的温度。在一些实施例中,蛋白质转导结构域序列是tat蛋白质转导结构域序列。在一些实施例中,myc融合多肽包含seq id no:1。
[0151]
在所述方法的示例性实施例中,从供体受试者分离约30ml至约470ml的全血样品。因此,可以从供体受试者分离约30ml、约32ml、约34ml、约36ml、约38ml、约40ml、约42ml、约44ml、约46ml、约48ml、约50ml、约55ml、约60ml、约65ml、约70ml、约75ml、约80ml、约85ml、约90ml、约95ml、约100ml、约110ml、约120ml、约130ml、约140ml、约150ml、约160ml、约170ml、约180ml、约190ml、约200ml、约220ml、约240ml、约260ml、约280ml、约300ml、约320ml、约340ml、约360ml、约380ml、约400ml、约420ml、约440ml、约460ml、约470ml或其间的任何整数值的全血样品。在一些实施例中,然后立即用抗凝血剂如edta(约1.5%w/v)处理从供体受试者分离的全血样品。在一些实施例中,然后允许分离的全血样品在约20℃培育一段时间(例如,约1
‑
24小时),以允许样品将免疫细胞和/或pbmc与全血样品的其它组分(即,红细胞、血小板、血浆等)分离。在一些实施例中,使用密度梯度溶液(dgs)进行分离。在一些实施
例中,采用sepax
‑
100细胞处理系统(biosafe america inc.,德克萨斯州休斯顿(houston,tx))。分离的细胞可以在细胞分离过程其间洗涤一或多次,以去除残留的血液组分。在一些实施例中,细胞使用在盐水中的2.5%(w/v)hsa(人血清白蛋白)溶液来洗涤,然后重新悬浮在相同的洗涤溶液中以提供细胞悬浮液。
[0152]
在一些实施例中,细胞悬浮液的样品可以在用ptd
‑
myc融合多肽处理之前采集(阴性对照)。在一些实施例中,然后可以用例如约0.5μg/ml至约500μg/ml的浓度的ptd
‑
myc融合多肽处理悬浮液中的剩余细胞。在一些实施例中,处理的和未处理的(阴性对照)样品然后可以在室温下培育适当的时间,例如约1小时。
[0153]
在一些实施例中,使免疫细胞(例如pbmc)与有效量的ptd
‑
myc融合多肽接触持续足以在冷冻前被细胞摄取的时间段。在一些实施例中,使免疫细胞与有效量的ptd
‑
myc接触少于约24小时、少于约23小时、少于约22小时、少于约21小时、少于约20小时、少于约19小时、少于约18小时、少于约17小时、少于约16小时、少于约15小时、少于约14小时、少于约13小时、少于约12小时、少于约11小时、少于约10小时、少于约9小时、少于约8小时、少于约7小时、少于约6小时、少于约5小时、少于约4小时、少于约3小时、少于约2小时、少于约1小时、少于约45分钟、少于约30分钟、少于约15分钟或少于约10分钟。在一些实施例中,使免疫细胞(例如pbmc)与有效量的ptd
‑
myc融合多肽接触约1小时。
[0154]
在一些实施例中,使免疫细胞(例如,pbmc)与浓度为约0.5μg/ml至约500μg/ml的ptd
‑
myc融合多肽接触。在可以与前述实施例中任一个组合的一些实施例中,使细胞与浓度为至少0.5μg/ml、至少0.6μg/ml、至少0.7μg/ml、至少0.8μg/ml、至少0.9μg/ml、至少1μg/ml、至少2μg/ml、至少3μg/ml、至少4μg/ml、至少5μg/ml、至少6μg/ml、至少7μg/ml、至少8μg/ml、至少9μg/ml、至少10μg/ml、至少15μg/ml、至少20μg/ml、至少25μg/ml、至少30μg/ml、至少35μg/ml、至少40μg/ml、至少45μg/ml、至少50μg/ml、至少55μg/ml、至少60μg/ml、至少65μg/ml、至少70μg/ml、至少75μg/ml、至少80μg/ml、至少85μg/ml、至少90μg/ml、至少95μg/ml、至少100μg/ml、至少110μg/ml、至少120μg/ml、至少130μg/ml、至少140μg/ml、至少150μg/ml、至少160μg/ml、至少170μg/ml、至少180μg/ml、至少190μg/ml、至少200μg/ml、至少220μg/ml、至少240μg/ml、至少260μg/ml、至少280μg/ml、至少300μg/ml、至少320μg/ml、至少340μg/ml、至少360μg/ml、至少380μg/ml、至少400μg/ml、至少420μg/ml、至少440μg/ml、至少460μg/ml、至少480μg/ml、至少500μg/ml或其间的任何整数值的ptd
‑
myc融合多肽接触。
[0155]
在与tat
‑
myc多肽培育后,处理的免疫细胞和/或处理的pbmc(tbx
‑
3400)然后可以重新洗涤(例如,在sepax
‑
100上)一或多次,以用洗涤溶液(例如,2.5%(w/v)hsa溶液)从细胞中去除过量的ptd
‑
myc。在最后的洗涤步骤之后,处理的细胞可以例如以约0.5
×
106个细胞/ml至约1
×
108个细胞/ml的浓度重新悬浮。在一些实施例中,处理的细胞可以以约0.5
×
106个细胞/ml、约0.6
×
106个细胞/ml、约0.7
×
106个细胞/ml、约0.8
×
106个细胞/ml、约0.9
×
106个细胞/ml、约1
×
106个细胞/ml、约1.1
×
106个细胞/ml、约1.2
×
106个细胞/ml、约1.3
×
106个细胞/ml、约1.4
×
106个细胞/ml、约1.5
×
106个细胞/ml、约1.6
×
106个细胞/ml、约1.7
×
106个细胞/ml、约1.8
×
106个细胞/ml、约1.9
×
106个细胞/ml、约2
×
106个细胞/ml、约2.2
×
106个细胞/ml、约2.4
×
106个细胞/ml、约2.6
×
106个细胞/ml、约2.8
×
106个细胞/ml、约3
×
106个细胞/ml、约3.2
×
106个细胞/ml、约3.4
×
106个细胞/ml、约3.6
×
106个细胞/ml、约3.8
×
106个细胞/ml、约4
×
106个细胞/ml、约4.2
×
106个细胞/ml、约4.4
×
106个细胞/ml、
约4.6
×
106个细胞/ml、约4.8
×
106个细胞/ml、约5
×
106个细胞/ml、约5.5
×
106个细胞/ml、约6
×
106个细胞/ml、约6.5
×
106个细胞/ml、约7
×
106个细胞/ml、约7.5
×
106个细胞/ml、约8
×
106个细胞/ml、约8.5
×
106个细胞/ml、约9
×
106个细胞/ml、约9.5
×
106个细胞/ml、约1
×
107个细胞/ml、约1.1
×
107个细胞/ml、约1.2
×
107个细胞/ml、约1.3
×
107个细胞/ml、约1.4
×
107个细胞/ml、约1.5
×
107个细胞/ml、约1.6
×
107个细胞/ml、约1.7
×
107个细胞/ml、约1.8
×
107个细胞/ml、约1.9
×
107个细胞/ml、约2
×
107个细胞/ml、约2.2
×
107个细胞/ml、约2.4
×
107个细胞/ml、约2.6
×
107个细胞/ml、约2.8
×
107个细胞/ml、约3
×
107个细胞/ml、约3.2
×
107个细胞/ml、约3.4
×
107个细胞/ml、约3.6
×
107个细胞/ml、约3.8
×
107个细胞/ml、约4
×
107个细胞/ml、约4.2
×
107个细胞/ml、约4.4
×
107个细胞/ml、约4.6
×
107个细胞/ml、约4.8
×
107个细胞/ml、约5
×
107个细胞/ml、约5.5
×
107个细胞/ml、约6
×
107个细胞/ml、约6.5
×
107个细胞/ml、约7
×
107个细胞/ml、约7.5
×
107个细胞/ml、约8
×
107个细胞/ml、约8.5
×
107个细胞/ml、约9
×
107个细胞/ml、约9.5
×
107个细胞/ml、约1
×
108个细胞/ml或其间的任何整数值的浓度被重新悬浮。
[0156]
在用ptd
‑
myc进行细胞处理后,可以将处理的细胞离心并以预定的浓度(细胞/ml)重新悬浮。在一些实施例中,将细胞重新悬浮在合适的冷冻培养基中。在一些实施例中,细胞悬浮液培养基选自chb培养基、cs10培养基或cs5培养基。chb培养基是一种细胞悬浮液培养基,其含有50%(v/v)的胎牛血清(fbs)、40%(v/v)的rpmi细胞培养基和10%(v/v)的二甲基亚砜(dmso)。cs10培养基(biolife solutions,inc.,华盛顿州博塞尔(bothell,wa))是一种含有10%(v/v)dmso的细胞培养基,并且基本上不含动物组分或血清。cs5(biolife solutions,inc.)培养基是一种包含5%(v/v)dmso的细胞培养基,并且基本上不含动物组分或血清。
[0157]
然后可以将重新悬浮的经ptd
‑
myc处理的细胞装瓶并低温冷冻。包含经ptd
‑
myc处理的细胞的组合物可以通过本领域已知的任何方法低温冷冻。例如,包含经ptd
‑
myc处理的细胞的组合物可以通过将受控的冷却提供至所需温度的方法进行低温冷冻。在一些实施例中,使用受控速率低温冷冻机来冷却包含经ptd
‑
myc处理的免疫细胞(例如,pbmc)的组合物。在一些实施例中,以约
‑
1℃/分钟的速率来冷却包含经ptd
‑
myc处理的免疫细胞(例如,pbmc)的组合物。
[0158]
在一些实施例中,足以冷冻组合物的温度是约
‑
80℃至约
‑
190℃。在一些实施例中,足以冷冻所述组合物的温度为约
‑
80℃、约
‑
82℃、约
‑
84℃、约
‑
86℃、约
‑
88℃、约
‑
90℃、约
‑
92℃、约
‑
94℃、约
‑
96℃、约
‑
98℃、约
‑
100℃、约
‑
105℃、约
‑
110℃、约
‑
115℃、约
‑
120℃、约
‑
125℃、约
‑
130℃、约
‑
135℃、约
‑
140℃、约
‑
145℃、约
‑
150℃、约
‑
155℃、约
‑
160℃、约
‑
165℃、约
‑
170℃、约
‑
175℃、约
‑
180℃、约
‑
185℃、约
‑
190℃或其间的任何整数值。
[0159]
在一些实施例中,经ptd
‑
myc处理的细胞经由装载到细胞冷冻容器(biocision)中被低温冷冻,然后在
‑
80℃下培育。提供约
‑
1℃/分钟的冷却速率。在一些实施例中,tbx
‑
3400和对照细胞经由装载到via freeze
tm
系统(ge healthcare life sciences,宾夕法尼亚州匹兹堡(pittsburgh,pa))中以
‑
1℃/分钟的冷却速率被低温冷冻,直到温度达到
‑
80℃。在细胞样品的冷冻保存后,可以将样品转移到
‑
190℃的液氮冷冻机中,在那里样品可以储存在液氮的气相中。
[0160]
在本文提供的方法的一些实施例中,从供体受试者分离的一或多种免疫细胞(例
如,pbmc)可以在分离后立即用抗凝血剂处理。在一些实施例中,从供体受试者分离的一或多种免疫细胞(例如pbmc)可以在分离后立即用ptd
‑
myc融合多肽处理。在其它实施例中,在用ptd
‑
myc融合多肽处理之前,可以将从供体受试者分离的一或多种免疫细胞储存在合适的缓冲液中。在一些实施例中,从供体受试者分离的一或多种免疫细胞可以在分离后立即用ptd
‑
myc融合多肽处理,并且处理的细胞在冷冻前被储存在合适的缓冲液中。
[0161]
在一些实施例中,抗凝剂可以是乙二胺四乙酸(edta)、肝素、华法林、利伐沙班(rivaroxaban)、达比加群(dabigatran)、阿哌沙班(apixaban)、依杜沙班(edoxaban)、依诺肝素(enoxaparin)、磺达肝癸钠(fondaparinux)、酸性柠檬酸盐葡萄糖(acd
‑
a)、柠檬酸钠、草酸盐、柠檬酸盐磷酸双葡萄糖(cp2d)或其任意组合中的一或多种。
[0162]
在一些实施例中,一或多种外周血单核细胞(pbmc)可以是t细胞、b细胞、nk细胞、单核细胞、粒细胞、巨噬细胞或其任意组合。在一些实施例中,从供体受试者分离的一或多种免疫细胞可以包括b细胞、t细胞、自然杀伤(nk)细胞、骨髓细胞或其任意组合。在一些实施例中,从供体受试者分离的一或多种骨髓细胞可以包括单核细胞、巨噬细胞、树突细胞、嗜酸性粒细胞、嗜中性粒细胞、肥大细胞、嗜碱性粒细胞、粒细胞或其任意组合。
[0163]
在一些实施例中,从供体受试者分离的一或多种b细胞可以包括前b细胞、祖b细胞、早期前b细胞、晚期前b细胞、大的前b细胞、小的前b细胞、未成熟b细胞、成熟b细胞、幼稚b细胞、血浆b细胞、活化的b细胞、无能b细胞、耐受b细胞、嵌合b细胞、抗原特异性b细胞、记忆b细胞、b
‑
1细胞、b
‑
2细胞、无能an1/t3细胞群或其两种或更多种的组合。
[0164]
在一些实施例中,从供体受试者分离的一或多种t细胞可以包括幼稚t细胞、cd4+t细胞、cd8+t细胞、记忆t细胞、活化的t细胞、无能t细胞、耐受t细胞、嵌合t细胞和抗原特异性t细胞、调节性t细胞或其任意组合。
[0165]
在一些实施例中,所述方法进一步包含解冻所述冷冻保存的细胞,使得与不与有效量的myc融合多肽接触的对照pbmc相比,所述细胞表现出增加的细胞存活率、增加的细胞恢复或在细胞活化后增加的cd25表达中的一或多种。
[0166]
在一些实施例中,在解冻所述冷冻保存的细胞后,可以评估免疫细胞的存活率和/或被活化的能力。例如,可以评估淋巴细胞通过刺激的活化或通过诱导免疫细胞活化的单一试剂的活化。在另一个实施例中,在解冻所述冷冻保存的细胞后,可以用两种药剂(一种药剂诱导初级信号,而第二种药剂是共刺激信号)来刺激或活化免疫细胞。可用于刺激单一信号或刺激初级信号的配体和刺激第二信号的辅助分子可以以可溶形式使用。配体可以附着于细胞的表面、工程改造的多价信号传导平台(emsp)或固定于表面。在一个实施例中,初级药剂和次级药剂都被共固定在表面(例如珠或细胞)上。在一些实施例中,通过单一药剂提供活化信号的分子可以是cd3配体。在一些实施例中,提供初级活化信号的分子可以是cd3配体,并且共刺激分子可以是cd28配体。
[0167]
在一些实施例中,所述方法进一步包含解冻所述冷冻保存的细胞,使得与不与有效量的myc融合多肽接触的对照pbmc相比,所述细胞表现出增加的细胞存活率、增加的细胞恢复、细胞活化或在细胞活化后增加的cd25表达中的一或多种。
[0168]
vi.免疫细胞库
[0169]
在一些实施例中,本公开涉及用于建立免疫细胞库的方法。如实例6(表2和3)所示,与本技术的myc融合多肽接触的pbmc被成功地冷冻保存,而不丧失活力。这有助于建立
可以储存并在以后使用的免疫细胞的细胞库,从而为免疫疗法提供后勤优势,并且使免疫细胞能够容易地用于过继细胞转移。
[0170]
vii.试剂盒
[0171]
根据该实施例的试剂盒可以包含载体装置,如盒、纸盒、管,其中具有紧密限制的一或多个容器,如小瓶、管、安瓿、瓶、注射器或袋。试剂盒还可以包含使用本技术的myc
‑
融合多肽、myc
‑
融合多肽修饰的免疫细胞和/或冷冻组合物的相关说明。在一些实施例中,所述试剂盒包含有效量的过继细胞疗法,如myc
‑
融合多肽修饰的免疫细胞。在一些实施例中,所述试剂盒包含一或多种用于检测所施用的myc
‑
融合多肽和/或myc
‑
融合多肽修饰的免疫细胞的试剂。
[0172]
实例
[0173]
通过以下实例来进一步说明本技术,这些实例不应被理解为以任何方式进行限制。本文提供了实例以说明本技术的优点,并进一步帮助本领域普通技术人员制备或使用本技术的组合物和系统。这些实例决不应被解释为限制如由所附权利要求所限定的本技术的范围。这些实例可以包括或并入上述本技术的任何变化、方面或实施例。上述变化、方面或实施例还可以进一步各自包括或并入本技术的任何或所有其它变化、方面或实施例的变化。
[0174]
实例1:材料和方法
[0175]
外周血单核细胞(pbmc)的活化。24孔板用在无菌dpbs中的抗cd3e抗体的溶液(500μl,5μg/ml;bd生物科学)包被。对于对照孔,仅添加500μl的dpbs。在移除溶液之前,允许板在4℃下培育过夜。然后用2ml的无菌dpbs洗涤每个孔两次。然后将细胞以2
×
106个细胞/ml的浓度重新悬浮在完全rpmi培养基(crpmi)中,并且随后用1ml的dpbs洗涤。然后,根据板布局向每个孔中加入1.0ml的细胞悬浮液。接下来,抗cd28抗体的溶液(100μl,200μg/ml;bd生物科学)在crpmi中制备,并且连续地稀释10倍以制备cd28抗体在crpmi中的两种贮备溶液(20μg/ml和2μg/ml)。然后,向指定的孔中加入10μl适当的cd28抗体溶液或dpbs(对照或单独活化的细胞)。然后将测定板在37℃、5%co2下培育48或72小时,然后用适当的抗体(抗人cd25
‑
pe,bd生物科学)染色,以便通过facs分析活化可视化。
[0176]
实例2:在用tat
‑
myc治疗后免疫细胞和/或pbmc的改进的冷冻保存
[0177]
在本实例中,从人类供体受试者中分离全血样品(450
‑
470ml),并与血液抗凝剂乙二胺四乙酸(edta,约1.5%w/v)混合。在允许细胞约20℃下培育至少24小时后,然后在sepax
‑
100细胞处理系统(biosafe america inc.,德克萨斯州休斯顿)上使用密度梯度溶液(dgs)将全血样品分离成外周血单核细胞(pbmc)和废物(即,红细胞、血小板、血浆等)。在细胞分离工艺期间,用2.5%(w/v)的hsa(人血清白蛋白)盐水溶液洗涤pbmc两次。在清洗步骤后,将pbmc以13.6
×
106个细胞/ml的浓度重新悬浮在2.5%(w/v)hsa溶液中,以提供细胞悬浮液。
[0178]
在细胞分离工艺后,在处理前从细胞悬浮液中取出pbmc的样品(阴性对照),并用tat
‑
myc融合蛋白(25μg/ml)处理细胞悬浮液中的剩余细胞,并且在室温下培育1小时。然后,将处理的pbmc(被称为tbx
‑
3400)在sepax
‑
100上再次洗涤,并用2.5%(w/v)的hsa溶液洗掉细胞中过量的tat
‑
myc。在最后一步洗涤步骤后,将tbx
‑
3400以2.7
×
106个细胞/ml的浓度重新悬浮在2.5%(w/v)hsa溶液中。
[0179]
在用tat
‑
myc进行细胞处理后,将对照pbmc和tbx
‑
3400离心并以预定浓度(细胞/ml)重新悬浮在三种细胞悬浮液培养基之一中:chb培养基、cs10培养基或cs5培养基。chb培养基是一种细胞悬浮液培养基,其含有50%(v/v)的胎牛血清(fbs)、40%(v/v)的rpmi细胞培养基和10%(v/v)的二甲基亚砜(dmso)。cs10培养基(biolife solutions,inc.)是一种包含10%(v/v)dmso的细胞培养基,并且基本上不含动物组分或血清。cs5培养基(biolife solutions,inc.)是一种包含5%(v/v)dmso的细胞培养基,并且基本上不含动物组分或血清。
[0180]
然后经由两种方法之一将重新悬浮的tbx
‑
3400和对照pbmc进行装瓶并低温冷冻。在第一种方法中,将低温小瓶(含有对照pbmc或tbx
‑
3400)装入细胞冷冻容器(biocision)中,然后在
‑
80℃下培育。将样品在
‑
80℃的细胞冷冻容器(其提供1℃/分钟的冷却速率)中培育24小时。在冷冻后,将样品储存在
‑
190℃的液氮冷冻机的气相中。在第二种方法中,将低温小瓶(含有对照pbmc或tbx
‑
3400)装入via freeze
tm
系统(ge healthcare life sciences,宾夕法尼亚州匹兹堡)中,其中冷却速率为
‑
1℃/分钟,直到温度达到
‑
80℃。在冷冻后,将样品然后储存在
‑
190℃的液氮冷冻机的气相中。
[0181]
将对照pbmc样品悬浮在三种培养基(chb培养基、cs10培养基和/或cs5培养基)中的每一种中,然后分成待经由细胞冷冻容器或via freeze
tm
系统冷冻的单独的样品。将tbx
‑
3400样品悬浮在三种培养基(chb培养基、cs10培养基和/或cs5培养基)中的每一种中,然后经由细胞冷冻容器冷冻。
[0182]
实例3:在解冻用tat
‑
myc处理的冷冻保存的pbmc后,提高的细胞存活率和细胞恢复
[0183]
在该实例中,通过流式细胞术来测定对照pbmc和tbx
‑
3400的细胞存活率和恢复。简言之,在冷冻保存前和在解冻冷冻保存的细胞后进行细胞计数。简言之,将冷冻的和/或冷冻保存的细胞在水浴(37℃)或via解冻系统(ge healthcare life sciences)中快速解冻。然后将解冻的细胞悬浮液转移到50ml锥形管中,并且将细胞悬浮液用crpmi逐滴稀释(用于渗透平衡),然后用crpmi缓慢稀释直至约10ml至约30ml。然后将细胞悬浮液在20℃下以160
‑
400rcf离心10分钟,并重新悬浮在10ml的crpmi中。然后将细胞在37℃、5%co2下培育过夜。
[0184]
为了确定细胞的存活率,将含有1
×
106个细胞/ml的细胞悬浮液的样品转移到微量离心管中,并以2,000rpm沉淀5分钟。然后将细胞沉淀物重新悬浮在dpbs中,并加入5μl的7
‑
氨基放线菌素d(7
‑
aad)。在室温下在黑暗中培育10分钟后,经由流式细胞术分析样品,以确定冷冻保存后的细胞存活率。图1表明,在用ptd
‑
myc融合多肽处理后,tbx
‑
3400在冷冻保存后显示出细胞存活率的显著增加。
[0185]
为了确定细胞恢复,用血细胞计数器进行细胞计数。简言之,含有1
×
106个细胞/ml的细胞悬浮液的样品用rbc裂解缓冲液进行裂解,并且允许在室温下培育。然后将细胞悬浮液与台盼蓝染色剂(1:1)混合,并且用血细胞计数器计数细胞。图2示出了在cs5细胞悬浮液培养基中冷冻保存并且使用细胞冷冻容器冷冻的tbx
‑
3400显示出约95%的活细胞的恢复,而在chb或cs5细胞悬浮液培养基中冷冻保存的tbx
‑
3400分别显示出约45%和40%的恢复。
[0186]
因此,这些结果表明,与不与有效量的myc融合多肽接触的对照pbmc相比,本文公
开的组合物和方法显示出增加的细胞存活率和/或增加的细胞恢复。
[0187]
实例4:在用tat
‑
myc处理后分离的pbmc的细胞群体的确定
[0188]
在本实例中,通过流式细胞术来确定分离的外周血单核细胞(pbmc)的群体。简言之,将含有至少3
×
106个细胞/ml的细胞悬浮液以1,600rpm离心5分钟,以沉淀细胞。然后用dpbs洗涤细胞l次,并以1
×
106个细胞/ml的浓度重新悬浮。然后,向细胞悬浮液中加入1μl/ml新制备的live/dead可固定近ir死细胞染料。通过向一小瓶live/dead可固定近ir死细胞染料(thermofisher scientific,马萨诸塞州沃尔瑟姆)中加入50μl的dmso来制备染料。然后在室温下将细胞在黑暗中培育约30分钟。在用dpbs洗涤1次后,将细胞在1%的bsa或dpbs中重新悬浮至1
×
106个细胞/ml的最终浓度。
[0189]
此外,将细胞悬浮液转移到三个染色管中,并用如表1所示的适当抗体染色。然后允许染色管在室温下在黑暗中培育20分钟。在培育后,向每个管中加入0.1ml的optilyse b(beckman coulter)染色溶液,然后。在培育后,经由流式细胞术来分析样品以确定pbmc的群体(图3)。
[0190]
表1.用抗体染色。
[0191]
管抗体1(每管体积)抗体2(每管体积)抗体3(每管体积)抗体4(每管体积)1没有一个没有一个没有一个没有一个2cd45
‑
fitc(20μl)cd19
‑
pe(20μl)cd3
‑
apc(20μl)cd56
‑
pc7(20μl)3cd45
‑
fitc(20μl)cd 15
‑
pe(20μl)cd14
‑
apc(20μl)没有一个
[0192]
实例5:在解冻用tat
‑
myc处理的冷冻保存的免疫细胞和/或pbmc后改善的细胞活化
[0193]
在本实例中,使用一种活化剂或两种共活化剂通过流式细胞术来确定对照pbmc和tbx
‑
3400的细胞活化。简言之,在冷冻保存的对照pbmc或tbx
‑
3400细胞的解冻后,将细胞以2
×
106个细胞/ml的浓度悬浮在crpmi中,并将1ml的细胞悬浮液加入到包被有抗cd3抗体的24孔板中。此外,向指定的孔中加入10μl的在crpmi中的cd28抗体(20μg/ml),然后在37℃、5%co2下培育72小时。在培育后,将样品充分混合,并用cd25
‑
fitc抗体染色。在培育后,将样品转移至facs管中,并经由流式细胞术进行分析,以确定在单独的cd3或与cd28组合的情况下的细胞活化(图4)。
[0194]
此外,在使用一种活化剂或两种共活化剂通过流式细胞术对对照pbmc和tbx
‑
3400进行细胞活化之后,确定cd25阳性细胞的级分。在用cd3和/或cd28的细胞活化后,将样品充分混合,并用cd25
‑
fitc(beckman coulter)染色。图5示出了在对照pbmc和tbx
‑
3400的细胞活化之后如通过流式细胞术确定的cd25阳性细胞的级分,所述对照pbmc和tbx
‑
3400先前已经被低温冷冻并且随后解冻。
[0195]
因此,这些结果证明,与不与有效量的myc融合多肽接触的对照pbmc相比,本文公开的组合物和方法在细胞活化后表现出增加的细胞活化和/或增加的cd25表达。
[0196]
实例6:用tat
‑
myc处理的pbmc的稳定性
[0197]
在本实例中,通过流式细胞术来确定tbx
‑
3400的稳定性。在冷冻前/冷冻保存前和解冻后测量了五个不同pbmc批次的总有核细胞(tnf)计数和存活率,这些批次在≤
‑
70℃或≤
‑
150℃下储存持续在24小时(24h)至42天(42d)范围内的存储时间。简言之,将冷冻的和/或冷冻保存的细胞在水浴(37℃)或via解冻系统(ge healthcare life sciences)中快速
解冻。然后将解冻的细胞悬浮液转移到50ml锥形管中,并且将细胞悬浮液用crpmi逐滴稀释(用于渗透平衡),然后用crpmi缓慢稀释直至约10ml至约30ml。然后将细胞悬浮液在20℃下以160
‑
400rcf离心10分钟,并重新悬浮在10ml的crpmi中。然后将细胞在37℃、5%co2下培育过夜。
[0198]
为了确定细胞的存活率,将含有1
×
106个细胞/ml的细胞悬浮液的样品转移到微量离心管中,并以2,000rpm沉淀5分钟。然后将细胞沉淀物重新悬浮在dpbs中,并加入5μl的7
‑
氨基放线菌素d(7
‑
aad)。在室温下在黑暗中培育10分钟后,经由流式细胞术分析样品,以确定冷冻保存后的细胞存活率。
[0199]
使用血细胞计数器进行细胞计数。简言之,含有1
×
106个细胞/ml的细胞悬浮液的样品用rbc裂解缓冲液进行裂解,并且允许在室温下培育。然后将细胞悬浮液与台盼蓝染色剂(1:1)混合,并且用血细胞计数器计数细胞。
[0200]
如表2所示,本技术的myc融合多肽可有效地作为pbmc的长期保存的冷冻保护剂,并且如表3所示,myc融合多肽可有效地维持pbmc在环境温度下的解冻后稳定性。储存的持续时间对tnc的恢复或tnc的存活率没有影响(表2)。
[0201]
表2.冷冻保存的tbx
‑
3400稳定性。
[0202][0203]
表3.冷冻保存的tbx
‑
3400稳定性
‑
在环境温度下的解冻后稳定性
[0204][0205]
因此,这些结果证明本文公开的组合物可用于长期储存免疫细胞的方法和免疫细胞库的方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1