用于药物递送的离子液体
用于药物递送的离子液体
1.相关申请的交叉引用
2.根据35 u.s.c.
§
119(e),本技术要求2019年4月3日提交的美国临时申请no.62/828,539的权益,以引用的方式将其内容整体并入本文。
3.序列表
4.本技术包含序列表,所述序列表已经以ascii格式电子提交,并且在此处以引用的方式将其整体并入本文。所述ascii副本创建于2020年3月24日,命名为002806-094500wopt_sl.txt,大小为2,891字节。
技术领域
5.本文所述技术涉及用于稳定和递送活性化合物的离子液体。
背景技术:
6.通过在溶剂中递送化合物可改善许多活性化合物(例如药物活性化合物)的摄取。然而,这种方法通常不适合在体内使用,因为大多数此类溶剂表现出毒性副作用和/或对递送点起刺激物作用。这些毒性和刺激作用严重到足以减缓活性化合物的性能或摄取的任何增加。
技术实现要素:
7.如本文所证明的,本发明人已经识别出了提供令人惊讶的优越活性化合物摄取动力学的离子液体的特性。因此,本文描述了与这些具有出乎意料的高功效的离子液体(il)相关的组合物和方法。
8.在任何实施方式的一个方面,本文描述的是给予至少一种活性化合物的方法,所述方法包括与至少一种离子液体(il)组合给予活性化合物,所述离子液体(il)包含:i)疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及,ii)阳离子,所述阳离子包括季铵。在任何实施方式的一个方面,本文描述的是用于药物递送方法的至少一种活性化合物和至少一种离子液体的组合,所述离子液体包含:i)疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及,ii)阳离子,所述阳离子包括季铵。
9.在任何实施方式的一个方面,本文描述的是在有需要的受试者中减少体重/减少体重增加或治疗肥胖症、糖尿病、溃疡、癌症或纤维化的方法,所述方法包括向受试者给予包含至少一种离子液体的组合物,所述离子液体包含:i)疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及,ii)阳离子,所述阳离子包括季铵。在任何实施方式的一个方面,本文描述的是包含至少一种离子液体的组合物,所述离子液体包含:i)疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及,ii)阳离子,所述阳离子包括季铵,所述组合物用于在有需要的受试者中减少体重/减少体重增加或治疗肥胖症、糖尿病、溃疡、癌症或纤维化的方法。在一些实施方式中,
不向受试者给予除所述至少一种离子液体之外的治疗剂或活性化合物,和/或组合物不包含除所述至少一种离子液体之外的治疗剂或活性化合物。在一些实施方式中,向受试者给予(例如,以与所述至少一种il相同的制剂或以单独的制剂)除所述至少一种离子液体之外的治疗剂或活性化合物,和/或组合物还包含除所述至少一种离子液体之外的治疗剂或活性化合物。
10.在一个方面,本文提供包含至少一种离子液体的组合物,所述离子液体包含:i)疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及,ii)阳离子,所述阳离子包括季铵。在一些实施方式中,所述组合物还包含与至少一种离子液体组合的治疗剂或活性化合物。
11.在任何方面的一些实施方式中,阴离子具有至少4.5的pka。在任何方面的一些实施方式中,阴离子具有至少5.0的pka。在任何方面的一些实施方式中,阴离子具有至少2.0的logp。在任何方面的一些实施方式中,阴离子具有至少2.5的logp。在任何方面的一些实施方式中,阴离子具有至少2.75的logp。
12.在任何方面的一些实施方式中,阴离子包含至少8个碳的碳链骨架。在任何方面的一些实施方式中,阴离子为烯烃。在任何方面的一些实施方式中,阴离子为香叶酸(geranic acid)、辛酸或香茅酸(citronellic acid)。
13.在任何方面的一些实施方式中,阳离子具有等于或大于胆碱(choline)的摩尔质量。在任何方面的一些实施方式中,阳离子具有大于胆碱的摩尔质量。在任何方面的一些实施方式中,季铵具有nr
4+
结构且至少一个r基团包含羟基。在任何方面的一些实施方式中,季铵具有nr
4+
结构,且仅一个r基团包含羟基。在任何方面的一些实施方式中,阳离子为c1、c6或c7。
14.在任何方面的一些实施方式中,阳离子选自胆碱、c1、c6和c7,且阴离子为香茅酸。在任何方面的一些实施方式中,阳离子为c1,且阴离子为香茅酸。在任何方面的一些实施方式中,阳离子选自c1、c6和c7,且阴离子为香叶酸。在任何方面的一些实施方式中,离子液体为胆碱:香茅酸、c1:香叶酸或c1:香茅酸。在任何方面的一些实施方式中,离子液体不是cage。
15.在任何方面的一些实施方式中,如通过核欧佛豪瑟效应频谱(nuclear overhauser effect spectroscopy,noesy)所测量的,离子液体具有小于20、小于10或小于5个的交叉峰。
16.在任何方面的一些实施方式中,给予是经皮给予。在任何方面的一些实施方式中,给予为经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。在任何方面的一些实施方式中,将所述组合物或组合配制用于经皮给予。在任何方面的一些实施方式中,将所述组合物或组合配制用于经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。
17.在任何方面的一些实施方式中,粘膜为鼻粘膜、口腔粘膜或阴道粘膜。
18.在任何方面的一些实施方式中,离子液体的浓度为至少0.1%w/v。
19.在任何方面的一些实施方式中,离子液体的浓度为约10%w/v至约70%w/v。在任何方面的一些实施方式中,离子液体的浓度为约30%w/v至约50%w/v。在任何方面的一些实施方式中,离子液体的浓度为约30%w/v至约40%w/v。在任何方面的一些实施方式中,离
子液体包含比例为约2:1至约1:10的阳离子与阴离子。在任何方面的一些实施方式中,离子液体包含比例为约1:1至约1:4的阳离子与阴离子。在任何方面的一些实施方式中,离子液体包含比例为约1:2的阳离子与阴离子。在任何方面的一些实施方式中,离子液体具有小于1:1的阳离子:阴离子比例。在任何方面的一些实施方式中,离子液体具有包括过量阴离子的阳离子:阴离子比例。
20.在任何方面的一些实施方式中,活性化合物是疏水性的。在任何方面的一些实施方式中,活性化合物是亲水性的。在任何方面的一些实施方式中,活性化合物包括多肽。在任何方面的一些实施方式中,活性化合物具有大于450的分子量。在任何方面的一些实施方式中,活性化合物具有大于500的分子量。在任何方面的一些实施方式中,活性化合物包括抗体或抗体试剂。在任何方面的一些实施方式中,活性化合物包括胰岛素、阿卡波糖(acarbose)、鲁索替尼(ruxolitinib)或glp-1多肽或其模拟物或类似物。
21.在任何方面的一些实施方式中,给予一次组合和/或组合物。在任何方面的一些实施方式中,以多剂量给予组合和/或组合物。在任何方面的一些实施方式中,以1-20mg/kg的剂量提供活性化合物和/或组合物。
22.在任何方面的一些实施方式中,活性化合物和离子液体还与至少一种非离子表面活性剂组合。在任何方面的一些实施方式中,组合和/或组合物还包含另外的药学上可接受的载体。在任何方面的一些实施方式中,所述给予为口服给予,并且组合和/或组合物以可降解胶囊提供。在任何方面的一些实施方式中,组合为掺和物(admixture)。在任何方面的一些实施方式中,组合和/或组合物以一种或多种纳米颗粒提供。在任何方面的一些实施方式中,组合以包含所述活性化合物的一种或多种纳米颗粒的形式提供,在包含所述离子液体的组合物中,所述纳米颗粒处于溶液或混悬液中。
附图说明
23.图1a描绘了胆碱和香叶酸的化学结构。图1b描绘了以1:2的摩尔比通过香叶酸与胆碱碳酸氢盐的盐置换作用制备的cage。
24.图2描绘了本研究中评估的两种药物:阿卡波糖和鲁索替尼。阿卡波糖被用作模型亲水性药物(mw:646,logp:-6.8),而鲁索替尼被用作模型疏水性药物(mw:306,logp:2.9)。
25.图3描绘了在局部施用后从各种cage组合物递送到和穿过皮肤的阿卡波糖或鲁索替尼的量。两种药物均以1mg/ml的浓度溶解于cage中(n=3,误差条为sem)。
26.图4描绘了用作香叶酸(geranic acid)替代物的阴离子。选择阴离子以覆盖分子量、pka和logp值的范围。
27.图5a-图5d描绘了阴离子替代物的整体转运排名与(图5a)分子量、(图5b)pka、(图5c)logp和(图5d)阴离子中碳数之间的关系。
28.图6a-图6b描绘了(图6a)胆碱:香茅酸和(图6b)胆碱:戊二酸的noesy光谱。带圆圈的交叉峰表示部分分子彼此在5nm以内。交叉峰的数量在所研究的il中表现出显著差异。
29.图7描绘了转运排名和noesy交叉相关峰的数量之间的相关性。胆碱:香茅酸以及胆碱:戊二酸的noesy数据取自图6a-图6b。其它il的noesy数据示于si中。转运排名和缩写见表2。
30.图8描绘了作为胆碱的阳离子替代物而合成的季铵的范围。
31.图9a描绘了通过离子液体(l-r,其中水平条纹为c1:香茅酸,斜条纹为c1:香叶酸(geranaic acid),纯黑为cage,点状为胆碱:香茅酸)在24小时时间段内将鲁索替尼(1mg/ml)转运至皮肤的不同部位。e是表皮,d是真皮,a是受体液体。误差条为sem(n=3)。图9b描绘了c1:香茅酸的2d noesy光谱,显示有一个交叉峰(带圆圈)。
32.图10描绘了通过pbs(白色柱状,未检测到)和cage离子液体(2:1显示为斜条纹,1:1为纯黑,1:2为水平条纹,1:4为点状)在24小时时间段内将鲁索替尼(1mg/ml)转运至皮肤的不同部位。e是表皮,d是真皮,a是受体液体。误差条是平均值的se。注意,使用纯甲醇从皮肤中提取鲁索替尼,同时也提取了大量sc脂质,弱化了通过hplc观察到的药物峰。因此,sc数据被排除在鲁索替尼分析之外。
33.图11描绘了通过pbs(白色柱状,未检测到)和cage离子液体(2:1显示为斜条纹,1:1为纯黑,1:2为水平条纹,1:4为点状)在24小时时间段内将阿卡波糖(1mg/ml)转运至皮肤的不同部位。sc是角质层,e是表皮,d是真皮,a是受体液体。误差条是平均值的se。
34.图12描绘了通过离子液体(l-r,其中纯黑为cage,点状为香茅酸胆碱(choline citronellate),向下斜线为己酸胆碱,波浪为癸酸胆碱,水平线为水杨酸胆碱,织纹为戊二酸胆碱,纸屑状(confetti)为乙醇酸胆碱,向上斜线为辛烯酸胆碱,网格为辛酸胆碱)在24小时时间段内将阿卡波糖转运至皮肤的不同部位。sc是角质层,e是表皮,d是真皮,a是受体液体。误差条是平均值的se。
35.图13描绘了通过离子液体(l-r,其中纯黑为cage,水平线为水杨酸胆碱,织纹为戊二酸胆碱,纸屑状为乙醇酸胆碱,点状为香茅酸胆碱,向下斜线为己酸胆碱,波浪为癸酸胆碱,向上斜线为辛烯酸胆碱,网格为辛酸胆碱)在24小时时间段内将鲁索替尼(1mg/ml)转运至皮肤不同部位。e是表皮,d是真皮,a是受体液体。误差条是平均值的se。
36.图14描绘了辛烯酸胆碱(1:2)的2d noesy光谱。
37.图15描绘了辛酸胆碱(1:2)的2d noesy光谱。
38.图16描绘了癸酸胆碱(1:2)的2d noesy光谱。
39.图17描绘了水杨酸胆碱(1:2)的2d noesy光谱。
40.图18描绘了乙醇酸胆碱(1:2)的2d noesy光谱。
41.图19描绘了己酸胆碱(1:2)的2d noesy光谱。
42.图20描绘了胆碱香叶酸盐(choline geranate,cage,1:2)(来自tanner等,2018)的2d noesy光谱。
43.图21描绘了胆碱替代物1与香叶酸(1:2)的2d noesy光谱。
44.图22描绘了用所示离子液体进行的胰岛素的肠内给予。将胰岛素与离子液体混合并在肠内进行给予。测量血糖浓度和血浆胰岛素浓度。如图22图例中所使用的,“c
‑”
指离子液体中作为阳离子的胆碱。
具体实施方式
45.本文提供的数据证明,离子液体(il)的阴离子对活性试剂是否会被转运通过生物屏障(例如上皮层,如真皮)表现出显著影响。与疏水性较低且质量较低的阴离子相比,疏水性较高且质量较高的阴离子将提供更好的药物递送特性。在选择与阴离子配对的阳离子时,主要关注的是阳离子不太紧密地与阴离子结合,紧密的结合会导致阴离子保留在生物
coefficient))的对数。p是物质在脂类(油)和水之间的分配程度的量度。p本身是一个常数。其被定义为水相中化合物的浓度与不互溶溶剂(作为中性分子)中化合物的浓度的比例。
53.分配系数,p=[有机]/[水],其中[]=浓度
[0054]
log p=log
10
(分配系数)=log
10 p
[0055]
实际上,logp值将根据测量条件和分配溶剂的选择而变化。logp值为1表示化合物在有机相中的浓度比在水相中的浓度大10倍。logp值增加1表示化合物在有机相中的浓度比在水相中的浓度增加10倍。
[0056]
在任何方面的一些实施方式中,本文所述il的阴离子具有至少1.0(例如,1.0以上)的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少2.0(例如,2.0以上)的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少2.5(例如,2.5以上)的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少2.75(例如,2.75以上)的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少约1.0(例如,约1.0以上)的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少约2.0(例如,约2.0以上)的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少约2.5(例如,约2.5以上)的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少约2.75(例如,约2.75以上)的logp。
[0057]
在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.0的pka和至少1.0的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.0的pka和至少2.0的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.0的pka和至少2.5的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.0的pka和至少2.75的logp。
[0058]
在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.5的pka和至少1.0的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.5的pka和至少2.0的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.5的pka和至少2.5的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少4.5的pka和至少2.75的logp。
[0059]
在任何方面的一些实施方式中,本文所述il的阴离子具有至少5.0的pka和至少1.0的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少5.0的pka和至少2.0的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少5.0的pka和至少2.5的logp。在任何方面的一些实施方式中,本文所述il的阴离子具有至少5.0的pka和至少2.75的logp。
[0060]
在任何方面的一些实施方式中,阴离子具有至少2.75的logp。在任何方面的一些实施方式中,阴离子具有至少2.8的logp。在任何方面的一些实施方式中,阴离子具有2.5-3.5的logp。在任何方面的一些实施方式中,阴离子具有2.8-3.01的logp。
[0061]
在任何方面的一些实施方式中,阴离子具有至少约2.75的logp。在任何方面的一些实施方式中,阴离子具有至少约2.8的logp。在任何方面的一些实施方式中,阴离子具有约2.5至约3.5的logp。在任何方面的一些实施方式中,阴离子具有约2.8至约3.01的logp。
[0062]
在任何方面的一些实施方式中,羧酸包含具有8个碳的碳骨架链,并且具有大于或
等于2.8的log p和在4.8和5.2之间的pka。在任何方面的一些实施方式中,羧酸具有大于或等于2.9的log p和在4.8和5.1之间的pka。
[0063]
阴离子的pka和logp值在本领域已知和/或可由本领域技术人员计算。例如,pubchem和spiderchem为各种阴离子提供这些值,化学品制造商通常将其作为其产品目录列表的一部分提供。本文表5中提供了示例性阴离子的pka和logp值。
[0064]
在任何方面的一些实施方式中,羧酸包含至少6个碳的碳链。在任何方面的一些实施方式中,羧酸包含至少7个碳的碳链。在任何方面的一些实施方式中,羧酸包含至少8个碳的碳链。在任何方面的一些实施方式中,羧酸包含至少9个碳的碳链。在任何方面的一些实施方式中,羧酸包含至少10个碳的碳链。在任何方面的一些实施方式中,羧酸包含至少11个碳的碳链。
[0065]
在任何方面的一些实施方式中,阴离子为烷烃。在任何方面的一些实施方式中,阴离子为烯烃。在任何方面的一些实施方式中,阴离子包含单个羧基。在任何方面的一些实施方式中,羧酸的碳链包含一个或多个取代基。在任何方面的一些实施方式中,羧酸的碳链骨架包含一个或多个取代基,其中每个取代基包含至少一个碳原子。在任何方面的一些实施方式中,羧酸的碳链骨架包含一个或多个取代基,其中至少一个取代基包含甲基。在任何方面的一些实施方式中,羧酸的碳链骨架包含两个取代基,其中每个取代基包含至少一个碳原子。在任何方面的一些实施方式中,羧酸的碳链骨架包含两个取代基,其中一个取代基包含甲基。在任何方面的一些实施方式中,羧酸的碳链骨架包含两个取代基,其中每个取代基包含甲基。
[0066]
在任何方面的一些实施方式中,阴离子为未取代烷烃。在任何方面的一些实施方式中,阴离子为未取代烯烃。在任何方面的一些实施方式中,羧酸的碳链骨架包含一个或多个取代基。在任何方面的一些实施方式中,羧酸的碳链包含一个或多个取代基,其中每个取代基包含至少一个碳原子。在任何方面的一些实施方式中,羧酸的碳链包含一个或多个取代基,其中每个取代基为烷基、芳基、杂烷基、杂芳基、烷烃或烯烃。在任何方面的一些实施方式中,羧酸的碳链包含一个或多个取代基,其中每个取代基为未取代烷基、未取代芳基、未取代杂烷基、未取代杂芳基、未取代烷烃或未取代烯烃。
[0067]
在任何方面的一些实施方式中,羧酸包含具有8个碳的碳骨架链,任选为单烯烃,并且任选具有两个取代基。在任何方面的一些实施方式中,取代基中的至少一个为甲基。在任何方面的一些实施方式中,两个取代基均为甲基。在任何方面的一些实施方式中,羧酸选自于由以下组成的组:辛酸;2-辛烯酸;3-辛烯酸;4-辛烯酸;5-辛烯酸;6-辛烯酸;7-辛烯酸;2,2-二甲基辛酸;2,3-二甲基辛酸;2,4-二甲基辛酸;2,5-二甲基辛酸;2,6-二甲基辛酸;2,7-二甲基辛酸;3,3-二甲基辛酸;3,4-二甲基辛酸;3,5-二甲基辛酸;3,6-二甲基辛酸;3,7-二甲基辛酸;4,4-二甲基辛酸;4,5-二甲基辛酸;4,6-二甲基辛酸;4,7-二甲基辛酸;5,5-二甲基辛酸;5,6-二甲基辛酸;5,7-二甲基辛酸;6,6-二甲基辛酸;6,7-二甲基辛酸;7,7-二甲基辛酸;2,3-二甲基-2-辛烯酸;2,4-二甲基-2-辛烯酸;2,5-二甲基-2-辛烯酸;2,6-二甲基-2-辛烯酸;2,7-二甲基-2-辛烯酸;3,4-二甲基-2-辛烯酸;3,5-二甲基-2-辛烯酸;3,6-二甲基-2-辛烯酸;3,7-二甲基-2-辛烯酸;4,4-二甲基-2-辛烯酸;4,5-二甲基-2-辛烯酸;4,6-二甲基-2-辛烯酸;4,7-二甲基-2-辛烯酸;5,5-二甲基-2-辛烯酸;5,6-二甲基-2-辛烯酸;5,7-二甲基-2-辛烯酸;6,6-二甲基-2-辛烯酸;6,7-二甲基-2-辛烯酸;
7,7-二甲基-2-辛烯酸;2,2-二甲基-3-辛烯酸;2,3-二甲基-3-辛烯酸;2,4-二甲基-3-辛烯酸;2,5-二甲基-3-辛烯酸;2,6-二甲基-3-辛烯酸;2,7-二甲基-3-辛烯酸;3,4-二甲基-3-辛烯酸;3,5-二甲基-3-辛烯酸;3,6-二甲基-3-辛烯酸;3,7-二甲基-3-辛烯酸;4,5-二甲基-3-辛烯酸;4,6-二甲基-3-辛烯酸;4,7-二甲基-3-辛烯酸;5,5-二甲基-3-辛烯酸;5,6-二甲基-3-辛烯酸;5,7-二甲基-3-辛烯酸;6,6-二甲基-3-辛烯酸;6,7-二甲基-3-辛烯酸;7,7-二甲基-3-辛烯酸;2,2-二甲基-4-辛烯酸;2,3-二甲基-4-辛烯酸;2,4-二甲基-4-辛烯酸;2,5-二甲基-4-辛烯酸;2,6-二甲基-4-辛烯酸;2,7-二甲基-4-辛烯酸;3,3-二甲基-4-辛烯酸;3,4-二甲基-4-辛烯酸;3,5-二甲基-4-辛烯酸;3,6-二甲基-4-辛烯酸;3,7-二甲基-4-辛烯酸;4,5-二甲基-4-辛烯酸;4,6-二甲基-4-辛烯酸;4,7-二甲基-4-辛烯酸;5,6-二甲基-4-辛烯酸;5,7-二甲基-4-辛烯酸;6,6-二甲基-4-辛烯酸;6,7-二甲基-4-辛烯酸;7,7-二甲基-4-辛烯酸;2,2-二甲基-5-辛烯酸;2,3-二甲基-5-辛烯酸;2,4-二甲基-5-辛烯酸;2,5-二甲基-5-辛烯酸;2,6-二甲基-5-辛烯酸;2,7-二甲基-5-辛烯酸;3,3-二甲基-5-辛烯酸;3,4-二甲基-5-辛烯酸;3,5-二甲基-5-辛烯酸;3,6-二甲基-5-辛烯酸;3,7-二甲基-5-辛烯酸;4,4-二甲基-5-辛烯酸;4,5-二甲基-5-辛烯酸;4,6-二甲基-5-辛烯酸;4,7-二甲基-5-辛烯酸;5,6-二甲基-5-辛烯酸;5,7-二甲基-5-辛烯酸;6,7-二甲基-5-辛烯酸;7,7-二甲基-5-辛烯酸;2,2-二甲基-6-辛烯酸;2,3-二甲基-6-辛烯酸;2,4-二甲基-6-辛烯酸;2,5-二甲基-6-辛烯酸;2,6-二甲基-6-辛烯酸;2,7-二甲基-6-辛烯酸;3,3-二甲基-6-辛烯酸;3,4-二甲基-6-辛烯酸;3,5-二甲基-6-辛烯酸;3,6-二甲基-6-辛烯酸;3,7-二甲基-6-辛烯酸(香茅酸(citranellic acid));4,4-二甲基-6-辛烯酸;4,5-二甲基-6-辛烯酸;4,6-二甲基-6-辛烯酸;4,7-二甲基-6-辛烯酸;5,5-二甲基-6-辛烯酸;5,6-二甲基-6-辛烯酸;5,7-二甲基-6-辛烯酸;6,7-二甲基-6-辛烯酸;2,2-二甲基-7-辛烯酸;2,3-二甲基-7-辛烯酸;2,4-二甲基-7-辛烯酸;2,5-二甲基-7-辛烯酸;2,6-二甲基-7-辛烯酸;2,7-二甲基-7-辛烯酸;4,4-二甲基-7-辛烯酸;3,4-二甲基-7-辛烯酸;3,5-二甲基-7-辛烯酸;3,6-二甲基-7-辛烯酸;3,7-二甲基-7-辛烯酸;4,4-二甲基-7-辛烯酸;4,5-二甲基-7-辛烯酸;4,6-二甲基-7-辛烯酸;4,7-二甲基-7-辛烯酸;5,5-二甲基-7-辛烯酸;5,6-二甲基-7-辛烯酸;5,7-二甲基-7-辛烯酸;6,6-二甲基-7-辛烯酸;6,7-二甲基-7-辛烯酸;以及它们的异构体。在任何方面的一些实施方式中,羧酸选自于由以下组成的组:辛酸;2-辛烯酸;3-辛烯酸;4-辛烯酸;5-辛烯酸;6-辛烯酸;7-辛烯酸;2,2-二甲基辛酸;2,4-二甲基辛酸;2,5-二甲基辛酸;2,6-二甲基辛酸;2,7-二甲基辛酸;3,3-二甲基辛酸;3,5-二甲基辛酸;3,6-二甲基辛酸;3,7-二甲基辛酸;4,4-二甲基辛酸;4,5-二甲基辛酸;4,6-二甲基辛酸;5,5-二甲基辛酸;5,6-二甲基辛酸;5,7-二甲基辛酸;6,6-二甲基辛酸;7,7-二甲基辛酸;3,7-二甲基-2-辛烯酸;3,7-二甲基-3-辛烯酸;3,7-二甲基-4-辛烯酸;2,7-二甲基-6-辛烯酸;3,7-二甲基-6-辛烯酸(香茅酸);2,2-二甲基-7-辛烯酸;2,3-二甲基-7-辛烯酸;以及它们的异构体。在任何方面的一些实施方式中,羧酸选自于由香茅酸、辛酸、2-辛烯酸以及它们的异构体组成的组。在任何方面的一些实施方式中,羧酸选自于由香茅酸、辛酸或反式-2-辛烯酸组成的组。在任何方面的一些实施方式中,如本文所使用的辛烯酸(例如在表5中)指反式-2-辛烯酸。
[0068]
在任何方面的一些实施方式中,羧酸包含具有8个碳的碳骨架链,并且任选地为单烯烃。在任何方面的一些实施方式中,羧酸的碳骨架链未被取代。在任何方面的一些实施方
式中,羧酸选自于由辛酸、2-辛烯酸、3-辛烯酸、4-辛烯酸、5-辛烯酸、6-辛烯酸、7-辛烯酸以及它们的异构体组成的组。在一些选项中,羧酸为辛酸或反式-2-辛烯酸(辛烯酸)。
[0069]
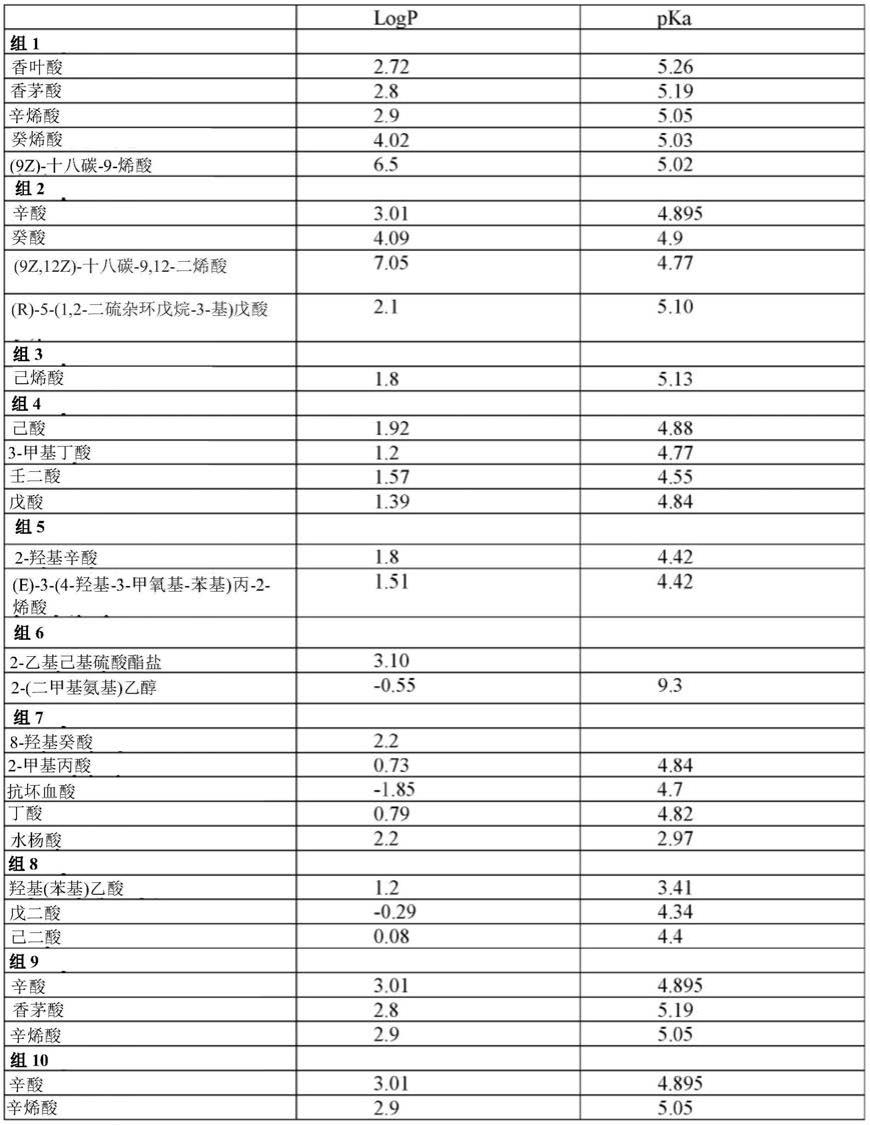
下表5提供了示例性非限制性阴离子。
[0070]
表5
[0071][0072]
在任何方面的一些实施方式中,阴离子选自表5。在任何方面的一些实施方式中,阴离子选自表5的组1。在任何方面的一些实施方式中,阴离子选自表5的组2。在任何方面的一些实施方式中,阴离子选自表5的组3。在任何方面的一些实施方式中,阴离子选自表5的组4。在任何方面的一些实施方式中,阴离子选自表5的组5。在任何方面的一些实施方式中,
阴离子选自表5的组6。在任何方面的一些实施方式中,阴离子选自表5的组7。在任何方面的一些实施方式中,阴离子选自表5的组8。在任何方面的一些实施方式中,阴离子选自表5的组1-组2。在任何方面的一些实施方式中,阴离子选自表5的组1-组3。在任何方面的一些实施方式中,阴离子选自表5的组1-组4。在任何方面的一些实施方式中,阴离子选自表5的组1-组5。在任何方面的一些实施方式中,阴离子选自表5的组1-组6。在任何方面的一些实施方式中,阴离子选自表5的组1-组7。在任何方面的一些实施方式中,阴离子选自表5的组9。在任何方面的一些实施方式中,阴离子选自表5的组10。在任何方面的一些实施方式中,阴离子选自表5的组9-组10。
[0073]
在任何方面的一些实施方式中,阴离子为香叶酸、辛酸和/或香茅酸。在任何方面的一些实施方式中,阴离子为香叶酸。在任何方面的一些实施方式中,阴离子为辛酸。在任何方面的一些实施方式中,阴离子为香茅酸。在任何方面的一些实施方式中,阴离子包含具有8个碳的骨架的碳链。在任何方面的一些实施方式中,阴离子为香叶酸、辛烯酸、辛酸或香茅酸。在任何方面的一些实施方式中,阴离子为辛烯酸、辛酸或香茅酸。
[0074]
如本文所述,在选择与阴离子配对的阳离子时,主要关注的是阳离子不太紧密地与阴离子结合,紧密的结合会导致阴离子保留在生物屏障的初始侧。胆碱及其衍生物被证明特别适合作为本文所述阴离子类型的il阳离子。因此,本文所述il的阳离子可以是包括季铵的阳离子。季铵是具有结构nr
4+
的带正电荷的多原子离子,r各自独立地为烷基或芳基。
[0075]
在任何方面的一些实施方式中,阳离子具有等于或大于胆碱的摩尔质量,例如,摩尔质量等于或大于104.1708g/mol。在任何方面的一些实施方式中,阳离子具有大于胆碱的摩尔质量,例如,摩尔质量大于104.1708g/mol。
[0076]
在任何方面的一些实施方式中,季铵的r基团各自独立地包含烷基、烷烃、烯烃或芳基。在任何方面的一些实施方式中,季铵的r基团各自独立地包含烷基、烷烃或烯烃。在任何方面的一些实施方式中,季铵的r基团各自独立地包含烷烃或烯烃。在任何方面的一些实施方式中,季铵的r基团各自独立地包含长度不超过10个碳原子的碳链,例如,长度不超过10、11、12、13、14、15、16、17、18、19、20、25或30个碳原子。在任何方面的一些实施方式中,季铵的r基团各自独立地包含长度不超过12个碳原子的碳链。在任何方面的一些实施方式中,季铵的r基团各自独立地包含长度不超过15个碳原子的碳链。在任何方面的一些实施方式中,季铵的r基团各自独立地包含长度不超过20个碳原子的碳链。
[0077]
在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过10个碳原子的碳链,例如,不超过10、11、12、13、14、15、16、17、18、19、20、25或30个碳原子。在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过12个碳原子的碳链。在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过15个碳原子的碳链。在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过20个碳原子的碳链。
[0078]
在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过10个碳原子的烷基,例如,不超过10、11、12、13、14、15、16、17、18、19、20、25或30个碳原子。在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过12个碳原子的烷基。在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过15个碳原子的烷基。在任何方面的一些实施方式中,季铵的r基团各自独立地包含不超过20个碳原子的烷基。
[0079]
在任何方面的一些实施方式中,季铵的r基团各自独立地包含烷烃、烯烃、芳基、杂
芳基、烷基或杂烷基。在任何方面的一些实施方式中,季铵的r基团各自独立地包含未取代的烷烃、未取代的烯烃、未取代的芳基、未取代的杂芳基、未取代的烷基或未取代的杂烷基。在任何方面的一些实施方式中,季铵的r基团各自独立地为未取代的烷烃。在任何方面的一些实施方式中,季铵的r基团各自独立地为未取代烯烃。在任何方面的一些实施方式中,季铵的r基团各自独立地包含一个或多个取代基。
[0080]
在任何方面的一些实施方式中,季铵的至少一个r基团包含羟基。在任何方面的一些实施方式中,季铵的一个r基团包含羟基。在任何方面的一些实施方式中,仅季铵的一个r基团包含羟基。
[0081]
示例性非限制性阳离子可包括胆碱和指定为由以下结构定义的c1-c7的任何阳离子:
[0082][0083]
阳离子的其它非限制性实例包括以下:
[0084]
1-(羟基甲基)-1-甲基吡咯烷-1-鎓
[0085]
1-(2-羟基乙基)-1-甲基吡咯烷-1-鎓
[0086]
1-乙基-1-(3-羟基丙基)吡咯烷-1-鎓
[0087]
1-(3-羟基丙基)-1-甲基吡咯烷-1-鎓
[0088]
1-(4-羟基丁基)-1-甲基吡咯烷-1-鎓
[0089]
1-乙基-1-(4-羟基丁基)吡咯烷-1-鎓
[0090]
1-(4-羟基丁基)-1-丙基吡咯烷-1-鎓
[0091]
1-(5-羟基戊基)-1-丙基吡咯烷-1-鎓
[0092]
1-乙基-1-(5-羟基戊基)吡咯烷-1-鎓
[0093]
1-(5-羟基戊基)-1-甲基吡咯烷-1-鎓
[0094]
1-(羟基甲基)-1-甲基哌啶-1-鎓
[0095]
1-(2-羟基乙基)-1-甲基哌啶-1-鎓
[0096]
1-乙基-1-(2-羟基乙基)哌啶-1-鎓
[0097]
1-乙基-1-(3-羟基丙基)哌啶-1-鎓
[0098]
1-(3-羟基丙基)-1-丙基哌啶-1-鎓
[0099]
1-(3-羟基丙基)-1-甲基哌啶-1-鎓
[0100]
1-(4-羟基丁基)-1-甲基哌啶-1-鎓
[0101]
1-乙基-1-(4-羟基丁基)哌啶-1-鎓
[0102]
1-(4-羟基丁基)-1-丙基哌啶-1-鎓
[0103]
1-丁基-1-(5-羟基戊基)哌啶-1-鎓
[0104]
1-(5-羟基戊基)-1-丙基哌啶-1-鎓
[0105]
1-乙基-1-(5-羟基戊基)哌啶-1-鎓
[0106]
1-(5-羟基戊基)-1-甲基哌啶-1-鎓
[0107]
3-乙基-1-甲基-1h-咪唑-3-鎓
[0108]
1-甲基-3-丙基-1h-咪唑-3-鎓
[0109]
3-丁基-1-甲基-1h-咪唑-3-鎓
[0110]
1-甲基-3-戊基-1h-咪唑-3-鎓
[0111]
1,2-二甲基-3-戊基-1h-咪唑-3-鎓
[0112]
3-丁基-1,2-二甲基-1h-咪唑-3-鎓
[0113]
1,2-二甲基-3-丙基-1h-咪唑-3-鎓
[0114]
3-(羟基甲基)-1,2-二甲基-1h-咪唑-3-鎓
[0115]
3-(2-羟基乙基)-1,2-二甲基-1h-咪唑-3-鎓
[0116]
3-(3-羟基丙基)-1,2-二甲基-1h-咪唑-3-鎓
[0117]
3-(4-羟基丁基)-1,2-二甲基-1h-咪唑-3-鎓
[0118]
3-(5-羟基戊基)-1,2-二甲基-1h-咪唑-3-鎓
[0119]
3-(5-羟基戊基)-1-甲基-1h-咪唑-3-鎓
[0120]
3-(4-羟基丁基)-1-甲基-1h-咪唑-3-鎓
[0121]
3-(3-羟基丙基)-1-甲基-1h-咪唑-3-鎓
[0122]
3-(2-羟基乙基)-1-甲基-1h-咪唑-3-鎓
[0123]
3-(羟基甲基)-1,2,4,5-四甲基-1h-咪唑-3-鎓
[0124]
3-(2-羟基乙基)-1,2,4,5-四甲基-1h-咪唑-3-鎓
[0125]
3-(3-羟基丙基)-1,2,4,5-四甲基-1h-咪唑-3-鎓
[0126]
3-(4-羟基丁基)-1,2,4,5-四甲基-1h-咪唑-3-鎓
[0127]
3-(5-羟基戊基)-1,2,4,5-四甲基-1h-咪唑-3-鎓
[0128]
1-(5-羟基戊基)吡啶-1-鎓
[0129]
1-(4-羟基丁基)吡啶-1-鎓
[0130]
1-(3-羟基丙基)吡啶-1-鎓
[0131]
1-(2-羟基乙基)吡啶-1-鎓
[0132]
1-(羟基甲基)吡啶-1-鎓
[0133]
1-羟基吡啶-1-鎓
[0134]
(羟基甲基)三甲基鏻
[0135]
三乙基(羟基甲基)鏻
[0136]
三乙基(2-羟基乙基)鏻
[0137]
(2-羟基乙基)三丙基鏻
[0138]
(3-羟基丙基)三丙基鏻
[0139]
三丁基(3-羟基丙基)鏻
[0140]
(3-羟基丙基)三戊基鏻
[0141]
(4-羟基丁基)三戊基鏻
[0142]
(5-羟基戊基)三戊基鏻。
[0143]
在任何方面的一些实施方式中,阳离子为胆碱、c1、c6和/或c7。在任何方面的一些实施方式中,阳离子为c1、c6和/或c7。
[0144]
在任何方面的一些实施方式中,阳离子选自胆碱、c1、c6和/或c7,且阴离子为香茅酸。在任何方面的一些实施方式中,阳离子为胆碱,且阴离子为香茅酸。在任何方面的一些实施方式中,阳离子为c1,且阴离子为香茅酸。在任何方面的一些实施方式中,阳离子为c6,且阴离子为香茅酸。在任何方面的一些实施方式中,阳离子为c7,且阴离子为香茅酸。
[0145]
在任何方面的一些实施方式中,阳离子选自c1、c6和/或c7,且阴离子为香叶酸。在任何方面的一些实施方式中,阳离子为c1,且阴离子为香叶酸。在任何方面的一些实施方式中,阳离子为c6,且阴离子为香叶酸。在任何方面的一些实施方式中,阳离子为c7,且阴离子为香叶酸。
[0146]
在任何方面的一些实施方式中,阳离子选自胆碱、c1、c6和/或c7,且阴离子为辛酸(octanoic acid)。在任何方面的一些实施方式中,阳离子为胆碱,且阴离子为辛酸。在任何方面的一些实施方式中,阳离子为c1,且阴离子为辛酸。在任何方面的一些实施方式中,阳离子为c6,且阴离子为辛酸(ocatanoic acid)。在任何方面的一些实施方式中,阳离子为c7,且阴离子为辛酸(ocatanoic acid)。
[0147]
在任何方面的一些实施方式中,阳离子选自胆碱、c1、c6和c7,且阴离子选自香茅酸、辛酸和辛烯酸。在任何方面的一些实施方式中,阳离子为胆碱,且阴离子选自香茅酸、辛酸和辛烯酸。在任何方面的一些实施方式中,离子液体为胆碱:香茅酸、胆碱:辛酸、或胆碱:辛烯酸。
[0148]
在任何方面的一些实施方式中,辛烯酸为2-辛烯酸。
[0149]
下表6提供了阳离子和阴离子的非限制性示例性组合。
[0150]
表6
[0151][0152]
在任何方面的一些实施方式中,离子液体不是cage(胆碱和香叶酸根(geranate))。在任何方面的一些实施方式中,离子液体的阳离子不是胆碱。在任何方面的一些实施方式中,离子液体的阴离子不是香叶酸根或香叶酸。
[0153]
如本文所证明的,如通过核欧佛豪瑟效应频谱(noesy)所测量的,给定il的交叉峰数量与其在药物递送中的性能相关,较少的交叉峰表明更好的药物递送性能。从根本上说,交叉峰的数量表明了质子介导的离子之间的分子内相互作用。即,每个同相峰(in-phase peak)(与1d对角线的颜色相同)表明分子彼此在5nm以内(作为整个液体的平均值)。在任何方面的一些实施方式中,本文所述的方法还包括通过noesy测量一个或多个il的交叉峰的数量的步骤。在任何方面的一些实施方式中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,本文所述的离子液体具有小于20个的交叉峰,例如,小于20个、小于15个、小于10个、小于9个、小于8个、小于7个、小于6个或小于5个。在任何方面的一些实施方式中,如通过核欧
佛豪瑟效应频谱(noesy)所测量的,本文所述的离子液体具有小于10个的交叉峰。在任何方面的一些实施方式中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,本文所述的离子液体具有小于5个的交叉峰。进行noesy的方法在本领域中是已知的,并且在本文的实施例中进行了描述。
[0154]
在任何实施方式的一个方面,本文提供了设计、选择和/或识别离子液体的方法。可将离子液体设计、选择和/或识别用于给予、通过特定途径给予(例如,经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予)和/或用于递送或给予一种或多种活性化合物。如本文所述,对于用于给予、通过特定途径给予(例如,经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予)和/或用于递送或给予一种或多种活性化合物,当阳离子和阴离子的离子间相互作用减少时,离子液体最为有利。因此,可以选择使离子间相互作用最小化的阳离子和阴离子对。例如,可选择该对以使低于本文提供的阈值的相互作用最小化、使低于参考水平的相互作用最小化,和/或提供来自阳离子和阴离子池的阳离子和阴离子的阳离子和阴离子任何成对组合的最小化。
[0155]
因此,在任何实施方式的一个方面,本文提供了设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子且另一种离子为阴离子,所述方法包括:
[0156]
在第一选项中:
[0157]
a.选择离子液体的两种离子中的一种;以及
[0158]
b.选择另一种离子以使离子间相互作用最小化;
[0159]
在第二选项中:
[0160]
a.选择阳离子;以及
[0161]
b.选择阴离子以使离子间相互作用最小化;或者
[0162]
在第三选项中:
[0163]
a.选择阴离子;以及
[0164]
b.选择阳离子以使离子间相互作用最小化。
[0165]
在任何实施方式的一个方面,本文提供了设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子且另一种离子为阴离子,所述离子来自候选阳离子池和候选阴离子池,所述方法包括:
[0166]
在第一选项中:
[0167]
a.从候选离子池中选择离子液体的两种离子中的一种;以及
[0168]
b.从另一候选离子池中选择最能使与步骤a中选择的离子的离子间相互作用最小化的离子;
[0169]
在第二选项中:
[0170]
a.从候选阳离子池中选择阳离子;
[0171]
b.从候选阴离子池中选择最能使与步骤a中选择的阳离子的离子间相互作用最小化的阴离子,或者
[0172]
在第三选项中:
[0173]
a.从候选阴离子池中选择阳离子;
[0174]
b.从候选阳离子池中选择最能使与步骤a中选择的阴离子的离子间相互作用最小
化的阴离子。
[0175]
在任何方面的一些实施方式中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,具有最小化的离子间相互作用的离子液体具有小于20个的交叉峰,例如,小于20个、小于15个、小于10个、小于9个、小于8个、小于7个、小于6个或小于5个。在任何方面的一些实施方式中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,具有最小化的离子间相互作用的离子液体具有小于10个的交叉峰。在任何方面的一些实施方式中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,具有最小化的离子间相互作用的离子液体具有小于5个的交叉峰。
[0176]
在任何方面的一些实施方式中,il的浓度为至少0.01%w/v。在任何方面的一些实施方式中,il的浓度为至少0.05%w/v。在任何方面的一些实施方式中,il的浓度为至少0.1%w/v。在任何方面的一些实施方式中,il的浓度为至少0.2%w/v、至少0.3%w/v、至少0.4%w/v、至少0.5%w/v、至少1%w/v或更高。在任何方面的一些实施方式中,il的浓度为约0.01%w/v至约1%w/v。在任何方面的一些实施方式中,il的浓度为0.01%w/v至1%w/v。在任何方面的一些实施方式中,il的浓度为约0.05%w/v至约0.5%w/v。在任何方面的一些实施方式中,il的浓度为0.05%w/v至0.5%w/v。
[0177]
在任何方面的一些实施方式中,il的浓度为至少25%w/w。在任何方面的一些实施方式中,il在水中的浓度为至少25%w/w。在任何方面的一些实施方式中,il在盐水或生理学上可相容的缓冲液中的浓度为至少25%w/w。
[0178]
在任何方面的一些实施方式中,il的浓度为约5%w/w至约75%w/w。在任何方面的一些实施方式中,il的浓度为5%w/w至75%w/w。在任何方面的一些实施方式中,il在水、盐水或生理学上可相容的缓冲液中的浓度为约5%w/w至约75%w/w。在任何方面的一些实施方式中,il在水、盐水或生理学上可相容的缓冲液中的浓度为5%w/w至75%w/w。
[0179]
在任何方面的一些实施方式中,il的浓度为至少约0.1%w/w。在任何方面的一些实施方式中,il的浓度为至少0.1%w/w。在任何方面的一些实施方式中,il的浓度为约10%w/w至约70%w/w。在任何方面的一些实施方式中,il的浓度为10%w/w至70%w/w。在任何方面的一些实施方式中,il的浓度为约30%w/w至约50%w/w。在任何方面的一些实施方式中,il的浓度30%w/w至40%w/w。在任何方面的一些实施方式中,il的浓度为约30%w/w至约50%w/w。在任何方面的一些实施方式中,il的浓度为30%w/w至40%w/w。
[0180]
在任何方面的一些实施方式中,il的%w/w浓度为在水、盐水或生理学上可相容的缓冲液中的%w/w浓度。
[0181]
在任何方面的一些实施方式中,il为100%w/w或w/v。
[0182]
在一些实施方式中,il为无水盐,例如未稀释或溶解于水中的离子液体。在一些实施方式中,il以水溶液提供。
[0183]
在任何方面的一些实施方式中,il的浓度为至少25%w/w,且具有至少1:3的阳离子:阴离子比例。在任何方面的一些实施方式中,il在水中的浓度为至少25%w/w,且具有至少1:3的阳离子:阴离子比例。在任何方面的一些实施方式中,il的浓度为至少25%w/w,且具有1:3或1:4的阳离子:阴离子比例。在任何方面的一些实施方式中,il在水中的浓度为至少25%w/w,且具有1:3或1:4的阳离子:阴离子比例。在任何方面的一些实施方式中,il为凝胶或剪切变稀(shear-thining)的牛顿凝胶。
[0184]
在任何方面的一些实施方式中,il具有约10:1至约1:10的阳离子:阴离子比例。在
任何方面的一些实施方式中,il具有10:1至1:10的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约5:1至约1:5的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有5:1至1:5的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约2:1至约1:4的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有2:1至1:4的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约2:1至约1:10的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有2:1至1:10的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有使阴离子的量更大的阳离子:阴离子比例,例如,小于1:1的比例。在任何方面的一些实施方式中,il具有使阴离子过量的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约1:1至约1:10的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有1:1至1:10的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约1:1至约1:4的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有1:1至1:4的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约1:1至约1:3的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有1:1至1:3的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约1:1至约1:2的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有1:1至1:2的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有约1:1、1:2、1:3或1:4的阳离子:阴离子比例。在任何方面的一些实施方式中,il具有1:1、1:2、1:3或1:4的阳离子:阴离子比例。不希望受到理论的限制,相对于阳离子,阴离子含量较高的组合物表现出更高的疏水性。
[0185]
在任何方面的一些实施方式中,例如,当与il组合提供一个或多个核酸分子时,阳离子:阴离子比大于1:1,例如大于1:2、约1:2至约1:4、或1:2至1:4。
[0186]
在任何方面的一些实施方式中,il的浓度为至少20mm。在任何方面的一些实施方式中,il的浓度为至少约20mm。在任何方面的一些实施方式中,il的浓度为至少25mm。在任何方面的一些实施方式中,il的浓度为至少约25mm。在任何方面的一些实施方式中,il的浓度为至少50mm。在任何方面的一些实施方式中,il的浓度为至少约50mm。在任何方面的一些实施方式中,il的浓度为至少100mm、500mm、1m、2m、3m或更高。在任何方面的一些实施方式中,il的浓度为至少约100mm、500mm、1m、2m、3m或更高。
[0187]
在任何方面的一些实施方式中,il的浓度为约50mm至约4m。在任何方面的一些实施方式中,il的浓度为50mm至4m。在任何方面的一些实施方式中,il的浓度为约500mm至约4m。在任何方面的一些实施方式中,il的浓度为500mm至4m。在任何方面的一些实施方式中,il的浓度为约1m至约4m。在任何方面的一些实施方式中,il的浓度为1m至4m。在任何方面的一些实施方式中,il的浓度为约2m至约4m。在任何方面的一些实施方式中,il的浓度为2m至4m。
[0188]
在任何方面的一些实施方式中,组合物或制剂中的il浓度为约0.1mm至20mm。在任何方面的一些实施方式中,组合物或制剂中的il浓度为约0.5mm至20mm、0.5mm至18mm、0.5mm至16mm、0.5mm至14mm、0.5mm至12mm、0.5mm至10mm、0.5mm至8mm、1mm至20mm、1mm至18mm、1mm至16mm、1mm至14mm、1mm至12mm、1mm至10mm、1mm至8mm、2mm至20mm、2mm至18mm、2mm至16mm、2mm至14mm、2mm至12mm、2mm至10mm、2mm至8mm、4mm至20mm、4mm至18mm、4mm至16mm、4mm至14mm、4mm至12mm、4mm至10mm、4mm至8mm、6mm至20mm、6mm至18mm、6mm至14mm、6mm至12mm、6mm至10mm、6mm至8mm、8mm至20mm、8mm至18mm、8mm至16mm、8mm至14mm、8mm至12mm、8mm
至10mm、10mm至20mm、10mm至18mm、10mm至16mm、10mm至14mm、10mm至12mm、12mm至20mm、12mm至18mm、12mm至16mm、12mm至14mm、14mm至20mm、14mm至18mm、14mm至16mm、16mm至20mm、16mm至18mm或18mm至20mm。在任何方面的一些实施方式中,组合物或制剂中的il浓度为约1mm、约2mm、约3mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm、约10mm、约11mm、约12mm、约13mm、约14mm、约15mm、约16mm、约17mm、约18mm、约19mm或约20mm。
[0189]
特别考虑的是,本文所述的组合物或组合可包含本文所述的任何类型的组分中的一种、两种、三种或多种。例如,组合物可包含两种以上不同离子液体的混合物、溶液、组合或乳液,和/或两种以上不同非离子表面活性剂的混合物、溶液、组合或乳液,和/或两种以上不同活性化合物的混合物、溶液、组合或乳液。
[0190]
如本文所使用的,“组合/与
…
组合(in combination with)”是指两种以上物质以任何分子或物理排列(例如,以掺和物(admixture)、溶液、混合物(mixture)、混悬液、胶体、乳液)存在于同一制剂中。制剂可以是均质或非均质混合物。在任何方面的一些实施方式中,活性化合物可由上层结构(superstructure)(例如纳米颗粒、脂质体、载体、细胞、支架等)包含,所述上层结构为与il一起处于溶液、混合物、掺和物、混悬液等中的上层结构。
[0191]
如本文所使用的,“活性化合物”或“活性试剂”为将对靶细胞或生物体产生作用的任何试剂。术语“化合物”和“试剂”是指通常不存在或不以向细胞、组织或受试者给予和/或提供的水平存在的任何实体。试剂可选自包含以下的组:化学品;有机或无机小分子;信号分子;核酸序列;核酸类似物;蛋白质;肽;酶;适体;拟肽、肽衍生物、肽类似物、抗体;胞内抗体(intrabody);生物大分子;由例如细菌、植物、真菌或动物细胞或组织的生物材料制成的提取物;天然存在或合成的组合物或其功能片段。在一些实施方式中,试剂为任何化学品、实体或部分,包括但不限于合成和天然存在的非蛋白质实体。已知试剂可以具有期望的活性和/或性质,或者可以从多种化合物库中选择。预期用于本文所述方法中的活性化合物的非限制性实例包括小分子、多肽、核酸、化学疗法/化疗化合物、抗体、抗体试剂、疫苗、glp-1多肽或其模拟物/类似物、胰岛素、阿卡波糖或鲁索替尼。
[0192]
如本文所述的核酸分子可以是载体、表达载体、抑制性核酸、适体、模板分子或盒(cassette)(例如,用于基因编辑)、或靶分子(例如,用于crispr-cas技术)、或希望向细胞递送的任何其它核酸分子。核酸分子可以是rna、dna或其合成或修饰版本。
[0193]
在任何实施方式的一个方面,本文描述的是向细胞递送核酸分子的方法,所述方法包括使细胞同与本文所述的il组合的核酸分子接触。在任何方面的一些实施方式中,细胞是受试者中的细胞,并且接触步骤包括向受试者给予与il组合的核酸分子。在任何方面的一些实施方式中,细胞是体外、体内或离体的。在任何方面的一些实施方式中,细胞为真核的(eurkaryotic)。在任何方面的一些实施方式中,细胞是哺乳动物的。在任何方面的一些实施方式中,细胞为上皮细胞,例如肠上皮细胞。
[0194]
如本文所使用的,术语“小分子”是指化学试剂,所述化学试剂可包括但不限于肽、拟肽、氨基酸、氨基酸类似物、多核苷酸、多核苷酸类似物、适体、核苷酸、核苷酸类似物、分子量小于约10,000克/摩尔的有机或无机化合物(即,包括杂有机化合物和有机金属化合物)、分子量小于约5,000克/摩尔的有机或无机化合物、分子量小于约1,000克/摩尔的有机或无机化合物、分子量小于约500克/摩尔的有机或无机化合物,以及这些化合物的盐、酯和其它药学上可接受的形式。
[0195]
在任何方面的一些实施方式中,活性化合物可以是治疗性化合物或药物,例如,对治疗受试者中的至少一种病症在治疗上有效的试剂或化合物。治疗性化合物在多种情况下为本领域已知的,参见例如,在万维网drugs.com上可用的数据库或在万维网catalog.data.gov/dataset/drugsfda-database上可用的经fda批准的化合物的目录;以引用的方式将它们各自整体并入本文。
[0196]
如本文所使用的,术语“化疗剂(chemotherapeutic agent)”指在以异常细胞生长为特征的疾病的治疗中具有治疗用途的任何化学或生物试剂。这些疾病包括肿瘤(tumor)、赘生物(neoplasm)和癌症(cancer)、以及以增生性生长为特征的疾病。这些试剂可以起到抑制癌细胞持续增殖所依赖的细胞活性的作用。在所有实施方式的一些方面中,化疗剂是细胞周期抑制剂或细胞分裂抑制剂。在本发明方法中有用的化疗剂类别包括烷化剂/生物碱试剂、抗代谢剂、激素或激素类似物以及各种抗肿瘤药物。这些试剂中的大多数对癌细胞具有直接或间接毒性。在一个实施方式中,化疗剂是放射性分子。
[0197]
在任何方面的一些实施方式中,活性化合物为疏水性分子,例如雌二醇(estradiol)、睾酮、皮质酮(corticosterone)、紫杉醇、阿霉素(doxorubicin)、顺铂(cisplatin)和/或喜树碱(camptothecin)。在任何方面的一些实施方式中,活性化合物为亲水分子。
[0198]
在任何方面的一些实施方式中,活性化合物为抗体或抗体试剂。如本文所使用的,术语“抗体试剂”是指多肽,所述多肽包含至少一个免疫球蛋白可变结构域或免疫球蛋白可变结构域序列且特异性结合给定抗原。抗体试剂可包括抗体或含有抗体的抗原结合结构域的多肽。在一些实施方式中,抗体试剂可包括单克隆抗体或含有单克隆抗体的抗原结合域的多肽。例如,抗体可包含重(h)链可变区(本文缩写为vh)和轻(l)链可变区(本文缩写为vl)。在另一实例中,抗体包含两个重(h)链可变区和两个轻(l)链可变区。术语“抗体试剂”涵盖了抗体的抗原结合片段,例如,单链抗体、fab和sfab片段、f(ab’)2、fd片段、fv片段、scfv和结构域抗体(dab)片段以及完整抗体。
[0199]
在任何方面的一些实施方式中,活性化合物具有大于约450的分子量。在任何方面的一些实施方式中,活性化合物具有大于约500的分子量。在任何方面的一些实施方式中,活性化合物具有大于450的分子量,例如,大于450、大于500、大于550、大于600、大于1000或更高。在任何方面的一些实施方式中,活性化合物是极性的。
[0200]
在任何方面的一些实施方式中,可将如本文所述的包含至少一种il和任选的活性化合物的组合物或组合配制为口服制剂、皮下制剂、静脉内制剂、皮内制剂或肠胃外制剂。在任何方面的一些实施方式中,口服制剂可为包含组合物的可降解胶囊,所述组合物包含至少一种il和任选的活性化合物。
[0201]
在任何方面的一些实施方式中,本文描述的是包含如本文所述的至少一种il和至少一种活性化合物的组合物。在任何方面的一些实施方式中,本文描述的是基本上由如本文所述的至少一种il和至少一种活性化合物组成的组合物。在任何方面的一些实施方式中,本文描述的是由如本文所述的至少一种il和至少一种活性化合物组成的组合物。在任何方面的一些实施方式中,包含如本文所述的至少一种il和至少一种活性化合物的组合物以单一疗法进行给予,例如,不向受试者给予针对病症的另一种治疗。
[0202]
在任何实施方式的一个方面,本文描述的是包含至少一种活性化合物与如本文所
述的至少一种il组合的药物组合物。在一些实施方式中,药物组合物包含如本文所述的一种或多种活性化合物和至少一种il。在一些实施方式中,药物组合物基本上由如本文所述的一种或多种活性化合物和至少一种il组成。在一些实施方式中,药物组合物由如本文所述的一种或多种活性化合物和至少一种il组成。在一些实施方式中,药物组合物基本上由如本文所述的一种或多种活性化合物和至少一种il的水溶液组成。在一些实施方式中,药物组合物由如本文所述的一种或多种活性化合物和至少一种il的水溶液组成。
[0203]
本文所述的组合物、制剂和组合可包含如本文所述的至少一种il,例如,一种il、两种il、三种il或更多种。在任何方面的一些实施方式中,如本文所述的组合物、制剂或组合可包含如本文所述的至少一种il和cage(胆碱和香叶酸根)。
[0204]
在任何方面的一些实施方式中,至少一种活性化合物和至少一种离子液体进一步与至少一种非离子表面活性剂组合。如本文所使用的,“非离子表面活性剂”指一种缺乏净离子电荷且在水介质中不会以明显程度发生离解的表面活性剂。非离子表面活性剂的性质很大程度上取决于分子中亲水性和疏水性基团的比例。亲水性基团包括氧乙烯基(
‑‑
och2ch2
‑‑
)和羟基。通过改变疏水性分子(如脂肪酸)中这些基团的数量,可以获得从强疏水性和水不溶性化合物(如单硬脂酸甘油酯)到强亲水性和水溶性化合物(如聚乙二醇(macrogols))的物质。在这两种极端类型之间,包括亲水性和疏水性基团比例更均衡的表面活性剂,如聚乙二醇酯、醚和失水山梨醇衍生物。合适的非离子表面活性剂可见于martindale,the extra pharmacopoeia,第28版,1982,the pharmaceutical press,london,great britain,pp.370-379。非离子表面活性剂的非限制性实例包括聚山梨醇酯、吐温
tm
、环氧乙烷和环氧丙烷的嵌段共聚物、脂肪酸的乙二醇酯和甘油酯及其衍生物、脂肪酸的聚氧乙烯酯(聚乙二醇酯)、脂肪酸的聚氧乙烯醚及其衍生物(聚乙二醇醚)、聚乙烯醇和失水山梨醇酯、失水山梨醇单酯、由脂肪醇和聚乙二醇形成的醚、聚氧乙烯-聚丙二醇、烷基糖苷、聚西托醇1000(cetomacrogol 1000)、十八十六醇、十六醇、椰油酰胺(cocamide)dea、椰油酰胺mea、癸基葡糖苷、癸基聚葡糖、单硬脂酸甘油酯、igepal ca-630、异鲸蜡醇聚醚-20、月桂基葡糖苷、麦芽糖苷、月桂酸甘油酯、抗霉枯草菌素、nonidet p-40、壬苯醇醚-9、壬苯醇醚、np-40、八甘醇单十二烷基醚、n-辛基β-d-硫代吡喃葡萄糖苷、辛基糖苷、油醇、peg-10向日葵油甘油酯、五甘醇单十二烷基醚、聚多卡醇、泊洛沙姆、泊洛沙姆407、聚氧化乙烯牛脂胺、聚甘油聚蓖麻油酸酯、失水山梨醇、失水山梨醇单月桂酸酯、失水山梨醇单硬脂酸酯、失水山梨醇三硬脂酸酯、硬脂醇、表面活性素、triton x-100等。在任何方面的一些实施方式中,至少一种非离子表面活性剂具有中性亲水性头部基团。
[0205]
如本文所使用的,“聚山梨醇酯”是指来源于用脂肪酸酯化的乙氧基化失水山梨醇(山梨糖醇的衍生物)的表面活性剂。聚山梨醇酯的常见商标名称包括scattics
tm
、alkest
tm
、canarcel
tm
、和吐温
tm
。示例性聚山梨醇酯包括聚山梨醇酯20(聚氧乙烯(20)失水山梨醇单月桂酸酯)、聚山梨醇酯40(聚氧乙烯(20)失水山梨醇单棕榈酸酯)、聚山梨醇酯60(聚氧乙烯(20)失水山梨醇单硬脂酸酯)和聚山梨醇酯80(聚氧乙烯(20)失水山梨醇单油酸酯)。
[0206]
在任何方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以约0.1%w/v至约50%w/v的浓度存在。在任何方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以0.1%w/v至50%w/v的浓度存在。在任何
方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以约1%w/v至约5%w/v的浓度存在。在任何方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以1%w/v至5%w/v的浓度存在。在任何方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以约3%w/v至约10%w/v的浓度存在。在任何方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以3%w/v至10%w/v的浓度存在。在任何方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以小于约5%w/v的浓度存在。在任何方面的一些实施方式中,至少一种非离子表面活性剂(例如,至少一种聚山梨醇酯)以小于5%w/v的浓度存在。
[0207]
在任何方面的一些实施方式中,如本文所述的至少一种il和至少一种活性化合物的组合以一种或多种纳米颗粒提供。在任何方面的一些实施方式中,如本文所述的至少一种il和至少一种活性化合物的组合包含含有活性化合物的纳米颗粒,在包含如本文所述的至少一种il的组合物中,所述纳米颗粒处于溶液或混悬液中。
[0208]
在任何方面的一些实施方式中,如本文所述的组合物(例如,包含至少一种il和活性化合物的组合物)可进一步包含药学上可接受的载体。如本文所使用的,当它们涉及组合物、载体、稀释剂和试剂时,术语“药学上可接受的”、“生理学上可耐受的”及其语法变体可互换使用,并且表示该材料能够向哺乳动物给予或能够针对哺乳动物给予而不会产生不期望的生理作用(例如恶心、头晕、胃部不适等)。除非期望,否则药学上可接受的载体不会促进针对与其混合的试剂的免疫应答的产生。包含溶解或分散于其中的活性成分的药物组合物的制备在本领域中是公知的,并且不必基于制剂而受到限制。通常,将此类组合物制备成可注射的液体溶液或混悬液,然而,也可制备成适合于在使用前在液体中形成溶液或混悬液的固体形式。该制剂也可被乳化为脂质体组合物或作为脂质体组合物存在。可将活性成分与药学上可接受的且与活性成分相容的赋形剂以适用于本文所述的治疗方法的量混合。合适的赋形剂包括例如水、盐水、右旋糖、甘油、乙醇等以及它们的组合。另外,如果期望,该组合物可包含少量的辅助物质,例如增强活性成分的效力的湿润剂或乳化剂、ph缓冲剂等。本公开的治疗组合物可包含其中的组分的药学上可接受的盐。药学上可接受的盐包括与无机酸(比如例如盐酸或磷酸)或有机酸(例如乙酸、酒石酸、扁桃酸等)形成的酸加成盐(与多肽的游离氨基形成)。与游离羧基形成的盐也可衍生自无机碱(比如例如钠、钾、铵、钙或铁的氢氧化物)、以及有机碱(例如异丙胺、三甲胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等)。生理学上可耐受的载体为本领域公知的。示例性的液体载体为无菌水性溶液,其除了活性成分和水外不包含任何物质,或者包含缓冲液(例如处于生理ph值的磷酸钠、生理盐水或两者,例如磷酸盐缓冲盐水)。更进一步,水性载体可包含多于一种的缓冲盐,以及诸如氯化钠和氯化钾的盐、右旋糖、聚乙二醇和其它溶质。除了水之外且把水排除在外,液体组合物还可包含液相。此类额外的液相的实例为甘油、植物油(例如棉籽油)和水油乳剂。本文所述的方法中所使用的、在治疗特定紊乱或病症中有效的活性剂的量将取决于紊乱或病症的性质,并且可通过标准的临床技术确定。在该领域的标准的参考书remington's pharmaceutical sciences,a.osol中描述了合适的药物载体。例如,通过将1.5wt%的活性成分溶解在0.9%的氯化钠溶液中来制备适于注射给予的胃肠外组合物。
[0209]
在药物载体的上下文中,术语“载体”是指与治疗剂一起给予的稀释剂、佐剂、赋形
剂或溶媒。此类药物载体可为无菌液体,例如水和油,包括石油、动物、植物或合成来源的油(例如花生油、大豆油、矿物油、芝麻油等)。当静脉内给予药物组合物时,水是优选的载体。盐水溶液以及右旋糖水性溶液和甘油水性溶液也可用作液体载体,特别是用于可注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。如果期望,该组合物还可包含少量的湿润剂或乳化剂或ph缓冲剂。这些组合物可采取溶液剂、混悬剂、乳剂、片剂、丸剂、胶囊剂、散剂、缓释制剂等形式。该组合物可与传统的粘合剂和载体(例如甘油三酯)一起配制成栓剂。口服制剂可包括标准载体,例如药用级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。在remington's pharmaceutical sciences,第18版,gennaro编(mack publishing co.,1990)中描述了合适的药物载体的实例。制剂应与给予方式相适应。
[0210]
药学上可接受的载体和稀释剂包括盐水、水性缓冲溶液、溶剂和/或分散介质。此类载体和稀释剂的使用是本领域公知的。可用作药学上可接受的载体的材料的一些非限制性实例包括:(1)糖,例如乳糖、葡萄糖和蔗糖;(2)淀粉,例如玉米淀粉和马铃薯淀粉;(3)纤维素及其衍生物,例如羧甲基纤维素钠、甲基纤维素、乙基纤维素、微晶纤维素和醋酸纤维素;(4)黄蓍胶粉;(5)麦芽;(6)明胶;(7)润滑剂,如硬脂酸镁、十二烷基硫酸钠和滑石粉;(8)赋形剂,例如可可脂和栓剂蜡;(9)油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;(10)二醇,例如丙二醇;(11)多元醇,例如甘油、山梨醇、甘露醇和聚乙二醇(peg);(12)酯,例如油酸乙酯和月桂酸乙酯;(13)琼脂;(14)缓冲剂,例如氢氧化镁和氢氧化铝;(15)海藻酸;(16)无热原水;(17)等渗盐水;(18)林格氏溶液;(19)乙醇;(20)ph缓冲溶液;(21)聚酯、聚碳酸酯和/或聚酸酐;(22)填充剂,例如多肽和氨基酸;(23)血清组分,例如血清白蛋白、hdl和ldl;(22)c
2-c
12
醇,例如乙醇;以及(23)药物制剂中使用的其它无毒相容性物质。制剂中也可存在润湿剂、着色剂、脱模剂、包衣剂、甜味剂、调味剂、芳香剂、防腐剂和抗氧化剂。术语如“赋形剂”、“载体”、“药学上可接受的载体”等在本文中可互换使用。在一些实施方式中,载体抑制活性化合物的降解。术语“药学上可接受的载体”不包括组织培养基。
[0211]
在任何方面的一些实施方式中,可将如本文所述的组合物(例如,包含如本文所述的至少一种il和活性化合物的组合物)配制为口服制剂、皮下制剂、静脉内制剂、皮内制剂或肠胃外制剂。在任何方面的一些实施方式中,口服制剂可为包含本文所述的组合物的可降解胶囊,例如,包含如本文所述的至少一种il和活性化合物的组合物。
[0212]
在本文所述的任一方面的一些实施方式中,与不存在至少一种il的情况的活性相比,活性化合物的生物活性得到改善或稳定。在本文所述的任一方面的一些实施方式中,与不存在至少一种il的对照相比,大大增强了活性化合物在皮肤上的渗透。
[0213]
在任何实施方式的一个方面,本文描述的是使用导管向受试者给予至少活性化合物的方法,其中所述导管涂覆有如本文所述的至少一种il。在任何实施方式的一个方面,本文描述的是通过将导管置于体内来收集体液的方法,其中所述导管涂覆有如本文所述的至少一种il。
[0214]
在任何实施方式的一个方面,本文所述的组合物或组合用于给予或递送至少一种活性化合物的方法,例如用于疾病的治疗。在任何实施方式的一个方面,本文描述的是给予
至少一种活性化合物的方法,所述方法包括给予与如本文所述的至少一种il组合的活性化合物。在任何实施方式的一个方面,本文描述的是通过给予至少一种活性化合物来治疗疾病的方法,所述方法包括给予与如本文所述的至少一种il组合的活性化合物。
[0215]
在一些实施方式中,本文所述的方法涉及用本文所述的组合物(例如包含至少一种il和活性化合物的组合物)治疗患有或经诊断患有病症的受试者。可由医师使用当前诊断糖尿病的方法来鉴别患有病症(例如糖尿病)的受试者。表征这些病症并有助于诊断的糖尿病的症状和/或并发症在本领域中是公知的,并且包括但不限于体重减轻、恢复缓慢、多尿、多饮、多食性头痛、皮肤瘙痒和疲劳。可有助于诊断例如糖尿病的测试包括但不限于血液测试(例如,用于空腹血糖水平的血液测试)。糖尿病的家族病史或暴露于糖尿病的危险因素(例如超重)也可有助于确定受试者是否可能患有糖尿病或有助于进行糖尿病诊断。
[0216]
可向患有或经诊断患有本文所述的病症的受试者给予本文所述的组合物和方法。在一些实施方式中,为了减轻本文所述病症的症状,本文所述的方法包括向受试者给予有效量的本文所述的组合物(例如,包含如本文所述的至少一种il和活性化合物的组合物)。如本文所使用的,“减轻症状”是改善与病症相关的任何标志物或症状。与等同的未处理对照相比,如通过任何标准技术所测量的,这种减少为至少5%、10%、20%、40%、50%、60%、80%、90%、95%、99%或更多。用于向受试者给予本文所述的组合物的各种方式是本领域技术人员已知的。此类方法可包括但不限于口服、胃肠外、静脉内、肌内、皮下、经皮、气道(气雾剂)、肺、皮肤、注射或瘤内给予。给予可为局部的或全身性的。
[0217]
在任何方面的一些实施方式中,给予是经皮给予。在任何方面的一些实施方式中,给予为经皮给予、向粘膜(例如,鼻粘膜、口腔粘膜或阴道粘膜)给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。
[0218]
口服给予可包括提供片剂(包括但不限于刻痕片剂或包衣片剂)、丸剂、囊片、胶囊、可咀嚼片剂、粉剂包、扁囊剂(cachet)、锭剂、糯米纸囊剂(wafer)、气雾剂或液体剂(例如但不限于糖浆、酏剂(elixir),处于水性液体、非水性液体、水包油乳液或油包水乳液中的溶液或混悬液)。口服制剂可包括离散剂型,例如但不限于片剂(包括但不限于刻痕或包衣片剂)、丸剂、囊片、胶囊、可咀嚼片剂、粉剂包、扁囊剂、锭剂、糯米纸囊剂、气雾剂或液体(例如但不限于糖浆剂、酏剂,处于水性液体、非水性液体、水包油乳液或油包水乳液中的溶液或混悬液)。此类组合物包含如本文所述的预定量的离子液体和至少一种活性化合物,并且可通过本领域技术人员熟知的药学方法制备。通常参见remington:the science and practice of pharmacy,第21版,lippincott,williams,and wilkins,philadelphia pa.(2005)。
[0219]
在任何实施方式的一个方面,本文描述的是通过皮下给予、皮内给予或静脉内给予递送至少一种活性化合物的方法,所述方法包括与如本文所述的至少一种il组合给予活性化合物。在任何方面的一些实施方式中,皮下给予、皮内给予或静脉内给予包括经由注射、导管、端口(port)等进行给予。
[0220]
在任何实施方式的一个方面,本文描述的是肠胃外递送至少一种活性化合物的方法,所述方法包括肠胃外给予与如本文所述的至少一种il组合的活性化合物。在一些实施方式中,肠胃外给予包括向肿瘤(例如,癌症肿瘤)递送。在任何方面的一些实施方式中,本文所述的组合物或组合可以是肠胃外剂型。由于肠胃外剂型的给予通常绕过患者对污染物
的自然防御,因此肠胃外剂型优选是无菌的,或者能够在向患者给予之前被灭菌。肠胃外剂型的实例包括但不限于准备好用于注射的溶液、准备好被溶解或悬浮在药学上可接受的溶媒中的用于注射的干燥产品、准备好用于注射的混悬液和乳剂。此外,可制备用于给予至患者的控释肠胃外剂型,包括但不限于型剂型和剂量倾卸(dose-dumping)。
[0221]
本领域技术人员熟知可用于提供组合物的肠胃外剂型的合适溶媒,所述组合物包含与所公开的至少一种活性化合物组合的如本文所述的离子液体。实例包括但不限于:无菌水;注射用水usp;盐水溶液;葡萄糖溶液;水性溶媒,例如但不限于氯化钠注射液、林格氏注射液、右旋糖注射液、右旋糖和氯化钠注射液以及乳酸盐林格氏注射液;与水混溶的溶媒,例如但不限于乙醇、聚乙二醇和丙二醇;以及非水性溶媒,例如但不限于玉米油、棉籽油、花生油、芝麻油、油酸乙酯、肉豆蔻酸异丙酯和苯甲酸苄酯。还可将改变或修改如本文所公开的组合物中的成分的溶解度的化合物掺入本公开的肠胃外剂型,包括常规和控释肠胃外剂型。
[0222]
常规剂型通常提供从制剂的快速或即时的药物释放。根据药物的药理学和药代动力学,常规剂型的使用可能导致患者血液和其它组织中药物浓度的大幅波动。这些波动可影响许多参数,例如剂量频率、起效、功效持续时间、治疗血液水平的维持、毒性、副作用等。尽管如上文所述,包含如本文所述的离子液体与至少一种活性化合物组合的组合物可消除使用控释制剂的某些理由,但在本文考虑之列的是,在一些实施方式中,所述方法和组合物可用于控释制剂中。例如,控释制剂可用于控制药物的起效、作用持续时间、治疗窗口内的血浆水平和血液峰值水平。特别是,可使用控释或缓释剂型或制剂,以在确保使潜在副作用和安全问题最小化的同时实现药物的最大功效,所述副作用和安全问题可能是由于药物剂量不足(即低于最低治疗水平)以及超过药物的毒性水平而引起。在一些实施方式中,包含如本文所述的离子液体与至少一种活性化合物组合的组合物可在缓释制剂中进行给予。
[0223]
控释药学产品的共同目标是改善其非控释对应物所实现的药物治疗。理想的是,在医学治疗中使用最佳设计的控释制剂的特征在于,在最短的时间内通过使用最少的药物物质来治愈或控制病症。控释制剂的优势包括:1)延长药物活性;2)减少剂量的频率;3)增加患者依从性;4)使用总量较少的药物;5)减少局部或全身性副作用;6)药物积累的最小化;7)减少血液水平的波动;8)治疗功效的改善;9)减少药物活性的丧失或增强;以及10)改善疾病或病症的控制速度。kim,cherng-ju,controlled release dosage form design,2(technomic publishing,lancaster,pa.:2000)。
[0224]
大多数控释制剂被设计成起始释放一定量的药物(活性成分),迅速产生期望的治疗作用,并逐渐和连续释放其它量的药物以在延长的时间段内维持这一水平的治疗或预防作用。为了在体内维持药物的这种恒定水平,药物必须从剂型中以代替从机体代谢和排泄的药物量的速度被释放。活性成分的控释可通过多种条件刺激,包括但不限于ph、离子强度、渗透压、温度、酶、水和其它生理条件或化合物。
[0225]
各种已知的控释或缓释剂型、制剂和装置可适于与本公开的盐和组合物一起使用。实例包括但不限于在美国专利no.3,845,770、no.3,916,899、no.3,536,809、no.3,598,123、no.4,008,719、no.5674,533、no.5,059,595、no.5,591,767、no.5,120,548;no.5,073,543、no.5,639,476、no.5,354,556、no.5,733,566和no.6,365,185b1中描述的那些,以引用的方式将它们各自并入本文。这些剂型可用于提供一种或多种活性成分的缓慢释放或控
1(7-36)和/或glp-1(7-37)或来自人以外物种的相关多肽。对于许多物种而言,本领域已知glp-1多肽的序列,如人glp-1(ncbi基因id:2641)多肽(例如ncbi参考序列:np_002045.1;seq id no:1)和seq id no:2-seq id no:4。在一些实施方式中,glp-1的前体肽或前肽可用于本文所述的方法或组合物中,例如,胰高血糖素前原蛋白(例如,seq id no:1)。还特别在考虑之列的是用于本文所述的方法和组合物中的本文所述的任何多肽的天然存在的等位基因或变体。
[0230]
seq id no:1
[0231][0232]
seq id no:2
[0233][0234]
seq id no:3
[0235][0236]
seq id no:4
[0237][0238]
本领域已知各种glp-1模拟物并用于治疗糖尿病。glp-1模拟物(或类似物)可包括exendin-4(与人glp-1具有同源性的heloderma蜥蜴多肽)及其衍生物、修饰为抗dpp-iv的glp-1类似物、或例如为了延长半衰期而与多种其它试剂缀合的人glp-1多肽。glp-1模拟物/类似物可包括,例如艾塞那肽(exenatide)、利昔那肽(lixisenatide)、杜拉鲁肽(dulaglutide)、司马鲁肽(semaglutide)、阿必鲁肽(albiglutide)、ly2189265、利拉鲁肽(liraglutide)和他司鲁肽(taspoglutide)。此类分子的实例以及关于其制备和活性的进一步讨论可见于本领域,例如gupta.indian j.endocrinol metab 17:413-421(2013);garber.diabetes treatments 41:s279-s284(2018);us专利公开us2009/0181912;以及国际专利公开wo2011/080103,通过引用的方式将它们各自整体并入本文。
[0239]
在任何方面的一些实施方式中,活性化合物可为化疗剂或有效治疗癌症的试剂。如本文所使用的,术语“癌症”通常涉及一类疾病或病症,其中异常细胞不受控地分裂并且可侵袭附近的组织。癌细胞还可通过血液和淋巴系统扩散到身体的其它部位。存在数种主要类型的癌症。恶性肿瘤(carcinoma)是始于内衬于或覆盖内部器官的组织或皮肤中的癌症。肉瘤是始于骨骼、软骨、脂肪、肌肉、血管或其它结缔组织或支持性组织的癌症。白血病是始于血液形成组织(例如骨髓)且导致大量异常血细胞生成并进入血液的一种癌症。淋巴瘤和多发性骨髓瘤是始于免疫系统细胞的癌症。中枢神经系统癌症是始于大脑和脊髓组织的癌症。
[0240]
在任何方面的一些实施方式中,癌症是原发性癌症。在任何方面的一些实施方式中,癌症是恶性癌症。如本文所使用的,术语“恶性”是指其中一组肿瘤细胞显示出一种或多种不受控的生长(即,超出正常界限的分裂)、侵袭(即,侵入和破坏相邻组织)和转移(即,通过淋巴或血液扩散到身体的其它部位)的癌症。如本文所使用的,术语“转移”是指癌症从身
体的一部分扩散到另一部分。由已扩散的细胞形成的肿瘤称为“转移性肿瘤”或“转移瘤”。转移性肿瘤包含与原始(原发性)肿瘤中的细胞相似的细胞。如本文所使用的,术语“良性”或“非恶性”是指可长大但不会扩散到身体其它部位的肿瘤。良性肿瘤是自限性的,并且通常不会侵袭或转移。
[0241]“癌细胞”或“肿瘤细胞”是指癌性生长物或组织的单个细胞。肿瘤通常是指由细胞的异常生长形成的肿胀或病变,其可为良性的、恶变前的或恶性的。大多数癌细胞形成肿瘤,但某些癌细胞例如白血病不一定形成肿瘤。对于形成肿瘤的那些癌细胞,术语癌症(细胞)和肿瘤(细胞)可互换使用。
[0242]
如本文所使用的,术语“赘生物”是指组织的任何新的和异常的生长(例如,异常的组织块),其生长超过正常组织的生长并且与正常组织的生长不协调。因此,赘生物可为良性赘生物、恶变前赘生物或恶性赘生物。
[0243]
患有癌症或肿瘤的受试者为在受试者体内存在客观上可测量的癌细胞的受试者。该定义包括恶性、活跃增殖的癌症以及潜在的休眠肿瘤或微转移瘤。从其原始位置迁移并定植到其它重要器官的癌症可最终通过受影响器官的功能恶化而导致受试者死亡。
[0244]
癌症的实例包括但不限于恶性肿瘤、淋巴瘤、胚细胞瘤、肉瘤、白血病、基底细胞癌、胆道癌、膀胱癌、骨癌、脑和中枢神经系统癌症、乳腺癌、腹膜癌、宫颈癌、绒毛膜癌、结肠和直肠癌、结缔组织癌、消化系统癌症、子宫内膜癌、食管癌、眼癌、头颈癌、胃癌(包括胃肠癌)、胶质母细胞瘤(gbm)、肝癌、肝细胞瘤、上皮内赘生物、肾癌或肾脏癌、喉癌、白血病、肝癌、肺癌(例如小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌)、淋巴瘤(包括霍奇金淋巴瘤和非霍奇金淋巴瘤)、黑色素瘤、骨髓瘤、成神经细胞瘤、口腔癌(例如,嘴唇、舌头、口和咽)、卵巢癌、胰腺癌、前列腺癌、视网膜母细胞瘤、横纹肌肉瘤、直肠癌、呼吸系统癌症、唾液腺癌、肉瘤、皮肤癌、鳞状细胞癌、胃癌、睾丸癌、甲状腺癌、子宫或子宫内膜癌、泌尿系统癌症、外阴癌、以及其它癌和肉瘤,以及b细胞淋巴瘤(包括低度/滤泡性非霍奇金淋巴瘤(nhl)、小淋巴细胞(sl)nhl、中度/滤泡性nhl、中度弥漫性nhl、高度免疫母细胞性nhl、高度淋巴母细胞性nhl、高度小无裂细胞(high grade small non-cleaved cell)nhl、肿块性疾病(bulky disease)nhl、套细胞淋巴瘤、aids相关淋巴瘤和waldenstrom巨球蛋白血症)、慢性淋巴细胞性白血病(cll)、急性成淋巴细胞性白血病(all)、毛细胞白血病、慢性成髓细胞性白血病和移植后的淋巴组织增生性紊乱(ptld),以及与母斑细胞病(phakomatoses)、水肿(如脑肿瘤有关的水肿)和meigs综合征相关的异常血管增生。
[0245]“癌细胞”是体内、离体或组织培养物中的癌性细胞、癌前细胞(pre-cancerous cell)或转化细胞,其具有自发的或经诱导的表型变化,其不一定涉及新遗传物质的摄取。尽管转化可源自转化病毒的感染和新的基因组核酸的掺入或外源核酸的摄取,但是其也可自发地或暴露至致癌物后产生,从而使内源基因发生突变。转化/癌症与如下有关:例如形态学变化、细胞永生化、异常生长控制、病灶形成、锚着非依赖性、恶性肿瘤、丧失接触抑制和生长密度限制、生长因子或血清非依赖性、肿瘤特异性标志物、侵袭性或转移性、在合适的动物宿主(例如裸鼠)中的肿瘤生长。
[0246]
在任何方面的一些实施方式中,将如本文所述的组合物(例如,包含如本文所述的至少一种il与至少一种活性化合物组合的组合物)作为单一疗法进行给予,例如,不向受试者给予针对该病症的其它治疗。
[0247]
在任何方面的一些实施方式中,例如作为组合疗法的一部分,本文所述的方法可进一步包括向受试者给予第二试剂和/或治疗,在本文所述的组合物中(例如,在包含本文所述的至少一种il与至少一种活性化合物组合的组合物中),或作为单独的制剂。例如,用于治疗癌症的第二试剂和/或治疗的非限制性实例可包括放射疗法、外科手术、吉西他滨、顺铂、紫杉醇、卡铂、硼替佐米、amg479、伏立诺他、利妥昔单抗、替莫唑胺、雷帕霉素、abt-737、pi-103、烷化剂(例如噻替哌(thiotepa)和环磷酰胺)、烷基磺酸酯/盐(例如白消安、英丙舒凡和哌泊舒凡(piposulfan))、氮丙啶(例如苯并多巴(benzodopa)、卡波醌、美妥替哌(meturedopa)和uredopa)、乙烯亚胺和甲基蜜胺(包括六甲蜜胺、三乙撑蜜胺(triethylenemelamine)、三乙撑磷酰胺(trietylenephosphoramide)、三乙撑硫代磷酰胺(triethiylenethiophosphoramide)和三羟甲基蜜胺(trimethylolomelamine))、多聚乙酰(特别是布拉它辛和布拉它辛酮(bullatacinone))、喜树碱(包括合成的类似物拓扑替康)、苔藓虫素、callystatin、cc-1065(包括其阿多来新、卡折来新和比折来新合成类似物)、隐藻素(尤其是隐藻素1和隐藻素8)、多拉司他汀、倍癌霉素(包括合成类似物kw-2189和cb1-tm1)、艾榴塞洛素、水鬼蕉碱、sarcodictyin、海绵毒素(spongistatin)、氮芥(例如苯丁酸氮芥、萘氮芥、胆磷酰胺、雌氮芥、异环磷酰胺、二氯甲基二乙胺、氮氧芥盐酸盐、美法仑、新氮芥、苯芥胆甾醇(phenesterine)、泼松龙苯芥、氯乙环磷酰胺、尿嘧啶氮芥)、亚硝基脲(例如卡莫司汀、氯脲菌素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀(ranimnustine))、抗生素(例如烯二炔抗生素(例如卡奇霉素、特别是卡奇霉素γ1i和卡奇霉素ωi1(参见例如,agnew,chem.intl.ed.engl.,33:183-186(1994))、dynemicin(包括dynemicin a)、双膦酸盐(例如氯膦酸盐)、埃斯培拉霉素(esperamicin)、以及新制癌菌素发色团和相关的色素蛋白烯二炔抗生素生色团)、aclacinomysins、放线菌素、安曲霉素(authramycin)、重氮丝氨酸、博来霉素、放线菌素c、carabicin、洋红霉素(caminomycin)、嗜癌素、色霉素(chromomycinis)、放线菌素d、柔红霉素、地托比星、6-重氮基-5-氧代-l-正亮氨酸、阿霉素(包括吗啉代阿霉素、氰基吗啉代阿霉素、2-吡咯啉并阿霉素和去氧阿霉素)、表柔比星、依索比星、去甲氧基柔红霉素、麻西罗霉素、丝裂霉素(例如丝裂霉素c)、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、泊非霉素(potfiromycin)、嘌呤霉素、三铁阿霉素(quelamycin)、罗多比星、链黑菌素、链脲佐菌素、杀结核菌素、乌苯美司、净司他丁、佐柔比星、抗代谢物(例如氨甲喋呤和5-氟尿嘧啶(5-fu))、叶酸类似物(例如二甲叶酸、氨甲蝶呤、蝶罗呤、曲美沙特)、嘌呤类似物(例如氟达拉滨、6-巯基嘌呤、硫咪嘌呤、硫鸟嘌呤)、嘧啶类似物(如安西他滨、阿扎胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、二脱氧尿苷、去氧氟尿苷、依诺他滨、氟尿苷)、雄激素(例如卡普睾酮、丙酸甲雄烷酮、环硫雄醇、美雄烷、睾丸内酯)、抗肾上腺素(例如氨鲁米特、米托坦、曲洛司坦)、叶酸补充剂(例如亚叶酸)、乙酰葡醛内酯、醛磷酰胺糖苷、氨基乙酰丙酸、恩尿嘧啶、安吖啶、bestrabucil、比生群、依达曲沙(edatraxate)、地磷酰胺(defofamine)、地美可辛、地吖醌、elformithine、依利醋铵、埃博霉素、依托格鲁、硝酸镓、羟基脲、香菇多糖、氯尼达明(lonidainine)、美登木素(maytansinoids,例如美登素(maytansine)和安丝菌素)、米托胍腙、米托蒽醌、莫哌达醇(mopidanmol)、二胺硝吖啶(nitraerine)、喷司他丁、蛋氨氮芥、吡柔比星、洛索蒽醌、鬼臼酸、2-乙基肼、甲基苄肼、多糖复合物(jhs natural products,eugene,oreg.)、雷佐生、根霉素、西佐喃(sizofuran)、螺旋锗、细交链孢菌酮酸、三亚胺醌、2,2',2
”‑
三氯三乙
胺、单端孢霉烯(特别是t-2毒素、疣孢菌素a(verracurin a)、杆孢菌素a和蛇行菌素)、氨基甲酸酯、长春地辛、达卡巴嗪,甘露醇氮芥、二溴甘露醇、二溴卫矛醇、哌泊溴烷、gacytosine、阿糖胞苷(“ara-c”)、环磷酰胺、噻替哌、紫杉烷类(例如紫杉醇(bristol-myers squibb oncology,princeton,n.j.)、cremophor-free、紫杉醇的白蛋白工程化纳米颗粒制剂(american pharmaceutical partners,schaumberg,ill.)和doxetaxel(rhone-poulenc rorer,antony,法国)、苯丁酸氮芥、吉西他滨、6-硫代鸟嘌呤、巯基嘌呤、氨甲喋呤、铂类似物(例如顺铂、奥沙利铂和卡铂)、长春碱、铂、依托泊苷(vp-16)、异环磷酰胺、米托蒽醌、长春新碱、navelbine.rtm.长春瑞滨、盐酸米托蒽醌、替尼泊苷、依达曲沙、道诺霉素、氨基蝶呤、希罗达、伊班膦酸盐、伊立替康(camptosar、cpt-11)(包括伊立替康与5-fu和甲酰四氢叶酸的治疗方案)、拓扑异构酶抑制剂rfs 2000、二氟甲基鸟氨酸(dmfo)、类视黄醇(例如视黄酸)、卡培他滨、考布他汀、甲酰四氢叶酸(lv)、奥沙利铂(包括奥沙利铂治疗方案(folfox))、拉帕替尼(tykerb.rtm.)、减少细胞增殖的pkc-α、raf、h-ras、egfr(例如厄洛替尼)和vegf-a的抑制剂,以及上述任一者的药学上可接受的盐、酸或衍生物。此外,治疗方法可进一步包括使用放射或放射疗法。此外,治疗方法可进一步包括使用外科手术治疗。
[0248]
由于本文所述的il具有优异的经皮递送特性,本文所述的组合物和组合适用于与有效治疗皮肤病和脱发(alopoeica)(例如,斑秃(alopoecia areta))的活性化合物一起使用。用于治疗脱发的合适的活性化合物可包括例如皮质类固醇(例如,氯倍他索(clobetasol)或醋酸氟轻松(fluocinonide))、米诺地尔(minoxidil)、elocon(莫米松(mometasone))、刺激物(例如,蒽林(anthralin)或局部煤焦油)和环孢素。
[0249]
在某些实施方式中,可将有效剂量的本文所述的组合物(例如,包含如本文所述的至少一种il与至少一种活性化合物组合的组合物)一次给予至患者。在某些实施方式中,可将有效剂量的本文所述的组合物(例如,包含如本文所述的至少一种il与至少一种活性化合物组合的组合物)重复给予至患者。对于全身给予,可向受试者给予治疗量的本文所述的组合物(例如,包含如本文所述的至少一种il与至少一种活性化合物组合的组合物),比如例如,0.1mg/kg、0.5mg/kg、1.0mg/kg、2.0mg/kg、2.5mg/kg、5mg/kg、10mg/kg、15mg/kg、20mg/kg、25mg/kg,30mg/kg、40mg/kg、50mg/kg或更多。在任何方面的一些实施方式中,至少一种活性化合物以约1.0-20.0mg/kg的剂量存在于组合中。在任何方面的一些实施方式中,至少一种活性化合物以1.0-20.0mg/kg的剂量存在于组合中。
[0250]
在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为约1u/kg至约20u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为1u/kg至20u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可小于20u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为约2u/kg至约10u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为2u/kg至10u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为约2u/kg至约5u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为2u/kg至5u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为约5u/kg至约10u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可
为5u/kg至10u/kg。在一些实施方式中,活性化合物为胰岛素,并且胰岛素的浓度或剂量可为2u/kg、5u/kg或10u/kg。
[0251]
在任何实施方式的一个方面,本文描述的是通过注射将活性化合物与如本文所述的至少一种il组合给予到受试者的受影响组织中,以在有需要的受试者中治疗疾病的方法。在一些实施方式中,受影响组织是包括患病细胞的组织。在一些实施方式中,受影响组织是表现出疾病症状的组织。合适的受影响组织的非限制性实例包括肿瘤组织、脂肪组织(fat tissue/adipose tissue)等。在任何方面的一些实施方式中,合适的受影响组织包括肿瘤组织、脂肪组织(fat tissue/adipose tissue)等。在任何方面的一些实施方式中,疾病是由组织生长引起的疾病,例如不期望的、异常的或病理性的组织生长。由组织生长引起的疾病可以是下述任何疾病,所述疾病的特征在于与健康受试者中该组织类型的正常情况不同的组织生长速率、组织生长位置、或组织生长模式/结构,或由与健康受试者中该组织类型的正常情况不同的组织生长速率、组织生长位置、或组织生长模式/结构引起。此类疾病的非限制性实例是肿瘤、癌症、肥胖/肥胖症、和/或增生。在任何方面的一些实施方式中,此类疾病是肿瘤、癌症、肥胖/肥胖症、和/或增生。
[0252]
酶抑制剂是许多病症(包括糖尿病)的治疗选择,其中,例如胰岛素降解酶抑制剂、ace抑制剂和α-葡萄糖苷酶抑制剂都已被作为治疗途径进行了探索。因此,安全、有效的酶抑制剂在许多病症的治疗中受到关注。不希望受理论的束缚,预期本文所述的il可表现出酶抑制活性。因此,在任何实施方式的一个方面,本文描述的是在有需要的受试者中治疗糖尿病、溃疡、癌症或纤维化的方法,所述方法包括向受试者给予包含如本文所述的至少一种il的组合物。在一些实施方式中,组合物不包含其它治疗活性试剂。
[0253]
通过减少瘢痕组织的积累而有利于细胞外基质,纤维化病症得益于细胞外基质的产生和/或维持。如本文所使用的,“纤维化”是指作为修复或反应过程而不是作为器官或组织的正常组成部分的纤维组织的形成。纤维化的特征在于任何特定组织中的超过正常沉积的胶原蛋白沉积和成纤维细胞积累。纤维化可作为炎症、刺激或愈合的结果而发生。需要治疗纤维化病症的受试者为患有或被诊断为患有纤维化病症或处于患有纤维化病症的风险的任何受试者。纤维化病症的非限制性实例包括但不限于肺纤维化、瘢痕、皮肤瘢痕、创伤、伤口、慢性伤口(例如在糖尿病患者中)、角膜缺损、角膜溃疡、角膜伤口、糖尿病性溃疡、溃疡、败血症、关节炎、特发性肺纤维化、囊性纤维化、肝硬化、心内膜心肌纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、进行性大块纤维化、肾源性系统性纤维化、克罗恩病、瘢痕疙瘩、硬皮病、系统性硬化、关节纤维化、粘连性关节囊炎、肺纤维化、肝纤维化、肾纤维化、心脏纤维化、血管纤维化、皮肤纤维化、眼纤维化、骨髓纤维化、哮喘、结节病、copd、肺气肿、血吸虫病(nschistomasomiasis)、胆管炎、糖尿病肾病、狼疮性肾炎、血管成形术后动脉再狭窄、动脉粥样硬化、烧伤瘢痕、增生性瘢痕、肾源性纤维化皮肤病、白内障术后、增殖性玻璃体视网膜病变、peyronie病、duputren挛缩、皮肌炎以及移植物抗宿主病。
[0254]
如本文所使用的,“溃疡”是指体膜的破裂或破坏。在一些实施方式中,溃疡可由受影响的组织的炎症和/或坏死引起。溃疡可为皮肤溃疡(例如压力性溃疡、糖尿病性溃疡、溃疡性皮炎等)、角膜溃疡、口腔溃疡、消化性溃疡、静脉溃疡、应激性溃疡或溃疡性结肠炎。
[0255]
在一些实施方式中,在初始治疗方案之后,可以在较低频率的基础上给予所述治疗。例如,在每两周治疗三个月后,治疗可以每月重复一次,持续六个月或一年或更长。根据
本文所述的方法的治疗可将病症的标志物或症状的水平降低至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%或更多。
[0256]
如有需要,如本文所述的组合物的剂量可由医师确定并进行调整,以匹配所观察到的治疗效果。关于治疗的持续时间和频率,对熟练的临床医师而言,通常会对受试者进行监测,以确定治疗何时提供治疗益处,并确定是否增加或减少剂量、增高或降低给予频率、停止治疗、恢复治疗、或者对治疗方案进行其它改变。根据一些临床因素(如受试者对活性化合物的敏感性),给药时间表(dosing schedule)可以从每周一次到每天一次变化。期望的剂量或活化量可一次给予或分为亚剂量(例如2-4个亚剂量)并在一段时间内(例如在一天中的适当间隔或其它适当时间表)给予。在一些实施方式中,给予可以是长期性的,例如,在数周或数月的时间段内每天一次或多次给药和/或治疗。给药和/或治疗时间表的实例包括在1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月或6个月或更长的时间段内每天、每天两次、每天三次或每天四次或更多次给予。本文所述的组合物(例如,包含至少一种il与至少一种活性化合物组合的组合物)可在一段时间内(例如在5分钟、10分钟、15分钟、20分钟或25分钟内)给予。
[0257]
根据本文所述的方法,给予本文所述组合物的剂量范围取决于例如活性化合物的形式、其效力以及本文所述的病症的症状、标志物或指标的期望减少的程度,例如,症状或标志物所期望的减少百分比。剂量不应太大以致引起不良副作用。通常,剂量将随患者的年龄、状况和性别而变化,并且可由本领域技术人员确定。在任何并发症的情况下,个体医师也可以调整剂量。
[0258]
熟练的临床医生可以确定本文所述的组合物在例如治疗本文所述病症或诱导本文所述应答中的功效。然而,如果在根据本文所述方法的治疗后,本文所述病症的一种或多种症状或迹象以有益的方式改变、其它临床上可接受的症状改善或甚至缓解、或诱导了期望的应答(例如至少10%),则如本文所使用的术语,该治疗被视为“有效治疗”。可以例如通过测量根据本文所述方法治疗的病症的发生率、标志物、指标和/或症状或任何其它合适的可测量参数来评估功效。通过住院治疗或需要医学干预评估的个体恶化的失败(即疾病进展停止),也可以测量功效。测量这些指标的方法是本领域技术人员已知的和/或在本文中描述。治疗包括对个体或动物(一些非限制性实例包括人或动物)的疾病的任何治疗,并且包括:(1)抑制疾病,例如防止症状(例如疼痛或炎症)恶化;或(2)减轻疾病的严重程度,例如引起症状消退。对于疾病治疗而言的有效量是指当给予有需要的受试者时足以产生对该疾病而言的如本文所定义的术语的有效治疗的量。可以通过评估期望的应答或病症的物理指标来确定试剂的功效。通过测量这些参数中的任何一个或参数的任何组合来监测给予和/或治疗的功效完全在本领域技术人员的能力范围内。可在本文所述病症(例如糖尿病或癌症的治疗)的动物模型中评估功效。当使用实验动物模型时,当观察到标志物的统计学上显著的变化时,可证明治疗的功效。
[0259]
本文提供了体外和动物模型测定,其允许对给定剂量的本文所述的组合物(例如,包含至少一种il与至少一种活性化合物组合的组合物)进行评估。通过非限制性实例,通过使用本文实施例中描述的模型可以评估包含至少一种il与胰岛素组合的组合物的剂量效应。
[0260]
肥胖症的发病率正在上升,并且众所周知地,现有的治疗(如节食)具有低的长期成功率。减少肥胖症或降低体重增加率的额外治疗和策略对于解决肥胖症本身以及由超重引起或加重的病症的数量都具有至关重要的意义。不希望受理论的束缚,预期本文所述的il可减少肠道中疏水性/亲脂性分子的摄取。因此,本文提供了通过向有此需要的受试者给予如本文所述的至少一种il来治疗肥胖症和/或减少体重/减少体重增加的方法。在任何方面的一些实施方式中,根据本发明方法治疗的受试者是未患有糖尿病或未诊断为患有糖尿病的受试者。在任何方面的一些实施方式中,根据本发明方法治疗的受试者是未给予胰岛素的受试者。在任何方面的一些实施方式中,包含至少一种il的组合物不包含胰岛素。在任何方面的一些实施方式中,包含至少一种il的组合物不包含对治疗糖尿病有效的另一种试剂和/或另一种药物活性成分。
[0261]
在任何方面的一些实施方式中,活性化合物对治疗肥胖症有效。在任何方面的一些实施方式中,活性化合物对治疗与肥胖症相关的疾病有效。在任何方面的一些实施方式中,活性化合物对治疗由肥胖症引起的疾病有效。在任何方面的一些实施方式中,活性化合物对治疗引起肥胖症的疾病有效。在任何方面的一些实施方式中,活性化合物对治疗代谢综合征有效。
[0262]
在任何方面的一些实施方式中,给予如本文所述的包含至少一种il的组合物(例如,与活性化合物组合)的受试者是患有、经诊断患有或需要治疗肥胖症、超重或预防体重增加的受试者。在一些实施方式中,受试者超重。本文所述的方法包括治疗肥胖症、减少体重增加、预防体重增加、促进体重减轻等的方法。这些方法可以例如促进代谢健康、出于美学原因而被采取、和/或使患者准备好外科手术干预(不适于具有高的bmi或体重的患者)。在一些实施方式中,例如当受试者超重和/或肥胖时,体重减轻可以是医学上必要的和/或医学上指示的。在一些实施方式中,体重减轻可出于美容目的,例如,当受试者期望减轻体重时,无论体重减轻是否是医学上必要的和/或医学上指示的。
[0263]
术语“肥胖症(obesity)”是指体内脂肪过多。肥胖症可以通过本领域技术人员公认和使用的任何量度(measure)来确定。目前,肥胖症的公认的量度是体重指数(bmi),其为相对于以米计的身高平方的以千克计的体重的度量。通常,对于20岁以上的成年人,bmi在约18.5至24.9之间被视为正常,bmi在约25.0至29.9之间被视为超重,bmi在约30.0或约30.0以上被视为肥胖,bmi在约40或约40以上被视为病态肥胖。(参见例如,gallagher等(2000)am j clin nutr 72:694-701.)。这些bmi范围基于体重对疾病风险增加的影响。与高bmi和肥胖症相关的一些常见病症包括心血管疾病、高血压(即hypertension)、骨关节炎、癌症和糖尿病。虽然bmi与体脂相关,但bmi与实际体脂之间的关系因年龄和性别而异。例如,对于相同的bmi,女性比男性更有可能拥有更高的体脂百分比。此外,区分正常、超重和肥胖的bmi阈值可能会随着例如年龄、性别、种族、健康状况(fitness)和体型等因素而有所不同。在一些实施方式中,患有肥胖症的受试者可以是在给予本文所述的治疗之前体重指数为至少约25kg/m2的受试者。在一些实施方式中,患有肥胖症的受试者可以是在给予本文所述的治疗之前体重指数为至少约30kg/m2的受试者。
[0264]
在任何方面的一些实施方式中,给予包含本文所述的至少一种il的组合物(例如,与至少一种活性化合物组合)的受试者是患有、经诊断患有或需要治疗代谢紊乱或代谢综合征的受试者。术语“代谢紊乱(metabolic disorder)”是指与葡萄糖调节或血糖控制受损
或改变相关、或因其而加重的任何紊乱,比如例如胰岛素抵抗。这些紊乱包括但不限于肥胖症、脂肪组织过多、糖尿病、脂肪肝病、非酒精性脂肪肝病、代谢综合征、血脂异常、高血压、高血糖和心血管疾病。与代谢紊乱不同,“代谢综合征(metabolic syndrome)”是指医学紊乱的组合,当同时发生时,会增加发展出心血管疾病和糖尿病的风险。例如美国心脏协会(american heart association)和国际糖尿病基金会(international diabetes foundation)已经建立了一些代谢综合征的定义。仅举一个例子,who将代谢综合征定义为存在以下中的任何一种:糖尿病、糖耐量受损、空腹血糖受损或胰岛素抵抗;以及存在以下的两种:血压等于或大于140/90mmhg、血脂异常、中心性肥胖和微量白蛋白尿。在一些实施方式中,代谢紊乱可选自于由以下组成的组:肥胖症;脂肪组织过多;糖尿病;以及心血管疾病。
[0265]
在溶剂中递送化合物可改善许多活性化合物(例如药物活性化合物)的摄取。然而,这种方法通常不适合在体内使用,因为大多数此类溶剂表现出毒性副作用和/或对递送点起刺激物作用。本文描述的是可提供低毒性和改善的递送动力学的方法和组合物。
[0266]
为了方便起见,以下提供在说明书、实施例和所附权利要求书中使用的一些术语和短语的含义。除非另有说明或从上下文中有所暗示,下列术语和短语包括下面所提供的含义。提供这些定义以帮助描述特定的实施方式,并非旨在限制要求保护的发明,因为本发明的适用范围仅通过权利要求书加以限定。除非另外定义,本文所使用的所有技术术语和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。如果本领域术语的使用与本文提供的定义之间存在明显差异,则以本说明书中提供的定义为准。
[0267]
为了方便起见,本文在说明书、实施例和所附权利要求书中使用的一些术语汇集在此处。
[0268]
羧酸是具有式rcooh的含羰基官能团,其中,r是脂肪族、杂脂肪族烷基或杂烷基。
[0269]
如本文所使用的,术语“烷基”意为具有碳原子链的直链或支链的饱和脂肪族原子团。术语“烷基”包括环烷基或环状烷基。通常使用c
x
烷基和c
x-cy烷基,其中,x和y表示链中的碳原子数。例如,c
1-c6烷基包括具有1个碳至6个碳的链的烷基(例如,甲基、乙基、丙基、异丙基、丁基、仲丁基、异丁基、叔丁基、戊基、新戊基、己基等)。与另一原子团一起表示的烷基(例如,如在芳基烷基中)意为具有指定原子数的直链或支链的饱和烷基二价原子团,或者当未指定原子时意为键,例如(c
6-c
10
)芳基(c
0-c3)烷基包括苯基、苄基、苯乙基、1-苯乙基、3-苯丙基等。烷基的骨架可任选地插入一个或多个杂原子(例如n、o或s)。烷基原子团的实例包括但不限于甲基、乙基、丙基、异丙基、正丁基、叔丁基、新戊基、正己基和正辛基原子团。
[0270]
在优选的实施方式中,直链或支链烷基在其骨架中具有30个以下、且更优选20个以下的碳原子(例如,直链为c
1-c
30
,支链为c
3-c
30
)。同样地,优选的环烷基在其环结构中具有3个-10个碳原子,并且更优选在环结构中具有5个、6个或7个碳。在整个说明书、实施例和权利要求中使用的术语“烷基”(或“低级烷基”)旨在包括“未取代的烷基”和“取代的烷基”两者,其中后者是指具有一个或多个取代基的烷基部分,烃骨架的一个或多个碳上的氢被所述取代基替换。
[0271]
除非对碳数另有说明,本文所使用的“低级烷基”意为如上所定义的烷基基团,但所述烷基基团在其骨架结构中具有1个-10个碳、更优选1个-6个碳原子。同样地,“低级烯
基”和“低级炔基”具有类似的链长。在整个申请中,优选的烷基基团是低级烷基。在优选的实施方式中,本文指定为烷基的取代基是低级烷基。
[0272]
取代的烷基的取代基可包括卤素、羟基、硝基、硫醇、氨基、叠氮基、亚氨基、酰胺基(amido)、磷酰基(包括膦酸酯/盐和亚膦酸酯/盐)、磺酰基(包括硫酸酯/盐、磺酰胺基、氨磺酰基和磺酸酯/盐)和甲硅烷基基团,以及醚、烷基硫醇、羰基(包括酮、醛、羧酸酯/盐和酯)、-cf3、-cn等。
[0273]
如本文所使用的,术语“烯基”是指具有至少一个碳-碳双键的不饱和的直链、支链或环状烃原子团。通常使用c
x
烯基和c
x-cy烯基,其中x和y表示链中的碳原子数。例如,c
2-c6烯基包括具有至少一个双键和1个-6个碳的链的烯基(例如乙烯基、烯丙基、丙烯基、异丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、2-甲基烯丙基、1-己烯基、2-己烯基、3-己烯基等)。与另一原子团一起表示的烯基(例如,如在芳基烯基中)意为具有指定原子数的直链或支链烯基二价原子团。烯基的骨架可任选地插入一个或多个杂原子(例如n、o或s)。
[0274]
如本文所使用的,术语“炔基”是指具有至少一个碳-碳三键的不饱和烃原子团。通常使用c
x
炔基和c
x-cy炔基,其中x和y表示链中的碳原子数。例如,c
2-c6炔基包括具有至少一个三键和1个-6个碳的链的炔基(例如,乙炔基、1-丙炔基、2-丙炔基、1-丁炔基、异戊炔基、1,3-己-二炔基、正己炔基、3-戊炔基、1-己-3-炔基等)。与另一原子团一起表示的炔基(例如,如在芳基炔基中)意为具有指定原子数的直链或支链炔基二价原子团。炔基的骨架可任选地插入一个或多个杂原子(例如n、o或s)。
[0275]
如本文所使用的,术语“卤素(halogen)”或“卤代/卤素(halo)”是指选自氟、氯、溴和碘的原子。术语“卤素放射性同位素”或“卤代同位素”是指选自氟、氯、溴和碘的原子的放射性核素。作为单独的基团或大基团的部分,“卤素取代部分”或“卤代部分”意为由一个或多个“卤素”原子取代的如本文所述的脂肪族、脂环族或芳香族部分,正如此类术语在本技术中所定义的。例如,卤素取代的烷基包括卤代烷基、二卤代烷基、三卤代烷基、全卤代烷基等(例如卤素取代的(c
1-c3)烷基包括氯甲基、二氯甲基、二氟甲基、三氟甲基(-cf3)、2,2,2-三氟乙基、全氟乙基、2,2,2-三氟-1,1-二氯乙基等)。
[0276]
术语“环基”或“环烷基”是指具有3个-12个碳(例如3个-8个碳,以及例如3个-6个碳)的饱和的和部分不饱和的环状烃基。通常使用c
x
环基和c
x-cy环基,其中x和y表示环系中的碳原子数。环烷基基团可另外任选地被例如1个、2个、3个或4个取代基取代。环基基团的实例包括但不限于环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、2,5-环己二烯基、环庚基、环辛基、双环[2.2.2]辛基、金刚烷-1-基、十氢萘基、氧代环己基、二氧代环己基、硫代环己基、2-氧代双环[2.2.1]庚-1-基等。
[0277]
术语“杂环基”是指具有1个-3个杂原子(如果是单环)、1个-6个杂原子(如果是双环)或1个-9个杂原子(如果是三环)的非芳香族5元-8元单环、8元-12元双环或11元-14元三环环系,所述杂原子选自o、n或s(例如,如果是单环、双环或三环,则分别为碳原子和1个-3个n、o或s杂原子,碳原子和1个-6个n、o或s杂原子,或碳原子和1个-9个n、o或s杂原子)。通常使用c
x
杂环基和c
x-cy杂环基,其中x和y表示环系中的碳原子数。在一些实施方式中,各个环的1个、2个或3个氢原子可被取代基取代。示例性杂环基基团包括但不限于:哌嗪基、吡咯烷基、二氧杂环己烷基(dioxanyl)、吗啉基(morpholinyl)、四氢呋喃基、哌啶基、4-morpholyl、4-哌嗪基、吡咯烷基、全氢吡咯嗪基(perhydropyrrolizinyl)、1,4-二氮杂全氢
环庚基(1,4-diazaperhydroepinyl)、1,3-二氧杂环己烷基、1,4-二氧杂环己烷基等。
[0278]
术语“双环”和“三环”是指通过单键稠合、桥接或连接的多环组装体。如本文所使用的,术语“稠合环”是指环与另一环键合形成具有双环结构的化合物,此时当两个环共有的环原子彼此直接键合。常见稠合环的非排它性实例包括:十氢化萘、萘、蒽、菲、吲哚、呋喃、苯并呋喃、喹啉等。具有稠合环系的化合物可以是饱和的、部分饱和的、环基、杂环基、芳香族的、杂芳族的等。
[0279]
术语“芳基”是指单环、双环、或三环稠合芳香族环系。通常使用c
x
芳基和c
x-cy芳基,其中x和y表示环系中的碳原子数。示例性的芳基基团包括但不限于:吡啶基、嘧啶基、呋喃基、噻吩基、咪唑基、噻唑基、吡唑基、哒嗪基、吡嗪基、三嗪基、四唑基、吲哚基、苄基、苯基、萘基、蒽基(anthracenyl)、薁基(azulenyl)、芴基、茚满基、茚基、萘基、苯基、四氢萘基、苯并咪唑基、苯并呋喃基、苯并硫代呋喃基(benzothiofuranyl)、苯并噻吩基(benzothiophenyl)、苯并噁唑基、苯并噁唑啉基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑啉基、咔唑基、4ah-咔唑基、咔啉基(carbolinyl)、色满基(chromanyl)、色烯基(chromenyl)、噌啉基(cinnolinyl)、十氢喹啉基(decahydroquinolinyl)、2h,6h-1,5,2-二噻嗪基、二氢呋喃并[2,3b]四氢呋喃、呋喃基、呋吖基(furazanyl)、咪唑烷基、咪唑啉基、咪唑基、1h-吲唑基、吲哚烯基(indolenyl)、吲哚啉基、吲哚嗪基(indolizinyl)、吲哚基、3h-吲哚基、靛红酰基(isatinoyl)、异苯并呋喃基、异色满基(isochromanyl)、异吲唑基、异吲哚啉基、异吲哚基、异喹啉基、异噻唑基、异噁唑基、亚甲基二氧基苯基(methylenedioxyphenyl)、吗啉基、萘啶基(naphthyridinyl)、八氢异喹啉基、噁二唑基(oxadiazolyl)、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、噁唑烷基、噁唑基(oxazolyl)、羟吲哚基(oxindolyl)、嘧啶基、菲啶基、菲咯啉基(phenanthrolinyl)、吩嗪基、吩噻嗪基、吩噁噻基(phenoxathinyl)、吩噁嗪基(phenoxazinyl)、酞嗪基、哌嗪基、哌啶基、哌啶酮基(piperidonyl)、4-哌啶酮基、胡椒基、蝶啶基(pteridinyl)、嘌呤基、吡喃基、吡嗪基、吡唑烷基、吡唑啉基、吡唑基、哒嗪基、吡啶并噁唑、吡啶并咪唑、吡啶并噻唑、吡啶基(pyridinyl/pyridyl)、嘧啶基、吡咯烷基、吡咯啉基、2h-吡咯基、吡咯基、喹唑啉基、喹啉基、4h-喹嗪基(4h-quinolizinyl)、喹喔啉基(quinoxalinyl)、奎宁环基、四氢呋喃基、四氢异喹啉基、四氢喹啉基、四唑基、6h-1,2,5-噻二嗪基(6h-1,2,5-thiadiazinyl)、1,2,3-噻二唑基(1,2,3-thiadiazolyl)、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基(thianthrenyl)、噻唑基、噻吩基(thienyl)、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、噻吩基(thiophenyl)和呫吨基(xanthenyl)等。在一些实施方式中,每个环的1个、2个、3个或4个氢原子可被取代基取代。
[0280]
术语“杂芳基”是指具有1个-3个杂原子(如果是单环)、1个-6个杂原子(如果是双环)或1个-9个杂原子(如果是三环)的芳香族5元-8元单环、8元-12元稠合双环或11元-14元稠合三环环系,所述杂原子选自o、n或s(例如,如果是单环、双环或三环,则分别为碳原子和1个-3个n、o或s杂原子,碳原子和1个-6个n、o或s杂原子,或碳原子和1个-9个n、o或s杂原子)。通常使用c
x
杂芳基和c
x-cy杂芳基,其中x和y表示环系中的碳原子数。杂芳基包括但不限于源自如下的杂芳基:苯并[b]呋喃、苯并[b]噻吩、苯并咪唑、咪唑并[4,5-c]吡啶、喹唑啉、噻吩并[2,3-c]吡啶、噻吩并[3,2-b]吡啶、噻吩并[2,3-b]吡啶、吲哚嗪、咪唑并[1,2a]吡啶、喹啉、异喹啉、酞嗪、喹喔啉、萘啶、喹嗪、吲哚、异吲哚、吲唑、吲哚啉、苯并噁唑、苯并
吡唑、苯并噻唑、咪唑并[1,5-a]吡啶、吡唑并[1,5-a]吡啶、咪唑并[1,2-a]嘧啶、咪唑并[1,2-c]嘧啶、咪唑并[1,5-a]嘧啶、咪唑并[1,5-c]嘧啶、吡咯并[2,3-b]吡啶、吡咯并[2,3c]吡啶、吡咯并[3,2-c]吡啶、吡咯并[3,2-b]吡啶、吡咯并[2,3-d]嘧啶、吡咯并[3,2-d]嘧啶、吡咯并[2,3-b]吡嗪、吡唑并[1,5-a]吡啶、吡咯并[1,2-b]哒嗪、吡咯并[1,2-c]嘧啶、吡咯并[1,2-a]嘧啶、吡咯并[1,2-a]吡嗪、三唑并[1,5-a]吡啶、蝶啶、嘌呤、咔唑、吖啶、吩嗪、吩噻嗪(phenothiazene)、吩噁嗪、1,2-二氢吡咯并[3,2,1-hi]吲哚、吲哚嗪、吡啶并[1,2-a]吲哚、2(1h)-吡啶酮、苯并咪唑基、苯并呋喃基、苯并硫代呋喃基、苯并噻吩基、苯并噁唑基、苯并噁唑啉基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑啉基、咔唑基、4ah-咔唑基、咔啉基、色满基、色烯基、噌啉基、十氢喹啉基、2h,6h-1,5,2-二噻嗪基、二氢呋喃并[2,3-b]四氢呋喃、呋喃基、呋吖基、咪唑烷基、咪唑啉基、咪唑基、1h-吲唑基、吲哚烯基、吲哚啉基、吲哚嗪基、吲哚基、3h-吲哚基、靛红酰基、异苯并呋喃基、异色满基、异吲唑基、异吲哚啉基、异吲哚基、异喹啉基、异噻唑基、异噁唑基、亚甲基二氧基苯基、吗啉基、萘啶基、八氢异喹啉基、噁二唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、噁唑烷基、噁唑基、氧杂环庚烷基(oxepanyl)、氧杂环丁烷基(oxetanyl)、羟吲哚基、嘧啶基、菲啶基、菲咯啉基、吩嗪基、吩噻嗪基、吩噁噻基、吩噁嗪基、酞嗪基、哌嗪基、哌啶基、哌啶酮基、4-哌啶酮基、胡椒基、碟啶基、嘌呤基、吡喃基、吡嗪基、吡唑烷基、吡唑啉基、吡唑基、哒嗪基、吡啶并噁唑、吡啶并咪唑、吡啶并噻唑、吡啶基(pyridinyl/pyridyl)、嘧啶基、吡咯烷基、吡咯啉基、2h-吡咯基、吡咯基、喹唑啉基、喹啉基、4h-喹嗪基、喹喔啉基、奎宁环基、四氢呋喃基、四氢异喹啉基、四氢吡喃基、四氢喹啉基、四唑基、6h-1,2,5-噻二嗪基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基、噻唑基、噻吩基、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、噻吩基和呫吨基等。一些示例性杂芳基基团包括但不限于:吡啶基、呋喃基(furyl/furanyl)、咪唑基、苯并咪唑基、嘧啶基、噻吩基(thiophenyl/thienyl)、哒嗪基、吡嗪基、喹啉基、吲哚基、噻唑基、萘啶基、2-氨基-4-氧代-3,4-二氢蝶啶-6-基、四氢异喹啉基等。在一些实施方式中,每个环的1个、2个、3个或4个氢原子可被取代基取代。
[0281]
如本文所使用的,术语“取代”是指用取代基对取代部分上的一个或多个氢原子进行的独立的替换,所述取代基独立地选自烷基、烯基、杂环烷基、烷氧基、芳氧基、羟基、氨基、酰胺基(amido)、烷基氨基、芳氨基、氰基、卤素、巯基、硝基、羰基、酰基、芳基和杂芳基基团,但不限于此。
[0282]
如本文所使用的,术语“取代”是指用取代基对取代部分上的一个或多个(通常是1个、2个、3个、4个或5个)氢原子进行的独立的替换,所述取代基独立地选自以下“取代基”定义中列出的取代基的组或另有说明。一般而言,非氢取代基可以是可与指定被取代的给定部分的原子键合的任何取代基。取代基的实例包括但不限于:酰基、酰氨基(acylamino)、酰氧基、醛、脂环族、脂肪族、链烷磺酰胺基(alkanesulfonamido)、链烷磺酰基(alkanesulfonyl)、烷芳基、烯基、烷氧基、烷氧基羰基、烷基、烷基氨基、烷基氨甲酰基(alkylcarbanoyl)、亚烷基(alkylene)、次烷基(alkylidene)、烷硫基(alkylthios)、炔基、酰氨基(amide)、酰胺基(amido)、氨基、氨基、氨基烷基、芳烷基、芳烷基磺酰胺基(aralkylsulfonamido)、芳烃磺酰胺基(arenesulfonamido)、芳烃磺酰基、芳香族、芳基、芳基氨基、芳基氨甲酰基(arylcarbanoyl)、芳氧基(aryloxy)、叠氮基、氨甲酰基
(carbamoyl)、羰基、羰基化合物(carbonyls)(包括酮、羧基、羧酸酯/盐)、cf3、氰基(cn)、环烷基、环亚烷基、酯、醚、卤代烷基、卤素、卤素、杂芳基、杂环基、羟基、羟基、羟烷基、亚氨基、亚氨基酮、酮、巯基、硝基、氧杂烷基(oxaalkyl)、氧代(oxo)、氧代烷基(oxoalkyl)、磷酰基(包括膦酸酯/盐和亚膦酸酯/盐)、甲硅烷基基团、磺酰胺基、磺酰基(包括硫酸酯/盐、氨磺酰基和磺酸酯/盐)、硫醇和脲基部分;它们各自也可任选地被取代或未被取代。在某些情况下,两个取代基与它们所连接的碳一起可以形成环。
[0283]
芳基和杂芳基可任选地在一个或多个位置被一个或多个取代基取代,所述取代基例如卤素、烷基、芳烷基、烯基、炔基、环烷基、羟基、氨基、硝基、巯氢基(sulfhydryl)、亚氨基、酰胺基、磷酸酯/盐、膦酸酯/盐、亚膦酸酯/盐、羰基、羧基、甲硅烷基、醚、烷硫基(alkylthio)、磺酰基、酮、醛、酯、杂环基、芳香族或杂芳族部分、-cf3、-cn等。
[0284]
本文所使用的术语“烷氧基(alkoxyl/alkoxy)”是指具有与其连接的氧原子团的如上所定义的烷基基团。代表性的烷氧基基团包括甲氧基、乙氧基、丙氧基、叔丁氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基等。“醚”是两种烃通过氧共价连接。因此,烷基的取代基(使该烷基成为醚)是烷氧基或类似于烷氧基,例如,所述烷氧基可由-o-烷基、-o-烯基和-o-炔基中的一种表示。芳氧基(aroxy)可由-o-芳基或o-杂芳基表示,其中芳基和杂芳基如下所定义。如上文针对烷基所述,烷氧基和芳氧基基团可被取代。
[0285]
如本文所使用的,术语“芳烷基”是指被芳基基团(例如,芳香族或杂芳香族基团)取代的烷基基团。
[0286]
术语“烷硫基(alkylthio)”是指具有与其连接的硫原子团的如上所定义的烷基基团。在优选的实施方式中,“烷硫基”部分由-s-烷基、-s-烯基和-s-炔基中的一种表示。代表性的烷硫基基团包括甲硫基、乙硫基等。术语“烷硫基”还涵盖环烷基基团、烯烃基团和环烯烃基团和炔烃基团。“芳基硫基”是指芳基或杂芳基基团。
[0287]
术语“亚磺酰基(sulfinyl)”意为原子团-so-。应注意,亚磺酰基原子团可进一步被各种取代基取代以形成不同的亚磺酰基基团,包括亚磺酸、亚磺酰胺、亚磺酰酯、亚砜等。
[0288]
术语“磺酰基(sulfonyl)”意为原子团-so
2-。应注意,磺酰基原子团可进一步被多种取代基取代以形成不同的磺酰基基团,包括磺酸(-so3h)、磺酰胺、磺酸酯、砜等。
[0289]
术语“硫代羰基(thiocarbonyl)”意为原子团-c(s)-。应注意,硫代羰基原子团可进一步被各种取代基取代以形成不同的硫代羰基基团,包括硫代酸、硫代酰胺、硫酯、硫酮等。
[0290]
如本文所使用的,术语“氨基”意为-nh2。术语“烷基氨基”意为具有至少一个与氮连接的直链或支链的不饱和脂肪族、环基或杂环基原子团的氮部分。例如,代表性氨基基团包括nh2、-nhch3、-n(ch3)2、-nh(c
1-c
10
烷基)、-n(c
1-c
10
烷基)2等。术语“烷基氨基”包括“烯基氨基”、“炔基氨基”、“环基氨基”和“杂环基氨基”。术语“芳基氨基”意为具有至少一个与氮连接的芳基原子团的氮部分。例如,-nh芳基和-n(芳基)2。术语“杂芳基氨基”意为具有至少一个与氮连接的杂芳基原子团的氮部分。例如,-nh杂芳基和-n(杂芳基)2。任选地,两个取代基和氮一起也可形成环。除非另有说明,本文所述的含有氨基部分的化合物可包括其经保护的衍生物。对于氨基部分而言合适的保护基包括乙酰基、叔丁氧基羰基、苄氧羰基等。
[0291]
术语“氨基烷基”意为如上定义的烷基、烯基和炔基,但一个或多个取代或未取代的氮原子(-n-)位于所述烷基、烯基或炔基的碳原子之间。例如,(c
2-c6)氨基烷基是指包含2
个至6个碳原子和位于碳原子之间的一个或多个氮原子的链。
[0292]
术语“烷氧基烷氧基”意为-o-(烷基)-o-(烷基),例如
–
och2ch2och3等。术语“烷氧基羰基”意为-c(o)o-(烷基),例如-c(=o)och3、-c(=o)och2ch3等。术语“烷氧基烷基”意为-(烷基)-o-(烷基),例如-ch2och3、-ch2och2ch3等。术语“芳氧基”指-o-(芳基),例如-o-苯基、-o-吡啶基等。术语“芳烷基”意为-(烷基)-(芳基),例如苄基(即,-ch2苯基)、-ch
2-吡啶基等。术语“芳烷基氧基”意为-o-(烷基)-(芳基),例如-o-苄基、-o-ch
2-吡啶基等。术语“环烷基氧基”意为-o-(环烷基),例如-o-环己基等。术语“环烷基烷氧基”意为-o-(烷基)-(环烷基),例如-och2环己基等。术语“氨基烷氧基”意为-o-(烷基)-nh2,例如-och2nh2、-och2ch2nh2等。术语“单-或二-烷基氨基”分别意为-nh(烷基)或-n(烷基)(烷基),例如-nhch3、-n(ch3)2等。术语“单-或二-烷基氨基烷氧基”分别意为-o-(烷基)-nh(烷基)或-o-(烷基)-n(烷基)(烷基),例如-och2nhch3、-och2ch2n(ch3)2等。术语“芳氨基”意为-nh(芳基),例如-nh-苯基、-nh-吡啶基等。术语“芳烷基氨基”意为-nh-(烷基)-(芳基),例如-nh-苄基、-nhch
2-吡啶基等。术语“烷基氨基”意为-nh(烷基),例如-nhch3、-nhch2ch3等。术语“环烷基氨基”意为-nh-(环烷基),例如-nh-环己基等。术语“环烷基烷基氨基”意为-nh-(烷基)-(环烷基),例如-nhch
2-环己基等。
[0293]
关于本文提供的所有定义,应当指出的是,所述定义应当解释为开放式的,就此而言,所指定的取代基以外的其它取代基可包括在内。因此,c1烷基表示存在一个碳原子但并未表示该碳原子上存在何种取代基。因此,c1烷基包括甲基(即-ch3)以及-crarbrc,其中ra、rb和rc可各自独立地为氢或者任何其它取代基,其中碳的α位原子为杂原子或氰基。因此,cf3、ch2oh和ch2cn均为c1烷基。
[0294]
除非另有说明,本文描述的结构意在包括仅在一个或多个同位素富集原子的存在方面有所不同的化合物。例如,下述化合物均在本发明的范围内,所述化合物除了用氘或氚替换氢原子或用富含
13
c-或
14
c-的碳替换碳原子之外,具有本发明的结构。
[0295]
如本文所使用的,术语“异构体”是指具有相同分子式但结构不同的化合物。仅在构型和/或构象上不同的异构体被称为“立体异构体”。术语“异构体”也用于指对映异构体。
[0296]
术语“对映异构体”用于描述彼此成镜像且不可重叠的一对分子异构体中的一个。用于指定或指代对映异构体的其它术语包括“立体异构体”(因为手性中心周围的不同排列或立体化学;尽管所有的对映异构体都是立体异构体,但并非所有的立体异构体都是对映异构体)或“光学异构体”(因为纯的对映异构体的光学活性,所述光学活性是不同的纯的对映异构体在不同方向上使平面偏振光旋转的能力)。对映异构体一般具有相同的物理性质,例如熔点和沸点,并且还具有相同的光谱性质。对映异构体可以在它们与平面偏振光的相互作用以及生物学活性方面彼此不同。
[0297]
术语“外消旋混合物”、“外消旋化合物”或“外消旋体”是指一种化合物的两种对映异构体的混合物。理想的外消旋混合物是如下物质,其中存在化合物的两种对映异构体的50:50的混合物,从而使得(+)对映异构体的旋光性抵消(-)对映异构体的旋光性。
[0298]
当用于外消旋混合物时,术语“拆分(resolving和/或resolution)”指将外消旋体分离为它的两种对映异构形式(即(+)和(-);或(r)和(s)形式)。该术语还可指外消旋体的一种异构体对映选择性转化为产物。
[0299]
术语“对映异构体过量(enantiomeric excess或ee)”是指反应产物,其中一种对
映异构体的生成量超过另一种对映异构体,且定义为(+)-对映异构体和(-)-对映异构体的混合物,其组成以摩尔或重量或体积分数f
(+)
和f
(-)
(其中f
(+)
和f
(-)
之和=1)给出。对映异构体过量定义为*f
(+)-f
(-)
*,对映异构体过量百分比定义为100
×
*f
(+)-f
(-)
*。对映异构体的“纯度”由其ee或ee百分比值(ee%)描述。
[0300]
无论表示为“纯化的对映异构体(purified enantiomer)”或“纯的对映异构体(pure enantiomer)”或“拆分的对映异构体(resolved enantiomer)”或“对映异构体过量的化合物(a compound in enantiomeric excess)”,这些术语都表示一种对映异构体的量超过另一种对映异构体的量。因此,当提及对映异构体制剂时,可使用两种(或其中之一)主要对映异构体的百分比(例如,以摩尔计或以重量计或以体积计)和(或)主要对映异构体的对映异构体过量百分比,来确定该制剂是否代表纯化的对映异构体制剂。
[0301]
异构体的术语“对映异构体纯度(enantiomeric purity/enantiomer purity)”是指纯化的对映异构体的定性或定量量度;通常,测量值基于ee或对映异构体过量来表示。
[0302]
术语“基本上纯化的对映异构体(substantially purified enantiomer)”、“基本上拆分的对映异构体(substantially resolved enantiomer)”、“基本上纯化的对映异构体制剂(substantially purified enantiomer preparation)”意在表示其中一种对映异构体的富集程度已比另一种对映异构体更高的制剂(例如,衍生自非光学活性起始材料、底物或中间体),且更优选地,其中另一种对映异构体占对映异构体或对映异构体制剂的小于20%、更优选小于10%、更优选小于5%、还更优选小于2%。
[0303]
术语“纯化的对映异构体”、“拆分的对映异构体”和“纯化的对映异构体制剂”意在表示其中一种对映异构体(例如,r-对映异构体)的富集程度已比另一对映异构体更高的制剂(例如,衍生自非光学活性起始材料、底物或中间体),且更优选地,其中另一种对映异构体(例如,s-对映异构体)占制剂的小于30%、优选小于20%、更优选小于10%(例如,在该特定示例中,r-对映异构体基本上不含s-对映异构体)、更优选小于5%、还更优选小于2%。可合成基本上不含另一种对映异构体的纯化的对映异构体,或可在立体优选程序中合成纯化的对映异构体,然后进行分离步骤,或纯化的对映异构体可衍生自外消旋混合物。
[0304]
术语“对映选择性”(也称为由符号“e”表示的对映异构体比例)是指酶从外消旋底物相对于产物外消旋混合物中的另一种对映异构体产生一种对映异构体的选择性能力;换句话说,它是酶区分对映异构体的能力的量度。非选择性反应的e为1,而e大于20的分辨率通常被认为对合成或拆分有用。对映选择性取决于所讨论的对映异构体之间转化率的差异。获得富集了一种对映异构体的反应产物;相反,剩余底物富集了另一种对映异构体。为了实用目的,通常希望得到大量过量的一种对映异构体。这通过在一定程度的转化下终止转化过程来实现。
[0305]
cage(胆碱和香叶酸根)为包含阳离子胆碱(参见例如结构i)和阴离子香叶酸根或香叶酸(参见例如结构ii和结构iii)的离子液体。cage的制备可为例如如国际专利公开wo 2015/066647中所述;以引用的方式将其整体内容并入本文,或如本文实施例中所述。
[0306][0307]
本文所使用的术语“减少”、“降低的”、“降低”或“抑制”都是指降低统计学上显著的量。在一些实施方式中,“下降”、“降低”、或“减少”或“抑制”通常是指与参照水平(例如,缺少给定的治疗或试剂)相比减少至少10%,并且可以包括例如减少至少约10%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%、或更多。如本文所使用的“降低”或“抑制”并未涵盖与参照水平相比的完全抑制或降低。“完全抑制”是与参照水平相比的100%的抑制。减少可以优选下降至在没有给定的紊乱的个体的正常范围内接受的水平。
[0308]
本文所使用的术语“增加的/增高的”、“增加/增高”、“增强”或“激活/活化”都是指增加统计学上显著的量。在一些实施方式中,术语“增加的/增高的”、“增加/增高”、“增强”或“激活/活化”可意味着与参照水平相比增加至少10%,例如增加至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%或上至并包括100%的增加、或与参照水平相比的10%-100%之间的任意增加、或者至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍或至少约10倍的增加、或与参照水平相比的2倍至10倍之间的任意增加或更多。在标志物或症状的上下文中,“增加/增高”是以此类水平的统计学上的显著增加/增高。
[0309]
如本文所使用的,“受试者”是指人或动物。通常动物是脊椎动物,例如灵长类动物、啮齿类动物、家养动物或狩猎动物。灵长类动物包括黑猩猩、食蟹猴、蜘蛛猴、以及猕猴例如恒河猴。啮齿类动物包括小鼠、大鼠、旱獭、雪貂、兔和仓鼠。家养动物和狩猎动物包括奶牛;马;猪;鹿;野牛;水牛;猫科动物,例如家猫;犬科动物,例如狗、狐狸、狼;鸟类,例如
鸡、鸸鹋、鸵鸟;以及鱼类,例如鳟鱼、鲶鱼和鲑鱼。在一些实施方式中,受试者是哺乳动物,例如灵长类动物,例如人。术语“个体”、“患者”和“受试者”在本文中可互换使用。
[0310]
优选地,受试者是哺乳动物。所述哺乳动物可以是人、非人灵长类动物、小鼠、大鼠、狗、猫、马或奶牛,但不限于这些示例。除了人之外的哺乳动物可以有利地用作代表本发明所述的病症的动物模型的受试者。受试者可以是雄性或雌性。
[0311]
受试者可以是先前已被诊断或鉴别为患有或具有需要治疗的病症或者与该病症相关的一种或多种并发症的受试者,并且可选地已经接受对病症的治疗或对与该病症相关的一种或多种并发症的治疗。或者,受试者也可以是先前没有被诊断为具有病症或与该病症相关的一种或多种并发症的受试者。例如,受试者可以是显示出病症的一个或多个风险因素或者显示出与该病症相关的一种或多种并发症的一个或多个风险因素的受试者、或未显示风险因素的受试者。
[0312]“需要”治疗特定病症的“受试者”可以是具有下述病症的受试者:诊断为具有该病症或诊断为具有发展出该病症的风险。
[0313]
如本文所使用的,术语“蛋白”和“多肽”在本文中互换使用,以指定一连串的氨基酸残基,所述氨基酸残基通过在相邻残基的α-氨基基团和羧基基团之间的肽键相互连接。无论其大小或功能,术语“蛋白”和“多肽”是指氨基酸的聚合物,所述氨基酸包括经修饰的氨基酸(例如,磷酸化、糖化、糖基化等)和氨基酸类似物。“蛋白”和“多肽”通常用来指比较大的多肽,而术语“肽”通常用于指小的多肽,但是在本领域中这些术语的用法重叠。当指基因产物及其片段时,术语“蛋白”和“多肽”在本文中互换使用。因此,示例性的多肽或蛋白包括基因产物、天然存在的蛋白、同源物、直系同源物、旁系同源物、片段和上述物质的其它等同物、变型、片段和类似物。
[0314]
在本文所述的多种实施方式中,在进一步考虑之列的是涵盖所描述的任何具体多肽的变体(天然存在的或其它的)、等位基因、同源物、保守修饰变体和/或保守置换变体。对于氨基酸序列,本领域技术人员将认识到,当改变引起将氨基酸置换为化学上类似的氨基酸并保留了多肽的期望活性时,对经编码的序列中的单个氨基酸或少部分的氨基酸进行改变的核酸、肽、多肽或蛋白序列的个别置换、缺失或添加是“保守修饰变体”。此类保守修饰变体在与本公开相一致的多态变体、种间同源物和等位基因的基础之上另外存在,并且不排除与本公开相一致的多态变体、种间同源物和等位基因。
[0315]
给定的氨基酸可以被具有相似的理化特性的残基替代,例如,用一个脂肪族残基置换另一残基(例如用ile、val、leu或ala互相置换),或用一个极性残基置换另一残基(例如lys和arg之间;glu和asp之间;或gln和asn之间)。其它这样的保守置换(例如置换具有类似疏水性特征的整个区域)是公知的。能够以本文所述的任何一种测定对包含保守氨基酸置换的多肽进行测试,以确认保留了期望的活性(例如天然或参考多肽的活性和特异性)。
[0316]
氨基酸可以根据其侧链的性质方面的相似性进行分组(在a.l.lehninger,in biochemistry,第二版,pp.73-75,worth publishers,new york(1975)中):(1)非极性的:ala(a)、val(v)、leu(l)、ile(i)、pro(p)、phe(f)、trp(w)、met(m);(2)不带电的极性的:gly(g)、ser(s)、thr(t)、cys(c)、tyr(y)、asn(n)、gln(q);(3)酸性的:asp(d)、glu(e);(4)碱性的:lys(k)、arg(r)、his(h)。或者,可基于共同的侧链特性将天然存在的残基分为如下的组:(1)疏水的:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水的:cys、ser、thr、asn、gln;
(3)酸性的:asp、glu;(4)碱性的:his、lys、arg;(5)残基影响链取向:gly、pro;(6)芳香的:trp、tyr、phe。非保守置换牵涉到用这些类别之一的一个成员更换另一类别。特定的保守置换包括例如:将ala置换为gly或置换为ser;将arg置换为lys;将asn置换为gln或置换为his;将asp置换为glu;将cys置换为ser;将gln置换为asn;将glu置换为asp;将gly置换为ala或置换为pro;将his置换为asn或置换为gln;将ile置换为leu或置换为val;将leu置换为ile或置换为val;将lys置换为arg、置换为gln或置换为glu;将met置换为leu、置换为tyr或置换为ile;将phe置换为met、置换为leu或置换为tyr;将ser置换为thr;将thr置换为ser;将trp置换为tyr;将tyr置换为trp;和/或将phe置换为val、置换为ile或置换为leu。
[0317]
在一些实施方式中,本文所述的多肽(或编码这一多肽的核酸)可以是本文所述的氨基酸序列之一的功能片段。如本文所使用的,“功能片段”是根据本文下文所述的测定保留至少50%的野生型参考多肽的活性的肽的片段或节段。功能片段可包含本文公开的序列的保守置换。
[0318]
在一些实施方式中,本文所述的多肽可以是本文所述的序列的变体。在一些实施方式中,变体是保守修饰变体。保守置换变体可以通过例如天然核苷酸序列的突变获得。本文所指的“变体”是与天然多肽或参考多肽实质上同源的多肽,但是该多肽由于一个或多个缺失、插入或置换而具有与天然或参考多肽的氨基酸序列不同的氨基酸序列。编码变体多肽的dna序列涵盖如下序列:当与天然dna序列或参考dna序列相比时,所述序列包含一个或多个核苷酸的添加、缺失或置换,但是编码保留活性的变体蛋白或其片段。多种基于pcr的位点特异性诱变方法在本领域中是已知的,并且可以被普通技术人员应用。
[0319]
变体氨基酸或dna序列可与天然或参考序列具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多的一致性。天然序列和突变序列之间的同源性程度(一致性百分比)可以通过例如使用万维网上通常用于此目的的免费可用的计算机程序(例如具有默认设置的blastp或blastn)对两个序列进行比较来确定。
[0320]
在任何方面的一些实施方式中,变体可为与本文提供的参考序列之一具有至少90%、至少95%、至少98%或更高的序列同源性并且保留该参考序列的野生型活性(例如肠降血糖素活性)的多肽。在任何方面的一些实施方式中,变体可为与本文提供的天然存在的参考序列之一具有至少90%、至少95%、至少98%或更高的序列同源性并保留该参考序列的野生型活性(例如肠降血糖素活性)的多肽。在任何方面的一些实施方式中,变体可为与本文提供的参考序列之一具有至少90%、至少95%、至少98%或更高的序列同源性并且保留了该参考序列的野生型活性(例如肠降血糖素活性)的天然存在的多肽。
[0321]
天然氨基酸序列的改变可通过本领域技术人员已知的多种技术的任一种来完成。例如,可通过合成含有突变序列的寡核苷酸而在特定基因座引入突变,所述寡核苷酸侧接有允许与天然序列的片段连接的限制性位点。连接后,所得到的重构序列编码具有期望的氨基酸插入、置换或缺失的类似物。或者,可使用寡核苷酸指导的位点特异性的突变发生程序来提供具有特定密码子的改变的核苷酸序列,所述特定密码子根据所需的置换、缺失或插入而改变。进行这种改变的技术已很好地建立,并且包括例如通过walder等(gene 42:133,1986);bauer等(gene 37:73,1985);craik(biotechniques,1985年1月,12-19);smith等(genetic engineering:principles and methods,plenum press,1981)和美国专利
nos:4,518,584和4,737,462公开的那些技术,将其通过引用整体并入本文。通常,还可用丝氨酸对不参与维持多肽的适当构象的任何半胱氨酸残基进行置换,以改进分子的氧化稳定性并防止异常交联。相反,可将半胱氨酸键添加至多肽,以改进多肽的稳定性或促进寡聚化。
[0322]
如本文所使用的,术语“抗体”是指免疫球蛋白分子和免疫球蛋白分子的免疫学活性部分,即包含免疫特异性地结合抗原的抗原结合位点的分子。该术语还指由两条免疫球蛋白重链和两条免疫球蛋白轻链组成的抗体以及包括全长抗体及其抗原结合部分在内的多种形式;包括例如免疫球蛋白分子、单克隆抗体、嵌合抗体、cdr移植抗体、人源化抗体、fab、fab’、f(ab’)2、fv、二硫键连接的fv、scfv、单域抗体(dab)、双价抗体、多特异性抗体、双重特异性抗体、抗独特型抗体、双特异性抗体、它们的功能活性表位结合部分和/或双功能杂交抗体。每条重链由所述重链的可变区(在本文缩写为hcvr或vh)和所述重链的恒定区组成。重链恒定区由三个结构域ch1、ch2和ch3组成。每条轻链由所述轻链的可变区(在本文缩写为lcvr或vl)和所述轻链的恒定区组成。轻链恒定区由cl结构域组成。vh和vl区可以进一步分为被称为互补决定区(cdr)的高变区并散布有被称为框架区(fr)的保守区。因此,每个vh和vl区由三个cdr和四个fr组成,它们从n端到c端按以下顺序排布:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。该结构是本领域技术人员所公知的。
[0323]
如本文所使用的,术语“抗体试剂”是指多肽,所述多肽包含至少一个免疫球蛋白可变结构域或免疫球蛋白可变结构域序列,并特异性地结合给定的抗原。抗体试剂可包括抗体或含有抗体的抗原结合结构域的多肽。在一些实施方式中,抗体试剂可包括单克隆抗体或含有单克隆抗体的抗原结合结构域的多肽。例如,抗体可包含重(h)链可变区(本文中缩写为vh)和轻(l)链可变区(本文中缩写为vl)。在另一示例中,抗体包含两个重(h)链可变区和两个轻(l)链可变区。术语“抗体试剂”涵盖了抗体的抗原结合片段(例如单链抗体、fab片段和sfab片段、f(ab’)2、fd片段、fv片段、scfv、和结构域抗体(dab)片段以及完整抗体)。
[0324]
抗体和/或抗体试剂可包括免疫球蛋白分子、单克隆抗体、嵌合抗体、cdr移植抗体、人源化抗体、全长人抗体、fab、fab’、f(ab’)2、fv、二硫键连接的fv、scfv、单域抗体、双价抗体、多特异性抗体、双重特异性抗体、抗独特型抗体、双特异性抗体、及它们的功能活性表位结合部分。
[0325]
如本文所使用的,术语“纳米体(nanobody)”或单域抗体(sdab)是指包含从骆驼(camel)和单峰骆驼(dromedary)获得的抗体的小的单个可变结构域(vhh)的抗体。已在尺寸、结构复杂性和对人受试者的抗原性方面,对从骆驼和单峰骆驼(camelus baclrianus和calelus dromaderius)家族成员(包括新的世界成员,例如美洲驼物种(lama paccos、lama glama和lama vicugna))获得的抗体蛋白进行了表征。自然界中发现的来自该哺乳动物家族的某些igg抗体缺少轻链,并因此在结构上不同于就来自其它动物的抗体而言的、具有两条重链和两条轻链的典型四链四级结构。参见pct/ep93/02214(1994年3月3日公开的wo 94/04678;以引用的方式将其内容整体并入本文)。
[0326]
可通过基因工程获得鉴定为vhh的小的单个可变结构域的骆驼抗体的区域,以产生对靶标具有高亲和力的小蛋白质,从而产生称为“骆驼纳米体”的低分子量抗体衍生的蛋白质。参见1998年6月2日发行的u.s.pat.no.5,759,808;还参见stijlemans,b.等,2004 j biol chem 279:1256-1261;dumoulin,m.等,2003 nature 424:783-788;pleschberger,m.
等,2003 bioconjugate chem 14:440-448;cortez-retamozo,v.等,2002 int jcancer 89:456-62;以及lauwereys,m.等,1998 embo j.17:3512-3520;每一篇以引用的方式将其内容整体并入本文。骆驼抗体和抗体片段的工程库可商购获得,例如,来自ablynx,ghent,belgium。与非人源的其它抗体一样,可重组改变骆驼抗体的氨基酸序列,以获得与人序列更像的序列,即纳米体可以进行“人源化”。因此,骆驼抗体对人的天然低抗原性可进一步降低。
[0327]
骆驼纳米体的分子量约为人igg分子的十分之一,并且所述蛋白质的物理直径仅为几纳米。小尺寸的一个结果是骆驼纳米体能够结合到更大抗体蛋白质在功能上不可见的抗原位点,即骆驼纳米体可用作使用传统免疫技术检测不到的抗原的检测试剂,并可用作可能的治疗剂。因此,小尺寸的另一结果是骆驼纳米体由于结合靶蛋白的沟(groove)或窄缝(narrow cleft)中的特异位点而因此可以抑制靶蛋白,因此与传统抗体的功能相比,可以发挥更像传统低分子量药物功能的能力。低分子量和紧密尺寸进一步导致骆驼纳米体极其热稳定,对极端ph和蛋白酶解消化稳定,且抗原性弱。参见2004年8月19日公开的us专利申请20040161738;以引用的方式将其内容整体并入本文。这些特征与对人的低抗原性结合表明了巨大的治疗潜力。
[0328]
如本文所使用的,术语“核酸”或“核酸序列”是指并入核糖核酸、脱氧核糖核酸或它们的类似物的单元的任何分子,优选聚合分子。核酸可以是单链或双链的。单链核酸可为变性的双链dna的一条核酸链。或者,单链核酸可为并非衍生自任何双链dna的单链核酸。在一个方面,核酸可以是dna。在另一方面,核酸可以是rna。合适的dna可包括例如cdna。合适的rna可包括例如mrna。
[0329]
如本文所使用的,“抑制性核酸”是指可抑制靶标(例如双链rna(dsrna)、抑制性rna(irna)等)的表达的核酸分子。
[0330]
双链rna分子(dsrna)已显示出以称为rna干扰(rnai)的高度保守的调控机制阻断基因表达。本文所述的抑制性核酸可以包括具有长度为30个或更少的核苷酸(即,长度为15-30个核苷酸、长度通常为19-24个核苷酸)的区域的rna链(反义链),该区域实质上与靶向的mrna转录物的至少一部分互补。使用这些irna使得可以靶向降解mrna转录物,引起靶标的表达和/或活性降低。
[0331]
如本文所使用的,术语“irna”是指含有rna(或本文下文所述的经修饰的核酸)、并通过rna诱导的沉默复合物(risc)通路来介导rna转录物的靶向切割的试剂。在任何方面的一些实施方式中,本文所述的irna引起靶标的表达和/或活性的抑制。在任何方面的一些实施方式中,与不存在irna的细胞中发现的靶mrna水平相比,用抑制剂(例如irna)接触细胞造成细胞中的靶mrna水平降低至少约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约99%、上至并包括100%。在任何方面的一些实施方式中,与不存在irna的受试者中发现的靶mrna水平相比,向受试者给予抑制剂(例如irna)造成受试者中的靶mrna水平降低至少约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约99%、上至并包括100%。
[0332]
在任何方面的一些实施方式中,irna可以是dsrna。dsrna包括两条rna链,两条rna链充分互补,以在使用dsrna的情况下杂交形成双链结构。dsrna的一条链(反义链)包括互补区域,该区域与靶序列实质上互补、且通常完全互补。靶序列可以衍生自在靶标的表达过
程中形成的mrna的序列,即,其可以跨越一个或多个内含子边界。另一条链(正义链)包含互补于反义链的区域,从而使得当在适当的条件下结合时,两条链杂交并形成双链结构。通常,双链结构的长度在15至30个碱基对之间,包括端值;长度更通常在18至25个碱基对之间,包括端值;长度更通常在19至24个碱基对之间,包括端值;并且长度最通常在19至21个碱基对之间,包括端值。类似地,与靶序列互补的区域的长度在15至30个碱基对之间,包括端值;长度更通常在18至25个碱基对之间,包括端值;长度更通常在19至24个碱基对之间,包括端值;并且长度最通常在19至21个碱基对之间,包括端值。在任何方面的一些实施方式中,dsrna的长度在15至20个核苷酸之间,包括端值;并且在其它实施方式中,dsrna的长度在25和30个核苷酸之间,包括端值。正如普通技术人员将认识到的,靶向用于切割的rna的靶向区域最通常是较大的rna分子(通常是mrna分子)的一部分。相关地,mrna靶标的“部分”是具有足以成为rnai引导的切割(即,通过risc通路切割)的底物的长度的mrna靶标的连续序列。在一些情况下,具有短至9个碱基对的双链的dsrna介导rnai引导的rna切割。最常见的靶标是至少15个核苷酸的长度、优选15-30个核苷酸的长度。
[0333]
抑制性核酸的类型的示例性实施方式可包括例如:sirna、shrna、mirna和/或amirna,其为本领域公知的。
[0334]
在任何方面的一些实施方式中,对irna的rna(例如dsrna)进行化学修饰,以增强稳定性或其它有益的特性。可以通过本领域完善建立的方法修饰和/或合成本文所述的核酸,例如描述于“current protocols in nucleic acid chemistry”,beaucage,s.l.等(编),john wiley&sons,inc.,new york,ny,usa中的方法,以引用的方式由此将其并入本文。修饰包括:例如(a)末端修饰,例如5’端修饰(磷酸化、缀合、反向连接等)、3’端修饰(缀合、dna核苷酸、反向连接等);(b)碱基修饰,例如,用稳定碱基、不稳定碱基、或与扩大体系的伴侣碱基配对的碱基进行的置换;移除碱基(脱碱基核苷酸)或缀合碱基;(c)糖修饰(例如,在2’位或4’位)或糖置换;以及(d)骨架修饰,包括磷酸二酯连接的修饰或置换。用于本文所述的实施方式中的rna化合物的具体示例包括但不限于含有经修饰的骨架或无天然核苷间连接的rna。其中,具有经修饰的骨架的rna包括在骨架中不具有磷原子的rna。为了本技术文件的目的,并且如本领域有时所引用的,在其核苷间的骨架中不具有磷原子的经修饰的rna也可以被认为是寡核苷酸。在任何方面的一些实施方式中,经修饰的rna将会在其核苷间的骨架中具有磷原子。
[0335]
经修饰的rna骨架可以包括例如:具有正常的3
’‑5’
连接的boranophosphates、磷硫酰、手性磷硫酰、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其它烷基膦酸酯(包括3
’‑
亚烷基膦酸酯和手性膦酸酯)、亚磷酸酯、氨基磷酸酯(包括3
’‑
氨基磷酸氨基酯和氨基烷基氨基磷酸酯)、硫羰氨基磷酸酯(thionophosphoramidates)、硫羰烷基膦酸酯(thionoalkylphosphonates)和硫羰烷基磷酸三酯;它们的2
’‑5’
连接的类似物;以及具有反极性的物质(其中,相邻的核苷单元对以3
’‑5’
至5
’‑3’
或2
’‑5’
至5
’‑2’
连接)。各种盐、混合盐和游离酸形式也包括在内。在其中不包含磷原子的经修饰的rna骨架具有通过如下形成的骨架:短链烷基或环烷基核苷间连接、混合的杂原子和烷基或环烷基核苷间连接、或者一个或多个短链杂原子或杂环核苷间连接。这些骨架包括:具有吗啉代连接(部分上由核苷的糖部分形成)的骨架;硅氧烷骨架;硫化物骨架、亚砜骨架或砜骨架;formacetyl骨架和thioformacetyl骨架;methylene formacetyl骨架和methylene thioformacetyl骨架;含
烯烃骨架;氨基磺酸酯骨架;亚甲基亚氨基骨架和亚甲基肼基骨架;磺酸酯骨架和磺胺骨架;酰胺骨架;以及其它的具有混合的n、o、s和ch2组成部分的骨架,以及具有杂原子骨架的寡核苷酸,并且特别是
‑‑
ch2‑‑
nh
‑‑
ch2‑‑
、
‑‑
ch2‑‑
n(ch3)
‑‑o‑‑
ch2‑‑
[称为亚甲基(甲基亚氨基)骨架或mmi骨架]、
‑‑
ch2‑‑o‑‑
n(ch3)
‑‑
ch2‑‑
、
‑‑
ch2‑‑
n(ch3)
‑‑
n(ch3)
‑‑
ch2‑‑
和
‑‑
n(ch3)
‑‑
ch2‑‑
ch2‑‑
[其中,天然磷酸二酯骨架表示为
‑‑o‑‑
p
‑‑o‑‑
ch2‑‑
]。
[0336]
适于或考虑用于irna中的其它rna模拟物中,核苷酸单元的糖和核苷间连接(即骨架)用新的基团所取代。碱基单元被保留用于与适当的核酸靶化合物杂交。一种此类寡聚化合物(已显示具有良好的杂交性质的rna模拟物)被称为肽核酸(pna)。在pna化合物中,rna的糖骨架被含酰胺骨架(特别是氨基乙基甘氨酸骨架)取代。核碱基保留并且直接或间接地结合至骨架的酰胺部分的氮杂氮原子。
[0337]
irna的rna也可以被修饰成包含一个或多个锁核酸(lna)。锁核酸是具有经修饰的核糖部分的核苷酸,其中,所述核糖部分包含连接2’位和4’位碳原子的另外的桥。这一结构有效地将核糖“锁定”在3
’‑
内向结构构象中。已经显示出,将锁核酸添加至sirna增加了血清中的sirna的稳定性,并降低了脱靶效应(elmen,j.等,(2005)nucleic acids research 33(1):439-447;mook,or.等,(2007)mol canc ther 6(3):833-843;grunweller,a.等,(2003)nucleic acids research 31(12):3185-3193)。
[0338]
经修饰的rna还可以包含一个或多个取代的糖部分。本文所述的irna(例如dsrna)在2’位置可以包含如下中的一种:oh;f;o-烷基、s-烷基或n-烷基;o-烯基、s-烯基或n-烯基;o-炔基、s-炔基或n-炔基;或者o-烷基-o-烷基,其中,烷基、烯基和炔基可以是取代或未取代的c1-c10烷基或c2-c10烯基和c2-c10炔基。示例性的适当的修饰包括:o[(ch2)no]mch3、o(ch2)noch3、o(ch2)nnh2、o(ch2)nch3、o(ch2)nonh2和o(ch2)non[(ch2)nch3)]2,其中,n和m为从1至约10。在任何方面的一些实施方式中,dsrna在2’位置包含如下中的一种:c1-c10低级烷基;取代的低级烷基、烷芳基、芳烷基、o-烷芳基或o-芳烷基;sh、sch3、ocn、cl、br、cn、cf3、ocf3、soch3、so2ch3、ono2、no2、n3、nh2;杂环烷基、杂环烷芳基、氨基烷氨基、多烷基氨基、取代的甲硅烷基、rna切割基团、报告子基团、嵌入剂、改善irna的药代动力学性质的基团、或改善irna的药效动力学性质的基团、以及具有类似性质的其它取代基。在任何方面的一些实施方式中,所述修饰包括2
’‑
甲氧基乙氧基(2
’‑o‑‑
ch2ch2och3,也称为2
’‑
o-(2-甲氧基乙基)或2
’‑
moe)(martin等,helv.chim.acta,1995,78:486-504),即烷氧基-烷氧基基团。另一示例性的修饰是如下文的实施例所述的2
’‑
二甲基氨基氧基乙氧基,即o(ch2)2on(ch3)2基团,又称为2
’‑
dmaoe;以及如下文的实施例所述的2
’‑
二甲基氨基乙氧基乙氧基(在本领域也称为2
’‑
o-二甲基氨基乙氧基乙基或2
’‑
dmaeoe),即2
’‑o‑‑
ch2‑‑o‑‑
ch2‑‑
n(ch2)2。
[0339]
其它修饰包括2
’‑
甲氧基(2
’‑
och3)、2
’‑
氨基丙氧基(2
’‑
och2ch2ch2nh2)和2
’‑
氟(2
’‑
f)。类似的修饰也可以在irna的rna上的其它位置进行,特别是2
’‑5’
连接的dsrna中或3’末端核苷酸上的糖的3’位、以及5’末端核苷酸的5’位置。irna也可以具有糖模拟物,例如取代戊呋喃糖的环丁基部分。
[0340]
抑制性核酸还可包括核碱基(在本领域通常简称为“碱基”)修饰或置换。如本文所使用的,“未修饰的”或“天然的”核碱基包括:嘌呤碱基腺嘌呤(a)和鸟嘌呤(g);以及嘧啶碱基胸腺嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。经修饰的核碱基包括其它合成和天然的核碱基,
例如:5-甲基胞嘧啶(5-me-c);5-羟甲基胞嘧啶;黄嘌呤;次黄嘌呤;2-氨基腺嘌呤;腺嘌呤和鸟嘌呤的6-甲基衍生物和其它烷基衍生物;腺嘌呤和鸟嘌呤的2-丙基衍生物和其它烷基衍生物;2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶;5-卤素尿嘧啶和5-卤素胞嘧啶;5-丙炔基尿嘧啶和5-丙炔基胞嘧啶;6-偶氮尿嘧啶、6-偶氮胞嘧啶和6-偶氮胸腺嘧啶;5-尿嘧啶(假尿嘧啶);4-硫尿嘧啶;8-卤素、8-氨基、8-硫醇、8-硫代烷基、8-羟基和其它的8-取代的腺嘌呤和鸟嘌呤;5-卤素(特别是5-溴)、5-三氟甲基和其它的5-取代的尿嘧啶和胞嘧啶;7-甲基鸟嘌呤和7-甲基腺嘌呤;8-氮杂鸟嘌呤和8-氮杂腺嘌呤;7-脱氮鸟嘌呤和7-脱氮腺嘌呤以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。这些核碱基中的一些对于增高本发明中的特征性的抑制性核酸的结合亲和力是特别有用的。这些核碱基包括:5-取代的嘧啶;6-氮杂嘧啶;以及n-2、n-6和o-6取代的嘌呤,包括2-氨基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。已显示出5-甲基胞嘧啶置换增高了核酸双链稳定性0.6-1.2℃(sanghvi,y.s.,crooke,s.t.和lebleu,b.编,dsrna research and applications,crc press,boca raton,1993,pp.276-278),并且是示例性的碱基置换,甚至更特别是当与2'-o-甲氧乙基糖修饰组合时。
[0341]
上述的经修饰的核酸、骨架和核碱基的制备是本领域公知的。
[0342]
本发明中的特征性的抑制性核酸的另一修饰涉及将一个或多个配体、部分或缀合物在化学上连接至抑制性核酸,所述配体、部分或缀合物增强了irna的细胞摄取、活性、细胞分布或药代动力学性质。此类部分包括但不限于:脂质部分如胆固醇部分(letsinger等,proc.natl.acid.sci.usa,1989,86:6553-6556);胆酸(manoharan等,biorg.med.chem.let.,1994,4:1053-1060);硫醚,例如beryl-s-三苯甲基硫醇(manoharan等,ann.n.y.acad.sci.,1992,660:306-309;manoharan等,biorg.med.chem.let.,1993,3:2765-2770);硫代胆固醇(oberhauser等,nucl.acids res.,1992,20:533-538);脂肪链,例如十二烷二醇或十一烷基残基(saison-behmoaras等,embo j,1991,10:1111-1118;kabanov等,febs lett.,1990,259:327-330;svinarchuk等,biochimie,1993,75:49-54);磷脂,例如二-十六烷基-消旋-甘油或三乙基铵1,2-二-o-十六烷基-消旋-甘油-3-磷酸酯(manoharan等,tetrahedron lett.,1995,36:3651-3654;shea等,nucl.acids res.,1990,18:3777-3783);聚胺或聚乙二醇链(manoharan等,nucleosides&nucleotides,1995,14:969-973),或金刚烷乙酸(manoharan等,tetrahedron lett.,1995,36:3651-3654);棕榈酰部分(mishra等,biochim.biophys.acta,1995,1264:229-237);或十八胺或己基氨基-羰基氧基胆固醇部分(crooke等,j.pharmacol.exp.ther.,1996,277:923-937)。
[0343]
如本文所使用的,术语“载体”是指被设计用于递送至宿主细胞或用于在不同宿主细胞之间转移的核酸构建体。如本文所使用的,载体可以是病毒的或非病毒的。术语“载体”涵盖了当与合适的控制元件相关联时能够复制并且可将基因序列转移至细胞的任何遗传元件。载体可包括但不限于克隆载体、表达载体、重组载体、质粒、噬菌体、转座子、粘粒、染色体、病毒、病毒粒等。
[0344]
如本文所使用的,术语“表达载体”是指对来自连接至载体上的转录调控序列的序列的rna或多肽的表达进行指导的载体。所表达的序列通常但不必须对于细胞而言是异源的。表达载体可包含额外的元件,例如表达载体可具有两种复制系统,从而允许其保持在两种生物体中,例如在人细胞中用于表达并在原核宿主中用于克隆和扩增。术语“表达”是指参与产生rna和蛋白质以及适当时分泌蛋白质的细胞过程,包括(如果适用的话)但不限于
例如转录、转录物加工、翻译和蛋白质折叠、修饰和加工。“表达产物”包括转录自基因的rna以及通过转录自基因的mrna的翻译而获得的多肽。术语“基因”意为当可操作地连接至合适的调控序列时,在体外或体内转录(dna)成rna的核酸序列。基因可包括或可不包括编码区域之前和之后的区域,例如,5’未翻译(5’utr)或“前导”序列以及3’utr或“尾随”序列、以及单独的编码区段(外显子)之间的间插序列(内含子)。
[0345]
如本文所使用的,术语“病毒载体”是指包含病毒来源的至少一种元件并且具有被包装到病毒载体颗粒中的能力的核酸载体构建体。病毒载体可包含编码本文所述的多肽的核酸,以代替非必需的病毒基因。可出于在体外或体内将任何核酸转移到细胞中的目的来使用载体和/或颗粒。许多形式的病毒载体是本领域已知的。
[0346]“重组载体”意为包含异源核酸序列或能够在体内表达的“转移基因”的载体。应当理解的是,在一些实施方式中,本文所述的载体可与其它合适的组合物和治疗组合。在一些实施方式中,载体是附加型的。合适的附加型载体的使用提供了将感兴趣的核苷酸在受试者中维持高拷贝数的染色体外dna的手段,从而消除了染色体整合的潜在影响。
[0347]
如本文所使用的,术语“治疗/处理”或“减轻”是指治疗性处理,其中,目的是逆转、缓解、减轻、抑制、减缓或停止与疾病或紊乱(例如本文所述的病症或疾病)相关的病症的进展或严重程度。术语“治疗”包括降低或缓解病症、疾病或紊乱的至少一种不利影响或症状。如果一种或多种症状或临床标记减少,则治疗通常是“有效”的。或者,如果疾病的进展减弱或停止,则治疗是“有效”的。也就是说,“治疗”不仅包括症状或标记的改善,还包括与未进行治疗时所预期的情况相比症状的进展或恶化中止或至少减缓。有益或期望的临床结果(无论可测定或不可测定)包括但不限于:缓解一种或多种症状、减小疾病程度、稳定疾病状态(即,不恶化)、延迟或减缓疾病进展、减轻或减缓疾病状态、缓和(部分或全部)、和/或减少死亡率。术语“治疗”疾病还包括提供疾病的症状或副作用的舒解(包括姑息治疗)。
[0348]
如本文所使用的,术语“药物组合物”是指与药学上可接受的载体(例如在制药工业中常用的载体)组合的活性试剂。本文采用的短语“药学上可接受的”是指下述化合物、材料、组合物和/或剂型:在合理的医学判断范围内,适于与人类和动物的组织接触而无过度的毒性、刺激、过敏反应或其它问题或并发症,与合理的收益/风险比相匹配。在任何方面的一些实施方式中,药学上可接受的载体可为除水以外的载体。在任何方面的一些实施方式中,药学上可接受的载体可为乳膏、乳剂、凝胶、脂质体、纳米颗粒和/或软膏。在任何方面的一些实施方式中,药学上可接受的载体可为人工或工程化的载体,例如,活性成分不会被发现在其中天然存在的载体。
[0349]
如本文所使用的,术语“给予”是指通过一定的方法或途径向受试者中放置本文所公开的化合物,使得至少将试剂部分递送至期望部位。含有本文所公开的化合物的药物组合物可以通过任何适当的途径给予,从而在受试者中产生有效的治疗。
[0350]
如本文所使用的,术语“接触”是指用于将试剂递送至或暴露于至少一个细胞的任何合适方法。示例性的递送方法包括但不限于直接递送至细胞培养基、灌注、注射或本领域技术人员熟知的其它递送方法。在一些实施方式中,接触包括人的身体活动,例如注射;配制、混合和/或倾倒的行为;和/或操纵递送装置或机器。
[0351]
术语“有效量”是指足以提供与病症相关的症状的至少一些减轻的组合物的量。在一个实施方式中,“有效量”是指将减轻患有该病症的受试者中的该病症的标记或症状的组
9783527600908);以及robert a.meyers(编),molecular biology and biotechnology:a comprehensive desk reference,由vch publishers,inc.出版,1995(isbn1-56081-569-8);immunology by werner luttmann,由elsevier出版,2006;janeway's immunobiology,kenneth murphy,allan mowat,casey weaver(编),taylor&francis limited,2014(isbn 0815345305,9780815345305);lewin's genes xi,由jones&bartlett publishers出版,2014(isbn-1449659055);michael richard green and joseph sambrook,molecular cloning:a laboratory manual,第4版,cold spring harbor laboratory出版社,cold spring harbor,n.y.,usa(2012)(isbn1936113414);davis等,basic methods in molecular biology,elsevier science publishing inc.,new york,usa(2012)(isbn 044460149x);laboratory methods in enzymology:dna,jon lorsch(编),elsevier,2013(isbn 0124199542);current protocols in molecular biology(cpmb),frederick m.ausubel(编),john wiley and sons,2014(isbn 047150338x,9780471503385);current protocols in protein science(cpps),john e.coligan(编),john wiley and sons,inc.,2005;以及current protocols in immunology(cpi)(john e.coligan,ada m kruisbeek,david h margulies,ethan m shevach,warren strobe,(编)john wiley and sons,inc.,2003(isbn 0471142735,9780471142737);以引用的方式将它们的内容以其整体全部并入本文。
[0361]
本领域技术人员可以容易地辨别有用的化疗剂(例如参见physicians'cancer chemotherapy drug manual 2014,edward chu,vincent t.devita jr.,jones&bartlett learning;principles of cancer therapy,harrison's principles of internal medicine中的第85章,第18版;therapeutic targeting of cancer cells:era of molecularly targeted agents and cancer pharmacology,abeloff’s clinical oncology中的第28至29章,2013elsevier;以及fischer d s(编):the cancer chemotherapy handbook,第4版,st.louis,mosby-year book,2003)。
[0362]
本文在对本发明各个方面的描述中对其它术语进行定义。
[0363]
出于描述和公开的目的,将本技术全文中引用的所有专利和其它出版物(包括参考文献、发行的专利、公开的专利申请和同时待审的专利申请)以引用的方式明确地并入本文,例如,在此类出版物中描述的可与本文描述的技术关联使用的方法学。这些出版物仅由于它们的公开早于本技术的申请日而提供。在这一方面,不应当视作承认了本发明人没有权利借助于先前的发明或因为任何其它原因而将此类公开内容提前。所有关于这些文件的日期的声明或关于这些文件的内容的表述是基于申请人可获得的信息,并不构成关于这些文件的日期或内容的正确性的任何承认。
[0364]
对本公开的实施方式的描述并非旨在进行穷举或将本公开限制为所公开的明确的形式。尽管本文中出于说明性目的描述了本公开的具体实施方式和实施例,然而正如相关领域的技术人员将了解的,可在本公开的范围内进行各种等同修改。例如,当方法步骤或功能以给定的顺序存在时,替代的实施方式能够以不同的顺序执行功能、或可以实质上同时执行功能。本文所提供的本公开的教导可以施用至其它适当的程序或方法。本文所述的各种实施方式可以组合以提供进一步的实施方式。如果需要的话,可对本公开的方面进行修改,以采用上述参考文献和应用的组合、功能和构思,从而提供本公开的进一步的实施方
式。此外,由于生物功能对等性的考虑,可以在种类或数量上对蛋白结构进行不影响生物或化学作用的一些改变。鉴于详细的描述,可以对本公开作出这些改变和其它改变。所有这些修饰都旨在包含于所附的权利要求的范围之内。
[0365]
可将任何上述实施方式的特定要素与其它实施方式中的要素组合或置换。此外,尽管在这些实施方式的上下文中已经描述了与本公开的一些实施方式相关的优点,然而其它实施方式也可以表现出此类优点,并且,并非所有的实施方式都必须表现出这样的优点才能落入本公开的范围之内。
[0366]
本文所描述的技术通过以下实施例进行进一步说明,而不应被解释为进行了进一步的限定。
[0367]
本文所述的技术的一些实施方式可以根据下列编号段落的任一段进行定义:
[0368]
1.一种给予至少一种活性化合物的方法,所述方法包括与至少一种离子液体组合给予所述活性化合物,所述离子液体包含:
[0369]
疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及
[0370]
阳离子,所述阳离子包括季铵。
[0371]
2.一种在有需要的受试者中减少体重/减少体重增加或治疗肥胖症、糖尿病、溃疡、癌症或纤维化的方法,所述方法包括向所述受试者给予包含至少一种离子液体的组合物,所述离子液体包含:
[0372]
疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及
[0373]
阳离子,所述阳离子包括季铵。
[0374]
3.如段落2所述的方法,其中,所述组合物不包含除所述至少一种离子液体之外的治疗剂。
[0375]
4.如段落2所述的方法,其中,所述组合物还包含除所述至少一种离子液体之外的活性化合物。
[0376]
5.如上述段落中任一段所述的方法,其中,所述阴离子具有至少4.5的pka。
[0377]
6.如上述段落中任一段所述的方法,其中,所述阴离子具有至少5.0的pka。
[0378]
7.如上述段落中任一段所述的方法,其中,所述阴离子具有至少2.0的logp。
[0379]
8.如上述段落中任一段所述的方法,其中,所述阴离子具有至少2.5的logp。
[0380]
9.如上述段落中任一段所述的方法,其中,所述阴离子具有至少2.75的logp。
[0381]
10.如上述段落中任一段所述的方法,其中,所述阴离子包含至少8个碳的碳链。
[0382]
11.如上述段落中任一段所述的方法,其中,所述阴离子为烯烃。
[0383]
12.如上述段落中任一段所述的方法,其中,所述阴离子为香叶酸、辛酸或香茅酸。
[0384]
13.如上述段落中任一段所述的方法,其中,所述阳离子具有等于或大于胆碱的摩尔质量。
[0385]
14.如上述段落中任一段所述的方法,其中,所述季铵具有nr
4+
结构,且至少一个r基团包含羟基。
[0386]
15.如上述段落中任一段所述的方法,其中,所述季铵具有nr
4+
结构,且仅一个r基团包含羟基。
[0387]
16.如上述段落中任一段所述的方法,其中,所述阳离子为c1、c6或c7。
[0388]
17.如上述段落中任一段所述的方法,其中,所述阳离子选自胆碱、c1、c6和c7,且所述阴离子为香茅酸。
[0389]
18.如上述段落中任一段所述的方法,其中,所述阳离子为c1,且所述阴离子为香茅酸。
[0390]
19.如上述段落中任一段所述的方法,其中,所述阳离子选自c1、c6和c7,且所述阴离子为香叶酸。
[0391]
20.如上述段落中任一段所述的方法,其中,所述离子液体为胆碱:香茅酸、c1:香叶酸或c1:香茅酸。
[0392]
21.如上述段落中任一段所述的方法,其中,所述离子液体不是cage。
[0393]
22.如上述段落中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于20个的交叉峰。
[0394]
23.如上述段落中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于10个的交叉峰。
[0395]
24.如上述段落中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于5个的交叉峰。
[0396]
25.如上述段落中任一段所述的方法,其中,所述给予为经皮给予。
[0397]
26.如上述段落中任一段所述的方法,其中,所述给予为经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。
[0398]
27.如段落26所述的方法,其中,所述粘膜为鼻粘膜、口腔粘膜或阴道粘膜。
[0399]
28.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为至少0.1%w/v。
[0400]
29.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为约10%w/v至约70%w/v。
[0401]
30.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为约30%w/v至约50%w/v。
[0402]
31.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为约30%w/v至约40%w/v。
[0403]
32.如上述段落中任一段所述的方法,其中,所述离子液体包含比例为约2:1至约1:10的阳离子与阴离子。
[0404]
33.如上述段落中任一段所述的方法,其中,所述离子液体包含比例为约1:1至约1:4的阳离子与阴离子。
[0405]
34.如上述段落中任一段所述的方法,其中,所述离子液体包含比例为约1:2的阳离子与阴离子。
[0406]
35.如上述段落中任一段所述的方法,其中,所述离子液体具小于1:1的阳离子:阴离子比例。
[0407]
36.如上述段落中任一段所述的方法,其中,所述活性化合物是疏水性的。
[0408]
37.如上述段落中任一段所述的方法,其中,所述活性化合物是亲水性的。
[0409]
38.如上述段落中任一段所述的方法,其中,所述活性化合物包括多肽。
[0410]
39.如上述段落中任一段所述的方法,其中,所述活性化合物具有大于450的分子量。
[0411]
40.如上述段落中任一段所述的方法,其中,所述活性化合物具有大于500的分子量。
[0412]
41.如上述段落中任一段所述的方法,其中,所述活性化合物包括抗体或抗体试剂。
[0413]
42.如上述段落中任一段所述的方法,其中,所述活性化合物包括胰岛素、阿卡波糖、鲁索替尼或glp-1多肽或其模拟物或类似物。
[0414]
43.如上述段落中任一段所述的方法,其中,给予一次所述组合和/或组合物。
[0415]
44.如上述段落中任一段所述的方法,其中,以多剂量给予所述组合和/或组合物。
[0416]
45.如上述段落中任一段所述的方法,其中,以1-20mg/kg的剂量提供所述活性化合物和/或组合物。
[0417]
46.如上述段落中任一段所述的方法,其中,将所述活性化合物和所述离子液体进一步与至少一种非离子表面活性剂组合。
[0418]
47.如上述段落中任一段所述的方法,其中,所述组合和/或组合物还包含其它药学上可接受的载体。
[0419]
48.如上述段落中任一段所述的方法,其中,所述给予为口服给予,并且所述组合和/或组合物以可降解胶囊提供。
[0420]
49.如上述段落中任一段所述的方法,其中,所述组合为掺和物。
[0421]
50.如上述段落中任一段所述的方法,其中,所述组合和/或组合物以一种或多种纳米颗粒提供。
[0422]
51.如上述段落中任一段所述的方法,其中,所述组合以包含所述活性化合物的一种或多种纳米颗粒的形式提供,在包含所述离子液体的组合物中,所述纳米颗粒处于溶液或混悬液中。
[0423]
52.一种包含至少一种离子液体的组合物,所述离子液体包含:
[0424]
疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及
[0425]
阳离子,所述阳离子包括季铵。
[0426]
53.如段落52所述的组合物,其中,所述阴离子具有至少4.5的pka。
[0427]
54.如段落52-53中任一段所述的组合物,其中,所述阴离子具有至少5.0的pka。
[0428]
55.如段落52-54中任一段所述的组合物,其中,所述阴离子具有至少2.0的logp。
[0429]
56.如段落52-55中任一段所述的组合物,其中,所述阴离子具有至少2.5的logp。
[0430]
57.如段落52-56中任一段所述的组合物,其中,所述阴离子具有至少2.75的logp。
[0431]
58.如段落52-57中任一段所述的组合物,其中,所述阴离子包含至少8个碳的碳链。
[0432]
59.如段落52-58中任一段所述的组合物,其中,所述阴离子为烯烃。
[0433]
60.如段落52-59中任一段所述的组合物,其中,所述阴离子为香叶酸、辛酸或香茅酸。
[0434]
61.如段落52-60中任一段所述的组合物,其中,所述阳离子具有等于或大于胆碱
的摩尔质量。
[0435]
62.如段落52-61中任一段所述的组合物,其中,所述季铵具有nr
4+
结构,且至少一个r基团包含羟基。
[0436]
63.如段落52-62中任一段所述的组合物,其中,所述季铵具有nr
4+
结构,且仅一个r基团包含羟基。
[0437]
64.如段落52-63中任一段所述的组合物,其中,所述阳离子为c1、c6或c7。
[0438]
65.如段落52-64中任一段所述的组合物,其中,所述阳离子选自胆碱、c1、c6和c7,且所述阴离子为香茅酸。
[0439]
66.如段落52-65中任一段所述的组合物,其中,所述阳离子为c1,且所述阴离子为香茅酸。
[0440]
67.如段落52-66中任一段所述的组合物,其中,所述阳离子选自c1、c6和c7,且所述阴离子为香叶酸。
[0441]
68.如段落52-67中任一段所述的组合物,其中,所述离子液体为胆碱:香茅酸、c1:香叶酸或c1:香茅酸。
[0442]
69.如段落52-68中任一段所述的组合物,其中,所述离子液体不是cage。
[0443]
70.如段落52-69中任一段所述的组合物,其中,所述离子液体包含比例为约2:1至约1:10的阳离子与阴离子。
[0444]
71.如段落52-70中任一段所述的组合物,其中,所述离子液体包含比例为约1:1至约1:4的阳离子与阴离子。
[0445]
72.如段落52-71中任一段所述的组合物,其中,所述离子液体包含比例为约1:2的阳离子与阴离子。
[0446]
73.如段落52-72中任一段所述的组合物,其中,所述离子液体具有小于1:1的阳离子:阴离子比例。
[0447]
74.如段落52-73中任一段所述的组合物,其中,所述离子液体具有过量阴离子的阳离子:阴离子比例。
[0448]
75.如段落52-74中任一段所述的组合物,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于20个的交叉峰。
[0449]
76.如段落52-75中任一段所述的组合物,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于10个的交叉峰。
[0450]
77.如段落52-76中任一段所述的组合物,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于5个的交叉峰。
[0451]
78.如段落52-77中任一段所述的组合物,所述组合物还包含与至少一种离子液体组合的至少一种活性化合物。
[0452]
79.如段落78所述的组合物,其中,所述活性化合物是疏水性的。
[0453]
80.如段落78-79中任一段所述的组合物,其中,所述活性化合物是亲水性的。
[0454]
81.如段落78-80中任一段所述的组合物,其中,所述活性化合物包括多肽。
[0455]
82.如段落78-81中任一段所述的组合物,其中,所述活性化合物具有大于450的分子量。
[0456]
83.如段落78-82中任一段所述的组合物,其中,所述活性化合物具有大于500的分
子量。
[0457]
84.如段落78-83中任一段所述的组合物,其中,所述活性化合物包括抗体或抗体试剂。
[0458]
85.如段落78-84中任一段所述的组合物,其中,所述活性化合物包括胰岛素、阿卡波糖、鲁索替尼或glp-1多肽或其模拟物或类似物。
[0459]
86.如段落52-85中任一段所述的组合物,其中,所述离子液体的浓度为至少0.1%w/v。
[0460]
87.如段落52-86中任一段所述的组合物,其中,所述离子液体的浓度为约10%w/v至约70%w/v。
[0461]
88.如段落52-87中任一段所述的组合物,其中,所述离子液体的浓度为约30%w/v至约50%w/v。
[0462]
89.如段落52-88中任一段所述的组合物,其中,所述离子液体的浓度为约30%w/v至约40%w/v。
[0463]
90.如段落52-89中任一段所述的组合物,其中,将所述组合物配制用于经皮给予。
[0464]
91.如段落52-90中任一段所述的组合物,其中,将所述组合物配制用于经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。
[0465]
92.如段落91所述的组合物,其中,所述粘膜为鼻粘膜、口腔粘膜或阴道粘膜。
[0466]
93.如段落78-92中任一段所述的组合物,其中,以1-20mg/kg的剂量提供所述活性化合物。
[0467]
94.如段落52-93中任一段所述的组合物,所述组合物还包含至少一种非离子表面活性剂。
[0468]
95.如段落52-94中任一段所述的组合物,所述组合物还包含药学上可接受的载体。
[0469]
96.如段落52-95中任一段所述的组合物,其中,所述组合物以可降解胶囊提供。
[0470]
97.如段落78-96中任一段所述的组合物,其中,所述组合物为掺和物。
[0471]
98.如段落52-97中任一段所述的组合物,其中,所述组合物以一种或多种纳米颗粒提供。
[0472]
99.如段落52-98中任一段所述的组合物,所述组合物包含含有所述活性化合物的一种或多种纳米颗粒,在包含所述离子液体的组合物中,所述纳米颗粒处于溶液或混悬液中。
[0473]
本文所述的技术的一些实施方式可以根据下列编号段落的任一段进行定义:
[0474]
1.一种给予至少一种活性化合物的方法,所述方法包括与至少一种离子液体组合给予所述活性化合物,所述离子液体包含:
[0475]
疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及
[0476]
阳离子,所述阳离子包括季铵。
[0477]
2.一种在有需要的受试者中减少体重/减少体重增加或治疗肥胖症、糖尿病、溃疡、癌症或纤维化的方法,所述方法包括向所述受试者给予包含至少一种离子液体的组合物,所述离子液体包含:
[0478]
疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及
[0479]
阳离子,所述阳离子包括季铵。
[0480]
3.如段落2所述的方法,其中,所述组合物不包含除所述至少一种离子液体之外的治疗剂。
[0481]
4.如段落2所述的方法,其中,所述组合物还包含除所述至少一种离子液体之外的活性化合物。
[0482]
5.如上述段落中任一段所述的方法,其中,所述阴离子具有至少4.5的pka。
[0483]
6.如上述段落中任一段所述的方法,其中,所述阴离子具有至少5.0的pka。
[0484]
7.如上述段落中任一段所述的方法,其中,所述阴离子具有至少4.895的pka。
[0485]
8.如上述段落中任一段所述的方法,其中,所述阴离子具有4.5-5.5的pka。
[0486]
9.如上述段落中任一段所述的方法,其中,所述阴离子具有4.895-5.19的pka。
[0487]
10.如上述段落中任一段所述的方法,其中,所述阴离子具有至少2.0的logp。
[0488]
11.如上述段落中任一段所述的方法,其中,所述阴离子具有至少2.5的logp。
[0489]
12.如上述段落中任一段所述的方法,其中,所述阴离子具有至少2.75的logp。
[0490]
13.如上述段落中任一段所述的方法,其中,所述阴离子具有至少2.8的logp。
[0491]
14.如上述段落中任一段所述的方法,其中,所述阴离子具有2.5-3.5的logp。
[0492]
15.如上述段落中任一段所述的方法,其中,所述阴离子具有2.8-3.01的logp。
[0493]
16.如上述段落中任一段所述的方法,其中,所述阴离子包含至少8个碳的碳链。
[0494]
17.如上述段落中任一段所述的方法,其中,所述阴离子包含具有8个碳的骨架的碳链。
[0495]
18.如上述段落中任一段所述的方法,其中,所述阴离子为香叶酸、辛烯酸、辛酸或香茅酸。
[0496]
19.如上述段落中任一段所述的方法,其中,所述阴离子为辛烯酸、辛酸或香茅酸。
[0497]
20.如上述段落中任一段所述的方法,其中,所述阴离子为烯烃。
[0498]
21.如上述段落中任一段所述的方法,其中,所述阴离子为香叶酸、辛酸或香茅酸。
[0499]
22.如上述段落中任一段所述的方法,其中,所述阳离子具有等于或大于胆碱的摩尔质量。
[0500]
23.如上述段落中任一段所述的方法,其中,所述季铵具有nr
4+
结构,且至少一个r基团包含羟基。
[0501]
24.如上述段落中任一段所述的方法,其中,所述季铵具有nr
4+
结构,且仅一个r基团包含羟基。
[0502]
25.如上述段落中任一段所述的方法,其中,所述阳离子为c1、c6或c7。
[0503]
26.如上述段落中任一段所述的方法,其中,所述阳离子选自胆碱、c1、c6和c7,且所述阴离子为香茅酸。
[0504]
27.如上述段落中任一段所述的方法,其中,所述阳离子为c1,且所述阴离子为香茅酸。
[0505]
28.如上述段落中任一段所述的方法,其中,所述阳离子选自c1、c6和c7,且所述阴离子为香叶酸。
[0506]
29.如上述段落中任一段所述的方法,其中,所述离子液体为胆碱:香茅酸、c1:香叶酸、或c1:香茅酸。
[0507]
30.如段落1-16中任一段所述的方法,其中,所述阳离子选自胆碱、c1、c6和c7,且所述阴离子选自香茅酸、辛酸和辛烯酸。
[0508]
31.如段落1-16中任一段所述的方法,其中,所述阳离子为胆碱,且所述阴离子选自香茅酸、辛酸和辛烯酸。
[0509]
32.如段落1-16中任一段所述的方法,其中,所述离子液体为胆碱:香茅酸、胆碱:辛酸、或胆碱:辛烯酸。
[0510]
33.如上述段落中任一段所述的方法,其中,所述离子液体不是cage。
[0511]
34.如上述段落中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于20个的交叉峰。
[0512]
35.如上述段落中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于10个的交叉峰。
[0513]
36.如上述段落中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于5个的交叉峰。
[0514]
37.如上述段落中任一段所述的方法,其中,所述给予为经皮给予。
[0515]
38.如上述段落中任一段所述的方法,其中,所述给予为经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。
[0516]
39.如段落26所述的方法,其中,所述粘膜为鼻粘膜、口腔粘膜或阴道粘膜。
[0517]
40.如上述段落中任一段所述的方法,其中,所述给予为口服给予。
[0518]
41.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为至少0.1%w/v。
[0519]
42.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为约10%w/v至约70%w/v。
[0520]
43.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为约30%w/v至约50%w/v。
[0521]
44.如上述段落中任一段所述的方法,其中,所述离子液体的浓度为约30%至约40%w/v。
[0522]
45.如上述段落中任一段所述的方法,其中,所述离子液体包含比例为约2:1至约1:10的阳离子与阴离子。
[0523]
46.如上述段落中任一段所述的方法,其中,所述离子液体包含比例为约1:1至约1:4的阳离子与阴离子。
[0524]
47.如上述段落中任一段所述的方法,其中,所述离子液体包含比例为约1:2的阳离子与阴离子。
[0525]
48.如上述段落中任一段所述的方法,其中,所述离子液体具有小于1:1的阳离子:阴离子比例。
[0526]
49.如上述段落中任一段所述的方法,其中,所述活性化合物是疏水性的。
[0527]
50.如上述段落中任一段所述的方法,其中,所述活性化合物是亲水性的。
[0528]
51.如上述段落中任一段所述的方法,其中,所述活性化合物包括多肽。
[0529]
52.如上述段落中任一段所述的方法,其中,所述活性化合物具有大于450的分子量。
[0530]
53.如上述段落中任一段所述的方法,其中,所述活性化合物具有大于500的分子量。
[0531]
54.如上述段落中任一段所述的方法,其中,所述活性化合物包括抗体或抗体试剂。
[0532]
55.如上述段落中任一段所述的方法,其中,所述活性化合物包括胰岛素、阿卡波糖、鲁索替尼或glp-1多肽或其模拟物或类似物。
[0533]
56.如上述段落中任一段所述的方法,其中,给予一次所述组合和/或组合物。
[0534]
57.如上述段落中任一段所述的方法,其中,以多剂量给予所述组合和/或组合物。
[0535]
58.如上述段落中任一段所述的方法,其中,以1-20mg/kg的剂量提供所述活性化合物和/或组合物。
[0536]
59.如上述段落中任一段所述的方法,其中,将所述活性化合物和所述离子液体进一步与至少一种非离子表面活性剂组合。
[0537]
60.如上述段落中任一段所述的方法,其中,所述组合和/或组合物还包含其它药学上可接受的载体。
[0538]
61.如上述段落中任一段所述的方法,其中,所述给予为口服给予,并且所述组合和/或组合物以可降解胶囊提供。
[0539]
62.如上述段落中任一段所述的方法,其中,所述组合为掺和物。
[0540]
63.如上述段落中任一段所述的方法,其中,所述组合和/或组合物以一种或多种纳米颗粒提供。
[0541]
64.如上述段落中任一段所述的方法,其中,所述组合以包含所述活性化合物的一种或多种纳米颗粒的形式提供,在包含所述离子液体的组合物中,所述纳米颗粒处于溶液或混悬液中。
[0542]
65.一种包含至少一种离子液体的组合物,所述离子液体包含:
[0543]
疏水性阴离子,所述疏水性阴离子包括具有至少4.0的pka和至少1.0的logp的羧酸;以及
[0544]
阳离子,所述阳离子包括季铵。
[0545]
66.如段落65所述的组合物,其中,所述阴离子具有至少4.5的pka。
[0546]
67.如段落65所述的组合物,其中,所述阴离子具有至少4.895的pka。
[0547]
68.如段落65所述的组合物,其中,所述阴离子具有4.5-5.5的pka。
[0548]
69.如段落65所述的组合物,其中,所述阴离子具有4.895-5.19的pka。
[0549]
70.如段落65-69中任一段所述的组合物,其中,所述阴离子具有至少5.0的pka。
[0550]
71.如段落65-69中任一段所述的组合物,其中,所述阴离子具有至少2.0的logp。
[0551]
72.如段落65-69中任一段所述的组合物,其中,所述阴离子具有至少2.5的logp。
[0552]
73.如段落65-69中任一段所述的组合物,其中,所述阴离子具有至少2.75的logp。
[0553]
74.如段落65-69中任一段所述的组合物,其中,所述阴离子具有至少2.8的logp。
[0554]
75.如段落65-69中任一段所述的组合物,其中,所述阴离子具有2.5-3.5的logp。
[0555]
76.如段落65-69中任一段所述的组合物,其中,所述阴离子具有2.8-3.01的logp。
[0556]
77.如段落65-76中任一段所述的组合物,其中,所述阴离子包含至少8个碳的碳链。
[0557]
78.如段落65-76中任一段所述的组合物,其中,所述阴离子包含具有8个碳的骨架的碳链。
[0558]
79.如段落65-76中任一段所述的组合物,其中,所述阴离子为香叶酸、辛烯酸、辛酸或香茅酸。
[0559]
80.如段落65-76中任一段所述的组合物,其中,所述阴离子为辛烯酸、辛酸或香茅酸。
[0560]
81.如段落65-80中任一段所述的组合物,其中,所述阴离子为烯烃。
[0561]
82.如段落65-81中任一段所述的组合物,其中,所述阴离子为香叶酸、辛酸或香茅酸。
[0562]
83.如段落65-82中任一段所述的组合物,其中,所述阳离子具有等于或大于胆碱的摩尔质量。
[0563]
84.如段落65-83中任一段所述的组合物,其中,所述季铵具有nr
4+
结构,且至少一个r基团包含羟基。
[0564]
85.如段落65-84中任一段所述的组合物,其中,所述季铵具有nr
4+
结构,且仅一个r基团包含羟基。
[0565]
86.如段落65-85中任一段所述的组合物,其中,所述阳离子为c1、c6或c7。
[0566]
87.如段落65-86中任一段所述的组合物,其中,所述阳离子选自胆碱、c1、c6和c7,且所述阴离子为香茅酸。
[0567]
88.如段落65-87中任一段所述的组合物,其中,所述阳离子为c1,且所述阴离子为香茅酸。
[0568]
89.如段落65-88中任一段所述的组合物,其中,所述阳离子选自c1、c6和c7,且所述阴离子为香叶酸。
[0569]
90.如段落65-89中任一段所述的组合物,其中,所述离子液体为胆碱:香茅酸、c1:香叶酸或c1:香茅酸。
[0570]
91.如段落65-90中任一段所述的组合物,其中,所述阳离子选自胆碱、c1、c6和c7,且所述阴离子选自香茅酸、辛酸和辛烯酸。
[0571]
92.如段落65-91中任一段所述的组合物,其中,所述阳离子为胆碱,且所述阴离子选自香茅酸、辛酸和辛烯酸。
[0572]
93.如段落65-92中任一段所述的组合物,其中,所述离子液体为胆碱:香茅酸、胆碱:辛酸、或胆碱:辛烯酸。
[0573]
94.如段落65-93中任一段所述的组合物,其中,所述离子液体不是cage。
[0574]
95.如段落65-94中任一段所述的组合物,其中,所述离子液体包含比例为约2:1至约1:10的阳离子与阴离子。
[0575]
96.如段落65-95中任一段所述的组合物,其中,所述离子液体包含比例为约1:1至约1:4的阳离子与阴离子。
[0576]
97.如段落65-96中任一段所述的组合物,其中,所述离子液体包含比例为约1:2的阳离子与阴离子。
[0577]
98.如段落65-97中任一段所述的组合物,其中,所述离子液体具有小于1:1的阳离子:阴离子比例。
[0578]
99.如段落65-98中任一段所述的组合物,其中,所述离子液体具有过量阴离子的阳离子:阴离子比例。
[0579]
100.如段落65-99中任一段所述的组合物,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于20个的交叉峰。
[0580]
101.如段落65-100中任一段所述的组合物,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于10个的交叉峰。
[0581]
102.如段落65-101中任一段所述的组合物,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,所述离子液体具有小于5个的交叉峰。
[0582]
103.如段落65-102中任一段所述的组合物,所述组合物还包含与所述至少一种离子液体组合的至少一种活性化合物。
[0583]
104.如段落103所述的组合物,其中,所述活性化合物是疏水性的。
[0584]
105.如段落103-104中任一段所述的组合物,其中,所述活性化合物是亲水性的。
[0585]
106.如段落103-105中任一段所述的组合物,其中,所述活性化合物包括多肽。
[0586]
107.如段落103-106中任一段所述的组合物,其中,所述活性化合物具有大于450的分子量。
[0587]
108.如段落103-107中任一段所述的组合物,其中,所述活性化合物具有大于500的分子量。
[0588]
109.如段落103-108中任一段所述的组合物,其中,所述活性化合物包括抗体或抗体试剂。
[0589]
110.如段落103-109中任一段所述的组合物,其中,所述活性化合物包括胰岛素、阿卡波糖、鲁索替尼或glp-1多肽或其模拟物或类似物。
[0590]
111.如段落65-110中任一段所述的组合物,其中,所述离子液体的浓度为至少0.1%w/v。
[0591]
112.如段落65-111中任一段所述的组合物,其中,所述离子液体的浓度为约10%w/v至约70%w/v。
[0592]
113.如段落65-112中任一段所述的组合物,其中,所述离子液体的浓度为约30%w/v至约50%w/v。
[0593]
114.如段落65-113中任一段所述的组合物,其中,所述离子液体的浓度为约30%w/v至约40%w/v。
[0594]
115.如段落65-114中任一段所述的组合物,其中,将所述组合物配制用于经皮给予。
[0595]
116.如段落65-115中任一段所述的组合物,其中,将所述组合物配制用于经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。
[0596]
117.如段落116所述的组合物,其中,所述粘膜为鼻粘膜、口腔粘膜或阴道粘膜。
[0597]
118.如段落65-117中任一段所述的组合物,其中,将所述组合物配制用于口服给予。
[0598]
119.如段落103-118中任一段所述的组合物,其中,以1-20mg/kg的剂量提供所述
活性化合物。
[0599]
120.如段落65-119中任一段所述的组合物,所述组合物还包含至少一种非离子表面活性剂。
[0600]
121.如段落65-120中任一段所述的组合物,所述组合物还包含药学上可接受的载体。
[0601]
122.如段落65-121中任一段所述的组合物,其中,所述组合物以可降解胶囊提供。
[0602]
123.如段落65-122中任一段所述的组合物,其中,所述组合物为掺和物。
[0603]
124.如段落65-123中任一段所述的组合物,其中,所述组合物以一种或多种纳米颗粒提供。
[0604]
125.如段落65-124中任一段所述的组合物,所述组合物包含含有所述活性化合物的一种或多种纳米颗粒,在包含所述离子液体的组合物中,所述纳米颗粒处于溶液或混悬液中。
[0605]
126.一种设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子,另一种离子为阴离子,所述方法包括:
[0606]
a.选择所述离子液体的两种离子中的一种;以及
[0607]
b.选择另一种离子以使离子间相互作用最小化。
[0608]
127.一种设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子,另一种离子为阴离子,所述方法包括:
[0609]
a.选择阳离子;以及
[0610]
b.选择阴离子,以使离子间相互作用最小化。
[0611]
128.一种设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子,另一种离子为阴离子,所述方法包括:
[0612]
a.选择阴离子;以及
[0613]
b.选择阳离子,以使离子间相互作用最小化。
[0614]
129.一种设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子,另一种离子为阴离子,所述离子来自候选阳离子池和候选阴离子池,所述方法包括:
[0615]
a.从上述候选离子池中选择所述离子液体的两种离子中的一种;以及
[0616]
b.从上述另一候选离子池中选择最能使与步骤a中选择的离子的离子间相互作用最小化的离子。
[0617]
130.一种设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子,另一种离子为阴离子,所述离子来自候选阳离子池和候选阴离子池,所述方法包括:
[0618]
a.从所述候选阳离子池中选择阳离子;
[0619]
b.从所述候选阴离子池中选择最能使与步骤a中选择的阳离子的离子间相互作用最小化的阴离子。
[0620]
131.一种设计和/或识别包含两种离子的离子液体的方法,其中,一种离子为阳离子,另一种离子为阴离子,所述离子来自候选阳离子池和候选阴离子池,所述方法包括:
[0621]
a.从所述候选阴离子池中选择阳离子;
[0622]
b.从所述候选阳离子池中选择最能使与步骤a中选择的阴离子的离子间相互作用最小化的阴离子。
[0623]
132.如段落126-131中任一段所述的方法,其中,将所述离子液体选择或设计用于经皮给予。
[0624]
133.如段落126-132中任一段所述的方法,其中,将所述离子液体选择或设计用于经皮给予、向粘膜给予、口服给予、皮下给予、皮内给予、肠胃外给予、瘤内给予或静脉内给予。
[0625]
134.如段落133所述的方法,其中,所述粘膜为鼻粘膜、口腔粘膜或阴道粘膜。
[0626]
135.如段落126-134中任一段所述的方法,其中,将所述离子液体选择或设计用于口服给予。
[0627]
136.如段落126-135中任一段所述的方法,其中,将所述离子液体选择或设计用于递送活性化合物。
[0628]
137.如段落126-136中任一段所述的方法,其中,所述阳离子包括包含季铵的阳离子,或选择阳离子包括选择包含季铵的阳离子;并且,所述阴离子包括包含羧酸的疏水性阴离子,或选择阴离子包括选择包含羧酸的疏水性阴离子,所述羧酸具有至少4.0的pka和至少1.0的logp。
[0629]
138.如段落126-137中任一段所述的方法,其中,所述阴离子具有至少4.5的pka,或选择阴离子包括选择具有至少4.5的pka的阴离子。
[0630]
139.如段落126-138中任一段所述的方法,其中,所述阴离子具有至少4.895的pka,或选择阴离子包括选择具有至少4.895的pka的阴离子。
[0631]
140.如段落126-138中任一段所述的方法,其中,所述阴离子具有4.5-5.5的pka,或选择阴离子包括选择具有4.5-5.5的pka的阴离子。
[0632]
141.如段落126-140中任一段所述的方法,其中,所述阴离子具有4.895-5.19的pka,或选择阴离子包括选择具有4.895-5.19的pka的阴离子。
[0633]
142.如段落126-141中任一段所述的方法,其中,所述阴离子具有至少5.0的pka,或选择阴离子包括选择具有至少5.0的pka的阴离子。
[0634]
143.如段落126-142中任一段所述的方法,其中,所述阴离子具有至少2.0的logp,或选择阴离子包括选择具有至少2.0的logp的阴离子。
[0635]
144.如段落126-143中任一段所述的方法,其中,所述阴离子具有至少2.5的logp,或选择阴离子包括选择具有至少2.5的logp的阴离子。
[0636]
145.如段落126-144中任一段所述的方法,其中,所述阴离子具有至少2.75的logp,或选择阴离子包括选择具有至少2.75的logp的阴离子。
[0637]
146.如段落126-145中任一段所述的方法,其中,所述阴离子具有至少2.8的logp,或选择阴离子包括选择具有至少2.8的logp的阴离子。
[0638]
147.如段落126-146中任一段所述的方法,其中,所述阴离子具有2.5-3.5的logp,或选择阴离子包括选择2.5-3.5的logp的阴离子。
[0639]
148.如段落126-147中任一段所述的方法,其中,所述阴离子具有2.8-3.01的logp,或选择阴离子包括选择具有2.8-3.01的logp的阴离子。
[0640]
149.如段落126-148中任一段所述的方法,其中,所述阴离子包含至少8个碳的碳链,或选择阴离子包括选择包含至少8个碳的碳链的阴离子。
[0641]
150.如段落126-149中任一段所述的方法,其中,所述阴离子包含具有8个碳的骨
架的碳链,或选择阴离子包括选择具有8个碳的骨架的碳链的阴离子。
[0642]
151.如段落126-150中任一段所述的方法,其中,所述阴离子为香叶酸、辛烯酸、辛酸或香茅酸,或选择阴离子包括选择作为阴离子的香叶酸、辛烯酸、辛酸或香茅酸。
[0643]
152.如段落126-151中任一段所述的方法,其中,所述阴离子为辛烯酸、辛酸或香茅酸,或选择阴离子包括选择作为阴离子的辛烯酸、辛酸或香茅酸。
[0644]
153.如段落126-152中任一段所述的方法,其中,所述阴离子为烯烃,或选择阴离子包括选择作为阴离子的烯烃。
[0645]
154.如段落126-153中任一段所述的方法,其中,所述阴离子为香叶酸、辛酸或香茅酸,或选择阴离子包括选择作为阴离子的香叶酸、辛酸或香茅酸。
[0646]
155.如段落126-154中任一段所述的方法,其中,所述阳离子具有等于或大于胆碱的摩尔质量,或选择阳离子包括选择具有等于或大于胆碱的摩尔质量的阳离子。
[0647]
156.如段落126-155中任一段所述的方法,其中,所述季铵具有nr
4+
结构,且至少一个r基团包含羟基。
[0648]
157.如段落126-156中任一段所述的方法,其中,所述季铵具有nr
4+
结构,且仅一个r基团包含羟基。
[0649]
158.如段落126-157中任一段所述的方法,其中,所述阳离子为c1、c6或c7,或选择阳离子包括选择作为阳离子的c1、c6或c7。
[0650]
159.如段落126-158中任一段所述的方法,其中,所述阳离子选自胆碱、c1、c6和c7,或选择阳离子包括选择选自胆碱、c1、c6和c7的阳离子,且所述阴离子为香茅酸。
[0651]
160.如段落126-159中任一段所述的方法,其中,所述阳离子选自c1、c6和c7,或选择阳离子包括选择选自c1、c6和c7的阳离子,且所述阴离子为香叶酸。
[0652]
161.如段落126-160中任一段所述的方法,其中,所述阳离子为胆碱、c1、c6或c7,或选择阳离子包括选择作为阳离子的胆碱、c1、c6或c7,且选择阴离子包括选择作为阴离子的香茅酸、辛酸或辛烯酸。
[0653]
162.如段落126-161中任一段所述的方法,其中,所述阳离子为胆碱,且选择阴离子包括选择作为阴离子的香茅酸、辛酸或辛烯酸。
[0654]
163.如段落126-162中任一段所述的方法,其中,所述离子液体不是cage。
[0655]
164.如段落126-163中任一段所述的方法,其中,所述离子液体包含比例为约2:1至约1:10的阳离子与阴离子。
[0656]
165.如段落126-164中任一段所述的方法,其中,所述离子液体包含比例为约1:1至约1:4的阳离子与阴离子。
[0657]
166.如段落126-165中任一段所述的方法,其中,所述离子液体包含比例为约1:2的阳离子与阴离子。
[0658]
167.如段落126-166中任一段所述的方法,其中,所述离子液体具有小于1:1的阳离子:阴离子比例。
[0659]
168.如段落126-167中任一段所述的方法,其中,所述离子液体具有过量阴离子的阳离子:阴离子比例。
[0660]
169.如段落126-168中任一段所述的方法,其中,使离子间相互作用最小化包括使如通过核欧佛豪瑟效应频谱(noesy)所测量的交叉峰的数量最小化。
[0661]
170.如段落126-169中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,如果它们具有小于20个的交叉峰,则阳离子和阴离子使得离子间相互作用最小化。
[0662]
171.如段落126-170中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,如果它们具有小于10个的交叉峰,则阳离子和阴离子使得离子间相互作用最小化。
[0663]
172.如段落126-171中任一段所述的方法,其中,如通过核欧佛豪瑟效应频谱(noesy)所测量的,如果它们具有小于5个的交叉峰,则阳离子和阴离子使得离子间相互作用最小化。
[0664]
173.如段落126-172中任一段所述的方法,其中,所述活性化合物是疏水性的。
[0665]
174.如段落126-173中任一段所述的方法,其中,所述活性化合物是亲水性的。
[0666]
175.如段落126-174中任一段所述的方法,其中,所述活性化合物包括多肽。
[0667]
176.如段落126-175中任一段所述的方法,其中,所述活性化合物具有大于450的分子量。
[0668]
177.如段落126-176中任一段所述的方法,其中,所述活性化合物具有大于500的分子量。
[0669]
178.如段落126-177中任一段所述的方法,其中,所述活性化合物包括抗体或抗体试剂。
[0670]
179.如段落126-178中任一段所述的方法,其中,所述活性化合物包括胰岛素、阿卡波糖、鲁索替尼或glp-1多肽或其模拟物或类似物。
[0671]
180.如段落126-179中任一段所述的方法,其中,所述离子液体的浓度为至少0.1%w/v。
[0672]
181.如段落126-180中任一段所述的方法,其中,所述离子液体的浓度为约10%w/v至约70%w/v。
[0673]
182.如段落126-181中任一段所述的方法,其中,所述离子液体的浓度为约30%w/v至约50%w/v。
[0674]
183.如段落126-182中任一段所述的方法,其中,所述离子液体的浓度为约30%w/v至约40%w/v。
[0675]
184.如段落126-183中任一段所述的方法,其中,以1-20mg/kg的剂量提供所述活性化合物。
[0676]
185.如段落126-184中任一段所述的方法,其中,将所述离子液体设计或选择为以可降解胶囊提供。
[0677]
186.如段落126-185中任一段所述的方法,其中,所述离子液体和活性化合物处于掺和物中。
[0678]
187.如段落126-186中任一段所述的方法,其中,将所述离子液体和任选地所述活性化合物选择或设计为以一种或多种纳米颗粒提供。
[0679]
188.如段落126-187中任一段所述的方法,其中,在具有包含所述活性化合物的一种或多种纳米颗粒的组合物中,所述离子液体处于溶液或混悬液中。
[0680]
实施例
[0681]
实施例1
[0682]
基于胆碱的离子液体(特别是胆碱和香叶酸(cage))已被用于增强几种小分子和大分子在皮肤上的递送。然而,仍然缺乏对用于经皮药物递送的il的设计原则进行概述的详细研究。我们使用两种亲水性不同的模型药物阿卡波糖和鲁索替尼以及不同阳离子和阴离子的16种离子液体,在本文中研究了皮肤渗透对il化学性质的依赖性。首先,使用cage作为代表性il评估了离子化学计量对药物皮肤渗透的影响,结果表明cage中胆碱与香叶酸的摩尔比为1:2时产生最高的递送。随后,使用与香叶酸结构相似的阴离子和与胆碱结构相似的阳离子制备cage变体。所有变体的阳离子与阴离子比例均保持恒定在1:2。在cage变体中观察到一系列渗透增强效应,其中一些变体优于原始cage组合物。机理研究表明,il增强经皮药物递送的效力与2d nmr测定的离子间相互作用呈负相关。基于这一认知设计了新的cage变体,它提供了此处测试的所有il中鲁索替尼的最高递送。总的来说,这些研究为优化il以增强皮肤渗透性提供了通用框架。
[0683]
引言
[0684]
经皮药物递送提供了一种无痛的药物给予方式,同时避免了首过代谢[1]。然而,克服皮肤最上层的转运屏障(角质层(sc))是一个重大挑战[1]。sc由紧密堆积的砖状和砂浆状角质细胞结构组成,周围环绕着脂质[2]。只有少数具有低质量和高亲脂性的药物能够在没有辅助的情况下通过sc屏障。已经设计了几种方法来增强药物的皮肤渗透性,包括使用超声波[3,4]、微针[5,6]、离子电渗[7,8]、喷射器[9,10]、和渗透促进剂[11-13]等。最近,离子液体和低共熔溶剂(为简单起见,以下统称为离子液体(il))在经皮药物递送方面显示出巨大的前景[14-19]。我们先前已证明,基于胆碱和香叶酸的il(称为cage)(图1)显示在胰岛素[20]和小分子抗菌剂[17]的经皮递送方面有效。
[0685]
il在增强皮肤渗透性方面的功效预计取决于其离子成分和组成。然而,文献中严重缺乏这种知识库(knowledge-base)。一项研究表明,cage在胰岛素递送中的功效在很大程度上取决于其离子化学计量。该研究还证明,cage主要通过其与sc脂质的相互作用来介导其增强效应[16]。然而,对于离子特性在决定il的递送功效方面的作用,仍缺乏普遍的认识。
[0686]
本文介绍的工作展示了对阴离子和阳离子性质在il介导的经皮药物递送中的作用进行的首次系统研究。使用了不同疏水性的药物来评估il的转运能力(图2)。第一种药物阿卡波糖是一种亲水性分子,通过抑制消化碳水化合物的酶用于治疗2型糖尿病[27]。该药物目前通过口服给予,但生物利用度非常低,胃肠道副作用高,因此用途有限[28]。第二种药物鲁索替尼是一种疏水性janus激酶(jak)抑制剂,目前已被fda批准作为用于骨髓纤维化的口服丸剂[29,30]。它在治疗脱发方面也显示出了潜力,因此它的局部递送很有意义[31,32]。本研究中使用的il是围绕cage的组成构建的。具体而言,使用了八种不同分子量、pka和疏水性的有机酸来作为香叶酸的替代物,并使用了七种有机季胺来作为胆碱的替代物。通过nmr对获得的il进行表征,并在体外测定了其递送鲁索替尼和阿卡波糖的能力。
[0687]
方法和材料
[0688]
材料
[0689]
胆碱碳酸氢盐、香叶酸、叔胺、卤代醇、磷酸盐缓冲盐水(pbs)、d2o和氘代dmso获得自sigma aldrich(st.louis,mo,usa)。在使用前,用丙酮对商购的香叶酸(85%,黄色液体)
进行至少五次的连续冻融循环,直到溶液澄清。在使用前,在减压下除去残余丙酮。猪皮(lampire biological laboratories,pipersville,pa)保持在-80℃并在使用前立即解冻。
[0690]
方法
[0691]
cage的合成。如先前所报道的,cage在不同的离子化学计量下合成[17]。将胆碱碳酸氢盐和香叶酸以1:4、1:2、1:1和2:1的摩尔比混合,通过盐置换反应制备cage。在agilent dd2
tm 600mhz光谱仪上用dmso-d6通过nmr对每个cage组合物进行表征。
[0692]
胆碱类似物的合成。制备了七种胆碱变体,以评估转运对阳离子性质的依赖性。该合成以参考文献[33]中报道的合成为模型。所有变体的起始材料均为三乙胺、三丙胺或三丁胺。在每种情况下,通过以1:1摩尔比溶解在甲苯(30ml)中并在预定温度下在圆底烧瓶中加热12小时,使胺与卤代醇反应(表4)。各种反应物、反应温度和有关生成产物的关键信息可见于表4。然后使用旋转蒸发仪在20mbar和60℃下除去大部分溶剂,进行2小时。在60℃下减压48小时除去残余溶剂。
[0693]
香叶酸与胆碱替代物的il。与先前报道的cage合成类似[34],使季胺与重结晶的香叶酸在40℃下以1:2的摩尔比反应12小时。然后使用旋转蒸发仪在20mbar和60℃下干燥产生的离子液体2小时。在60℃下减压48小时除去残余水。
[0694]
香叶酸替代物的il。在40℃下以1:2摩尔比(胆碱:羧酸),使溶解在溶解所需的最小量(《5ml)的超纯水(或在水杨酸的情况下为甲醇)中的羧酸与胆碱碳酸氢盐反应12小时。然后,使用旋转蒸发仪在20mbar和60℃下干燥产生的离子液体2小时。在60℃下减压48小时除去残余水。
[0695]
noesy测量。连同与含有氘代dmso的同轴插入物,将干燥的il置于nmr管中来制备样品。使用agilent dd2
tm 600mhz光谱仪。采用11.25的90
°
脉冲宽度,增量数(ni)设置为128,扫描数设置为4。测量后对光谱进行相位校正。
[0696]
皮肤渗透研究。完全如先前所述[35],在franz扩散池中使用猪皮进行皮肤渗透研究(皮肤面积=1.7cm2)。简单而言,将解冻、清洗过的猪皮放置在扩散池中,sc朝上。用pbs填充池的受体组件并配备有磁搅拌棒。研究中只使用所测量的经表皮电流小于12μa的池,并随机分配处理。将处于每种il中的300μl药物溶液(1mg/ml)置于皮肤顶部,确保完全覆盖。将池置于37℃下的搅拌板上24小时,此时除去皮肤,并用pbs轻轻清洗表面。然后,将各皮肤层分离。通过胶带剥离(最多10层)除去角质层,用手术刀将表皮与真皮分离,并使用4mm打孔器(punch)三次以除去三分之一的真皮(按面积)。然后,将组织放入甲醇(鲁索替尼)或50%甲醇/pbs混合物(阿卡波糖)中,在摇动下过夜以提取药物,然后如下所述通过hplc进行分析。
[0697]
hplc分析。每层中存在的药物量的分析通过hplc测定。在每种情况下,制备校准曲线,由十个样品组成,浓度范围为2
×
10-3
mg/ml-1mg/ml。对于阿卡波糖,使用250
×
4.6,5μm nucleosil-nh2柱。等度流动相为1ml/min的乙腈:磷酸盐缓冲液(比例为76:24)(其中1l含有0.6g的kh2po4和0.48g的na2hpo4),且uv检测器(210nm处)显示在5.2分钟出现峰。对于鲁索替尼,使用内径为250
×
4.6mm和颗粒尺寸为5μm的inertsil ods c-18柱。使用流速为1mil/min的thf:甲醇:乙腈10:40:50(v/v/v)等度洗脱流动相,3.2分钟处的峰被鉴定为产物峰(通过uv在270nm处检测)。
[0698]
结果
[0699]
递送功效对离子化学计量的依赖性。进行了初步研究,以评估cage中的离子化学计量在确定其递送阿卡波糖和鲁索替尼的能力方面的作用。以2:1、1:1、1:2和1:4的胆碱:香叶酸比例,合成了cage的四种变体。阿卡波糖和鲁索替尼以1mg/ml的浓度溶解在cage中。在该浓度下,两种药物在所有cage变体中均完全溶解。这两种药物向皮肤中的递送对cage组成表现出强烈依赖性(图3,阿卡波糖(红色)和鲁索替尼(蓝色))。图3所示的量对应于递送至真皮和受体室(acceptor compartment)的量。药物在不同皮肤层的详细分布示于图11和图12中。发现真皮中递送的药物量最高,其次是受体,接着是表皮。在pbs(阴性对照)中未观察到任何药物的显著转运。阿卡波糖在1mg/ml的浓度下可溶于pbs,而鲁索替尼仅在0.2mg/ml的浓度下可溶,因此供体中使用了处于pbs中的饱和溶液。在鲁索替尼的情况下,随着香叶酸含量增加2倍(2:1cage至1:2cage),递送功效增加~4倍,之后趋于稳定。在阿卡波糖的情况下也观察到类似的趋势,从而证实1:2cage对亲水性和亲脂性药物表现出最高的递送功效。这与先前的胰岛素研究一致,其中1:2cage在呈现的四种变体中表现最佳[16]。应当注意,当将鲁索替尼或阿卡波糖溶解于纯香叶酸或80%胆碱碳酸氢盐水溶液中时,未观察到它们的明显转运。考虑到1:2的胆碱:香叶酸比例提供了最大递送,而不论药物的亲水性如何,随后的变体是在此离子化学计量下制备的。
[0700]
递送功效对阴离子化学的依赖性。通过用其它有机酸替代香叶酸合成了第一组il变体。使用了香叶酸的八种替代物(图4)。香叶酸的第一个、也是最接近的变体是香茅酸,香茅酸比香叶酸少一个双键,在其它方面是相同的。辛酸在主骨架中与香叶酸具有相同的碳数,但缺乏不饱和度,且香叶酸中存在的甲基侧基。辛烯酸是辛酸的不饱和类似物,提供了机会,以评估不饱和度在递送功效中的作用。癸酸与香叶酸具有相同的总碳数,且缺乏不饱和度,因此提供了机会,以评估总碳数在递送功效中的作用。戊二酸是列表中包括的唯一的二羧酸,水杨酸是唯一的芳香酸。表1列出了阴离子的一些关键性质,包括分子量、pka、logp和碳原子数。
[0701]
使用胆碱作为平衡离子,利用胆碱碳酸氢盐与酸的盐置换作用,以1:2胆碱:酸的化学计量比合成了这些羧酸中的每一种的离子液体。以1mg/ml的浓度将鲁索替尼和阿卡波糖溶解在每种il变体中。与对照组(pbs)相比,所有il均表现出鲁索替尼和阿卡波糖向皮肤中的增强的递送。一般而言,大多数药物在真皮中发现,其次是表皮,然后是受体(图13和图14)。所递送的阿卡波糖和鲁索替尼的量(尤其是递送到真皮的药物量)对il化学表现出显著依赖性(表2)。在阿卡波糖的情况下,香叶酸优于其它阴离子。己烯酸和乙醇酸排在第二位和第三位,两者均是具有低log p的阴离子。然而,应当注意,同样具有0.05的低log p的戊二酸表现不佳,这表明增强作用不仅仅是亲脂性的函数。有趣的是,两种阴离子戊二酸和己烯酸同样也是递送鲁索替尼的效率最低的阴离子。香茅酸和辛酸在鲁索替尼的递送方面优于香叶酸。通过对所有变体在鲁索替尼和阿卡波糖递送方面的排名进行平均,来确定它们的总排名,以识别在广谱药物中提供渗透增强作用的il。
[0702]
香叶酸排名最高,其次是其相近的类似物香茅酸。包括水杨酸和戊二酸在内的小阴离子位于排名谱的底端。有趣的是,与香叶酸具有相同碳数的癸酸排名非常低,对阿卡波糖和鲁索替尼的效果较差。辛酸具有与香叶酸骨架相同的碳数,表现相当好,排在香叶酸和香茅酸之后。辛烯酸的排名仅次于辛酸,类似于排在香叶酸之后的香茅酸,因此表明单个不
饱和键对递送功效有影响。
[0703]
递送功效与分子参数的相关性。试图评估阴离子的转运排名是否与它们的物理化学参数(包括分子量、pka、logp和碳数)相关(图5a-图5d)。选择这些参数是因为它们体现了一些关键的化学描述符。从这些图中没有出现明显的定量趋势。然而,可以看到一些定性的观察结果。例如,排名最好的阴离子具有超过5的pka值(图5b)和接近3的logp值(图5c),这意味着从弱疏水性酸制备的il在增强皮肤渗透性方面更有效。考虑到酸的单一物理化学性质和它们的转运功效之间并没有简单的相关性,还探讨了其它可能性。
[0704]
使用il时必须考虑的一个关键参数是其离子组分之间的相互作用。具体而言,阴离子和阳离子之间的强相互作用对il的形成和稳定性而言至关重要。然而,il组分和sc脂质之间的相互作用对于确定它们增强皮肤渗透性的功效而言也至关重要。考虑到阴离子和阳离子之间相互作用的相关性,并且考虑到单独的阴离子性质与测量的渗透排名无关,因此试图确定离子间相互作用是否与整体渗透排名相关。为此,我们利用2d核欧佛豪瑟效应频谱(noesy)研究了离子间相互作用[36]。该技术将nmr数据绘制在两个频率轴上,并通过计算交叉峰的数量(图6a、图6b),使用对角峰和交叉峰来揭示潜在化学基团(在这种情况下为阴离子和阳离子)之间的空间相互作用。每个交叉峰代表相互距离在5nm以内的两组质子。由于其独特的解决空间相互作用的能力,nosey已被用于研究蛋白质[37,38]、肽[39,40]、和离子液体[36,41,42]的结构。
[0705]
示例的noesy光谱示于图6a-图6b中,该光谱具有带圆圈的同相交叉峰,表示彼此在5nm以内的离子部分。其余光谱以si表示。测量的交叉峰数量在很大范围内变化。例如,在胆碱:香茅酸(图6a)中发现了10个峰,在胆碱:戊二酸(图6b)中发现了30个峰。il的整体转运排名与nosey交叉峰的数量表现出很强的相关性(图7)。具有最低交叉峰数量的香叶酸和香茅酸表现出最高的转运排名,而具有最高交叉峰数量的戊二酸和水杨酸表现出最低的转运排名。
[0706]
阳离子的修饰。接着,通过增加胆碱的烷基头部基团和延长乙氧基链对阳离子进行修饰。除胆碱外,总共合成了7种阳离子(图8)。以香叶酸为阴离子,以1:2的比例(香叶酸:阳离子)合成了每种阳离子的离子液体,并用nmr对其进行表征。以1mg/ml的浓度将鲁索替尼和阿卡波糖溶解于每种il中,并测量它们向皮肤中的递送。表3示出了用各种阳离子制备的il递送阿卡波糖和鲁索替尼的能力。在阿卡波糖的情况下,所研究的阳离子几乎没有变化,新合成的阳离子中没有一种表现优于胆碱。这可能是阿卡波糖亲水性的结果,因为胆碱阳离子是该研究中最具亲水性的阳离子,它可能使il更具亲水性。在鲁索替尼的情况下,观察到转运对阳离子的显著依赖性。例如,体积较大的阳离子c6和c7在递送量方面表现显著优于胆碱。许多新合成的胆碱替代物表现优于胆碱,其中c1排名第一。再一次,这种改进的性能与nosey光谱相关。具体而言,与胆碱:香叶酸情况下的八个相峰比,c1:香叶酸il仅表现出三个交叉峰(图21)。据推测,c1中添加的大量取代基减少了阳离子和香叶酸之间的紧密接触。
[0707]
同时变化阴离子和阳离子
[0708]
在探索了几种阴离子和阳离子替代物并建立了转运排名和nosey交叉相关峰之间的相关性之后,我们将两种阴离子和两种阳离子组合,以制备代表性的il。这两种阴离子是香叶酸及其最佳替代物香茅酸。这两种阳离子是胆碱及其最佳替代物c1。比较了四种il;胆
碱:香叶酸(cage),胆碱:香茅酸,c1:香叶酸和c1:香茅酸。对用所有il测量了鲁索替尼向皮肤中的递送。还测量了所有il的nosey光谱。发现鲁索替尼递送对il组成有显著依赖性(图9a)。24小时后,c1:香茅酸表现出在真皮和受体中测量的117.1
±
12.7μg
·
cm-2
的鲁索替尼的最高递送。相比之下,c1:香叶酸、胆碱:香叶酸和胆碱:香茅酸递送89.9
±
4.6μg
·
cm-2
、68.0
±
6.1μg
·
cm-2
和97.8
±
4.6μg
·
cm-2
。递送功效再次表现出与nosey交叉相关峰的强相关性,与表现出8个峰的cage相比,c1:香茅酸仅表现出一个峰(图9b)。
[0709]
讨论
[0710]
最近,离子液体在促进药物的经皮给予转运方面显示出巨大的潜力[14,43]。特别是,已在它们通过完整角质层向真皮转运小分子的能力方面,对基于咪唑鎓[18]、季铵[44,45]和环鎓[43]的阳离子进行了体外研究。然而,目前对产生经皮给予递送的最佳il(特别是对基于季铵的il)的因素的理论理解仍然有限。
[0711]
对基于胆碱羧酸离子液体,本文报道的研究呈现了经皮药物递送对阴离子和阳离子性质的依赖性的系统评估。我们首先使用cage作为示例il,评估了转运对离子化学计量的依赖性。结果显示,与具有等摩尔或阳离子量大的il相比,具有过量阴离子(香叶酸)的il对鲁索替尼和阿卡波糖递送表现出更强的转运。这些结论与之前使用胰岛素的报道一致[16]。本文呈现的结果与先前对胰岛素、头孢他啶(ceftazidime)和甘露醇(mannitol)的研究一起表明,cage可以递送广泛的分子(从mw为180的甘露醇到mw为~6000的胰岛素,从logp为-6.8的阿卡波糖到logp为2.9的鲁索替尼,以及各种分子类型,包括糖类、肽类和芳族化合物)。cage增强多种分子的能力表明cage的主要作用是在sc上,从而解决了主要屏障功能。
[0712]
傅里叶变换红外光谱(ftir)研究显示,如通过亚甲基峰的减少所测量的,cage会影响sc脂质,表明脂质提取和/或流态化[16]。文献中使用基于咪唑的离子液体进行的ftir研究也与我们发现的离子液体对富含脂质的sc的影响一致[18]。香叶酸比例更高(》50mol%)的cage变体对sc脂质产生更显著的影响,这与观察到的分子通量趋势一致。有趣的是,制剂中的香叶酸浓度有明显的最佳值,因为纯的香叶酸不会对任何一种药物产生明显的皮肤通量。这可能源于香叶酸的高度亲脂性,其虽然有利于鲁索替尼的溶解,但可能会减少其向皮肤中的分配。对于其它化学品,先前已报道了制剂亲脂性对亲脂性药物递送的不良影响的类似影响[46]。因此,胆碱似乎可以单独减轻阴离子的亲脂性,并使香叶酸以及药物能够分配到皮肤中。
[0713]
以1:2的阳离子:阴离子的固定化学计量,制备了几种新型cage变体。在一组变体中,使阳离子以胆碱的形式保持不变,而使用八种羧酸阴离子。没有观察到药物转运对任何单一阴离子参数(包括分子量、pka、logp和碳数)的明显依赖性。定性地说,大的疏水性阴离子比小的亲水阴离子排名更好。具体而言,阴离子和/或阳离子的疏水端在sc脂质的流态化中起关键作用。由于胆碱高度亲水且缺乏脂肪链,阴离子提供了脂质破坏的主要方式。本研究中两种最具疏水性的阴离子香叶酸和香茅酸在其中表现出最佳效率。癸酸是这一趋势的一个例外。与香叶酸相比,尽管具有相当的mw和pka以及稍高的logp,但癸酸的表现并不好。这表明不饱和度在决定递送功效方面起着重要作用。化学促进剂文献中的研究先前已指出不饱和度在经皮通量增强中的作用。具体而言,据推测,不饱和度的增加会增强sc脂质破坏,这可能是由于不饱和度带来的空间限制增加所致[49]。
[0714]
在本文考虑之列的是,两个因素主导用于经皮递送的理想离子液体的设计;阴离子的效力及其进入皮肤的能力。阴离子的效力与它本身能够如何有效地破坏sc中的脂质以促进药物转运有关。阴离子进入皮肤的能力可能会影响其与sc脂质接触的能力。大量的离子间相互作用可降低阴离子进入sc的能力。脂肪酸在皮肤渗透增强方面显示出很高的功效[50,51],且脂肪酸进入皮肤的相对能力可显著影响il的功效。
[0715]
发现nosey中交叉峰的数量与总渗透性排名之间存在强相关性。nosey光谱中的交叉相关峰显示出宽的范围,远大于任何单个分子参数的测量范围。峰的数量从c1:香茅酸的1个至c1:戊二酸的30个不等。从根本上而言,交叉峰的数量表明了质子介导的离子之间的分子内相互作用。即,每个同相峰(与1d对角线的颜色相同)表明分子在整个液体中平均彼此在5nm以内。2d nmr先前已成功应用于纯离子液体中,以研究il中的离子间相互作用[36,41,42]。先前用cage进行的nosey研究也表明胆碱和香叶酸之间存在相互作用,并且这些相互作用随离子化学计量而变化[16]。
[0716]
不希望受理论的束缚,在本文考虑之列的是,il中的离子间相互作用在确定皮肤转运中以至少两种方式发挥重要作用。首先,强的离子间相互作用的存在可以产生大尺寸和/或能量稳定的超分子结构,从而减少它们进入sc以及随后对sc脂质的破坏。用cage进行的分子动力学模拟研究表明,胆碱和香叶酸之间有强的氢键[52],主要相互作用产生于香叶酸的羧基和胆碱的羟基之间的氢键。特别是,由于il的脂质破坏作用主要由疏水性阴离子介导,因此有利于阴离子在制剂中溶解和保留的相互作用将降低它们进入皮肤和介导皮肤渗透的能力。其次,在其自己的离子成分之间表现出高水平相互作用的il也可能与溶剂化药物发生强烈相互作用,并减少其向皮肤中的分配。无论其机理起源如何,转运功效排名和交叉峰之间的相关性非常显著,不仅在cage的阴离子变体中观察到,而且在组合的阳离子-阴离子变体中也能观察到。具体而言,表现出最少交叉峰数量(1个)的c1:香茅酸表现出鲁索替尼的最高递送。
[0717]
可能是c1中比如大体积脂肪族基团的存在限制了其羟基与香茅醛酸中羧基基团的相互作用。换言之,大体积的疏水性阳离子和大体积的疏水性阴离子可以潜在地制造用于经皮药物递送的优异il。此处呈现的研究清楚地表明,2d nmr可以用于筛查确定il在增强皮肤渗透性方面的效力。
[0718]
在此处研究的阴离子中,一些有在人类中使用的历史。在除香叶酸之外的性能最好的阴离子中,香茅酸在化妆品中被用作去屑剂和掩蔽剂。辛酸(caprylic acid)是一种常用的膳食补充剂。经修饰的胆碱分子在工业应用方面(即在催化方面)有一些使用历史[33]。c1也已被用于检查血脑屏障的大鼠灌注研究,但尚未进行全面的毒性筛选。令人鼓舞的是,基于胆碱的阳离子显示出可接受的低毒性,特别是与基于咪唑鎓的阳离子相比[53]。
[0719]
结论
[0720]
该研究为用于经皮药物递送的离子液体的设计和筛选提供了框架。使用两种模型药物阿卡波糖和鲁索替尼以及16种离子液体,我们研究了转运对离子化学计量和分子组成的依赖性。在cage的情况下,包含1:2胆碱:香叶酸的组合物产生了最大转运增强作用。对阴离子的系统修饰表明,离子间相互作用最少的il在经皮转运中最为成功,本文考虑的是,这是阴离子自由进入皮肤的能力的结果。进一步减少离子间相互作用的阳离子修饰也改善了递送功效。最有效的阳离子和阴离子的组合产生了新的il,其提供了对鲁索替尼转运的最
高增强作用。这项工作代表了il在经皮药物递送中的首次系统结构研究,并为设计新的、有效的局部制剂提供了范例。
[0721]
表1:用于产生新il的羧酸的分子性质。如参考文献[54]中所述进行logp和pka的理论测定。
[0722][0723]
表2:通过一系列具有经修饰的阴离子的离子液体(n=3,误差条表示sem)在24小时内将阿卡波糖和鲁索替尼转运到真皮和受体。
[0724][0725]
表3:通过一系列具有经修饰的阳离子的离子液体(n=3,误差条表示sem)在24小时内将阿卡波糖和鲁索替尼转运到真皮和受体。
[0726][0727]
表4:阳离子前体的反应条件。
[0728][0729]
1d nmr表征:
[0730]
(2-羟基乙基)三甲基铵(胆碱)癸酸盐
[0731]1h nmr(600mhz,dmso)0.80-0.87(dt,6h,oocch2ch2ch2ch2ch2ch2ch2ch2ch3);1.17-1.22(m,24h,oocch2ch2ch2ch2ch2ch2ch2ch2ch3);1.41(h,4h,oocch2ch2ch2ch2ch2ch2ch2ch2ch3);2.04(q,4h,oocch2ch2ch2ch2ch2ch2ch2ch2ch3);3.11(s,9h,nch3);3.40(h,2h,nch2ch2oh);3.81((h,2h,nch2ch2oh)
[0732]
(2-羟基乙基)三甲基铵(胆碱)戊二酸盐
[0733]1h nmr(600mhz,dmso)1.59-1.65(m,4h,ooch2ch2ch2oo);2.07-2.20(m,8h,ooch2ch2ch2oo);3.10(s,9h,nch3);3.39(m,2h,nch2ch2oh);3.82(dtd,2h,nch2ch2oh)
[0734]
(2-羟基乙基)三甲基铵(胆碱)乙醇酸盐
[0735]1h nmh(600mhz,dmso)3.10(s,9h,nch3);3.39(m,2h,nch2ch2oh);3.66(d,4h,hoch2oo);3.82(m,2h,nch2ch2oh)
[0736]
(2-羟基乙基)三甲基铵(胆碱)水杨酸盐
[0737]1h nmr(600mhz,dmso)3.10(s,9h,nch3);3.39(m,2h,nch2ch2oh);3.83(m,2h,nch2ch2o);6.77(m,4h,arh);7.32(ddd,2h,arh);7.74(dd,2h,arh))
[0738]
(2-羟基乙基)三甲基铵(胆碱)香茅酸盐
[0739]1h nmr(600mhz,dmso)0.83(m,6h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.03-1.31(m,4h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.54(s,6h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.62(s,6h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.70-1.82(m,2h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.82-1.97(m,4h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.99-2.08(m,4h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);3.09(s,9h,nch3);3.39(m,2h,nch2ch2oh);3.82(m,2h,nch2ch2oh);5.05(tt,2h,oocch2ch(ch3)ch2ch2chc(ch3)ch3)
[0740]
(2-羟基乙基)三甲基铵(胆碱)己烯酸盐
[0741]1h nmr(600mhz,dmso)0.83(t,6h,oocchchch2ch2ch3);1.36(m,4h,oocchchch2ch2ch3);1.99-2.08(qd,4h,oocchchch2ch2ch3);3.10(s,9h,nch3);3.40(m,2h,nch2ch2oh);3.82(m,2h,nch2ch2oh);5.68-5.74(dt,2h,oocchchch2ch2ch3);6.44-6.52(dt,2h,oocchchch2ch2ch3)
[0742]
(2-羟基乙基)三甲基铵(胆碱)辛烯酸盐
[0743]1h nmr(600mhz,dmso)0.84(t,6h,oocchchch2ch2ch2ch2ch3);1.18-1.40(m,12h,oocchchch2ch2ch2ch2ch3);2.01-2.10(qd,4h,oocchchch2ch2ch2ch2ch3);3.11(s,9h,nch3);3.40(m,2h,nch2ch2oh);3.83(m,2h,nch2ch2oh);5.67-5.74(dt,2h,oocchchch2ch2ch2ch2ch3);6.46-6.55(dt,2h,oocchchch2ch2ch2ch2ch3)
[0744]
(2-羟基乙基)三甲基铵(胆碱)辛酸盐
[0745]1h nmr(600mhz;dmso)0.77(t,6h,oocch2ch2ch2ch2ch2ch2ch3);1.13-1.33(m,16h,oocch2ch2ch2ch2ch2ch2ch3);1.95-2.02(q,4h,oocch2ch2ch2ch2ch2ch2ch3);3.12(s,9h,nch3);3.45(m,2h,nch2ch2oh);3.85(m,2h,nch2ch2oh);5.72(t,2h;oocch2ch2ch2ch2ch2ch2ch3);6.51(dt,2h,oocch2ch2ch2ch2ch2ch2ch3);
[0746]
(2-羟基乙基)三丁基铵香叶酸盐
[0747]1h nmr(600 mhz,dmso)0.87(d,9h,nch2ch2ch2ch3);1.23-1.33(m,6h,nch2ch2ch2ch3);1.52-1.68(m,18h,oocchc(ch3)ch2ch2chc(ch3)ch3;nch2ch2ch2ch3)2.02-2.13(m,14h,oocchc(ch3)ch2ch2chc(ch3)ch3);2.89-2.97(m,2h,nch2ch2ch2ch3);3.21-3.27(m,4h,nch2ch2ch2ch3);3.31-3.36(dd,2h,nch2ch2oh);3.72-3.77(t,2h,nch2ch2oh);5.00-5.06(dtt,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);5.55-5.59(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);
[0748]
(4-羟基丁基)三丁基铵香叶酸盐
[0749]1h nmr(600mhz,dmso)0.87(d,9h;nch2ch2ch2ch3);1.24-1.34(m,6h,nch2ch2ch2ch3);1.52-1.69(m,22h,nch2ch2ch2ch3;nch2ch2ch2ch2oh;oocchc(ch3)ch2ch2chc(ch3)ch3);2.02-2.10(m,14h,oocchc(ch3)ch2ch2chc(ch3)ch3);2.88-2.97(m,6h,nch2ch2ch2ch3);3.23-3.67(m,4h,nch2ch2ch2ch2oh);4.99-5.07(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);5.54-5.58(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3)
[0750]
(2-羟基乙基)三乙基铵香叶酸盐
[0751]1h nmr(600mhz,dmso)0.86(d,12h,oocchc(ch3)ch2ch2chc(ch3)ch3);1.11-1.22(m,14h,oocchc(ch3)ch2ch2chc(ch3)ch3);1.67(t,9h,nch2ch3);3.03-3.10(m,8h,nch2ch3;nch2ch2oh);3.56(t,2h,nch2ch2oh);4.60-4.63(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);5.22-5.25(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);
[0752]
(2-羟基乙基)三乙基铵香茅酸盐
[0753]1h nmr(600mhz,dmso)0.69-0.75(d,6h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);0.93-1.14(m,8h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.33-1.45(d,12h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);1.67-1.82(m,9h,nch2ch3);1.87-1.95(m,2h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);2.05-2.15(m,4h,oocch2ch(ch3)ch2ch2chc(ch3)ch3);3.24-3.31(m,4h,nch2ch3);3.78-383(m,4h,nch2ch3;nch2ch2oh);4.20-4.24(m,2h,nch2ch2oh);4.84-4.89(m,2h,oocch2ch(ch3)ch2ch2chc(ch3)ch3)
[0754]
(2-羟基乙基)三丙基铵香叶酸盐
[0755]1h nmr(600mhz,dmso)0.85(t,9h,nch2ch2ch3);1.52-1.56(m,6h,nch2ch2ch3);1.58-1.67(m,12h,oocchc(ch3)ch2ch2chc(ch3)ch3);2.01-2.14(m,14h,oocchc(ch3)ch2ch2chc(ch3)ch3);2.79-2.73(m,2h,nch2ch2ch3;nch2ch2oh);3.16-3.35(m,6h,nch2ch2ch3;nch2ch2oh);3.53-3.62(m,2h,nch2ch2oh);4.99-5.07(m,2h,oocchc(ch3)
ch2ch2chc(ch3)ch3);5.55-5.58(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3)
[0756]
(5-羟基戊基)三丙基铵香叶酸盐
[0757]1h nmr(600mhz,dmso)0.83(t,9h,nch2ch2ch3);1.34-1.48(m,12h,nch2ch2ch3;nch2ch2ch2ch2ch2oh);1.53-1.64(m,12h,oocchc(ch3)ch2ch2chc(ch3)ch3);2.00-2.11(m,14h,oocchc(ch3)ch2ch2chc(ch3)ch3);3.33-3.63(m,10h,nch2ch2ch3;nch2ch2ch2ch2ch2oh);5.01-5.07(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);5.54-5.58(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3)
[0758]
(2-羟基乙基)三戊基铵香叶酸盐
[0759]1h nmr(600mhz,dmso)0.80-0.89(m,9h,nch2ch2ch2ch2ch3);1.26-1.53(m,10h,nch2ch2ch2ch2ch3);1.60-1.64(m,20h,nch2ch2ch2ch2ch3;oocchc(ch3)ch2ch2chc(ch3)ch3);1.99-2.13(m,14h,oocchc(ch3)ch2ch2chc(ch3)ch3);3.21-3.39(m,8h,nch2ch2ch2ch2ch3;nch2ch2oh);3.55-3.63(t,2h,nch2ch2oh);5.01-5.07(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);5.55-5.56(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);
[0760]
(4-羟基丁基)三丙基铵香叶酸盐
[0761]1h nmr(600mhz,dmso)0.85(t,9h,nch2ch2ch3);1.24-1.67(m,22h,nch2ch2ch3;nch2ch2ch2ch2oh;oocchc(ch3)ch2ch2chc(ch3)ch3);2.00-2.14(m,14h,oocchc(ch3)ch2ch2chc(ch3)ch3);2.71-2.92(m,8h,nch2ch2ch3;nch2ch2ch2ch2oh);3.26-3.67(m,2h,nch2ch2ch2ch2oh);5.01-5.07(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3);5.54-5.63(m,2h,oocchc(ch3)ch2ch2chc(ch3)ch3)
[0762]
参考文献
[0763]
[1]prausnitz mr,langer r.transdermal drug delivery.nat biotechnol 2008;26:1261-8.doi:10.1038/nbt.1504.
[0764]
[2]harding cr.the stratum corneum:structure and function in health and disease.dermatol ther 2004;17:6-15.doi:10.12892/ejgo3153.2016.
[0765]
[3]mitragotri s,blankschtein d,langer r.ultrasound-mediated transdermal protein delivery.science(80-)1995.doi:10.1126/science.7638603.
[0766]
[4]azagury a,khoury l,enden g,kost j.ultrasound mediated transdermal drug delivery.adv drug deliv rev 2014.doi:10.1016/j.addr.2014.01.007.
[0767]
[5]teo al,shearwood c,ng kc,lu j,moochhala s.transdermal microneedles for drug delivery applications.mater sci eng b solid-state mater adv technol 2006.doi:10.1016/j.mseb.2006.02.008.
[0768]
[6]allen img,mark r,mcallister d v,us ny,paul f,cros m,et al.microneedles for transdermal drug delivery.adv drug deliv rev 2004.doi:10.1016/j.addr.2003.10.023.
[0769]
[7]panchagnula r,pillai o,nair vb,ramarao p.transdermal iontophoresis revisited.curr opin chem biol 2000.doi:10.1016/s1367-5931(00)00111-3.
[0770]
[8]kanikkannan n.iontophoresis-based transdermal delivery systems.biodrugs 2002.doi:10.2165/00063030-200216050-00003.
[0771]
[9]schramm j,mitragotri s.transdermal drug delivery by jet injectors:
energetics of jet formation and penetration.pharm res 2002.doi:10.1023/a:1020753329492.
[0772]
[10]inoue n,kobayashi d,kimura m,toyama m,sugawara i,itoyama s,et al.fundamental investigation of a novel drug delivery system,a transdermal delivery system with jet injection.int j pharm 1996.doi:10.1016/0378-5173(96)04488-2.
[0773]
[11]finnin bc,morgan tm.transdermal penetration enhancers:applications,limitations,and potential.j pharm sci 1999.doi:10.1021/js990154g.
[0774]
[12]karande p,jain a,ergun k,kispersky v,mitragotri s.design principles of chemical penetration enhancers for transdermal drug delivery.proc natl acad sci u s a 2005;102:4688-93.doi:10.1073/pnas.0501176102.
[0775]
[13]lane me.skin penetration enhancers,int j pharm 2013.doi:10.1016/j.ijpharm.2013.02.040.
[0776]
[14]adawiyah n,moniruzzaman m,hawatulaila s,goto m.ionic liquids as a potential tool for drug delivery systems.medchemcomm 2016.doi:10.1039/c6md00358c.
[0777]
[15]agatemor c,ibsen kn,tanner eel,mitragotri s.ionic liquids for addressing unmet needs in healthcare.bioeng transl med 2018;3:7-25.doi:10.1002/btm2.10083.
[0778]
[16]tanner eel,ibsen kn,mitragotri s.transdermal insulin delivery using choline-based ionic liquids(cage).j control release 2018;286:137-44.doi:10.1016/j.jconrel.2018.07.029.
[0779]
[17]zakrewsky m,lovejoy ks,kern tl,miller te,le v,nagy a,et al.ionic liquids as a class of materials for transdermal delivery and pathogen neutralization.proc natl acad sci 2014;111:13313-8.doi:10.1073/pnas.1403995111.
[0780]
[18]zhang d,wang h-j,cui x-m,wang c-x.evaluations of imidazolium ionic liquids as novel skin permeation enhancers for drug transdermal delivery.pharm dev technol 2017;22:511-20.doi:10.3109/10837450.2015.1131718.
[0781]
[19]banerjee,a.,ibsen,k.,brown,t.,chen,r.,agatemor,c.,mitragotri s.ionic liquids for oral insulin delivery.proc natl acad sci 2018;in press.
[0782]
[20]banerjee a,ibsen k,iwao y,zakrewsky m,mitragotri s.transdermal protein delivery using choline and geranate(cage)deep eutectic solvent.adv healthc mater 2017;6.doi:10.1002/adhm.201601411.
[0783]
[21]terahara t,mitragotri s,kost j,langer r.dependence of low-frequency sonophoresis on ultrasound parameters;distance of the horn and intensity.int j pharm 2002.doi:10.1016/s0378-5173(01)00981-4.
electrical impedance and permeability in the presence of chemical enhancers.j control release 2006;110:307-13.doi:10.1016/j.jconrel.2005.10.012.
[0798]
[36]khatun s,castner ew.ionic liquid-solute interactions studied by 2d noe nmr spectroscopy.j phys chem b 2015.doi:10.1021/jp509861g.
[0799]
[37]mumenthaler c,g
ü
ntert p,braun w,w
ü
thrich k.automated combined assignment of noesy spectra and three-dimensional protein structure determination.j biomol nmr 1997.doi:10.1023/a:1018383106236.
[0800]
[38]herrmann t,g
ü
ntert p,w
ü
thrich k.protein nmr structure determination with automated noe-identification in the noesy spectra using the new software atnos.j biomol nmr 2002.doi:10.1023/a:1021614115432.
[0801]
[39]dratz ea,furstenau je,lambert cg,thireault dl,rarick h,schepers t,et al.nmr structure of a receptor-bound g-protein peptide.nature 1993.doi:10.1038/363276a0.
[0802]
[40]blanco fj,jim
é
nez ma,herranz j,rico m,santoro j,nieto jl.nmr evidence of a short linear peptide that folds into aβ-hairpin in aqueous solution.j am chem soc 1993.doi:10.1021/ja00066a092.
[0803]
[41]giernoth r,a,brehm m,lingscheid y.interactions in ionic liquids probed by in situ nmr spectroscopy.j mol liq 2014;192∶55-8.doi:10.1016/j.molliq.2013.07.010.
[0804]
[42]lingscheid y,arenz s,giernoth r.heteronuclear noe spectroscopy of ionic liquids.chemphyschem 2012.doi:10.1002/cphc.201100622.
[0805]
[43]monti d,egiziano e,burgalassi s,chetoni p,chiappe c,sanzonea,et al.ionic liquids as potential enhancers for transdermal drug delivery.int j pharm 2017;516:45-51.doi:10.1016/j.ijpharm.2016.11.020.
[0806]
[44]wu x,chen z,li y,yu q,lu y,zhu q,et al.improving dermal delivery of hydrophilic macromolecules by biocompatible ionic liquid based on choline and malic acid.iht j pharm 2019.doi:10.1016/j.ijpharm.2019.01.021.
[0807]
[45]zakrewsky m,banerjee a,apte s,kern tl,jones mr.sesto red,et al.choline and geranate deep eutectic solvent as a broad-spectrum antiseptic agent for preventive and therapeutic applications.adv healthc mater 2016;5:1282-9.doi:10.1002/adhm.201600086.
[0808]
[46]valjakka-koskela r,hirvonen j,j,kiesvaara j,antila s,lehtonen l,et al.transdermal delivery of levosimendan.eur j pharm sci 2000.doi:10.1016/s0928-0987(00)00120-2.
[0809]
[47]park hj,prausnitz mr.lidocaine-ibuprofen ionic liquid for dermal anesthesia.aiche j 2015;61:2732-8.doi:10.1002/aic.14941.
[0810]
[48]berton p,di bona kr,yancey d,rizvi saa,gray m,gurau g,et al.transdermal bioavailability in rats of lidocaine in the forms of ionic liquids,salts,and deep euteetic.acs med chem lett 2017.doi:10.1021/
acsmedchemlett.6b00504.
[0811]
[49]kandimalla k,kanikkannan n,andega s,singh m.effect of fatty acids on the permeation of melatonin across rat and pig skin in-vitro and on the transepidermal water loss in rats in-vivo.jpharmpharmacol 2010;51∶783-90.doi:10.1211/0022357991773140.
[0812]
[50]kim mj,dob hj,choi mk,chung sj,shim ck,kim dd,et al.skin permeation enhancement of diclofenac by fatty acids.drug deliv 2008.doi:10.1080/10717540802006898.
[0813]
[51]kubota k,shibata a,yamaguchi t.the molecular assembly of the ionic liquid/aliphatic carboxylic acid/aliphatic amine as effective and safety transdermal permeation enhancers.eur j pharm sci 2016.doi:10.1016/j.ejps.2016.03.002.
[0814]
[52]tanner eel,piston km,ma h,ibsen kn,nangia s,mitragotri s.the influence of water on choline-based ionic liquids.manuscr prep 2019.
[0815]
[53]santos de almeida t,j
ú
lio a,saraiva n,fernandes as,ara
ú
jo mem,baby ar,et al.choline-versus imidazole-based ionic liquids as functional ingredients in topical delivery systems:cytotoxicity,solubility,and skin permeation studies.drug dev ind pharm 2017.doi:10.1080/03639045.2017.1349788.
[0816]
[54]kim s,thiessen pa,bolton ee,chen j,fu g,gindulyte a,et al.pubchem substance and compound databases.nucleic acids res 2016.doi:10.1093/nar/gkv951.
[0817]
实施例2
[0818]
使用胰岛素测试用各种离子液体组合物进行的肠内给予功效。将胰岛素与图22中所示的离子液体混合并在肠内给予。测量血糖浓度和血浆胰岛素浓度。胆碱-香茅酸、胆碱-辛酸和胆碱-辛烯酸在胰岛素的肠内递送中特别有效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1