表达嵌合蛋白的T细胞的制作方法
表达嵌合蛋白的t细胞
技术领域
1.本发明尤其涉及可用于治疗癌症的组合物和方法,包括表达嵌合抗原受体和异源嵌合蛋白的工程化的t细胞。
2.优先权
3.本技术要求2019年6月21日提交的美国申请号62/864,791的权益和优先权,所述申请特此以引用的方式整体并入。
4.以电子方式提交的文本文件的说明
5.本技术含有序列表。它已经由efs-web以名称为“shk-021pc_sequencelisting_st25”的ascii文本文件形式通过电子方式提交。序列表的大小是57,782字节,并且创建于或约2020年6月17日。所述序列表特此以引用的方式整体并入。
背景技术:
6.癌症是涉及细胞生长失调的广泛疾病,其中癌细胞不受控制地分裂和生长。在影响人类的200多种已知癌症类型中,安全且有效的治疗选择仅可用于一部分癌症类型。基于工程化的t细胞的免疫疗法(包括car-t细胞)已成功用于几种癌症类型。然而,工程化的t细胞不能在体内保持持续长时间段的活性和/或工程化的t细胞的抗癌活性相对较低。对于具有改善的抗癌活性的组合物和方法仍然存在未满足的需求。
技术实现要素:
7.在各个方面,本发明提供了可用于癌症免疫疗法的组合物和方法。例如,本发明部分地涉及一种表达嵌合抗原受体并表达异源嵌合蛋白的工程化的t细胞。嵌合抗原受体和异源嵌合蛋白各自能够在癌细胞与工程化的t细胞之间形成突触,从而允许改善的抗癌靶向和功能。本发明的组合物和方法克服癌症领域的各种不足。
8.本发明的一个方面是一种表达嵌合抗原受体和异源嵌合蛋白的工程化的t细胞。嵌合抗原受体包含抗原结合结构域、跨膜结构域和细胞内结构域,所述细胞内结构域包含共刺激结构域和/或信号传导结构域。异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。
9.本发明的一个方面是一种表达异源嵌合蛋白的工程化的t细胞,其中异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。
10.在一个方面,本发明提供了一种用于制造工程化的t细胞的方法。方法包括以下步骤:(i)从受试者获得t细胞或t细胞祖细胞;(ii)用编码嵌合抗原受体并被设计为整合至t细胞或t细胞祖细胞的基因组中的第一dna分子转染t细胞或t细胞祖细胞;(iii)用编码异源嵌合蛋白并被设计为整合至t细胞或t细胞祖细胞的基因组中的第二dna分子转染t细胞
β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
15.在另一个方面,本发明提供了一种分析工程化的t细胞的方法。方法包括以下步骤:(a)制造工程化的t细胞,(b)将工程化的t细胞与第二细胞共培养,以及(c)分析第二细胞对细胞因子的表达。在实施方案中,工程化的t细胞根据本文公开的实施方案中的任一个制造。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、ac vr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dc r3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、la yn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmi gd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
16.本发明的一个方面是一种用于获得工程化的t细胞群体的方法。方法包括获得通过本文公开的方法制造的工程化的t细胞并在增强工程化的t细胞的增殖的培养基中培养工程化的t细胞,从而获得工程化的t细胞群体。
17.本发明的其他方面包括一种包含本文公开的工程化的t细胞的组合物,以及一种包含组合物和药学上可接受的赋形剂的药物组合物。
18.另一个方面是一种本文公开的工程化的t细胞,工程化的t细胞用作治疗癌症的药物。
19.另一个方面是本文公开的工程化的t细胞在制造药物中的用途。
20.在另一个方面,本发明提供了一种通过本文公开的方法获得的工程化的t细胞群体。
21.另一个方面是一种包含本文公开的工程化的t细胞群体和药学上可接受的赋形剂的药物组合物。
22.在另一个方面,本发明提供了一种用于治疗有需要的受试者的癌症的方法。方法包括向受试者施用治疗有效量的本文公开的药物组合物。
23.本文公开的任何方面或实施方案可与本文公开的任何其他方面或实施方案组合。
附图说明
24.图1示出表达嵌合抗原受体和异源嵌合蛋白的工程化的t细胞及其与癌细胞的相互作用的非限制性示意图。
25.图2a至图2d示出i型跨膜蛋白(图2a和图2b,左侧蛋白)和ii型跨膜蛋白(图2a和图2b,右侧蛋白)的示意图。可对i型跨膜蛋白和ii型跨膜蛋白进行工程化,以使得它们的跨膜
4-1bbl(灰色条形)的纯培养上清液中的嵌合蛋白与过表达人pd-l1的cho-k1细胞的结合。
32.图9a和图9b示出如通过流式细胞术测定的由jurkat/hpd-1-fc-ox40l细胞产生的hpd-1-fc-ox40l嵌合蛋白中存在的人pd-1和ox40l的ecd与表达ox40或pd-l1的细胞的结合的定量。虚线显示背景信号。图9a示出jurkat亲本细胞(黑色条形)或jurkat/hpd-1-fc-ox40l细胞(灰色条形)的纯培养上清液中的嵌合蛋白与cho-k1/hpd-l1细胞的结合。图9b示出jurkat亲本细胞(黑色条形)或jurkat/hpd-1-fc-ox40l(灰色条形)的纯培养上清液中的嵌合蛋白与过表达人ox40的cho-k1细胞的结合。
33.图10a和图10b示出由jurkat/hpd-1-fc-ox40l细胞产生的hp d-1-fc-ox40l嵌合蛋白中存在的人csf1r和cd40l的ecd与其相应配体的结合的定量。虚线显示背景信号。图10a示出如通过流式细胞术测量的jurkat亲本细胞(黑色条形)或jurkat/hcsf1r-fc-cd40l细胞(灰色条形)的纯培养上清液中的嵌合蛋白与cho-k1/hcd40细胞的结合的定量。图10b示出如使用msd平台检测到的jurkat亲本细胞(黑色条形)或jurkat/hcsf1r-fc-cd40l细胞的纯培养上清液中的hcsf1r-fc-cd40l嵌合蛋白与人csf1蛋白的结合。将人重组cs f1包被的msd板与递增量的jurkat亲本或jurkat/hcsf1r-fc-cd40l细胞的培养上清液一起孵育,如实施例2中所论述。使用抗人cd40l-生物素、然后使用msd链霉亲和素试剂检测结合。
34.图11a至图11c示出由jurkat/hpd-1-fc-4-1bbl细胞产生的嵌合hpd-1-fc-4-1bbl蛋白对细胞因子基因的诱导。培养了250,000个ht1080/h4-1bb细胞。将所指示量的jurkat亲本细胞或jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液添加至ht1080/h4-1bb细胞培养物中。3小时后,从ht1080/h4-1bb细胞分离rna,合成cdna,并通过qrt-pcr评估actb(图11a)、cxcl8(图11b)和ccl2(图11c)的基因表达。根据δ-δct方法,gapdh用于归一化基因表达和倍数诱导。虚线显示来自用jurkat亲本细胞的纯培养上清液处理的ht1080/h4-1bb细胞的背景信号。
35.图12示出由jurkat/hpd-1-fc-4-1bbl细胞产生的嵌合hpd-1-fc-4-1bbl蛋白对il-8的诱导。培养了250,000个ht1080/h4-1bb细胞。将jurkat亲本细胞或jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液添加至25%的ht1080/h4-1bb细胞培养物中。3小时后,从ht1080/h4-1bb细胞培养物中除去培养基并通过elisa评估il-8。虚线显示来自用jurkat亲本细胞的纯培养上清液处理的ht1080/h4-1bb细胞的背景信号。
36.图13a和图13b示出由jurkat/hpd-1-fc-ox40l细胞产生的嵌合hpd-1-fc-ox40l蛋白对ccl2表达的诱导。培养了250,000个ht1080/h4-1bb细胞。将所指示量的jurkat亲本细胞或jurkat/hpd-1-fc-ox40l细胞的纯培养上清液添加至ht1080/h4-1bb细胞培养物中。3小时后,从ht1080/h4-1bb细胞分离rna,合成cdna,并通过qr t-pcr评估actb(管家控制基因;图13a)和ccl2(图13b)的基因表达。根据δ-δct方法,gapdh用于归一化基因表达和倍数诱导。虚线显示来自用jurkat亲本细胞的纯培养上清液处理的ht1080/h4-1bb细胞的背景信号。
37.图14a和图14b示出jurkat/hcsf1r-fc-cd40l细胞对pathh unter u2os-nik/nfκb报告细胞(discoverx)中信号传导的诱导。虚线显示背景信号。图14a证明pathhunter u2os-nik/nfκb报告细胞表达人cd40(hcd40)。将pathhunter u2os-nik/nfκb报告细胞使用apc缀合的同种型抗体或抗人cd40-apc抗体染色,并通过流式细胞术进行分析。图14b示出jurkat/hcsf1r-fc-cd40l细胞对pathhunter u2os-nik/nfκb报告细胞中nfκb信号传导的
诱导。将所指示数量的jurkat亲本细胞或jurkat/hcsf1r-fc-cd40l细胞与pathhunter u2os-nik/nfκb报告细胞共培养。15μg/ml纯化的csf1r-fc-cd40l嵌合蛋白的3倍连续稀释液用作阳性对照。培养6小时后,添加discoverx发光试剂,并使用pro mega glomax仪器测定生物发光。
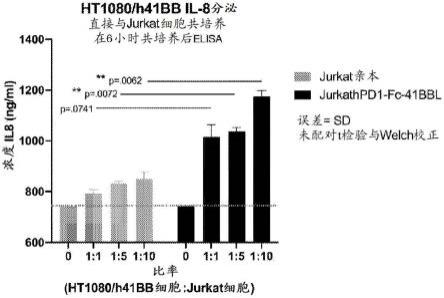
38.图15示出当与表达4-1bb的细胞共培养时jurkat/hpd1-fc-4-1bbl细胞对il-8分泌的诱导。将250,000个ht1080/4-1bb细胞培养过夜。第二天,将jurkat亲本细胞或jurkat/hpd1-fc-4-1bbl细胞以所指示比率添加至ht1080/4-1bb细胞中。共培养6小时后,除去上清液并通过elisa评估il-8。虚线显示来自未处理的ht1080/h4-1bb细胞的背景信号。
具体实施方式
39.本发明部分地基于表达嵌合抗原受体并表达异源嵌合蛋白的工程化的t细胞的产生。
40.本发明及其优点在图1中示出。示出表达嵌合抗原受体并表达异源嵌合蛋白的工程化的t细胞。至少包含抗原结合结构域、跨膜结构域和细胞内结构域的嵌合抗原受体是其中其抗原结合结构域位于细胞外空间中的跨膜蛋白。在所述细胞外空间中,所述抗原结合结构域能够结合至癌细胞表面上呈递的抗原。当抗原结合结构域与癌细胞结合时,在工程化的t细胞与癌细胞之间形成稳定的突触;这种稳定的突触有利于工程化的t细胞的抗癌作用/肿瘤减少(当抗原结合信号通过嵌合抗原受体的细胞内结构域传输至细胞时,所述工程化的t细胞变得激活)。如图1所示,一些癌细胞通过嵌合抗原受体与工程化的t细胞结合,并且一些癌细胞通过异源嵌合蛋白另外/可替代地与工程化的t细胞结合。至少包含第一结构域(包含结合癌细胞上的配体/受体的第一跨膜蛋白的一部分)、接头结构域和第二结构域(包含结合t细胞上的配体/受体的第二跨膜蛋白的一部分)的异源嵌合蛋白由工程化的t细胞表达和分泌。当第一结构域与癌细胞结合时,并且当第二结构域与工程化的t细胞结合时,在所述工程化的t细胞与所述癌细胞之间也形成稳定的突触;这种稳定的突触也有利于所述工程化的t细胞的抗癌作用/肿瘤减少(其响应于所述第二结构域与所述工程化的t细胞的结合被激活)并阻断抑制信号(其通过由癌细胞呈递的第一跨膜蛋白的配体/受体传递)。如所示,可形成仅包含嵌合抗原受体的稳定突触;可形成仅包含异源嵌合蛋白的稳定突触;或者可与嵌合抗原受体和异源嵌合蛋白两者形成协同稳定的突触。由于嵌合抗原受体和异源嵌合蛋白各自能够在癌细胞与工程化的t细胞之间形成突触,这允许抗癌靶向和功能的改进。因此,本发明的工程化的t细胞、包含所述工程化的t细胞的组合物和使用这些的治疗方法提供优异的癌细胞杀伤和肿瘤减少并克服癌症治疗剂领域中的各种缺陷。
41.嵌合抗原受体(car)
42.本发明尤其提供了一种表达嵌合抗原受体(car)和异源嵌合蛋白的工程化的t细胞。嵌合抗原受体包含抗原结合结构域、跨膜结构域和细胞内结构域,所述细胞内结构域包含共刺激结构域和/或信号传导结构域。
43.嵌合抗原受体(car,也称为嵌合免疫受体、嵌合t细胞受体或人工t细胞受体)是受体蛋白,所述受体蛋白已被工程化以赋予t细胞靶向特定蛋白质的新能力。这些受体是嵌合的,因为它们将抗原结合和t细胞激活功能组合到单一受体中。
44.存在几代嵌合抗原受体。例如,“第一代”嵌合抗原受体通常包含与跨膜结构域融
合的细胞外抗原结合结构域(例如,单链可变片段(scfv)),所述跨膜结构域与t细胞受体(tcr)链的细胞质/细胞内信号传导结构域融合。“第一代”嵌合抗原受体通常具有来自cd3ζ-链的细胞内信号传导结构域,其是来自内源性tcr的信号的主要传递者。“第一代”嵌合抗原受体可提供从头抗原识别,并通过单个融合分子中的其cd3ζ-链信号传导结构域引起cd4+和cd8+t细胞两者的激活,独立于hla介导的抗原呈递,如天然tcr所要求的。“第二代”嵌合抗原受体将来自各种共刺激分子(例如cd28、4-1bb、icos和ox40)的细胞内信号传导结构域添加至嵌合抗原受体的胞质尾区,以向t细胞提供额外的信号。“第二代”嵌合抗原受体包含共刺激(例如,cd28或4-1bb)和激活(cd3ζ)结构域两者。临床前研究表明,“第二代”嵌合抗原受体可提高t细胞的抗癌活性。例如,“第二代”嵌合抗原受体-工程化的t细胞的强大功效已用于靶向慢性成淋巴细胞性白血病(cll)和急性成淋巴细胞性白血病(all)患者的cd19分子的临床试验中。“第三代”嵌合抗原受体包含多个共刺激(例如,cd28和4-1bb)和激活(cd3ζ)结构域。“第四代”嵌合抗原受体包含由嵌合抗原受体-工程化的t细胞共同表达的促炎性细胞因子或共刺激配体。本文公开的嵌合抗原受体可包括如上所述的任一代嵌合抗原受体。
45.在实施方案中,提供了工程化的t细胞,所述工程化的t细胞包含第一dna区段,所述第一dna区段编码包含通过柔性接头与特定抗体的vh连接的vl的抗原结合结构域,例如单链fv结构域(scfv);和第二dna区段,所述第二dna区段部分或完全编码内源性蛋白的跨膜结构域和细胞质结构域,其中所述内源性蛋白在淋巴细胞的表面上表达并触发所述淋巴细胞的激活和/或增殖;以及第三dna片段,所述第三dna片段编码本文所述的任何异源嵌合蛋白。在实施方案中,在转染至淋巴细胞后,淋巴细胞在转染的淋巴细胞表面上以一个单一连续链的形式表达scfv结构域和内源性蛋白的结构域。在实施方案中,当表达的scfv结构域与其抗原结合时,转染的淋巴细胞被触发以激活和/或增殖并具有mhc非限制性抗体类型特异性。在实施方案中,内源性蛋白是淋巴细胞受体链、tcr/cd3复合物的多肽、或fc或il-2受体的亚基。
46.在实施方案中,对工程化的t细胞进行工程化以允许同种异体用途(例如在本文所述的治疗方法中)。在实施方案中,对工程化的t细胞进行修饰以在功能上损害或减少内源性t细胞受体(tcr)的表达,和/或修饰以表达任选地包含嵌合受体的至少一种功能性外源性非tcr,所述嵌合受体包含连接至cd3ζ信号传导结构域的nkg2d配体结合结构域。在实施方案中,工程化的t细胞适合用于人类疗法中,例如与从未修饰或仅修饰以表达至少一种功能性外源性非tcr的相同人供体分离的原代人t细胞引发的gvhd反应相比,工程化的t细胞在组织不相容的人受体中不引发gvhd反应或引发减少的gvhd反应。
47.嵌合抗原受体的抗原结合结构域
48.本文公开的嵌合抗原受体包含能够结合由癌细胞表达的抗原的抗原结合结构域。
49.在实施方案中,可用于本发明中的嵌合抗原受体的抗原结合结构域特异性地结合至癌细胞特异性抗原,例如人癌细胞特异性抗原。
50.在实施方案中,抗原结合结构域是抗体、抗体片段、scfv、fv、fab、(fab')2、单结构域抗体(sdab)、vh或vl结构域或骆驼科动物vhh结构域,例如人scfv、人fv、人fab、人(fab')2、人单结构域抗体(sdab)或人vh或vl结构域或人源化scfv、人源化fv、人源化fab、人源化(fab')2、人源化单结构域抗体(sdab)或人源化vh或vl结构域。
51.在实施方案中,由癌细胞表达(并由抗原结合结构域识别)的抗原选自由以下组成的组:b细胞成熟抗原(bcma)、cd10、cd19、cd20、cd22、cd30、cd33、cd34、cd38、cd56、cd80/86、cd117、cd123、cd123、cd133、cd138、癌胚抗原(cea)、cs1/cd319/slamf7、双唾液酸神经节苷脂(gd2)、epha2、表皮生长因子受体(egfr)、上皮细胞粘附分子(epcam)、磷脂酰肌醇蛋白聚糖-3(gpc3)、her2、整联蛋白β7、lewis-y、间皮素、muc1、pd-l1和前列腺干细胞抗原(psca)。
52.任选地,嵌合抗原受体在抗原结合结构域与工程化的t细胞外膜之间包含间隔区。理想的间隔区增强抗原结合结构域相对于受体的剩余部分的柔性,从而减少受体与其靶抗原之间的空间限制。这种柔性促进工程化的t细胞与癌细胞之间的抗原结合和突触形成。间隔区可包含来自igg或来自cd8的铰链结构域。
53.抗原结合结构域对癌细胞抗原的结合是在工程化的t细胞与癌细胞之间形成稳定突触的第一步骤。
54.嵌合抗原受体的跨膜结构域
55.在实施方案中,可用于本发明中的嵌合抗原受体的跨膜结构域包含选自由以下组成的组的蛋白质的跨膜结构域:t细胞受体的α链、t细胞受体的β链或t细胞受体的ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、kirds2、ox40、cd2、cd27、lfa-1(cdl la、cd18)、icos(cd278)、4-1bb(cd137)、gitr、cd40、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、il-2rβ、il-2rγ、il-7r a、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cdlld、itgae、cd103、itgal、cdlla、lfa-1、itgam、cdl lb、itgax、cdllc、itgbl、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、dnaml(cd226)、slamf4(cd244、2b4)、cd84、cd96(触觉)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、pag/cbp、nkp44、nkp30、nkp46、nkg2d和nkg2c或它们的组合。
56.在实施方案中,可用于本发明中的嵌合抗原受体的跨膜结构域包含跨越膜的至少一部分的疏水性α螺旋。跨膜结构域对于受体整体的稳定性而言是必不可少的。不同的跨膜结构域导致不同的受体稳定性。已知cd28跨膜结构域产生高度表达的稳定受体。
57.在工程化的t细胞与癌细胞之间形成稳定的突触后,附近的嵌合抗原受体簇集。
58.嵌合抗原受体的细胞内结构域
59.在实施方案中,可用于本发明中的嵌合抗原受体的细胞内结构域包含共刺激结构域,所述共刺激结构域包含cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3或特异性地结合cd83的配体的细胞内结构域的一部分,或它们的组合。
60.在实施方案中,可用于本发明中的嵌合抗原受体的细胞内结构域包含来自cd28、ox40和/或4-1bb的共刺激结构域。
61.在实施方案中,可用于本发明中的嵌合抗原受体的细胞内结构域包含信号传导结构域,所述信号传导结构域包含cd3-ζ的细胞质结构域的一部分。正常t细胞受体激活依赖于cd3-ζ的细胞质域中存在的基于免疫受体酪氨酸的激活基序(itam)的磷酸化。为了模拟这个过程,一旦抗原被嵌合抗原受体的抗原结合结构域结合,包含的cd3-ζ的信号传导结构
域就能够将激活信号传递至工程化的t细胞。
62.在实施方案中,可用于本发明中的嵌合抗原受体的细胞内结构域包含来自cd3-ζ的信号传导结构域。
63.在实施方案中,可用于本发明中的嵌合抗原受体的细胞内结构域包含共刺激结构域和信号传导结构域两者。
64.在工程化的t细胞与癌细胞之间形成稳定的突触并且附近的嵌合抗原受体簇集后,信号通过其细胞内结构域传递至细胞。
65.本发明的一个方面是一种表达异源嵌合蛋白的工程化的t细胞,其中所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。在实施方案中,t细胞是t细胞祖细胞。在实施方案中,t细胞或t细胞祖细胞获自患者。在实施方案中,t细胞或t细胞祖细胞对癌抗原具有特异性。
66.异源嵌合蛋白
67.本发明的一个方面是一种表达嵌合抗原受体和异源嵌合蛋白的工程化的t细胞。异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。
68.在实施方案中,第一结构域基本上包含第一跨膜蛋白的整个细胞外结构域,和/或第二结构域基本上包含第二跨膜蛋白的整个细胞外结构域。
69.在实施方案中,第一结构域能够结合第一跨膜蛋白的配体/受体,并且第二结构域能够结合第二跨膜蛋白的配体/受体。
70.在实施方案中,第一结构域在与其配体/受体结合时能够抑制免疫抑制信号,和/或第二结构域在与其配体/受体结合时能够激活免疫刺激信号。
71.在实施方案中,第一跨膜蛋白的配体/受体由癌细胞表达,和/或第二跨膜蛋白的配体/受体由工程化的t细胞和/或天然t细胞表达。
72.与本发明相关的单程跨膜蛋白包含细胞外结构域、跨膜结构域和细胞内结构域。跨膜蛋白的细胞外结构域负责与可溶性受体/配体或膜结合的受体/配体(即,相邻细胞的膜)相互作用。跨膜结构域负责将跨膜蛋白定位于质膜。并且,细胞内结构域负责响应于细胞外结构域与其配体/受体的接触而将信号传递至细胞内部。
73.通常存在两种类型的单程跨膜蛋白:具有细胞外氨基末端和细胞内羧基末端的i型跨膜蛋白(参见图2a和图2b,左侧蛋白)和具有细胞外羧基末端和细胞内氨基末端的ii型跨膜蛋白(参见图2a和图2b,右侧蛋白)。跨膜蛋白可以是受体或配体。对于i型跨膜蛋白,蛋白的氨基末端面向细胞外部,并且因此含有负责在细胞外环境中与其他结合配偶体(配体或受体)相互作用的功能结构域。对于ii型跨膜蛋白,蛋白的羧基末端面向细胞外部,并且因此含有负责在细胞外环境中与其他结合配偶体(配体或受体)相互作用的功能结构域。因此,这两种类型的跨膜蛋白相对于细胞膜具有彼此相反的取向。
74.可用于本发明中的异源嵌合蛋白包含直接或通过接头连接的第一跨膜蛋白的细胞外结构域和第二跨膜蛋白的细胞外结构域。如图2c和图2d所示,当结构域以氨基末端至
羧基末端取向连接时,第一结构域位于嵌合蛋白的“左”侧并且“面向外”,并且第二结构域位于嵌合蛋白的“右”侧并且“面向外”。
75.重要的是,由于可用于本发明中的异源嵌合蛋白破坏、阻断、减少、抑制和/或隔离免疫抑制信号的传递并且还传递、提供和/或激活免疫刺激信号,因此它通过两条不同的途径提供抗癌作用;这种双重作用更可能在患者中提供治疗作用和/或在患者中提供增强的治疗作用,例如当与包含结合至异源嵌合蛋白的配体/受体中的任一者或各自包含异源嵌合蛋白的单个配体/受体结合结构域的两种融合蛋白的两种抗体的治疗剂相比时),它们都不能在癌细胞与工程化的t细胞之间产生稳定的突触。另外,因为此类异源嵌合蛋白可经由两种不同的途径起作用,因此至少在对靶向所述两种途径中的一者的治疗响应差的患者中,它们可以是有效的。因此,对经由两种途径之一起作用的治疗的响应差的患者可通过靶向另一途径来获得治疗益处。
76.当其第一结构域结合至由癌细胞表达的第一跨膜蛋白的配体/受体并且第二结构域结合至由工程化的t细胞表达的第二跨膜蛋白的配体/受体时,可用于本发明中的异源嵌合蛋白能够在所述癌细胞与所述工程化的t细胞之间形成稳定的突触。稳定的突触提供有利于工程化的t细胞减少肿瘤的空间取向。
77.在可用于本发明的异源嵌合蛋白中,第一跨膜蛋白可以是2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8。
78.在实施方案中,第一跨膜蛋白是pd-1、csflr、tim-3、btla、ctla-4、lag-3、b7-h3、tmigd2、tigit、sirpa、btnl3、btnl8、btnl3a1、btnl3a2或vsig8。
79.在可用于本发明的异源嵌合蛋白中,第二跨膜蛋白可以是4-1bb配体(4-1bbl)、april、baff、btnl2、cd28、cd30配体(cd30l)、cd40配体(cd40l)、cd70、c-型凝集素结构域(clec)家族成员、fasl、gitr配体(gitrl)、light(cd258)、lta、lta1b2、nkg2a、nkg2c、nkg2d、ox40配体(ox40l)、rankl、tl1a、tnfa或trail。
80.在实施方案中,第二跨膜蛋白是ox40l、cd40l、4-1bbl、gitrl、light、cd70、cd30l、trail或tl1a。
81.在实施方案中,可用于本发明中的异源嵌合蛋白包含pd-1的细胞外结构域的变体。作为实例,所述变体可与pd-1(例如人pd-1)的已知氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至
少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
82.在实施方案中,pd-1的细胞外结构域具有以下氨基酸序列:
83.ldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfq(seq id no:57)。
84.在实施方案中,异源嵌合蛋白包含pd-1的细胞外结构域的变体。作为实例,所述变体可与seq id no:57具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
85.在实施方案中,异源嵌合蛋白的第一结构域包含与seq id no:57的氨基酸序列至少95%同一的氨基酸序列。
86.普通技术人员可通过参考文献来选择pd-1的已知氨基酸序列的变体,所述文献例如zhang等人“structural and functional analysis of the costimulatory receptor programmed death-1”immunity.2004年3月;20(3):337-47;lin等人“the pd-1/pd-l1 complex resembles the antigen-binding fv domains of antibodies and t cell receptors”,proc natl acad sci u s a.2008年2月26日;105(8):3011-6;zak等人“structure of the complex of human programmed death 1,pd-1,and its ligand pd-l1”,structure.2015年12月1日;23(12):2341-2348;和cheng等人“structure and interactions of the human programmed cell death 1receptor”,j biol chem.2013年4月26日;288(17):11771-85,所述文献各自以引用的方式整体并入。
87.在实施方案中,可用于本发明中的异源嵌合蛋白包含ox40l的细胞外结构域的变体。作为实例,所述变体可与ox40l(例如人ox40l)的已知氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
88.在实施方案中,ox40l的细胞外结构域具有以下氨基酸序列:
89.qvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislhyqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl(seq id no:58)。
90.在实施方案中,异源嵌合蛋白包含ox40l的细胞外结构域的变体。作为实例,所述
变体可与seq id no:58具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
91.在实施方案中,异源嵌合蛋白的第二结构域包含与seq id no:58的氨基酸序列至少95%同一的氨基酸序列。
92.普通技术人员可通过参考文献来选择ox40l的已知氨基酸序列的变体,所述文献例如croft,等人,"the significance of ox40 and ox40l to t cell biology and immune disease,"immunol rev.,229(1),第173-191页,2009和baum,等人,"molecular characterization of murine and human ox40/0x40 ligand systems:identification of a human ox40 ligand as the htlv-1-regulated protein gp34,"the embo journal,第13卷,第77期,第3992-4001页,1994,所述文献各自以引用的方式整体并入。
93.在实施方案中,可用于本发明中的异源嵌合蛋白包含:(a)包含seq id no:57的氨基酸序列的第一结构域,(b)包含seq id no:58的氨基酸序列的第二结构域,和(c)接头,所述接头包含与seq id no:1、seq id no:2或seq id no:3至少95%同一的氨基酸序列。这种异源嵌合蛋白可被称为“pd-1-fc-ox40l”。
94.在实施方案中,pd-1-fc-ox40l嵌合蛋白用于本发明中并且具有以下氨基酸序列:
95.ldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqskygppcppcpapeflggpsvflfppkpkdqlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlsgkeykckvsskglpssiektisnatgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvlhealhnhytqkslslslgkiegrmdqvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislhyqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl(seq id no:59)。
96.在实施方案中,可用于本发明中的异源嵌合蛋白包含4-1bbl的细胞外结构域的变体。作为实例,所述变体可与4-1bbl(例如人4-1bbl)的已知氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
97.在实施方案中,4-1bbl的细胞外结构域具有以下氨基酸序列:
98.qvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislh
yqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl(seq id no:60)。
99.在实施方案中,异源嵌合蛋白包含4-1bbl的细胞外结构域的变体。作为实例,所述变体可与seq id no:60具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
100.在实施方案中,异源嵌合蛋白的第二结构域包含与seq id no:60的氨基酸序列至少95%同一的氨基酸序列。
101.所编码的4-1bbl蛋白是属于肿瘤坏死因子(tnf)配体家族的细胞因子。这种跨膜细胞因子是充当tnfrsf9/4-1bb的配体的双向信号转导器,所述tnfrsf9/4-1bb是t淋巴细胞中的共刺激受体分子。这种细胞因子及其受体参与抗原呈递过程和细胞毒性t细胞的产生。受体tnfrsf9/4-1bb不存在于静息t淋巴细胞中,但在抗原刺激后迅速表达。由这种基因编码的配体tnfsf9/4-1bbl除了促进t淋巴细胞增殖外,还显示重新激活无反应性t淋巴细胞。这种细胞因子也被证明是cd8 t细胞中最佳cd8反应所必需的。这种细胞因子在癌细胞系中表达,并且被认为参与t细胞-癌细胞相互作用。
102.普通技术人员可通过参考文献来选择4-1bbl的已知氨基酸序列的变体,所述文献例如won等人,“the structure of the trimer of human 4-1bb ligand is unique among members of the tumor necrosi s factor superfamily.”j.biol.chem.285(12),9202-9210(2010);alderson等人,“molecular and biological characterization of human 4-1bb and its ligand.”eur.j.immunol.24(9),2219-2227(1994);以及arch和thompson“4-1bb and ox40 are members of a tumor necrosis factor(tnf)-nerve growth factor receptor subfamily that bind tnf receptor-associated factors and activate nuclear factor kappa b.”mol.cell.biol.18(1),558-565(1998),所述文献各自以引用的方式整体并入。
103.在实施方案中,可用于本发明中的异源嵌合蛋白包含:(a)包含seq id no:57的氨基酸序列的第一结构域,(b)包含seq id no:60的氨基酸序列的第二结构域,和(c)接头,所述接头包含与seq id no:1、seq id no:2或seq id no:3至少95%同一的氨基酸序列。这种异源嵌合蛋白可被称为“pd-1-fc-4-1bbl”。
104.在实施方案中,pd-1-fc-4-1bbl嵌合蛋白用于本发明中并且具有以下氨基酸序列:
105.ldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqskygppcppcpapeflggpsvflfppkpkdqlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlsgkeykckvsskglpssiektisnatgqprepqvytlppsqeemtknqvsltclvkgf
ypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvlhealhnhytqkslslslgkiegrmddacpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse(seq id no:61)。
106.在实施方案中,可用于本发明中的异源嵌合蛋白包含csf1r的细胞外结构域的变体。作为实例,所述变体可与csf1r(例如人csf1r)的已知氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
107.在实施方案中,csf1r的细胞外结构域具有以下氨基酸序列:
108.ipviepsvpelvvkpgatvtlrcvgngsvewdgppsphwtlysdgsssilstnnatfqntgtyrctepgdplggsaaihlyvkdparpwnvlaqevvvfedqdallpclltdpvleagvslvrvrgrplmrhtnysfspwhgftihrakfiqsqdyqcsalmggrkvmsisirlkvqkvipgppaltlvpaelvrirgeaaqivcsassvdvnfdvflqhnntklaipqqsdfhnnryqkvltlnldqvdfqhagnyscvasnvqgkhstsmffrvvesaylnlsseqnliqevtvgeglnlkvmveaypglqgfnwtylgpfsdhqpepklanattkdtyrhtftlslprlkpseagrysflarnpggwraltfeltlryppevsviwtfingsgtllcaasgypqpnvtwlqcsghtdrcdeaqvlqvwddpypevlsqepfhkvtvqslltvetlehnqtyecrahnsvgsgswafipisagahthppdeflftp(seq id no:62)。
109.在实施方案中,异源嵌合蛋白包含csf1r的细胞外结构域的变体。作为实例,所述变体可与seq id no:62具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
110.在实施方案中,异源嵌合蛋白的第一结构域包含与seq id no:62的氨基酸序列至少95%同一的氨基酸序列。
111.普通技术人员可以通过参考文献来选择csf1r的已知氨基酸序列的变体,所述文献例如,tap,等人,“structure-guided blockade of csf1r kinase in tenosynovial giant-cell tumor”,n.engl.j.med.2015年7月30日;373(5):428-37;schubert等人,“crystal structure of the tyrosine kinase domain of colony-stimulating factor-1receptor(cfms)in complex with two inhibitors.”j.biol.chem.282(6),4094-4101(2007);walter等人,“the 2.7a crystal structure of the autoinhibited human c-fms kinase domain.”j.mol.biol.367(3),839-847(2007);以及mashkani等人,
structure 3(10),1031-1039(1995);以及singh等人,“the role of polar interactions in the molecular recognition of cd40l with its receptor cd40.”protein sci.7(5),1124-1135(1998),所述文献各自以引用的方式整体并入。
118.在实施方案中,可用于本发明中的异源嵌合蛋白包含:(a)包含seq id no:62的氨基酸序列的第一结构域,(b)包含seq id no:63的氨基酸序列的第二结构域,和(c)接头,所述接头包含与seq id no:1、seq id no:2或seq id no:3至少95%同一的氨基酸序列。这种异源嵌合蛋白可被称为“csf1r-fc-cd40l”。
119.在实施方案中,csf1r-fc-cd40l嵌合蛋白用于本发明中并且具有以下氨基酸序列:
120.ipviepsvpelvvkpgatvtlrcvgngsvewdgppsphwtlysdgsssilstnnatfqntgtyrctepgdplggsaaihlyvkdparpwnvlaqevvvfedqdallpclltdpvleagvslvrvrgrplmrhtnysfspwhgftihrakfiqsqdyqcsalmggrkvmsisirlkvqkvipgppaltlvpaelvrirgeaaqivcsassvdvnfdvflqhnntklaipqqsdfhnnryqkvltlnldqvdfqhagnyscvasnvqgkhstsmffrvvesaylnlsseqnliqevtvgeglnlkvmveaypglqgfnwtylgpfsdhqpepklanattkdtyrhtftlslprlkpseagrysflarnpggwraltfeltlryppevsviwtfingsgtllcaasgypqpnvtwlqcsghtdrcdeaqvlqvwddpypevlsqepfhkvtvqslltvetlehnqtyecrahnsvgsgswafipisagahthppdeflftpskygppcppcpapeflggpsvflfppkpkdqlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlsgkeykckvsskglpssiektisnatgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvlhealhnhytqkslslslgkiegrmdhrrldkiedernlhedfvfmktiqrcntgerslsllnceeiksqfegfvkdimlnkeetkkensfemqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seq id no:64)。
121.在实施方案中,所述嵌合蛋白能够提供持续的免疫调节作用。
122.在实施方案中,其中接头是选自柔性氨基酸序列、igg铰链区和抗体序列的多肽。
123.在实施方案中,接头不是单个氨基酸接头,例如但不限于,接头的长度大于一个氨基酸。在实施方案中,接头的长度大于1-6个氨基酸,例如但不限于,接头的长度大于七个氨基酸。在实施方案中,接头包含多于一个甘氨酸残基。
124.在实施方案中,可用于本发明中的异源嵌合蛋白包含连接所述蛋白的第一和第二结构域的接头结构域。
125.在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-ch2-ch3 fc结构域,例如源自igg、iga、igd或ige。在实施方案中,igg选自igg1、igg2、igg3和igg4,并且iga选自iga1和iga2。在实施方案中,igg是igg4,例如人igg4。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。
126.在实施方案中,铰链-ch2-ch3 fc结构域源自igg、iga、igd或ige。在实施方案中,igg选自igg1、igg2、igg3和igg4,并且iga选自iga1和iga2。在实施方案中,igg是igg4,例如人igg4。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。
127.在可用于本发明中的异源嵌合蛋白中,所述异源嵌合蛋白是重组融合蛋白,例如
具有本文所公开的细胞外结构域的单个多肽。例如,在实施方案中,异源嵌合蛋白在原核细胞、真核细胞或无细胞表达系统中作为单个单元翻译。
128.在实施方案中,本发明的异源嵌合蛋白可在哺乳动物宿主细胞(即,本发明的工程化的t细胞)中作为可分泌的和全功能的单个多肽链产生。
129.在实施方案中,异源嵌合蛋白是指包含多个多肽,例如本文所公开的多个细胞外结构域的重组蛋白,所述多肽组合(经由共价或非共价键合)以例如在体外产生单个单元(例如具有本文公开的一个或多个合成接头)。
130.可用于本发明中的异源嵌合蛋白具有在空间上能够结合其配体/受体的第一结构域和/或在空间上能够结合其配体/受体的第二结构域。这意味着嵌合蛋白中存在足够的总体柔性和/或细胞外结构域(或其部分)与嵌合蛋白的剩余部分之间存在物理距离,以使得细胞外结构域的配体/受体结合结构域在空间上不受阻碍地结合其配体/受体。这种柔性和/或物理距离(在本文中称为“松弛”)通常可存在于一个或多个细胞外结构域中,通常存在于接头中,和/或通常存在于嵌合蛋白中(作为整体)。或者或另外地,可通过包含一个或多个另外的氨基酸序列(例如,下文描述的接合接头)或合成接头(例如,聚乙二醇(peg)接头)来修饰嵌合蛋白,其提供了避免空间位阻所需的额外松弛。
131.在本文公开的任何方面和实施方案中,可用于本发明中的异源嵌合蛋白可包含相对于本文公开的任何蛋白质序列具有一种或多种氨基酸突变的氨基酸序列。在实施方案中,一种或多种氨基酸突变可独立地选自取代、插入、缺失和截短。
132.在实施方案中,氨基酸突变是氨基酸取代,并且可包括保守性取代和/或非保守性取代。可例如基于所涉及的氨基酸残基的极性、电荷、大小、溶解度、疏水性、亲水性和/或两亲性质的相似性来进行“保守性取代”。20种天然存在的氨基酸可分为以下六个标准氨基酸组:(1)疏水性:met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr、asn、gln;(3)酸性:asp、glu;(4)碱性:his、lys、arg;(5)影响链取向的残基:gly、pro;以及(6)芳香性:trp、tyr、phe。如本文所用,“保守性取代”定义为氨基酸被上面所示六个标准氨基酸组中的同一组中列出的另一种氨基酸交换。例如,asp被glu交换在这样修饰的多肽中保留一个负电荷。另外,基于甘氨酸和脯氨酸破坏α-螺旋的能力,它们可彼此取代。如本文所用,“非保守性取代”定义为氨基酸被上面所示六个标准氨基酸组(1)至(6)中的不同组中列出的另一种氨基酸交换。
133.在实施方案中,取代还可包括非经典氨基酸(例如,硒代半胱氨酸、吡咯赖氨酸、n-甲酰基甲硫氨酸β-丙氨酸、gaba和δ-氨基乙酰丙酸、4-氨基苯甲酸(paba)、常见氨基酸的d-异构体、2,4-二氨基丁酸、α-氨基异丁酸、4-氨基丁酸、abu、2-氨基丁酸、γ-abu、ε-ahx、6-氨基己酸、aib、2-氨基异丁酸、3-氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸,环己基丙氨酸、β-丙氨酸、氟代-氨基酸、设计者氨基酸如β-甲基氨基酸、cα-甲基氨基酸、nα-甲基氨基酸以及一般的氨基酸类似物)。
134.还可参考遗传密码(包括将密码子简并性考虑在内)来对异源嵌合蛋白的核苷酸序列进行突变。
135.在实施方案中,可用于本发明中的异源嵌合蛋白能够结合一种或多种人配体/受体。
136.在实施方案中,可用于本发明中的异源嵌合蛋白能够结合一种或多种鼠配体/受体。
137.在实施方案中,异源嵌合蛋白的每个细胞外结构域(或其变体)以约1nm至约5nm,例如约1nm、约1.5nm、约2nm、约2.5nm、约3nm、约3.5nm、约4nm、约4.5nm或约5nm的kd结合至其同源受体或配体。在实施方案中,嵌合蛋白以约5nm至约15nm,例如5nm、约5.5nm、约6nm、约6.5nm、约7nm、约7.5nm、约8nm、约8.5nm、约9nm、约9.5nm、约10nm、约10.5nm、约11nm、约11.5nm、约12nm、约12.5nm、约13nm、约13.5nm、约14nm、约14.5nm或约15nm的kd结合至同源受体或配体。
138.在实施方案中,异源嵌合蛋白的每个细胞外结构域(或其变体)以小于约1μm、约900nm、约800nm、约700nm、约600nm、约500nm、约400nm、约300nm、约200nm、约150nm、约130nm、约100nm、约90nm、约80nm、约70nm、约60nm、约55nm、约50nm、约45nm、约40nm、约35nm、约30nm、约25nm、约20nm、约15nm、约10nm、或约5nm、或约1nm的kd(例如,如通过表面等离子体共振或生物层干涉法所测量)结合至其同源受体或配体。在实施方案中,异源嵌合蛋白以小于约1nm、约900pm、约800pm、约700pm、约600pm、约500pm、约400pm、约300pm、约200pm、约100pm、约90pm、约80pm、约70pm、约60pm、约55pm、约50pm、约45pm、约40pm、约35pm、约30pm、约25pm、约20pm、约15pm、或约10pm、或约1pm的kd(例如,如通过表面等离子体共振或生物层干涉法所测量)结合至人csf1。
139.如本文所用,可用于本发明中的细胞外结构域的变体能够结合天然细胞外结构域的受体/配体。例如,变体可在细胞外结构域中包含一种或多种不影响其与其受体/配体的结合亲和力的突变;或者,细胞外结构域中的一种或多种突变可改善对受体/配体的结合亲和力;或者细胞外结构域中的一种或多种突变可降低对受体/配体的结合亲和力,但不完全消除结合。在实施方案中,一种或多种突变位于结合口袋外部,其中细胞外结构域与其受体/配体相互作用。在实施方案中,一种或多种突变位于结合口袋内部,其中细胞外结构域与其受体/配体相互作用,只要所述突变不完全消除结合即可。基于熟练技术人员的知识以及本领域中关于受体-配体结合的知识,他/她将知道哪些突变将允许结合以及哪些突变将消除结合。
140.在实施方案中,嵌合蛋白表现出增强的稳定性和蛋白半衰期。
141.可用于本发明中的异源嵌合蛋白可包含多于两个细胞外结构域。例如,嵌合蛋白可包含三个、四个、五个、六个、七个、八个、九个、十个或更多个细胞外结构域。如本文所公开的,第二细胞外结构域可经由接头与第三细胞外结构域分开。或者,第二细胞外结构域可直接连接(例如,经由肽键)至第三细胞外结构域。在实施方案中,异源嵌合蛋白包含直接连接的细胞外结构域和经由接头间接连接的细胞外结构域,如本文所公开。
142.接头
143.在实施方案中,可用于本发明中的异源嵌合蛋白包含接头。
144.在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基。至少一个半胱氨酸残基能够在一对(或更多)异源嵌合蛋白之间形成二硫键。不希望受理论束缚,这种二硫键的形成负责维持异源嵌合蛋白的有用的和/或必要的多聚体状态。这些允许功能性异源嵌合蛋白的有效产生(例如,不会形成无功能的蛋白质聚集体)和所需的体外和体内活性。
145.在可用于本发明中的异源嵌合蛋白中,接头是选自柔性氨基酸序列、igg铰链区或抗体序列的多肽。
146.在实施方案中,接头源自天然存在的多结构域蛋白,或者是例如,如chichili等人,(2013),protein sci.22(2):153-167;chen等人,(2013),adv drug deliv rev.65(10):1357-1369中所描述的经验接头,所述文献的全部内容特此以引用的方式并入。在实施方案中,接头可使用诸如以下文献中描述的那些的接头设计数据库和计算机程序来设计:chen等人,(2013),adv drug deliv rev.65(10):1357-1369和crasto等人,(2000),protein eng.13(5):309-312,所述文献的全部内容特此以引用的方式并入。
147.在实施方案中,接头包含多肽。在实施方案中,多肽小于约500个氨基酸长、约450个氨基酸长、约400个氨基酸长、约350个氨基酸长、约300个氨基酸长、约250个氨基酸长、约200个氨基酸长、约150个氨基酸长或约100个氨基酸长。例如,接头可小于约100、约95、约90、约85、约80、约75、约70、约65、约60、约55、约50、约45、约40、约35、约30、约25、约20、约19、约18、约17、约16、约15、约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3或约2个氨基酸长。
148.在实施方案中,接头是柔性的。
149.在实施方案中,接头是刚性的。
150.在实施方案中,接头基本上包含甘氨酸和丝氨酸残基(例如,约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约97%、或约98%、或约99%、或约100%的甘氨酸和丝氨酸)。
151.在实施方案中,接头包含抗体(例如,igg、iga、igd和ige,包括亚类(例如,igg1、igg2、igg3和igg4、以及iga1和iga2))的铰链区。在igg、iga、igd和ige类抗体中所见的铰链区充当柔性间隔区,由此允许fab部分在空间中自由移动。与恒定区相反,铰链结构域在结构上是多样的,在免疫球蛋白类和亚类中在序列和长度上都有所不同。例如,igg亚类中的铰链区的长度和柔性有所不同。igg1的铰链区包含氨基酸216-231,并且,由于它是自由灵活的,因此fab片段可以围绕其对称轴旋转并在以两个重链间二硫桥中的第一个为中心的球体内移动。igg2具有比igg1短的铰链,带有12个氨基酸残基和四个二硫桥。缺乏甘氨酸残基的igg2的铰链区相对较短,并且含有刚性的聚脯氨酸双螺旋,通过额外的重链间二硫桥而稳定。这些特性限制了igg2分子的柔性。igg3由于其独特的延长铰链区(约为igg1铰链的四倍长)而与其他亚类不同,所述独特的延长铰链区含有62个氨基酸(包含21个脯氨酸和11个半胱氨酸),形成了非柔性的聚脯氨酸双螺旋。在igg3中,fab片段是相对远离fc片段的,赋予了该分子以更大的柔性。igg3中的细长铰链还是其比其他亚类具有更高分子量的原因。igg4的铰链区比igg1的短,并且其柔性介于igg1与igg2的柔性之间。据报告,铰链区的柔性按以下顺序降低:igg3》igg1》igg4》igg2。在实施方案中,接头可源自人igg4并且含有一种或多种突变以增强二聚化(包括s228p)或fcrn结合。
152.根据晶体学研究,免疫球蛋白铰链区可在功能上进一步细分为三个区域:上铰链区、核心区和下铰链区。参见shin等人,1992immunological reviews 130:87。上铰链区包括从c
h1
的羧基末端至铰链中限制运动的第一残基(通常是在两个重链之间形成链间二硫键的第一半胱氨酸残基)的氨基酸。上铰链区的长度与抗体的区段柔性相关。核心铰链区含有重链间二硫键,并且下铰链区接合c
h2
结构域的氨基末端,并且包含c
h2
中的残基。同上。野生
型人igg1的核心铰链区含有序列cppc(seq id no:24),所述序列当通过二硫键形成而二聚化时产生环状八肽,所述环状八肽被认为充当枢轴,由此赋予柔性。在实施方案中,本发明的接头包含任何抗体(例如,igg、iga、igd和ige,包括亚类(例如,igg1、igg2、igg3和igg4以及iga1和iga2))的上铰链区、核心区和下铰链区中的一者、或两者或三者。铰链区还可含有一个或多个糖基化位点,所述一个或多个糖基化位点包括用于碳水化合物附着的许多结构上不同类型的位点。例如,iga1在铰链区的17个氨基酸的区段内含有五个糖基化位点,从而赋予铰链区多肽对肠蛋白酶的抗性,被认为是分泌性免疫球蛋白的有利性质。在实施方案中,可用于本发明中的接头包含一个或多个糖基化位点。
153.在实施方案中,接头包含抗体(例如,igg、iga、igd和ige,包括亚类(例如,igg1、igg2、igg3和igg4、以及iga1和iga2))的fc结构域。
154.在可用于本发明中的异源嵌合蛋白中,接头包含源自igg4的铰链-ch2-ch3 fc结构域。在实施方案中,接头包含源自人igg4的铰链-ch2-ch3 fc结构域。在实施方案中,接头包含与seq id no:1至seq id no:3中任一项的氨基酸序列至少95%同一,例如与seq id no:2的氨基酸序列至少95%同一的氨基酸序列。在实施方案中,接头包含一个或多个接合接头,此类接合接头独立地选自seq id no:4-50(或其变体)。在实施方案中,接头包含两个或更多个接合接头,每个接合接头独立地选自seq id no:4-50(或其变体);其中一个接合接头在铰链-ch2-ch3 fc结构域的n末端,并且另一个接合接头在铰链-ch2-ch3 fc结构域的c末端。
155.在实施方案中,接头包含源自人igg1抗体的铰链-ch2-ch3 fc结构域。在实施方案中,fc结构域对新生儿fc受体(fcrn)表现出增加的亲和力和增强的结合。在实施方案中,fc结构域包含一种或多种突变,所述一种或多种突变增加对fcrn的亲和力并增强与fcrn的结合。不希望受理论束缚,据信对fcrn的亲和力增加和与fcrn的结合增强增加了本发明异源嵌合蛋白的体内半衰期。
156.在实施方案中,接头中的fc结构域在氨基酸残基250、252、254、256、308、309、311、416、428、433或434(根据kabat编号,如,kabat,等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991),明确地以引用的方式并入本文)处含有一个或多个氨基酸取代,或其等效物。在实施方案中,在氨基酸残基250处的氨基酸取代是被谷氨酰胺取代。在实施方案中,在氨基酸残基252处的氨基酸取代是被酪氨酸、苯丙氨酸、色氨酸或苏氨酸取代。在实施方案中,在氨基酸残基254处的氨基酸取代是被苏氨酸取代。在实施方案中,在氨基酸残基256处的氨基酸取代是被丝氨酸、精氨酸、谷氨酰胺、谷氨酸、天冬氨酸或苏氨酸取代。在实施方案中,在氨基酸残基308处的氨基酸取代是被苏氨酸取代。在实施方案中,在氨基酸残基309处的氨基酸取代是被脯氨酸取代。在实施方案中,在氨基酸残基311处的氨基酸取代是被丝氨酸取代。在实施方案中,在氨基酸残基385处的氨基酸取代是被精氨酸、天冬氨酸、丝氨酸、苏氨酸、组氨酸、赖氨酸、丙氨酸或甘氨酸取代。在实施方案中,在氨基酸残基386处的氨基酸取代是被苏氨酸、脯氨酸、天冬氨酸、丝氨酸、赖氨酸、精氨酸、异亮氨酸或甲硫氨酸取代。在实施方案中,在氨基酸残基387处的氨基酸取代是被精氨酸、脯氨酸、组氨酸、丝氨酸、苏氨酸或丙氨酸取代。在实施方案中,在氨基酸残基389处的氨基酸取代是被脯氨酸、丝氨酸或天冬酰胺取代。在实施方案中,在氨基酸残基416处的氨基酸取代是被丝氨
酸取代。在实施方案中,在氨基酸残基428处的氨基酸取代是被亮氨酸取代。在实施方案中,在氨基酸残基433处的氨基酸取代是被精氨酸、丝氨酸、异亮氨酸、脯氨酸或谷氨酰胺取代。在实施方案中,在氨基酸残基434处的氨基酸取代是被组氨酸、苯丙氨酸或酪氨酸取代。
157.在实施方案中,fc结构域接头(例如,包含igg恒定区)包含一种或多种突变,如在氨基酸残基252、254、256、433、434或436(根据kabat编号,如kabat,等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991),明确地以引用的方式并入本文)处的取代。在实施方案中,igg恒定区包含三重m252y/s254t/t256e突变或yte突变。在实施方案中,igg恒定区包含三重h433k/n434f/y436h突变或kfh突变。在实施方案中,igg恒定区包含组合的yte和kfh突变。
158.在实施方案中,接头包含igg恒定区,所述igg恒定区在氨基酸残基250、253、307、310、380、428、433、434和435(根据kabat编号,如kabat,等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991),明确地以引用的方式并入本文)处含有一种或多种突变。示例性突变包括t250q、m428l、t307a、e380a、i253a、h310a、m428l、h433k、n434a、n434f、n434s和h435a。在实施方案中,igg恒定区包含m428l/n434s突变或ls突变。在实施方案中,igg恒定区包含t250q/m428l突变或ql突变。在实施方案中,igg恒定区包含n434a突变。在实施方案中,igg恒定区包含t307a/e380a/n434a突变或aaa突变。在实施方案中,igg恒定区包含i253a/h310a/h435a突变或ihh突变。在实施方案中,igg恒定区包含h433k/n434f突变。在实施方案中,igg恒定区包含组合的m252y/s254t/t256e和h433k/n434f突变。
159.igg恒定区中的另外示例性突变描述于例如robbie,等人,anti microbial agents and chemotherapy(2013),57(12):6147-6153;dall’acqua等人,jbc(2006),281(33):23514-24;dall’acqua等人,journa l of immunology(2002),169:5171-80;ko等人nature(2014)514:642-645;grevys等人journal of immunology.(2015),194(11):5497-508;以及美国专利号7,083,784中,所述文献的全部内容特此以引用的方式并入。
160.说明性的fc稳定化突变体是s228p。说明性的延长fc半衰期的突变体是t250q、m428l、v308t、l309p和q311s,并且本发明的接头可包含这些突变体中的1者、或2者、或3者、或4者、或5者。
161.在实施方案中,嵌合蛋白以高亲和力结合至fcrn。在实施方案中,嵌合蛋白可以约1nm至约80nm的kd结合至fcrn。例如,嵌合蛋白可以约1nm、约2nm、约3nm、约4nm、约5nm、约6nm、约7nm、约8nm、约9nm、约10nm、约15nm、约20nm、约25nm、约30nm、约35nm、约40nm、约45nm、约50nm、约55nm、约60nm、约65nm、约70nm、约71nm、约72nm、约73nm、约74nm、约75nm、约76nm、约77nm、约78nm、约79nm或约80nm的kd结合至fcrn。在实施方案中,嵌合蛋白可以约9nm的kd结合至fcrn。在实施方案中,嵌合蛋白基本上不结合至具有效应子功能的其他fc受体(即,不是fcrn)。
162.在实施方案中,接头中的fc结构域具有seq id no:1的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。在实施方案中,对seq id no:1进行突变以增加稳定性和/或半衰期。例如,在实施方案中,接头中的fc结构域包含seq id no:2的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、
或97%、或98%、或99%同一性。例如,在实施方案中,接头中的fc结构域包含seq id no:3的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。
163.此外,可采用一个或多个接合接头来连接接头中的fc结构域(例如,seq id no:1、seq id no:2、seq id no:3之一或与其至少90%、或93%、或95%、或97%、或98%、或99%同一性)和细胞外结构域。例如,seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9中的任一者或其变体可连接如本文所公开的细胞外结构域和如本文所公开的接头中的fc结构域。任选地,seq id no:4至50中的任一者或其变体位于如本文公开的细胞外结构域和如本文公开的fc结构域之间。
164.在实施方案中,本发明的异源嵌合蛋白可包含下文表1中公开的接合接头的变体。例如,接头可与seq id no:4至50中的任一者的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
165.在实施方案中,第一和第二接合接头可不同或它们可相同。
166.不希望受理论束缚,在异源嵌合蛋白中包括包含fc结构域的至少一部分的接头有助于避免形成不溶性和可能的非功能性蛋白多联体和/或聚集体。这部分是由于在fc结构域中存在半胱氨酸,所述半胱氨酸能够在异源嵌合蛋白之间形成二硫键。
167.在实施方案中,异源嵌合蛋白可包含如本文所公开的一个或多个接合接头,并且缺乏如本文所公开的fc结构域接头。
168.在实施方案中,第一和/或第二接合接头独立地选自seq id no:4至50的氨基酸序列,并且提供在下文表1中:
169.表1:说明性接头(fc结构域接头和接合接头)
170.171.[0172][0173]
在实施方案中,接合接头基本上包含甘氨酸和丝氨酸残基(例如,约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约97%、或约98%、或约99%、或约100%的甘氨酸和丝氨酸)。例如,在实施方案中,接合接头是(gly4ser)n,其中n是约1至约8,例如1、2、3、4、5、6、7或8(分别是seq id no:25至seq id no:32)。在实施方案中,接合接头序列是ggsggsggggsggggs(seq id no:33)。另外的说明性接合接头包括但不限于具有序列le,(eaaak)n(n=1-3)(seq id no:36至seq id no:38)、a(eaaak)na(n=2-5)(seq id no:39至se q id no:42)、a(eaaak)4alea(eaaak)4a(seq id no:43)、papap(seq id no:44)、kesgsvsseqlaqfrsld(seq id no:45)、gsagsaagsgef(seq id no:46)和(xp)n的接头,其中x表示任何氨基酸,例如ala、lys或glu。在实施方案中,接合接头是ggs。在实施方案中,接合接头具有序列(gly)n,其中n是1至100的任何数字,例如:(gly)8(seq id no:34)和(gly)6(seq id no:35)。
[0174]
在实施方案中,接合接头是gggse(seq id no:47)、gses g(seq id no:48)、gsegs(seq id no:49)、geggsgegssg egsssegggsegggsegggseggs(seq id no:50)和每4个氨基酸间隔随机放置g、s和e的接合接头中的一者或多者。
[0175]
第一接合接头、fc结构域接头和第二接合接头的组合在本文中称为“模块化接头”。在实施方案中,异源嵌合蛋白包含如表2中所示的模块化接头:
[0176]
表2:说明性模块化接头
[0177]
[0178]
[0179][0180]
在实施方案中,本发明的异源嵌合蛋白可包含以上表2中公开的模块化接头的变体。例如,接头可与seq id no:51至56中的任一者的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
[0181]
在实施方案中,接头可以是柔性的,包括但不限于高度柔性的。在实施方案中,接头可以是刚性的,包括但不限于刚性α螺旋。说明性接合接头的特征在下文表3中示出:
[0182]
表3:说明性接合接头的特征
[0183]
[0184][0185]
在实施方案中,接头可以是功能性的。例如但不限于,接头可起到提高折叠和/或稳定性、提高表达、改善药物动力学和/或改善本发明嵌合蛋白的生物活性的作用。在另一个实例中,接头可起到将异源嵌合蛋白靶向特定细胞类型或位置的作用。
[0186]
在实施方案中,异源嵌合蛋白仅包含一个接合接头。
[0187]
在实施方案中,异源嵌合蛋白缺乏接合接头。
[0188]
在实施方案中,接头是合成接头,如聚乙二醇(peg)。
[0189]
在实施方案中,异源嵌合蛋白具有在空间上能够结合其配体/受体的第一结构域和/或在空间上能够结合其配体/受体的第二结构域。因此,嵌合蛋白中存在足够的总体柔性和/或细胞外结构域(或其部分)与嵌合蛋白的剩余部分之间存在物理距离,以使得细胞外结构域的配体/受体结合结构域在空间上不受阻碍地结合其配体/受体。这种柔性和/或物理距离(其被称为“松弛”)通常可存在于一个或多个细胞外结构域中,通常存在于接头中,和/或通常存在于嵌合蛋白中(作为整体)。或者或另外地,可将氨基酸序列(例如)添加至一个或多个细胞外结构域和/或接头,以提供避免空间位阻所需的松弛。可添加提供松弛的任何氨基酸序列。在实施方案中,所添加的氨基酸序列包含序列(gly)n,其中n是1至100的任何数字。可添加氨基酸序列的另外实例包括表1和表3中所述的接合接头。在实施方案
中,可在细胞外结构域与接头之间添加聚乙二醇(peg)接头,以提供避免空间位阻所需的松弛。此类peg接头是本领域众所周知的。
[0190]
工程化的t细胞
[0191]
本文公开了一种表达嵌合抗原受体和异源嵌合蛋白的工程化的t细胞。嵌合抗原受体包含抗原结合结构域、跨膜结构域和细胞内结构域,所述细胞内结构域包含共刺激结构域和/或信号传导结构域。异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。图1示出本发明的工程化的t细胞。
[0192]
在实施方案中,异源嵌合蛋白的第一结构域基本上包含第一跨膜蛋白的整个细胞外结构域,和/或异源嵌合蛋白的第二结构域基本上包含第二跨膜蛋白的整个细胞外结构域。
[0193]
在实施方案中,第一结构域能够结合第一跨膜蛋白的配体/受体,并且第二结构域能够结合第二跨膜蛋白的配体/受体。
[0194]
在实施方案中,第一结构域在与其配体/受体结合时能够抑制免疫抑制信号,和/或第二结构域在与其配体/受体结合时能够激活免疫刺激信号。
[0195]
在实施方案中,第一跨膜蛋白的配体/受体由癌细胞表达,和/或第二跨膜蛋白的配体/受体由工程化的t细胞和/或由天然t细胞表达。
[0196]
在实施方案中,异源嵌合蛋白由工程化的t细胞分泌。在实施方案中,异源嵌合蛋白响应于由工程化的t细胞表达的嵌合抗原受体的激活而分泌。在一个实施方案中,嵌合抗原受体的激活刺激嵌合抗原受体相关启动子,如激活的t细胞的核因子(nfat)启动子。
[0197]
在实施方案中,嵌合抗原受体包含抗原结合结构域、跨膜结构域和细胞内结构域,所述细胞内结构域包含共刺激结构域和/或信号传导结构域。
[0198]
在实施方案中,嵌合抗原受体的抗原结合结构域能够结合由癌细胞表达的抗原,例如人癌细胞特异性抗原。
[0199]
在实施方案中,嵌合抗原受体的细胞内结构域包含共刺激结构域和信号传导结构域中的一者或两者。
[0200]
在实施方案中,异源嵌合蛋白和/或嵌合抗原受体能够增加cd4+和/或cd8+t细胞亚群或防止cd4+和/或cd8+t细胞亚群的减少。
[0201]
在实施方案中,异源嵌合蛋白增加癌细胞/肿瘤部位附近存在的非工程化的t细胞克隆的数量。
[0202]
当异源嵌合蛋白的第一结构域与由癌细胞表达的第一跨膜蛋白的配体/受体结合并且第二结构域与由工程化的t细胞表达的第二跨膜蛋白的配体/受体结合时,所述异源嵌合蛋白能够在所述癌细胞与所述工程化的t细胞之间形成稳定的突触;和/或当与由癌细胞表达的抗原结合时,嵌合抗原受体能够在所述癌细胞与所述工程化的t细胞之间形成稳定的突触。稳定的突触提供有利于工程化的t细胞的抗癌作用/肿瘤减少的空间取向。在实施方案中,空间取向定位工程化的t细胞以攻击癌细胞。在实施方案中,稳定的突触允许工程化的t细胞在癌细胞附近的增殖。在实施方案中,稳定的突触允许非工程化的天然t细胞在癌细胞/肿瘤部位附近的募集和增殖。在实施方案中,稳定的突触允许足够的信号传递以提
供刺激信号(例如,细胞因子)的表达和/或释放。
[0203]
在实施方案中,由本发明的工程化的t细胞表达和分泌的异源嵌合蛋白选自以下表4。
[0204]
表4:说明性异源嵌合蛋白
[0205][0206]
在实施方案中,由本发明的工程化的t细胞表达的嵌合抗原受体选自以下表5:
[0207]
表5:说明性嵌合抗原受体(car)t细胞靶标
[0208][0209]
在实施方案中,本文公开的工程化的t细胞表达和分泌来自表4的一种或多种异源嵌合蛋白并且表达来自表5的一种或多种嵌合抗原受体。在实施方案中,工程化的t细胞表达和分泌来自表4的一种异源嵌合蛋白并且表达来自表5的多于一种嵌合抗原受体。在实施方案中,工程化的t细胞表达和分泌来自表4的多于一种异源嵌合蛋白并且表达来自表5的一种嵌合抗原受体。在实施方案中,工程化的t细胞表达和分泌来自表4的多于一种异源嵌合蛋白并且表达来自表5的多于一种嵌合抗原受体。
[0210]
作为实例,工程化的t细胞表达并分泌pd-1-fc-ox40l异源嵌合蛋白和/或pd-1-fc-ox40l异源嵌合蛋白并且表达结合由癌细胞呈递的cd19的嵌合抗原受体,和/或工程化的t细胞表达并分泌csf1r-fc-cd40l异源嵌合蛋白并且表达结合由癌细胞呈递的cd19的嵌合抗原受体。
[0211]
本文公开的主题的工程化的t细胞可以是淋巴谱系的细胞。淋巴谱系(包括b细胞和t细胞)提供抗体的产生、细胞免疫系统的调控、血液中外来因子的检测、对于宿主外来的细胞的检测等。淋巴谱系的工程化的t细胞的非限制性实例包括t细胞、胚胎干细胞和多能干细胞(例如,可从其分化出淋巴样细胞的那些)。t细胞可以是在胸腺中成熟并且主要负责细胞介导的免疫的淋巴细胞。t细胞参与适应性免疫系统。本文公开的主题的t细胞可以是
任何类型的t细胞,包括但不限于t辅助细胞、细胞毒性t细胞、记忆t细胞(包括中枢记忆t细胞、干细胞样记忆t细胞(或干细胞样记忆t细胞)和两种类型的效应记忆t细胞:例如,t
em
细胞和t
emra
细胞、调控性t细胞(也称为抑制t细胞)、粘膜相关非变异t细胞和γδt细胞。细胞毒性t细胞(ctl或杀伤t细胞)是能够诱导受感染的体细胞或癌细胞死亡的t淋巴细胞的亚群。通过引入car,可对患者自身的t细胞进行遗传修饰以靶向特异性抗原。
[0212]
本发明的人淋巴细胞的类型包括但不限于经遗传修饰以表达ca r的外周供体淋巴细胞(sadelain,m.,等人2003nat rev cancer 3:35-45)、经遗传修饰以表达包含α和β异二聚体的全长抗原识别t细胞受体复合物的外周供体淋巴细胞(morgan,r.a.,等人2006science314:126-129)、源自肿瘤活检中的肿瘤浸润淋巴细胞(til)的淋巴细胞培养物(panelli,m.c.,等人2000j immunol 164:495-504;panelli,m.c.,等人2000j immunol 164:4382-4392)以及使用人工抗原呈递细胞(aapc)或脉冲树突细胞选择性地体外扩增的抗原特异性外周血白细胞(dupont,j.,等人2005cancer res 65:5417-5427;papanicola ou,g.a.,等人2003blood 102:2498-2505)。t细胞可以是自体的、同种异体的或在体外源自工程化的祖细胞或干细胞。
[0213]
在实施方案中,工程化的t细胞是cd4+t细胞或cd8+t细胞。
[0214]
在实施方案中,工程化的t细胞表达α/βt细胞受体。
[0215]
在实施方案中,工程化的t细胞表达γ/δt细胞受体。
[0216]
在实施方案中,工程化的t细胞源自同种异体t细胞、自体t细胞或肿瘤浸润淋巴细胞(til)。在实施方案中,工程化的t细胞是人细胞。
[0217]
在实施方案中,工程化的t细胞源自从受试者(例如需要抗癌疗法的受试者)获得的t细胞或t细胞祖细胞。在实施方案中,t细胞或t细胞祖细胞获自自体来源(例如,来自需要抗癌疗法的同一受试者)。在实施方案中,自体t细胞或t细胞祖细胞获自受试者并在体外培养和扩增。在实施方案中,将培养的和/或扩增的自体t细胞或t细胞祖细胞工程化以表达如本文公开的嵌合t细胞受体和/或异源嵌合蛋白。在实施方案中,将自体t细胞或t细胞祖细胞工程化以表达嵌合t细胞受体,和/或使用本文公开的方法分析异源嵌合蛋白。在实施方案中,将自体t细胞或t细胞祖细胞工程化以表达嵌合t细胞受体,和/或将异源嵌合蛋白任选地在体外培养和/或扩增,并施用于有需要的受试者。在实施方案中,将自体t细胞或t细胞祖细胞工程化以表达嵌合t细胞受体,和/或如本文所公开制造异源嵌合蛋白,任选地使用本文公开的方法进行分析,并施用于有需要的受试者。
[0218]
在实施方案中,t细胞或t细胞祖细胞从分离的人t细胞的同种异体来源获得,即tcr缺陷型t细胞,其可在患者需要之前并且廉价地制造。在实施方案中,t细胞或t细胞祖细胞获自同种异体来源,允许在单个位点产生单一治疗产品。在实施方案中,如本文所公开进行修饰的同种异体t细胞不表达功能性t细胞受体(tcr)。不受理论束缚,应当理解,一些或甚至全部tcr亚基/二聚体可在细胞表面上表达,但t细胞未表达足够的功能性tcr来在宿主中诱导不希望的反应。在其表面上没有功能性tcr的情况下,同种异体t细胞未能对宿主细胞产生不需要的免疫反应。在实施方案中,如本文公开进行修饰的tcr缺陷型同种异体t细胞未能引起移植物抗宿主病(gvhd),例如,因为它们不能识别宿主mhc分子。此外,这些tcr缺陷型t细胞可被工程化为同时表达功能性、非tcr、疾病特异性受体。
[0219]
如本领域技术人员众所周知的,多种方法可容易地用于从受试者分离同种异体t
细胞。例如,使用细胞表面标记表达或使用市售试剂盒(例如,来自pierce,rockford,ill.的isocell)。
[0220]
在实施方案中,同种异体t细胞或t细胞祖细胞获自受试者并在体外培养和扩增。在实施方案中,将培养的和/或扩增的同种异体t细胞或t细胞祖细胞工程化以表达如本文公开的嵌合t细胞受体和/或异源嵌合蛋白。在实施方案中,将同种异体t细胞或t细胞祖细胞工程化以表达嵌合t细胞受体,和/或使用本文公开的方法分析异源嵌合蛋白。在实施方案中,将同种异体t细胞或t细胞祖细胞工程化以表达嵌合t细胞受体,和/或将异源嵌合蛋白任选地在体外培养和/或扩增,并施用于有需要的受试者。在实施方案中,将同种异体t细胞或t细胞祖细胞工程化以表达嵌合t细胞受体,和/或如本文所公开制造异源嵌合蛋白,任选地使用本文公开的方法进行分析,并施用于有需要的受试者。
[0221]
制造工程化的t细胞的方法
[0222]
本发明的一个方面是用于制造工程化的t细胞的方法。所述方法包括以下步骤:(i)从受试者获得t细胞或t细胞祖细胞;(ii)用编码嵌合抗原受体并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染所述t细胞或t细胞祖细胞;(iii)用编码异源嵌合蛋白并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染所述t细胞或t细胞祖细胞。这方面的异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。在实施方案中,步骤(ii)在步骤(iii)之前。在实施方案中,步骤(iii)在步骤(ii)之前。在实施方案中,步骤(ii)和步骤(iii)是同时的。
[0223]
本发明的另一个方面是用于制造工程化的t细胞的另一种方法。所述方法包括以下步骤:(i)获得t细胞或t细胞祖细胞,所述t细胞或t细胞祖细胞已用编码嵌合抗原受体并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染;以及(ii)用编码异源嵌合蛋白并设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染步骤(i)的t细胞或t细胞祖细胞。在这方面,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。
[0224]
本发明的另一个方面是用于制造工程化的t细胞的另一种方法。所述方法包括以下步骤:(i)获得t细胞或t细胞祖细胞,所述t细胞或t细胞祖细胞已用编码异源嵌合蛋白并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染;以及(ii)用编码嵌合抗原受体并设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染步骤(i)的t细胞或t细胞祖细胞。在这方面,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。
[0225]
在另一个方面,本发明提供了用于制造工程化的t细胞的另一种方法。所述方法包括以下步骤:(i)获得t细胞或t细胞祖细胞,以及(ii)用编码嵌合抗原受体并被设为整合至所述t细胞或t细胞祖细胞的基因组中的dna分子转染步骤(i)的t细胞或t细胞祖细胞。在这
方面,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。在实施方案中,t细胞是t细胞祖细胞。在实施方案中,t细胞或t细胞祖细胞获自患者。在实施方案中,t细胞或t细胞祖细胞对癌抗原具有特异性。
[0226]
这些方面包括制造表达任何本文公开的嵌合抗原受体和任何本文公开的异源嵌合蛋白的工程化的t细胞。
[0227]
在实施方案中,嵌合抗原受体由引入工程化的t细胞基因组中的基因组安全港(gsr)中的核酸编码。在实施方案中,gsr是腺相关病毒位点1(aavs1);趋化因子(c-c基序)受体5(ccr5)基因;或rosa26基因座/rosa26基因座的人直向同源物。
[0228]
在实施方案中,嵌合抗原受体由引入到t细胞基因组中的内源性t细胞受体基因座中的核酸编码。
[0229]
任何靶向基因组编辑方法均可用于将编码嵌合抗原受体的核酸整合至工程化的t细胞基因组的选定基因座中。在实施方案中,嵌合抗原受体的表达由基因座内或附近的内源性启动子/增强子驱动。在实施方案中,嵌合抗原受体的表达由整合至基因座中的外源性启动子驱动。基于基因座内基因的表达水平和基因座内基因的基因表达时机选择嵌合抗原受体整合于其中的基因座。在细胞分化的不同阶段和有丝分裂原/细胞因子微环境下,表达水平和时机可有所不同,其是进行选择时要考虑的因素。
[0230]
在实施方案中,成簇规律间隔短回文重复序列(crispr)系统用于将编码嵌合抗原受体的核酸整合至工程化的t细胞的基因组的选定基因座中。使用crispr系统的方法在例如wo2014093661、wo2015123339和wo2015089354中进行了描述,其各自以引用的方式整体并入。
[0231]
在实施方案中,锌指核酸酶(zfn)用于将编码嵌合抗原受体的核酸整合至工程化的t细胞的基因组的选定基因座中。使用zfn系统的方法在例如wo2009146179、wo2008060510和cn102174576中进行了描述,其各自以引用的方式整体并入。
[0232]
在实施方案中,转录激活因子样效应物核酸酶(talen)系统用于将编码嵌合抗原受体的核酸整合至工程化的t细胞的基因组的选定基因座中。使用talen系统的方法在例如wo2014134412、wo2013163628和wo2014040370中进行了描述,其各自以引用的方式整体并入。
[0233]
用于递送基因组编辑剂的方法可根据需要而不同。在实施方案中,选定基因组编辑方法的组分作为一种或多种质粒中的dna构建体递送。在实施方案中,组分通过病毒载体递送。常见递送方法包括但不限于电穿孔、显微注射、基因枪、穿刺转染、静水压力、连续输注、超声处理、磁转染、腺相关病毒、病毒载体的包膜蛋白假型化、具有复制能力的载体顺式和反式作用元件、单纯疱疹病毒和化学媒介物(例如,寡核苷酸、脂质复合物、聚合物囊泡、聚合复合物、树枝状聚合物、无机纳米颗粒和细胞穿透肽)。
[0234]
修饰可在选定基因座内的任何地方进行,或者可在可影响整合的嵌合抗原受体的基因表达的任何地方进行。在实施方案中,在整合的嵌合抗原受体的转录起始位点上游引入修饰。在实施方案中,在嵌合抗原受体的转录起始位点与蛋白编码区之间引入修饰。在实施方案中,在嵌合抗原受体的蛋白编码区下游引入修饰。
[0235]
可使用包含编码本文公开的异源嵌合蛋白的核酸的表达载体,或者可将编码本文公开的异源嵌合蛋白的核酸稳定地整合在工程化的t细胞的基因组中。
[0236]
在实施方案中,编码三个片段(第一跨膜蛋白的细胞外结构域,然后是接头序列,然后是第二跨膜蛋白的细胞外结构域)的核酸至载体(质粒、病毒或其他载体)中。
[0237]
在实施方案中,编码异源嵌合蛋白或其补体的核酸与在哺乳动物细胞中起作用的表达控制区或其补体可操作地连接。
[0238]
在实施方案中,本发明设想使用能够瞬时响应于线索实现高水平表达的诱导型启动子。例如,当在癌细胞附近时,通过使转染的细胞暴露于适当的线索来诱导用嵌合蛋白的表达载体转化的细胞和/或具有编码嵌合蛋白的核酸的稳定整合并包含诱导型启动子的细胞瞬时产生高水平的所述剂。说明性诱导型表达控制区包括包含用线索(如小分子化合物)刺激的诱导型启动子的那些诱导型表达控制区。特定实例可见于例如美国专利号5,989,910、5,935,934、6,015,709和6,004,941中,所述专利各自以引用的方式整体并入本文。
[0239]
可促进/针对使用抗生素选择核酸(编码嵌合抗原受体和/或编码异源嵌合蛋白)的稳定整合。用于选择稳定整合的常用抗生素包括杀稻瘟菌素、g-418(也称为遗传霉素)、潮霉素、卡那霉素、新霉素、嘌呤霉素和博莱霉素(zeocin)。
[0240]
存在多种可用于将核酸引入到存活细胞中的技术。适于在体外将核酸转移至哺乳动物细胞中的技术包括使用脂质体、电穿孔、微注射、细胞融合、基于聚合物的系统、deae-葡聚糖、病毒转导、磷酸钙沉淀法等。对于体内基因转移,也可使用许多技术和试剂,包括脂质体;基于天然聚合物的载体,如壳聚糖和明胶;病毒载体也适合用于体内转导。在一些情况下,希望提供靶向剂,如对癌细胞表面膜蛋白具有特异性的抗体或配体。在采用脂质体的情况下,结合至与内吞作用相关的细胞表面膜蛋白的蛋白可用于靶向和/或促进摄取,例如对于特定细胞类型具有趋向性的衣壳蛋白或其片段、针对在循环中发生内化的蛋白的抗体、靶向细胞内定位并增强细胞内半衰期的蛋白。受体介导的内吞作用的技术例如由wu等人,j.biol.chem.262,4429-4432(1987);和wagner等人,proc.natl.acad.sci.usa 87,3410-3414(1990)描述。
[0241]
在实施方案中,可将编码嵌合抗原受体的核酸和/或编码异源嵌合蛋白的核酸包装至病毒载体中。已知许多适用于基因疗法的病毒载体(参见例如,lundstrom,trends biotechnol.,21:117-122,2003。在实施方案中,所选择的载体表现出高效的感染和稳定的整合以及表达(参见例如,cayouette等人,human gene therapy 8:423-430,1997;kido等人,current eye research 15:833-844,1996;bloomer等人,journal of virology 71:6641-6649,1997;naldini等人,science 272:263-267,1996;以及miyoshi等人,proc.natl.acad.sci.u.s.a.94:10319,1997)。可使用的其他病毒载体包括例如,腺病毒、慢病毒和腺相关病毒载体、痘苗病毒、牛乳头瘤病毒或疱疹病毒,如爱泼斯坦-巴尔病毒(还参见例如miller,human gene therapy 15-14,1990;friedman,science 244:1275-1281,1989;eglitis等人,biotechniques 6:608-614,1988;tolstoshev等人,current opinion in biotechnology 1:55-61,1990;sharp,the lancet 337:1277-1278,1991;cornetta等人,nucleic acid research and molecular biology 36:311-322,1987;anderson,science 226:401-409,1984;moen,blood cells 17:407-416,1991;miller等人,biotechnology 7:980-990,1989;legal la salle等人,science 259:988-990,1993;和
johnson,chest 107:77s-83s,1995的载体)。逆转录病毒载体得到了特别良好地开发,并且已在临床环境中使用(rosenberg等人,n.engl.j.med 323:370,1990;anderson等人,美国专利号5,399,346,其特此以引用的方式整体并入)。
[0242]
编码嵌合抗原受体的核酸和/或编码异源嵌合蛋白的核酸可在单个载体中、或在单个多顺反子表达盒中、在单个载体的多个表达盒中、或在多个载体中构建。产生多顺反子表达盒的元件的实例包括但不限于各种内部核糖体进入位点(ires,例如脊髓灰质炎病毒ires和脑心肌炎病毒ires)和2a肽(例如p2a、t2a、e2a和f2a肽)。逆转录病毒载体和适当的包装细胞系的组合也是合适的,其中衣壳蛋白将具有感染人细胞的功能。已知多种产生双嗜性病毒的细胞系,包括但不限于pa12(miller,等人(1985)mol.cell.biol.5:431-437);pa317(miller,等人(1986)mol.cell.biol.6:2895-2902);和crip(danos,等人(1988)proc.natl.acad.sci.usa 85:6460-6464)。非双嗜性颗粒也是合适的,例如用vsvg、rd114或galv包膜和本领域已知的任何其他假型化的颗粒。
[0243]
编码嵌合抗原受体的核酸和/或编码异源嵌合蛋白的核酸可离体转染至t细胞或t细胞祖细胞(例如,自体或异源原代细胞或其子代)中;之后,将现在工程化的t细胞(或其后代)注射到目标组织或全身注射/输注到患者体内。
[0244]
在实施方案中,制造方法还包括在选择性地增强表达嵌合抗原受体的细胞和/或表达异源嵌合蛋白的细胞的增殖的培养基中培养转染的t细胞或t细胞祖细胞(现在称为工程化的t细胞)的步骤。
[0245]
在实施方案中,方法还包括分离表达嵌合抗原受体和/或表达异源嵌合蛋白的工程化的t细胞的步骤。
[0246]
本发明还涉及通过本文公开的方法制造和/或通过本文公开的方法分离的工程化的t细胞。
[0247]
本发明的另一个方面是通过本文公开的方法获得的工程化的t细胞群体。
[0248]
工程化的t细胞群体
[0249]
本发明的方面提供包含本文公开的工程化的t细胞的细胞群体以及用于获得所述细胞群体的方法。
[0250]
方法包括获得通过本文公开的方法制造的工程化的t细胞并在增强所述工程化的t细胞的增殖的培养基中培养所述工程化的t细胞,从而获得工程化的t细胞群体。
[0251]
在实施方案中,群体包含表达嵌合抗原受体且表达异源嵌合蛋白的工程化的t细胞,并且还包含表达嵌合抗原受体但不表达异源嵌合蛋白的工程化的t细胞。
[0252]
在实施方案中,群体包含表达嵌合抗原受体且表达异源嵌合蛋白的工程化的t细胞,并且还包含表达异源嵌合蛋白但不表达嵌合抗原受体的工程化的t细胞。
[0253]
在实施方案中,群体包含表达嵌合抗原受体且表达异源嵌合蛋白的工程化的t细胞,并且还包含表达异源嵌合蛋白但不表达嵌合抗原受体的工程化的t细胞。
[0254]
在实施方案中,群体包含表达嵌合抗原受体且表达异源嵌合蛋白的工程化的t细胞,并且还包含不表达异源嵌合蛋白也不表达嵌合抗原受体的t细胞(例如,天然t细胞或t细胞祖细胞)。
[0255]
因此,群体可包含表达两种嵌合蛋白的工程化的t细胞和表达一种嵌合蛋白的另外的工程化的t细胞和/或不表达任一者嵌合蛋白的t细胞。
[0256]
工程化的t细胞的分析
[0257]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,(b)培养所述工程化的t细胞,(c)分离所述工程化的t细胞的培养上清液,任选地富集或部分纯化所述培养上清液,(d)使所述工程化的t细胞的培养上清液与第二细胞接触,以及(e)分析所述第二细胞对细胞因子或趋化因子的表达。在实施方案中,工程化的t细胞根据本文公开的实施方案中的任一个制造。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、bt la、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(kl rf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、sig lec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、ti git、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过检测和/或定量mrna(但不限于,例如使用逆转录酶聚合酶链反应)来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0258]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)从受试者获得t细胞或t细胞祖细胞;(ii)用编码嵌合抗原受体并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染所述t细胞或t细胞祖细胞;以及(iii)用编码异源嵌合蛋白并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染所述t细胞或t细胞祖细胞。这方面的异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接所述第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域;(b)培养所述工程化的t细胞;(c)分离所述工程化的t细胞的培养上清液,任选地富集或部分纯化所述培养上清液;(d)使所述工程化的t细胞的培养上清液与第二细胞接触;以及(e)分析所述第二细胞对细胞因子或趋化因子的表达。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,所述细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测
和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。在实施方案中,步骤(ii)在步骤(iii)之前。在实施方案中,步骤(iii)在步骤(ii)之前。在实施方案中,步骤(ii)和步骤(iii)是同时的。
[0259]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)获得t细胞或t细胞祖细胞,所述t细胞或t细胞祖细胞已用编码嵌合抗原受体并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染;以及(ii)用编码异源嵌合蛋白并设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染步骤(i)的t细胞或t细胞祖细胞,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接所述第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域;(b)培养所述工程化的t细胞;(c)分离所述工程化的t细胞的培养上清液,任选地富集或部分纯化所述培养上清液;(d)使所述工程化的t细胞的培养上清液与第二细胞接触;以及(e)分析所述第二细胞对细胞因子或趋化因子的表达。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0260]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)获得t细胞或t细胞祖细胞,所述t细胞或t细胞祖细胞已用编码异源嵌合蛋白并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染;以及(ii)用编码嵌合抗原受体并设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染步骤(i)的t细胞或t细胞祖细胞,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接所述第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域;(b)培养所述工程化的t细胞;(c)分离所述工程化的t细胞的培养上清液,任选地富集或部分纯化所述培养上清液;(d)使所述工程化的t细胞的培养上清液与第二细胞接触;以及(e)分析所述第二细胞对细胞因子或趋化因子的表达。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、
kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0261]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)获得t细胞或t细胞祖细胞,以及(ii)用编码嵌合抗原受体并被设为整合至所述t细胞或t细胞祖细胞的基因组中的dna分子转染步骤(i)的t细胞或t细胞祖细胞,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。在实施方案中,t细胞是t细胞祖细胞。在实施方案中,t细胞或t细胞祖细胞获自患者。在实施方案中,t细胞或t细胞祖细胞对癌抗原具有特异性;(b)培养所述工程化的t细胞,(c)分离所述工程化的t细胞的培养上清液,任选地富集或部分纯化所述培养上清液,(d)使所述工程化的t细胞的培养上清液与第二细胞接触,以及(e)分析所述第二细胞对细胞因子或趋化因子的表达。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0262]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造工程化的t细胞,(b)将所述工程化的t细胞与第二细胞共培养,以及(c)分析所述第二细胞对细胞因子的表达。在实施方案中,工程化的t细胞根据本文公开的实施方案中的任一个制造。在实施方案中,第二细胞表达选自2b4、4-1bb、ac vr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btn l3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icos l、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、
slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0263]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)从受试者获得t细胞或t细胞祖细胞;(ii)用编码嵌合抗原受体并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染所述t细胞或t细胞祖细胞;(iii)用编码异源嵌合蛋白并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染所述t细胞或t细胞祖细胞。这方面的异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域;(b)将所述工程化的t细胞与第二细胞共培养;以及(c)分析所述第二细胞对细胞因子的表达。在实施方案中,工程化的t细胞根据本文公开的实施方案中的任一个制造。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,所述细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。在实施方案中,步骤(ii)在步骤(iii)之前。在实施方案中,步骤(iii)在步骤(ii)之前。在实施方案中,步骤(ii)和步骤(iii)是同时的。
[0264]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)获得t细胞或t细胞祖细胞,所述t细胞或t细胞祖细胞已用编码嵌合抗原受体并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染;以及(ii)用编码异源嵌合蛋白并设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染步骤(i)的t细胞或t细胞祖细胞,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域;(b)将所述工程化的t细胞与第二细胞共培养;以及(c)分析所述第二细胞对细胞因子的表达。在实施方案中,工程化的t细胞根据本文公开的实施方案中的任一个制造。在实施方案中,第二细胞表达选自2b4、4-1bb、
acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,所述细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0265]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)获得t细胞或t细胞祖细胞,所述t细胞或t细胞祖细胞已用编码异源嵌合蛋白并被设计为整合至所述t细胞或t细胞祖细胞的基因组中的第一dna分子转染;以及(ii)用编码嵌合抗原受体并设计为整合至所述t细胞或t细胞祖细胞的基因组中的第二dna分子转染步骤(i)的t细胞或t细胞祖细胞,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域;(b)将所述工程化的t细胞与第二细胞共培养;以及(c)分析所述第二细胞对细胞因子的表达。在实施方案中,工程化的t细胞根据本文公开的实施方案中的任一个制造。在实施方案中,所述第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,所述细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0266]
在另一个方面,本发明提供了一种分析工程化的t细胞的方法。所述方法包括以下步骤:(a)制造所述工程化的t细胞,其中所述制造包括以下步骤:(i)获得t细胞或t细胞祖细胞,以及(ii)用编码嵌合抗原受体并被设为整合至所述t细胞或t细胞祖细胞的基因组中的dna分子转染步骤(i)的t细胞或t细胞祖细胞,所述异源嵌合蛋白包含通用结构:n末端-(a)-(b)-(c)-c末端,其中(a)是包含第一跨膜蛋白的细胞外结构域的第一结构域,(b)是连
接第一结构域和第二结构域的接头结构域,并且(c)是包含第二跨膜蛋白的细胞外结构域的第二结构域。在实施方案中,t细胞是t细胞祖细胞。在实施方案中,t细胞或t细胞祖细胞获自患者。在实施方案中,t细胞或t细胞祖细胞对癌抗原具有特异性;(b)将所述工程化的t细胞与第二细胞共培养,以及(c)分析所述第二细胞对细胞因子的表达。在实施方案中,工程化的t细胞根据本文公开的实施方案中的任一个制造。在实施方案中,第二细胞表达选自2b4、4-1bb、acvr1b、acvr2a、acvr2b、axl、b7-h3、bcma、btla、btnl3、btnl8、btnl3a1、btnl3a2、cd2、cd27、cd30、cd31、cd31、cd40、cd48(slamf2)、cd58(lfa3)、cd137、cd160、cd200、cd226(ptaudnami)、cd244、cd247、csf1r(cd115)、ctla-4、dcr3、fas、fgfr3、fn14、gitr、hvem、icos、icosl、kir2dl1、kir2dl2、kir2dl3、kir3dl1、kirdl2、lag-3、lap、layn、ltbr、nkg2a、nkp46(ncr1)、nkp80(klrf1)、ntb-a、ox40、pd-1、pd-l1、pd-l2、pvr、rank、siglec7、siglec9、sirpα(cd172a)、slamf6、taci、tgfbr2、tigit、tim-3、tmigd2、tnfr1、tnfr2、tnfrsf25、tnfrsf4、trail-r、vista或vsig8的跨膜蛋白的受体。在实施方案中,细胞因子选自ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过mrna的检测和/或定量来分析表达。在实施方案中,通过蛋白质的检测和/或定量来分析表达。
[0267]
在实施方案中,通过检测和/或定量mrna(但不限于,例如使用逆转录酶聚合酶链反应)来分析表达。在实施方案中,通过蛋白质的检测和/或定量(但不限于,例如使用elisa)分析表达。
[0268]
药物组合物
[0269]
如本文所公开的工程化的t细胞群体(例如,包含表达两种嵌合蛋白的工程化的t细胞,并且任选地包含表达一种嵌合蛋白的另外的工程化的t细胞和/或不表达任一嵌合蛋白的t细胞)可用于制备药物组合物。
[0270]
本发明的方面包括包含本文公开的工程化的t细胞和药学上可接受的赋形剂的药物组合物。
[0271]
另一个方面是一种包含本文公开的工程化的t细胞群体和药学上可接受的赋形剂的药物组合物。
[0272]
在实施方案中,药物组合物中的至少一种工程化的t细胞是同种异体的。
[0273]
在实施方案中,药物组合物中的至少一种工程化的t细胞是自体的。
[0274]
在实施方案中,药物组合物中的至少一种工程化的t细胞是同种异体的,并且药物组合物中的至少一种工程化的t细胞是自体的。
[0275]
包含本文所述的工程化的t细胞群体的任何药物组合物可补充有任何本文所述的异源嵌合蛋白。补充的异源嵌合蛋白可以是由工程化的t细胞表达和分泌的相同异源嵌合蛋白,和/或补充的异源嵌合蛋白可不同于由工程化的t细胞表达和分泌的异源嵌合蛋白。
[0276]
药物组合物包含适合量的药学上可接受的赋形剂以便提供用于适当施用的形式。在实施方案中,当施用给受试者时,药学上可接受的赋形剂是无菌的。当静脉内施用本文所公开的组合物时,水是有用的赋形剂。盐溶液和葡萄糖水溶液以及甘油溶液也可用作液体赋形剂,特别是对于可注射的溶液。适合的药物赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明
胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙烯、乙二醇、水、乙醇等。任何药物组合物还可包含少量的润湿剂或乳化剂或ph缓冲剂。在实施方案中,药物组合物可包含盐水缓冲液(包括但不限于tbs、pbs等)。合适的药物赋形剂的实例描述于remington’s pha rmaceutical sciences 1447-1676(alfonso r.gennaro编著,第19版1995)中,所述文献以引用的方式并入本文。
[0277]
在实施方案中,任何本文公开的工程化的t细胞或包含工程化的t细胞的组合物根据常规程序配制为适合于本文所公开的施用模式的药物组合物。
[0278]
治疗方法
[0279]
本发明的一个方面是用于治疗有需要的受试者的癌症的方法。所述方法包括向所述受试者施用治疗有效量的本文公开的药物组合物。
[0280]
在实施方案中,药物组合物中的至少一种工程化的t细胞是同种异体的。
[0281]
在实施方案中,药物组合物中的至少一种工程化的t细胞是自体的。
[0282]
在实施方案中,药物组合物中的至少一种工程化的t细胞是自体的,并且药物组合物中的至少一种工程化的t细胞是同种异体的。
[0283]
在实施方案中,药物组合物诱导选自以下的细胞因子的表达:ifnγ、tnfα、il-2、il-4、il-5、il-6、il-7、il-9、il-10、il-12、il-13、il-15、il-21、il-17a、il-17f、il-22、cxcl8、il-1α/il-1f1、il-1β/il-1f2、lap(tgf-β1)、淋巴毒素-α/tnf-β、tgf-β、tnf-α、trance/tnfsf11/rank l或其任何两者或更多者的组合。在实施方案中,通过检测和/或定量mrna(但不限于,例如使用逆转录酶聚合酶链反应)来分析表达。在实施方案中,通过蛋白质的检测和/或定量(但不限于,例如使用elisa)分析表达。
[0284]
在实施方案中,方法治疗选自以下的癌症:结肠癌、直肠癌、肾细胞癌、肝癌、非小细胞肺癌、小肠癌、食道癌、黑素瘤、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内恶性黑素瘤、子宫癌、卵巢癌、直肠癌、肛区癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、内分泌系统癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、膀胱癌、肾或输尿管癌、肾盂癌、中枢神经系统肿瘤(cns)、原发性cns淋巴瘤、肿瘤血管生成、脊轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波济氏肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱导的癌症、所述癌症的组合以及所述癌症的转移性病灶或它们的组合。
[0285]
在实施方案中,癌症是选自由以下组成的组的血液癌症:慢性淋巴细胞性白血病(cll)、急性白血病、急性淋巴细胞白血病(all)、b细胞急性淋巴细胞白血病(b-all)、t细胞急性淋巴细胞白血病(t-all)、慢性髓细胞性白血病(cml)、b细胞幼淋巴细胞性白血病、母细胞性浆细胞样树突细胞肿瘤、伯基特氏淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、毛细胞白血病、小细胞或大细胞滤泡性淋巴瘤、恶性淋巴组织增生病状、malt淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、多发性骨髓瘤、骨髓增生异常和骨髓增生异常综合征、非霍奇金淋巴瘤、霍奇金淋巴瘤、浆母细胞性淋巴瘤、浆细胞样树突细胞肿瘤、瓦尔登斯特伦巨球蛋白血症和白血病前期或它们的组合。
[0286]
在实施方案中,方法还包括施用包含任何本文公开的异源嵌合蛋白的药物组合物。异源嵌合蛋白可以是由工程化的t细胞表达和分泌的相同异源嵌合蛋白,和/或异源嵌合蛋白可不同于由工程化的t细胞表达和分泌的异源嵌合蛋白。在实施方案中,在向受试者
施用包含工程化的t细胞群体的药物组合物之前,向所述受试者施用包含异源嵌合蛋白的药物组合物;在向受试者施用包含工程化的t细胞群体的药物组合物之后,向所述受试者施用包含异源嵌合蛋白的药物组合物;或者与施用包含工程化的t细胞群体的药物组合物同时向受试者施用包含异源嵌合蛋白的药物组合物。在实施方案中,包含异源嵌合蛋白的药物组合物的剂量小于施用至尚未或将不会施用包含工程化的t细胞群体的药物组合物的受试者的剂量。
[0287]
在实施方案中,方法还包括向受试者施用治疗有效量的免疫抑制药物,例如,免疫抑制药物减轻或预防细胞因子释放综合征。在实施方案中,免疫抑制药物是针对白细胞介素-6受体(il-6r)的抗体,例如托珠单抗。在实施方案中,免疫抑制药物在包含工程化的t细胞群体的药物组合物之前施用;免疫抑制药物在包含工程化的t细胞群体的药物组合物之后施用;或者免疫抑制药物与包含工程化的t细胞群体的药物组合物同时施用。
[0288]
在实施方案中,本文公开的药物组合物可通过局部注射或局部输注;通过静脉内注射或静脉内输注;通过动脉内注射或动脉内输注;或通过淋巴管内注射或淋巴管内输注施用。
[0289]
在实施方案中,局部注射或局部输注是直接至肿瘤,即,肿瘤内注射。
[0290]
在实施方案中,局部注射或局部输注是直接至免疫系统的器官,例如骨髓、胸腺、脾、腺样体、扁桃体、淋巴结、皮肤和肝脏。
[0291]
所施用的药物组合物中工程化的t细胞的数量,即工程化的t细胞的剂量可取决于若干因素,包括疾患的严重程度、是要治疗还是预防疾患以及待治疗受试者的年龄、体重和健康。另外,关于特定受试者的药物基因组学(基因型对治疗剂的药物动力学、药效学或功效分布的影响)信息可影响所用剂量。此外,可根据多种因素稍微调整精确的单个剂量,所述因素包括所施用的特定药物组合物、施用时间、施用途径、制剂的性质、所治疗的特定疾病、病症的严重程度以及病症的解剖学位置。可预期一些剂量的变化。
[0292]
本发明的方面还包括本文公开的工程化的t细胞在制造药物例如用于治疗癌症的药物中的用途。
[0293]
本文公开的任何方面或实施方案可与本文公开的任何其他方面或实施方案组合。
[0294]
本发明将在以下实施例中进一步描述,所述实施例不限制权利要求书中描述的本发明的范围。
[0295]
实施例
[0296]
提供本文的实施例以说明本技术的优点和益处并进一步帮助本领域普通技术人员制备或使用本技术的嵌合蛋白。还提供了本文中的实施例以更全面地说明本技术的优选方面。实施例决不应被解释为限制本公开的范围,其如所附权利要求书所定义。实施例可包括或结合上述本技术的任何变型、方面或实施方案。上述变型、方面或实施方案还可进一步各自包括或结合本技术的任何或所有其他变型、方面或实施方案的变型。
[0297]
实施例1.说明性的工程化的t细胞的构建和表征
[0298]
在此实施例的实验中,产生了编码pcdna3.4-pd-1-fc-ox40l或pcdna3.4-csf1r-fc-cd40l的单独质粒。然后用pcdna3.4-pd-1-fc-ox40l质粒dna或pcdna3.4-csf1r-fc-cd40l质粒dna分别转染jurkat t细胞。然后在施加抗生素选择(g418)之前将jurkat t细胞孵育48小时,以在两周时间段内选择稳定转染的细胞。稳定库的单细胞克隆使得能够选择
高异源嵌合蛋白分泌克隆来计算嵌合蛋白生产水平(pg/细胞)。
[0299]
在两周选择期后出现每种构建体的g418抗性稳定库后,允许工程化的t细胞达到高密度,然后收获、浓缩工程化的t细胞培养基并通过标准elisa方法测试分泌的pd-1-fc-ox40l(图3)或分泌的csf1r-fc-cd40l(图4)的存在。浓缩的jurkat亲本细胞培养基用作阴性对照。
[0300]
为了检测来自细胞培养基中的工程化的t细胞的pd-1-fc-ox40l或csf1r-fc-cd40l的分泌,双重结合elisa方法证实了分泌的异源嵌合蛋白的功能。elisa方法包括使用通用异源嵌合蛋白特异性抗fc抗体捕获异源嵌合蛋白,并使用生物素化的抗人ox40l(在pd-1-fc-ox40l的情况下)或生物素化的抗cd40l抗体(在csf1r-fc-cd40l的情况下)检测异源嵌合蛋白。如图3和图4所示,工程化的t细胞分泌高水平的pd-1-fc-ox40l和csf1r-fc-cd40l。
[0301]
实施例2.由t细胞克隆分泌的嵌合蛋白同时结合两种配体的能力
[0302]
此实验的目的是了解由本文公开的t细胞克隆分泌的异源嵌合蛋白中存在的i型细胞外结构域(ecd)和ii型ecd是否能够同时结合配体。为此,使用meso scale discovery(msd)平台进行双重结合测定。
[0303]
浓缩的、脱盐的培养上清液如下制备:将4000万个jurkat亲本细胞、表达人pd-1-fc-4-1bbl嵌合蛋白的jurkat细胞(jurkat/hpd-1-fc-4-1bbl)、表达人pd-1-fc-ox40l嵌合蛋白的jurkat细胞(jurkat/hpd-1-fc-ox40l)或表达人csf1r-fc-cd40l嵌合蛋白的jurkat细胞(jurkat/hcsf1r-fc-cd40l)在60ml培养基中培养48小时。此后,收获培养基并使用amicon-15 50k柱浓缩50-75
×
。将浓缩的上清液在zeba脱盐柱上脱盐或直接在pbs中透析并用于实验中。所得上清液也称为“纯”上清液。
[0304]
pd-1-fc-4-1bbl嵌合蛋白在n末端处或附近具有pd-1蛋白结构域的细胞外结构域,并且在c末端或附近具有4-1bb配体(4-1bbl)蛋白结构域的细胞外结构域。为了了解pd-1和4-1bbl是否能够同时结合至相应的抗体,将抗人pd-1抗体包被在板上。将jurkat亲本细胞或jurkat/hpd-1-fc-4-1bbl细胞的三倍连续稀释纯培养上清液添加至板中。作为阳性对照,添加了0、0.0137、0.041、0.12、0.37、1.11、3.33和10μg/ml的纯化pd-1-fc-4-1bbl嵌合蛋白。对板进行孵育以允许板结合的抗人pd-1抗体捕获任何蛋白。为了检测板结合的抗人pd-1抗体对pd-1-fc-4-1bbl嵌合蛋白的捕获,添加了抗人4-1bbl抗体。此测定中信号的产生取决于pd-1-fc-4-1bbl嵌合蛋白对抗人pd-1和抗人4-1bbl抗体的桥接。使用msd平台检测结合。如图5a所示,jurkat亲本细胞的纯培养上清液仅显示背景信号。相比之下,jurkat/hpd-1-fc-4-1bbl细胞的培养上清液产生了剂量依赖性信号,从而表明jurkat/hpd-1-fc-4-1bbl细胞产生了hpd-1-fc-4-1bbl嵌合蛋白,所述嵌合蛋白能够同时结合抗人pd-1和抗人4-1bbl抗体(图5a)。纯化的hpd-1-fc-4-1bbl嵌合蛋白产生了剂量依赖性且饱和的信号。将由纯化的hpd-1-fc-4-1bbl嵌合蛋白产生的信号与由jurkat/hpd-1-fc-4-1bbl细胞的培养上清液产生的信号进行比较表明纯培养上清液含有与0.0137μg/ml的纯化pd-1-fc-4-1bbl嵌合蛋白相当的量的蛋白(图5a)。
[0305]
pd-1-fc-ox40l嵌合蛋白在n末端处或附近具有pd-1蛋白结构域的细胞外结构域,并且在c末端或附近具有ox40配体(ox40l)蛋白结构域的细胞外结构域。为了了解pd-1和ox40l的细胞外结构域是否能够同时结合至相应的抗体,将抗人pd-1抗体包被在板上。将
k1/hpd-l1细胞。将cho-k1/hpd-l1细胞和亲本cho-k1细胞与抗pd-l1抗体一起孵育。使用流式细胞术检测结合。如图6b所示,抗pd-l1抗体染色了cho-k1/hpd-l1细胞,但不染色亲本cho-k1细胞。这些数据表明稳定表达人pd-l1的细胞系的成功构建。
[0312]
构建了稳定表达人ox40的cho-k1亲本细胞。ox40阳性克隆的细胞被称为cho-k1/hox40细胞。将cho-k1/hox40细胞和亲本cho-k1细胞与抗ox40抗体一起孵育。使用流式细胞术检测结合。如图6c所示,抗ox40抗体染色了cho-k1/hox40细胞,但不染色亲本cho-k1细胞。这些数据表明稳定表达人ox40的细胞系的成功构建。
[0313]
构建了稳定表达人4-1bb的ht1080亲本细胞。4-1bb阳性克隆的细胞被称为ht1080/h4-1bb细胞。将ht1080/h4-1bb细胞和亲本ht1080细胞与抗4-1bb抗体一起孵育。使用流式细胞术检测结合。如图7a所示,抗4-1bb抗体染色了ht1080/h4-1bb细胞,但不染色亲本ht1080细胞。这些数据表明稳定表达人4-1bb的细胞系的成功构建。ht1080以中等水平表达其他tnf受体(例如hox40)。为了证实这一点,将ht1080/h4-1bb细胞和亲本ht1080细胞与抗ox40抗体一起孵育。使用流式细胞术检测结合。如图7b所示,抗ox40抗体染色了亲本ht1080细胞和ht1080/h4-1bb细胞两者。
[0314]
实施例4.由本文公开的t细胞克隆分泌的嵌合蛋白与表达细胞外结构域的配体的细胞的结合
[0315]
此实验的目的是评估由本文公开的t细胞克隆分泌的嵌合蛋白中存在的两个ecd与其相应同源配体的结合。为此目的,分别定量与表达每个ecd的配体的细胞的结合程度。
[0316]
在一项实验中,将ht1080/h4-1bb细胞与递增量的如实施例2中所述产生的jurkat亲本细胞或jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液一起孵育。使用流式细胞术检测结合并计算平均荧光强度(mfi),并将其绘制为jurkat亲本细胞或jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液的量的函数。如图8a所示,jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液显示出与ht1080/h4-1bb细胞的剂量依赖性结合。相比之下,jurkat亲本细胞的纯培养上清液仅显示背景信号(图8a)。此外,将cho-k1/hpd-l1细胞与递增量的如实施例2中所述产生的jurkat亲本细胞或jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液一起孵育。使用流式细胞术检测结合并计算mfi,并将其绘制为jurkat亲本细胞或jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液的量的函数。如图8b所示,jurkat/hpd-1-fc-4-1bbl细胞的纯培养上清液显示出与cho-k1/hpd-l1细胞的剂量依赖性结合。相比之下,jurkat亲本细胞的纯培养上清液仅显示背景信号(图8b)。这些数据表明jurkat/hpd-1-fc-4-1bbl细胞产生了hpd-1-fc-4-1bbl异源嵌合蛋白,所述异源嵌合蛋白能够特异性地结合至表达人4-1bb(其是4-1bbl的同源配体)的细胞以及表达人pd-l1(其是pd-1的同源配体)的细胞。
[0317]
在另一个实验中,将cho-k1/hpd-l1细胞与递增量的如实施例2中所述产生的jurkat亲本细胞或jurkat/hpd-1-fc-ox40l细胞的纯培养上清液一起孵育。使用流式细胞术检测结合并计算mfi,并将其绘制为jurkat亲本细胞或jurkat/hpd-1-fc-ox40l细胞的纯培养上清液的量的函数。如图9a所示,jurkat/hpd-1-fc-ox40l细胞的纯培养上清液显示出与cho-k1/hpd-l1细胞的剂量依赖性结合。相比之下,jurkat亲本细胞的纯培养上清液仅显示背景信号(图9a)。此外,将cho-k1/hox40细胞与递增量的如实施例2中所述产生的jurkat亲本细胞或jurkat/hpd-1-fc-ox40l细胞的纯培养上清液一起孵育。使用流式细胞术检测结合并计算mfi,并将其绘制为jurkat亲本细胞或jurkat/hpd-1-fc-ox40l细胞的纯培养上
清液的量的函数。如图9b所示,jurkat/hpd-1-fc-ox40l细胞的纯培养上清液显示出与ch o-k1/hox40细胞的剂量依赖性结合。相比之下,jurkat亲本细胞的纯培养上清液仅显示背景信号(图9b)。这些数据表明cho-k1/hox40细胞产生了hpd-1-fc-ox40l异源嵌合蛋白,所述异源嵌合蛋白能够特异性地结合至表达人ox40(其是ox40l的同源配体)的细胞以及表达人pd-l1(其是pd-1的同源配体)的细胞。
[0318]
在另一个实验中,将cho-k1/hcd40细胞与递增量的如实施例2中所述产生的jurkat亲本细胞或jurkat/hcsf1r-fc-cd40l细胞的纯培养上清液一起孵育。使用流式细胞术检测结合并计算mfi,并将其绘制为jurkat亲本细胞或jurkat/hcsf1r-fc-cd40l细胞的纯培养上清液的量的函数。如图10a所示,jurkat/hcsf1r-fc-cd40l细胞的纯培养上清液显示出与cho-k1/hcd40细胞的剂量依赖性结合。相比之下,jurkat亲本细胞的纯培养上清液仅显示背景信号(图10a)。
[0319]
为了检测由jurkat/hcsf1r-fc-cd40l细胞产生的嵌合蛋白与人csf1(其是一种可溶性蛋白)的结合,使用了msd平台。简言之,将重组人csf1蛋白包被在msd板上。添加递增量的如实施例2中所述产生的jurkat亲本细胞或jurkat/hcsf1r-fc-cd40l细胞的纯培养上清液。将板孵育以允许板结合的csf1捕获任何csf-1结合蛋白。为了检测板结合的csf1对hcsf1r-fc-cd40l嵌合蛋白的捕获,添加了抗人cd40l-生物素抗体。添加msd链霉亲和素试剂用于检测。msd信号被绘制为jurkat亲本细胞或jurkat/hcsf1r-fc-cd40l细胞的纯培养上清液的量的函数。如图10b所示,jurkat/hcsf1r-fc-cd40l细胞的纯培养上清液显示出与人csf1的剂量依赖性结合。相比之下,jurkat亲本细胞的纯培养上清液仅显示背景信号(图10b)。纯化的hcsf1r-fc-cd40l嵌合蛋白产生了剂量依赖性且饱和的信号。将由纯化的hcsf1r-fc-cd40l嵌合蛋白产生的信号与由jurkat/hcsf1r-fc-cd40l细胞的培养上清液产生的信号进行比较表明纯培养上清液含有与0.37μg/ml的纯化csf1r-fc-cd40l嵌合蛋白相当的量的蛋白质(图5c)。
[0320]
这些数据表明jurkat/hcsf1r-fc-cd40l细胞产生了hcsf1r-fc-cd40l异源嵌合蛋白,所述异源嵌合蛋白能够特异性地结合至表达人cd40(其是cd40l的同源配体)的细胞和板结合的人csf1(其是csf1r的同源配体)。
[0321]
总的来说,这些数据证明本文公开的t细胞表达且分泌了功能活性嵌合蛋白,所述嵌合蛋白能够结合至表达两种类型的同源配体的细胞。因此,当两种配体由两种细胞类型表达时,嵌合蛋白将桥接两种细胞类型(例如癌细胞和免疫细胞)。
[0322]
实施例5.由本文公开的t细胞克隆分泌的嵌合蛋白对细胞因子的诱导
[0323]
此实验的目的是了解由本文公开的t细胞克隆分泌的嵌合蛋白与其同源配体的结合是否产生免疫效应。为此目的,将细胞因子的诱导与管家控制基因进行比较评估。
[0324]
在一项实验中,将250,000个ht1080/h4-1bb细胞生长过夜。第二天,将如实施例2中所述产生的jurkat亲本细胞或jurkat/hpd1-fc-4-1bbl细胞的(总细胞培养体积的)0%或25%纯培养上清液添加至细胞。继续孵育另外3小时。3小时后,从ht1080/h4-1bb细胞分离rna,合成cdna,并通过qrt-pcr评估gapdh、actb(管家控制基因)、cxcl8和ccl2的基因表达。根据δ-δct方法,gapdh用于归一化基因表达和倍数诱导。如图11a所示,添加jurkat亲本细胞或jurkat/hpd1-fc-4-1bbl细胞的纯培养上清液并未明显影响actb基因表达的表达。添加jurkat亲本细胞的纯培养上清液引起cxcl8和ccl2基因的轻微诱导(图11b和图
u2os-nik/nfκb报告细胞,根据制造商的建议将50,000个pathhunter u2os-nik/nfκb报告细胞培养过夜。第二天,将递增数量的jurkat亲本细胞或jurkat/hcsf1r-fc-cd40l细胞与pa thhunter u2os-nik/nfκb报告细胞共培养。具体地,0、约500、约1,230、约3,700、约11,100、约33,300、约100,000或约300,000个jurkat亲本细胞或jurkat/hcsf1r-fc-cd40l细胞与pathhunte r u2os-nik/nfκb报告细胞共培养。15μg/ml纯化的csf1r-fc-cd40l嵌合蛋白的3倍连续稀释液用作阳性对照。培养6小时后,添加discoverx发光试剂,并使用promega glomax仪器测定生物发光。如图14b所示,jurkat/hcsf1r-fc-cd40l细胞也诱导了生物发光,从而表明诱导了cd40l诱导的nf-κb信号传导。纯化的csf1r-fc-cd40l嵌合蛋白、阳性对照诱导了生物发光(图14b),并且jurkat亲本细胞未诱导这种生物发光(图14b)。在较高的jurkat/hc sf1r-fc-cd40l细胞数量下,生物发光信号接近由纯化的hcsf1r-fc-cd40l嵌合蛋白产生的最大诱导。如图14b所示,jurkat/hcsf1r-fc-cd40l细胞对nfκb信号传导的诱导在所测试的每个剂量下是统计上显著的。这些结果表明,在共培养期间中,jurkat/hcsf1r-fc-cd40l产生了hcsf1r-fc-cd40l蛋白,所述蛋白结合至由pathhun ter u2os-nik/nfκb报告细胞表达的cd40并在pathhunter u2os-nik/nfκb报告细胞中诱导下游nfκb信号传导。
[0332]
这些数据表明jurkat/hcsf1r-fc-cd40l细胞产生了hcsf1r-fc-cd40l异源嵌合蛋白,所述异源嵌合蛋白能够特异性地结合至表达人cd40(cd40l的同源配体)的细胞,并诱导cd40下游的信号传导,其最终达到细胞因子的诱导。
[0333]
实施例7.在共培养期间通过本文公开的t细胞克隆在表达ecd配体的细胞中诱导细胞因子
[0334]
此实验的目的是探索由所公开的t细胞克隆分泌的嵌合蛋白是否产生免疫效应。这种免疫效应可源于嵌合蛋白与其配体的结合和/或嵌合抗原受体与其具有特异性的抗原的结合。为此目的,在共培养实验中将细胞因子的诱导与管家控制基因进行比较评估。
[0335]
在一项实验中,将250,000个ht1080/h4-1bb细胞生长过夜。第二天,将jurkat/hpd1-fc-4-1bbl细胞涂铺在ht1080/h4-1bb细胞上的ht1080/h4-1bb细胞处:jurkat细胞比率为1:0(没有jurkat细胞的对照)、1:1、1:5和1:10。继续孵育另外6小时。6小时后,从共培养物中除去培养基并通过elisa评估il-8。如图15所示,与jurkat亲本细胞相比,jurkat/hpd1-fc-4-1bbl细胞引起il-8的诱导(p=0.0696,通过未配对t检验与welch校正)。此外,如图15所示,il-8分泌的诱导是统计上显著的。这些数据表明jurkat/hpd-1-fc-4-1bbl细胞产生了hpd-1-fc-4-1bbl异源嵌合蛋白,所述异源嵌合蛋白能够诱导细胞因子表达。
[0336]
总的来说,这些数据表明本文公开的t细胞克隆产生异源嵌合蛋白,所述异源嵌合蛋白能够特异性地结合至表达嵌合蛋白的配体/受体的细胞,并诱导配体/受体下游的信号传导,其最终达到细胞因子的诱导。
[0337]
以引用的方式并入
[0338]
本文引用的所有专利和出版物以引用的方式整体并入本文。
[0339]
本文所论述的出版物仅仅出于其在本技术的提交日期之前公开而提供。本技术中的任何内容均不应解释为承认本发明无权凭借在先发明而早于此类出版物。
[0340]
如本文所用的,所有标题仅用于组织,并不意图以任何方式限制本公开。任何单个部分的内容可同样适用于所有部分。
[0341]
等效方案
[0342]
尽管已经结合本发明具体的实施方案公开了本发明,但应理解本发明能够具有另外的修改,并且本技术意图涵盖通常遵循本发明原理的、包括虽然不属于本发明所公开内容范围但属于本发明所属领域的公知技术或常用的技术手段并可以应用于上文中阐述和所附权利要求的范围所列出的必要特征的任何变型、用途或者变更。
[0343]
本领域技术人员仅使用常规实验将会认识到或将能够确定本文中确切公开的具体实施方案的许多等效方案。此类等效方案意图涵盖在所附权利要求书的范围中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1