用于治疗胆管癌的包含帕比司他的联合疗法的制作方法
1.本发明涉及用于治疗胆管癌的组合物和方法。更具体地,本发明涉及用于治疗胆管癌的包含帕比司他组合物与其他细胞毒性剂(例如增强帕比司他作用的药剂)联用的联合疗法,以及通过联合施用帕比司他与其他细胞毒性剂(例如促进帕比司他作用的药剂)治疗胆管癌的方法。
背景技术:
2.有100多种形式的癌症源自与器官或组织无关的特定细胞类型。国家癌症研究所(nci)列出了癌症的主要类型(https://www.cancer.gov/types),其中每一种类型可基于分子标志物的表达、基因表达谱、突变负荷和转化致癌突变而进一步分组和分类。乳腺癌就是一个这样的实例,其根据雌激素受体、孕酮受体和her2受体的表达进一步分类。此外,三阴性乳腺癌不表达任何上述受体。
3.与几乎所有形式的癌症一样,如果在疾病进展的早期诊断肿瘤,并且还根据癌症的发展阶段对癌症进行分组,则预后会好得多。各种形式、各种阶段的癌症通常具有不同的治疗方案。
4.如果治疗基于已建立并可用的治疗方案,则用于任何给定诊断的癌症治疗进一步分为一线治疗、二线治疗和三线治疗。各种形式的癌症的优选治疗方案在各国也可能有一定的不同。
5.在欧洲和北美,胆管癌(cca)是罕见的原发性恶性肿瘤之一。然而,胆管癌在亚洲国家更常见(boris blechacz:cholangiocarcinoma:current knowledge and new developments in gut liver.,2017年1月;第11卷第1期:第13-26页)。
6.在胆管癌中,癌细胞源自肝内胆管或者肝外胆管。因此,胆管癌可以被分为肝内胆管癌和肝外胆管癌。肝外胆管癌占胆管癌的60%-80%,可以被细分为肝门部胆管癌和远端胆管癌。在挪威,胆管癌的主要治疗方案是外科手术。然而,70%-80%的肝外胆管癌不适宜进行治疗性切除。放射疗法可能是另一种有价值的治疗方案。如果患者患有转移性胆管癌,则药物治疗通常是吉西他滨联用奥沙利铂、卡培他滨或顺铂。
7.近年来,在科学文献和数据库中已经报道了用药物和药物组合治疗胆管癌的各种临床研究。这些治疗研究包括靶向疗法,如单克隆抗体(“mab”)、激酶抑制剂(“nib”)和其他药物。
8.例如,wo2017/202806涉及用于针对胆囊癌和胆管癌以及其他癌症的免疫疗法的肽和肽的组合。
9.wo2017/037299提供了通过施用治疗有效量的瓦尼替尼治疗胆管癌的方法。
10.wo2008/023947描述了用于抑制胆管癌的生长或转移的药物组合物,其包含l1cam活性抑制剂或表达抑制剂,以及使用该组合物的治疗方法。
11.然而,尽管开发了新疗法,胆管癌仍然被认为是具有致命并发症并对化疗表现出低应答和低抗性的破坏性恶性肿瘤。
12.胆管癌患者的预后通常非常差并且药物治疗在胆管癌中的临床价值有限。胆管癌的五年存活率低于5%,不能手术的患者五年存活率为0%。平均存活时间为12个月。因此,医学界迫切需要改进的疗法。
13.发明简述
14.在实现本发明的工作中,发明人选择了380多种已知的抗癌相关药物物质(例如,细胞毒性剂)用于广泛评价它们单独治疗和联合治疗对几种胆管癌细胞系的作用。在基于物质的已知性质(诸如低剂量下的功效、良性副作用和已知作用机制)并结合它们对胆管癌细胞系的活性进行的几轮选择之后,发明人发现帕比司他对肝内胆管癌细胞系和肝外胆管癌细胞系都特别有效。考虑到在细胞测定中仅一部分测试药物和药物组合是活性的,这是特别令人惊讶的。
15.此外,发明人确定一些选定的药物物质(例如,细胞毒性剂)可促进帕比司他对一种或多种胆管癌细胞系的抗癌活性。
16.因此,在其最广泛的意义上,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐并向该受试者施用治疗有效量的可促进(即增强)帕比司他或其药学上可接受的盐的治疗效果的细胞毒性剂,其中该细胞毒性剂与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
17.或者,本发明提供帕比司他或其药学上可接受的盐和促进(即增强)帕比司他或其药学上可接受的盐的治疗效果的细胞毒性剂,用于治疗受试者胆管癌。
18.在另一个实施方案中,本发明提供用于治疗受试者胆管癌的帕比司他或其药学上可接受的盐联用可促进(即增强)帕比司他或其药学上可接受的盐的治疗效果的细胞毒性剂。
19.在又一个实施方案中,本发明提供帕比司他或其药学上可接受的盐作为与细胞毒性剂联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。在一些实施方案中,帕比司他或其药学上可接受的盐可与细胞毒性剂一起配制以提供联合制剂,例如包含帕比司他或其药学上可接受的盐和细胞毒性剂的药物组合物。
20.本发明还提供帕比司他或其药学上可接受的盐在制备其与细胞毒性剂联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。在一些实施方案中,帕比司他或其药学上可接受的盐可与细胞毒性剂一起配制以提供联合制剂,例如包含帕比司他或其药学上可接受的盐和细胞毒性剂的药物组合物。
具体实施方式
21.帕比司他((e)-n-羟基-3-[4-[[2-(2-甲基-1h-吲哚-3-基)乙氨基]甲基]苯基]丙-2-烯酰胺)是具有以下结构的组蛋白脱乙酰基酶(hdac)的酶抑制剂。帕比司他可从诺华公司获得。或者,可如wo 02/22577中所述制备帕比司他,该文献通过引用方式并入本文。本文提及的帕比司他包括其盐。
[0022][0023]
药学上可接受的盐包括药学上可接受的碱加成盐和酸加成盐,例如金属盐,诸如碱金属盐和碱土金属盐、铵盐、有机胺加成盐和氨基酸加成盐,以及磺酸盐。酸加成盐包括无机酸加成盐(诸如盐酸盐、硫酸盐和磷酸盐)和有机酸加成盐(诸如烷基磺酸盐、芳基磺酸盐、乙酸盐、马来酸盐、富马酸盐、酒石酸盐、柠檬酸盐和乳酸盐)。金属盐的实例是碱金属盐诸如锂盐、钠盐和钾盐;碱土金属盐诸如镁盐和钙盐;铝盐;以及锌盐。铵盐的实例是铵盐和四甲基铵盐。有机胺加成盐的实例是吗啉盐和哌啶盐。氨基酸加成盐的实例是甘氨酸盐、苯丙氨酸盐、谷氨酸盐和赖氨酸盐。磺酸盐包括甲磺酸盐、甲苯磺酸盐和苯磺酸盐。
[0024]
优选的盐包括有机酸加成盐,诸如烷基磺酸盐、芳基磺酸盐、乙酸盐、马来酸盐、富马酸盐、酒石酸盐、柠檬酸盐和乳酸盐。乳酸盐是特别优选的。
[0025]
除非另有说明,否则以上列出的药学上可接受的盐的列表适用于本文所述的所有药物物质(例如,下文描述的帕比司他和细胞毒性剂)。
[0026]
本文所指的“药学上可接受的”是指与本发明的方法或用途中使用的其他成分相容并且对于受体而言是生理学上可接受的成分。
[0027]“胆管癌”或“cca”可以是肝内胆管癌或肝外胆管癌(其可以是肝门部胆管癌和远端胆管癌)。超过90%的胆管癌是腺癌。在一些实施方案中,待治疗的胆管癌是转移性胆管癌。在一些实施方案中,待治疗的胆管癌是肝内胆管癌。在一些实施方案中,待治疗的胆管癌是肝外胆管癌。
[0028]
如实施例中详述的,发明人已经确定本发明的联合疗法在各种细胞系中具有不同的功效。在这个方面,细胞系源自个体肿瘤并可视为代表不同形式的胆管癌。例如,每种细胞系可具有一种或多种特征,例如一种或多种遗传标志物、生长速率、细胞形态或其组合,这些特征通常发现于胆管癌肿瘤中。因此,本文公开的在抑制特定细胞系的生长或杀死特定细胞系的细胞方面特别有效的联合疗法在治疗胆管癌肿瘤中可以发现特别的效用,该胆管癌肿瘤具有与胆管癌细胞系相关的一种或多种特征(例如一种或多种遗传标志物(例如突变)、生长速率和/或细胞形态),例如对胆管癌细胞系特异的一种或多种特征。
[0029]
例如,egi-1(cvcl_1193)和tfk-1(cvcl_2214)细胞系源自雄性受试者肝外胆管癌肿瘤的外植体(shimizu等人,int.j.cancer,第52卷:第252-260页(1992年),通过引用方式并入本文)。因此,在一些实施方案中,本文公开的联合疗法可用于治疗患有胆管癌肿瘤(例如肝外胆管癌肿瘤)的受试者,该胆管癌肿瘤具有对egi-1细胞系和/或tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0030]
cc-sw-1细胞系源自雌性受试者肝内胆管癌肿瘤的外植体。因此,在一些实施方案中,本文公开的联合疗法可用于治疗患有胆管癌肿瘤(例如肝内胆管癌肿瘤)的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生
长速率和/或细胞形态。
[0031]
hucc-t1细胞系源自具有转移性肝内胆管癌肿瘤的雄性受试者的腹水。因此,在一些实施方案中,本文公开的联合疗法可用于治疗患有胆管癌肿瘤(例如肝内胆管癌肿瘤)的受试者(例如患有转移性肝内胆管癌的受试者),该胆管癌肿瘤具有对hucc-t1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0032]
实施例部分描述了哪些联合疗法在每种细胞系中有效,因此这些疗法可在治疗如上定义的胆管癌肿瘤中有效。在代表性实例中,实施例26和实施例27表明曲美替尼和多柔比星在cc-sw-1细胞系中促进帕比司他的作用方面特别有效。因此,在一些实施方案中,本发明提供一种帕比司他与曲美替尼或多柔比星(如本文所定义,例如包括其盐等)的联合疗法,用于治疗患有胆管癌肿瘤(例如肝内胆管癌肿瘤)的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0033]
由于一些联合疗法对一种以上细胞系有效,例如曲美替尼可促进帕比司他在cc-sw-1、egi-1、hucc-t1和tfk-1细胞系中的作用,因此该联合疗法在治疗患有胆管癌肿瘤的受试者中可以发现效用,该胆管癌肿瘤具有对多种特定细胞系特异的一种或多种特征(例如一种或多种遗传标志物、生长速率和/或细胞形态),例如具有对cc-sw-1细胞系特异的特征和对hucc-t1细胞系特异的特征的胆管癌肿瘤。
[0034]
对胆管癌细胞系特异的特征或特征组合(例如遗传标志物(诸如突变)的组合)是指存在于胆管癌细胞系中并且在正常(即健康的)胆管细胞和/或一种或多种其他胆管癌细胞系中不存在的特征或特征组合。
[0035]
在这个方面,实施例29描述了上述胆管癌细胞系的遗传分析和在每个细胞系中鉴定的突变。因此,在一些实施方案中,具有与egi-1细胞系相关的一个或多个特征的胆管癌肿瘤可在选自kras、tp53、asxl1、pdgfra、myh11、e2f1、ahnak、safb2、notch1、peg3、cadm3、spi1、ar、hcar2、ppp1r1b或其组合的基因中具有一个或多个突变。在一些实施方案中,这些基因中的突变如实施例29中所述。在一些实施方案中,具有与egi-1细胞系相关的一种或多种特征的胆管癌肿瘤可在选自kras和/或tp53的基因中具有一个或多个突变,特别是在kras中的gly12asp和/或在tp53中的arg273his。
[0036]
在一些实施方案中,具有与tfk-1细胞系相关的一种或多种特征的胆管癌肿瘤可在选自bap1、pbrm1、ikzf3、pawr、fgfr3、stil、sema3f、pcm1、fgf5、whsc1、tp53(例如trp91ter、272g>a)或其组合的基因中具有一个或多个突变。在一些实施方案中,这些基因中的突变如实施例29中所述。
[0037]
在一些实施方案中,具有与hucc-t1细胞系相关的一种或多种特征的胆管癌肿瘤可在选自kras、tp53、fbxw7、letmd1、setd2、kdm5a、myo18b、rb1、dnaja3、cdt1、zfp36l2、maf、gmps、npas2、cntnap2、msh6(例如lys1358fs*2、编码序列4071_4072insgatt)或其组合的基因中具有一个或多个突变。在一些实施方案中,这些基因中的突变如实施例29中所述。在一些实施方案中,具有与hucc-t1细胞系相关的一种或多种特征的胆管癌肿瘤可在选自kras和/或tp53的基因中具有一个或多个突变,特别是在kras中的gly12asp和/或在tp53中的arg175his。
[0038]
在一些实施方案中,具有与cc-sw-1细胞系相关的一种或多种特征的胆管癌肿瘤
可在选自pdgfra、ccar2、reck、znf292、pyhin1、dsp或其组合的基因中具有一个或多个突变。在一些实施方案中,这些基因中的突变如实施例29中所述。
[0039]
如本文所定义的,本文所用的“治疗”泛指对临床病况或病症管理有益的任何作用或步骤(或干预)。因此,治疗可以指相对于治疗前的症状,减少、减轻、改善、减缓正在接受治疗的胆管癌(cca)的一种或多种症状的发展或消除这些症状或以任何方式改善受试者的临床状态。治疗可包括任何临床步骤或干预,其有助于治疗程序或方案或成为治疗程序或方案中的一部分。特别地,该治疗可包括减小所治疗的胆管癌的肿瘤尺寸或体积。
[0040]
治疗可包括延迟、限制、减少或预防胆管癌中一种或多种症状的发作,例如相对于治疗前的胆管癌或症状。因此,治疗明确地包括绝对预防胆管癌中症状的发生或发展和任何胆管癌或症状发展的延迟,或减少或限制胆管癌或症状的发展或进展。
[0041]
因此,根据本发明的治疗包括杀死、抑制或减缓胆管癌细胞生长或胆管癌细胞的本体或群体的尺寸的增加(例如在组织中、肿瘤中或生长中),减少胆管癌细胞数量或防止胆管癌细胞扩散(例如扩散到另一个解剖学部位),减小细胞生长的尺寸等。术语“治疗”不一定意味着治愈或胆管癌细胞生长(或胆管癌细胞的生长)的完全清除或消除。
[0042]“受试者”或“患者”是动物(即,任何人或非人动物),优选为哺乳动物,最优选为人。
[0043]
本文所述的治疗剂或药物物质(例如帕比司他、细胞毒性剂)可使用任何合适的方式施用给受试者,并且施用途径将取决于治疗剂。在一些实施方案中,治疗剂是全身施用的。
[0044]“全身施用”包括任何形式的非局部施用,其中将药剂在直接邻近胆管癌或胆管癌局部附近以外的部位施用至身体使得全身接受所施用的药剂。方便地,全身施用可通过肠内递送(例如口服)或肠胃外递送(例如静脉内施用、肌内施用或皮下施用)。
[0045]
帕比司他可以任何合适的药物形式施用。例如,帕比司他可作为包含帕比司他或其盐以及药理学上(或药学上)可接受的赋形剂的药物组合物提供。
[0046]
赋形剂可包括本领域已知的任何赋形剂,例如任何载体或稀释剂或任何其他成分或试剂,诸如缓冲剂、抗氧化剂、螯合剂、粘合剂、包衣、崩解剂、填充剂、调味剂、着色剂、助流剂、润滑剂、防腐剂、吸附剂和/或甜味剂等。
[0047]
赋形剂可选自例如乳酸、葡萄糖、焦亚硫酸钠、苯甲醇、聚乙二醇、丙二醇、微晶纤维素、乳糖、淀粉、壳聚糖、预胶化淀粉、碳酸钙、硫酸钙、纤维素、葡萄糖结合剂、糊精、右旋糖、磷酸氢钙二水合物、磷酸三钙、明胶、碳酸镁、氧化镁、硬脂酸镁、麦芽糖糊精、甘露醇、粉状纤维素、预胶化淀粉、氯化钠、山梨醇、丙二醇和/或滑石。赋形剂通常还包括有色物质,如二氧化钛和各种铁氧化物。
[0048]
除非另有说明,否则以上列出的赋形剂列表适用于本文所述的所有药物物质(例如,下文所述的帕比司他和细胞毒性剂)。
[0049]
本文所述的药物组合物可以本领域已知的任何形式提供,例如作为片剂、胶囊、包衣片剂、液体、悬浮液、药丸、小药囊、植入物、粉末、微丸、乳液、冻干物、泡腾剂或其任何混合物。它可以例如作为抗胃液制剂和/或以持续作用形式提供。
[0050]
在优选的实施方案中,配制帕比司他(例如包含帕比司他或其盐的药物组合物)用于口服施用。换句话说,在本发明的方法和用途中,帕比司他是口服施用于受试者的。
[0051]
用于治疗胆管癌的帕比司他的最优选剂型是片剂或胶囊形式。片剂可以是包衣片剂。
[0052]
用于治疗胆管癌的甚至最优选的剂型之一是胶囊形式。
[0053]
帕比司他或其盐可使用任何适当的剂量方案以任何合适的剂量范围施用。技术人员将知道帕比司他的合适剂量范围。在一个实施方案中,帕比司他或其盐存在于药物组合物中并以其典型剂量范围施用于受试者。这可以被看作是帕比司他的治疗有效量。
[0054]
如上所述,帕比司他与另一种治疗剂(例如,促进帕比司他的作用的细胞毒性剂)一起用于联合疗法。因此,在一些实施方案中,帕比司他可以低于其典型剂量范围的剂量范围施用。然而,在联合疗法中使用较低剂量的帕比司他的情况下,帕比司他将具有与较高剂量的帕比司他本身相同或相当的治疗效果。因此,在一些实施方案中,本发明因此使得治疗对帕比司他具有低或低于平均耐受性的受试者成为可能,诸如老年人、婴儿或幼儿,或例如由于疾病、营养不良等而虚弱的人。
[0055]
在代表性实施方案中,用于治疗胆管癌的帕比司他的临床剂量为约5mg至50mg,更优选为10mg至30mg,每天施用或每周施用至少2次,例如每周2-6次、2-5次或2-4次。在优选的实施方案中,临床剂量是单剂量制剂,例如片剂或胶囊。
[0056]
如上所述和实施例中详述的,发明人已确定,当与各种其他细胞毒性剂(例如,抗癌剂)联用时,帕比司他对胆管癌的作用可被增强。
[0057]
因此,本发明涉及用于治疗胆管癌的治疗方案,其中帕比司他与另一种细胞毒性剂(例如,抗癌药)联用。
[0058]
因此,本文所述的另外的细胞毒性剂(例如,抗癌剂)可用于提供敏化作用,换句话说,用于增强(或增加、增大或促进)帕比司他的作用(例如在治疗胆管癌中),或使受试者(或更具体地讲,受试者中存在的胆管癌细胞或肿瘤)对帕比司他的作用更敏感。因此,在一些实施方案中,帕比司他可被视为主要药物(治疗剂),另外的细胞毒性剂可被视为次要药物(治疗剂)。
[0059]
术语“主要药物(primary drug)”和“主要治疗剂(primary therapeutic agent)”是指与“次要药物(secondary drug)”或“次要治疗剂(secondary therapeutic agent)”相比以较高相对剂量施用的药物。例如,主要药物以其最大耐受剂量(例如最大耐受剂量的至少70%、80%或90%,例如100%)或接近其最大耐受剂量施用,次要药物以显著低于其最大耐受剂量(例如小于最大耐受剂量的70%、60%或50%)的剂量施用。例如,次要药物可以ic20剂量或接近该剂量施用。由于不同的药物具有不同的剂量范围,因此显然可以比主要药物更高的绝对剂量施用次要药物,即使该次要药物以显著低于其最大耐受剂量的剂量施用。
[0060]
最大耐受剂量(mtd)是指产生所需效果而没有不可接受的毒性的药理学治疗方案的最高剂量。技术人员将知道本文公开的任何给定细胞毒性剂的最大耐受剂量。
[0061]
在一些实施方案中,另外的细胞毒性剂可以是与单独使用帕比司他的ic50值相比帕比司他的ic50值有所降低的任何药剂。可使用任何合适的方法测定ic50,诸如实施例中所述的体外方法。
[0062]
以下实施例证明,当与特定剂量的帕比司他联用时,一些细胞毒性剂的ic50可降低。因此,在一些实施方案中,帕比司他可增强另外的细胞毒性剂的治疗功效,例如降低另
外的细胞毒性剂的ic50。换句话说,在一些实施方案中,帕比司他可被用作(即施用作为)次要药物(例如以显著低于其最大耐受剂量的剂量),另外的细胞毒性剂可被施用作为主要药物(例如以等于或接近其最大耐受剂量的剂量)。在一些实施方案中,帕比司他对另外的细胞毒性剂的治疗功效的作用(例如降低另外的细胞毒性剂的ic50)可以是另外的细胞毒性剂对帕比司他的作用之外的作用。
[0063]
在优选的实施方案中,帕比司他被用作本文公开的组合中的主要药物。
[0064]
术语“ic50”是物质抑制特定生物功能或生化功能的有效性的量度。因此,在本发明的上下文中,ic50代表50%抑制(降低)体外胆管癌细胞活力所需药物(例如,帕比司他)浓度。类似地,术语“ic20”代表20%抑制(降低)体外胆管癌细胞活力所需的药物浓度。因此,抑制浓度(ic)可以看作物质的致死浓度(lc)或致死剂量(ld),这些术语用于描述体内研究中的施用剂量。
[0065]
本文所述的细胞毒性剂(即抗癌药)通常与临床使用中的不良事件相关。毒性和不良事件的频率和严重性通常与剂量有关。剂量越高,副作用越频繁、越严重。抗癌药物通常以可能的最高临床剂量(最大耐受剂量)使用以便使其功效最大化。因此,如果可能的话,降低抗癌药物在癌细胞中的ic50是临床相关的。
[0066]
细胞毒性剂降低主要药物(例如,帕比司他)在胆管癌细胞中的ic50的能力可通过测量特定细胞系的ic50剂量的变化以提供δic50来确定。δic50涉及给定物质的单治疗曲线如何受第二化合物的联合治疗的影响。在本文的一些实施例中,在各种细胞系中,将次要药物(另外的细胞毒性剂)以其ic20浓度加入到各种浓度的主要药物(例如,帕比司他)中。当次要药物降低了主要药物的ic50时,次要药物可被视为促进主要药物的作用。如上所述,联用的临床结果可能是可以减少主要药物的剂量,从而降低副作用的频率和/或副作用的严重性。另一种选择是维持主要药物的正常剂量以提高治疗胆管癌的药物的临床功效。在一些实施方案中,另外的细胞毒性剂可使帕比司他的ic50值降低至少约10%,例如降低至少约12%、15%、20%、25%、30%、40%或50%。在一些实施方案中,另外的细胞毒性剂可使帕比司他的ic50值降低至少约60%、70%、80%、90%或100%。
[0067]
在一些实施方案中,另外的细胞毒性剂为当与帕比司他联用时,对于相同剂量或相同浓度的帕比司他,该组合在治疗胆管癌中比单独使用帕比司他更有效(例如,加成或协同)的任何药剂。
[0068]“组合指数”(ci)提供了两种药物物质的组合的功效的定量评价。例如,两种药物的组合可以起协同作用(功效大于两种药物的加成功效,例如2+2=5)、加成作用(功效是单独药物的功效的总和,例如2+2=4)或拮抗作用(功效小于单独药物的功效的总和,例如2+2=3)。可使用chou-talalay原理和calcusyn软件(biosoft,ferguson,mo;也参见chou tc,talalay p.adv enzyme regul.,1984年;第22卷:第27-55页;lu huang等人,nature,第7卷,文章号:40752(2017年);和ashkan zandi等人,middle east journal of cancer;2017年1月;第8卷第1期:第31-38页,所有这些文献通过引用方式并入本文)计算ci。ci值小于1表示协同作用;ci值等于1表示加成作用;ci值大于1表示拮抗作用。在一些实施方案中,当单独使用时,另外的细胞毒性剂可有效抑制(例如,杀死)胆管癌细胞的活力(例如,治疗受试者的胆管癌)。因此,在一些实施方案中,帕比司他与另外的细胞毒性剂的组合对抑制胆管癌细胞的活力(例如,治疗受试者的胆管癌)的作用是加成的,即该组合的ci值等于1。
[0069]
加成相互作用是指帕比司他和另外的细胞毒性剂的作用等于它们在相同剂量下的单独作用的总和,例如,作用是物质抑制(例如,杀死)胆管癌细胞的活力的能力,例如使用实施例中所述的体外测定所评估的。
[0070]
在一些实施方案中,帕比司他与另外的细胞毒性剂的组合对抑制(例如,杀死)胆管癌细胞的活力(例如,治疗受试者的胆管癌)的作用是协同的。
[0071]
协同相互作用是指帕比司他与另外的细胞毒性剂一起服用的效果大于它们在相同剂量下单独服用的效果的总和,例如该效果是这些物质抑制(例如,杀死)胆管癌细胞的活力的能力,例如使用实施例中所述的体外测定所评估的,即该组合的ci值小于1,例如约0.95、0.90、0.85、0.80、0.75或更小。
[0072]
在一些实施方案中,相对于单独使用帕比司他用于治疗胆管癌,帕比司他与另外的细胞毒性剂的联用改善了用于治疗胆管癌的帕比司他的安全因子。
[0073]“安全因子”是在受试者中产生毒性作用和/或严重副作用的剂量与功效剂量(例如治疗有效量)之间的比率。因此,在一些实施方案中,本文所公开的帕比司他组合的安全因子高于单独使用帕比司他治疗胆管癌的安全因子。或者,在一些实施方案中,另外的细胞毒性剂是改善帕比司他的安全因子的药剂。
[0074]
在一些实施方案中,相对于单独使用帕比司他用于治疗胆管癌,帕比司他与另外的细胞毒性剂的联用改善了用于治疗胆管癌的帕比司他的治疗指数。
[0075]
治疗指数(ti)是药物相对安全性的定量量度,其以毒性剂量(td50)和有效剂量(ed50)之间的比率来测量。ed50是在50%的患者中产生给定治疗效果的剂量,td50是在50%的患者中产生给定毒性效果的剂量。这些值可以从剂量反应曲线中提取。从临床角度来看,治疗指数尽可能高是有利的。治疗指数值高是药物安全且严重副作用的可能性低的指征。另一方面,如果治疗指数低(例如,接近1),则患者使用给定临床剂量产生严重副作用的可能性将会高得多。对于临床使用的药物,ti将因药物而异。细胞毒性药物(例如,抗癌药)的ti通常较低而例如青霉素和扑热息痛的ti则高得多。
[0076]
ti可使用体外数据基于正常细胞和癌细胞中ic50之间的比率计算,如实施例中所示。因此,在一些实施方案中,帕比司他与另外的细胞毒性剂的联用改善了如在实施例中所计算的治疗指数,即体外ti。在一些实施方案中,组合的体外ti为至少1.5,优选为2.0、2.5、3.0或更高,例如,5、6、7、8、9、10或更高。
[0077]
术语“药物敏感性评分(dss)”是指在单个参数中表征药物或药物组合的定量度量。dds以1至100的单一值描述了多参数剂量与反应之间的关系,其中值越高表示治疗更有效。dds鉴定癌症和对照细胞之间的选择性药物或药物组合反应(参见yadav等人,scientific reports(nature),第4卷,文章号:5193(2014年))。因此,在一些实施方案中,本文公开的联合疗法具有比单一疗法(例如,单独使用帕比司他)更高的dss。
[0078]“细胞毒性剂”是指能够抑制(例如,杀死)动物细胞生长、活力和/或增殖(复制/繁殖)的药剂。在一些实施方案中,细胞毒性剂能够抑制(例如,杀死)胆管癌细胞(优选,人胆管癌细胞)生长、活力和/或增殖(复制/繁殖)。
[0079]
作为细胞毒性剂包括抗肿瘤剂和任何可指示用于肿瘤学应用的药剂。因此,包括在化疗治疗方案中使用的药剂(“化疗剂”或“抗癌”剂)。
[0080]
细胞毒性剂通常根据其作用机制分为不同的类别并且所有这些类别都涵盖于本
文中。因此,细胞毒性剂可以是例如烷化剂、交联剂、嵌入剂、核苷酸类似物、纺锤体形成抑制剂和/或拓扑异构酶i和/或ii抑制剂。其他类型或种类的药剂包括抗代谢物、植物生物碱和萜类化合物或抗肿瘤抗生素。
[0081]
烷化剂通过烷基化核苷修饰dna,这会阻止正确的dna复制。核苷酸类似物在复制过程中掺入dna中并抑制dna合成。纺锤体形成抑制剂干扰纺锤体形成,这会使中期有丝分裂停止。嵌入剂插入dna碱基之间从而抑制dna合成。拓扑异构酶i或ii抑制剂影响dna扭转从而干扰dna复制。
[0082]
合适的细胞毒性剂是本领域已知的,但作为实例,放线菌素d、硼替佐米、bcnu(卡莫司汀)、bi 2536、布帕尼西、卡铂、ccnu、喜树碱(cpt)、斑蝥素、顺铂、考布他汀a4、cudc-907、环磷酰胺、阿糖胞苷、达沙替尼、达卡巴嗪、达托里昔布、达珀利奈、柔红霉素、多西他赛、多柔比星、杜韦利西布、dtic、伊利司莫、表柔比星、依托泊苷、吉非替尼、吉西他滨、艾地拉利斯、异环磷酰胺、伊斯平斯、伊立替康、离子霉素、芦米司匹、美法仑、甲氨蝶呤、丝霉素c(mmc)、米托蒽醌、巯嘌呤、莫利布斯(molibresib)、奥沙利铂、奥巴克拉、紫杉醇、parp-1抑制剂、培立替尼、哌立福新、px-866、sepantronium bromide、sb-743921、taselisib、紫杉特尔、替莫唑胺(tzm)、替尼泊苷、托泊替康、曲美替尼、苏消安、雷公藤内酯、厄布利塞、长春瑞滨、长春新碱、长春花碱、伏拉塞替、伏他利塞、五氮杂胞苷、5,6-二氢-5-氮杂胞苷和5-氟尿嘧啶可用于本发明的联合疗法。
[0083]
在特别优选的实施方案中,另外的细胞毒性剂选自硼替佐米、bi 2536、卡铂、顺铂、考布他汀a4、达托里昔布、达珀利奈、达沙替尼、多西他赛、多柔比星、伊利司莫、吉西他滨、伊斯平斯、芦米司匹、甲氨蝶呤、莫利布斯、奥巴克拉、培立替尼、sb-743921、托泊替康、曲美替尼和雷公藤内酯。
[0084]
在又一个优选的实施方案中,另外的细胞毒性剂选自bi 2536、卡铂、顺铂、考布他汀a4、达托里昔布、达珀利奈、达沙替尼、多西他赛、多柔比星、伊利司莫、伊斯平斯、芦米司匹、甲氨蝶呤、莫利布斯、奥巴克拉、培立替尼、sb-743921、托泊替康、曲美替尼和雷公藤内酯。
[0085]
在另一个优选的实施方案中,另外的细胞毒性剂选自多柔比星、达托里昔布、sb-743921、曲美替尼、伊利司莫、莫利布斯、甲氨蝶呤、达珀利奈、托泊替康、顺铂、达沙替尼、卡铂和芦米司匹。
[0086]
在还一个优选的实施方案中,另外的细胞毒性剂选自卡铂、顺铂、达沙替尼、多柔比星、多西他赛、甲氨蝶呤、托泊替康、曲美替尼、达托里昔布、达珀利奈、伊利司莫、伊斯平斯、芦米司匹、莫利布斯、奥巴克拉、培立替尼、曲美替尼和雷公藤内酯,优选选自卡铂、顺铂、达沙替尼、阿霉素、多西他赛、甲氨蝶呤、拓扑替康和曲美替尼。
[0087]
与帕比司他联用的细胞毒性剂可以如上文所定义的药物组合物提供并且可以如上文和下文所定义施用。在一些实施方案中,包含细胞毒性剂的药物组合物可配制用于肠胃外施用。因此,组合物可包含适于这类制剂(例如静脉内推注或注射)的药学上可接受的赋形剂、溶剂和稀释剂。
[0088]
技术人员将知道任何给定细胞毒性剂的合适剂量范围。在优选的实施方案中,细胞毒性剂以其典型剂量范围存在于药物组合物中或施用于受试者。
[0089]
然而,如下文实施例所示和上文所述,一些细胞毒性剂能够以低剂量促进帕比司
他对胆管癌细胞的作用。因此,在一些实施方案中,另外的细胞毒性剂可以低于下文所述的典型剂量范围的剂量范围存在于药物组合物中或施用于受试者。例如,在一些实施方案中,另外的细胞毒性剂可以典型剂量范围的70%或更少(例如,以典型剂量范围(例如,最大耐受剂量)的60%、50%、40%或30%或更少)的剂量范围存在于药物组合物中或施用于受试者。因此,在一些实施方案中,另外的细胞毒性剂的治疗有效量低于如上定义的典型剂量范围。
[0090]
在一个实施方案中,联合疗法包括施用帕比司他和硼替佐米。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的硼替佐米或其药学上可接受的盐、溶剂化物或水合物。
[0091]
硼替佐米或其药学上可接受的盐、溶剂化物或水合物可以与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0092]
或者,本发明提供帕比司他或其药学上可接受的盐作为与硼替佐米或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0093]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与硼替佐米或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0094]
在一些实施方案中,帕比司他与硼替佐米的联合疗法被用于治疗肝内胆管癌。
[0095]
在一些实施方案中,帕比司他与硼替佐米的联合疗法被用于治疗患有胆管癌肿瘤(例如,肝内胆管癌肿瘤)的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0096]
硼替佐米([(1r)-3-甲基-1-({(2s)-3-苯基-2-[(吡嗪-2-基羰基)氨基]丙酰基}氨基)丁基]硼酸)是一种具有如下所示结构的蛋白酶体抑制剂。硼替佐米可从杨森公司获得。术语“硼替佐米”包括其药学上可接受的盐、溶剂化物和水合物。
[0097][0098]
硼替佐米的稳定液体药物组合物描述于wo2016/166653(通过引用方式并入本文)并且任何这样的组合物可用于本发明的方法、组合物和用途。
[0099]
在一些实施方案中,包含硼替佐米的组合物是“即用型”制剂,其包含溶解或增溶形式的硼替佐米并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0100]
在优选的实施方案中,包含硼替佐米的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0101]
合适的溶剂可以选自水性溶剂和非水性溶剂,例如但不限于甘油、乙醇、正丙醇、正丁醇、异丙醇、乙酸乙酯、碳酸二甲酯、乙腈、二氯甲烷、甲基乙基酮、甲基异丁基酮、环己烷、二甲基乙酰胺(dma)、二甲亚砜(dmso)、n-甲基-2-吡咯烷酮(nmp)、l,3-二甲基-2-咪唑啉酮(dmi)、丙酮、四氢呋喃(thf)、二甲基甲酰胺(dmf)、碳酸丙烯酯(pc)、异山梨醇二甲酯、水和它们的混合物。优选的溶剂是乙醇、甘油和水。
[0102]
用于本发明的硼替佐米制剂可以包含稳定剂,诸如糖和氨基酸。合适的稳定剂包括葡萄糖、海藻糖、蔗糖、甘露醇、山梨醇、精氨酸、甘氨酸、脯氨酸、甲硫氨酸、赖氨酸等。
[0103]
用于本发明的硼替佐米制剂可以包含螯合剂。合适的螯合剂包括dota(1,4,7,10-四氮杂环十二烷-l,4,7,10-四乙酸)、dtpa(二亚乙基三胺五乙酸)、edta(乙二胺四乙酸)、odda(l,4,10,13-四氧杂-7,16-二氮杂环十八烷-7)、ttt a(1,7,13-三氮杂-4,10,16-三氧杂环十八烷-n,n',n
”‑
三乙酸酯)、dotrp(四甘醇-l,5,9-三氮杂环十二烷-n,n',n
”‑
三(亚甲基膦酸)、egta(乙二醇-双(p-氨基乙基醚)-四乙酸)等。
[0104]
用于本发明的硼替佐米制剂还可以包含一种或多种抗氧化剂。合适的抗氧化剂包括但不限于硫代甘油、抗坏血酸、亚硫酸氢钠、焦亚硫酸钠、l-半胱氨酸、巯基乙酸、柠檬酸、酒石酸、磷酸、葡糖酸、硫代二丙酸等。最优选的抗氧化剂是硫代甘油。
[0105]
联合施用帕比司他和硼替佐米以治疗胆管癌的最优选方面是以皮下或静脉内注射形式施用硼替佐米。
[0106]
根据本发明使用的硼替佐米注射剂优选地是水溶性硼酸酯的形式;最优选的酯是甘露醇硼酸酯。
[0107]
硼酸酯制剂,优选甘露醇酯,通常为无菌干粉制剂形式。粉末通常是经冷冻干燥的粉末。在施用前,将粉末溶解在无菌水中,通常是无菌等渗氯化钠水溶液。
[0108]
用于本发明的硼替佐米制剂可以任选地包含其他药学上可接受的佐剂,例如缓冲剂、ph调节剂、防腐剂、张力调节剂等。
[0109]
除非另有说明,否则以上列出的溶剂、稳定剂、螯合剂和抗氧化剂的列表也可用于包含本文所述的其他细胞毒性剂的药物组合物中。
[0110]
上述基于硼替佐米的制剂可以优选地包含甘露醇并且可以在氮气保护下在注射小瓶中提供或在预填充的注射器中提供。
[0111]
使用帕比司他与硼替佐米联合治疗胆管癌的优选实施方案是口服施用帕比司他并且以注射的形式施用硼替佐米。
[0112]
在一些实施方案中,帕比司他与硼替佐米联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0113]
在一些实施方案中,硼替佐米与帕比司他联合治疗胆管癌的临床剂量通常为0.5mg/m2体表面积(bsa)至3mg/m2体表面积,每周施用至少一次,优选为1mg/m2体表面积(bsa)至2mg/m2体表面积,每周施用至少一次。
[0114]
在本发明的优选方面中,施用帕比司他和硼替佐米的组合治疗胆管癌涉及共同施用糖皮质激素,典型地为地塞米松。
[0115]
在一个实施方案中,联合疗法包括施用帕比司他和卡铂。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的卡铂或其药学上可接受的盐、溶剂化物或水合物。
[0116]
卡铂或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0117]
或者,本发明提供帕比司他或其药学上可接受的盐作为与卡铂或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0118]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与卡铂或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0119]
在一些实施方案中,帕比司他与卡铂的联合疗法被用于治疗肝外胆管癌。
[0120]
在一些实施方案中,帕比司他与卡铂的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系和/或tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0121]
卡铂(顺式-(1,1-环丁烷二羧基)二氨合铂(ii))是一种具有如下所示结构的含铂抗癌药物。卡铂是广泛可得的。术语“卡铂”包括其药学上可接受的盐、溶剂化物和水合物。
[0122][0123]
卡铂的液体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0124]
在一些实施方案中,包含卡铂的组合物是“即用型”制剂,其包含溶解或增溶形式的卡铂并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0125]
在优选的实施方案中,包含卡铂的药物制剂旨在用于肠胃外施用。
[0126]
使用帕比司他与卡铂联合治疗胆管癌的优选实施方案是口服施用帕比司他并且以注射或输注的形式施用卡铂。
[0127]
在一些实施方案中,帕比司他与卡铂联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0128]
在一些实施方案中,卡铂与帕比司他联合治疗胆管癌的临床剂量通常与当前卡铂用于其他适应症时使用的剂量范围相同,例如1mg/m2bsa至30mg/m2bsa。calvert公式应用于计算正确的临床剂量。
[0129]
在一个实施方案中,联合疗法包括施用帕比司他和顺铂。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的顺铂或其药学上可接受的盐、溶剂化物或水合物。
[0130]
顺铂或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0131]
或者,本发明提供帕比司他或其药学上可接受的盐作为与顺铂或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0132]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与顺铂或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0133]
在一些实施方案中,帕比司他与顺铂的联合疗法被用于治疗肝外胆管癌。
[0134]
在一些实施方案中,帕比司他与顺铂的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系和/或tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0135]
顺铂((sp-4-2)-二胺二氯铂(ii))是一种具有如下所示结构的含铂抗癌药物。顺铂是广泛可得的,例如可从赫升瑞公司(cisplatin hospira)获得。术语“顺铂”包括其药学上可接受的盐、溶剂化物和水合物。
[0136][0137]
顺铂的液体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0138]
在一些实施方案中,包含顺铂的组合物是“即用型”制剂,其包含溶解或增溶形式的顺铂并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0139]
在优选的实施方案中,包含顺铂的药物制剂旨在用于肠胃外施用。
[0140]
使用帕比司他与顺铂联合治疗胆管癌的优选实施方案是口服施用帕比司他并且以注射或输注的形式施用顺铂。
[0141]
在一些实施方案中,帕比司他与顺铂联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0142]
在一些实施方案中,顺铂与帕比司他联合治疗胆管癌的临床剂量通常与当前顺铂用于其他适应症时使用的剂量范围相同,例如10mg/m2bsa至50mg/m2bsa,优选为20mg/m2bsa至30mg/m2bsa。calvert公式应用于计算正确的临床剂量。
[0143]
在一个实施方案中,联合疗法包括施用帕比司他和达沙替尼。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的达沙替尼或其药学上可接受的盐。
[0144]
达沙替尼或其药学上可接受的盐可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0145]
或者,本发明提供帕比司他或其药学上可接受的盐作为与达沙替尼或其药学上可接受的盐联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0146]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与达
沙替尼或其药学上可接受的盐联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0147]
在一些实施方案中,帕比司他与达沙替尼的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和达沙替尼的药物组合物。
[0148]
在一些实施方案中,帕比司他与达沙替尼的联合疗法被用于治疗肝外胆管癌。
[0149]
在一些实施方案中,帕比司他与达沙替尼的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系和/或tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0150]
达沙替尼(n-(2-氯-6-甲基苯基)-2-({6-[4-(2-羟乙基)哌嗪-1-基]-2-甲基嘧啶-4-基}氨基)-1,3-噻唑-5-甲酰胺)是一种蛋白激酶抑制剂,公开于wo2000/062778(式i)中。达沙替尼具有如下所示结构。达沙替尼可从百时美施贵宝公司获得。术语“达沙替尼”包括其药学上可接受的盐和水合物。
[0151][0152]
达沙替尼的药物组合物是本领域公知的,例如可见于wo2000/062778、wo2007/035874和wo2015/181573(三者都通过引用方式并入本文)并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0153]
在优选的实施方案中,包含达沙替尼的药物组合物被配制用于口服施用。
[0154]
使用帕比司他与达沙替尼联合治疗胆管癌的优选实施方案是口服施用帕比司他和达沙替尼。
[0155]
因此,在一些实施方案中,帕比司他和达沙替尼可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和达沙替尼可以作为联合药物制剂以一种剂型(例如片剂或胶囊)施用。
[0156]
用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和达沙替尼的药物制剂(如本文所定义的药物组合物)是本发明的一个方面。
[0157]
联合施用帕比司他和达沙替尼治疗胆管癌的最优选方面是以包含达沙替尼一水合物的口服制剂形式施用达沙替尼。
[0158]
根据本发明,用于治疗胆管癌的达沙替尼的典型口服制剂包含至少一种以下赋形剂:乳糖、甘露醇、微晶纤维素、羟丙基甲基纤维素(hpmc)、交联羧甲基纤维素钠、硬脂酸镁、十二烷基硫酸钠、聚乙二醇和二氧化硅。
[0159]
在一些实施方案中,帕比司他与达沙替尼联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0160]
在一些实施方案中,达沙替尼与帕比司他联合治疗胆管癌的临床剂量通常应为10mg/天至200mg/天。
[0161]
在一个实施方案中,联合疗法包括施用帕比司他和多柔比星。因此,本发明提供了治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的多柔比星或其药学上可接受的盐、溶剂化物或水合物。
[0162]
多柔比星或其药学上可接受的盐、溶剂化物或水合物可以与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0163]
或者,本发明提供帕比司他或其药学上可接受的盐作为与多柔比星或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0164]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与多柔比星或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0165]
帕比司他与多柔比星的联合疗法可用于治疗肝内胆管癌或肝外胆管癌。在一些实施方案中,帕比司他与多柔比星的联合疗法被用于治疗肝内胆管癌。
[0166]
在一些实施方案中,帕比司他与多柔比星的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、efi-1细胞系和/或tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0167]
多柔比星((1s,3s)-3-羟乙酰基-3,5,12-三羟基-10-甲氧基-6,11-二氧代-1,2,3,4,6,11-六氢并四苯-1-基-3-氨基-2,3,6-三脱氧-α-l-来苏糖-吡喃己糖苷)是一种具有如下所示结构的细胞毒性抗生素药物物质。多柔比星是广泛可得的,例如可从杨森公司和辉瑞公司获得。
[0168]
术语“多柔比星”包括其药学上可接受的盐、溶剂化物和水合物。
[0169][0170]
多柔比星的液体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0171]
在一些实施方案中,包含多柔比星的组合物是“即用型”制剂,其包含溶解或增溶形式的多柔比星并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0172]
在优选的实施方案中,包含多柔比星的药物组合物被配制用于肠胃外施用。
[0173]
使用帕比司他与多柔比星联合治疗胆管癌的优选实施方案是口服施用帕比司他并且以注射或输注的形式施用多柔比星。
[0174]
在一些实施方案中,帕比司他与多柔比星联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0175]
在一些实施方案中,多柔比星与帕比司他联合治疗胆管癌的临床剂量通常与当前多柔比星用于其他适应症时使用的剂量范围相同,例如每2-4周施用10mg/m2体表面积(bsa)至100mg/m2体表面积,优选为40mg/m2bsa至75mg/m2bsa。
[0176]
在一个实施方案中,联合疗法包括施用帕比司他和吉西他滨。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的吉西他滨或其药学上可接受的盐、溶剂化物或水合物。
[0177]
吉西他滨或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0178]
或者,本发明提供帕比司他或其药学上可接受的盐作为与吉西他滨或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0179]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与吉西他滨或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0180]
帕比司他与吉西他滨的联合疗法可用于治疗肝内胆管癌或肝外胆管癌。在一些实施方案中,帕比司他与吉西他滨的联合疗法被用于治疗肝内胆管癌。
[0181]
在一些实施方案中,帕比司他与吉西他滨的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系和/或hucc-t1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0182]
吉西他滨(4-氨基-1-(2-脱氧-2,2-二氟-β-d-赤式-戊呋喃糖基)嘧啶-2(1h)-酮)是一种具有如下所示结构的核苷类似物。吉西他滨是广泛可得的,例如可从礼来公司或美国密苏里州圣路易斯市的西格玛奥德里奇公司获得。术语“吉西他滨”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义,优选为盐酸盐。
[0183][0184]
吉西他滨的液体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0185]
在一些实施方案中,包含吉西他滨的组合物是“即用型”制剂,其包含溶解或增溶形式的吉西他滨并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0186]
在优选的实施方案中,包含吉西他滨的药物组合物被配制用于肠胃外施用。
[0187]
使用帕比司他与吉西他滨联合治疗胆管癌的优选实施方案是口服施用帕比司他并且以注射或输注的形式施用吉西他滨。
[0188]
在一些实施方案中,帕比司他与吉西他滨联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0189]
在一些实施方案中,吉西他滨与帕比司他联合治疗胆管癌的临床剂量通常与当前吉西他滨用于其他适应症时使用的剂量范围相同,例如500mg/m2至1500mg/m2(吉西他滨的mg数/m2体表面积,bsa)。方便地,使用900mg/m2至1100mg/m2的剂量。方便地,吉西他滨可以在少于1小时内施用,例如15分钟至45分钟,例如大约30分钟或者在更长的时间范围内施用,例如1小时至12小时。
[0190]
在一个实施方案中,联合疗法包括施用帕比司他和甲氨蝶呤。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的甲氨蝶呤或其药学上可接受的盐、溶剂化物或水合物。
[0191]
甲氨蝶呤或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0192]
或者,本发明提供帕比司他或其药学上可接受的盐作为与甲氨蝶呤或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0193]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与甲氨蝶呤或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0194]
在一些实施方案中,帕比司他与甲氨蝶呤的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和甲氨蝶呤的药物组合物。
[0195]
在一些实施方案中,帕比司他与甲氨蝶呤的联合疗法被用于治疗肝外胆管癌。
[0196]
在一些实施方案中,帕比司他与甲氨蝶呤的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系和/或tfk-1细胞系特异(优选对tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0197]
甲氨蝶呤(n-[4-[[(2,4-二氨基-6-蝶啶基)甲基]甲氨基]苯甲酰基]-l-谷氨酸)是一种具有如下所示结构的叶酸衍生物(抗代谢物)。甲氨蝶呤是广泛可得的,例如可从赫升瑞公司获得。术语“甲氨蝶呤”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义,优选为钠盐。
[0198]
[0199]
甲氨蝶呤的液体药物组合物和固体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0200]
在一些实施方案中,包含甲氨蝶呤的组合物是“即用型”制剂,其含有溶解或增溶形式的甲氨蝶呤并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0201]
因此,在一些实施方案中,包含甲氨蝶呤的药物组合物被配制用于肠胃外施用,例如注射或输注。在这些实施方案中,甲氨蝶呤可以盐的形式提供,优选以钠盐的形式提供。
[0202]
然而,在一些实施方案中,包含甲氨蝶呤的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0203]
在一些实施方案中,使用帕比司他与甲氨蝶呤联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用甲氨蝶呤。
[0204]
在其他实施方案中,使用帕比司他与甲氨蝶呤的组合治疗胆管癌是口服施用帕比司他和甲氨蝶呤。
[0205]
因此,在一些实施方案中,帕比司他和甲氨蝶呤可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和甲氨蝶呤可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0206]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和甲氨蝶呤的药物制剂(药物组合物)是本发明的又一个方面。
[0207]
在一些实施方案中,帕比司他与甲氨蝶呤联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0208]
在一些实施方案中,甲氨蝶呤与帕比司他联合治疗胆管癌的临床剂量通常与当前甲氨蝶呤用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,甲氨蝶呤的剂量范围可以是每周施用2.5mg/m2bsa至50mg/m2bsa,例如7.5mg/m2bsa至25mg/m2bsa。
[0209]
在一个实施方案中,联合疗法包括施用帕比司他和托泊替康。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的托泊替康或其药学上可接受的盐、溶剂化物或水合物。
[0210]
托泊替康或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0211]
或者,本发明提供帕比司他或其药学上可接受的盐作为与托泊替康或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0212]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与托泊替康或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0213]
在一些实施方案中,帕比司他与托泊替康的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和托泊替康的药物组合物。
[0214]
帕比司他与托泊替康的联合疗法可用于治疗肝内胆管癌或肝外胆管癌。
[0215]
在一些实施方案中,帕比司他与托泊替康的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1
细胞系特异(优选对cc-sw-1细胞系和/或tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0216]
托泊替康(9-[(二甲基氨基)甲基]-10-羟基-(4s)-喜树碱)是一种具有如下所示结构的拓扑异构酶抑制剂。托泊替康是广泛可得的,例如可从阿特维斯公司获得。术语“托泊替康”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义,优选为盐酸盐。
[0217][0218]
托泊替康的液体药物组合物和固体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0219]
在一些实施方案中,包含托泊替康的组合物是“即用型”制剂,其含有溶解或增溶形式的托泊替康并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0220]
因此,在一些实施方案中,包含托泊替康的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0221]
然而,在一些实施方案中,包含托泊替康的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0222]
在一些实施方案中,使用帕比司他与托泊替康联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用托泊替康。
[0223]
在其他实施方案中,使用帕比司他与托泊替康联合治疗胆管癌是口服施用帕比司他和托泊替康。
[0224]
因此,在一些实施方案中,帕比司他和托泊替康可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和托泊替康可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0225]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和托泊替康的药物制剂(即,药物组合物)是本发明的又一个方面。
[0226]
在一些实施方案中,帕比司他与托泊替康联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0227]
在一些实施方案中,托泊替康与帕比司他联合治疗胆管癌的临床剂量通常与当前托泊替康用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,托泊替康的剂量范围可以是0.25mg/m2bsa至3mg/m2bsa,例如0.75mg/m2bsa至1.50mg/m2bsa,如上所定义的每天施用或每周施用至少2次。
[0228]
在一个实施方案中,联合疗法包括施用帕比司他和曲美替尼。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或
其药学上可接受的盐和治疗有效量的曲美替尼或其药学上可接受的盐。
[0229]
曲美替尼或其药学上可接受的盐可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0230]
或者,本发明提供帕比司他或其药学上可接受的盐作为与曲美替尼或其药学上可接受的盐联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0231]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与曲美替尼或其药学上可接受的盐联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0232]
在一些实施方案中,帕比司他与曲美替尼的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和曲美替尼的药物组合物。
[0233]
帕比司他与曲美替尼的联合疗法可用于治疗肝外胆管癌或肝内胆管癌。
[0234]
在一些实施方案中,帕比司他和曲美替尼的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系和/或tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0235]
曲美替尼是一种具有亲和性促分裂原活化的蛋白激酶并且具有如下所示结构的酪氨酸激酶抑制剂。曲美替尼可从诺华公司获得。术语“曲美替尼”包括如本文中其他部分所定义的其药学上可接受的盐。在一些实施方案中,曲美替尼以曲美替尼二甲亚砜的形式提供。
[0236][0237]
曲美替尼的液体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0238]
在优选的实施方案中,包含曲美替尼的药物组合物被配制用于口服施用(例如片剂或胶囊)。
[0239]
使用帕比司他与曲美替尼联合治疗胆管癌的优选实施方案是口服施用帕比司他和曲美替尼。
[0240]
因此,在一些实施方案中,帕比司他和曲美替尼可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和曲美替尼可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0241]
用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和曲美替尼的药物制剂(即,药物组合物)是本发明的又一个方面。
[0242]
在本发明的优选方面中,联合施用帕比司他和曲美替尼治疗胆管癌涉及使用口服
形式的曲美替尼制剂,其中曲美替尼任选地为硫酸二甲酯溶剂化物的形式,并且该口服制剂包含一种或多种以下赋形剂:甘露醇、微晶纤维素、羟丙基甲基纤维素(hpmc)、交联羧甲基纤维素钠、硬脂酸镁、十二烷基硫酸钠和二氧化硅。
[0243]
在一些实施方案中,帕比司他与曲美替尼联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0244]
在一些实施方案中,曲美替尼与帕比司他联合治疗胆管癌的临床剂量通常为每天施用0.1mg至10mg,更优选为0.5mg至5mg,或每周施用至少2次,例如2-6次、2-5次或2-4次。在优选的实施方案中,临床剂量是单剂量制剂,例如片剂或胶囊。
[0245]
在一个实施方案中,联合疗法包括施用帕比司他和考布他汀a4。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的考布他汀a4或其药学上可接受的盐、溶剂化物或水合物。
[0246]
考布他汀a4或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0247]
或者,本发明提供帕比司他或其药学上可接受的盐作为与考布他汀a4或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0248]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与考布他汀a4或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0249]
在一些实施方案中,帕比司他与考布他汀a4的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和考布他汀a4的药物组合物。
[0250]
在一些实施方案中,帕比司他与考布他汀a4的联合疗法被用于治疗肝内胆管癌。
[0251]
在一些实施方案中,帕比司他与考布他汀a4的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0252]
考布他汀a4(2-甲氧基-5-[(z)-2-(3,4,5-三甲氧基-苯基)-乙烯基]-苯酚)是一种具有如下所示结构的芪类化合物。它可从灌木(combretum caffrum)中分离得到。术语“考布他汀a4”包括其药学可接受的盐、溶剂化物和水合物。药学上可接受的盐、溶剂化物和水合物优选如上文所定义。在一些实施方案中,考布他汀a4以水溶性酯的形式提供,例如以水溶性磷酸酯的形式提供。
[0253][0254]
考布他汀a4可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0255]
在一些实施方案中,包含考布他汀a4的组合物是“即用型”制剂,其含有溶解或增溶形式的考布他汀a4并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0256]
因此,在一些实施方案中,包含考布他汀a4的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0257]
然而,在一些实施方案中,包含考布他汀a4的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0258]
在一些实施方案中,使用帕比司他与考布他汀a4联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用考布他汀a4。
[0259]
在其他实施方案中,使用帕比司他与考布他汀a4联合治疗胆管癌是口服施用帕比司他和考布他汀a4。
[0260]
因此,在一些实施方案中,帕比司他和考布他汀a4可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和考布他汀a4可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0261]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和考布他汀a4的药物制剂(即,药物组合物)是本发明的又一个方面。
[0262]
在一些实施方案中,帕比司他与考布他汀a4联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0263]
在一些实施方案中,考布他汀a4与帕比司他联合治疗胆管癌的临床剂量通常与当前考布他汀a4用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,考布他汀a4的剂量范围可以是5mg/m2bsa至100mg/m2bsa,例如20mg/m2bsa至85mg/m2bsa,如上所定义的每天施用或每周施用至少2次。
[0264]
在一个实施方案中,联合疗法包括施用帕比司他和sb-743921。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的sb-743921或其药学上可接受的盐、溶剂化物或水合物。
[0265]
sb-743921或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0266]
或者,本发明提供帕比司他或其药学上可接受的盐作为与sb-743921或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0267]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与sb-743921或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0268]
帕比司他与sb-743921的联合疗法可用于治疗肝内胆管癌或肝外胆管癌。在一些实施方案中,帕比司他与sb-743921的联合疗法被用于治疗肝外胆管癌。
[0269]
在一些实施方案中,帕比司他与sb-743921的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系和/或egi-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0270]
sb-743921是一种具有如下所示结构的有丝分裂驱动蛋白ksp的抑制剂。术语“sb-743921”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义,优选为盐酸盐。
[0271][0272]
sb-743921的液体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0273]
在一些实施方案中,包含sb-743921的组合物是“即用型”制剂,其含有溶解或增溶形式的sb-743921并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0274]
在优选的实施方案中,包含sb-743921的药物组合物被配制用于肠胃外施用。
[0275]
使用帕比司他与sb-743921联合治疗胆管癌的优选实施方案是口服施用帕比司他并且以注射或输注的形式施用sb-743921。
[0276]
在一些实施方案中,帕比司他与sb-743921联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0277]
在一些实施方案中,sb-743921与帕比司他联合治疗胆管癌的临床剂量通常与当前sb-743921用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,sb-743921的剂量范围可以是每周或每月(例如,每1-4周)施用1mg/m2bsa至10mg/m2bsa。
[0278]
在一个实施方案中,联合疗法包括施用帕比司他和达珀利奈。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的达珀利奈或其药学上可接受的盐、溶剂化物或水合物。
[0279]
达珀利奈或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0280]
或者,本发明提供帕比司他或其药学上可接受的盐作为与达珀利奈或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0281]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与达珀利奈或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0282]
在一些实施方案中,帕比司他与达珀利奈的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和达珀利奈的药物组合物。
[0283]
帕比司他与达珀利奈的联合疗法可用于治疗肝内胆管癌或肝外胆管癌。在一些实施方案中,帕比司他与达珀利奈的联合疗法被用于治疗肝内胆管癌。
[0284]
在一些实施方案中,帕比司他与达珀利奈的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、egi-1细胞系和/或tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0285]
达珀利奈((e)-n-[4-(1-苯甲酰基哌啶-4-基)丁基]-3-吡啶-3-基丙-2-烯酰胺)抑制烟酰胺磷酸核糖基转移酶(nmprtase)并且具有如下所示结构。术语“达珀利奈”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义,优选为盐酸盐。
[0286][0287]
达珀利奈可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0288]
在一些实施方案中,包含达珀利奈的组合物是“即用型”制剂,其含有溶解或增溶形式的达珀利奈并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0289]
因此,在一些实施方案中,包含达珀利奈的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0290]
然而,在一些实施方案中,包含达珀利奈的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0291]
在一些实施方案中,使用帕比司他与达珀利奈联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用达珀利奈。
[0292]
在其他实施方案中,使用帕比司他与达珀利奈联合治疗胆管癌是口服施用帕比司他和达珀利奈。
[0293]
因此,在一些实施方案中,帕比司他和达珀利奈可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和达珀利奈可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0294]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和达珀利奈的药物制剂(即,药物组合物)是本发明的又一个方面。
[0295]
在一些实施方案中,帕比司他与达珀利奈联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0296]
在一些实施方案中,达珀利奈与帕比司他联合治疗胆管癌的临床剂量通常与当前达珀利奈用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,达珀利奈的剂量范围可以是每周或每月施用0.1mg/m2bsa至10mg/m2bsa,例如每1-6周、1-5周、1-4周或1-3周。
[0297]
在一个实施方案中,联合疗法包括施用帕比司他和伊斯平斯。因此,本发明提供一
种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的伊斯平斯或其药学上可接受的盐、溶剂化物或水合物。
[0298]
伊斯平斯或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0299]
或者,本发明提供帕比司他或其药学上可接受的盐作为与伊斯平斯或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0300]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与伊斯平斯或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0301]
在一些实施方案中,帕比司他与伊斯平斯的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和伊斯平斯的药物组合物。
[0302]
在一些实施方案中,帕比司他与伊斯平斯的联合疗法被用于治疗肝外胆管癌。
[0303]
在一些实施方案中,帕比司他和伊斯平斯的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系和/或tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0304]
伊斯平斯(n-(3-氨基丙基)-n-[(1r)-1-[7-氯-4-氧代-3-(苯甲基)-2-喹唑啉基]-2-甲基丙基]-4-甲基苯甲酰胺)衍生自喹唑啉酮并且选择性抑制有丝分裂运动蛋白和纺锤体驱动蛋白(ksp)。伊斯平斯具有如下所示结构。术语“伊斯平斯”包括其药学上可接受的盐、溶剂化物和水合物。例如,在一些实施方案中,伊斯平斯可以是盐酸盐的形式。在一些优选的实施方案中,伊斯平斯是游离化合物的形式。
[0305][0306]
伊斯平斯可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0307]
在一些实施方案中,包含伊斯平斯的组合物是“即用型”制剂,其含有溶解或增溶形式的伊斯平斯并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0308]
因此,在一些实施方案中,包含伊斯平斯的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0309]
然而,在一些实施方案中,包含伊斯平斯的药物组合物被配制用于口服施用,例如
片剂或胶囊。
[0310]
在一些实施方案中,使用帕比司他与伊斯平斯联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用伊斯平斯。
[0311]
在其他实施方案中,使用帕比司他与伊斯平斯联合治疗胆管癌是口服施用帕比司他和伊斯平斯。
[0312]
因此,在一些实施方案中,帕比司他和伊斯平斯可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和伊斯平斯可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0313]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和伊斯平斯的药物制剂(即,药物组合物)是本发明的又一个方面。
[0314]
在一些实施方案中,帕比司他与伊斯平斯联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0315]
在一些实施方案中,伊斯平斯与帕比司他联合治疗胆管癌的临床剂量通常与当前伊斯平斯用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,伊斯平斯的剂量范围可以是每周或每月施用5mg/m2bsa至30mg/m2bsa,例如每1-6周、1-5周、1-4周或1-3周。
[0316]
在一个实施方案中,联合疗法包括施用帕比司他和芦米司匹。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的芦米司匹或其药学上可接受的盐、溶剂化物或水合物。
[0317]
芦米司匹或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0318]
或者,本发明提供帕比司他或其药学上可接受的盐作为与芦米司匹或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0319]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与芦米司匹或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0320]
在一些实施方案中,帕比司他与芦米司匹的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和芦米司匹的药物组合物。
[0321]
在一些实施方案中,帕比司他与芦米司匹的联合疗法被用于治疗肝外胆管癌。
[0322]
在一些实施方案中,帕比司他与芦米司匹的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对egi-1细胞系和/或tfk-1细胞系特异(优选对egi-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0323]
芦米司匹(5-(2,4-二羟基-5-异丙基-苯基)-n-乙基-4-[4-(吗啉代甲基)苯基]异恶唑-3-甲酰胺)是一种具有如下所示结构的hsp90抑制剂。术语“芦米司匹”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义。例如,在一些实施方案中,芦米司匹可以是盐酸盐或甲磺酸盐的形式。
[0324][0325]
芦米司匹可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0326]
在一些实施方案中,包含芦米司匹的组合物是“即用型”制剂,其含有溶解或增溶形式的芦米司匹并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0327]
因此,在一些实施方案中,包含芦米司匹的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0328]
然而,在一些实施方案中,包含芦米司匹的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0329]
在一些实施方案中,使用帕比司他与芦米司匹联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用芦米司匹。
[0330]
在其他实施方案中,使用帕比司他与芦米司匹联合治疗胆管癌是口服施用帕比司他和芦米司匹。
[0331]
因此,在一些实施方案中,帕比司他和芦米司匹可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和芦米司匹可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0332]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和芦米司匹的药物制剂(即,药物组合物)是本发明的又一个方面。
[0333]
在一些实施方案中,帕比司他与芦米司匹联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0334]
在一些实施方案中,芦米司匹与帕比司他联合治疗胆管癌的临床剂量通常与当前芦米司匹用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,芦米司匹的剂量范围可以是每周施用5mg/m2bsa至150mg/m2bsa,例如40mg/m2bsa至70mg/m2bsa,例如每1-4周、1-3周或1-2周。
[0335]
在一个实施方案中,联合疗法包括施用帕比司他莫利布斯。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的莫利布斯或其药学上可接受的盐、溶剂化物或水合物。
[0336]
莫利布斯或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0337]
或者,本发明提供帕比司他或其药学上可接受的盐作为与莫利布斯或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0338]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与莫利布斯或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0339]
在一些实施方案中,帕比司他与莫利布斯的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和莫利布斯的药物组合物。
[0340]
在一些实施方案中,帕比司他与莫利布斯的联合疗法被用于治疗肝外胆管癌。
[0341]
在一些实施方案中,帕比司他与莫利布斯的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对egi-1细胞系和/或tfk-1细胞系特异(优选对tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0342]
莫利布斯(2-[(4s)-6-(4-氯苯基)-8-甲氧基-1-甲基-4h-[1,2,4]三唑并[4,3-a][1,4]苯并二氮杂-4-基]-n-乙基乙酰胺)是一种具有以下所示结构的含溴结构域蛋白的bet(bromodomain and extra-terminal)家族的抑制剂。术语“莫利布斯”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义。例如,在一些实施方案中,莫利布斯可以是盐酸盐或甲磺酸盐的形式。
[0343][0344]
莫利布斯可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0345]
在一些实施方案中,包含莫利布斯的组合物是“即用型”制剂,其含有溶解或增溶形式的莫利布斯并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0346]
因此,在一些实施方案中,包含莫利布斯的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0347]
然而,在一些实施方案中,包含莫利布斯的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0348]
在一些实施方案中,使用帕比司他与莫利布斯联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用莫利布斯。
[0349]
在其他实施方案中,使用帕比司他与莫利布斯联合治疗胆管癌是口服施用帕比司他和莫利布斯。
[0350]
因此,在一些实施方案中,帕比司他和莫利布斯可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和莫利布斯可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0351]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和莫
利布斯的药物制剂(即,药物组合物)是本发明的又一个方面。
[0352]
在一些实施方案中,帕比司他与莫利布斯联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0353]
在一些实施方案中,莫利布斯与帕比司他联合治疗胆管癌的临床剂量通常与当前莫利布斯用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,莫利布斯的剂量范围可以是每天施用5mg至150mg,例如10mg至80mg。
[0354]
在一个实施方案中,联合疗法包括施用帕比司他和培立替尼。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的培立替尼或其药学上可接受的盐、溶剂化物或水合物。
[0355]
培立替尼或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0356]
或者,本发明提供帕比司他或其药学上可接受的盐作为与培立替尼或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0357]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与培立替尼或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0358]
在一些实施方案中,帕比司他与培立替尼的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和培立替尼的药物组合物。
[0359]
在一些实施方案中,帕比司他与培立替尼的联合疗法被用于治疗肝外胆管癌。
[0360]
在一些实施方案中,帕比司他与曲美替尼的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0361]
培立替尼((2e)-n-(4-((3-氯-4-氟苯基)氨基)-3-氰基-7-乙氧基-6-喹啉基)-4-(二甲基氨基)-2-丁烯酰胺)是一种具有以下所示结构的表皮生长因子受体(egfr)的不可逆抑制剂。术语“培立替尼”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义。例如,在一些实施方案中,培立替尼可以是酸式盐的形式,例如盐酸盐或甲磺酸盐。
[0362][0363]
培立替尼可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、
组合物和用途。
[0364]
在一些实施方案中,包含培立替尼的组合物是“即用型”制剂,其含有溶解或增溶形式的培立替尼并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0365]
因此,在一些实施方案中,包含培立替尼的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0366]
然而,在一些实施方案中,包含培立替尼的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0367]
在一些实施方案中,使用帕比司他与培立替尼联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用培立替尼。
[0368]
在其他实施方案中,使用帕比司他与培立替尼联合治疗胆管癌是口服施用帕比司他和培立替尼。
[0369]
因此,在一些实施方案中,帕比司他和培立替尼可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和培立替尼可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0370]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和培立替尼的药物制剂(即,药物组合物)是本发明的又一个方面。
[0371]
在一些实施方案中,帕比司他与培立替尼联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0372]
在一些实施方案中,培立替尼与帕比司他联合治疗胆管癌的临床剂量通常与当前培立替尼用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,培立替尼的剂量范围可以是每天施用10mg至100mg,例如25mg至75mg。
[0373]
在一个实施方案中,联合疗法包括施用帕比司他和雷公藤内酯。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的雷公藤内酯或其药学上可接受的盐、溶剂化物或水合物。
[0374]
雷公藤内酯或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0375]
或者,本发明提供帕比司他或其药学上可接受的盐作为与雷公藤内酯或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0376]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与雷公藤内酯或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0377]
在一些实施方案中,帕比司他与雷公藤内酯的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和雷公藤内酯的药物组合物。
[0378]
在一些实施方案中,帕比司他与雷公藤内酯的联合疗法被用于治疗肝外胆管癌。
[0379]
在一些实施方案中,帕比司他与雷公藤内酯的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0380]
雷公藤内酯是一种具有如下所示结构的二萜类环氧化物。术语“雷公藤内酯”包括其药学上可接受的盐、溶剂化物和水合物。在一些实施方案中,可以水溶性前药的形式提供雷公藤内酯。
[0381][0382]
雷公藤内酯可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0383]
在一些实施方案中,包含雷公藤内酯的组合物是“即用型”制剂,其含有溶解或增溶形式的雷公藤内酯并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0384]
因此,在一些实施方案中,包含雷公藤内酯的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0385]
然而,在一些实施方案中,包含雷公藤内酯的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0386]
在一些实施方案中,使用帕比司他与雷公藤内酯联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用雷公藤内酯。
[0387]
在其他实施方案中,使用帕比司他与雷公藤内酯联合治疗胆管癌是口服施用帕比司他和雷公藤内酯。
[0388]
因此,在一些实施方案中,帕比司他和雷公藤内酯可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和雷公藤内酯可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0389]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和雷公藤内酯的药物制剂(即,药物组合物)本发明的又一个方面。
[0390]
在一些实施方案中,帕比司他与雷公藤内酯联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0391]
在一些实施方案中,雷公藤内酯与帕比司他联合治疗胆管癌的临床剂量通常与当前雷公藤内酯用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,雷公藤内酯的剂量范围可以是每天施用10mg至200mg,例如25mg至150mg。
[0392]
在一个实施方案中,联合疗法包括施用帕比司他和bi 2536。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的bi 2536或其药学上可接受的盐、溶剂化物或水合物。
[0393]
bi 2536或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0394]
或者,本发明提供帕比司他或其药学上可接受的盐作为与bi 2536或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗
受试者胆管癌的产品。
[0395]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与bi2536或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0396]
在一些实施方案中,帕比司他与bi 2536的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和bi 2536的药物组合物。
[0397]
在一些实施方案中,帕比司他与bi 2536的联合疗法被用于治疗肝外胆管癌。
[0398]
在一些实施方案中,帕比司他与bi 2536的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0399]
bi 2536是一种具有如下所示结构的plk1(polo-like激酶1)蛋白的抑制剂。术语“bi2536”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选如上文所定义。例如,在一些实施方案中,bi 2536可以是酸式盐的形式,例如盐酸盐。
[0400][0401]
bi 2536可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0402]
在一些实施方案中,包含bi 2536的组合物是“即用型”制剂,其含有溶解或增溶形式的bi 2536并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0403]
因此,在一些实施方案中,包含bi 2536的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0404]
然而,在一些实施方案中,包含bi 2536的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0405]
在一些实施方案中,使用帕比司他与bi 2536联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用bi 2536。
[0406]
在其他实施方案中,使用帕比司他与bi 2536联合治疗胆管癌是口服施用帕比司他和bi 2536。
[0407]
因此,在一些实施方案中,帕比司他和bi 2536可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和bi 2536可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0408]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和bi2536的药物制剂(即,药物组合物)是本发明的又一个方面。
[0409]
在一些实施方案中,帕比司他与bi 2536联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0410]
在一些实施方案中,bi 2536与帕比司他联合治疗胆管癌的临床剂量通常与当前bi 2536用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,bi 2536的剂量范围可以是每天施用1mg至200mg,例如25mg至150mg。
[0411]
在一个实施方案中,联合疗法包括施用帕比司他和达托里昔布。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的达托里昔布或其药学上可接受的盐、溶剂化物或水合物。
[0412]
达托里昔布或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0413]
或者,本发明提供帕比司他或其药学上可接受的盐作为与达托里昔布或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0414]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与达托里昔布或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0415]
在一些实施方案中,帕比司他与达托里昔布的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和达托里昔布的药物组合物。
[0416]
帕比司他与达托里昔布的联合疗法可用于治疗肝外胆管癌或肝内胆管癌。在一些实施方案中,帕比司他与达托里昔布的联合疗法被用于治疗肝外胆管癌。
[0417]
在一些实施方案中,帕比司他和达托里昔布的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系和/或tfk-1细胞系特异、最优选对tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0418]
达托里昔布是一种磷酸肌醇-3-激酶抑制剂(pi3k抑制剂)并且还抑制mtor。达托里昔布具有如下所示结构。术语“达托里昔布”包括其药学上可接受的盐、溶剂化物和水合物。
[0419][0420]
达托里昔布
[0421]
达托里昔布可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0422]
在一些实施方案中,包含达托里昔布的组合物是“即用型”制剂,其含有溶解或增溶形式的达托里昔布并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0423]
因此,在一些实施方案中,包含达托里昔布的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0424]
然而,在一些实施方案中,包含达托里昔布的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0425]
在一些实施方案中,使用帕比司他与达托里昔布联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用达托里昔布。
[0426]
在其他实施方案中,使用帕比司他与达托里昔布联合治疗胆管癌是口服施用帕比司他和达托里昔布。
[0427]
因此,在一些实施方案中,帕比司他和达托里昔布可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和达托里昔布可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0428]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和达托里昔布的药物制剂(即,药物组合物)是本发明的又一个方面。
[0429]
在一些实施方案中,帕比司他与达托里昔布联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0430]
在一些实施方案中,达托里昔布与帕比司他联合治疗胆管癌的临床剂量通常与当前达托里昔布用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,达托里昔布的剂量范围可以是每天施用100mg至1200mg,例如200mg至800mg。
[0431]
在一个实施方案中,联合疗法包括施用帕比司他和奥巴克拉。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的奥巴克拉或其药学上可接受的盐、溶剂化物或水合物。
[0432]
奥巴克拉或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0433]
或者,本发明提供帕比司他或其药学上可接受的盐作为与奥巴克拉或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0434]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与奥巴克拉或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0435]
在一些实施方案中,帕比司他与奥巴克拉的组合产品是联合制剂,例如包含呈单一剂量形式(例如,片剂或胶囊)的帕比司他和奥巴克拉的药物组合物。
[0436]
在一些实施方案中,帕比司他与奥巴克拉的联合疗法被用于治疗肝外胆管癌。
[0437]
在一些实施方案中,帕比司他与奥巴克拉的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对egi-1细胞系和/或tfk-1细胞系特异的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0438]
奥巴克拉是一种具有如下所示结构的bcl-2家族蛋白的抑制剂。术语“奥巴克拉”包括其药学上可接受的盐、溶剂化物和水合物。药学上可接受的盐优选为奥巴克拉甲磺酸盐。
[0439][0440]
奥巴克拉可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。
[0441]
在一些实施方案中,包含奥巴克拉的组合物是“即用型”制剂,其含有溶解或增溶形式的奥巴克拉并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0442]
因此,在一些实施方案中,包含奥巴克拉的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0443]
然而,在一些实施方案中,包含奥巴克拉的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0444]
在一些实施方案中,使用帕比司他与奥巴克拉联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用奥巴克拉。
[0445]
在其他实施方案中,使用帕比司他与奥巴克拉联合治疗胆管癌是口服施用帕比司他和奥巴克拉。
[0446]
因此,在一些实施方案中,帕比司他和奥巴克拉可以单独的剂型(例如单独的片剂或胶囊)施用。在一些实施方案中,帕比司他和奥巴克拉可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0447]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和奥巴克拉的药物制剂(即,药物组合物)是本发明的又一个方面。
[0448]
在一些实施方案中,帕比司他与奥巴克拉联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0449]
在一些实施方案中,奥巴克拉与帕比司他联合治疗胆管癌的临床剂量通常与当前奥巴克拉用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,奥巴克拉的剂量范围可以是每天施用5mg/m2bsa至50mg/m2bsa,例如10mg/m2bsa至20mg/m2bsa。
[0450]
在一个实施方案中,联合疗法包括施用帕比司他和伊利司莫。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐、溶剂化物或水合物和治疗有效量的伊利司莫或其药学上可接受的盐、溶剂化物或水合物。
[0451]
伊利司莫或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐、溶剂化物或水合物单独、同时或依次施用。
[0452]
或者,本发明提供帕比司他或其药学上可接受的盐、溶剂化物或水合物作为与伊利司莫或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0453]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐、溶剂化物或
水合物在制备其与伊利司莫或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0454]
在一些实施方案中,帕比司他与伊利司莫的组合产品是联合制剂,例如包含单一剂量形式(例如,注射或输注)的帕比司他和伊利司莫的药物组合物。
[0455]
帕比司他与伊利司莫的联合疗法可用于治疗肝外胆管癌或肝内胆管癌。
[0456]
在一些实施方案中,帕比司他与伊利司莫的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系、hucc-t1细胞系、egi-1细胞系和/或tfk-1细胞系特异(优选对tfk-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0457]
伊利司莫(1-n',3-n'-双(苯硫代羰基)-1-n',3-n'-二甲基丙二酰肼)诱导氧化应激,在癌细胞和正常细胞中产生高水平的活性氧物质(ros),诸如过氧化氢。伊利司莫具有如下所示结构。术语“伊利司莫”包括其药学上可接受的盐、溶剂化物和水合物。在一些实施方案中,伊利司莫以钠盐的形式提供。
[0458][0459]
伊利司莫可以液体药物组合物或固体药物组合物的形式提供用于本发明的方法、组合物和用途。伊利司莫描述于wo2013071106中,其通过引用方式并入本文。
[0460]
在一些实施方案中,包含伊利司莫的组合物是“即用型”制剂,其含有溶解或增溶形式的伊利司莫并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0461]
因此,在一些实施方案中,包含伊利司莫的药物组合物被配制用于肠胃外施用,例如注射或输注。
[0462]
然而,在一些实施方案中,包含伊利司莫的药物组合物被配制用于口服施用,例如片剂或胶囊。
[0463]
在一些实施方案中,使用帕比司他与伊利司莫联合治疗胆管癌是口服施用帕比司他并且以注射或输注的形式施用伊利司莫。
[0464]
在其他实施方案中,使用帕比司他与伊利司莫联合治疗胆管癌是口服施用帕比司他和伊利司莫。
[0465]
因此,在一些实施方案中,帕比司他和伊利司莫可以单独的剂型(例如,片剂或胶囊)施用。在一些实施方案中,帕比司他和伊利司莫可以作为联合药物制剂(即,药物组合物)以一个剂型(例如片剂或胶囊)施用。
[0466]
因此,用于治疗胆管癌的在同一联合制剂(例如片剂或胶囊)中包含帕比司他和伊利司莫的药物制剂(即,药物组合物)是本发明的又一个方面。
[0467]
在一些实施方案中,帕比司他与伊利司莫联合治疗胆管癌的临床剂量通常为5mg至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0468]
在一些实施方案中,伊利司莫与帕比司他联合治疗胆管癌的临床剂量通常与当前
伊利司莫用于其他适应症时使用的剂量范围相同。例如,在一些实施方案中,伊利司莫的剂量范围可以是每天施用50mg/m2bsa至300mg/m2bsa,例如100mg/m2bsa至200mg/m2bsa。
[0469]
在一个实施方案中,联合疗法包括施用帕比司他和多西他赛。因此,本发明提供一种治疗受试者胆管癌的方法,该方法包括向有需要的受试者施用治疗有效量的帕比司他或其药学上可接受的盐和治疗有效量的多西他赛或其药学上可接受的盐、溶剂化物或水合物。
[0470]
多西他赛或其药学上可接受的盐、溶剂化物或水合物可与治疗有效量的帕比司他或其药学上可接受的盐单独、同时或依次施用。
[0471]
或者,本发明提供帕比司他或其药学上可接受的盐作为与多西他赛或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以用于治疗受试者胆管癌的产品。
[0472]
在另一个实施方案中,本发明提供帕比司他或其药学上可接受的盐在制备其与多西他赛或其药学上可接受的盐、溶剂化物或水合物联合用于单独、同时或依次使用或施用于受试者以治疗受试者胆管癌的产品中的用途。
[0473]
在一些实施方案中,帕比司他与多西他赛的联合疗法被用于治疗肝内胆管癌。
[0474]
在一些实施方案中,帕比司他与多西他赛的联合疗法被用于治疗患有胆管癌肿瘤的受试者,该胆管癌肿瘤具有对cc-sw-1细胞系和/或tfk-1细胞系特异(优选对cc-sw-1细胞系特异)的一种或多种特征,例如一种或多种遗传标志物、生长速率和/或细胞形态。
[0475]
多西他赛(n-脱苯甲酰基-n-(叔丁氧基羰基)-10-脱乙酰基紫杉醇)是一种抗有丝分裂的化学治疗药物,其以1:1的化学计量比以高亲和力可逆地结合微管蛋白。多西他赛具有如下列出的结构并且是广泛可得的,例如可从自阿特维斯公司获得。术语“多西他赛”包括其药学上可接受的溶剂化物和水合物。在一些实施方案中,多西他赛以多西他赛三水合物提供。
[0476][0477]
多西他赛的液体药物组合物是本领域公知的并且任何这样的组合物可以用于本发明的方法、组合物和用途。
[0478]
在一些实施方案中,包含多西他赛的组合物是“即用型”制剂,其含有溶解或增溶形式的多西他赛并且旨在原样使用或在静脉内稀释剂中进一步稀释后使用。
[0479]
在优选的实施方案中,包含多西他赛的药物组合物被配制用于肠胃外施用。
[0480]
使用帕比司他与多西他赛联合治疗胆管癌的优选实施方案是口服施用帕比司他并且以注射或输注的形式施用多西他赛。
[0481]
在一些实施方案中,帕比司他与多西他赛联合治疗胆管癌的临床剂量通常为5mg
至50mg,更优选为10mg至30mg,如上文所定义的每天施用或每周施用至少2次。
[0482]
在一些实施方案中,多西他赛与帕比司他联合治疗胆管癌的临床剂量通常与当前多西他赛用于其他适应症时使用的剂量范围相同,例如每天施用20mg/m2体表面积(bsa)至200mg/m2体表面积,优选为40mg/m2bsa至75mg/m2bsa。
[0483]
根据本发明,本文公开的药物物质(即,帕比司他和细胞毒性剂)可以是游离药物或其药学上可接受的盐、溶剂化物或水合物的形式。这些盐、溶剂化物和水合物在本领域中有详细描述。根据本发明,本文公开的药物物质的任何合适的药学上可接受的盐、溶剂化物或水合物可以用于治疗胆管癌。
[0484]
药物物质的优选形式是存在于商业监管机构批准的药物产品中的形式的药物物质。
[0485]
药物可以同时或依次施用。如果药物以依次施用的形式施用,则药物施用之间的时间间隔可以从数分钟到数天,这取决于药物物质的性质和临床情况。
[0486]
因此,帕比司他和另外的细胞毒性剂可以同时、单独或依次使用。当同时使用时,同时施用帕比司他和另外的细胞毒性剂,但可以通过单一途径或通过单独的途径施用(例如口服施用混合物或同时但通过不同途径(即口服和静脉内)施用两种(或多种)制剂)。当单独施用时,可同时或依次施用帕比司他和另外的细胞毒性剂并且/或者可在它们的施用时间间隔上重叠。在一些实施方案中,这些药剂在单一制剂(混合物)中一起施用,例如帕比司他和达沙替尼、帕比司他和托泊替康、帕比司他和甲氨蝶呤、帕比司他和曲美替尼、帕比司他和bi 2536、帕比司他和考布他汀a4、帕比司他和达托里昔布、帕比司他和达珀利奈、帕比司他和伊斯平斯、帕比司他和芦米司匹、帕比司他和莫利布斯、帕比司他和奥巴克拉、帕比司他和培立替尼、帕比司他和伊利司莫,以及帕比司他和雷公藤内酯。
[0487]
在本发明的一些实施方案中,帕比司他和/或另一种细胞毒性剂被施用多于一次,例如2次、3次、4次、5次、6次、7次、8次、9次或10次(例如至多20次)。这种施用方式可以在单个(或每个)周期内或总共在多个周期内进行。
[0488]
如本文所提及的,“周期”是应用特定治疗方案的时间段并且通常重复以提供周期性治疗。每个周期中的治疗可以相同或不同(例如,可以使用不同的剂量、时间间隔等)。一个周期的时长可以是7天至30天,例如14天或21天为一个周期。在一些实施方案中,一个周期可以是约1个月至约3个月。可以使用多个周期,例如至少2个周期、3个周期、4个周期或5个周期,例如6个周期、7个周期、8个周期、9个周期或10个周期(例如,至多8个周期、9个周期、10个周期或20个周期)。如上文所述,在每个周期内,帕比司他和/或另一种细胞毒性剂可被施用一次或多于一次。
[0489]
如果联合药物疗法单独或依次施用,则两种或多种不同药物(例如,帕比司他和另一种细胞毒性剂)可作为组合产品提供,其中这些药物作为单独制剂(例如,即用型制剂)提供以供单独和/或依次施用。例如,组合产品可以包括含有制剂和任选的施用说明的试剂盒或包装。
[0490]
如果同时施用联合药物疗法,则可以将两种或多种不同药物(例如,帕比司他和另一种细胞毒性剂)作为单一药物制剂以所谓的联合制剂形式一起施用。
[0491]
因此,本发明的又一个实施方案涉及用于治疗胆管癌的包含帕比司他和一种或多种细胞毒性剂的联合制剂(药物组合物)。在优选的实施方案中,一种或多种细胞毒性剂选
自达沙替尼、托泊替康、甲氨蝶呤、曲美替尼、bi 2536、考布他汀a4、达托里昔布、达珀利奈、伊利司莫、伊斯平斯、芦米司匹、莫利布斯、奥巴克拉、培立替尼和雷公藤内酯以及它们的组合。使用公知的制剂技术可以容易地制备这种联合制剂。
[0492]
然而,在一些实施方案中,不同的药物可以单独的形式同时施用,例如,单独的片剂。
[0493]
因此,在又一个实施方案中,可以看出本发明提供了一种上文所定义的包含帕比司他和细胞毒性剂的试剂盒,其优选地用于同时、单独或依次使用以治疗患者的胆管癌,其中优选地该用途如上文所定义。
[0494]
在优选的实施方案中,细胞毒性剂选自硼替佐米、bi 2536、卡铂、顺铂、考布他汀a4、达托里昔布、达珀利奈、达沙替尼、多柔比星、多西他赛、伊利司莫、吉西他滨、伊斯平斯、芦米司匹、甲氨蝶呤、莫利布斯、奥巴克拉、培立替尼、sb-743921、托泊替康、曲美替尼和雷公藤内酯以及它们的组合。
[0495]
在又一个优选的实施方案中,细胞毒性剂选自bi 2536、卡铂、顺铂、考布他汀a4、达托里昔布、达珀利奈、达沙替尼、多柔比星、多西他赛、伊利司莫、伊斯平斯、芦米司匹、甲氨蝶呤、莫利布斯、奥巴克拉、培立替尼、sb-743921、托泊替康、曲美替尼和雷公藤内酯以及它们的组合。
[0496]
在另一个优选的实施方案中,另外的细胞毒性剂选自多柔比星、达托里昔布、sb-743921、曲美替尼、伊利司莫、莫利布斯、甲氨蝶呤、达珀利奈、托泊替康、顺铂、达沙替尼、卡铂和芦米司匹。
[0497]
在还一个优选的实施方案中,另外的细胞毒性剂选自卡铂、顺铂、达沙替尼、多柔比星、多西他赛、甲氨蝶呤、托泊替康、曲美替尼、达托里昔布、达珀利奈、伊利司莫、伊斯平斯、芦米司匹、莫利布斯、奥巴克拉、培立替尼、曲美替尼和雷公藤内酯,优选选自卡铂、顺铂、达沙替尼、阿霉素、多西他赛、甲氨蝶呤、拓扑替康和曲美替尼。
[0498]
除了上述用于治疗胆管癌的药物物质和组合之外,本发明的组合物、试剂盒或治疗方案可以包括其他药物。这些药物可以是其他抗癌药物或已知在癌症治疗方案中施用的药物,例如本文所述的其他细胞毒性剂。
[0499]
在本发明的一些实施方案中,在本发明的治疗之前、同时或之后,受试者(患者)可以接受其他治疗。例如,在一些实施方案中,受试者(患者)可以根据本领域已知的方法用放射疗法和/或手术治疗。
[0500]
因此,在一些实施方案中,本发明的方法可以包括用放射疗法和/或手术治疗受试者的另外的步骤。手术可以包括胆管癌肿瘤的切除。
[0501]
在一些实施方案中,本发明的联合疗法可用作二线治疗,即,用于对基于吉西他滨的疗法治疗效果不佳的受试者。因此,在一些实施方案中,待治疗的受试者对基于吉西他滨的疗法治疗效果不佳。
[0502]
bsa(体表面积)可以例如使用mosteller公式(√([高度(cm)
×
重量(kg)]/3600))计算。必要时,这可以通过使用平均成人的转化因子(0.025mg/kg=1mg/m2)转化为mg/kg。
[0503]
本发明的优选方面如实施例中所述,其中实施例中所用的一个或多个参数或组分可用作上文所述方法的优选特征。
[0504]
现在将参考以下附图在以下非限制性实施例中更详细地描述本发明,其中:
[0505]
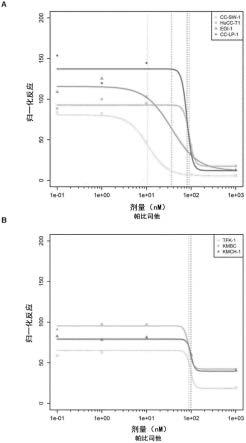
图1示出了七种胆管癌细胞系的帕比司他的浓度反应曲线。a)肝内胆管癌细胞系。b)肝外胆管癌细胞系和kmch-1为胆管癌和肝癌结合细胞系。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0506]
图2示出了作为单一物质治疗的帕比司他(正方形)和硼替佐米(三角形)以及帕比司他与1.3nm的硼替佐米的组合(圆形)在hucc-t1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0507]
图3示出了作为单一物质治疗的帕比司他(正方形)和卡铂(三角形)以及帕比司他与1000nm的卡铂的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0508]
图4示出了作为单一物质治疗的帕比司他(正方形)和顺铂(三角形)以及帕比司他与100nm的顺铂的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0509]
图5示出了作为单一物质治疗的帕比司他(正方形)和达沙替尼(三角形)以及帕比司他与5nm的达沙替尼的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0510]
图6示出了作为单一物质治疗的帕比司他(正方形)和多柔比星(三角形)以及帕比司他与87nm或100nm的多柔比星的组合(圆形)在(a)hucct-1细胞系和(b)tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0511]
图7示出了作为单一物质治疗的帕比司他(正方形)和吉西他滨(三角形)以及帕比司他与12nm或1000nm的吉西他滨的组合(圆形)在(a)cc-sw-1细胞系和(b)tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0512]
图8示出了作为单一物质治疗的帕比司他(正方形)和甲氨蝶呤(三角形)以及帕比司他与24nm的甲氨蝶呤的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0513]
图9示出了作为单一物质治疗的帕比司他(正方形)和曲美替尼(三角形)以及帕比司他与8.8nm或1000nm的曲美替尼的组合(圆形)在(a)hucct-1细胞系和(b)tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0514]
图10示出了作为单一物质治疗的帕比司他(正方形)和托泊替康(三角形)以及帕比司他与24nm或120nm的托泊替康的组合(圆形)在(a)cc-sw-1细胞系和(c)tfk-1细胞系中的作用。(b)示出了作为单一物质治疗的托泊替康(正方形)和帕比司他(三角形)以及托泊替康与5.3nm的帕比司他的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0515]
图11示出了作为单一物质治疗的帕比司他(正方形)和bi 2536(三角形)以及帕比司他与490nm的bi 2536的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0516]
图12示出了作为单一物质治疗的帕比司他(正方形)和雷公藤内酯(三角形)以及帕比司他与30nm的雷公藤内酯的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0517]
图13示出了作为单一物质治疗的帕比司他(正方形)和达托里昔布(三角形)以及
帕比司他与80nm或2nm的达托里昔布的组合(圆形)分别在(a)egi-1细胞系和(b)tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0518]
图14示出了(a)作为单一物质治疗的帕比司他(正方形)和达珀利奈(三角形)以及帕比司他与23nm的达珀利奈的组合(圆形)在tfk-1细胞系中的作用;以及(b)作为单一物质治疗的达珀利奈(正方形)和帕比司他(三角形)以及达泊那肽与5.3nm的达珀利奈的组合(圆形)在cc-sw-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0519]
图15示出了作为单一物质治疗的帕比司他(正方形)和奥巴克拉甲磺酸盐(三角形)以及帕比司他与16nm的奥巴克拉甲磺酸盐的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0520]
图16示出了作为单一物质治疗的帕比司他(正方形)和sb-743921(三角形)以及帕比司他与6.4nm的sb-743921的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0521]
图17示出了作为单一物质治疗的帕比司他(正方形)和考布他汀a4(三角形)以及帕比司他与1000nm或100nm的考布他汀a4的组合(圆形)分别在(a)egi-1细胞系和(b)hucc-t1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0522]
图18示出了作为单一物质治疗的帕比司他(正方形)和伊斯平斯(三角形)以及帕比司他与75nm的伊斯平斯的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0523]
图19示出了作为单一物质治疗的帕比司他(正方形)和莫利布斯(三角形)以及帕比司他与1000nm的莫利布斯的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0524]
图20示出了作为单一物质治疗的帕比司他(正方形)和芦米司匹(三角形)以及帕比司他与56nm的芦米司匹的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0525]
图21示出了作为单一物质治疗的帕比司他(正方形)和培立替尼(三角形)以及帕比司他90nm的培立替尼的组合(圆形)在tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0526]
图22(a)和(b)分别示出了作为单一物质治疗的伊利司莫(正方形)和帕比司他(三角形)以及伊利司莫与5.3nm或14nm的帕比司他的组合(圆形)分别在cc-sw-1细胞系和egi-1细胞系中的作用。(c)和(d)分别示出了作为单一物质治疗的帕比司他(正方形)和伊利司莫(三角形)以及帕比司他与7nm或70nm的伊利司莫的组合(圆形)在hucc-t1细胞系和tfk-1细胞系中的作用。在药物添加后48小时测量细胞活力。ic50值以垂直线突出显示。
[0527]
实施例
[0528]
药物组合的实验方法和分析说明
[0529]
各种胆管癌(cca)细胞系用于该药物筛选。表1提供了用于实验的培养基和细胞数量的细节。
[0530]
表1:胆管癌细胞系的细胞培养条件
[0531]
细胞系细胞培养基细胞/孔
egi-1dmem高糖,10%的fcs,抗生素750hucc-t1rpmi glutamax,10%的fcs,抗生素750tfk-1rpmi glutamax,10%的fcs,抗生素500cc-sw-1rpmi glutamax,10%的fcs,抗生素500kmbcdmem高糖,10%的fcs,抗生素750cc-lp-1rpmi glutamax,10%的fcs,抗生素750kmch-1rpmi glutamax,10%的fcs,抗生素500
[0532]
胰蛋白酶消化和计数后,将单个细胞接种到greier 384孔组织培养处理的聚苯乙烯板(#781098)的10μl适当培养基中(准确的细胞数参见表1)。接种后的细胞在24小时内附着于板上,然后使用声学液体分配器(labcyte echo 550)加入适当体积的化合物,以便得到25μl总体积中0.1nm至1000nm(“剂量反应”)的单一药物浓度。孔中装入15μl的适当培养基并如上温育48小时。温育48小时后,用25μl的0.5
×
细胞titreglo发光活性试剂处理细胞。将细胞避光孵育10分钟,然后在synergy neo2读板仪上利用自动增益功能从顶部读取发光读数。
[0533]
对于作为单一物质治疗的帕比司他,使用七种胆管癌细胞系。然后在四种胆管癌细胞系上测试与23种其他药物联用的帕比司他。基于先前测定的在四种细胞系中的每一种上单独测试的组合药物的ic20值,加入单一浓度的组合药物。tfk-1细胞系对某些测试药物不敏感。如果不能计算ic20值,则选择100nm至1000nm的剂量用于组合试验(适用于卡铂、顺铂、吉西他滨、曲美替尼)。对于hucct-1细胞,曲美替尼的加入剂量为ic44=8.8nm,而不是ic20。
[0534]
数据分析
[0535]
来自cell titreglo测定的细胞活力对于每个测试的细胞系产生了576条剂量反应曲线(其中24条为使用dmso的单一疗法,552条为浓度为ic20的药物的组合)。
[0536]
实施例1:帕比司他对七种胆管癌细胞系的作用
[0537]
如上文方法部分中详细描述的,与dmso相比,作为单一物质治疗的帕比司他在七种不同的胆管癌细胞系上进行了测试。这些揭示了所有分析后的细胞系显示对帕比司他的应答(参见图1):五种细胞系显示约100nm的ic50,两种细胞系(cc-sw-1和egi-1)显示对帕比司他的较高敏感性,其中ic50为12nm或36nm(参见表2中的ic50值以及图1中的剂量反应曲线)。
[0538]
尽管作为单一物质有效,但通过与如下所述的其他癌症药物(实施例2至实施例22)联用,帕比司他功效有所提高。
[0539]
表2:七种胆管癌细胞系中帕比司他的ic50值
[0540]
细胞系细胞类型ic50(nm)cc-sw-1肝内胆管癌12hucc-t1肝内胆管癌90egi-1肝内胆管癌36cc-lp-1肝内胆管癌81tfk-1肝外胆管癌95kmbc肝外胆管癌88
kmch-1胆管癌和肝癌结合99
[0541]
实施例2:帕比司他与硼替佐米联用于hucct-1胆管癌细胞
[0542]
用帕比司他和低剂量硼替佐米的组合(1.3nm,ic20剂量的单一物质曲线)处理hucct-1细胞系,参见图2。关于组合药物测试的实验细节,请参考上述方法部分。
[0543]
实际上,帕比司他与硼替佐米的组合更有效,这突出表现在与1.3nm硼替佐米联用时,帕比司他的ic50值从作为单一物质治疗的90nm降低到51nm。因此,可以得出结论,与单一物质治疗相比,帕比司他联用硼替佐米显示出更高的功效。
[0544]
实施例3:帕比司他与卡铂联用于tfk-1胆管癌细胞
[0545]
关于组合药物测试的实验细节,请参考上述方法部分。有趣的是,作为单一物质治疗的卡铂(图3,三角形)对tfk-1细胞的细胞活力没有作用。然而,当将卡铂以1000nm的剂量添加至帕比司他时(图3,圆形),帕比司他的功效有所增加,如ic50值从70nm降低至26nm所示(图3)。因此,预期帕比司他与卡铂的组合比单独使用帕比司他显示出更好的胆管癌治疗效果。
[0546]
实施例4:帕比司他与顺铂联用于tfk-1胆管癌细胞
[0547]
作为单一物质治疗的顺铂(图4,三角形)对tfk-1没有作用。然而,向帕比司他中加入100nm的顺铂(ic50=42nm;图4,圆形)显示出比单独使用帕比司他(ic50=70nm;正方形)更高的功效,参见图4。关于组合药物测试的实验细节,请参考上述方法部分。因此,预期帕比司他与顺铂的组合将对胆管癌治疗具有更高的功效。
[0548]
实施例5:帕比司他与达沙替尼联用于tfk-1胆管癌细胞系
[0549]
关于组合药物测试的实验细节,请参考上述方法部分。作为单一物质的达沙替尼(图5,三角形)在tfk-1细胞中仅显示出有限的功效。有趣的是,添加低剂量达沙替尼(5nm,ic20剂量的单一物质曲线)会增加帕比司他的作用。这通过将ic50值从单独使用帕比司他(图5,正方形)的70nm向下移动到组合(图5,圆形)的39nm来说明。因此,从这些结果预期帕比司他和达沙替尼的组合对于胆管癌治疗具有比单独使用帕比司他更高的功效。
[0550]
实施例6:帕比司他与多柔比星联用于hucct-1胆管癌细胞和tfk-1胆管癌细胞
[0551]
关于组合药物测试的实验细节,请参考上述方法部分。hucct-1细胞系对帕比司他和多柔比星敏感,其中ic50值分别为90nm和158nm。与单独使用帕比司他(正方形)或多柔比星(三角形)相比,帕比司他与多柔比星的组合(图6a,圆形)显示出更好的应答,其中ic50值为44nm,参见图6a。
[0552]
tfk-1细胞系对帕比司他和多柔比星敏感,其中ic50值分别为70nm和123nm。与单独使用帕比司他(正方形)或多柔比星(三角形)相比,帕比司他与多柔比星的组合(图6b,圆形)显示出更好的应答,其中ic50值为40nm,参见图6b。
[0553]
因此,预期帕比司他与多柔比星的组合有益于胆管癌治疗。
[0554]
实施例7:帕比司他与吉西他滨联用于cc-sw-1胆管癌细胞系和tfk-1胆管癌细胞系关于组合药物测试的实验细节,请参考上述方法部分。cc-sw-1细胞系对帕比司他(图7a,正方形)和吉西他滨(图7a,三角形)都敏感,但尤其对帕比司他与12nm的吉西他滨的组合(图7a,圆形)敏感。与单独使用帕比司他的ic50值为12nm相比,该组合显示较低的ic50值,其值为3nm。
[0555]
有趣的是,tfk-1细胞系对作为单一物质治疗的吉西他滨不敏感。然而,与仅使用
帕比司他(ic50=70nm,见图7b)相比,向帕比司他加入吉西他滨(ic50=46nm)增加了功效。
[0556]
因此,在胆管癌治疗期间向帕比司他中加入吉西他滨会增加对细胞活力的作用。
[0557]
实施例8:帕比司他与甲氨蝶呤联用于tfk-1胆管癌细胞
[0558]
关于组合药物测试的实验细节,请参考上述方法部分。甲氨蝶呤(图8,三角形)对tfk-1细胞中的细胞活力仅有较小的作用。然而,与单独使用帕比司他(图8,正方形,ic50值为70nm)相比,向帕比司他加入24nm甲氨蝶呤(图8,圆形,ic50值为37nm)显示功效增加(参见图8)。预期对于胆管癌治疗有类似的效果。
[0559]
实施例9:帕比司他与曲美替尼联用于hucct-1胆管癌细胞系和tfk-1胆管癌细胞系
[0560]
关于组合药物测试的实验细节,请参考上述方法部分。曲美替尼(三角形,图9a和图9b)在hucct-1细胞和tfk-1细胞中都只显示出较小的功效。然而,在hucct-1细胞中向帕比司他加入低剂量曲美替尼(8.8nm)增加了帕比司他对细胞活力的作用。这通过将ic50值从单独使用帕比司他(图9a,正方形)的90nm移至联合治疗(圆形,图9a)的42nm来说明。
[0561]
类似地,通过将ic50值从70nm降低至31nm,曲美替尼与帕比司他的联合治疗在tfk-1细胞中也显示出比单独使用帕比司他更大的作用(图9b)。
[0562]
因此,预测帕比司他与曲美替尼的联合治疗在胆管癌治疗中显示出较大的作用。
[0563]
实施例10:帕比司他与托泊替康联用于cc-sw-1胆管癌细胞系和tfk-1胆管癌细胞系
[0564]
关于组合药物测试的实验细节,请参考上述方法部分。cc-sw-1细胞系对帕比司他与托泊替康的组合敏感,其中ic50值分别为12nm和54nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量托泊替康的组合(图10a,圆形)在cc-sw-1细胞中显示出更好的应答,其中ic50值为5.0nm,参见图10a。另外,与单独使用托泊替康(正方形)相比,托泊替康与固定剂量帕比司他的组合(图10b,圆形)在cc-sw-1细胞中也显示出更好的应答,其中ic50值为37nm,参见图10b。
[0565]
tfk-1细胞系还对帕比司他和托泊替康的组合敏感,其中ic50值分别为70nm和373nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量托泊替康的组合(图10c,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为28nm,参见图10c。
[0566]
因此,预期帕比司他与托泊替康的组合有益于胆管癌治疗。
[0567]
实施例11:帕比司他与bi 2536联用于tfk-1胆管癌细胞
[0568]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和bi 2536敏感,其中ic50值分别为70nm和80nm。与单独使用帕比司他(正方形)相比,帕比司他与bi 2536的组合(图11,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为38nm,参见图11。因此,预期帕比司他与bi 2536的组合有益于胆管癌治疗。
[0569]
实施例12:帕比司他与雷公藤内酯联用于tfk-1胆管癌细胞
[0570]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和雷公藤内酯敏感,其中ic50值分别为70nm和15nm。与帕比司他(正方形)相比,帕比司他与雷公藤内酯的组合(图12,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为64nm,参见图12。因此,预期帕比司他与雷公藤内酯的组合有益于胆管癌治疗。
[0571]
实施例13:帕比司他与达托里昔布联用于egi-1胆管癌细胞系和tfk-1胆管癌细胞
系
[0572]
关于组合药物测试的实验细节,请参考上述方法部分。egi-1细胞系对帕比司他和达托里昔布敏感,其中ic50值分别为99nm和99nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量达托里昔布的组合(图13a,圆形)在egi-1细胞中显示出更好的应答,其中ic50值为34nm,参见图13a。
[0573]
tfk-1细胞系还对帕比司他和达托里昔布敏感,其中ic50值分别为70nm和93nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量达托里昔布的组合(图13b,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为30nm,参见图13b。因此,预期帕比司他与达托里昔布的组合有益于胆管癌治疗。
[0574]
实施例14:帕比司他与达珀利奈联用于tfk-1胆管癌细胞系和cc-sw-1胆管癌细胞系
[0575]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和达托里昔布敏感,其中ic50值分别为70nm和73nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量达托里昔布的组合(图14a,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为48nm,参见图14a。
[0576]
另外,cc-sw-1细胞系对帕比司他和达珀利奈敏感,其中ic50值分别为12nm和8nm。达珀利奈与固定剂量帕比司他的组合(图14b,圆形)在tfk-1细胞中显示出更好的应答,与单独使用达珀利奈(正方形)的药物敏感性评分(dss)为17相比,组合的dss为34。因此,预期帕比司他和达珀利奈的组合有益于胆管癌治疗,参见图14b。
[0577]
实施例15:帕比司他与奥巴克拉甲磺酸盐联用于tfk-1胆管癌细胞
[0578]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和奥巴克拉甲磺酸盐敏感,其中ic50值分别为70nm和1523nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量奥巴克拉甲磺酸盐的组合(图15,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为52nm,参见图15。因此,预期帕比司他与奥巴克拉甲磺酸盐的组合有益于胆管癌治疗。
[0579]
实施例16:帕比司他与sb-743921联用于tfk-1胆管癌细胞系
[0580]
关于组合药物测试的实验细节,请参考上述方法部分。
[0581]
tfk-1细胞系还对帕比司他和sb-743921敏感,其中ic50值分别为70nm和8nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量sb-743921的组合(图16,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为37nm,参见图16。
[0582]
因此,预期帕比司他与sb-743921的组合有益于胆管癌治疗。
[0583]
实施例17:帕比司他与考布他汀a4联用于egi-1胆管癌细胞和hucc-t1胆管癌细胞
[0584]
关于组合药物测试的实验细节,请参考上述方法部分。egi-1细胞系对帕比司他敏感但对考布他汀a4不敏感,其中ic50值分别为99nm和>1000nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量考布他汀a4的组合(图17a,圆形)在egi-1细胞中显示出更好的应答,其中ic50值为52nm,参见图17a。
[0585]
hucc-t1细胞系也对帕比司他和考布他汀a4敏感,其中ic50值分别为90nm和11nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量考布他汀a4的组合(图17b,圆形)在hucc-t1细胞中显示出更好的应答,其中ic50值为53nm,参见图17b。
[0586]
因此,预期帕比司他与考布他汀a4的组合有益于胆管癌治疗。
[0587]
实施例18:帕比司他与伊斯平斯联用于tfk-1胆管癌细胞
[0588]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和伊斯平斯敏感,其中ic50值分别为70nm和11nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量伊斯平斯的组合(图18,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为45nm,参见图18。因此,预期帕比司他与伊斯平斯的组合有益于胆管癌治疗。
[0589]
实施例19:帕比司他与莫利布斯联用于tfk-1胆管癌细胞
[0590]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和莫利布斯敏感,其中ic50值分别为70nm和181nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量莫利布斯的组合(图19,圆形)在hucc-t1细胞中显示出更好的应答,其中ic50值为26nm,参见图19。因此,预期帕比司他与莫利布斯的组合有益于胆管癌治疗。
[0591]
实施例20:帕比司他与芦米司匹联用于tfk-1胆管癌细胞
[0592]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和芦米司匹敏感,其中ic50值分别为70nm和21nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量芦米司匹的组合(图20,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为11nm,参见图20。因此,预期帕比司他与芦米司匹的组合有益于胆管癌治疗。
[0593]
实施例21:帕比司他与培立替尼联用于tfk-1胆管癌细胞
[0594]
关于组合药物测试的实验细节,请参考上述方法部分。tfk-1细胞系对帕比司他和培立替尼敏感,其中ic50值分别为70nm和0.08nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量培立替尼的组合(图21,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为34nm,参见图21。因此,预期帕比司他与培立替尼的组合有益于胆管癌治疗。
[0595]
实施例22:帕比司他与伊利司莫联用于cc-sw-1胆管癌细胞系、egi-1胆管癌细胞系、hucc-t1胆管癌细胞系和tfk-1胆管癌细胞系
[0596]
关于组合药物测试的实验细节,请参考上述方法部分。cc-sw-1细胞系对帕比司他和伊利司莫敏感,其中ic50值分别为12nm和50nm。与单独使用伊利司莫(正方形)相比,帕比司他与固定剂量伊利司莫的组合(图22a,圆形)在cc-sw-1细胞中显示出更好的应答,其中ic50值为19nm,参见图22a。
[0597]
egi-1细胞系也对帕比司他和伊利司莫敏感,其中ic50值分别为99nm和34nm。与单独使用伊利司莫(正方形)相比,帕比司他与固定剂量伊利司莫的组合(图22b,圆形)在egi-1细胞中显示出更好的应答,其中ic50值为19nm,参见图22b。
[0598]
hucc-t1细胞系也对帕比司他和伊利司莫敏感,其中ic50值分别为90nm和9nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量伊利司莫的组合(图22c,圆形)在hucc-t1细胞中显示出更好的应答,其中ic50值为46nm,参见图22c。
[0599]
tfk-1细胞系也对帕比司他和伊利司莫敏感,其中ic50值分别为70nm和35nm。与单独使用帕比司他(正方形)相比,帕比司他与固定剂量伊利司莫的组合(图22d,圆形)在tfk-1细胞中显示出更好的应答,其中ic50值为24nm,参见图22d。因此,预期帕比司他与伊利司莫的组合有益于胆管癌治疗。
[0600]
实施例23:包含帕比司他和达沙替尼的胶囊
[0601]
帕比司他(纯度为99%)可购自中国山东三瑞科技有限公司。或者,帕比司他乳酸
盐可以根据wo2007146716(通过引用方式并入本文)由帕比司他和乳酸产生。达沙替尼一水合物(纯度≥99.0%)可购自中国北京屹柏生物科技有限公司。
[0602]
如下所述制备包含帕比司他和达沙替尼的胶囊:
[0603]
组分
[0604]
帕比司他乳酸盐(相当于15g帕比司他)
[0605]
达沙替尼一水合物(相当于50g达沙替尼)
[0606]
1g硬脂酸镁
[0607]
50g甘露醇
[0608]
适量微晶纤维素,最多500g
[0609]
在混合器中按体积混合各组分并填充到1000粒0号硬明胶胶囊中。每粒胶囊包含15mg帕比司他和50mg达沙替尼。
[0610]
实施例24:包含两种不同药物制剂的药物产品
[0611]
帕比司他(纯度为99%)可购自中国山东三瑞科技有限公司。或者,帕比司他乳酸盐可以根据wo2007146716(通过引用方式并入本文)由帕比司他和乳酸产生。
[0612]
制备类似于15mg的farydak(诺华公司)的胶囊。
[0613]
胶囊被包装在泡罩中(每个泡罩有6个胶囊)。
[0614]
达沙替尼一水合物(纯度≥99.0%)可购自中国北京屹柏生物科技有限公司。
[0615]
制备类似于50mg的sprycel(百时美施贵宝公司)的片剂。
[0616]
片剂被包装在泡罩中(每个泡罩有6片)
[0617]
泡罩(5个片剂泡罩和5个胶囊泡罩)与包装说明书一起包装在药品包装中。
[0618]
实施例25:帕比司他与细胞毒性剂联用与帕比司他单一疗法相比在正常胆管细胞中毒性降低
[0619]
检查了各种细胞毒性剂对正常胆管细胞中帕比司他毒性的作用。h69细胞系(cvcl_8121)用于上述实验方法中以测定当与以ic20浓度加入细胞中的细胞毒性剂(次要药物)联用时这些细胞中帕比司他(主要药物)的ic50值。
[0620]
使用δic50测量来定量次要药物的作用,其计算方法为单独使用帕比司他的ic50减去帕比司他组合的ic50。正数表明该组合比单独使用帕比司他毒性更大。差异越大,组合的毒性越大。负的δic50表明该组合比单一疗法毒性小。结果如下所示:
[0621][0622]
结果表明,经测试的次要药物降低了帕比司他在正常胆管细胞中的毒性。
[0623]
实施例26:帕比司他与其他细胞毒剂联用与帕比司他单一疗法相比的治疗指数
[0624]
通过比较组合和单一疗法(即,单独使用帕比司他)在正常胆管细胞(h-69细胞系)和如上所述的各种胆管癌细胞系中的作用确定各种帕比司他联合疗法的治疗指数。当单独使用或与以ic20浓度加入细胞的细胞毒性剂(次要药物)联用时,使用上述实验方法测定细胞中帕比司他(主要药物)的ic50值。
[0625]
治疗指数(ti)是指正常细胞中的ic50与胆管癌细胞系中的ic50的比率。ti大于1表明相对于正常细胞该疗法在降低胆管癌细胞的活力方面是有效的。ti高(例如1.5或更高)表明正常细胞和癌细胞之间在效力上有很大差异,即该疗法显示了相对于正常细胞对癌细胞的高选择性。联合疗法的ti比单一疗法的ti更高表明联合疗法比单一疗法对癌细胞更具选择性。结果如下所示(ic50值以nm计):
[0626]
[0627][0628]
[0629][0630]
这些结果表明,经测试的帕比司他联合疗法可能对与cc-sw-1细胞系共有特征的胆管癌肿瘤特别有效。然而,数据鉴定了在其他细胞系中有效的联合疗法。例如,曲美替尼与多柔比星的联合疗法在cc-sw-1细胞系中特别有效。曲美替尼与托泊替康的联合疗法在egi-1细胞系中特别有效。曲美替尼与卡铂的联合疗法在hucct-1细胞系中特别有效。与达沙替尼、甲氨蝶呤、达托里昔布、托泊替康和曲美替尼的联合疗法在tfk-1细胞系中特别有效。
[0631]
实施例27:调节胆管癌细胞系中帕比司他的ic50的帕比司他联合疗法
[0632]
本文所述的实验数据用于鉴定在促进胆管癌细胞中帕比司他的作用方面特别有效的细胞毒性剂。通过测定δic50来鉴定各个组合,其中正δic50越高代表该组合越有效。下表示出了绝对δic50(nm)和呈百分比的相对变化。
[0633]
[0634]
[0635][0636]
下表表明并非所有组合在所有细胞系中均有效,即一些组合在一些细胞系中显示对帕比司他毒性的负面作用,如负δic50值所示。
[0637][0638]
实施例28:帕比司他与伊利司莫组合指数的测定
[0639]
数据归一化和曲线拟合
[0640]
来自ctg测定的细胞活力对于每个测试的细胞系产生了x条剂量反应曲线(其中y条为使用dmso的单一疗法,z条为浓度为ic20的药物的组合)。将每个板的活力数据归一化为0.1%dmso的八个重复测定值和100um苄索氯铵(bzcl)的七个重复测定值的平均值。bzcl作为细胞杀伤对照,其解释了ctg发光测定中来自死亡细胞的背景信号。根据以下等式将原始发光数据归一化:
[0641][0642]
然后使用r包drc的drm函数拟合每个剂量反应曲线的归一化数据。该函数使用四参数对数-逻辑曲线来拟合剂量反应数据,得到曲线最小值、曲线最大值、ic50值和斜率值。在对数-逻辑曲线不能拟合数据的情况下,使用逻辑曲线。ic50对应于在50%响应下计算的曲线最大值和曲线最小值之间的浓度,因此是相对ic50值。
[0643]
对数-逻辑函数:
[0644]
逻辑函数:
[0645]
协同得分计算
[0646]
按照loewe加和法、bliss独立法和零相互作用潜力(zip)法,计算单一疗法剂量反应相对于各药物组合的组合剂量反应的协同得分。这些方法基于组合中所使用药物的单一疗法反应计算预测反应。然后从这些预测反应中减去各组合的测量反应以产生每个测试浓度的协同得分;正的得分表示协同作用而负的得分表示拮抗作用。
[0647]
loewe协同
[0648]
使用显式法计算loewe协同值。对于组合中的每种药物,预测反应由该药物单独在等于组合中的两种药物的剂量总和的剂量下的反应计算。然后将每种药物的预测反应平均化并从该平均值中减去在测量浓度下观察到的值以产生协同得分。
[0649][0650]
其中是使用药物1单一疗法在浓度为x1的药物1和浓度为x2的药物2的浓度总和下的曲线拟合计算的反应,是使用药物2单一疗法在药物1和药物2的相同浓度总和下的曲线拟合计算的反应,是药物1和药物2在它们各自剂量x1和x2的组合的测量反应。在项或者为》100或《0的情况下,它们分别被设为100和0。
[0651]
当联合使用的药物靶向相同的途径时,优选loewe加和模型,因为预期它们具有加和作用。
[0652]
bliss协同
[0653]
通过将组合中各测试浓度的各药物的单一疗法反应相乘来计算使用bliss模型产生的预测反应。然后从这些预测值中减去在这些浓度下测量的反应以产生协同得分。
[0654][0655]
其中是来自药物1单一疗法在剂量x1下的曲线拟合的反应,是来自药物2单一疗法在剂量x2下的曲线拟合的反应,是药物1和药物2在它们各自剂量x1和x2下的组合的测量反应。在项或中任一项或两项为》100或《0的情况下,它们分别被设定为100和0。
[0656]
当联合使用的药物靶向不同的途径时,优选bliss独立模型,因为预期它们具有独立作用。
[0657]
zip协同
[0658]
根据上述bliss方法计算使用zip模型产生的预测反应。将观察到的组合的反应拟合到对数-逻辑函数,设定曲线最大值为在相关剂量下ic20药物单一疗法的相应反应。然后从预测反应中减去这些拟合的组合值以产生协同得分。
[0659][0660]
其中是来自药物1单一疗法在剂量x1下的曲线拟合的反应,是来自药
物2单一疗法在剂量x2下的曲线拟合的反应,是使用药物1与固定剂量药物2的曲线拟合计算的反应,其中上限参数设定为药物2单一疗法在剂量x2下的反应。在项或中任一项或两项为》100或《0的情况下,它们分别被设定为100和0。
[0661]
创建zip模型以整合bliss模型和loewe模型。
[0662]
如本文所述测定帕比司他和伊利司莫的组合指数。下表示出了该组合在三种细胞系中显示出协同作用,即组合指数小于1。
[0663]
帕比司他浓度(nm)伊利司莫浓度(nm)细胞系组合指数0.120ccsw10.3120ccsw10.6320ccsw10.71020ccsw10.70.120egi10.5120egi10.5320egi10.51020egi10.73020egi10.710020egi10.60.17hucct0.417hucct0.537hucct0.6107hucct0.7
[0664]
实施例29:细胞系的基因组序列
[0665]
对本文所用的细胞系进行全基因组测序以鉴定对细胞系特异并且预期可能出现在胆管癌肿瘤中的遗传标志物(突变)。下表示出了在细胞系中的与civic数据库和癌症生物标志物数据库中的预测性、预后性、诊断性和易感性生物标志物相关的标志物、在已知的癌症突变热点中发现的编码突变,该突变预测为癌症驱动突变或被选为在致癌基因或肿瘤抑制基因中发现的致病突变和编码突变。
[0666]
[0667]
[0668][0669]
实施例30:小鼠异种移植研究
[0670]
细胞培养
[0671]
根据标准条件培养正常人胆管细胞系(h69)和各种人胆管癌细胞系(hucct、cc-sw1、egi-1和tfk-1)。
[0672]
小鼠实验
[0673]
所有小鼠实验都是按照挪威研究中动物使用伦理委员会批准的方案进行的。将动物饲养在具有温控环境的笼中。动物可以自由地获得标准饲料和水。亮/暗周期是12小时/12小时。将细胞悬浮液皮下注射到裸鼠中。
[0674]
在施用细胞悬浮液后10天,证实肿瘤有所生长。将小鼠分成5组(每组10只动物);第一组不进行活性治疗,第二组进行药物a治疗,第三组进行药物b治疗,第四组进行药物a与药物b的联合治疗,第五组进行基于吉西他滨的联合疗法。所有动物都可以自由地获得饲料和水。
[0675]
如果药物是经监管批准的药物,则以与临床用于治疗其他癌症疾病相同的剂量(每kg)和剂量频率并以相同的方式施用这些药物。使用剂量最高和给药最频繁的施用方式。如果药物是实验药物(即,目前未经批准的药物),则以与现有技术文献中用于治疗癌症相同的剂量(每kg)和剂量频率并以相同的方式施用这些药物。
[0676]
在整个治疗期间每周测定肿瘤体积。一些小鼠在治疗期间接受超声检查和/或核磁共振(mri)检查以观察肿瘤生长。50天后根据标准方法将小鼠麻醉并处死。取出肿瘤,称重并保存在冰箱中以进一步分析。
[0677]
预期结果表明,某些药物组合对于异种移植裸鼠模型中的人胆管癌的治疗是非常有效的。预期体内功效与体外细胞系功效密切相关。
[0678]
实施例31:在胆管癌患者中使用药物a和药物b联合疗法作为二线疗法的临床方案
[0679]
单臂、开放标记、非随机、探索性、多中心试验性研究。药物a和药物b是经监管批准用于其他癌症适应症的药物。
[0680]
30名参与者
[0681]
入选标准:
[0682]
·
组织学或细胞学证实确诊为胆管癌的患者
[0683]
·
影像学可测量疾病(根据recist v1.1标准)
[0684]
·
先前用基于吉西他滨的一线疗法治疗的患者
[0685]
·
年龄:18岁至80岁,男性或女性
[0686]
·
服用避孕药的女性(如果相关)
[0687]
排除标准:
[0688]
·
哺乳期或妊娠期妇女
[0689]
·
严重的心功能障碍
[0690]
·
高血压(收缩压≥150mmhg或舒张压≥100mmhg)
[0691]
·
丙型肝炎阳性和/或人类免疫缺陷病毒(hiv)阳性和/或新型冠状病毒肺炎(covid-19)阳性
[0692]
·
原发性硬化性胆管炎和/或炎性肠病和/或自身免疫性疾病
[0693]
·
全身性感染的活性药物治疗。
[0694]
·
有对联用药物或与联用药物具有相同作用机制的药物的过敏史或严重不良事件。
[0695]
·
有物质滥用史,包括酒精滥用和/或药物滥用。
[0696]
·
器官功能不足
[0697]
ο绝对嗜中性粒细胞计数(anc)<1,000/mm3〔1.0
×
109/l〕
[0698]
ο血小板<75,000/mm3〔75
×
109/l〕
[0699]
ο血红蛋白<109.0g/dl
[0700]
ο总胆红素>1.5
×
uln
[0701]
ο存在肝转移时,天冬氨酸转氨酶/谷草转氨酶/got(ast/sgot)和丙氨酸转氨酶/谷丙转氨酶/gpt(alt/sgpt)>2.5
×
uln(ast和alt)>5
×
正常值上限(uln)
[0702]
ο血清肌酸酐>1.5
×
uln,经计算或测量的肌酸酐清除率<45ml/min
[0703]
ο无机磷超出正常范围
[0704]
ο血清总钙和血清离子钙超出正常范围
[0705]
可应用其他方案定义的入选/排除标准
[0706]
给药
[0707]
药物以用于治疗其他癌症形式的经批准的可接受最高剂量的50%单独给药。各药物以与用于其他适应症的药物相同的方式和相同的频率给药。两种药物优选一起给药。
[0708]
持续时间
[0709]
向每个患者给药长达24个月。
[0710]
结局指标
[0711]
主要目标:
[0712]
·
客观缓解率(orr)[时间范围:长达24个月]
[0713]
定义为根据1.1版实体瘤疗效评价标准(recist v1.1)每个队列中达到完全缓解(cr)或部分缓解(pr)的参与者的比例。
[0714]
次要目标:
[0715]
·
无进展生存期(pfs)[时间范围:长达24个月]
[0716]
定义为每个队列中从首次给药直至疾病进展(根据recist v1.1标准)或死亡(以先者为准)的时间。中位无进展生存期。
[0717]
·
缓解持续时间(dor)[时间范围:长达24个月]
[0718]
定义为从cr或pr首次评估日期直至每个队列中首个疾病进展(根据recist v1.1标准)或死亡(以先者为准)的日期的时间。
[0719]
·
最佳总疗效[时间范围:长达24个月]
[0720]
最佳总疗效将通过具有pr、cr、疾病稳定(sd)或pd的最佳总疗效的患者的比例进行汇总。
[0721]
·
疾病控制率(dcr)[时间范围:长达24个月]
[0722]
定义为根据recist v1.1标准获得cr、pr或疾病稳定的最佳总疗效的参与者的比例。
[0723]
·
总生存期(os)[时间范围:长达24个月]
[0724]
定义为每个队列中从研究药物的首次给药到任何原因导致死亡的时间。
[0725]
中位总生存期。
[0726]
·
治疗相关不良事件的数目[时间范围:长达24个月]
[0727]
首次报道的不良事件和严重不良事件、类型和频率,或在首次给药研究药物/治疗后预先存在的事件的恶化。
[0728]
·
生活质量-生活质量分析。参见:(https://www.eortc.org/app/uploads/sites/2/2018/08/specimen-qlq-c30-english.pdf)
[0729]
实施例32:在胆管癌患者中使用药物a与药物b联合疗法和吉西他滨与顺铂治疗的临床方案
[0730]
双臂、双盲随机化、多中心临床iii期研究。
[0731]
药物x和药物y是经监管批准用于其他癌症适应症的药物。
[0732]
80名参与者。
[0733]
臂a:使用药物a和药物b的联合疗法(40名参与者)
[0734]
臂b:根据经监管批准的可接受剂量施用吉西他滨(1000mg/m2)并根据经监管批准的可接受剂量施用顺铂(25mg/m2)。
[0735]
入选标准:
[0736]
·
组织学或细胞学证实确诊为胆管癌的患者
[0737]
·
影像学可测量疾病(根据recist v1.1标准)
[0738]
·
年龄:18岁至80岁,男性或女性
[0739]
·
服用避孕药的女性(如果相关)
[0740]
排除标准:
[0741]
·
哺乳期或妊娠期妇女
[0742]
·
严重的心功能障碍
[0743]
·
高血压(收缩压≥150mmhg或舒张压≥100mmhg)
[0744]
·
丙型肝炎阳性和/或人类免疫缺陷病毒(hiv)阳性和/或新型冠状病毒肺炎(covid-19)阳性
[0745]
·
原发性硬化性胆管炎和/或炎性肠病和/或自身免疫性疾病
[0746]
·
全身性感染的活性药物治疗。
[0747]
·
有对联用药物或与联用药物具有相同作用机制的药物的过敏史或严重不良事件。
[0748]
·
有物质滥用历史,包括酒精滥用和药物滥用。
[0749]
·
器官功能不足
[0750]
ο绝对嗜中性粒细胞计数(anc)<1,000/mm3〔1.0
×
109/l〕
[0751]
ο血小板<75,000/mm3〔75
×
109/l〕
[0752]
ο血红蛋白<109.0g/dl
[0753]
ο总胆红素>1.5
×
uln
[0754]
ο存在肝转移时,天冬氨酸转氨酶/谷草转氨酶/got(ast/sgot)和丙氨酸转氨酶/谷丙转氨酶/gpt(alt/sgpt)>2.5
×
uln(ast和alt)>5
×
正常值上限(uln)
[0755]
ο血清肌酸酐>1.5
×
uln,经计算或测量的肌酸酐清除率<45ml/min
[0756]
ο无机磷超出正常范围
[0757]
ο血清总钙和血清离子钙超出正常范围
[0758]
可应用其他方案定义的入选/排除标准
[0759]
给药
[0760]
探索性研究结果形成了联用药物剂量的基础。没有相关指导。联用药物以用于治疗其他癌症形式的经批准的可接受最高剂量的50%单独给药。各药物以与用于其他适应症的药物相同的方式和相同的频率给药。两种药物优选一起给药。
[0761]
持续时间
[0762]
向每个患者给药24个月。
[0763]
结局指标
[0764]
主要目标:
[0765]
·
客观缓解率(orr)[时间范围:长达24个月]
[0766]
定义为根据1.1版实体瘤疗效评价标准(recist v1.1)每个队列中达到完全缓解(cr)或部分缓解(pr)的参与者的比例。
[0767]
次要目标:
[0768]
·
无进展生存期(pfs)[时间范围:长达24个月]
[0769]
定义为每个队列中从首次给药直至疾病进展(根据recist v1.1标准)或死亡(以先者为准)的时间。中位无进展生存期。
[0770]
·
缓解持续时间(dor)[时间范围:长达24个月]
[0771]
定义为从cr或pr首次评估日期直至每个队列中首个疾病进展(根据recist v1.1标准)或死亡(以先者为准)的日期的时间。
[0772]
·
最佳总疗效[时间范围:长达24个月]
[0773]
最佳总疗效将通过具有pr、cr、疾病稳定(sd)或pd的最佳总疗效的患者的比例进行汇总。
[0774]
·
疾病控制率(dcr)[时间范围:长达24个月]
[0775]
定义为根据recist v1.1标准获得cr、pr或疾病稳定的最佳总疗效的参与者的比例。
[0776]
·
总生存期(os)[时间范围:长达24个月]
[0777]
定义为每个队列中从研究药物的首次给药到任何原因导致死亡的时间。中位总生存期。
[0778]
·
治疗相关不良事件的数目[时间范围:长达24个月]
[0779]
首次报道的不良事件和严重不良事件、类型和频率,或在首次给药研究药物/治疗后预先存在的事件的恶化。
[0780]
·
生活质量-生活质量分析。参见:(https://www.eortc.org/app/uploads/sites/2/2018/08/specimen-qlq-c30-english.pdf)
[0781]
实施例33:参考实施例-包含吉西他滨与顺铂的联合疗法的作用分析
[0782]
吉西他滨与顺铂的组合是目前胆管癌的常用治疗方法(参见https://www.legemiddelhandboka.no/t2.2.1.4/galleveiscancer and juan valle et al,annals of oncology 25:391
–
398,2014)。
[0783]
使用上述实验方法测试该组合。使用吉西他滨作为主要药物的组合的治疗指数结果如下所示。
[0784][0785]
吉西他滨单一疗法是一种优选的胆管癌治疗方法。吉西他滨在cc-sw-1、egi-1、hucct和tfk-1中的单一疗法数据表明,正常细胞的ic50值远低于所有胆管癌细胞系的ic50值。治疗指数分别为0.4、0.4、0.4和0.2。这表明施用吉西他滨不是一种良好的胆管癌治疗方法。
[0786]
施用吉西他滨加顺铂的药物组合也是一种优选的胆管癌临床治疗方法。cc-sw-1细胞系和tfk-1细胞系的组合指数数据表明治疗指数有一定的改善。然而,对于egi-1细胞系,向吉西他滨中加入顺铂破坏了吉西他滨的作用。该组合对hucct细胞系没有治疗作用。
[0787]
实施例34:在至少一种胆管癌细胞系中显示协同作用的帕比司他联合疗法
[0788]
下表显示了帕比司他联合疗法在至少一种胆管癌细胞系中表现出协同作用。
[0789][0790]
总之,本发明人已经进行了抗癌药物及其组合的广泛测试。在这方面,目前有数千种已知化合物具有一些针对一种或多种癌症形式的经报道的活性。为了得到本文所述的结果,本发明人首先选择了包含384种化合物的合适化合物库。这样的化合物库将产生120,000多种包含两种物质的不同组合。通过广泛测试单一化合物和化合物组合,本发明人已经鉴定出20种对本文测试的细胞系中的至少一种显示出良好功效的组合。这一数目约为基于384种不同化合物的初始选择的理论组合数的0.02%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1