肝脏前体细胞、其制备方法以及在阿尔茨海默病治疗中的用途
本发明涉及阿尔茨海默病的治疗领域。具体地,本发明涉及肝脏前体细胞的分离、培养方法,以及其在治疗阿尔茨海默病中的用途。
背景技术:
阿尔茨海默病(alzheimer’sdisease,ad)是一种渐进性的神经系统退行性疾病,最早由德国巴伐利亚精神病学家和神经学家aloisalzheimer于1907年首次描述提出。临床上以记忆力减退、认知能力下降和精神行为异常等痴呆表现为特征,已成为老年痴呆的主要病因,且以其极高的病死率和致残率严重影响着老年人的日常生活。目前,全世界有5000万ad患者,且发病率呈现出逐年上升,预计2050年,全球患者将达到1.52亿。老年人在65岁以后ad发病率每5年上升一倍。目前我国65岁以上老龄人口ad患病率为3-4%。随着我国社会老龄化日益加剧,ad患者也越来越多。ad病理特征有大脑皮层及海马区的β淀粉样肽(β-amyloidpeptide,aβ)在胞外沉积并形成老人斑(senileplaque,sp)、脑神经细胞内tau蛋白异常聚集形成的神经原纤维缠结(neurofibrillarytangle,nft)、神经元突触功能异常及锥体神经细胞丢失等,其中aβ沉积是其最直接的病理表现。现代科学认为阿尔茨海默病是基因和环境因素共同作用的结果,其中基因起着主要作用。有许多假说可以解释ad的发病机理,包括淀粉样蛋白级联反应,tau蛋白过度磷酸化,神经递质和氧化应激。但是,根本原因和最佳治疗方案仍然难以捉摸。目前,临床上有一些药物(主要是碱酯酶抑制剂和n-甲基-d-天冬氨酸(nmda)受体拮抗剂)可以改善ad的症状,但这些药物仅能在病情初期改善病人的一些症状,不能阻止病程进展,长期服用后有效时间缩短,且对部分病人有较大的副作用。
近些年来,越来越多的研究者不再把精神类等脑部的疾病仅仅看作是脑中的病变,而是从外周与脑部的相互作用出发来看待问题。已有的研究认为,除中枢自身清除aβ外,脑部的aβ还可能通过血脑屏障转运、脑组织间液流出以及脑脊液吸收进入淋巴等途径由中枢进入外周进行清除,这些过程即是aβ的外周清除,在这一过程中肝脏是重要的参与者。有研究报道,通过增强肝脏对aβ的代谢能力,脑内的aβ水平可显著降低,并改善ad小鼠的病理和认知功能。
肝对于身体的内稳态具有至关重要的作用,从消化道尤其小肠吸收的营养物质首先通过门静脉进入肝脏,肝脏除了代谢的功能外同时行使解毒的功能,大量因素可以影响肝,如病毒、毒物、代谢物、免疫攻击等,从而导致肝炎、纤维化、肝硬化、肝癌甚至最终死亡。对于终末期肝病,唯一有效的方法就是肝移植,但在世界范围内存在一个器官短缺问题,还有免疫排斥问题。直接移植肝细胞也可以治疗肝病,但肝细胞的长期应用效率不高,培养困难,所以干细胞的移植就成为了一种很有前途的手段。可用的干细胞有胚胎干细胞,间充质干细胞,诱导多能干细胞,骨髓干细胞等,而近些年对肝脏前体细胞(hepaticprogenitorcells,hpcs)的研究为肝病治疗提供了新的手段。
hpcs是肝脏中的成体干细胞,成体干细胞是存在于已经分化的组织器官中的未分化细胞,具有自我更新的能力,并在一定条件下可以分化为各种特异的细胞类型,最早对成体干细胞的研究起始于20世纪60年代对造血干细胞(hematopoieticstemcells,hscs)的研究,成体干细胞应用研究是再生医学的重要组成部分。早在1958年,wilson和leduc发现了肝脏中的双潜能前体细胞可以分化为肝实质细胞或胆道上皮细胞。hpcs在健康肝脏中的含量是极少的,这一点与小肠上皮的前体细胞或毛囊的前体细胞处于持续分裂增殖有很大不同。但当肝脏受到持续慢性损伤时(如四氯化碳腹腔注射,胆管结扎,蛋氨酸及胆碱缺乏饮食等),hpcs才会大量激活并增殖。hpcs可以分化为肝实质细胞或胆管上皮细胞,参与肝脏再生;可以修复受慢性毒性损伤的肝脏,体外扩增培养后回体注射,可使得修复效果更加显著;hpcs或可用于体外构建肝脏类器官,彻底解决器官移植短缺的问题。
技术实现要素:
在本发明的第一方面,本发明提供了肝脏前体细胞在制备用于治疗患有阿尔茨海默病的患者的药物中的用途;优选地,所述患者是哺乳动物,优选为人、牛、猪、马、羊、猴、狗、猫、大鼠、小鼠和豚鼠。
本发明中的肝脏前体细胞是肝脏中的成体干细胞,其存在于已经分化的组织器官中的未分化细胞,具有自我更新的能力,并在一定条件下可以分化为各种特异的细胞类型。
在一些实施方案中,本发明的所述肝脏前体细胞表达表面标志物cd133、epcam和ck19。
在一些实施方案中,本发明的所述肝脏前体细胞通过修复和改善肝脏功能来实现治疗阿尔茨海默病的效果。
在本发明的第二方面,本发明提供了一组药物组合物在制备用于治疗患有阿尔茨海默病的患者的药物中的用途,其中所述药物组合物包含1×104至1×1010之间的肝脏前体细胞,以及药学上可接受的载体、赋性剂和/或佐剂。
在优选的实施方案中,本发明的药物组合物中包含约1×104、约1×105、约1×106、约1×107、约1×108、约1×109、约1×1010、或这些点值之间的任何范围的肝脏前体细胞,优选地,所述肝脏前体细胞溶解在生理上可接受的溶剂中,包括但不限于,生理盐水或pbs。
可以通过适合于递送本发明组合物或药物的任何途径进行施用。因此,递送途径可包括静脉内、肌肉内、腹膜内或皮下递送。
在一些实施方案中,本发明的肝脏前体细胞是一种成体干细胞,优选地,其可来源于哺乳动物的受损肝脏;优选地,所述哺乳动物选自人、牛、猪、马、羊、猴、狗、猫、大鼠、小鼠和豚鼠。
在一些实施方案中,本发明所述的受损肝脏选自脂肪肝、肝纤维化、肝硬化、药物或毒物造成的肝损伤、胆管堵塞造成的胆损伤、和蛋氨酸及胆碱缺乏饮食缺乏造成的肝损伤;优选地,所述药物或毒物造成的肝损伤包括四氯化碳和/或ddc造成的肝损伤。
在另一方面,本发明提供了一种体外获得肝脏前体细胞的方法,所述方法包括以下步骤:
1)获得受损肝脏,
2)将所述受损肝脏分离为单细胞,
3)以cd133和epcam为表面标记物进行流式细胞仪分选,获得肝脏前体细胞,和
4)在适当的培养基和适当的培养条件下,培养所述肝脏前体细胞。
在一些实施方案中,所述培养基为包含胎牛血清、肝生长因子、表皮生长因子、尼克酰胺、胰岛素、β-巯基乙醇、庆大霉素、glutamax和青霉素和链霉素的dmem/f12高糖培养基;优选地,在所述培养基中,dmem/f12高糖培养基约占总体积87%,胎牛血清占总体积10%,肝生长因子40ng/ml,表皮生长因子40ng/ml,尼克酰胺1mg/ml,胰岛素10μg/ml,β-巯基乙醇0.1mmol/l,庆大霉素50mg/ml,glutamax占总体积1%,青霉素和链霉素占总体积1%。
在一些实施方案中,所述适当的培养条件为在37℃,5%二氧化碳下培养。
在一些是实施方案中,本发明提供了一种体外获得肝脏前体细胞的方法,所述方法包括以下步骤:
1)向哺乳动物口服施用ddc,所述哺乳动物包括但不限于牛、猪、马、羊、猴、狗、猫、大鼠、小鼠和豚鼠,
2)获得受损肝脏,
3)将所述受损肝脏分离为单细胞,
4)以cd133和epcam为表面标记物进行流式细胞仪分选,获得肝脏前体细胞,和
5)在适当的培养基和适当的培养条件下,培养所述肝脏前体细胞。
本发明进一步提供了根据本发明的方法获得的肝脏前体细胞在制备用于治疗患有阿尔茨海默病的患者的药物中的用途。
术语
本文中使用的术语“阿尔茨海默病(ad,alzheimer’sdisease)”,又称老年痴呆症,是一种渐进性的神经系统退行性疾病。临床上以记忆力减退、认知能力下降和精神行为异常等痴呆表现为特征,已成为老年痴呆的主要病因,且以其极高的病死率和致残率严重影响着老年人的日常生活。。
术语“β-淀粉样肽(aβ,β-amyloidpeptide)”,由β淀粉样前体蛋白(β-amyloidprecursorprotein,app)水解而来,由多种细胞产生,循环于血液、脑脊液和脑间质液中,大多与伴侣蛋白分子结合,少数以游离状态存在。最常见的亚型是aβ40和aβ42。aβ42具有更强的毒性,更容易聚集,从而形成aβ沉淀的核心,引发神经毒性作用。
术语“老人斑(sp,senileplaque)”,是高龄人脑出现的异常结构,银染见处突起的聚合物。
术语“神经原纤维缠结(nft,neurofibrillarytangle)”,是指神经原纤维增粗扭曲形成缠结,银染电镜下证实为双螺旋缠绕的细丝构成,多见于较大的神经元,尤以海马、杏仁核、颞叶内侧、额叶皮质的椎体细胞最为多见,这一变化是神经元趋于死亡的标志。是引发老年性痴呆的第二个主要病理学变化。
术语“tau蛋白”,是含量最高的微管相关蛋白,微管系统是神经细胞骨架成分,可参与多种细胞功能。微管由微管蛋白及微管相关蛋白组成。正常脑中tau蛋白的细胞功能是与微管蛋白结合促进其聚合形成微管;与形成的微管结合,维持微管稳定性,降低微管蛋白分子的解离,并诱导微管成束。
术语“n-甲基-d-天冬氨酸(nmda,n-methyl-d-asparticacid)”,是动物机体中天然存在的一种氨基酸衍生物,为哺乳动物中枢神经系统中重要的兴奋性神经递质l-谷氨酸同系物。
如本文中使用的术语,“肝脏前体细胞hpcs(hepaticprogenitorcells)”是肝脏中的成体干细胞,成体干细胞是存在于已经分化的组织器官中的未分化细胞,具有自我更新的能力,并在一定条件下可以分化为各种特异的细胞类型。在肝脏受到持续慢性损伤时(如四氯化碳腹腔注射、胆管结扎、蛋氨酸及胆碱缺乏饮食等),会大量激活并增殖的细胞。hpcs可以分化为肝实质细胞或胆管上皮细胞,参与肝脏再生。
造血干细胞(hscs,hematopoieticstemcells),是血液系统中的成体干细胞,是一个异质性的群体,具有长期自我更新的能力和分化成各类成熟血细胞的潜能。
如本文中使用的术语,“绿色荧光蛋白(gfp,greenfluorescentprotein)”,是一个由约238个氨基酸组成的蛋白质,从蓝光到紫外线都能使其激发,发出绿色萤光。虽然许多其他海洋生物也有类似的绿色荧光蛋白,但传统上,绿色荧光蛋白(gfp)指首先从维多利亚多管发光水母中分离的蛋白质。
ddc(3,5-diethoxycarbonyl-1,4-dihydrocollidine)3,5-二乙氧羰基-1,4-二氢可立丁,一种肝毒性化合物。
如本文使用的术语“磷酸盐缓冲液(pbs,phosphatebuffersaline)”,是一种常用的用于生物学研究的缓冲溶液,是一种水基盐溶液,含磷酸二氢钾,磷酸氢二钠,氯化钠和氯化钾,主要用于保持恒定的ph值以及等渗。
术语“患者”、“受试者”、“个体”等在本文中可互换使用,并且无论是体外还是原位,是指可适用于本文所述的方法的任何动物或其细胞。在某些非限制性实施方案中,患者、受试者或个体是人。
术语“治疗”或“处理”包括在受试者如人中治疗本文所述的疾病或病症,并且包括:(i)抑制疾病或病症,即阻止其发生;(ii)缓解疾病或病症,即引起病症消退;(iii)减缓疾病的进展;和/或(iv)抑制、缓解或减缓疾病或病症的一种或多种症状的进展。
术语“施用”或“给予”治疗剂如肝脏前体细胞的试剂包括引入或递送治疗剂以执行预期功能的任何途径。可以通过适合于递送药剂的任何途径进行施用。因此,递送途径可包括静脉内、肌肉内、腹膜内或皮下递送。
以下将结合附图以及具体实施例进一步说明本发明的实施方案,但是,不应理解为将本发明的范围限于这些具体实施例。
附图说明
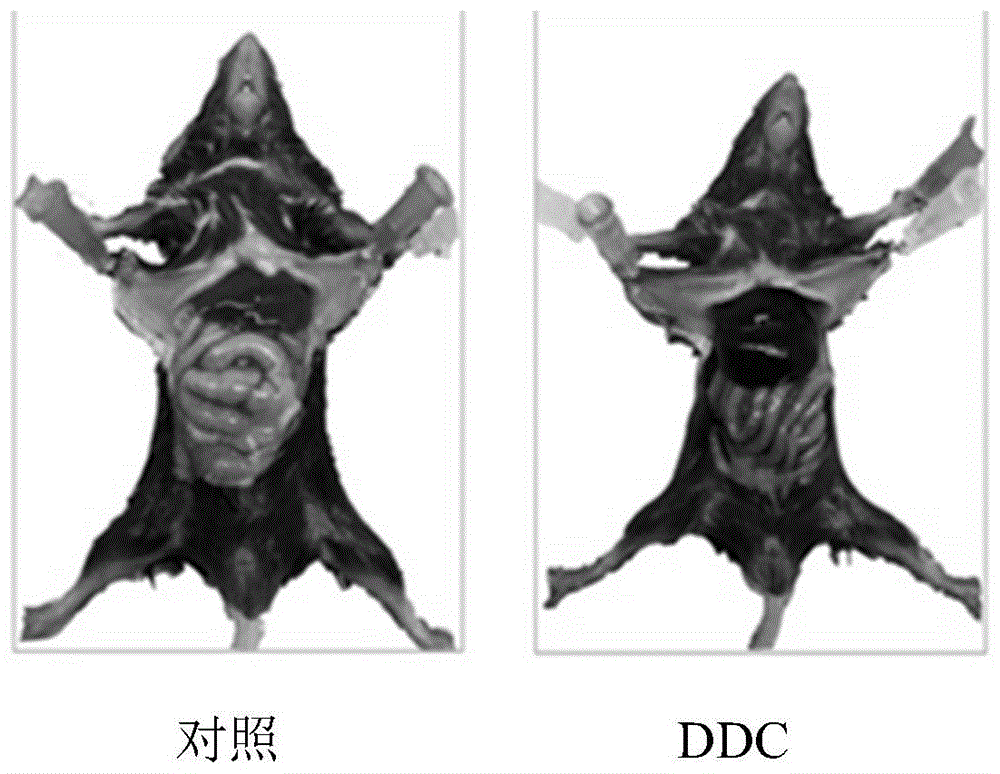
图1.ddc饮食小鼠与对照小鼠相比的肉眼可见的肝脏病变。
图2显示以cd133-pe和epcam-apc作为表面标记物进行的流式细胞仪分选。
图3显示hpcs的体外培养情况。
图4显示传代培养后的细胞的形态以及gfp表达。
图5a显示免疫荧光显色中选取的脑中的不同部位;
图5b中显示了ad组与ad+hpcs组脑中不同部位aβ免疫荧光图。
图6a显示相对aβ荧光强度显示在ad-hpcs组中,aβ的荧光强度显著低于ad组;
图6b为elisa检测的小鼠全脑中aβ42相对于总蛋白的含量;
图6c为elisa检测的小鼠全脑中aβ40相对于总蛋白的含量。
具体实施方式
本发明人开展了hpcs和阿尔茨海默病方面的研究,考虑到hpcs对肝脏的修复与治疗效果,同时肝脏对健康的重要性,我们建立了可全身表达绿色荧光蛋白(greenfluorescentprotein,gfp)的c57bl/6雄性小鼠,该小鼠由南京模式动物中心提供,后经过饲喂3,5-二乙氧羰基-1,4-二氢可立丁(3,5-diethoxycarbonyl-1,4-dihydrocollidine,ddc)饮食获得肝损伤模型,分离获得hpcs后,在体外大量扩增培养,后经尾静脉回体注射入患有阿尔茨海默病的c57bl/6雄性小鼠体内(该小鼠购于北京维通利华公司),发现hpcs对阿尔茨海默病具有明显的治疗效果。具体实施方式如下详述。
实施例1hpcs的分离获得以及体外克隆培养
我们建立了可全身表达绿色荧光蛋白(greenfluorescentprotein,gfp)的c57bl/6雄性小鼠,该小鼠由南京模式动物中心提供。经饲喂3,5-二乙氧羰基-1,4-二氢可立丁(3,5-diethoxycarbonyl-1,4-dihydrocollidine,ddc)饮食获得肝损伤模型。
从图1中可见,ddc饮食饲喂一段时间后,小鼠的肝脏出现严重病变,与对照组相比,ddc饮食组小鼠的肝脏颜色明显变暗,且肝脏硬化,已发生明显的损伤。
将ddc和对照小鼠的肝脏摘除后,经胶原酶完全消化为单细胞。以cd133-pe和epcam-apc为表面标记物进行流式细胞仪分选。从图2中可以看出,hpcs的得率在8-13%,其中cd133和epcam是ddc肝损伤模型下hpcs的特异标记物。
将收集到的hpcs离心后培养,每隔一天更换一半培养基;培养基配方:dmem/f12高糖培养基约占总体积87%,胎牛血清占总体积10%,肝生长因子40ng/ml,表皮生长因子40ng/ml,尼克酰胺1mg/ml,胰岛素10μg/ml,β-巯基乙醇0.1mmol/l,庆大霉素50mg/ml,glutamax占总体积1%,青霉素和链霉素占总体积1%。培养条件:在恒温培养箱中保持37℃,5%二氧化碳水平。具体步骤:每隔一天吸掉一半培养皿中原有的培养基,并添加等体积新的培养基。在第3天时,有极个别细胞开始贴壁;在第6天时出现个别较小克隆;在第18天时,有较大的克隆出现,并且这些获得的hpcs也表达ck19,所述ck19是胆管上皮标记物,证明了其胆管来源。
将获得的较大克隆消化后传代培养,可以看到细胞的形态呈多边形,且细胞间排列紧密,并且表达gfp,方便以后对hpcs的追踪(参见图4)。
实施例2hpcs在ad小鼠中的治疗效果
ad小鼠模型为5×fad鼠,3-4月龄,购自于南方模式生物。
将体外扩增培养hpcs通过尾静脉注射入输入月龄ad小鼠体内,可观察到其显著的治疗效果,aβ沉积显著减少。
在治疗期间,hpcs共注射两次,间隔半个月,其中,将hpcs悬于pbs中,每只鼠单次尾静脉注射200μl,细胞数不少于106,治疗持续时间一个半月,对照小鼠注射等体积的pbs。
首先,通过免疫荧光显色证实了hpcs降低ad小鼠脑中aβ沉积的显著效果。
图5a显示免疫荧光显色中选取的脑中的不同部位;
图5b中显示了ad组与ad+hpcs组脑中不同部位aβ免疫荧光图。
由图5b的免疫荧光染色可见,通过尾静脉注射hpcs的小鼠组,脑中的aβ沉积显色显著降低。
纵向每隔6张取一张脑片对全脑的aβ荧光强度进行统计;并进行elisa检测。简言之,使用的是invitrogen公司的aβ42及aβ40elisa试剂盒,取小鼠完整的左半脑,置于盐酸胍溶液中,低温彻底研磨,离心后取上清置于新的ep管中,低温超声,之后按照试剂盒的操作步骤完成后续部分,包括添加兔源检测抗体,洗板4次,添加抗兔igghrp,孵育后洗板,添加稳定色原体,孵育后添加停止溶液,之后在光度计上检测。小鼠全脑中aβ42以及aβ40的含量,结果如图6a至图6c所示。
如图6a所示,hpcs可显著降低ad小鼠脑中的aβ水平(p<0.001;spss软件,t检验);图6b和6c的elisa结果显示,hpc组小鼠脑中aβ42水平显著降低(p<0.01;spss软件,t检验);aβ40水平也显著降低(p<0.05;spss软件,t检验)。这些结果表明hpcs回体注射可显著降低脑中的aβ水平,对ad有显著的治疗效果。
hpcs进入体内后只会进入肝脏当中,hpcs通过修复和改善肝脏来达到治疗ad的效果,与传统认知有明显的区别并提供了新的手段。
- 还没有人留言评论。精彩留言会获得点赞!