含绿原酸的药物组合物在制备抗病毒药中的应用
本发明涉及医药领域,具体涉及含绿原酸的药物组合物在制备抗病毒药中的应用。
背景技术:
绿原酸(chlorogenicacid,cga)在药用植物中广泛存在,主要存在于忍冬科忍冬属、杜仲科杜仲属植物中,例如金银花、杜仲。绿原酸在25℃水中溶解度为4%,热水中溶解度更大,易溶于乙醇、丙酮,微溶于乙酸乙酯,难溶于氯仿、乙醚。
目前,有研究表明,绿原酸具有防治肺损伤的疗效,能够抑制由脂多糖引起的肺组织髓过氧化物酶活性上升及肺泡灌洗液中多形核白细胞的表达,同时显著降低了肺组织中可诱导型一氧化氮合酶的活性;此外,绿原酸对双氧水及眼镜蛇毒因子引起的肺部损伤也具有明显的保护作用。
病毒性疾病困扰人类,针对病毒性疾病,多采用化学合成药,化学合成药因此,亟需能抗病毒的植物提取物参与到人类与病毒抗争的过程。
病毒性疾病困扰人类,病毒具有很强的人际间传播能力,使得病毒性传染病具有较高的致病率和致死率,严重威胁人类生命健康。病毒感染引起的慢性疾病难以根治,给病人带来巨大痛苦,长期用药造成的高额费用给家庭和社会带来沉重的负担。目前现有的抗病毒药物主要有利巴韦林、阿昔洛韦、奥司他韦等化学合成药,这些药物不仅对肝肾等器官有较大的毒副作用,而且有较强的耐药性,临床疗效越来越低,抗病毒药物出现临床重大需求。现在亟需高效、低毒、抗耐药性的抗病毒药物,从而有力的抗击病毒,满足临床需要,保证人民健康。
技术实现要素:
本发明目的在于克服现有技术的不足,提供含绿原酸的药物组合物在制备抗病毒药中的应用。
本发明的技术方案概述如下:
含绿原酸的药物组合物在制备抗病毒药中的应用,所述含绿原酸的药物组合物用下述方法制成:
(1)称取磷脂和第一份绿原酸,置于容器内,加入乙醇水溶液,20-35℃搅拌1-2h,减压回收乙醇,固形物减压干燥,粉碎,过筛,得绿原酸磷脂复合物;
(2)称取第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物,混合或按等量递增法进行混合,搅拌均匀,得到含绿原酸的药物组合物。
优选地,磷脂、第一份绿原酸和乙醇水溶液的质量比为(1-10):(1-10):(100-4000)
第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物的质量比为(1-10):(1-20)。
磷脂为大豆磷脂、蛋黄卵磷脂、二肉豆蔻酰基卵磷脂、二棕榈酰基卵磷脂、二硬脂酰基卵磷脂、二油酰基卵磷脂、1-肉豆蔻酰基-2-棕榈酰基卵磷脂、1-硬脂酰基-2-肉豆蔻酰基卵磷脂、肉豆蔻酰溶血卵磷脂、棕榈酰溶血卵磷脂、硬脂酰溶血卵磷脂、二月桂酰磷脂酰甘油、二肉豆蔻酰磷脂酰甘油、1,2-棕榈酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二肉豆蔻酰磷脂酸、二棕榈酰磷脂酸、二硬脂酰磷脂酸、二肉豆蔻酰磷脂酰乙醇胺、二油酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二硬脂酰磷脂酰乙醇胺、1-棕榈酰-2-油酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰丝氨酸、二油酰基磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸和二硬脂酰磷脂酰丝氨酸中至少一种。
乙醇水溶液的体积浓度为70%及以上;
过筛为过三号筛至七号筛,优选地是五号筛。
所述病毒为甲型流感病毒或人冠状病毒。
本发明的优点:
实验证明,含绿原酸的药物组合物能抗病毒。本发明的含绿原酸的药物组合物口服生物利用度高、改善了原料绿原酸的口服药物动力学参数,在本发明提供的含绿原酸的药物组合物中,绿原酸和绿原酸磷脂复合物表现出优异的协同增效作用,能够显著抑制感染病毒小鼠的体重降低、降低肺指数,抑制肺组织炎症因子、抗击炎症风暴、降低肺组织的病毒载量,对抗甲型流感病毒对肺的损伤。
附图说明
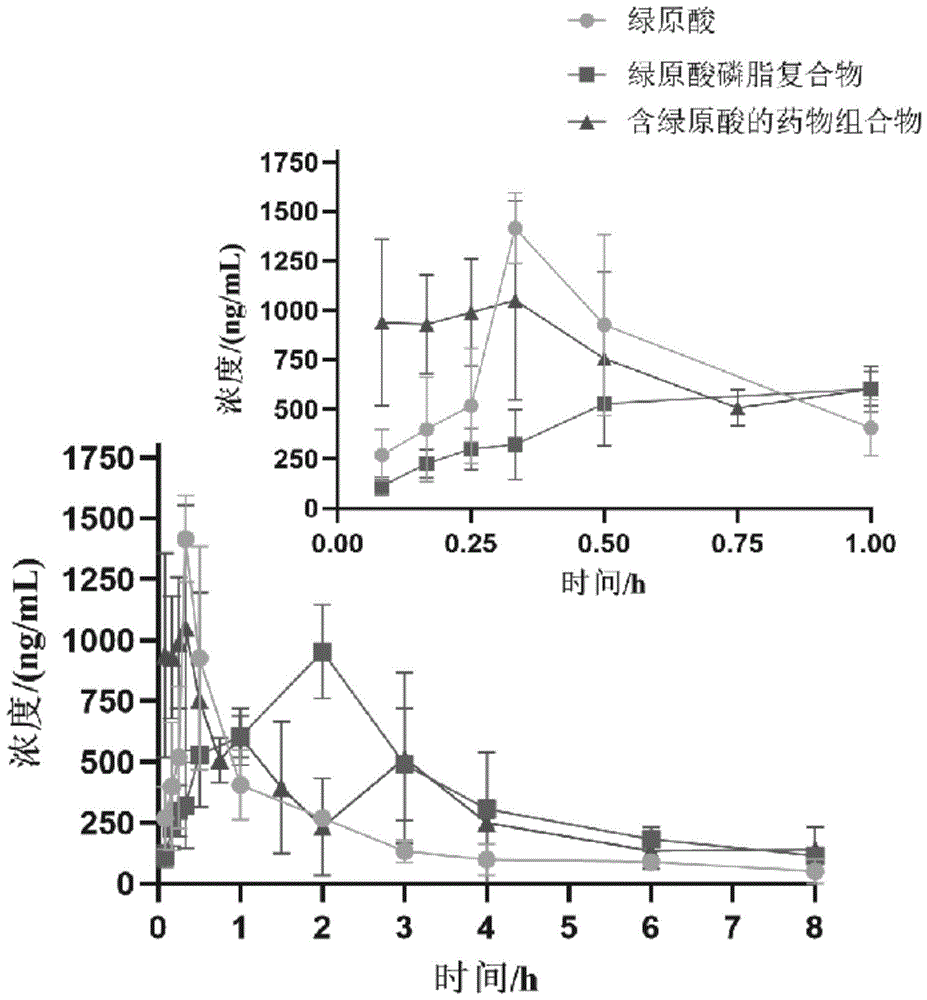
图1绿原酸(cga)、绿原酸磷脂复合物(capc)、本发明的含绿原酸的药物组合物(ca-capc)给药后大鼠血浆中绿原酸(cga)的平均血药浓度-时间曲线(mean±sd);
图2含绿原酸的药物组合物组对甲型h1n1流感病毒fm1致小鼠肺炎模型体重的影响(n=8)
图3含绿原酸的药物组合物组对甲型h1n1流感病毒fm1致小鼠肺炎模型炎症因子的影响(n=6)(a:il-6;b:tnf-α;c:il-1β;)
注:与模型对照组比较:*p<0.05,**p<0.01。
图4含绿原酸的药物组合物对甲型h1n1流感病毒fm1致小鼠肺炎模型病毒载量的影响(n=6)
注:与模型对照组比较:**p<0.01。
图5含绿原酸的药物组合物对甲型h1n1流感病毒pr8致小鼠肺炎模型体重的影响
图6含绿原酸的药物组合物对甲型h1n1流感病毒pr8致小鼠肺炎模型炎症因子的影响(n=6)(a:il-6;b:tnf-α;c:il-1β;)
注:与模型对照组比较:*p<0.05,**p<0.01。
图7含绿原酸的药物组合物对甲型h1n1流感病毒pr8致小鼠肺炎模型病毒载量的影响(n=6)
注:与模型对照组比较:*p<0.05,**p<0.01。
图8含绿原酸的药物组合物对人冠状病毒hcov-229e致小鼠肺炎模型体重的影响
图9含绿原酸的药物组合物对人冠状病毒hcov-229e致小鼠肺炎模型炎症因子的影响(n=6)(a:il-6;b:tnf-α;c:il-1β;)
注:与模型对照组比较:*p<0.05,**p<0.01。
图10含绿原酸的药物组合物对人冠状病毒hcov-229e致小鼠肺炎模型病毒载量的影响(n=6)
注:与模型对照组比较:*p<0.05,**p<0.01。
具体实施方式
第一份绿原酸和第二份绿原酸相同,是从植物中提取,或化学合成原料药,本发明各实施例采用的是购于上海阿拉丁生化科技股份有限公司,纯度为98%以上,其它企业出售的绿原酸也可以用于本发明。
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
为更好地理解本发明,下面通过以下实施例对本发明作进一步具体的阐述,但不可理解为对本发明的限定,对于本领域的技术人员根据上述发明内容所作的一些非本质的改进与调整,也视为落在本发明的保护范围内。
下面通过具体实施例对本发明作进一步的说明。
实施例1
含绿原酸的药物组合物的制备方法,包括如下步骤:
(1)称取大豆磷脂和第一份绿原酸,置于容器内,加入体积浓度为75%的乙醇水溶液,30℃搅拌2h,减压(50℃,-0.08mpa)回收乙醇,固形物减压干燥,干燥的固形物粉碎,过五号筛,得绿原酸磷脂复合物;
(2)称取第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物,混合,搅拌均匀,得到含绿原酸的药物组合物。
大豆磷脂、第一份绿原酸和体积浓度为75%的乙醇水溶液的质量比为5:5:1000。
第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物的质量比为1:2。
各实施例和各图中,绿原酸简写为cga、绿原酸磷脂复合物简写为capc、含绿原酸的药物组合物简称为ca-capc。
实施例2
含绿原酸的药物组合物的制备方法,包括如下步骤:
(1)称取二肉豆蔻酰磷脂酰乙醇胺和第一份绿原酸,置于容器内,加入体积浓度为90%的乙醇水溶液,35℃搅拌1h,减压(50℃,-0.08mpa)回收乙醇,固形物减压干燥,干燥的固形物粉碎,过六号筛,得绿原酸磷脂复合物;
(2)称取第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物,进行混合,搅拌均匀,得到含绿原酸的药物组合物。
二肉豆蔻酰磷脂酰乙醇胺、第一份绿原酸和体积浓度为90%的乙醇水溶液的质量比为10:2:4000。
第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物的质量比为1:1。
实施例3
含绿原酸的药物组合物的制备方法,包括如下步骤:
(1)称取二肉豆蔻酰磷脂酰甘油和第一份绿原酸,置于容器内,加入体积浓度为80%的乙醇水溶液,20℃搅拌2h,减压(50℃,-0.08mpa)回收乙醇,固形物减压干燥,干燥的固形物粉碎,过四号筛,得绿原酸磷脂复合物;
(2)称取第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物,按等量递增法混合,搅拌均匀,得到含绿原酸的药物组合物。
二肉豆蔻酰磷脂酰甘油、第一份绿原酸、体积浓度为80%乙醇水溶液的质量比为4:10:2000。
第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物的质量比为1:20。
实施例4
含绿原酸的药物组合物的制备方法,包括如下步骤:
(1)称取磷脂(磷脂是由质量比为1:1的二硬脂酰磷脂酸和二棕榈酰磷脂酸组成)和第一份绿原酸,置于容器内,加入体积浓度为70%的乙醇水溶液,30℃搅拌2h,减压(25℃,-0.08mpa)回收乙醇,固形物减压干燥,干燥的固形物粉碎,过七号筛,得绿原酸磷脂复合物;
(2)称取第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物,按等量递增法进行混合,搅拌均匀,得到含绿原酸的药物组合物。
磷脂、第一份绿原酸和体积浓度为70%的乙醇水溶液的质量比为3:1:100。
第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物的质量比为10:1。
实施例5
含绿原酸的药物组合物的制备方法,包括如下步骤:
(1)称取蛋黄卵磷脂和第一份绿原酸,置于容器内,加入体积浓度为75%的乙醇水溶液,30℃搅拌2h,减压(25℃,-0.08mpa)回收乙醇,固形物减压干燥,干燥的固形物粉碎,过三号筛,得绿原酸磷脂复合物;
(2)称取第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物,进行混合,搅拌均匀,得到含绿原酸的药物组合物。
蛋黄卵磷脂、第一份绿原酸和体积浓度为70%的乙醇水溶液的质量比为1:7:500。
第二份绿原酸和步骤(1)获得的绿原酸磷脂复合物的质量比为10:20。
用二肉豆蔻酰基卵磷脂、二棕榈酰基卵磷脂、二硬脂酰基卵磷脂、二油酰基卵磷脂、1-肉豆蔻酰基-2-棕榈酰基卵磷脂、1-硬脂酰基-2-肉豆蔻酰基卵磷脂、肉豆蔻酰溶血卵磷脂、棕榈酰溶血卵磷脂、硬脂酰溶血卵磷脂、二月桂酰磷脂酰甘油、1,2-棕榈酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二肉豆蔻酰磷脂酸、二油酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二硬脂酰磷脂酰乙醇胺、1-棕榈酰-2-油酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰丝氨酸、二油酰基磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸或二硬脂酰磷脂酰丝氨酸替代实施例1的大豆磷脂,其它同实施例1,分别制备出性质、作用与实施例1相似的含绿原酸的药物组合物。
为了进一步验证本发明的优异效果,发明人还对本发明的含绿原酸的药物组合物(实施例1制备)进行两类实验:第一类是进行大鼠的口服药物动力学实验,证明本发明的含绿原酸的药物组合物在口服生物利用度方面的提高,药物动力学参数的改善;第二类是抗病毒药效学实验,采用甲型h1n1流感病毒fm1和pr8株、人冠状病毒hcov-229e致小鼠肺炎模型,考察药物对小鼠体重变化、肺指数、肺组织炎症因子表达、肺组织病毒载量等药效学指标的影响;从口服生物利用度和药效学两方面来证明本发明的含绿原酸的药物组合物抗病毒的作用优势和优异效果。
实验例1
通过制备工艺、供试品药液的配制浓度和给药剂量的协调,大鼠口服药物动力学研究试验三组大鼠的绿原酸绝对给药剂量保持一致。方法和结果如下:
绿原酸(cga)、绿原酸磷脂复合物(capc)、本发明的绿原酸的药物组合物(ca-capc)的大鼠口服药物动力学实验
本实验所使用的绿原酸磷脂复合物(capc)由实施例1步骤(1)制备获得;含绿原酸的药物组合物(ca-capc)由实施例1制备获得。本实验的绿原酸磷脂复合物均简写为capc,含绿原酸的药物组合物均简写为ca-capc。
实验仪器:
agilent6460triplequadlc/ms型三重四级杆串联质谱仪;恒温磁力加热搅拌器(金坛市江南仪器厂);hh-9数显恒温水浴锅(苏州江东精密仪器有限公司);离心机(北京博奥晶典生物技术有限公司);kq-700b超声波清洗器(上海汉克科学仪器有限公司);milli-q超纯水仪(美国millipore;ms198du);电子天平(浙江力辰仪器科技有限公司);shz-cb循环水式多用真空泵(上海霓玥仪器有限公司);万分之一电子天平(瑞士梅特勒-托利多仪器有限公司);十万分之一电子天平(瑞士梅特勒-托利多仪器有限公司);
实验试药:
绿原酸标准品、葛根素标准品(正东科技,纯度98%)、大豆磷脂(上海艾伟拓医药科技有限公司),色谱级乙腈、甲醇、甲酸(美国fisher公司),无水乙醇、系列浓度乙醇为分析纯(石家庄第四制药厂)。本发明所涉及的磷脂均为商品。
实验动物:
sd大鼠,雄性,体重(200±20g),购自斯贝福(北京)生物技术有限公司。许可证号:scxk(京)2019-0010。
绿原酸分析方法色谱条件:
采用aichcromboodaqc18色谱柱(250mm×4.6mm×5μm),以乙腈(b)-0.1%甲酸水(a)为流动相,采用流动相梯度洗脱,梯度洗脱程序见表1。检测波长330nm,柱温30℃,流速0.2ml/min,进样量5μl。
表1流动性梯度洗脱程序
绿原酸分析方法质谱参数:
以葛根素为内标,esi电喷雾离子源;正离子检测模式;多反应检测(mrm);离子源喷射电压:-4000v;雾化气温度:300℃;干燥气温度:500℃;鞘气温度:400℃;碰撞气、鞘气、辅助气:氮气;雾化器、加热器、干燥器压力:40、50、10psi;其他参数见表2。
表2绿原酸和内标葛根素的质谱参数设定值
绿原酸磷脂复合物的制备:
由实施例1步骤(1)制备获得。
本发明的含绿原酸的药物组合物的制备:
由实施例1制备获得。
绿原酸原料药的供试品药液配制方法:
称取绿原酸原料药适量,加体积浓度为30%的乙醇水溶液,制成浓度为30mg/ml的药液。
绿原酸磷脂复合物的供试品药液配制方法:
称取绿原酸磷脂复合物适量,加体积浓度为30%的乙醇水溶液,制成浓度为60mg/ml的药液。
含绿原酸的药物组合物的供试品药液配制方法:
称取含绿原酸的药物组合物适量,加体积浓度为30%的乙醇水溶液,制成浓度为45mg/ml的药液。
大鼠口服药物动力学研究:
将18只sd雄鼠随机分成3组,每组6只,分别是绿原酸组(cga,给药剂量150mg/kg),绿原酸磷脂复合物组(capc,给药剂量300mg/kg)及含绿原酸的药物组合物组(ca-capc,给药剂量225mg/kg)。
正常饲养一周,实验前禁食12h,只给饮水,按剂量1ml/200g分别灌胃给予绿原酸原料药、绿原酸磷脂复合物和含绿原酸的药物组合物(即每200g大鼠体重灌胃1ml试药)。
分别于给药后5min,10min,15min,20min,30min,45min,1h,1.5h,2h,3h,4h,6h,8h,眼眶取血,然后迅速装入肝素化的1.5ml离心管中,振摇,10000r/min离心10min,分离血浆,于-80℃冰箱储存,备用。
取上层血浆100μl于1.5ml离心管中,加入内标(含葛根素500ng/ml)的甲醇溶液10μl以及280μl乙腈,涡旋振荡2min,10000r/min离心10min取上清液5μl进样。按绿原酸分析方法色谱条件和质谱条件进样测定,根据测定结果绘制绿原酸的平均血药浓度-时间曲线。含量测定中使用方法的本法的线性、精密度、重复性、稳定性、回收率、基质效应已被验证,满足含量测定要求。
实验结果
不同组别的绿原酸的平均血药浓度-时间曲线,如图1所示。
采用药物动力学winnolin6.2版软件(美国certara公司)分析计算主要药物动力学参数,根据非房室模型参数估算方法,求得三组动物血浆药物动力学的主要参数,结果见表3。
表3各组药物口服后绿原酸的主要药物动力学参数
注:与绿原酸原料药比较,*p<0.05,**p<0.01,***p<0.001,差异具有统计学意义。
与绿原酸磷脂复合物比较,#p<0.05,##p<0.01,###p<0.001,差异具有统计学意义。
由图1和表3可知,绿原酸原料药的口服后,吸收相的药物浓度低,口服生物利用度低。
由图1和表3可知,与绿原酸原料药比较,绿原酸磷脂复合物的auc(0-t)与auc(0-∞)均显著提高(p<0.001,p<0.01),表明绿原酸制成绿原酸磷脂复合物后,显著提高绿原酸的口服生物利用度。但是,绿原酸磷脂复合物的药物动力学参数存在明显缺点:第一,绿原酸磷脂复合物的tmax显著增大,达峰时间延迟了,可能会导致绿原酸的起效变慢;第二,绿原酸磷脂复合物的吸收相的药物浓度却比绿原酸原料药的还低,不能达到快速起效的目的。
由图1和表3可知,与绿原酸原料药相比,含绿原酸的药物组合物的auc(0-t)与auc(0-∞)均显著提高(提高了41.9%、59.5%)(p<0.05,p<0.05),表明绿原酸制成含绿原酸的药物组合物后,可显著提高绿原酸的口服生物利用度;同时,含绿原酸的药物组合物的吸收相的药物浓度显著高于绿原酸原料(p<0.05),达峰时间显著快于绿原酸原料药(p<0.05),而最大血药浓度cmax与绿原酸原料药持平没有显著性差异。由此可见,含绿原酸的药物组合物提高了绿原酸的口服生物利用度,改进了绿原酸的药物动力学参数,保证了绿原酸在给药后吸收相血药浓度快速达到较高浓度,并且血药浓度快速达峰,有利于疾病的治疗。
由图1和表3可知,与绿原酸磷脂复合物相比,含绿原酸的药物组合物的auc(0-t)与auc(0-∞)与绿原酸磷脂复合物持平没有显著性差异,含绿原酸的药物组合物吸收相的药物浓度显著高于绿原酸磷脂复合物(p<0.01),达峰时间显著快于绿原酸磷脂复合物(p<0.001),最大血药浓度cmax显著高于绿原酸磷脂复合物(p<0.05)。由此可见,含绿原酸的药物组合物不仅提高了绿原酸的口服生物利用度,并且血药浓度快速达峰,吸收相浓度高,极大地改进了绿原酸磷脂复合物的药物动力学参数缺点,为绿原酸治疗急性疾病提供了有力的药物动力学理论基础。
鉴于上述实验结果,本发明的含绿原酸的药物组合物在药物动力学方面达到一种显著优势:不仅提高了口服生物利用度,而且吸收达峰快,吸收相药物浓度高,药物峰值浓度高,整体上改进了绿原酸、绿原酸磷脂复合物的药物动力学参数。
实验例2
本发明的含绿原酸的药物组合物(ca-capc)对甲型h1n1流感病毒fm1株致小鼠肺炎模型的影响
含绿原酸的药物组合物(简称ca-capc)由实施例1制备获得(以下各实验均采用实施例1制备获得),绿原酸与绿原酸磷脂复合物的质量比例是1:2。本实验的绿原酸磷脂复合物(实施例1步骤(1)制备,以下各实验均实施例1步骤(1)制备)均简写为capc。
实验方法:
病毒传代:取9日龄鸡胚,用铅笔画出气室和胎位,用75%乙醇消毒气室,在胎位背侧气室边缘2mm处打一小孔,将0.2ml甲型h1n1流感病毒fm1株病毒液(美国模式培养物集存库,atcc)打入尿囊腔,用蜡封住小孔,将胚蛋放入37℃恒温培养箱内,培养48h,将尿囊液吸出,取少量尿囊液,用鸡血球做血凝实验,病毒液滴度640以上的用于后续实验,置于-80℃低温冰箱冻存。
病毒滴度测定:取已长成单层a549人肺泡腺癌基底上皮细胞(国家实验细胞资源共享平台)的培养板,倒掉培养液,用细胞维持液冲洗细胞面3遍后,按10倍稀释接种不同滴度的甲型h1n1流感病毒fm1株,10-1~10-8共8个稀释度,100μl/孔,每个浓度4个复孔,同时设正常细胞对照。置37℃5%co2培养箱中培养,每日倒置显微镜下观察细胞病变情况,72h记录各孔的细胞病变情况。按reed-muench计算50%细胞病变浓度(tcid50)。
制备小鼠病毒性肺炎模型:将icr小鼠(13-15克,)置于生物安全柜内,用异氟烷短暂麻醉小鼠,小鼠进入麻醉状态后,立即以100tcid50病毒液滴鼻感染小鼠,滴入量为35μl/只,正常对照组小鼠,在同等条件下滴鼻生理盐水,滴入量为35μl/只。
分组和给药:icr小鼠按体重随机分为正常对照组(normal)、模型对照组(model)、阳性对照组(磷酸奥司他韦胶囊,oseltamivir,27.5mg/kg)、含绿原酸的药物组合物(ca-capc,37.5、75、150、300mg/kg)四个剂量组,正常对照组10只小鼠,其余实验组每组8只小鼠,雌雄各半。阳性对照组和ca-capc各剂量给药组按0.2ml/10g灌胃给药,每日1次,连续6天,正常对照组和模型对照组在同等条件下给予蒸馏水。第2天小鼠给药1小时后,除正常对照组外,其余各组用异氟烷短暂麻醉小鼠,小鼠进入麻醉状态后,立即以100tcid50甲型h1n1流感病毒fm1株病毒液滴鼻感染小鼠,滴入量为35μl/只,正常对照组异氟烷短暂麻醉后滴鼻生理盐水,滴入量为35μl/只。记录每日小鼠体重。实验第6天称重小鼠体重,以这次称重数据计算体重下降率,然后小鼠眼眶取血,断颈处死小鼠后,解剖取肺脏,称重量并计算肺指数及肺指数抑制率,采用多功能酶标仪(德国perkinelmer公司)检测肺组织的炎性细胞因子(elisa法),用real-timepcr仪(美国appliedbiosystems公司)检测肺组织的病毒载量。
统计学分析,使用graphpadprism6.0软件进行数据分析。计量资料以
考察指标:
肺指数=[肺湿重(g)/体重(g)]×100
试药:
绿原酸(chlorogenicacid,cga)购自上海阿拉丁生化科技股份有限公司。
磷酸奥司他韦胶囊(达菲),购自上海罗氏制药有限公司。
试药配制方法:
磷酸奥司他韦胶囊(1.375mg/ml):2粒磷酸奥司他韦胶囊(共含磷酸奥司他韦150mg),加蒸馏水定溶至109ml,得到浓度为1.375mg/ml的磷酸奥司他韦药液。
本发明的含绿原酸的药物组合物组ca-capc(1.875mg/ml):称取ca-capc18.75mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度1.875mg/ml。
本发明的含绿原酸的药物组合物组ca-capc(3.75mg/ml):称取ca-capc37.5mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度3.75mg/ml。
本发明的含绿原酸的药物组合物组ca-capc(7.5mg/ml):称取ca-capc75mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度7.5mg/ml。
本发明的含绿原酸的药物组合物组ca-capc(15mg/ml):称取ca-capc150mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度15mg/ml。
研究结果:
表4含绿原酸的药物组合物对甲型h1n1流感病毒fm1致小鼠肺炎模型体重的影响
试验期间每日测定小鼠的体重值,其变化如表4、图2所示。
表5含绿原酸的药物组合物组对甲型h1n1流感病毒fm1致小鼠肺炎模型肺指数的影响
注:与正常组比较,##p<0.01;与模型组比较,*p<0.05,**p<0.01。
表5中结果显示:模型对照组小鼠感染甲型h1n1流感病毒fm1后肺指数明显升高,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物不同剂量组给药6天后,37.5、75、150mg/kg剂量组肺指数明显降低,与模型对照组比较均有统计学差异(p<0.05),肺指数抑制率分别为49.89%、67.06%、37.67%。
图3-a,图3-b,图3-c中结果显示:模型对照组小鼠感染甲型h1n1流感病毒fm1后,肺组织中il-6、tnf-α及il-1β含量均明显升高,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物不同剂量组给药6天后,肺组织中炎症因子含量降低,其中37.5mg/kg剂量组小鼠肺组织中il-6、75mg/kg剂量组小鼠肺组织中il-6及il-1β、150mg/kg和300mg/kg剂量组小鼠肺组织中il-6、tnf-α及il-1β含量明显降低,与模型对照组比较均有显著性差异(p<0.05或p<0.01)。
图4中结果显示:感染甲型h1n1流感病毒fm1后,小鼠肺组织中病毒载量显著增加,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物给药6天后,37.5、75、150、300mg/kg四个剂量组肺组织中病毒载量均显著降低,与模型对照组比较均有显著性差异(p<0.01)。
实验例3本发明的含绿原酸的药物组合物(ca-capc)对甲型h1n1流感病毒pr8株致小鼠肺炎模型的影响
本实验例3所用造模病毒更换为甲型h1n1流感病毒pr8株(美国模式培养物集存库,atcc),其他方法均与实验例2相同。
研究结果:
表6含绿原酸的药物组合物对甲型h1n1流感病毒pr8致小鼠肺炎模型体重的影响
结果显示:试验期间每日测定小鼠的体重值,其变化如表6、图5所示。实验开始时各实验组小鼠无显著差异。实验第3天感染组小鼠体重开始下降,实验第5、6天感染组体重下降明显。实验第6天,含绿原酸的药物组合物四个剂量组小鼠体重下降率低于模型对照组。
表7含绿原酸的药物组合物对甲型h1n1流感病毒pr8致小鼠肺炎模型肺指数的影响
注:与正常组比较,##p<0.01;与模型组比较,*p<0.05,**p<0.01。
表7中结果显示:模型对照组小鼠感染甲型h1n1流感病毒pr8后肺指数明显升高,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物不同剂量组给药6天后,75、150mg/kg剂量组肺指数均明显降低,与模型对照组比较有统计学差异(p<0.05),肺指数抑制率分别为39.75%、42.66%。
图6-a,图6-b,图6-c中结果显示:模型对照组小鼠感染甲型h1n1流感病毒pr8后,肺组织中il-6、tnf-α及il-1β含量均明显升高,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物不同剂量组给药6天后,肺组织中炎症因子含量降低,其中37.5及300mg/kg剂量组小鼠肺组织中tnf-α、il-1β含量明显降低,与模型对照组比较有统计学差异(p<0.05或p<0.01)。
图7中结果显示:感染甲型h1n1流感病毒pr8后,小鼠肺组织中病毒载量显著增加,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物给药6天后,75、150mg/kg两个剂量组肺组织中病毒载量显著降低,与模型对照组比较有显著性差异(p<0.01)。
实验例4
本发明的含绿原酸的药物组合物(ca-capc)对人冠状病毒hcov-229e致小鼠肺炎模型的影响
病毒传代:取已长成单层raw264.7小鼠单核巨噬细胞白血病细胞(北京北纳创联生物技术研究院)的培养瓶,倒掉培养液,用细胞维持液冲洗细胞3遍后,加入人冠状病毒hcov-229e(美国模式培养物集存库,atcc)的病毒液200μl,置37℃5%co2培养箱中培,每日倒置显微镜下观察细胞病变情况,72-96h,直至80%细胞出现明显病变后,将细胞培养瓶置于-80℃低温冰箱冻存,病毒液反复冻融3次后,用于检测病毒毒力。
病毒滴度测定:取已长成单层raw264.7细胞的培养板,倒掉培养液,用细胞维持液冲洗细胞3遍后,按10倍稀释接种不同滴度的人冠状病毒hcov-229e病毒液,10-1~10-8共8个稀释度,100μl/孔,每个浓度4个复孔,同时设正常细胞对照。置37℃5%co2培养箱中培养,每日倒置显微镜下观察细胞病变情况,72~96h记录各孔的细胞病变情况。按reed-muench计算50%细胞病变浓度(tcid50)。
制备小鼠病毒性肺炎模型:将小鼠置于生物安全柜内,用异氟烷短暂麻醉小鼠,小鼠进入麻醉状态后,立即以100tcid50人冠状病毒hcov-229e病毒液滴鼻感染小鼠,滴入量为50μl/只,正常对照组小鼠,在同等条件下滴鼻生理盐水,滴入量为50μl/只。
分组和给药:icr小鼠按体重(13克-15克)随机分为正常对照组(normal)、模型对照组(model)、阳性对照组(磷酸氯喹片,chloroquine,90mg/kg)、含绿原酸的药物组合物(ca-capc,37.5、75、150、300mg/kg)四个剂量组,正常对照组10只小鼠,其余实验组每组8只小鼠,雌雄各半。各剂量给药组按0.2ml/10g灌胃给药,每日1次,连续6天,正常对照组和模型对照组在同等条件下给予蒸馏水。第2天小鼠给药1小时后,除正常对照组外,其余各组用异氟烷短暂麻醉小鼠,小鼠进入麻醉状态后,立即以100tcid50人冠状病毒hcov-229e病毒液滴鼻感染小鼠,滴入量为50μl/只,正常对照组异氟烷短暂麻醉后滴鼻生理盐水,滴入量为50μl/只。记录每日小鼠体重。实验第6天称重小鼠体重,以这次称重数据计算体重下降率,然后小鼠眼眶取血,断颈处死小鼠后,解剖取肺脏,称重量并计算肺指数及肺指数抑制率,采用多功能酶标仪(德国perkinelmer公司)检测肺组织的炎性细胞因子(elisa法),用real-timepcr仪(美国appliedbiosystems公司)检测肺组织的病毒载量。
统计学分析,使用graphpadprism6.0软件进行数据分析。计量资料以
考察指标:
肺指数=[肺湿重(g)/体重(g)]×100
试药:
磷酸氯喹片,购自上海信宜天平药业有限公司。
试药配制方法:
阳性药磷酸氯喹(4.5mg/ml):2片磷酸氯喹(共含500mg磷酸氯喹),加蒸馏水定溶至111.2ml,得到浓度为4.5mg/ml的磷酸氯喹药液。
本发明的含绿原酸的药物组合物组ca-capc(1.875mg/ml):称取ca-capc18.75mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度1.875mg/ml。
本发明的含绿原酸的药物组合物组ca-capc(3.75mg/ml):称取ca-capc37.5mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度3.75mg/ml。
本发明的含绿原酸的药物组合物组ca-capc(7.5mg/ml):称取ca-capc75mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度7.5mg/ml。
本发明的含绿原酸的药物组合物组ca-capc(15mg/ml):称取ca-capc150mg充分溶解于10ml超纯水中,得到ca-capc药液,浓度15mg/ml。
实验结果:
表8绿原酸对人冠状病毒hcov-229e致小鼠肺炎模型体重的影响
结果显示:试验期间每日测定小鼠的体重值,其变化如表8、图8所示。
表9绿原酸对人冠状病毒hcov-229e致小鼠肺炎模型肺指数的影响
注:与正常组比较,##p<0.01;与模型组比较,**p<0.01。
表9中结果显示:模型对照组小鼠感染人冠状病毒hcov-229e后肺指数明显升高,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物不同剂量组给药6天后,75、150mg/kg剂量组肺指数有降低趋势,但与模型对照组比较无统计学差异(p>0.05),肺指数抑制率分别是34.98%、30.74%。
图9-a,图9-b,图9-c中结果显示:模型对照组小鼠感染人冠状病毒hcov-229e后,肺组织中il-6、tnf-α及il-1β含量均明显升高,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物不同剂量组给药6天后,小鼠肺组织中炎症因子含量有降低趋势,其中37.5mg/kg剂量组tnf-α、il-1β含量以及300mg/kg剂量组il-1β含量明显降低。
图10中结果显示:小鼠感染人冠状病毒hcov-229e后,肺组织中病毒载量显著增加,与正常对照组比较有显著性差异(p<0.01)。含绿原酸的药物组合物给药6天后,小鼠肺组织中病毒载量降低,其中75、150、300mg/kg三个剂量组病毒载量显著降低,与模型对照组比较有统计学差异(p<0.05或p<0.01)。
实验证明,实施例2、3、4、5制备的含绿原酸的药物组合物的药动学实验结果与药效学实验结果与实施例1制备的含绿原酸的药物组合物的实验结果相似。
含绿原酸的药物组合物口服生物利用度高、改善了绿原酸的口服药物动力学参数,能够抑制感染病毒小鼠的体重降低、降低肺指数,抑制肺组织炎症因子、抗击炎症风暴、降低肺组织的病毒载量,对抗流感病毒对肺的损伤。
- 还没有人留言评论。精彩留言会获得点赞!