富硒乳酸菌缓解黄曲霉毒素致鸡小肠肠屏障损伤的应用
本发明属于生物技术领域,涉及细胞工程技术,尤其是一种富硒乳酸菌抑制黄曲霉毒素致鸡小肠肠屏障损伤的应用和方法。
背景技术:
黄曲霉毒素(af)的毒性作用主要包括:生长发育毒性、肝毒性、免疫毒性、遗传毒性,af除了对机体肝、肾造成损伤以外,对肠道也产生相应的毒害作用;肠道是真菌毒素的初始屏障,肠粘膜的屏障保护对于肠道健康至关重要。
硒作为机体必需的微量元素,具有抗氧化,提高机体免疫力和抗病力,调节机体代谢,影响动物和人的繁育机能,抗肿瘤,延缓衰老,拮抗有毒元素等等多种生物学功能,另外其对肠道菌群失调、改善肠道炎症方面有一定的改善作用。乳酸菌能够通过其体内的生物学作用将无机硒转化为有机硒并制得富硒乳酸菌,其对于af的毒性有拮抗作用,并且对于黄曲霉的生长也能起到抑制作用。
正常的肠屏障在维持体内和外界环境的稳态上发挥重要作用。紧密连接是多种蛋白组成的复合物,其对肠上皮屏障的通透性、性质和功能至关重要,对营养物质的运输、吸收和利用具有重要意义。紧密连接蛋白对于维持肠上皮结构十分重要,其能够封闭细胞间隙,阻止有害物质进入机体,是调节上皮细胞通透性的机械屏障;紧密连接蛋白不仅在调节屏障方面发挥作用,也参与调节细胞形态、细胞极性等。闭合蛋白(occludin)是一种重要的跨膜紧密连接蛋白,与上皮机械屏障有着密切关系;若occludin蛋白水平下降,则会导致肠道屏障受损,加剧毒素经肠腔进入血液循环。研究发现af能够降低occludin蛋白水平、增加肠道细胞旁通透性,损伤肠道的机械屏障,进而影响肠道的正常功能。
本发明用富硒乳酸菌来抑制af引起的鸡小肠上皮细胞紧密连接蛋白occludin蛋白水平下降,达到抵抗af对肠屏障的损伤,维持肠道正常功能的作用效果。目前,国内外未见到富硒乳酸菌抑制af所致鸡小肠肠道屏障损伤方面的专利公开文献或报道。
技术实现要素:
本发明目的在于克服现有技术中的不足之处,提供一种富硒乳酸菌缓解af致鸡小肠肠屏障损伤的应用和方法,为富硒乳酸菌在预防和治疗鸡af中毒,特别是缓解肠道屏障损伤、维持肠道功能方面的应用提供技术支持。
为实现上述目的,本发明公开了如下的技术内容:
一种富硒乳酸菌在缓解af致鸡小肠肠屏障损伤方面的应用;所述的缓解af致鸡小肠肠屏障损指的是:富硒乳酸菌抑制af所致鸡小肠上皮细胞紧密连接蛋白occludin蛋白水平下降。
本发明所述的应用,其特征在于:对于鸡小肠上皮细胞,当af浓度为200-300μmol/l时,使用0.01-0.1μmol/l的富硒乳酸菌(在培养液中的终浓度,以硒计),能够抑制af所致鸡小肠上皮细胞occludin蛋白水平下降,以此达到减弱af对鸡小肠肠道屏障损伤的作用效果。实验结果显示:对于鸡小肠上皮细胞,使用0.01-0.1μmol/l的富硒乳酸菌(在培养液中的终浓度,以硒计),在af浓度为200-300μmol/l,能够抑制af所致鸡小肠上皮细胞occludin蛋白水平下降,并减弱af对鸡小肠肠屏障损伤的作用,
本发明进一步公开了富硒乳酸菌缓解af致鸡小肠肠屏障损伤的方法,步骤如下:
对于鸡小肠上皮细胞,加入硒浓度为0.01-0.1μmol/l(在培养液中的终浓度)的富硒乳酸菌,培养6-12h后,再向其中加入af,使其浓度为200-300μmol/l,继续培养12-24h后培养结束,能够抑制af所致鸡小肠上皮细胞occludin蛋白水平下降,以此达到减弱af对鸡小肠肠道屏障损伤的作用。
本发明还公开了富硒乳酸菌缓解af致鸡小肠肠屏障损伤的验证方法,步骤如下:
s1:将鸡小肠上皮细胞接种于六孔板,调整细胞浓度为2×105个/孔;试验分为对照组、af攻毒组和富硒乳酸菌组;待细胞汇合60-70%,更换培养液;对照组和af攻毒组更换为普通培养液,富硒乳酸菌组更换含富硒乳酸菌的培养液,硒浓度为0.01-0.1μmol/l;继续培养8-12h后取出六孔板,在af攻毒组和富硒乳酸菌组加入af,使其浓度为200-300μmol/l,继续培养12-24h后,培养结束;
s2:采用westernbloting法测定occludin蛋白水平的改变:
提取鸡小肠上皮细胞总蛋白,采用bca法测定蛋白浓度,加入5×buffer,100℃煮沸变性蛋白;通过sds-page分离蛋白,转膜至pvdf膜,常规孵育一抗二抗,通过imagelab显影,测定occludin蛋白水平。
而且,所述步骤s2的具体步骤如下:
(1)蛋白提取
用预冷的pbs洗涤细胞3次,每孔加入150µl的含1mmpmsf的ripa细胞裂解液,充分接触细胞后,刮下细胞移至1.5ml离心管中,于4℃继续裂解1h,每15min震荡10s以充分裂解细胞。4℃12000g离心10min,收集上清液;于-20℃保存;
(2)bca法测定蛋白浓度
将试剂盒中的蛋白标准品稀释为0.5mg/kg;
配制bca工作液:按50:1混合a液和b液;
将标准品按0、1、2、4、8、12、16和20µl加到96孔板,用生理盐水补至20µl;取2µl待测样品加到96孔板,用生理盐水补至20µl;
每孔加入200µlbca工作液,37℃孵育30min;
于540nm下测定其od值,计算样品蛋白浓度;
向待测样品中加入30µl5×loadingbuffer,煮沸10min以变性蛋白,于-20℃保存待用;
(3)sds-page电泳
正确组装电泳槽,放入预制胶;倒入电泳缓冲液,拔掉梳子,依次加入多色预染蛋白maker和待测样品;室温110v恒压电泳至凝胶底部结束;
(4)转膜
1)将pvdf膜于甲醇中浸泡5min,滤纸浸泡在转膜缓冲液中;
2)取出凝胶,对照marker切下包含目的蛋白的凝胶;
3)按照滤纸-pvdf膜-凝胶-滤纸的顺序铺好,去掉气泡使凝胶与膜充分接触;
4)用15v电压转膜45min;
(5)封闭
转膜结束后,取出pvdf膜,在70转/min摇床上用tbst洗涤3次,每次5min;配制5%脱脂乳作封闭液,将pvdf膜充分与封闭液接触,4℃封闭过夜;
(6)结合抗体
结合一抗:
根据抗体说明书使用封闭液稀释occludin抗体,稀释度为1:600;兔源β-actin抗体稀释度为1:1000。取封闭后的pvdf膜置于稀释后的一抗中,室温孵育90min后,取出pvdf膜,用tbst洗涤3次,每次5min;
结合二抗:
根据抗体说明书,使用封闭液稀释二抗,使用的羊抗兔igg抗体稀释度为1:1000;取孵育一抗后的pvdf膜与稀释后二抗孵育,室温孵育60min后,取出pvdf膜,用tbst洗涤3次,每次5min;
(7)ecl法显色
取ecl试剂盒中等量a液和b液,充分混合后与pvdf膜接触,避光室温反应5min。与bio-rad凝胶成像仪采集图像,用imagelab软件扫描灰度,测定occludin蛋白水平。
本发明公开的富硒乳酸菌缓解af致鸡小肠肠屏障损伤的有益效果在于:
本发明提出了富硒乳酸菌缓解af致鸡小肠肠屏障损伤方面的应用;实验结果显示:对于鸡小肠上皮细胞,使用0.01-0.1μmol/l的富硒乳酸菌(在培养液中的终浓度,以硒计),在af浓度为200-300μmol/l,可抑制af所致鸡小肠上皮细胞occludin蛋白水平下降,以此达到减弱af对鸡小肠肠道屏障损伤的作用,可为富硒乳酸菌在预防和治疗鸡af中毒,特别是缓解肠道屏障损伤、维持肠道功能方面的应用提供技术支持。
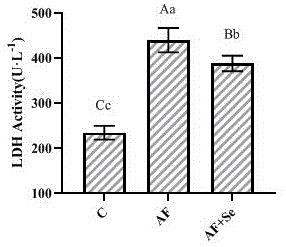
将本发明中能够缓解af致鸡小肠肠屏障损伤的富硒乳酸菌,用于保护同时给予af攻毒的鸡小肠上皮细胞,试验结果表明,与af攻毒组相比,富硒乳酸菌能够上调af所致鸡小肠上皮细胞occludin表达的降低,进而抑制了鸡小肠上皮细胞损伤所引起的培养液中的乳酸脱氢酶(ldh)活性的升高,从缓解了af对肠道细胞的损伤,维持了肠道细胞的完整性(见图1)。
本发明主要解决了如何应用富硒乳酸菌缓解af致鸡小肠肠屏障损伤的方法及应用;重点考察了富硒乳酸菌作为能够抑制细胞损伤的物质在减弱af对鸡小肠肠屏障毒性作用方面的作用效果;主要的难点在于,确定富硒乳酸菌对af所致鸡小肠肠屏障损伤具有最佳保护效果的时间以及最佳应用浓度;为此先后考察了af对鸡小肠上皮细胞生长的影响、攻毒的毒素剂量、攻毒时间、富硒乳酸菌的应用剂量和应用时间等条件;最后确定的方案是:鸡小肠上皮细胞培养12h,处于生长对数期时,应用含有富硒乳酸菌的培养液(在培养液中的终浓度0.01-0.1μmol/l,以硒计)对肠屏障进行保护;继续培养6-12h,待富硒乳酸菌充分发挥作用后,加入200-300μmol/l的af进行攻毒,攻毒进行12-24h,在此条件下,富硒乳酸菌抑制af所致鸡小肠肠屏障损伤具有最佳的作用效果。
附图说明
图1富硒乳酸菌缓解af对鸡小肠上皮细胞ldh活力的影响;注:不同小写字母表示差异显著(p<0.05);不同大写字母表示差异极显著(p<0.01);相同字母或无字母表示差异不显著(p>0.05);下同;
图2富硒乳酸菌(0.01μmol/l)缓解afb1(200µg/ml)致鸡小肠肠道屏障损伤的测定结果;其中,上图为富硒乳酸菌(0.01μmol/l)对afb1(200μmol/l)导致的鸡小肠上皮细胞occludin蛋白水平改变的条带图,下图为富硒乳酸菌(0.01μmol/l)对afb1(200μmol/l)导致的鸡小肠上皮细胞occludin蛋白水平改变的统计结果图。
图3富硒乳酸菌(0.1μmol/l)缓解afb1(300μmol/l)致鸡小肠肠道屏障损伤的测定结果;其中,上图为富硒乳酸菌(0.1μmol/l)对afb1(300μmol/l)导致的鸡小肠上皮细胞occludin蛋白水平改变的条带图,下图为富硒乳酸菌(0.1μmol/l)对afb1(300μmol/l)导致的鸡小肠上皮细胞occludin蛋白水平改变的统计结果图。
具体实施方式
下面详细叙述本发明的实施例,需要说明的是,本实施例是叙述性的,不是限定性的,不能以此限定本发明的保护范围。本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
较优地,本发明中鸡小肠上皮细胞培养液可以购买于gibco公司,af可以购买于fermentekltd公司。富硒乳酸菌由天津农学院临床兽医学实验室参照文献(姚婉,赵方红,刘丽娜,等.不同浓度硒含量的富硒乳酸菌抑制黄曲霉菌生长以及产毒效果的研究[j].中国饲料,2016,(12):19-21+26.)的方法进行制备,制备原料:乳酸菌(鼠李糖乳杆菌,购买于中国普通微生物菌种保藏管理中心)由实验室保存,亚硒酸钠可以购自天津市化学试剂究所;制备的富硒乳酸菌中硒含量为9.69µg/ml。
富硒乳酸菌缓解af致鸡小肠肠屏障损伤的应用。
较优地,所述应用为富硒乳酸菌提高af致鸡小肠上皮细胞occludin蛋白水平下降的应用。
较优地,对于鸡小肠上皮细胞,当af浓度为200-300μmol/l时,使用硒在培养液中的终浓度为0.01-0.1μmol/l的富硒乳酸菌,能够抑制af所致鸡小肠上皮细胞occludin蛋白水平下降,以此达到减弱af对鸡小肠肠道屏障损伤的作用。
富硒乳酸菌缓解af致鸡小肠肠屏障损伤的方法,步骤如下:
对于鸡小肠上皮细胞,加入硒浓度为0.01-0.1μmol/l(培养液中的终浓度)的富硒乳酸菌,培养8-12h后,再向其中加入af,使其浓度为200-300μmol/l,继续培养12-24h后培养结束,能够抑制af所致鸡小肠上皮细胞occludin蛋白水平下降,以此达到减弱af对鸡小肠肠道屏障损伤的作用。
富硒乳酸菌缓解af致鸡小肠肠屏障损伤的验证方法,步骤如下:
s1:将鸡小肠上皮细胞接种于六孔板,调整细胞浓度为2×105个/孔;试验分为对照组、af攻毒组和富硒乳酸菌组;待细胞汇合60-70%,更换培养液:对照组和af攻毒组更换为普通培养液,富硒乳酸菌组更换含富硒乳酸菌的培养液,硒浓度为0.01-0.1μmol/l;继续培养8-12h后取出六孔板,在af攻毒组和富硒乳酸菌组加入af,使其浓度为200-300μmol/l,继续培养12-24h后,培养结束;
s2:采用westernbloting法测定occludin蛋白水平的改变:
提取鸡小肠上皮细胞总蛋白,采用bca法测定蛋白浓度,加入5×buffer,100℃煮沸变性蛋白;通过sds-page分离蛋白,转膜至pvdf膜,常规孵育一抗二抗,通过imagelab显影,测定occludin蛋白水平。
而且,所述步骤s2的具体步骤如下:
(1)蛋白提取
用预冷的pbs洗涤细胞3次,每孔加入150µl的含1mmpmsf的ripa细胞裂解液,充分接触细胞后,刮下细胞移至1.5ml离心管中,于4℃继续裂解1h,每15min震荡10s以充分裂解细胞。4℃12000g离心10min,收集上清液;于-20℃保存;
(2)bca法测定蛋白浓度
将试剂盒中的蛋白标准品稀释为0.5mg/kg;
配制bca工作液:按50:1混合a液和b液;
将标准品按0、1、2、4、8、12、16和20µl加到96孔板,用生理盐水补至20µl;取2µl待测样品加到96孔板,用生理盐水补至20µl;
每孔加入200µlbca工作液,37℃孵育30min;
于540nm下测定其od值,计算样品蛋白浓度;
向待测样品中加入30µl5×loadingbuffer,煮沸10min以变性蛋白,于-20℃保存待用;
(3)sds-page电泳
正确组装电泳槽,放入预制胶;倒入电泳缓冲液,拔掉梳子,依次加入多色预染蛋白maker和待测样品;室温110v恒压电泳至凝胶底部结束;
(4)转膜
1)将pvdf膜于甲醇中浸泡5min,滤纸浸泡在转膜缓冲液中;
2)取出凝胶,对照marker切下包含目的蛋白的凝胶;
3)按照滤纸-pvdf膜-凝胶-滤纸的顺序铺好,去掉气泡使凝胶与膜充分接触;
4)用15v电压转膜45min;
(5)封闭
转膜结束后,取出pvdf膜,在70转/min摇床上用tbst洗涤3次,每次5min;配制5%脱脂乳作封闭液,将pvdf膜充分与封闭液接触,4℃封闭过夜;
(6)结合抗体
结合一抗:
根据抗体说明书,使用封闭液稀释occludin抗体,稀释度为1:600;兔源β-actin抗体稀释度为1:1000。取封闭后的pvdf膜置于稀释后的一抗中,室温孵育90min后,取出pvdf膜,用tbst洗涤3次,每次5min;
结合二抗:
根据抗体说明书,使用封闭液稀释二抗,使用的羊抗兔igg抗体稀释度为1:1000;取孵育一抗后的pvdf膜与稀释后二抗孵育,室温孵育60min后,取出pvdf膜,用tbst洗涤3次,每次5min;
(7)ecl法显色
取ecl试剂盒中等量a液和b液,充分混合后与pvdf膜接触,避光室温反应5min。与bio-rad凝胶成像仪采集图像,用imagelab软件扫描灰度,测定occludin蛋白水平。
实施例1
富硒乳酸菌缓解afb1(黄曲霉毒素b1)致鸡小肠肠屏障损伤的方法,步骤如下:
对于鸡小肠上皮细胞,加入硒浓度为0.01μmol/l(在培养液中的终浓度)的富硒乳酸菌,培养8h后,再向其中加入afb1,使其浓度为200μmol/l,继续培养12h后培养结束,达到抑制afb1所致鸡小肠上皮细胞occludin蛋白水平下降、减弱afb1对鸡小肠肠道屏障损伤的作用。
富硒乳酸菌在抑制afb1致鸡小肠肠屏障损伤的验证方法,步骤如下:
1.1鸡小肠上皮细胞培养与分组处理
鸡小肠上皮细胞接种于6孔板,调整细胞浓度至2×105个/孔,加样布板前要缓慢多次吹打。试验分为3组,即对照c组、afb1攻毒组(afb1毒素200μmol/l)和富硒乳酸菌组(0.01μmol/lse+afb1毒素200μmol/l),每组6个重复。细胞生长至60%-70%后,弃掉培养液并清洗2次,更换培养液:对照组和afb1攻毒组更换普通培养液;富硒乳酸菌组更换含有0.01μmol/l(以硒计)的富硒乳酸菌培养液。继续培养8h后取出细胞培养板,富硒乳酸菌组和afb1组均加入afb1,使其浓度为200μmol/l,继续培养12h后,培养结束。
1.2蛋白提取
用预冷的pbs洗涤细胞3次,每孔加入150µl的含1mmpmsf的ripa细胞裂解液,充分接触细胞后,刮下细胞移至1.5ml离心管中,于4℃继续裂解1h,每15min震荡10s以充分裂解细胞。4℃12000g离心10min,收集上清液;于-20℃保存;
1.3bca法测定蛋白浓度
将试剂盒中的蛋白标准品稀释为0.5mg/kg;
配制bca工作液:按50:1混合a液和b液;
将标准品按0、1、2、4、8、12、16和20µl加到96孔板,用生理盐水补至20µl;取2µl待测样品加到96孔板,用生理盐水补至20µl;
每孔加入200µlbca工作液,37℃孵育30min;
于540nm下测定其od值,计算样品蛋白浓度;
向待测样品中加入30µl5×loadingbuffer,煮沸10min以变性蛋白,于-20℃保存待用;
1.4sds-page电泳
正确组装电泳槽,放入预制胶;倒入电泳缓冲液,拔掉梳子,依次加入多色预染蛋白maker和待测样品;室温110v恒压电泳至凝胶底部结束;
1.5转膜
(1)将pvdf膜于甲醇中浸泡5min,滤纸浸泡在转膜缓冲液中;
(2)取出凝胶,对照marker切下包含目的蛋白的凝胶;
(3)按照滤纸-pvdf膜-凝胶-滤纸的顺序铺好,去掉气泡使凝胶与膜充分接触;
(4)用15v电压转膜45min;
1.6封闭
转膜结束后,取出pvdf膜,在70转/min摇床上用tbst洗涤3次,每次5min;配制5%脱脂乳作封闭液,将pvdf膜充分与封闭液接触,4℃封闭过夜;
1.7结合抗体
结合一抗:
根据抗体说明书使用封闭液稀释occludin抗体,稀释度为1:600;兔源β-actin抗体稀释度为1:1000。取封闭后的pvdf膜置于稀释后的一抗中,室温孵育90min后,取出pvdf膜,用tbst洗涤3次,每次5min;
结合二抗:
根据抗体说明书,使用封闭液稀释二抗,使用的羊抗兔igg抗体稀释度为1:1000;取孵育一抗后的pvdf膜与稀释后二抗孵育,室温孵育60min后,取出pvdf膜,用tbst洗涤3次,每次5min;
1.8ecl法显色
取ecl试剂盒中等量a液和b液,充分混合后与pvdf膜接触,避光室温反应5min。与bio-rad凝胶成像仪采集图像,用imagelab软件扫描灰度,测定occludin蛋白水平。
富硒乳酸菌(0.01μmol/l)缓解afb1(200μmol/l)致鸡小肠肠屏障损伤的测定结果见图2。
结果表明,200μmol/l的afb1可显著的降低鸡小肠上皮细胞中occludin蛋白的表达量(p<0.05),而0.01μmol/l(以硒计)的富硒乳酸菌能显著的提高afb1所致的鸡小肠上皮细胞occludin蛋白水平量的降低(p<0.05)。
实施例2
富硒乳酸菌缓解afb1致鸡小肠肠屏障损伤的方法,步骤如下:
对于鸡小肠上皮细胞,加入硒浓度为0.1μmol/l(在培养液中的终浓度)的富硒乳酸菌,培养12h后,再向其中加入afb1,使其浓度为300μmol/l,继续培养24h后培养结束,达到抑制afb1所致鸡小肠上皮细胞occludin蛋白水平下降、减弱afb1对鸡小肠肠道屏障损伤的作用。
富硒乳酸菌在抑制afb1致鸡小肠肠屏障损伤的验证方法,步骤如下:
2.1鸡小肠上皮细胞培养与分组处理
鸡小肠上皮细胞接种于6孔板,调整细胞浓度至2×105个/孔,加样布板前要缓慢多次吹打。试验分为3组,即对照c组、afb1攻毒组(afb1毒素300μmol/l)和富硒乳酸菌组(0.1μmol/lse+afb1毒素300μmol/l),每组6个重复。细胞生长至60%-70%后,弃掉培养液并清洗2次,更换培养液:对照组和afb1攻毒组更换普通培养液;富硒乳酸菌组更换含有0.1μmol/l(以硒计)的富硒乳酸菌培养液。继续培养12h后取出细胞培养板,富硒乳酸菌组和afb1组均加入afb1,使其浓度为300μmol/l,继续培养24h后,培养结束。
2.2蛋白提取
用预冷的pbs洗涤细胞3次,每孔加入150µl的含1mmpmsf的ripa细胞裂解液,充分接触细胞后,刮下细胞移至1.5ml离心管中,于4℃继续裂解1h,每15min震荡10s以充分裂解细胞。4℃12000g离心10min,收集上清液;于-20℃保存;
2.3bca法测定蛋白浓度
将试剂盒中的蛋白标准品稀释为0.5mg/kg;
配制bca工作液:按50:1混合a液和b液;
将标准品按0、1、2、4、8、12、16和20µl加到96孔板,用生理盐水补至20µl;取2µl待测样品加到96孔板,用生理盐水补至20µl;
每孔加入200µlbca工作液,37℃孵育30min;
于540nm下测定其od值,计算样品蛋白浓度;
向待测样品中加入30µl5×loadingbuffer,煮沸10min以变性蛋白,于-20℃保存待用;
2.4sds-page电泳
正确组装电泳槽,放入预制胶;倒入电泳缓冲液,拔掉梳子,依次加入多色预染蛋白maker和待测样品;室温110v恒压电泳至凝胶底部结束;
2.5转膜
(1)将pvdf膜于甲醇中浸泡5min,滤纸浸泡在转膜缓冲液中;
(2)取出凝胶,对照marker切下包含目的蛋白的凝胶;
(3)按照滤纸-pvdf膜-凝胶-滤纸的顺序铺好,去掉气泡使凝胶与膜充分接触;
(4)用15v电压转膜45min;
2.6封闭
转膜结束后,取出pvdf膜,在70转/min摇床上用tbst洗涤3次,每次5min;配制5%脱脂乳作封闭液,将pvdf膜充分与封闭液接触,4℃封闭过夜;
2.7结合抗体
结合一抗:
根据抗体说明书,使用封闭液稀释occludin抗体,稀释度为1:600;兔源β-actin抗体稀释度为1:1000。取封闭后的pvdf膜置于稀释后的一抗中,室温孵育90min后,取出pvdf膜,用tbst洗涤3次,每次5min;
结合二抗:
根据抗体说明书,使用封闭液稀释二抗,使用的羊抗兔igg抗体稀释度为1:1000;取孵育一抗后的pvdf膜与稀释后二抗孵育,室温孵育60min后,取出pvdf膜,用tbst洗涤3次,每次5min;
2.8ecl法显色
取ecl试剂盒中等量a液和b液,充分混合后与pvdf膜接触,避光室温反应5min。与bio-rad凝胶成像仪采集图像,用imagelab软件扫描灰度,测定occludin蛋白水平。
富硒乳酸菌(0.1μmol/l)缓解afb1(300μmol/l)致鸡小肠肠屏障损伤的测定结果见图3。
结果表明,300μmol/l的afb1可极显著的降低鸡小肠上皮细胞中occludin蛋白的表达量(p<0.01),而0.1μmol/l(以硒计)的富硒乳酸菌能极显著的提高afb1所致的鸡小肠上皮细胞occludin蛋白水平量的降低(p<0.01)。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例和附图所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!