氨磷汀作为NDM-1抑制剂或抗生素保护剂的新用途
氨磷汀作为ndm
‑
1抑制剂或抗生素保护剂的新用途
技术领域
1.本发明涉及氨磷汀的新药理用途,尤其涉及氨磷汀作为ndm
‑
1抑制剂或抗生素保护剂的新药理用途,属于氨磷汀药理活性新用途领域。
背景技术:
2.β
‑
内酰胺类抗生素杀菌活性强、毒性低、适应症广,是目前治疗敏感细菌所致感染性疾病的重要药物。β
‑
内酰胺类抗生素包括碳青霉烯类、头孢菌素类、青霉素类等,它们结构上都有一个发挥抗菌活性的β
‑
内酰胺环。随着β
‑
内酰胺类抗生素的广泛使用,使得越来越多的细菌产生由β
‑
内酰胺酶介导的耐药性。
3.产生β
‑
内酰胺酶是导致细菌耐药的重要机制之一,它可催化β
‑
内酰胺类抗生素中的β
‑
内酰胺环上的c
‑
n键断裂而开环,导致抗生素失活。基于氨基酸序列同源性,β
‑
内酰胺酶可以分为丝氨酸
‑
β
‑
内酰胺酶和金属
‑
β
‑
内酰胺酶,丝氨酸
‑
β
‑
内酰胺酶依赖于活性中心的丝氨酸发挥催化作用,可以被克拉维酸、舒巴坦和他唑巴坦等临床上使用的抗生素所抑制。金属
‑
β
‑
内酰胺酶依靠活性中心的锌离子发挥催化作用,可水解包括碳青霉烯类在内的所有β
‑
内酰胺类抗生素,广泛存在多种革兰氏阴性和阳性耐药致病菌中,临床上尚无有效的抑制剂。
4.2010年8月,《柳叶刀》杂志报道了一种水解碳青霉烯类药物的新德里金属
‑
β
‑
内酰胺酶
‑
1(ndm
‑
1),由于产ndm
‑
1细菌其广泛的耐药性导致感染治疗十分困难,称之为“超级细菌”。blandm
‑
1基因是位于质粒上,可以独立于染色体之外自主复制,并可在不同菌种之间水平转移,使原本对抗生素敏感的菌株获得耐药性。ndm
‑
1是近年来发现的影响范围最广、危害程度最严重的金属
‑
β
‑
内酰胺酶,表达ndm
‑
1细菌几乎对所有抗生素均表现出高度的耐药性,仅有替加环素和多黏菌素对其有一定的抑制作用,不断进化的突变株使得临床治疗更加艰难。ndm
‑
1能水解临床常用的β
‑
内酰胺类抗生素,而其抑制剂能够抑制ndm
‑
1酶的活性,从而保护β
‑
内酰胺类抗生素,恢复其抗菌效果,因此,寻找ndm
‑
1的抑制剂是遏制“超级细菌”引起感染最迫切的要求。
5.氨磷汀是化学治疗细胞保护药和放疗保护剂,临床主要用于各种癌症的辅助治疗,在杀伤癌细胞时能够选择性地保护正常组织细胞,可明显减轻化疗药物所产生的肾脏、骨髓、心脏、耳及神经系统的毒性,预防放疗引起的造血系统、免疫损伤等毒副反应有一定的效果,也用于减少和中性白细胞减少症相关的感染。截至目前,国内外未见氨磷汀用于ndm
‑
1抑制剂的相关报道。
技术实现要素:
6.本发明的主要目的是提供氨磷汀作为ndm
‑
1抑制剂或抗生素保护剂的新用途。
7.为了实现上述目的,本发明所采用的技术方案包括:
8.本发明一方面公开了氨磷汀作为ndm
‑
1抑制剂的新药理用途,即抑制ndm
‑
1对β
‑
内酰胺类抗生素的水解作用,恢复β
‑
内酰胺类抗生素对携带ndm
‑
1阳性菌的抗菌活性。因此,
氨磷汀能够作为抗生素保护剂,尤其是作为β
‑
内酰胺类抗生素的保护剂。
9.本发明另一方面提供了一种抑制致病菌的药物组合物,包括有效量的抗生素、抗生素保护剂和药学上可接受的载体或辅料,其中,所述的抗生素优选为β
‑
内酰胺类抗生素;所述的抗生素保护剂是氨磷汀。
10.按照本领域的常规制剂方法将所述的抑制致病菌的药物组合物制备成临床常用的制剂,譬如是粉剂、颗粒剂、片剂、胶囊剂、注射剂等,通过注射、口服、滴鼻、滴眼、物理或化学介导的方法将其导入肌肉、内皮、皮下、静脉、粘膜组织,或是被其他物质混合或包裹后导入机体。
11.所述的载体或辅料是指药学领域常规的载体或辅料,例如:稀释剂、崩解剂、润滑剂、赋形剂、粘合剂、助流剂、填充剂、表面活性剂等;另外,还可以在药物组合物中加入其它辅助剂如香味剂和甜味剂。
12.所述稀释剂可以是一种或几种增加片剂重量和体积的成分;常用的稀释剂包括乳糖、淀粉、预胶化淀粉、微晶纤维素、山梨醇、甘露醇以及无机钙盐等。其中最常用为乳糖、淀粉、微晶纤维素。
13.所述崩解剂可以为交联聚乙烯吡咯烷酮(与总重量比为2
‑
6%),交联羧甲基纤维素钠(与总重量比为2
‑
6%)、海藻酸(与总重量比为2
‑
5%)、微晶纤维素(与总重量比为5
‑
15%)中之一种或几种混合物。其中以交联聚乙烯吡咯烷酮(与总重量比为2
‑
7%),交联羧甲基纤维素钠(与总重量比为2
‑
6%)为佳。最佳为交联聚乙烯吡咯烷酮(与总重量比为2
‑
6%)。
14.所述的润滑剂包括硬脂酸,硬脂酸钠,硬脂酸镁,硬脂酸钙,聚乙二醇,滑石粉,氢化植物油中之一种或几种混合物。其中以硬脂酸镁最为适宜。润滑剂的用量范围(与总重量比)为0.10
‑
1%,一般用量为0.25
‑
0.75%,最佳用量为0.5
‑
0.7%。
15.所述的粘合剂可以是一种或几种有利于制粒的成分。可以是淀粉浆(10
‑
30%,与粘合剂总重量比),羟丙基甲基纤维素(2
‑
5%,与粘合剂总重量比),聚乙烯吡咯烷酮(2
‑
20%,与粘合剂总重量比),以聚乙烯吡咯烷酮的乙醇水溶液为佳,最佳为聚乙烯吡咯烷酮的50%乙醇水溶液。
16.所述助流剂可以为微粉硅胶、滑石粉、三硅酸镁中之一种或几种混合物。
17.所述表面活性剂可以为一种或几种能够提高润湿性和增加药物溶出的成分。常用为十二烷基硫酸钠(常用范围为0.2
‑
6%,与总重量比)。
18.本发明中所述的氨磷汀包括其原型、药学上可接受的盐或者含氨磷汀的制剂。
19.本发明中的所述β
‑
内酰胺类抗生素的代表药物是美罗培南,其分子式为:c
17
h
25
n3o5s,分子量为:383.5。
20.本发明中所述的ndm
‑
1酶是从自然界中提取或用基因工程菌制备得到重组ndm
‑
1酶。
21.本发明中所述的“致病菌”优选为革兰氏阴性或者革兰氏阳性致病细菌,更优先为ndm
‑
1阳性菌。
22.氨磷汀,别名:阿米福汀、依硫磷酸,化学名称为2
‑
(3
‑
氨基丙胺基)
‑
乙硫醇磷酸酯。其分子式:c5h
15
n2o3ps,分子量:214.2,白色结晶粉末或冻干块状物,有微臭味,熔点160
‑
161℃,易溶于水,是硫磷衍生物,其结构式如下:
[0023][0024]
本发明通过ndm
‑
1酶抑制试验、酶抑制率与半抑制浓度测定、棋盘法测定最小抑菌浓度以及时间
‑
杀菌曲线法等发现氨磷汀能够抑制ndm
‑
1的活性并恢复美罗培南对携带ndm
‑
1耐药菌的抗菌活性,用于治疗ndm
‑
1阳性细菌感染性疾病,具有广泛的医用用途。
[0025]
本发明整体技术方案详述
[0026]
本发明首先以蛋白质数据库中ndm
‑
1(pdb:4ey2)晶体结构为靶标蛋白,应用计算机辅助药物设计软件glide和maestro,采用分子对接的方法计算氨磷汀与ndm
‑
1配体结合部位的结合自由能。分子对接结果发现,对接产物结合自由能小于
‑
10.0kcal/mol,且氨磷汀紧密结合在ndm
‑
1以锌离子为中心的活性区域,因此氨磷汀被视为具有潜在ndm
‑
1抑制作用的候选化合物。
[0027]
在此基础上,本发明进一步检测了氨磷汀对ndm
‑
1酶抑制活性,检测结果表明氨磷汀能够剂量依赖地抑制ndm
‑
1酶的活性,最大抑制率为82.3%,ic50为25.4
±
0.6μm。
[0028]
最小抑菌浓度试验结果表明,氨磷汀单独使用不具备抑菌效果,氨磷汀与美罗培南联合使用能够使美罗培南对ndm
‑
1阳性大肠杆菌mic值降低16倍。fic指数表明氨磷汀与美罗培南联合使用,对抑制产ndm
‑
1的菌株有显著的协同作用。
[0029]
根据时间
‑
杀菌曲线的试验结果可见,氨磷汀联用美罗培南能够显著抑制ndm
‑
1阳性大肠杆菌的生长。
附图说明
[0030]
图1为氨磷汀
‑
ndm
‑
1复合物体系活性区域结合模式图。
[0031]
图2为氨磷汀联用美罗培南对ndm
‑
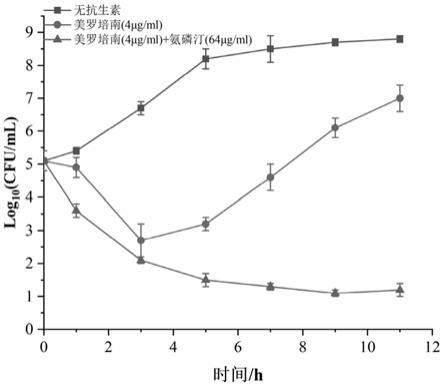
1阳性大肠杆菌的时间杀菌曲线。
具体实施方式
[0032]
以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0033]
试验例1氨磷汀与靶蛋白ndm
‑
1的分子对接试验
[0034]
本试验以蛋白质数据库中ndm
‑
1(pdb:4ey2)晶体结构为靶标蛋白,应用计算机辅助药物设计软件glide和maestro,采用分子对接的方法计算氨磷汀与ndm
‑
1配体结合部位的结合自由能。
[0035]
分子对接结果发现,对接产物结合自由能小于
‑
10.0kcal/mol,且氨磷汀紧密结合在ndm
‑
1以锌离子为中心的活性区域(图1),因此氨磷汀被视为具有潜在ndm
‑
1抑制作用的候选化合物。
[0036]
试验例2 ndm
‑
1蛋白的表达及分离纯化
[0037]
通过ecorⅰ和xhoⅰ酶切位点,将blandm
‑
1的基因序列插入到pet32(α)质粒中,构建
pet32(α)
‑
ndm
‑
1重组质粒,经dna测序验证,在连接过程中blandm
‑
1基因无突变。
[0038]
把重组质粒转入大肠杆菌bl21(de3)感受态细胞中,通过氨苄青霉素平板进行筛选,挑选单克隆菌落,接种到5ml lb液体培养基,37℃180rpm振荡过夜,将50%甘油与菌液按1:1的比例混合,于
‑
80℃保存工程菌e.coli bl21(de3)
‑
pet32(α)
‑
ndm
‑
1。
[0039]
将工程菌在含有氨苄青霉素的lb培养基中,37℃、180rpm培养至od值为0.6
‑
0.8的对数生长期,应用终浓度为1mm的异丙基
‑
β
‑
d
‑
硫代半乳糖苷(iptg),37℃诱导诱导4.5h,4℃离心收集细菌。
[0040]
将收集的细菌用磷酸盐缓冲液(pbs,ph=8.0)重悬,超声细胞破碎仪冰浴破碎菌液,将细菌裂解液离心,收集上清过ni
‑
nta his标签亲和层析柱,使用0、10、20、40、250mm浓度咪唑梯度洗脱,分离纯化ndm
‑
1蛋白。最后将ndm
‑
1蛋白使用分子截留量为10kd透析袋,透析36h除盐,使用分子截留量10kd超滤管浓缩,sds
‑
page印记检测ndm
‑
1蛋白表达纯化结果,获得纯度大于90%的ndm
‑
1重组蛋白。
[0041]
试验例3氨磷汀对ndm
‑
1酶活性抑制试验
[0042]
酶抑制活性反应体系中包括120μm美罗培南为底物、10mm 4
‑
羟乙基哌嗪乙磺酸(hepes,ph=8.0)为缓冲液、ndm
‑
1酶量为3.0u和不同浓度梯度的氨磷汀溶液。30℃条件下孵育15min,利用酶标仪295nm波长检测酶活性。同时用edta做阳性对照,dmso做阴性对照。空白对照组既不含抑制剂也不含有酶,作为体系的底值。反应在96孔板中进行,每个反应均设置3个复孔。
[0043]
具体过程如下:
[0044]
首先将ndm
‑
1酶用缓冲液配置成浓度3.0u的溶液,置于30℃孵育10min,使得zn
2+
充分占据活性中心;将氨磷汀溶于缓冲液中,配制成100mm浓度的母液,再将母液梯度稀释,加入到ndm
‑
1酶中,30℃孵育10min,使氨磷汀与酶充分结合;在96孔板反应体系中加入50μl美罗培南,置于酶标仪中振荡混匀,30℃孵育15min检测295nm紫外吸收变化。计算不同浓度的氨磷汀对ndm
‑
1酶水解底物的抑制率,抑制率的计算公式如下:
[0045]
抑制率(%)=(1
‑
氨磷汀样品酶反应速率/阴性对照孔的平均酶反应速率)
×
100%
[0046]
计算氨磷汀对ndm
‑
1的半抑制浓度ic50值。
[0047]
检测结果表明氨磷汀能够剂量依赖地抑制ndm
‑
1酶的活性,最大抑制率为82.3%,ic50为25.4
±
0.6μm。
[0048]
试验例4最小抑菌浓度试验
[0049]
取2μl ndm
‑
1阳性大肠杆菌接种至5ml lb培养基中,37℃、180rpm振荡培养活化约12h至细菌处于对数生长期后期。取菌液至mh肉汤培养基中,调整菌液浓度至5
×
106cfu/ml,采用微量肉汤稀释法分别进行氨磷汀、美罗培南(浓度梯度为1
‑
2048μg/ml)的药敏试验,同时设置不含美罗培南的菌悬液作阳性对照,mh肉汤作阴性对照。将96孔板在37℃培养24h后,读取mic结果,均平行操作3次,药物mic值为96孔板中浑浊孔的前一个澄清孔的药物浓度。
[0050]
取上述活化培养的菌液,采用棋盘法配96孔板,同时检测77种可能的浓度组合,加入不同浓度组合的氨磷汀、美罗培南,并将96孔板置于37℃恒温生化培养箱中孵育24h,进行氨磷汀、美罗培南二者联用抗ndm
‑
1阳性菌的抑菌活性实验,确定二者联合应用的最小抑
菌浓度mic值。同时设置阴性对照组和阳性对照组,均平行操作3次,根据mic值计算部分抑菌浓度指数fic值,计算方法如下:
[0051]
fic=mic(美罗培南联用)/mic(美罗培南单用)+mic(氨磷汀联用)/mic(氨磷汀单用)
[0052]
当fici≤0.5,二者为协同作用;0.5<fici≤4,二者为无关作用;fici>4,两者为拮抗作用。
[0053]
表1美罗培南联用氨磷汀对表达ndm
‑
1阳性大肠杆菌的mic值及fic值
[0054][0055]
最小抑菌浓度试验结果表明,氨磷汀单独使用不具备抑菌效果,氨磷汀与美罗培南联合使用能够使美罗培南对ndm
‑
1阳性大肠杆菌mic值降低16倍。fic指数表明氨磷汀与美罗培南联合使用,对抑制产ndm
‑
1的菌株有显著的协同作用。
[0056]
试验例5时间
‑
杀菌曲线试验
[0057]
从ndm
‑
1阳性大肠杆菌的纯培养平皿上挑取单菌落接种于mh肉汤培养基中37℃培养6
‑
8h,取细菌培养物,用麦氏比浊仪以无菌生理盐水调节菌液浓度至5
×
107cfu/ml,再以无菌mh肉汤10倍稀释,使其终浓度为106cfu/ml。
[0058]
设置无抗生素空白对照组、4μg/ml美罗培南组、4μg/ml美罗培南与64μg/ml氨磷汀联用组。试验组与对照组在同样菌液浓度的条件下于37℃培养,分别于0、1、3、5、7、9、11h从各组取出定量培养液转种于相应琼脂培养基中,37℃培养18~24h后作菌落计数,以菌落数的对数为纵坐标,以培养时间为横坐标,绘制时间
‑
杀菌曲线(图2)。
[0059]
根据图2的时间
‑
杀菌曲线可见,氨磷汀联用美罗培南能够显著抑制ndm
‑
1阳性大肠杆菌的生长。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1