创伤酸在制备抗肥胖药物或抗肥胖保健品中的应用的制作方法
1.本发明属于医药技术领域,具体涉及创伤酸在制备抗肥胖药物或抗肥胖保健品中的 应用。
背景技术:
2.肥胖是以白色脂肪组织在体内过多积聚为主要特征的慢性营养障碍性疾病,已成为 全球严重的公共卫生问题之一。肥胖危害巨大,不但直接影响身心健康,还是引发2型 糖尿病、心脑血管病、高血压等疾病的重要危险因素。因此,深入探讨肥胖发生发展的 内在机制、寻找健康有效的干预措施刻不容缓。
3.目前饮食控制、运动疗法、行为疗法是肥胖的常规干预手段,在实施过程中却往往 由于短期见效慢、持续时间长、难以坚持而收效甚微;药物与手术治疗虽可作为常规干 预措施难以奏效或严重肥胖症时的被动选择,但也因药物存在副作用、手术费用高且有 术后并发症的风险和再发可能而难以获得广泛应用。有效防治措施的缺失,使全球肥胖 人数不减反增。截止目前,国外批准上市治疗肥胖的药物有五种:氯卡色林、芬特明及 复方芬特明/托吡酯、纳曲酮/安非他酮、奥利司他和利拉鲁肽,在我国,目前国家药品 监督管理局批准上市、可用于减肥的只有奥利司他,而这些药物都会存在一些副作用, 如:氯卡色林是一种可以减少食物摄入和体重,但不影响能量代谢的药物,最常见副作 用有头痛、头晕、疲劳、恶心、口干和便秘等;芬特明或复方芬特明/托吡酯胶囊:芬特 明产生抑制食欲的效果,托吡酯会增强饱腹感,其主要副作用有高血压、心悸、头痛、 焦虑、口干、便秘等;纳曲酮/安非他酮复合缓释片,通过中枢神经系统抑制食欲,促进 能量消耗,常见副作用有恶心、呕吐、便秘、腹泻、失眠等。专利cn102225078a公开 了一种肥胖剂,其以鼠李糖乳杆菌的微生物为有效成分,其有效性和安全性较好。专利 cn103442561a公开了calebina在抑制脂肪形成中的能力及其在肥胖管理中的应用, calebina显著的生物调节特性包括抑制瘦素的产生,增加脂连蛋白的表达和抑制由促炎 性细胞因子肿瘤坏死因子(tnf
‑
α)、白介素
‑
6(il
‑
6)和白介素
‑
1(il
‑
1β)引起的局部 (脂肪细胞)和全身性炎症。
4.目前肥胖相关研究大部分集中在蛋白及小分子多肽等的研究,但最终只停留在机制 阶段,因此有必要从新的代谢角度出发,提出创新代谢物。近几年随着代谢组学的兴起, 发现代谢物小分子在不同的研究领域发挥着功能,如:脂质代谢物磷脂酰胆碱pc可以 通过在脂肪组织中诱导pgc
‑
1α和prdm16来协调脂质分解代谢和热基因表达,从而预 防肥胖症和相关的代谢异常;反式肉桂酸通过激活β3
‑
ar和ampk信号传导途径诱导 白色脂肪细胞褐变,增加脂肪细胞的能量代谢。
5.创伤酸(ta),正式名称为反式2
‑
十二碳烯二酸,是一种单不饱和二元羧酸,是一 种植物激素,天然存在于植物中。该化合物首先由美国化学家james english jr.和jamesfrederick bonner以及荷兰科学家arie jan haagen
‑
smit于1939年从受伤的豆类植物中分 离出来。创伤酸是植物中一种有效的伤口愈合剂(“伤口激素”),刺激创伤部位附近的 细胞分裂以形成保护性愈伤组织并治愈受损组织。外伤酸用作前列腺素合成的中间体。 由
于其粘膜再上皮化活性,它也是一些医药产品的成分,例如牙科学凝胶restomyl。植 物中ta的生物合成从亚油酸或亚麻酸开始,而在动物细胞中,类似的途径是脂肪酸的 ω
‑
氧化途径。ta的分子量为228.2848,化学式为c
12
h
20
o4,其化学结构式如下式1所 示,其属于一类被称为中链脂肪酸的有机化合物。ta在体外成纤维细胞中表现出多种 复杂的活性,对胶原蛋白生物合成显示出抗氧化和刺激作用,可用于治疗与氧化应激和 胶原蛋白生物合成障碍相关的许多皮肤病。在乳腺癌细胞中,ta又表现出具有潜在的 抗癌特性和肿瘤预防活性:通过降低乳腺癌细胞增殖和活力、gsh/gssg比率和硫醇基 团含量,增加caspase7活性、膜脂过氧化和ros含量来减少乳腺癌细胞的生长。目前 人类代谢组数据库(hmdb)显示ta(hmdb0000933)是一种显示它是一种人体代谢 物,主要定位在人的细胞外和细胞膜。
[0006][0007]
因此,亟需提供一种安全、有效、普适的减肥产品。
技术实现要素:
[0008]
发明目的:为了克服现有技术中存在的不足,本发明提供了创伤酸在制备抗肥胖药 物或抗肥胖保健品中的应用。本发明首次发现创伤酸可以显著抑制脂肪细胞的分化,减 轻脂质蓄积,揭示了其在脂肪细胞中的功能与机制具有创新性及安全性。本发明可填补 ta在脂肪细胞分化研究中的空白,有助于进一步阐明脂肪细胞分化的调控机制,并为 肥胖的预防和/或治疗提供新线索和潜在的干预新靶标。
[0009]
技术方案:为实现上述目的,本发明的技术方案如下:
[0010]
一方面,本发明提供了一种如式1所示结构的创伤酸在制备抑制脂肪细胞分化的组 合物中的应用。
[0011]
其中,式1结构式为:
[0012][0013]
又一方面,本发明提供了一种如式1所示结构的创伤酸在制备抗肥胖药物中的应用。
[0014]
其中,式1结构式为:
[0015][0016]
具体地,所述的创伤酸的浓度为5
‑
1000μm,优选为50μm。
[0017]
其中,具有式1所示结构的创伤酸可以为市售。
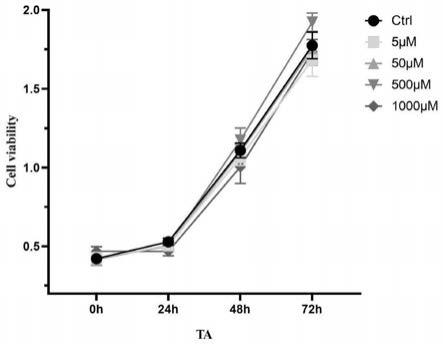
[0018]
又一方面,本发明提供了一种抗肥胖药物,所述的抗肥胖药物包含如式1所示结构 的创伤酸。
[0019]
其中,式1结构式为:
[0020][0021]
具体地,所述的抗肥胖药物还包括药学上可接受的载体,所述的载体为缓释剂、赋 形剂、填充剂、粘合剂、润湿剂、崩解剂、吸收促进剂、吸附载体、表面活性剂或润滑 剂中的任意一种或多种。
[0022]
具体地,所述的抗肥胖药物为外用制剂、口服制剂或注射制剂中的任意一种。
[0023]
进一步具体地,所述的外用制剂为喷雾剂或气雾剂。
[0024]
进一步具体地,所述的口服制剂为颗粒剂、胶囊剂、片剂或囊泡剂中的任意一种。
[0025]
进一步具体地,所述的注射制剂采用皮内、皮下、肌内、局部或静脉内注射作为给 药方式。
[0026]
又一方面,本发明提供了一种如式1所示结构的创伤酸在制备抗肥胖保健品中的应 用。
[0027]
其中,式1结构式为:
[0028][0029]
具体地,所述的创伤酸的浓度为5
‑
1000μm,优选为50μm。
[0030]
又一方面,本发明提供了一种抗肥胖保健品,所述的抗肥胖保健品包含如式1所示 结构的创伤酸。
[0031]
其中,式1结构式为:
[0032][0033]
有益效果:与现有技术相比,本发明的积极和有益效果在于:
[0034]
1)本发明首次发现创伤酸在不影响脂肪细胞活力的情况下能够显著抑制脂肪的分 化,有效的抑制了脂滴的蓄积,揭示了其在脂肪细胞中的功能与机制具有创新性及有效 性。
[0035]
2)ta是一种来源于植物的天然的抗氧化抗癌的有益成分,因此其作为一种减肥药 物或减肥产品,具有较好的安全性。
[0036]
3)本发明可填补ta在脂肪细胞分化研究中的空白,有助于进一步阐明脂肪细胞分 化的调控机制,并为肥胖的预防和/或治疗提供新线索和潜在的干预新靶标。
附图说明
[0037]
附图1为cck8检测ta对前体脂肪细胞活性的影响结果图。
[0038]
附图2为ta对前体脂肪细胞的成脂分化影响结果图,其中,a为油红o染色及定 量
结果图,b为甘油三脂实验检测成脂情况结果图。
[0039]
附图3为ta对前体脂肪细胞的成脂分化影响结果图,其中,a为长效刺激结果图, b为短效刺激结果图。
[0040]
附图4为ta抑制前体脂肪细胞成脂分化关键基因及蛋白的表达检测结果图,其中,a为基因的表达检测结果图,b为蛋白的表达检测结果图。
[0041]
附图5为rna测序检测ta作用后下游基因的变化结果图,其中,a为转录组学 分析的火山图,b为转录组学分析的热图。
[0042]
附图6为go分析ta作用后差异性表达基因涉及的信号通路结果图。
[0043]
附图7为kegg分析ta作用后差异性表达基因涉及的信号通路结果图。
[0044]
附图8为ta对ferroptosis关键蛋白的影响结果图,其中,a为蛋白的表达检测结 果图,b为统计检测结果图。
具体实施方式
[0045]
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发 明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注 明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如 无特殊说明,均可从商业途径得到。
[0046]
实施例中未注明具体技术或条件者,均按照本领域内的文献所描述的技术或条件 (如参考j.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》,第三版,科学出版 社)或者按照产品说明书进行。
[0047]
本发明采取独立重复实验,均重复3次。实验数据采用spss18.0统计分析软件分 析,计量资料以均数
±
标准差表示,两样本均数之间的比较,经正态性检验和方差齐性 检验后,采用t或t'检验,p<0.05提示差异有统计学意义。
[0048]
实施例1.前体脂肪细胞诱导分化方案
[0049]
人内脏前体脂肪细胞,购于sciencell公司(cat:7210),培养于37℃,5%co2培 养箱,培养至100%后进行诱导分化,诱导分化体系及方案如下。
[0050]
诱导分化剂i(100ml体系):dmem/f12培养基:97.2ml;ibmx:称取11.5mg, 加入500μl 0.5n的koh助溶;胰岛素(1mg/ml):290μl,终浓度500nm;地塞米松 (0.1mm):1ml,终浓度1μm;罗格列酮(20mm):5μl,终浓度1μm;p/s:1ml。 维持4天。
[0051]
诱导分化剂ii(100ml体系):dmem/f12培养基:98.7ml;胰岛素(1mg/ml): 290μl,终浓度100nm;p/s:1ml。维持4天。
[0052]
实施例2.不同浓度ta对前体脂肪细胞活性的影响
[0053]
以人内脏前体脂肪细胞为研究对象,ta标准品(mce,中国,cat:hy
‑
119358) 设立不同浓度(0μm、5μm、50μm、500μm、1000μm)ta干预组进行时间点细胞活性 检测。
[0054]
实验方法:采用cck8检测细胞活性,人内脏前体脂肪细胞悬液以每孔100μl约 3000个细胞接种于96孔板,贴壁后换成含不同ta浓度的pam完全培养基(sciencell, cat:7211)。由于cck8试剂中wst
‑
8可能与还原剂反应生成wst
‑
8formazan,ta在 文献中被证明具有抗氧化活性,如果使用还原剂(例如一些抗氧化剂)会干扰检测,因 此在待检测体系中去除了ta的影响(检测前将含不同ta浓度的pam完全培养基换成 无ta的pam完全培养基),
24h、48h、72h后,每孔加入10μl的cck8溶液,培养箱 孵育1h,450nm测定吸光度(a)值。
[0055]
检测结果如图1所示,5
‑
1000μm的ta连续处理脂肪细胞24h、48h、72h后对细胞 的活性无影响。最终选择50μm的终浓度作为处理浓度,进行后续实验。
[0056]
实施例3.ta对前体脂肪细胞的成脂分化的影响
[0057]
以人内脏前体脂肪细胞为研究对象,以50μm浓度的ta加入诱导培养基中,利用 诱导脂肪细胞分化培养基培养人前体脂肪细胞以诱发细胞分化,在细胞分化过程中每隔 一天向培养体系中添加ta干预,分化8天后,利用油红o染色和甘油三酯含量测定评 估脂肪细胞分化效率,检测结果如图2所示。
[0058]
实验方法:
[0059]
3.1.油红o实验检测人内脏前体脂肪细胞成脂情况
[0060]
3.1.1.油红o染色
[0061]
1)分化成熟的脂肪细胞弃去培养基,pbs洗2遍,4%多聚甲醛1ml/孔固定30min;
[0062]
2)油红o染色液配置:采用油红o染色试剂盒(sciencell油红o试剂盒0843) 配置工作液:储备液:ddh2o=3:2比例配置;
[0063]
3)过滤:配置溶解好的油红,用0.22μm滤膜过滤2遍,注意轻柔操作;
[0064]
4)固定:pbs清洗细胞3遍,采用sciencell细胞固定液固定20min;
[0065]
5)染色:固定好的细胞,吸弃固定液,pbs洗两遍,加入油红工作液后置于37℃ 温箱,染色30min;
[0066]
6)染色完成后弃去染色液,ddh2o润洗5遍,注意不要正对着细胞冲洗;加入适 量pbs,显微镜下拍照。
[0067]
3.1.2.油红o定量
[0068]
1)细胞染色固定后,加入150μl细胞裂解液,500μl异丙醇反复吹打混匀;
[0069]
2)800rpm/min,离心3分钟,小心吸取上面的上清,加入96孔板,每孔100微升;
[0070]
3)在酶联免疫机检测其在520nm波长处检测吸光度值。
[0071]
3.2.甘油三脂实验检测成脂情况(普利来组织甘油三酯测定试剂盒e1013)
[0072]
1)细胞裂解:分化成熟的脂肪细胞,pbs洗涤1
‑
2遍以去除甘油,后按比例每1
×
106个细胞加入0.1ml裂解液,移液器吸头刮下细胞混匀后室温静置10分钟;
[0073]
2)裂解液处理:吸取适量上清转移到1.5ml离心管中,余下的裂解液可用bca法 蛋白定量试剂盒进行蛋白定量;细胞裂解液置于70℃,混匀加热10min;加热完成后室 温2000
×
rpm离心5min,上层清液即可进行酶学检测;
[0074]
3)工作溶液配制:试剂r1与试剂r2按4:1比例混合即可,最好当天配制,变 色弃去;
[0075]
4)标准品稀释:4mm甘油标准品使用蒸馏水或与缓冲液一致的液体等比稀释,一 般4
‑
6管即可,设置0浓度对照反应管;
[0076]
5)待测样品10μl/孔,工作液190μl/孔,混匀后置于37℃10min或25℃30min, 反应平衡后60min内颜色均稳定;
[0077]
6)于550nm处测定各管od值。
[0078]
由图2a可知,油红整体照片可见ta干预组成脂水平受到明显抑制,对应200
×
光 镜下可见,ta干预组细胞内脂滴的数量明显减少,油红o定量结果也显示了ta组较 对照组
相比显著降低脂质蓄积,且差异具有统计学意义(p<0.05)。
[0079]
由图2b可知,甘油三脂含量检测也显示,50μm浓度ta干预分别抑制了约38%的 甘油三酯水平。
[0080]
以上数据表明,ta对人前体脂肪细胞的成脂分化有抑制作用。
[0081]
实施例4.mito tracker染色检测线粒体膜电位水平
[0082]
实验方法:
[0083]
1)短效刺激:人前体脂肪细胞诱导分化成熟后,采用50μm的ta刺激24小时后 用mito tracker染色检测线粒体膜电位;长效刺激:在细胞分化过程中每隔一天向培养 体系中添加50μm的ta,在分化第8天采用mito tracker染色检测线粒体膜电位。
[0084]
2)mito
‑
tracker red cmxros储存液的配制(1mm):取一管50μg mito
‑
tracker red cmxros粉末(invitrogen m7512)加入94μl的无水dmso,充分溶解后,得到浓度为1mm的mito
‑
tracker red cmxros储存液,适当分装后避光保存于
‑
20℃或更低温度;
[0085]
3)工作液配制及活化探针(100nm):取1μl的储存液于10ml的无血清的pam 体系中,混匀后于37℃避光孵育1h;
[0086]
4)mito tracker染色:去除mito
‑
tracker red cmx ros工作液,加入37℃预温育 的新鲜细胞培养液。用荧光显微镜、激光共聚焦显微镜或荧光酶标仪进行观察或检测。 此时可观察到线粒体呈明亮的强荧光染色;
[0087]
5)细胞固定:染色完成后,用pbs清洗5遍,加入细胞固定液1ml,固定30min;
[0088]
6)通透处理:加入含有0.2%的triton通透15min,注意避光,放置37℃孵箱;
[0089]
7)37℃孵育结束后,吸除上清,用pbs(1
×
)洗涤3次,每次5min;
[0090]
8)拍照:最后加入300μldapi抗荧光淬灭封片液,激光共聚焦显微镜下观察。
[0091]
mito tracker结果显示无论是长效刺激(图3a)还是短效刺激(图3b),ta处理 组和对照组之间荧光信号强度差异不明显,说明50μm的ta对脂肪细胞线粒体膜电位 没有影响。
[0092]
实施例5.脂肪细胞分化相关基因表达mrna表达水平
[0093]
以人内脏前体脂肪细胞为研究对象,以50μm浓度的ta加入诱导培养基中,利用 诱导脂肪细胞分化培养基培养人前体脂肪细胞以诱发细胞分化,在细胞分化过程中每隔 一天向培养体系中添加ta干预,分化7天后(按照实施例1的方案进行处理,在第7 天提取rna),收集脂肪细胞并分别提取rna,通过qpcr检测成脂分化关键基因 (cebpα、cebpβ、pparγ、pparα、fabp4、plin1)mrna的表达水平,具体实验 方法如下。
[0094]
5.1.细胞总rna提取
[0095]
离心机4℃预冷,65℃预热rnase
‑
free ddh2o,实验台于操作前经75%酒精拭擦、 清洁纱布拭擦、以及rnasezap喷洒等处理。
[0096]
1)取出
‑
80℃冻存的细胞裂解液(trizol),待裂解液融化后置于室温裂解10min。
[0097]
2)按比例(trizol:氯仿=1:0.2)加入氯仿,剧烈振荡30sec后,12000rpm/min, 4℃离心15min。离心结束后液体分为三层:水相(无色上层)、中间相(白色)、有机 相(红色下层)。
[0098]
3)取上层水相200
‑
300μl转移至新的rnase
‑
free离心管中,加入1.5倍体积无水 乙醇,votex充分混匀后小离。
cdna 或10
‑
100ng gdna。
[0121]
正、反向引物分别如下表3所示。
[0122]
表3
[0123]
geneforward sequence(5'to3')sequencereverse(5'to3')h
‑
ppiattcatctgcactgccaagactcgagttgtccacagtcagch
‑
cebpαctgtgtcaccacccaaatccttattgtgtcgagaaaaggaccttgah
‑
cebpβgacaagcacagcgacgagtaagctgctccaccttcttctgh
‑
pparγgctgtgcaggagatcacagagggctccataaagtcaccaah
‑
pparaggcgaacgattcgactcaagtccaaaacgaatcgcgttgth
‑
plin1cacctgccttacatggcttgttctggaagcattcgcaggth
‑
fabp4actgggccaggaatttgacgctcgtggaagtgacgcctt
[0124]
反应体系配好后,盖上反应盖,充分涡旋混匀,离心。将反应液分装到每个反应孔 中。封上贴膜,离心,避免产生气泡。
[0125]
5)运行qpcr反应程序:将反应板放在荧光定量pcr仪上,根据需要选择快速或 标准pcr反应程序,并按照以下表格设置反应参数。
[0126]
标准模式(引物tm≥60℃,下表4):
[0127]
表4
[0128][0129][0130]
设置熔解曲线模式(下表5):
[0131]
表5
[0132]
阶段升降温速度温度时间11.6℃/秒95℃15秒21.6℃/秒60℃1分钟30.15℃/秒95℃15秒
[0133]
采用δδct法计算mrna的相对表达量(利用ppia进行标化):mrna相对表达 量=2
(
△
ct(control)
‑△
ct(mrna))
[0134]
检测结果如图4a所示,50μm浓度ta干预后,脂肪生成及脂肪酸转运等相关基因 的mrna水平均下调(cebpα、cebpβ、fabp4、plin1、pparα及pparγ)。
[0135]
实施例6.脂肪细胞分化相关蛋白表达水平
[0136]
6.1.细胞蛋白质提取:
[0137]
培养细胞的大皿中加入4℃预冷的ripa裂解液(已加过蛋白酶抑制剂及磷酸酶抑 制剂),500μl/孔,利用移液器吸头刮下细胞收集至1.5ml ep管中,冰上静置裂解30min。 裂
解完成后于4℃,12000rpm离心30min,取上清即为提取蛋白质。
[0138]
6.2.bca法蛋白定量(碧云天,中国,cat:p0012):
[0139]
1)工作液配制:a液:b液=50:1;
[0140]
2)蛋白标准品按如下所示配制标准曲线:
[0141]
蛋白标准品(μl)0、1、2、4、8、12、16、20;
[0142]
pbs(或ddh2o)(μl)20、19、18、16、12、8、4、0。
[0143]
3)加样:样品(可根据经验适量稀释)/标准品20μl/孔,工作液200μl/孔,小心 混匀;
[0144]
4)37℃反应30min;
[0145]
5)测562nm波长处od值。根据标准曲线计算蛋白浓度。
[0146]
6.3.western blot实验
[0147]
1)采用预制胶(天地人和,中国,sle009)上样:
[0148]
依据所测蛋白浓度调整上样量,一般为20
‑
80μg/孔,上样体积一般为10
‑
30μl;
[0149]
2)电泳:
[0150]
一般采用恒压电泳,70v 30min,待蛋白maker条带分离后调整电压为140v 60min。 依据目的蛋白分子量大小切取所需范围的胶;
[0151]
3)转膜:
[0152]
依据胶的大小裁取pvdf膜,于甲醇中浸泡2
‑
3min激活,转膜时注意去除膜与胶 之间气泡,300mah,90min,注意降温,可置于冰盒中进行(转膜电流大小主要依据目 的蛋白分子量大小);
[0153]
4)封闭:
[0154]
转膜完成后将膜转移至wb抗体孵育盒中,加入适量封闭液,一般为5%的脱脂奶 粉。室温摇床封闭1
‑
2h;
[0155]
5)一抗孵育(表6):
[0156]
根据抗体说明书利用一抗稀释液稀释抗体,置于摇床4℃孵育过夜;
[0157]
6)一抗回收:
[0158]
回收一抗,tbst(雅酶,中国,cat:ps103s)洗膜,3次,每次10min;
[0159]
7)二抗孵育(表6):
[0160]
hrp标记小鼠或兔二抗,利用二抗稀释液1:5000稀释,室温孵育1
‑
2h;
[0161]
8)二抗回收:
[0162]
回收二抗,tbst洗膜,3次,每次10min;
[0163]
9)显影:
[0164]
采用ta干预后,fabp4和pparγ的蛋白水平显著下调。
[0165]
表6
[0166]
抗体名称种属品牌货号fabp4rabbitabcamab92501β
‑
actinrabbitaffinity biosciencesaf7018pparγrabbitabcamab272718hrp山羊抗小鼠genetexgtx213111
‑
01
[0167]
实施例7.ta影响脂肪细胞分化机制(rnaseq分析)
[0168]
采用rna
‑
seq方法对ta干预后差异表达的基因进行了筛选与分析,共检测到62492 条基因,其中324条基因差异显著(倍数变化>2,p<0.01),其中,与对照组相比,188 条基因下调,136条基因上调(图5)。进一步利用go分析列出了前10个富集的生物 过程,其中包括氧化应激信号通路(go:0016209),表明ta干预后差异表达的基因可 能参与这些生物过程(图6)。kegg途径分析差异表达的基因,观察到脂肪酸降解信号 通路(hsa00071)作用丰度最高,其次为脂肪酸代谢(hsa01212)、ppar信号通路 (hsa03320),此外铁死亡(hsa04216)信号通路及胰岛素信号通路(hsa04931)(图7)。 在这些信号通路中,脂肪酸降解信号通路、ppar信号通路及铁死亡信号通路均与脂肪 细胞形成密切相关。
[0169]
实施例7.显著聚类信号通路的验证
[0170]
以人内脏前体脂肪细胞为研究对象,培养过程中50μm的ta干预,并通过wb检 测显著聚类的信号通路活性。检测铁死亡通路蛋白相关信息如下表7所示。
[0171]
表7
[0172]
抗体名称种属品牌货号β
‑
actinrabbitaffinity biosciencesaf7018nrf2rabbitabcamab62352acsl4rabbitabcamab155282trfcrabbitabcamab214039gpx4rabbitabcamab125066hrp山羊抗小鼠genetexgtx213111
‑
01
[0173]
检测结果如图8所示,铁死亡相关信号通路中,蛋白结果显示,ta组能显著上调 铁死亡相关通路中的nrf2的蛋白水平,下调acsl4蛋白水平,nrf2在铁死亡通路中能 够起到抗氧化作用,能够阻止铁死亡的发生,而acsl4蛋白促进铁死亡,在铁死亡的 进程中上调。结果表明ta能够通过促进nrf2的表达、抑制acsl4蛋白表达,从而阻 止铁死亡发生,抑制脂质蓄积。
[0174]
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员 来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也 应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1