一种胶原蛋白植入剂及其制备方法与流程
1.本发明涉及美容领域,具体地,本发明涉及一种胶原蛋白植入剂及其制备方法。
背景技术:
2.随着社会与经济的发展和人们生活水平的日渐提高,人们对自身形象的关注度与日俱增,如何保持面部年轻化成为现代人们关注的焦点之一,而皮肤填充剂是当下社会最受瞩目的恢复年轻态的技术。理想的软组织可注射植入剂应该具有原料易得及良好的生物相容性和稳定性,具备安全可靠、适应性强、创伤小且效果维持时间长、不需做过敏测试、无不良反应、操作方便且储存时间长等优点,而目前市场上的相关产品还不是最理想的可注射植入剂。
3.目前市场上可用于整形美容外科的可注射填充材料包括:胶原蛋白、透明质酸钠、羟基磷灰石、聚乳酸、a型肉毒素。这几类材料还可以与不可吸收的高分子材料(如聚甲基丙烯酸甲酯,简称“pmma”)复合作为填充剂。
4.(1)透明质酸
5.透明质酸及其衍生产品作为皮肤填充剂已大量应用于整形美容行业,目前国内市场共有不下30家制造商提供的数十个品牌的透明质酸注射产品,因此这也是目前市面上使用最广,最易获得的皮肤填充剂产品。但是在大量的临床使用中发现,反复注射透明质酸后,皮肤松陷不回弹,有颗粒感,且瘀斑、疼痛和治疗后肿胀的发生率比胶原更高。
6.(2)羟基磷灰石和左旋聚乳酸
7.羟基磷灰石和左旋聚乳酸均用于修复深层缺陷,疗效可维持1
‑
2年。但羟基磷灰石多用于骨轮廓填充,且多与其它生物材料组成复合材料进行填充。左旋聚乳酸目前只被fda批准使用于人类免疫缺陷病毒感染相关的面部脂肪萎缩。
8.(3)a型肉毒素
9.a型肉毒素是肉毒杆菌在繁殖中分泌的一种有毒性的蛋白质,是一种神经毒素。最早临床主要是用于麻痹肌肉神经,治疗肌肉痉挛症,治疗效果良好,后来加拿大一位眼科教授偶然才发现可使眼部皱纹消失,于是开始用于美容注射,但是这种产品注射技术要求特别高,过量易导致中毒。
10.(4)胶原蛋白填充剂
11.其中胶原蛋白是一类天然蛋白质,作为皮肤组织的主要组分,是纠正面部软组织缺陷的较为理想的材料。
12.以牛皮为原料的产品主要有zyderm、zyplast和长春博泰的肤美达,在注射前30天需进行皮试以防止患者出现过敏反应,并且产品的提取收率底、成本高,大大地局限了其大规模、高通量生产及市场应用。
13.以猪皮为原料的产品如双美胶原蛋白植入剂,是由猪皮纯化而成的i型胶原蛋白经过无菌操作方式分散于磷酸盐生理盐水缓冲液充填于无菌注射针筒中制成。该产品的缺点为猪源性胶原,存在猪口蹄疫、猪瘟和猪细小病毒等感染风险,如何有效地保证产品的安
全性是制约其发展的主要瓶颈。
14.人重组胶原蛋白是以大肠杆菌、酵母菌等作为基因工程载体,通过对发酵培养、诱导表达后的发酵液进行离心,对离心后的上清液进行浓缩、纯化,得到的一种类似于人体内胶原蛋白结构的类人胶原蛋白。缺点是其胶原蛋白的一级结构虽然与人体胶原蛋白、动物源性胶原蛋白的一级结构基本相似,即gly
‑
x
‑
y胶原肽链,但在基因表达过程中胶原的二级结构遭到破坏,不具有天然的胶原三股螺旋结构,其分子量为90kd左右,因此不具有填充作用。
15.如中国专利申请201710383159.x中公开了一种胶原蛋白植入剂,按照重量百分比计,包括:2
‑
8%的胶原蛋白,0.1
‑
0.5%的添加剂,和余量的磷酸生理缓冲液,其使用的胶原蛋白是采用微生物发酵法获得的重组人源胶原蛋白,由于在基因表达过程中胶原的二级结构遭到破坏,不具有天然的胶原三股螺旋结构,因此填充作用较差。
16.以上各种类型的美容植入剂产品均存在一定程度的缺陷,目前国家药监局对面部填充植入剂类产品的要求非常严格,如:要明确分子量大小,分子的空间结构、杂蛋白含量、病毒灭活及免疫原性的控制等,需满足的技术条件很高。
17.因此,需要提供一种安全有效的胶原蛋白植入剂及其制备方法。
技术实现要素:
18.针对现有技术中存在的的不足,本发明旨在提供一种胶原蛋白植入剂及其制备方法。
19.其中,所述的胶原蛋白为从动物跟腱中提取的可注射到真皮深层以填补由于软组织缺损造成皮肤缺陷的胶原蛋白。
20.本发明提供的胶原蛋白保留了胶原的三股螺旋和三维立体结构和极高的天然活性成分,在保证填充效果的同时降低了在临床使用后可能存在的过敏反应。
21.其次,本发明提供的胶原蛋白植入剂注射到人体真皮深层后,极易与人体组织相融并刺激皮下产生大量的胶原蛋白,同时生成毛细血管网有效地改善面部微循环,最终达到皮肤的自然年轻状态。
22.为达到本发明的技术效果,本发明是通过以下技术方案来实现:
23.一方面,本发明提供了一种从动物跟腱中提取植入剂可用胶原蛋白纤维的方法,包括如下步骤:
24.(1)动物跟腱的前处理
25.取一定量的动物跟腱在酸中浸泡,剔除跟腱中的筋膜并进行切片,用nacl溶液浸泡、清洗,去除上清液并收集沉淀物a,备用。
26.(2)酶解消化
27.将(1)中收集的沉淀物a捣碎溶解在酸溶液中,加入蛋白酶在进行酶解;得到酶解产物;调节ph为7
‑
10反应,然后离心沉淀,收集沉淀物b,备用。
28.(3)助滤吸附
29.将(2)中收集的沉淀物b用酸溶解后,加入一定量的助滤剂搅拌后过滤,收集上清液,备用。
30.(4)分离纯化
31.将步骤(3)中的上清液进行浓缩后,通过阳离子交换介质吸附胶原蛋白后再洗脱分离,最后得到洗脱液。
32.(5)除菌过滤
33.将(4)中收集的洗脱液用超滤系统进行浓缩后,用0.22um的过滤膜除菌过滤,得到无菌可溶性胶原溶液;
34.(6)胶原蛋白纤维的制备
35.向步骤(5)得到的可溶性胶原溶液中加0.1m
‑
1m的na2hpo4调节ph为6
‑
9,静置过夜后,10000rpm/min
‑
15000rpm/min离心,弃去上清液并收集沉淀物,即得到胶原蛋白纤维。
36.上述步骤(1)中所述的动物跟腱包括但不限于牛跟腱、猪跟腱、马跟腱和羊跟腱中的一种或几种;优选为牛跟腱、马跟腱和羊跟腱中的一种或几种;再优选为牛跟腱。
37.上述步骤(1)中所述的酸包括但不限于冰醋酸、磷酸和盐酸中的一种或几种;优选为冰醋酸或/和盐酸。
38.上述步骤(1)中所述的酸的质量分数为1
‑
20%;优选为5
‑
15%;再优选为8
‑
12%;进一步优选为10
‑
12%。
39.上述步骤(1)中所述的浸泡时间为12
‑
120h;优选为24
‑
100h;再优选为48
‑
96h;进一步优选为60
‑
96h;再进一步优选为72h
‑
96h。
40.上述步骤(1)中所述的nacl溶液得质量分数为0.9%。
41.上述步骤(2)中所述的酸包括但不限于冰醋酸、盐酸和磷酸中的一种或几种;优选为冰醋酸或/和盐酸。
42.上述步骤(2)中所述的蛋白酶包括但不限于胃蛋白酶、胰蛋白酶、胶原蛋白酶和木瓜蛋白酶中的一种或几种;
43.优选为胰蛋白酶、胃蛋白酶和木瓜蛋白酶中的一种或几种;
44.再优选为胃蛋白酶;
45.上述步骤(2)中所述的酸的浓度为0.1m
‑
1m;优选为0.2
‑
0.8m;再优选为0.4
‑
0.6m。
46.上述步骤(2)中所述的蛋白酶与沉淀物a的质量比为0.01
‑
0.1:1;优选为0.02
‑
0.08:1;再优选为0.05:1。
47.上述步骤(2)中酶解过程中为温度为15
‑
28℃;优选为20
‑
25℃;酶解时间为5
‑
10d;优选为7
‑
10d。
48.步骤(2)中调节ph值的试剂为1m
‑
10m的naoh溶液。
49.上述步骤(3)所述的酸选自但不限于冰醋酸、磷酸和盐酸中的一种或几种;优选为冰醋酸或/和盐酸。
50.所述的酸的浓度为0.1m
‑
0.5m;优选为0.3m
‑
0.5m。
51.上述步骤(3)所述的助滤剂选自但不限于活性炭、硅藻土和氧化镁中的一种或几种;优选地,所述的助滤剂为硅藻土。
52.上述步骤(3)中所述的助滤剂与沉淀物b的质量比为0.5
‑
2:1;优选为1:1。
53.上述步骤(4)中所述的阳离子交换介质选自dene(n,n
‑
二乙基氨基乙基)、cm(羧甲基)、q(n,n
‑
二乙基氨基
‑2‑
羟丙基)、sp(磺丙基)中的一种或几种;
54.优选地,所述的阳离子交换介质选自dene(n,n
‑
二乙基氨基乙基)、cm(羧甲基)、sp(磺丙基)中的一种或几种;
55.再优选地,所述的阳离子交换介质选自dene(n,n
‑
二乙基氨基乙基)、cm(羧甲基)中的一种或几种;
56.进一步优选地,所述的阳离子交换介质为cm(羧甲基);
57.上述步骤(4)中所述的分离纯化过程中的平衡缓冲液为0.1m
‑
1m的强碱弱酸盐;洗脱溶液为0.1m
‑
1m的中性盐溶液;
58.优选地,所述的强碱弱酸盐包括但不限于khco3、kac、kh2po4、nahco3、naac、nah2po4中的一种或几种;所用的中性盐包括但不限于kcl、kno3、k2so4、nacl、nano3、na2so4中的一种或几种。
59.另一方面,本发明还提供了一种由上述方法制备得到的胶原蛋白纤维。
60.再一方面,本发明还提供了所述的胶原蛋白纤维在制备胶原蛋白植入剂中的应用。
61.还一方面,本发明还提供了一种胶原蛋白植入剂,包括如下组分:胶原蛋白纤维和ph=7的磷酸盐缓冲液。
62.所述的胶原蛋白纤维的浓度为
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
20
‑
65mg/ml;
63.所述的磷酸盐缓冲液(ph=7),包括以下组分:
64.氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
65.磷酸氢二钠(na2hpo4×
2h2o)0.05
‑
0.5mg/ml;
66.注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
67.还一方面,本发明还提供了上述植入剂在改善面部微循环方面的应用。
68.与现有技术相比,本发明的有益效果在于:
69.1、原料的来源:跟腱中富含i型胶原蛋白且胶原纤维结构紧密、结实,从牛跟腱中提取的胶原蛋白在注射到人体真皮深层后,极易与人体组织相融并刺激皮下产生大量的胶原蛋白,同时生成毛细血管网有效地改善面部微循环,最终达到皮肤的自然年轻状态。
70.牛跟腱对比牛皮、猪皮的优势:
71.(1)在牛跟腱组织中仅发现i型胶原蛋白,而在牛皮、猪皮中含有i型和iii型胶原蛋白,牛跟腱中i型胶原蛋白的纯度更高;
72.(2)具有天然三股螺旋结构的原胶原分子之间会发生自组装和自聚集反应形成胶原微纤维。采用本发明提供的方法得到的胶原分子自聚集后有形状分明的纤维结构,每条纤维暴露完全并相互交错形成纤维网,同时能清晰观测到胶原纤维的周期性横纹d带,能形成较好的纤维形态具有更高的分子规整度;
73.(3)采用本发明提供的方法得到的胶原纤维粗细均匀,其拉断伸长率最高达到93.25%远高于牛皮和猪皮的拉断伸长率21.35%,具有更好的弹性强度;
74.2、病毒和免疫原性的去除:在整个工艺中采取多个工序对潜在的病毒及免疫原性进行去除,
75.具体包括:
76.(1)高浓度的酸长时间浸泡原料,达到完全去除病毒的目的。
77.(2)酶
‑
酸法精准切除端肽技术,在保留胶原天然三股螺旋结构的同时完全切除胶原分子两端的末端端肽。
78.(3)助滤吸附:采用加入助滤剂吸附去除具有潜在免疫原性的物质,如核酸、多糖、
脂质等。
79.(4)分离纯化:采用离子交换层析去除存在的杂蛋白和其他小分子,降低产品在临床使用中存在副作用的风险。从原料到最终产品的整个生产工艺进行控制,使得到的胶原达到高活性、高纯度、高安全性。
80.3、本专利方法制备的胶原蛋白植入剂的优势:
81.(1)全球首款用跟腱胶原制作和可区块链安全溯源的材料来源,尤其是牛跟腱胶原。
82.(2)病毒灭活前处理技术和精准酶切去端肽技术,可完全去除潜在的过敏风险。
83.(3)高浓度、高纯度、高活性的牛跟腱胶原具有更自然塑形的填充效果和较长的体内降解周期。
附图说明
84.图1本发明实施例5得到的胶原纤维扫描电镜图片;
85.图2本发明实施例5得到的胶原蛋白纤维周期性横纹d带的扫描电镜图谱。
具体实施方式
86.本发明中提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所解释的所有特征可与任意方法形式并用,说明书中揭示的各个特征,可被任何可提供相同、均等或相似目的的取代性特征取代。因此除有特殊说明,所揭示的特征仅为均等或相似特征的一般性例子。
87.下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中为注明具体条件的实施方法,通常按照常规条件或按照制造厂商所建议的条件。除非特殊说明,否则所有的百分比和分数按重量计。
88.除非另行定义,文中所使用的所有专业与科学用语与本领域技术人员所熟知的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的优选实施方法与材料仅做示范作用。
89.实施例1一种从动物跟腱中提取植入剂可用胶原蛋白纤维的方法
90.包括如下步骤:
91.(1)动物跟腱的前处理
92.取一定量的牛跟腱在5%的盐酸中浸泡120h,剔除跟腱中的筋膜并进行切片,用0.9%nacl溶液浸泡、清洗,去除上清液并收集沉淀物a,备用。
93.(2)酶解消化
94.将(1)中收集的沉淀物a捣碎溶解在0.1m盐酸溶液中,加入胃蛋白酶(与沉淀物a的质量比为0.01:1)在进行酶解,得到酶解产物;调节ph为7反应,然后离心沉淀,收集沉淀物b,备用。
95.(3)助滤吸附
96.将(2)中收集的沉淀物b用0.1m盐酸溶解后,加入活性炭(与沉淀物b的质量比为1:1)搅拌后过滤,收集上清液,备用。
97.(4)分离纯化
98.将步骤(3)中的上清液进行浓缩后,通过阳离子交换介质吸附胶原蛋白后再洗脱分离,最后得到洗脱液。
99.(5)除菌过滤
100.将(4)中收集的洗脱液用超滤系统进行浓缩后,用0.22um的过滤膜除菌过滤,得到无菌可溶性胶原溶液。
101.(6)胶原蛋白纤维的制备
102.向步骤(5)得到的可溶性胶原溶液中加0.1m的na2hpo4调节ph为6,静置过夜后,15000rpm/min离心,弃去上清液并收集沉淀物,即得到胶原蛋白纤维。
103.实施例2一种从动物跟腱中提取植入剂可用胶原蛋白纤维的方法
104.包括如下步骤:
105.(1)动物跟腱的前处理
106.取一定量的牛跟腱在10%的冰醋酸中浸泡100h,剔除跟腱中的筋膜并进行切片,用0.9%nacl溶液浸泡、清洗,去除上清液并收集沉淀物a,备用。
107.(2)酶解消化
108.将(1)中收集的沉淀物a捣碎溶解在1m冰醋酸溶液中,加入胰蛋白酶(与沉淀物a的质量比为0.1;1)在进行酶解,得到酶解产物;调节ph为7反应,然后离心沉淀,收集沉淀物b,备用。
109.(3)助滤吸附
110.将(2)中收集的沉淀物b用0.5m磷酸溶解后,加入硅藻土(与沉淀物b的质量比为2;1)搅拌后过滤,收集上清液,备用。
111.(4)分离纯化
112.将步骤(3)中的上清液进行浓缩后,通过阳离子交换介质吸附胶原蛋白后再洗脱分离,最后得到洗脱液。
113.(5)除菌过滤
114.将(4)中收集的洗脱液用超滤系统进行浓缩后,用0.22um的过滤膜除菌过滤,得到无菌可溶性胶原溶液;
115.(6)胶原蛋白纤维的制备
116.向步骤(5)得到的可溶性胶原溶液中加1m的na2hpo4调节ph为9,静置过夜后,10000rpm/min离心,弃去上清液并收集沉淀物,即得到胶原蛋白纤维。
117.实施例3一种从动物跟腱中提取植入剂可用胶原蛋白纤维的方法
118.包括如下步骤:
119.(1)动物跟腱的前处理
120.取一定量的牛跟腱在20%的磷酸中浸泡24h,剔除跟腱中的筋膜并进行切片,用0.9%nacl溶液浸泡、清洗,去除上清液并收集沉淀物a,备用。
121.(2)酶解消化
122.将(1)中收集的沉淀物a捣碎溶解在0.8m冰醋酸溶液中,加入胶原蛋白酶(与沉淀物a的质量比为0.05:1)在20℃进行酶解8d,得到酶解产物;调节ph为9反应,然后离心沉淀,收集沉淀物b,备用。
123.(3)助滤吸附
124.将(2)中收集的沉淀物b用0.3m磷酸溶解后,加入硅藻土(与沉淀物b的质量比为3:1)搅拌后过滤,收集上清液,备用。
125.(4)分离纯化
126.将步骤(3)中的上清液进行浓缩后,通过阳离子交换介质吸附胶原蛋白后再洗脱分离,最后得到洗脱液。
127.(5)除菌过滤
128.将(4)中收集的洗脱液用超滤系统进行浓缩后,用0.22um的过滤膜除菌过滤,得到无菌可溶性胶原溶液。
129.(6)胶原蛋白纤维的制备
130.向步骤(5)得到的可溶性胶原溶液中加0.5m的na2hpo4调节ph为7,静置过夜后,12000rpm/min离心,弃去上清液并收集沉淀物,即得到胶原蛋白纤维。
131.实施例4一种从动物跟腱中提取植入剂可用胶原蛋白纤维的方法
132.包括如下步骤:
133.(1)动物跟腱的前处理
134.取一定量的牛跟腱在10%的磷酸中浸泡96h,剔除跟腱中的筋膜并进行切片,用0.9%nacl溶液浸泡、清洗,去除上清液并收集沉淀物a,备用。
135.(2)酶解消化
136.将(1)中收集的沉淀物a捣碎溶解在0.6m冰醋酸溶液中,加入胃蛋白酶(与沉淀物a的质量比为0.03:1)在25℃进行酶解10d,得到酶解产物;调节ph为9反应,然后离心沉淀,收集沉淀物b,备用。
137.(3)助滤吸附
138.将(2)中收集的沉淀物b用0.2m冰醋酸溶解后,加入硅藻土(与沉淀物b的质量比为2:1)搅拌后过滤,收集上清液,备用。
139.(4)分离纯化
140.将步骤(3)中的上清液进行浓缩后,通过阳离子交换介质吸附胶原蛋白后再洗脱分离,最后得到洗脱液。
141.(5)除菌过滤
142.将(4)中收集的洗脱液用超滤系统进行浓缩后,用0.22um的过滤膜除菌过滤,得到无菌可溶性胶原溶液。
143.(6)胶原蛋白纤维的制备
144.向步骤(5)得到的可溶性胶原溶液中加0.8m的na2hpo4调节ph为8,静置过夜后,14000rpm/min离心,弃去上清液并收集沉淀物,即得到胶原蛋白纤维。
145.实施例5一种从动物跟腱中提取植入剂可用胶原蛋白纤维的方法
146.包括如下步骤:
147.(1)动物跟腱的前处理
148.取一定量的牛跟腱在10%的冰醋酸中浸泡120h,剔除跟腱中的筋膜并进行切片,用0.9%nacl溶液浸泡、清洗,去除上清液并收集沉淀物a,备用。
149.(2)酶解消化
150.将(1)中收集的沉淀物a捣碎溶解在0.5m冰醋酸溶液中,加入胃蛋白酶(与沉淀物a
的质量比为0.05:1)在20℃进行酶解10d,得到酶解产物;调节ph为9反应,然后离心沉淀,收集沉淀物b,备用。
151.(3)助滤吸附
152.将(2)中收集的沉淀物b用0.5m冰醋酸溶解后,加入硅藻土(与沉淀物b的质量比为1:1)搅拌后过滤,收集上清液,备用。
153.(4)分离纯化
154.将步骤(3)中的上清液进行浓缩后,通过阳离子交换介质吸附胶原蛋白后再洗脱分离,最后得到洗脱液。
155.(5)除菌过滤
156.将(4)中收集的洗脱液用超滤系统进行浓缩后,用0.22um的过滤膜除菌过滤,得到无菌可溶性胶原溶液;
157.(6)胶原蛋白纤维的制备
158.向步骤(5)得到的可溶性胶原溶液中加0.8m的na2hpo4调节ph为8,静置过夜后,12000rpm/min离心,弃去上清液并收集沉淀物,即得到胶原蛋白纤维。
159.对比例1
160.采用中国专利申请201811465406.1中公开的方法制备胶原蛋白。
161.对比例2
162.与实施例5的区别在于:分离纯化采用葡聚糖基cm bestdex c
‑
25阳离子交换介质,其他操作与步骤与实施例5相同。
163.效果检测:
164.1、胶原纤维的周期性横纹d带检测
165.根据附图1和附图2可以明显看出,本发明实施例5中制备得到胶原分子自聚集后有形状分明的纤维结构,每条纤维暴露完全并相互交错形成纤维网,三螺旋结构完整,同时能清晰观测到胶原纤维的周期性横纹d带,能形成较好的纤维形态具有更高的分子规整度。
166.2、胶原纤维拉断伸长率检测
167.检测方法:根据gb/t1040
‑
2006方法测定胶原纤维的拉断伸长率。
168.检测结果:
169.表1胶原纤维拉断伸长率
[0170] 拉断伸长率%实施例192.07%实施例292.36%实施例390.52%实施例491.37%实施例593.25%对比例187.64%对比例288.76%
[0171]
根据上表1的检测数据可以看出,本发明实施例1
‑
5的方法得到的胶原蛋白纤维的拉伸强度明显高于对比例,其原因是采用本发明的得到的胶原纤维粗细均匀,其拉断伸长率最高达到93.25%远高于牛皮和猪皮的拉断伸长率21.35%,具有更好的弹性强度。
[0172]
3、纯度检测
[0173]
检测方法:根据sds
‑
聚丙烯酰胺凝胶电泳(sds
‑
page)银染法及凝胶成像系统进行纯度的检测计算。
[0174]
检测结果:
[0175]
表2胶原蛋白纤维纯度检测
[0176] 纯度%实施例199.55%实施例299.38%实施例398.82%实施例499.19%实施例599.82%对比例197.26%对比例298.47%
[0177]
根据上表2的检测数据可以看出,本发明实施例1
‑
5的方法得到的胶原蛋白纤维的纯度明显高于对比例,其原因在分离纯化步骤中采用离子交换层析去除存在的杂蛋白和其他小分子,降低产品在临床使用中存在副作用的风险。从原料到最终产品的整个生产工艺进行控制,使得到的胶原达到高活性、高纯度、高安全性。
[0178]
应用实施例1一种胶原蛋白植入剂
[0179]
包括如下组分:
[0180]
实施例1制备的胶原蛋白纤维的浓度为
ꢀꢀꢀꢀ
20mg/ml;
[0181]
所述的磷酸盐缓冲液(ph=7),包括以下组分:
[0182]
氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
[0183]
磷酸氢二钠(na2hpo4×
2h2o)
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.05mg/ml;
[0184]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0185]
制备方法:将胶原蛋白纤维在无菌条件下加入磷酸盐缓冲液中配置成20mg/ml胶原蛋白植入剂。
[0186]
应用实施例2一种胶原蛋白植入剂
[0187]
包括如下组分:
[0188]
实施例2制备的胶原蛋白纤维的浓度为
ꢀꢀ
65mg/ml;
[0189]
所述的磷酸盐缓冲液(ph=7),包括以下组分:
[0190]
氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
[0191]
磷酸氢二钠(na2hpo4×
2h2o)
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.5mg/ml;
[0192]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0193]
制备方法:将胶原蛋白纤维在无菌条件下加入磷酸盐缓冲液中配置成65mg/ml胶原蛋白植入剂。
[0194]
应用实施例3一种胶原蛋白植入剂
[0195]
包括如下组分:
[0196]
实施例3制备的胶原蛋白纤维的浓度为
ꢀꢀꢀ
30mg/ml;
[0197]
所述的磷酸盐缓冲液(ph=7),包括以下组分:
[0198]
氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
[0199]
磷酸氢二钠(na2hpo4×
2h2o)
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.1mg/ml;
[0200]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0201]
制备方法:将胶原蛋白纤维在无菌条件下加入磷酸盐缓冲液中配置成30mg/ml胶原蛋白植入剂。
[0202]
应用实施例4一种胶原蛋白植入剂
[0203]
包括如下组分:
[0204]
实施例4制备的胶原蛋白纤维的浓度为
ꢀꢀꢀꢀꢀ
40mg/ml;
[0205]
所述的磷酸盐缓冲液(ph=7),包括以下组分:
[0206]
氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
[0207]
磷酸氢二钠(na2hpo4×
2h2o)
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.25mg/ml;
[0208]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0209]
制备方法:将胶原蛋白纤维在无菌条件下加入磷酸盐缓冲液中配置成40mg/ml胶原蛋白植入剂。
[0210]
应用实施例5一种胶原蛋白植入剂
[0211]
包括如下组分:
[0212]
实施例5制备的胶原蛋白纤维的浓度为
ꢀꢀ
35mg/ml;
[0213]
所述的磷酸盐缓冲液(ph=7),包括以下组分:
[0214]
氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
[0215]
磷酸氢二钠(na2hpo4×
2h2o)
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.3mg/ml;
[0216]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0217]
制备方法:将胶原蛋白纤维在无菌条件下加入磷酸盐缓冲液中配置成50mg/ml胶原蛋白植入剂。
[0218]
应用对比例1一种胶原蛋白植入剂
[0219]
包括如下组分:
[0220]
对比例1制备的胶原蛋白纤维的浓度为
ꢀꢀꢀꢀ
35mg/ml;
[0221]
所述的磷酸盐缓冲液(ph=7),包括以下组分:
[0222]
氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
[0223]
磷酸氢二钠(na2hpo4×
2h2o)
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.3mg/ml;
[0224]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0225]
制备方法:将胶原蛋白纤维在无菌条件下加入磷酸盐缓冲液中配置成50mg/ml胶原蛋白植入剂。
[0226]
应用对比例2一种胶原蛋白植入剂
[0227]
包括如下组分:
[0228]
对比例2制备的胶原蛋白纤维的浓度为
ꢀꢀ
35mg/ml;
[0229]
所述的磷酸盐缓冲液(ph=7),包括以下组分:
[0230]
氯化钠(nacl)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9mg/ml;
[0231]
磷酸氢二钠(na2hpo4×
2h2o)
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.3mg/ml;
[0232]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0233]
制备方法:将胶原蛋白纤维在无菌条件下加入磷酸盐缓冲液中配置成50mg/ml胶原蛋白植入剂。
[0234]
效果实验
[0235]
3、安全性检测
[0236]
检测方法:无菌按《中华人民共和国药典(二部)》(2020年版)附录xih规定的方法进行检测;细菌内毒素含量按《中华人民共和国药典(二部)》
[0237]
(2020年版)附录xie规定的方法进行检测。
[0238]
检测结果:
[0239]
表3安全性检测
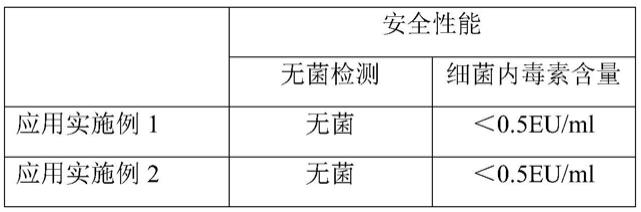
[0240][0241][0242]
根据上表3的检测数据可以看出,本发明应用实施例1
‑
5制备的胶原蛋白植入剂的的安全性能高于对比例,其原因:(1)全球首款用跟腱胶原制作和可区块链安全溯源的材料来源,尤其是牛跟腱胶原;(2)病毒灭活前处理技术和精准酶切去端肽技术,可完全去除潜在的过敏风险。
[0243]
4、体外降解试验检测
[0244]
检测方法:依据yy/t0473和gb/t16886.13的方法进行体外降解试验检测结果:
[0245]
表4体内降解检测
[0246][0247]
根据上表4的检测数据可以看出,本发明应用实施例1
‑
5制备的胶原蛋白植入剂的体内降解速度明显低于对比例,其原因:本发明制备得胶原蛋白纤维三螺旋结构完整,能清晰观测到胶原纤维的周期性横纹d带,能形成较好的纤维形态具有更高的分子规整度,使得高浓度、高纯度、高活性的牛跟腱胶原具有更自然塑形的填充效果和较长的体内降解周期。
[0248]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1