多肽的抗抑郁、抗焦虑用途及复合体的制作方法
1.本发明涉及抗抑郁、抗焦虑领域,具体涉及多肽在抗抑郁、抗焦虑中的用途。
背景技术:
2.抑郁症是由各种原因引起的以心境低落为主要临床症状的精神障碍疾病,具有发病率高、致残率高和自杀率高等特点。抑郁症的发病机制尚未完全阐明,目前临床上常用的抗抑郁药物大多是基于“单胺神经递质假说”而研发的。该假说认为,抑郁症的发生与脑内多巴胺(dopamine,da)、5
‑
羟色胺(5
‑
hydroxytryptamine,5
‑
ht)、去甲肾上腺素(na)等单胺类神经递质缺乏有关;抗抑郁药物通过抑制5
‑
ht和na转运体功能阻断单胺类神经递质再摄取,增加其在突触间隙的浓度,从而改善抑郁症状。
3.根据抗抑郁药物的作用机制及被开发时间,临床上将常用的抗抑郁药物分为如下几类,即第一代抗抑郁药物:单胺氧化酶抑制剂(maoi)和三环类抗抑郁药物;第二代抗抑郁药物:选择性5
‑
羟色胺再摄取抑制剂(ssri);第三代抗抑郁药物:5
‑
羟色胺和去甲肾上腺素双重再摄取抑制剂、去甲肾上腺素再摄取抑制剂(snri)及去甲肾上腺素和5
‑
羟色胺能抗抑郁剂等。
4.这类依据“单胺神经递质假说”所开发的药物虽有明确疗效,但有效率仅为60%,并且其抗抑郁疗效显现较慢(通常在服药后2~3周才显现),此外,这类药物还存在长期应用时不良反应大和停药后易复发等缺点。
5.除抑郁症经典的“单胺神经递质假说”外,近年来随着研究者对抑郁症发病机制的深入研究,发现了一些基于非单胺递质的新型抗抑郁药物分子靶标,如nmda受体、crf1受体、δ受体,κ受体、gabab受体、m胆碱受体、ido、cyslt1r、pde4、pparγ、pparδ、nos等。围绕这些新靶标发现了一些具有抗抑郁活性的物质,部分物质已进入临床研究阶段。
6.为了提供更为丰富、更佳的治疗策略并更好地阐明发病机制,在抑郁症领域仍存在着探索与发现更重要的发病机制和治疗靶点的强烈需求。
技术实现要素:
7.为达到上述目的,发明人基于抑郁症模型的分子变化进行了大量研究,并发现了抑郁症致病的一种新机制,从而完成了本发明。
8.具体而言,5
‑
ht受体是一群于中枢神经系统中央处和末梢神经系统周边出现的g蛋白偶联受体及配体门控离子通道。5ht受体可分为七个亚科5
‑
ht1、5
‑
ht2、5
‑
ht3、5
‑
ht4、5
‑
ht5、5
‑
ht6和5
‑
ht7。5
‑
ht2受体又有a、b、c三种亚型,即,5
‑
ht2a、5
‑
ht2b和5
‑
ht2c三种受体蛋白。其中,5
‑
ht2a受体(5
‑
ht2ar)作为一种兴奋性5
‑
ht受体,在哺乳动物的大脑中广泛表达。
9.da受体是通过其相应的膜受体发挥作用的一种位于生物体内的受体。da受体可分为五种:d1、d2、d3、d4和d5。d1受体(d1r)在脑内表达广泛。
10.发明人认识到,5
‑
ht2ar除单独形式外,也通过复合物的形式,如5
‑
ht1ar/5
‑
ht2ar
和5
‑
ht2ar/催产素受体(oxtr),对神经递质进行调节。
11.目前,不存在报道显示5
‑
ht2ar在体内会与d1r形成蛋白复合物,更未有任何报道揭示5
‑
ht2ar/d1r复合物与抑郁症发生之间的关联。而本发明人意外地发现5
‑
ht2ar通过其羧基端与d1r形成蛋白复合物,并且该复合物具有抑郁症致病性,随后通过进一步研究发现一种多肽能降低5
‑
ht2ar/d1r的相互作用并因此减轻抑郁症状和焦虑症状。
12.据此,在第一方面,本发明提供了一种多肽,其具有如seq id no:1所示的氨基酸序列(skdnsdgvnekvscv)。此外,还提供了本发明的多肽在制备用于治疗和/或预防抑郁症或焦虑症的药物中的用途。
13.在一些实施方式中,本发明的多肽长度可为15至90aa,尤其15至50aa、15至30aa、15至20aa。例如,16aa、17aa、18aa、19aa、20aa、21aa、22aa、23aa、24aa、25aa、26aa、27aa、28aa、29aa、30aa、31aa、32aa、33aa、34aa、35aa、36aa、37aa、38aa、39aa、40aa、41aa、42aa、43aa、44aa、45aa、46aa、47aa、48aa或49aa。
14.在一些实施方式中,本发明的多肽可源自5
‑
ht2ar。可通过生物信息库(如genbank、emi、ddbj等)查询多肽所源自的5
‑
ht2ar,并在此基础上确认源自5
‑
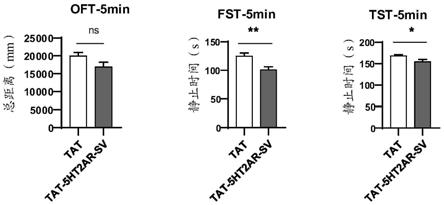
ht2ar的多肽。例如,在多肽源自5
‑
ht2ar(genbank登录号:np_001365853)的情况下,除含有seq id no:1所示的序列(即np_001365853中氨基酸序列的第457至471位)外,多肽还可以在n端方向上包括一个或更多个氨基酸残基。
15.在一个示例性的实施方式中,本发明的多肽由np_001365853对应的氨基酸序列的第442至471位组成。
16.在一个示例性的实施方式中,本发明的多肽由np_001365853对应的氨基酸序列的第385至471位组成。
17.在一些实施方式中,5
‑
ht2ar源自灵长目动物。
18.在优选的实施方式中,5
‑
ht2ar源自人。
19.如本文所使用的,术语“治疗”是指在患者中引起希望的或有益的作用,所述希望的或有益的作用可包括减少疾病一个或更多个症状的频率或严重性,或者阻抑或抑制疾病、病症或失调的进一步发展。
20.如本文所使用的,术语“预防”是指防止或延缓疾病的发生,或者防止其临床或亚临床症状的出现。
21.本发明的多肽通过抑郁症病理中一种的新的机制(5
‑
ht2ar/d1r复合物)起到抗抑郁作用,具有起效快、活性好且副作用小的特点,具有较好的临床开发价值。此外,本发明的多肽亦可实现抗焦虑的作用。
22.需要说明的是,如下文中实施例4和7,及图5、6、9和10中所证实的,本发明的多肽破坏5
‑
ht2ar/d1r复合物的相互作用,但对5
‑
ht2ar或d1r的表达并没有显著影响。换句话说,本发明的多肽通过特异性破坏5
‑
ht2ar/d1r复合物的相互作用起作用。
23.在第二方面,本发明提供了一种核酸分子,其编码本发明的多肽。此外,还提供了本发明的核酸分子在制备用于治疗和/或预防抑郁症或焦虑症的药物中的用途。
24.本发明的核酸分子用于生产本发明的抗原肽,根据所采用的表达系统,本领域技术人员能够适当地对核酸分子的序列进行调整。
25.在示例性的实施方式中,所述核酸分子具有如seq id no:2所示的序列。
26.在第三方面,本发明提供了一种表达载体,其包含本发明的核酸分子。此外,还提供了本发明的表达载体在制备用于治疗和/或预防抑郁症或焦虑症的药物中的用途。
27.可以利用多种已知方法将本发明的核酸序列插入到表达载体中。例如,可将核酸分子插入适当的限制性内切核酸酶位点。用于克隆、分离、扩增及纯化的标准技术,及操作中涉及dna连接酶、dna聚合酶、限制性内切核酸酶等的酶学反应以及各种分离技术,属于本领域技术人员已知并常用的技术。
28.在第四方面,本发明提供了一种宿主细胞,其包含本发明的核酸分子或表达载体。此外,还提供了本发明的宿主细胞在制备用于治疗和/或预防抑郁症或焦虑症的药物中的用途。
29.可以使用多种表达系统,如原核表达系统和真核表达系统中的表达载体和宿主细胞来生产本发明的多肽。接下来以哺乳动物表达系统为例进行说明,宿主细胞可包括猴肾成纤维细胞的cos
‑
7细胞系以及能够表达相容性载体的其它细胞系,如c127、3t3、cho、hela和bhk细胞系。哺乳动物表达载体应包含复制起点、合适的启动子和增强子以及任何必需的核糖体结合位点、聚腺苷酸化位点、剪接供体和受体位点、转录终止序列以及5’侧翼非转录序列。源自例如sv40剪接和聚腺苷酸化位点的dna序列可以用于提供所需的非转录性遗传元件。可以通过本领域技术人员熟悉的多种方法,包括但不限于例如磷酸钙转染、deae
‑
葡聚糖介导的转染或电穿孔,将表达载体引入宿主细胞中。
30.在第五方面,本发明提供了一种复合体,其包括本发明的多肽及连接于其上的用于通透血脑屏障的(转运)载体。
31.在示例性的实施方式中,用于通透血脑屏障的载体可以是:hiv
‑
1tat蛋白、胰岛素、阳离子化白蛋白、抗大鼠转铁蛋白受体的单抗(ox26)、人胰岛素受体鼠源性单抗(hirmab)、penetratin、tat蛋白的转导结构域、pep
‑
1肽、s4
13
‑
pv、magainin 2和buforin 2中的一种或更多种。例如,tat转导结构域能跨膜转导至胞内,其氨基酸为ygrkkrrqrrr(如seq id no:3所示)。
32.本发明的多肽可通过适当的连接技术与用于通透血脑屏障的载体连接。示例性的连接技术可以是亲和素
‑
生物素技术、基于聚乙二醇(peg)的空间臂技术、融合蛋白技术等。例如,在使用hiv
‑
1tat蛋白的转导结构域作为通透血脑屏障的载体的情况下,可以通过融合蛋白技术,直接将本发明的多肽与tat蛋白的转导结构域相连。
33.在一些实施方式中,使用融合蛋白技术的情况下,也可以使用连接子(linker)将本发明的多肽与用于通透血脑屏障的载体相连。示例性的连接子可以是带有甘氨酸的柔性连接子,如g、gsg、gsggsg、gsggsgg、gsggsggg、ggggsggg、ggggs和sgg等。
附图说明
34.图1示出了对小鼠的海马组织进行免疫共沉淀的免疫印迹结果;
35.图2示出了crs、cms和csds小鼠模型进行的免疫共沉淀的免疫印迹结果;
36.图3示出了实施例3中所涉及的片段在5
‑
ht2ar上的位置;
37.图4示出了使用实施例3中的片段对小鼠海马组织进行gst pulldown分析的免疫印迹结果;
38.图5示出了对经多肽处理的小鼠的海马组织进行免疫共沉淀的免疫印迹结果;
39.图6示出了对经多肽处理的小鼠的海马组织进行免疫印迹的结果;
40.图7示出了对经多肽处理的小鼠进行oft、fst和tst分析的结果,其中,*:p<0.05;**:p<0.01;
41.图8示出了对经多肽处理的crs、cms和csds小鼠进行fst、tst和spt分析的结果,其中,*:p<0.05;**:p<0.01;***:p<0.001;****:p<0.0001;
42.图9示出了对经多肽处理的crs、cms和csds小鼠的海马组织进行免疫共沉淀的免疫印迹结果;
43.图10示出了对经多肽处理的crs小鼠的海马组织进行免疫印迹的结果;
44.图11示出了对经多肽处理的小鼠进行oft(用于中央区停留时间)分析的结果,其中,**:p<0.01;
45.图12示出了示出了对经多肽处理的小鼠进行epm分析的结果,其中,*:p<0.05;**:p<0.01。
具体实施方式
46.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
47.下面将结合实施例对本发明的实施方式进行详细描述,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
48.实施例中未注明具体条件的,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产产商的,为可以通过商购获得的常规产品。
49.除另有说明外,实施例中所使用的实验动物为成年c57bl/6j雄性小鼠(12
‑
14周),其饲养在18
‑
22℃下,12小时光照/12小时黑暗。在整个过程中可以自由获得饮食和自来水。
50.实施例中所涉及的统计学分析采用单因素方差(anova)分析,然后进行后比较来评估平均值之间的差异。除非另有说明,使用独立样本t检验来比较任何给定的两组之间的差异。
51.实施例1体内形成5
‑
ht2ar/d1r复合物的确认
52.使用来自小鼠海马组织的蛋白质样本(100
‑
500μg的蛋白质)进行免疫共沉淀。使用抗5
‑
ht2ar的小鼠抗体(santacruz生物技术,sc
‑
166775)与25μl蛋白a/g+琼脂糖珠浆(santacruz生物技术,sc
‑
2001)进行沉淀。
53.沉淀后进行免疫印迹分析:经变性的蛋白质在8%sds
‑
page凝胶上分离,然后转移到硝酸纤维素膜,用tbst封闭膜;接下来用抗d1r(santacruz生物技术,sc
‑
33660)、抗d2r(santacruz生物技术,sc
‑
5303)的小鼠抗体4℃孵育过夜;最后采用hrp偶联的二抗处理1小时并使用ecl超级信号化学发光试剂盒检测信号,使用图像实验室软件对条带进行密度分析,结果如图1所示。
54.由图1可知,抗5
‑
ht2ar抗体能沉淀d1r,但不沉淀d2r,这表明5
‑
ht2ar在体内可以与d1r形成复合物,而不能与d2r形成复合物。
55.实施例2复合物病理意义的验证
56.为了探索该复合物的病理意义,我们构建了不同的抑郁症模型,包括:慢性束缚应力应激(crs)、慢性中度压力应激(cms)和慢性社会压力应激(csds)。各模型的构建方法如下:
57.crs小鼠模型的构建:小鼠每天水平固定6小时(10点到16点)在丙烯酸圆柱形平底头约束器(25
×
90mm)中,持续2周。过滤器有几个插槽,可以根据每只老鼠的大小牢固地束缚小鼠,并抑制肢体的身体运动而不会引起疼痛。在被限制后,老鼠立即被放回自己的笼子里。非约束小鼠(对照)在没有进行crs程序时仍留在自家的笼子里,对照小鼠和crs小鼠在crs暴露期间都无法获得食物和水。
58.cms小鼠模型的构建:小鼠受到各种压力,包括:约束(4小时)、笼倾斜(45次,每次12小时)、光
‑
暗周期逆转(一次)、闪光(12小时)和脏笼(2次,每次14小时)。该方案持续6周。对照小鼠没有受到相应压力。
59.csds小鼠模型的构建:小鼠暴露于不同的cd1攻击性小鼠(目标小鼠),每天10min,共10天。接触10min后,实验小鼠被一个包含孔的塑料分隔器分开。此外,实验小鼠通过被放置在笼子中间的分离器暴露于慢性压力下24小时。对照组小鼠也采用了类似的程序(非社会压力),但使用的是同一品种小鼠,而非攻击性小鼠。
60.分别使用所构建的crs小鼠模型、cms小鼠模型和csds小鼠模型,按照实施例1中的免疫共沉淀和免疫印迹方法,研究这些模型中d1r和5
‑
ht2ar的相互作用,结果如图2所示。
61.由图2可知,在crs、cms和csds模型中均发现5
‑
ht2ar/d1r复合物的显著增加,证实了该复合物在抑郁症中的病因作用。
62.实施例3复合物相互结合位点的确认
63.为了确认5
‑
ht2ar/d1r复合物的相互结合位点,首先扩增5
‑
ht2ar全长cdna克隆(genbank登录号:nm_001378924)得到5
‑
ht2ar的ct区域(k385
‑
v471)和5
‑
ht2ar第三胞内环(il3)区域(f255
‑
v324)的cdna片段。将这些片段亚克隆到pgex
‑
4t
‑
3质粒(优宝no:vt1255)的bamh1/ecor1或bamh1/xho1位点。适当时地合并起始蛋氨酸残基和终止密码子。对所有构建物都进行了重测序以确认适当地实现了剪接融合。使用e.coli bl21活性细胞(康体健康生命技术公司,no:ktsm104l)进行表达,并从细菌裂解液中纯化得到含有5
‑
ht2ar的第3个胞内环(il3)的gst融合蛋白(gst
‑
5ht2ar
‑
il3)、含有将5
‑
ht2ar的ct区域的gst融合蛋白(gst
‑
5ht2ar
‑
ct)。其中,il3区域和ct区域的编码序列在5
‑
ht2ar上的具体位置如图3所示。
64.将溶解的小鼠海马组织提取物500μg用1
×
pbs/1%triton x
‑
100稀释,随后与20μl蛋白gst树脂饱和gst蛋白或15μg gst融合蛋白在4℃孵育过夜。珠子用1
×
pbs/1%triton x
‑
100洗涤1
‑
8次。结合蛋白用2
×
上样缓冲液洗脱,sds
‑
page分离,用各自的抗体进行免疫印迹,结果如图4中a所示。
65.由图4中a可知,5
‑
ht2ar的ct区域可以pulldown d1r。
66.接下来,为了进一步挖掘5
‑
ht2ar与d1r之间正确的相互作用序列/位点,我们将该ct区域分割为:5
‑
ht2ar的kv(k385
‑
v411)区域、5
‑
ht2ar的nn(n412
‑
n441)区域和5
‑
ht2ar的dv(d442
‑
v471)区域,这些区域在5
‑
ht2ar上的具体位置如图3所示。
67.按照本实施例中的方法,使用含有5
‑
ht2ar的kv区域的gst融合蛋白(gst
‑
5ht2ar
‑
kv)、含有5
‑
ht2ar的nn区域的gst融合蛋白(gst
‑
5ht2ar
‑
nn)、含有5
‑
ht2ar的dv区域的gst融合蛋白(gst
‑
5ht2ar
‑
dv)进行pulldown分析,免疫印迹结果如图4中b所示。
68.由图4中b可知,5
‑
ht2ar的dv区域可以pulldown d1r。
69.进一步地,我们将该dv区域分割为:5
‑
ht2ar的da(d442
‑
a456)区域和5
‑
ht2ar的sv(d442
‑
v471)区域,这些区域在5
‑
ht2ar上的具体位置如图3所示。
70.按照本实施例中的方法,使用含有5
‑
ht2ar的da区域的gst融合蛋白(gst
‑
5ht2ar
‑
da)、含有5
‑
ht2ar的sv区域的gst融合蛋白(gst
‑
5ht2ar
‑
sv)进行pulldown分析,免疫印迹结果如图4中c所示。
71.由图4中c可知,5ht2ar
‑
sv多肽(s457
‑
v471)可以从小鼠海马组织中亲和d1r,表明5
‑
ht2ar可以通过羧基尾部与d1r相互作用。
72.实施例4多肽在体内对复合物的破坏作用的确认
73.为了验证5
‑
ht2ar羧基端多肽在体内对5
‑
ht2ar/d1r复合物的作用,将5
‑
ht2ar的sv区域(s457
‑
v471)c端与hiv
‑
1型tat蛋白的转导结构域(如seq id no:3所示,下文称为tat)的n端融合,得到可以通透血脑屏障的融合蛋白,命名为tat
‑
5ht2ar
‑
sv。类似地,将5
‑
ht2ar的dv区域(d442
‑
v471)与tat融合,得到tat
‑
5ht2ar
‑
dv;将5
‑
ht2ar的ct区域(k385
‑
v471)与tat融合,得到tat
‑
5ht2ar
‑
ct。
74.使用tat
‑
5ht2ar
‑
sv、tat
‑
5ht2ar
‑
dv、tat
‑
5ht2ar
‑
ct对小鼠进行处理,仅tat处理的小鼠用作对照(处理方式均为单次腹腔给药,3nmol/g)。处理1小时后,使用的小鼠,按照实施例1中免疫共沉淀方法进行分析,结果如图5所示。
75.由图5可知,5ht2ar
‑
sv在小鼠海马组织中成功破坏了5
‑
ht2ar/d1r的相互作用。
76.此外,取tat
‑
5ht2ar
‑
sv和tat处理的小鼠的海马组织直接进行免疫印迹分析。由图6可知,经处理后5
‑
ht2ar和d1r的表达均没有显著变化。
77.另一方面,tat
‑
5ht2ar
‑
dv和tat
‑
5ht2ar
‑
ct同样成功破坏了5
‑
ht2ar/d1r的相互作用,并没有引起5
‑
ht2ar和d1r的表达均没有显著变化。
78.实施例5多肽的抗抑郁样作用的评估
79.为了评价本发明的多肽抗抑郁样作用,使用经tat
‑
5ht2ar
‑
sv、tat
‑
5ht2ar
‑
dv、tat
‑
5ht2ar
‑
ct处理的小鼠(处理方式均为单次腹腔给药,3nmol/g)在处理1小时后进行旷场试验(oft)、强制游泳试验(fst)和悬尾试验(tst),仅tat处理的小鼠作为对照。试验方法如下:
80.oft:小鼠适应实验环境1小时,并放置在45
×
45
×
30cm的腔室中。记录一段5分钟的视频,观察小鼠的运动活动。测量和分析小鼠覆盖的总距离,并以毫米表示。
81.fst:小鼠被放置在一个充满水(水温23
±
1℃)的有机玻璃圆柱体中(高度70厘米,直径30厘米),水的高度为30厘米以上。对小鼠录像5分钟并进行分析,记录静止的时长。小鼠一动不动地漂浮在水中或使鼻子高于水面时被定义为静止;在整个圆柱体上的水平运动时被定义为游泳;而对着圆柱体壁的垂直运动时被定义为攀爬。
82.tst:小鼠分别以胶带悬挂在地板上方40厘米处,矩形隔间(长度55厘米
×
宽度20厘米
×
深度11.5厘米)内。记录视频共5分钟,记录静止的时长。采用ethovisionxt软件进行记录和分析。
83.部分结果示于图7中,由左侧oft结果可知可知,tat
‑
5ht2ar
‑
sv处理的小鼠的总运动距离与tat处理组无显著差异,表明多肽对小鼠的运动能力无影响;此外,由中间的fst结果及右侧的tst结果可知,与对照组(仅tat处理)相比,tat
‑
5ht2ar
‑
sv处理组的静止时间显
著减少。tat
‑
5ht2ar
‑
dv处理组和tat
‑
5ht2ar
‑
ct处理组获得了与tat
‑
5ht2ar
‑
sv处理组相似的结果。以上证实了本发明的抗抑郁作用。
84.实施例6使用药物评价模型评估多肽的抗抑郁能力
85.为进一步评估多肽作为抗抑郁药物的能力,按照实施例2所描述的方法分别构建crs、cms和csds小鼠模型;构建1小时后分别使用10μm的tat
‑
5ht2ar
‑
sv、tat
‑
5ht2ar
‑
dv、tat
‑
5ht2ar
‑
ct或tat分别处理(处理方式均为单次腹腔给药,3nmol/g);随后对crs进行fst和tst,并对cms和csds小鼠分别进行fst、tst和蔗糖偏好试验(spt)。
86.其中,fst和tst操作按照实施例6中的描述进行;spt具体操作如下:
87.spt使用两瓶自由选择范式进行。小鼠用1%的蔗糖溶液习惯3天,并随机分组。为了评估它们个体的蔗糖摄入量,小鼠在3天内剥夺24小时的水和食物。第二天,每只老鼠都可以自由接触两瓶含有蔗糖和水的瓶子。2.5小时后改变水和含蔗糖瓶的位置,总试验时间为5小时。最后,记录所消耗的水和蔗糖溶液的体积,并按下式(i)计算:
[0088][0089]
由图8中分析结果可知,对全部三种药物评价模型,tat
‑
5ht2ar
‑
sv处理的小鼠相较于tat处理的小鼠均显著地减少了应激诱导的静止时间增加量(a至c,fst和tst),并且显著地增强了蔗糖偏好(a至c,spt)。tat
‑
5ht2ar
‑
dv处理组和tat
‑
5ht2ar
‑
ct处理组获得了与tat
‑
5ht2ar
‑
sv处理组相似的结果。
[0090]
实施例7在动物模型中验证多肽破坏复合物相互作用的有效性
[0091]
按照实施例1中免疫共沉淀方法,对实施例6中经处理的crs、cms和csds小鼠(tat
‑
5ht2ar
‑
sv、tat
‑
5ht2ar
‑
dv、tat
‑
5ht2ar
‑
ct和tat)进行分析,免疫印迹结果分别如图9所示。
[0092]
与预期一致,在所有三种模型中,5
‑
ht2ar/d1r偶联水平均显著增加;与tat处理组相比,tat
‑
5ht2ar
‑
sv处理组显著降低了应激小鼠海马组织中5
‑
ht2ar与d1r的相互作用(图9中a至c)。
[0093]
进一步地,取经处理的crs小鼠的海马组织直接进行了免疫印迹分析,以考察d1r和5
‑
ht2ar表达水平,结果如图10所示。有趣的是,d1r和5
‑
ht2ar的水平在tat
‑
5ht2a
‑
sv与tat处理组之间均没有任何显著变化,这表明本发明的多肽对d1r和5
‑
ht2ar的偶联具有特异性。
[0094]
此外,对经tat
‑
5ht2ar
‑
dv或tat
‑
5ht2ar
‑
ct处理的crs、cms和csds小鼠分别进行了测试,结果表明tat
‑
5ht2ar
‑
dv处理组和tat
‑
5ht2ar
‑
ct处理组显著降低了应激小鼠海马组织中5
‑
ht2ar与d1r的相互作用,但未引起d1r和5
‑
ht2ar水平的显著变化。
[0095]
实施例8多肽的抗焦虑样作用的评估
[0096]
为了评价本发明的多肽抗焦虑样作用,使用经tat
‑
5ht2ar
‑
sv、tat
‑
5ht2ar
‑
dv、tat
‑
5ht2ar
‑
ct处理的小鼠(处理方式均为单次腹腔给药,3nmol/g)在处理1小时后进行用于测试中央区停留时间的旷场试验(oft)和高架十字迷宫试验(epm),仅tat处理的小鼠作为对照。试验方法如下:
[0097]
oft(用于测试中央区停留时间):将旷底面等分成25个等面积的格子,中间9个格子区域为中央区。小鼠接受多肽处理1小时后放置于中央区记录5min,记录小鼠在中央区停
留的时间。
[0098]
epm:由两个开放臂(25cm
×
8cm)和两个闭合臂(25cm
×
8cm)组成,交叉处为中央区(8cm
×
8cm),离地40cm高。接受多肽处理1小时后,将小鼠面向开放臂放置于中央区,记录其自由活动5min。每只动物检测完成后,用70%酒精擦拭装置。记录小鼠在开放臂停留的时间、在闭合臂停留时间和小鼠总运动距离。
[0099]
部分oft结果示于图11中,tat
‑
5ht2a
‑
sr多肽能显著增加了小鼠在中央区的停留时间;类似地,tat
‑
5ht2ar
‑
dv多肽和tat
‑
5ht2ar
‑
ct也显著增加了小鼠在中央区的停留时间(p<0.01),表明其有效地降低了焦虑情绪。
[0100]
部分epm结果示于图12中,tat
‑
5ht2a
‑
sr多肽显著增加了小鼠的开放臂停留时间(a),降低闭合臂停留时间(b),而不影响总运动能力(c);类似地,tat
‑
5ht2ar
‑
dv多肽和tat
‑
5ht2ar
‑
ct也显著增加了小鼠的开放臂停留时间(p<0.01),降低闭合臂停留时间(p<0.05),而不影响总运动能力。表明本发明的多肽有效地降低了焦虑情绪。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1