一种基于脂肪组织的中枢靶向递送siRNA的方法及应用与流程
一种基于脂肪组织的中枢靶向递送sirna的方法及应用
技术领域
1.本发明属于生物医学技术领域,具体涉及一种基于脂肪组织的中枢靶向递送sirna的方法及应用。
背景技术:
2.老龄化进程进一步加重,伴随而来的是一个不可忽视的问题:中枢神经系统相关疾病,如老年痴呆(阿尔兹海默病)、帕金森、脑肿瘤等发病率的升高。老年痴呆症是继心血管病、脑血管病和癌症之后,成了老人健康的“第四大杀手”,且目前尚无有效治疗或逆转疾病进展的药物。中枢神经系统由于血脑屏障的存在,目前大多数的药物无法穿过,这使得对中枢神经系统疾病的治疗成为一大挑战。因此,研发高效、安全的中枢药物递送方法成为治疗神经系统疾病的关键。
3.小干扰rna(sirna)特异性抑制致病靶向基因的表达,起到治疗疾病的作用。外泌体可以包裹小rna(包括mirna和sirna)并分泌至循环系统,而分泌出来的外泌体可靶向受体细胞,将sirna递送到受体细胞并发挥生物学功能。由于外泌体是细胞自身分泌的囊泡,与其他载体相比,其具有低免疫原性和低毒性的特点,是一种良好的小rna天然载体。而为了让外泌体更好的靶向中枢,现有技术通过脑靶向肽(狂犬病毒糖蛋白rvg) 对外泌体进行修饰,但是这可能增加免疫反应。此外,传统的基于外泌体 sirna递送的策略中,sirna需要在体外培养环境与外泌体进行预组装,该方法成本较高,过程复杂且风险不易控制,得到的外泌体难以达到临床需求,这很大程度上限制了其大规模的应用。
技术实现要素:
4.有鉴于此,本发明期望提供一种基于脂肪组织靶向神经元递送sirna 药物的方法及应用,能够有效的将靶向bace1的sirna运送至神经元中,降低了aβ沉积改善阿尔兹海默症的认知损伤,提供了低免疫原性和低毒性的靶向神经元的给药方式;而且,本发明方法不需经过复杂的体外外泌体预组装过程,极大降低成本及风险,便于规模化临床应用。
5.为达到上述目的,本发明的技术方案是这样实现的:
6.一种基于脂肪组织的中枢靶向递送sirna的方法,对人或模型动物脂肪组织注射装载有sirna的病毒载体,所述病毒为腺相关病毒、慢病毒或腺病毒。
7.这里,可装载不同sirna,实现不同sirna的同时递送,操作简便,不需经过复杂的体外外泌体预组装过程,极大降低成本及风险,便于规模化临床应用。
8.进一步地,所述腺病毒为raav-sirna腺相关病毒。
9.进一步地,所述病毒为raav-sibace1腺相关病毒。
10.进一步地,所述病毒为raav-palm-mcherry腺相关病毒。
11.进一步地,所述模型动物为小鼠。
12.这里,所述小鼠可以为aap/ps1小鼠或c57小鼠,aap/ps1小鼠为ad 老年痴呆小鼠。
13.进一步地,所述脂肪组织为内脏脂肪组织、皮下脂肪组织、臀股脂肪组织、肌间脂
肪组织、心外脂肪组织、性腺脂肪组织或棕色脂肪组织。
14.这里,向上述任意一种脂肪组织注射装载sirna的病毒载体,均有中枢靶向递送sirna的功能。
15.本发明还另外提供了一种基于脂肪组织的中枢靶向递送sirna的应用,将上述一种基于脂肪组织的中枢靶向递送sirna的方法,应用于治疗阿尔兹海默症。
16.这里,病毒注射进脂肪组织后,以宿主自身分泌的外泌体为载体,将 sirna靶向递送至目的区域并发挥生物学功能,解决传统sirna递送载体具有的免疫原性和毒性问题。
17.本发明有益效果如下:1)本发明方法通过利用宿主自身的器官分泌的外泌体作为载体,克服sirna靶向递送中的血脑屏障的制约,有效的将靶向 bace1的sirna运送至神经元中,降低了aβ沉积改善阿尔兹海默症的认知损伤,解决了传统sirna递送载体具有的免疫原性和毒性问题;2)本发明方法灵活可变,可实现不同sirna的同时递送,操作简便,不需经过复杂的体外外泌体预组装过程,极大降低成本及风险,便于规模化临床应用。
附图说明
18.图1为本发明实施例1中小鼠海马区palm-mcherry荧光蛋白分布图;
19.图2为本发明实施例1中小鼠主要脑区mcherry分布的荧光强度统计图;
20.图3为本发明实施例2中小鼠脂肪组织提取外泌体镜检图;
21.图4为本发明实施例2中小鼠脂肪组织提取外泌体nanosight分析图;
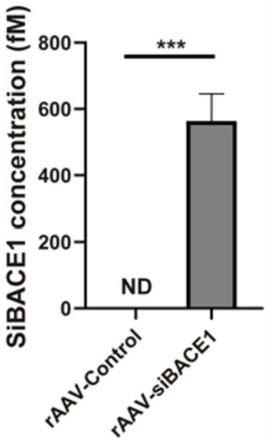
22.图5为本发明实施例2中脂肪组织外泌体中sibace1的含量检测结果图;
23.图6为本发明实施例3中小鼠海马sibace1的含量检测结果图;
24.图7为本发明实施例3中sibace1 mrna含量检测结果图;
25.图8为本发明实施例3中sibace1表达蛋白检测及含量统计图;
26.图9为本发明实施例3中小鼠水迷宫上台潜伏时间对照图;
27.图10为本发明实施例3中小鼠水迷宫处于目的象限时间对照图;
28.图11为本发明实施例3中水迷宫实验小鼠脑组织免疫荧光染色及aβ蛋白检测图;
29.图12为本发明实施例4中小鼠脑中小胶质细胞的染色及统计图;
30.图13为本发明实施例4中炎症因子浓度检测结果图。
具体实施方式
31.为了能够更加详尽地了解本发明的特点与技术内容,下面结合附图对本发明的实现进行详细阐述,所附附图仅供参考说明之用,并非用来限定本发明。
32.实施例1
33.脂肪组织外泌体体内靶向中枢检测与验证
34.1、制备raav-palm-mcherry腺相关病毒
35.raav-palm-mcherry病毒为raav-cmv-palm-mcherry-wpre-hgh pa,由武汉枢密脑科学技术有限公司构建,palm-mcherry序列如下:
36.atgctgtgctgtatgagaagaaccaaacagatggtgagcaagggcgaggaggataacatg gccatcatcaaggagttcatgcgcttcaaggtgcacatggagggctccgtgaacggcc acgagttcgagatcgagggcgagggcgagggccgcccctacgagggcacccagacc gccaagctgaaggtgaccaagggtggccccctgcccttcgcct
gggacatcctgtccc ctcagttcatgtacggctccaaggcctacgtgaagcaccccgccgacatccccgactac ttgaagctgtccttccccgagggcttcaagtgggagcgcgtgatgaacttcgaggacg gcggcgtggtgaccgtgacccaggactcctccctgcaggacggcgagttcatctacaa ggtgaagctgcgcggcaccaacttcccctccgacggccccgtaatgcagaagaagacc atgggctgggaggcctcctccgagcggatgtaccccgaggacggcgccctgaagggc gagatcaagcagaggctgaagctgaaggacggcggccactacgacgctgaggtcaa gaccacctacaaggccaagaagcccgtgcagctgcccggcgcctacaacgtcaacatc aagttggacatcacctcccacaacgaggactacaccatcgtggaacagtacgaacgcg ccgagggccgccactccaccggcggcatggacgagctgtacaagtaa
37.2、将构建的raav-cmv-palm-mcherry-wpre-hgh pa病毒原位注射感染小鼠内脏脂肪。2周后处死小鼠,取脑组织后以4%多聚甲醛进行固定,冰冻切片后用神经元特异性标志物neun进行荧光染色,荧光共聚焦显微镜拍照观察mcherry蛋白在脑中的分布。
38.图1为本发明实施例1中小鼠海马区palm-mcherry荧光蛋白分布图,图2为本发明实施例1中小鼠主要脑区mcherry分布的荧光强度统计图,如图1和图2所示,注射raav-palm-mcherry的小鼠可在海马中观察到显著的mcherry信号,且该信号与神经元共定位,显示小鼠脂肪组织分泌的外泌体具有神经元靶向性。
39.实施例2
40.脂肪组织注射raav-sibace1腺相关病毒显著升高脂肪外泌体中sibace1 的水平
41.1、制备raav-sibace1腺相关病毒及对照病毒
42.raav-sibace1病毒为raav-u6-shrna(bace1)-cmv-mcherry-sv40 pa,对照病毒为raav-u6-shrna(scramble)-cmv-mcherry-sv40 pa,由武汉枢密脑科学技术有限公司构建。
43.sibace1序列:
[0044]5′‑
gaugaauuccuaucuuguuaagcuuccugucacuuaacaagauaggaau ucaucuguu-3
′
[0045]
对照序列:
[0046]5′‑
uucuccgaacgugucacgugcuuccugucacacgugacacguucggagaa uu-3
′
[0047]
2、将10只8周龄的c57小鼠随机分为2组,分别将raav-sibace1腺相关病毒及其对照病毒原位注射感染小鼠内脏脂肪(病毒规格剂量为5e+12 vg/ml,2μl)。2周后处死小鼠,取小鼠的内脏脂肪进行培养及外泌体分离与鉴定,并同时提取脂肪组织外泌体rna,qrt-pcr法检测sibace1的水平,具体步骤如下:
[0048]
(1)脂肪组织培养及外泌体的分离与鉴定
[0049]
取小鼠脂肪组织剪碎为1mm3小块的脂肪组织后,置于dmem完全培养基(含有1%100μg/ml青霉素+100μg/ml链霉素+2%去外泌体的胎牛血清) 培养24h后收集上清。超速离心法提取脂肪组织外泌体后电镜检测外泌体的形态,nanosight分析外泌体的粒径,结果如图3、图4所示,图3为本发明实施例2中小鼠脂肪组织提取外泌体镜检图,图4为本发明实施例2 中小鼠脂肪组织提取外泌体nanosight分析图。
[0050]
(2)外泌体总rna提取
[0051]
用trizol试剂将样品匀浆后,加入氯仿,使匀浆离心后取上层的水层,加入异丙醇将rna从水层析出。沉淀的rna用75%乙醇清洗以去除杂质,然后再用rnase-free ddh2o重悬,放置在-80℃保存。
[0052]
(3)qrt-pcr检测
[0053]
对所提取的rna及其sibace1标准品进行逆转录。逆转录引物:5'
‑ꢀ
gtcgtatccagt
gcagggtccgaggtattcgcactggatacgacattcgc-3'
[0054]
sibace1标准品:5
′‑
gaaccuaugcgaugcgaau-3
′
[0055]
逆转录所得cdna进行荧光定量检测,具体步骤按照sybr green master mix kit说明书进行操作,使用罗氏lightcycler 96实时荧光定量pcr仪进行检测,每次实验设计3个复孔。
[0056]
这里,荧光定量引物如下:
[0057]
f:5'-gcgcggaacctatgcgat-3'
[0058]
r:5'-agtgcagggtccgaggtatt-3'
[0059]
sybr green master mix kit采购于诺唯赞生物科技股份有限公司,货号为q121。
[0060]
图5为本发明实施例2中脂肪组织外泌体中sibace1的含量检测结果图,sibace1的定量结果如图5所示,与对照组相比,感染raav-sibace1腺相关病毒的内脏脂肪组织分泌的外泌体中,sibace1的含量显著升高。
[0061]
结果表明,在脂肪组织注射表达sibace1的腺相关病毒,增加了外泌体中sibace1的含量。
[0062]
实施例3
[0063]
脂肪组织注射raav-sibace1腺相关病毒靶向中枢递送sibace1
[0064]
1、将5月龄的aap/ps1小鼠(ad小鼠)随机分成2组,ad+raav-control 组(control组)和ad+raav-sibace1组(sibace1组),每组5只。对每组小鼠内脏脂肪进行对应的病毒注射,2周后处死小鼠,取小鼠脑组织并分离其海马与皮层并提取rna和蛋白。qrt-pcr法检测其bace1的mrna水平, western-blot检测其bace1蛋白表达水平。
[0065]
图6为本发明实施例3中小鼠海马sibace1的含量检测结果图,图7 为本发明实施例3中sibace1 mrna含量检测结果图,图8为本发明实施例 3中sibace1表达蛋白检测及含量统计图,如图6、图7、图8所示,与对照组相比,脂肪组织注射raav-sibace1腺相关病毒小鼠的海马及皮层中 bace1 mrna的表达水平降低,且bace1蛋白表达水平显著降低。
[0066]
结果表明,通过脂肪组织原位感染表达sibace1的腺相关病毒可靶向海马和皮层神经元递送sirna并发挥生物学功能。
[0067]
2、将5月龄的aap/ps1小鼠(ad小鼠)随机分成2组,ad+raav-control 组(control组)和ad+raav-sibace1组(sibace1组),每组10只。对每组小鼠内脏脂肪进行对应的病毒注射。3个月后进行morris水迷宫实验。前五天进行训练,记录小鼠在水池中到达安全平台的时间(潜伏期);至第6 天撤去平台,记录小鼠在原平台所在象限内游泳的时间。水迷宫结束的小鼠处死后取脑组织,免疫荧光染色以及elisa检测其aβ蛋白水平。
[0068]
图9为本发明实施例3中小鼠水迷宫上台潜伏时间对照图,图10为本发明实施例3中小鼠水迷宫处于目的象限时间对照图,如图9、图10所示,与对照组相比,脂肪组织注射raav-sibace1腺相关病毒小鼠的水迷宫上台潜伏时间减少,目的象限内的时间比例增加,其认知功能显著改善。
[0069]
图11为本发明实施例3中水迷宫实验小鼠脑组织免疫荧光染色及aβ蛋白检测图,如图11所示,脂肪组织注射raav-sibace1腺相关病毒,显著降低了海马和皮层中bace1的表达,显著降低小鼠海马和皮层脑区aβ蛋白沉积,可应用于治疗阿尔兹海默症(ad)。
[0070]
实施例4
[0071]
脂肪组织注射raav-sibace1腺相关病毒的安全性验证
[0072]
1、将10只8周龄c57小鼠随机分为2组,分别为ad+raav-control组 (control组)和ad+raav-sibace1组(sibace1组),每组5只。对每组小鼠内脏脂肪组织进行对应的病毒注射。2周后处死小鼠,取小鼠脑组织免疫荧光染色小胶质细胞或qrt-pcr法检测炎症因子表达。
[0073]
图12为本发明实施例4中小鼠脑中小胶质细胞的染色及统计图,图13 为本发明实施例4中炎症因子浓度检测结果图,如图12、图13所示,与对照组相比,注射raav-sibace1小鼠小胶质细胞的细胞激活及炎症因子表达无显著变化,表明本发明方法不会引起中枢炎症,具有低免疫原性和高安全性的特点。
[0074]
因此,通过本发明方法,使用aav病毒载体注射脂肪组织可靶向中枢神经元递送sirna药物。注射表达sibace1的腺相关病毒能够显著增加皮层和海马中sibace1的含量,降低海马和皮层bace1蛋白表达水平,减少aβ沉积,减轻ad小鼠的认知损伤,起到改善阿尔兹海默症(ad)病理表型的作用。
[0075]
以上所涉及发明方法的具体步骤不作限制及详细描述,以上所涉及试剂的具体成分不作详细描述,作为公知常识,本领域的技术人员能够理解。
[0076]
以上所述,仅为本发明的较佳实施例而已,并非用于限定本发明的保护范围,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1