一种成纤维细胞植入物及其制备方法和应用与流程
1.本发明属于细胞治疗技术领域,具体涉及一种表达耐酶解胶原蛋白的自体成纤维细胞及其应用。
背景技术:
2.成纤维细胞(fibroblast)是疏松结缔组织(lose connective tissue)中的主要细胞成分,负责表现并分泌多种细胞外基质(extracellular matrix,简称ecm),包含结构性蛋白如纤维胶原蛋白(fibrous collagen)和弹力蛋白(elastin)、粘性蛋白如层粘蛋白(laminin)和 (fibronectin)及基底物质如透明质酸(hyaluronan)等粘粘多糖(glycosaminoglycans);成纤维细胞在许多生理与病理功能上扮演重要角色,如维持ecm代谢的稳定、伤口愈合(woundhealing)、发炎反应(inflammation)或组织纤维化(tissue fibrosis)等。
3.自体成纤维细胞疗法(autologous fibroblast therapy)是一种现行的细胞治疗方式,常用于协助困难伤口愈合、促进烧烫伤愈合、软组织缺损填补、皱纹填补等用途。自体成纤维细胞疗法需要三大步骤:1、自患者身体提取一小块健康组织;2、进行组织中成纤维细胞的纯化与扩增培养;3、将一定量成纤维细胞悬浮液注射或喷涂等方式应用至患部;自体成纤维细胞疗法主要目的之一是透过植入的自体成纤维细胞产生胶原蛋白,以对缺损组织产生支撑与填补作用,或协助伤口愈合。
4.胶原蛋白(collagen)是由28种蛋白所构成的家族,其分子特征是由三股具有α螺旋结构的肽链所组成,胶原蛋白的分型以希腊数字做区分,同一型胶原蛋白的不同肽链则以阿拉伯数字作区别,例如第ⅰ型胶原蛋白的二种肽链为α1(ⅰ)和α2(ⅰ);胶原蛋白的α链具有独特的 (gxy)三个胺基酸重复片段的区域,其中,g为甘氨酸、x多为脯氨酸或其他胺基酸、y多为羟脯氨酸或其他胺基酸,三条肽链透过(gxy)重复片段缠绕成为特殊的绳索状三股螺旋结构。
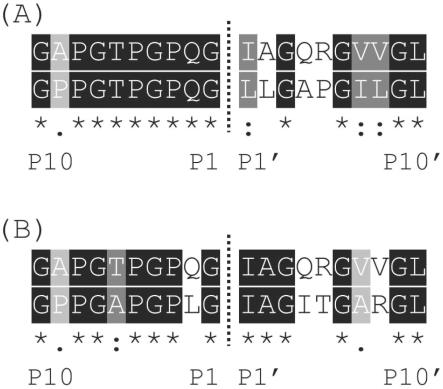
5.胶原蛋白的绳索状三股螺旋结构使其能抵抗多数蛋白酶(proteinases)的分解,当胶原蛋白失去完整三螺旋结构时,即可被许多蛋白酶分解成小分子胶原肽或胺基酸。人体中目前已知具有裂解胶原蛋白完整三螺旋结构的酵素以基质金属蛋白酶(matrixmetalloproteinases,简称mmps)为主,mmps透过辨识并结合到胶原蛋白的特定部位以进行分解,mmp酶切位点(cleavage site)二侧氨基酸序列是决定mmps能否辨识的重要关键,酶切位点氨基端序列由近而远依序为p1、p2、p3、p4....,酶切位点羧基端序列由近而远依序为p1'、p2'、p3'、p4'....,若改变p2、p1’、p2’、p7’、p8’、p10’的一个或多个位点后,可降低mmps对胶原蛋白分子的结合与裂解,进而增加胶原蛋白在体内的安定性与存在量。
6.皮肤或多数软组织中的成纤维细胞以表达和分泌第ⅰ型和第ⅲ型胶原蛋白为主,若能使这些成纤维细胞表达耐酶解的第ⅰ型或第ⅲ型胶原蛋白,可以增加植入细胞所表达和分泌出的胶原蛋白安定性及填补部位的胶原蛋白沉积量(collagen deposit),并在较低的成纤维细胞数量需求条件下,产生充足的胶原蛋白及填补效果。这将有助于减少培养所
需时间,降低成纤维细胞培养生产成本,使自体成纤维细胞疗法更能广泛被使用。
7.发明人在实际使用过程中发现,现有自体成纤维细胞医疗制品至少存在以下问题:植入到组织后的效能维持时间短、需要频繁使用以维持产品效能等问题,因而造成自体成纤维细胞医药制品使用成本高,限制了自体成纤维细胞医药制品的普及化使用。
技术实现要素:
8.进一步的优选技术方案为:一种自体成纤维细胞植入物,其特征在于:该植入物是由表达耐酶解胶原蛋白的自体成纤维细胞所组成;
9.进一步的优选技术方案为:所述表达耐酶解胶原蛋白的自体成纤维细胞对具有裂解胶原蛋白三股螺旋结构的蛋白酶具有抗性,所述蛋白酶包括人类基质金属蛋白酶1、2、8、12、13、14、18。
10.进一步的优选技术方案为:所述表达耐酶解胶原蛋白的自体成纤维细胞中的胶原蛋白包括ⅰ型胶原蛋白α1链、ⅰ型胶原蛋白α2链、ⅲ型胶原蛋白α1链中的一种或多种。
11.进一步的优选技术方案为:所述耐酶解型人源胶原蛋白是将重组人源胶原蛋白α链中的mmp酶辨识部位进行点突变(pointmutation),主要突变位点包含mmp酶辨识部位中p2、p1’、p2’、p7’、p8’、p10’的一个或多个,相对应氨基酸序列见图二灰底标示处,突变后氨基酸位点以粗体标示;点突变后可将野生型胶原蛋白(wild-type,简称wt)改变为耐酶解型胶原蛋白(degradation-resistanttype,简称dr),使其对mmp产生抗性;上述胶原蛋白链均由野生型(wild-type,wt)改变为耐酶解型(degradation-resistanttype,dr),相对应氨基酸序列见图1:
12.进一步的优选技术方案为:α1(ⅰ)链主要突变位点包含mmp酶辨识部位中p2、p1’、p2’、p7’、p8’、p10’的一个或多个;α2(ⅰ)链主要突变位点包含mmp酶辨识部位中p2、p1’、p7’、p8’、p10’的一个或多个;α1(ⅲ)链主要突变位点包含mmp酶辨识部位中p1’、p2’、p10’的一个或多个;
13.进一步的优选技术方案为:所述表达胶原蛋白,表达方法包含但不限于基因转殖或/和基因敲入;基因转殖(transgenicgene)策略:先透过使用野生型(wild-type)胶原蛋白互补脱氧核糖核酸(complementarydna,简称cdna)模板、点突变引物(site-directed
14.mutagenesisprimer)及聚合酶链式反应(polymerasechainreaction,pcr)方法来达成点突变,扩增出耐酶解胶原蛋白互补脱氧核糖核酸,再将耐酶解胶原蛋白互补脱氧核糖核酸克隆至适当表现载体(expressionvectors)后,以携带耐酶解型胶原蛋白基因的一般表现载体(expressionvector)、腺病毒载体(adenoviralvector)、反转录病毒载体(retroviralvector)或慢病毒载体(lentiviralvector)等,透过转染(transfection)或转导(transduction)方式将耐酶解型胶原蛋白基因送入成纤维细胞后,使细胞表达外源性耐酶解型胶原蛋白(exogenousmmp-resistantcollagen),见实施例1;
15.基因敲入(geneknock-in)策略是以核酸酶介导基因编程(nuclease-mediatedgeneediting)方式,将自体干细胞或自体成纤维细胞的内源性胶原蛋白基因由野生型(wt)置换为耐酶解型(dr),从而使改质后的干细胞衍生成纤维细胞(stemcell-derivedfibroblasts)或成纤维细胞表达内源性耐酶解型胶原蛋白(endogenousmmp-resistant
collagen),见实施例2;基因编程方式包含但不限于巨型核酸酶(meganucleases)、锌指核酸酶(zincfingernucleases,简称zfns)、转录激活样效应因子核酸酶(transcriptionactivator-likeeffectornucleases,简称talens)和成簇规律间隔短回文重复(clusteredregularlyinterspacedshortpalindromicrepeats-associatedrna-guidedcas9,简称crispr-cas9)等;
16.进一步的优选技术方案为:一种成纤维细胞植入物,其特征在于,权利要求1所述自体成纤维细胞(autologousfibroblasts),包含但不限于提取自皮肤、牙龈、阴道或其它自体软组织、由自体间充质干细胞(mesenchymalstemcells,mscs)分化而来、或由自体诱导多能干细胞(inducedpluripotentstemcells,ipscs)分化而来;自体成纤维细胞可提取自欲修复的患部周围健康软组织,在适当培养基下继代培养数次后即可取得高纯度的自体成纤维细胞;间充质干细胞(mesenchymalstemcells,mscs)可提取自患者的骨髓、脂肪组织等部位,诱导多能干细胞(inducedpluripotentialstemcells,ipscs)可自患者不同部位的体细胞诱导而来,间充质干细胞和诱导多能干细胞均可透过适当条件将其诱导分化为成纤维细胞,见实施例5~8;
17.进一步的优选技术方案为:一种成纤维细胞植入物在制作医疗产品中的应用,包括修补皮肤和软组织缺损,适用于皱纹填补、皮肤扩张纹、凹陷性瘢痕修复、非创伤性皮肤凹陷修复、嘴唇增厚、皮肤伤口组织修复、牙龈组织修复、阴道组织修复等皮肤和软组织修复用途;
18.或混合其他物质加以应用,其他物质包含但不限于未交联透明质酸钠、重组人类胶原蛋白、多核苷酸、多脱氧核糖核苷酸、水解胶原胜肽、交联透明质酸钠、交联多核苷酸、交联多脱氧核糖核苷酸、重组人源上皮生长因子、重组人源酸性成纤维细胞生长因子、重组人源碱性成纤维细胞生长因子、重组人源血管内皮细胞生长因子、重组人源类胰岛素生长因子、自体富血小板血浆、纤维蛋白凝胶、干细胞外泌体等;
19.或混合其它种类的自体或异体细胞与细胞基质支架共同培养制成活细胞组织移植物加以应用,如皮肤替代物、口腔粘膜替代物、阴道粘膜替代物等;
20.或低温冻存备用。
21.相比现有技术,本发明的技术方案具有如下优点/有益效果:
22.本专利透过基因转殖(transgenic)或基因敲入(geneknock-in)技术进行自体成纤维细胞的改质,使其表现耐mmp酶解的胶原蛋白,具有以下优点:
23.1.与一般动物源胶原蛋白植入剂比较时,自体成纤维细胞具有更高的人体兼容性,无免疫源性或风险;
24.2.可生成较稳定而大量的胶原蛋白网络,维持较长填补时效;
25.3.可使用较少的自体成纤维细胞即可达到足够的填补效果,可以减少过多自体组织的需求或细胞扩增培养时间;
26.4.使用自体间充质干细胞或诱导多能干细胞分化成自体成纤维细胞,可以减少过多自体组织的需求;
27.5.可事先储存备用,以应付因意外受创时的紧急需求。
附图说明
[0028][0029]
图1为人类胶原蛋白α1(ⅰ)链、α2(ⅰ)链和α1(ⅲ)链的胶原蛋白分解酶切点前后区域氨基酸序列比对-(a)α1(ⅰ)链和α2(ⅰ)链)、(b)α1(ⅰ)链和α1(ⅲ)链)胶原蛋白分解酶切点为p1-p1’中间,上图表示p10~p10’共20个氨基酸序列;本发明分析其潜在mmp 酶切位点前后20个氨基酸序列,包含p10~p1及p1’~p10’部位,以clustal 2.1多序列排序软件分析,酶切位点以虚线表示,“*”表示序列间氨基酸完全相同,“:”表示序列间氨基酸具有高度相似性,“.”表示序列间氨基酸具有低度相似性,未标示者表示序列间氨基酸不具相似性,比对结果如图1。
[0030]
图2为本发明中pcdna3-hcol1a1(wt)克隆策略
[0031]
图3为本发明中pcdna3-hcol1a1(i954p)克隆策略
[0032]
图4为本发明中hdf-col1a1基因转殖(transgenic)成纤维细胞
[0033]
图5为本发明中hdf-col1a1基因敲入(gene knock-in)成纤维细胞
[0034]
图6为本发明中hdf-col1a2基因转殖(gene knock-in)成纤维细胞
[0035]
图7为本发明中hdf-col3a1基因敲入(gene knock-in)成纤维细胞
[0036]
图8为本发明中ipsc-col1a1基因转殖(transgenic)诱导干细胞
[0037]
图9为本发明中ipsc-col1a1基因敲入(gene knock-in)诱导干细胞
[0038]
图10为本发明中msc-col1a1基因转殖(transgenic)间充质干细胞
[0039]
图11为本发明中msc-col1a1基因敲入(gene knock-in)间充质干细胞
[0040]
图12为本发明中hdf-col1a1基因转殖(transgenic)成纤维细胞混合未交联透明质酸钠
[0041]
图13为本发明中hdf-col1a1基因转殖(transgenic)成纤维细胞混合角细胞
[0042]
图14为本发明中hdf-col1a1基因转殖(transgenic)成纤维细胞低温冻存
[0043]
图15为本发明中ⅰ型胶原蛋白a1链基因座(col1a1 locus)、guide rna与donor dna 序列及位置、野生型与耐酶解型转录物序列及蛋白质产物标示
[0044]
图16为本发明中ⅰ型胶原蛋白α2链基因座(col1a2 locus)、guide rna与donor dna 序列及位置、野生型与耐酶解型转录物序列及蛋白质产物标示
[0045]
图17为本发明中ⅲ型胶原蛋白a1链基因座(col3a1 locus)、guide rna与donor dna 序列及位置、野生型与耐酶解型转录物序列及蛋白质产物标示
具体实施方式
[0046]
为使本发明目的、技术方案和优点更加清楚,下面对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明的一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。因此,以下提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。
[0047]
应注意到:相似的标号和字母在下面的图中表示类似项,因此,一旦某一项在一个图中被定义,则在随后的图中可以不对其进行进一步定义和解释。
[0048]
实施例1:野生型和耐酶解型人源ⅰ型胶原蛋白转基因比较
[0049]
1.提取mrna
[0050]
(1)将人类纤维母细胞培养于含10%胎牛血清(fetalbovineserum,以下简称fbs)的dulbecco'smodifiedeaglemedium(以下简称dmem)培养基中;
[0051]
(2)细胞长满后,去除培养基后直接加入trizol,放置室温5分钟,使其充分裂解消化;
[0052]
(3)将裂解液移到微量离心管,以12,000rpm转速离心5分钟;
[0053]
(4)将上清液移到新的微量离心管,依每mltrizol加入200微升苯酚-氯仿,振荡混匀后放置于室温15分;
[0054]
(5)于4℃,以12,000rpm转速离心15分钟;
[0055]
(6)将上层水相移到新的微量离心管;依每mltrizol加入0.5ml异丙醇,振荡混匀后放置于室温5-10分;
[0056]
(7)于4℃以12,000rpm转速离心,弃上清液,rna沉于管底;
[0057]
(8)按每mltrizol加入1ml75%乙醇,温和振荡离心管;
[0058]
(9)于4℃下以8,000g转速离心5分钟,尽量去除上清液,于室温晾干5~10分;
[0059]
(10)以用depc处理过的纯化水溶解rna样品,置于55~60℃、5~10分钟加速溶解,并以od260吸光值定量;
[0060]
2.制备互补脱氧核糖核酸(complementarydna,以下简称cdna)文库(cdnalibrary)
[0061]
(1)在无rnase的pcr反应管中加入下列试剂:oligo-dt引物、mrna、水
[0062]
(2)将上述溶液混合均匀,置于70℃、5分钟,随后置于4℃;
[0063]
(3)在pcr管中加入下列试剂:m-mlvreversetranscriptase、dntps、mgcl2、m-mlvrt缓冲液
[0064]
(4)将上述反应溶液混匀,以下列反应条件进行反转录作用:25℃保温10分钟;42℃保温60分钟;70℃保温15分钟;4℃,∞。
[0065]
(5)以分光光度计检测cdna浓度
[0066]
3.野生型人源ⅰ型胶原蛋白α1链表现载体pcdna3-hcol
‑ⅰ
α1(wt)制备于美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation)查询人源ⅰ型胶原蛋白α1链的核苷酸序列,其id:nm_000088,使用聚合酶链反应(polymerasechainreaction,简称pcr)以上述cdna文库为模板,扩增出野生型人源ⅰ型α1胶原蛋白(wild-typehumancollagen,简称wt)cdna;由于hcol
‑ⅰ
α1cdna全长达4402碱基对(basepair,简称bp),故使用二段式扩增再连结的克隆策略,见图2,先分别扩增出hcol
‑ⅰ
α1(wt)n、hcolⅰα1(wt)c二段cdna,再分别以hindⅲ和aatⅱ及aatⅱ和xbai进行酶切,再将二者连接至pcdna3表现载体的ecori
–
xbai部位内,制得hcol
‑ⅲ
α1表现载体pcdna3-hcol
‑ⅰ
α1(wt);pcdna3载体有neomycin抗性基因,可用geneticin来筛选并维持携带此载体的细胞具有生长优势;
[0067]
(1)hcol
‑ⅰ
α1(wt)n扩增所用引物序列为:
[0068]
正向引物nf5
’‑
aagcttatgttcagctttgtggacctccggctcc-3’(底标为hindⅲ酶切位点)
[0069]
反向引物nr5
’‑
ccaggacgtccagcagggccag-3’(底标为aatⅱ内切酶酶切位点)
[0070]
(2)hcol
‑ⅰ
α1(wt)n pcr扩增反应条件:
[0071]
预变性94℃,5分钟
[0072]
扩增循环:模板变性95℃,30秒
[0073]
引物退火65℃,30秒
[0074]
引物延伸72℃,2分钟30秒
[0075]
扩增循环数:32次
[0076]
(3)hcol
‑ⅰ
α1(wt)c pcr扩增所用引物序列为:
[0077]
正向引物cf 5
’‑
ctggccctgctggacgtcctgg-3’(底标为aatⅱ酶切位点)
[0078]
反向引物cr 5
’‑
tctagattacaggaagcagacagggccaacgtcg-3’(底标为xbai 酶切位点)
[0079]
(4)hcol
‑ⅰ
α1(wt)c pcr扩增反应条件:
[0080]
预变性94℃,5分钟
[0081]
扩增循环:模板变性95℃,30秒
[0082]
引物退火64℃,30秒
[0083]
引物延伸72℃,2分钟30秒
[0084]
扩增循环数:32次
[0085]
(5)先以琼脂糖电泳确认hcol
‑ⅰ
α1n和hcol
‑ⅰ
α1c扩增片段大小的正确性,再将hcol
‑ꢀⅰ
α1(i949p)n、hcol
‑ⅰ
α1(i949p)c和pcdna3分别以hindⅲ+aatⅱ、aatⅱ+xbai和hind
ꢀⅲ
+xbai进行酶切,纯化后进行三段式dna连接反应,可得表现载体pcdna3-hcol
‑ⅰ
α1(wt);
[0086]
(6)pcdna3-hcol
‑ⅰ
α1(wt)表现载体可用t7引物做hcol
‑ⅲ
α1(wt)cdna的定序,t7引物序列为:5
’‑
taatacgactcactataggg-3’,定序结果如下:
[0087]
[0088]
[0089][0090]
其中粗体标示部分为nf和nr引物位置,底线标示为cf和cr引物位置,限制酶位点以小写标示,依序为hindⅲ、aatⅱ、xbai;
[0091]
4.耐酶解型重组人源ⅰ型胶原蛋白表现载体pcdna3-hcol
‑ⅰ
α1(i954p)制备
[0092]
以上述cdna文库为模板,使用二段式扩增再连结的克隆策略,见图3,先分别扩增出 hcol
‑ⅰ
α1(i954p)n、hcol
‑ⅰ
α11(i94p)c二段cdna,hcolⅰα11(i954p)n、hcol
‑ⅰ
α1 (i954p)c和pcdna3载体再分别以hindⅲ+smai、smai+xbai和hindⅲ+xbai进行酶切,制得耐酶解型重组人源ⅲ型胶原蛋白表现载体pcdna3-hcol
‑ⅰ
α1(i954p);
[0093]
(1)hcol
‑ⅰ
α11(i954p)n扩增所用引物序列为:
[0094]
正向引物正向引物nf 5
’‑
aagcttatgttcagctttgtggacctccggctcc-3’(底标为 hindⅲ酶切位点)
[0095]
反向引物i945p-nr 5
’‑
gaggcccgggagtaccaggagc-3’(底标为smai酶切位点)
[0096]
(2)hcol
‑ⅰ
α11(i954p)n pcr扩增反应条件:
[0097]
预变性94℃,5分钟
[0098]
扩增循环:模板变性95℃,30秒
[0099]
引物退火65℃,30秒
[0100]
引物延伸72℃,2分钟30秒
[0101]
扩增循环数:32次
[0102]
(3)hcol
‑ⅰ
α11(i954p)c扩增所用引物序列为:
[0103]
正向引物i954p-cf 5
’‑
cccgggcctcaaggtcctgctggacagcgtggtgtggtcg-3’(底标为smai酶切位点)
[0104]
反向引物cr 5
’‑
tctagattacaggaagcagacagggccaacgtcg-3’(底标为xbai 酶切位点)
[0105]
(4)hcol
‑ⅰ
α11(i949p)c pcr扩增反应条件:
[0106]
预变性94℃,5分钟
[0107]
扩增循环:模板变性95℃,30秒
[0108]
引物退火62℃,30秒
[0109]
引物延伸72℃,2分钟30秒
[0110]
扩增循环数:35次
[0111]
(5)先以琼脂糖电泳分析确认hcol
‑ⅰ
α1(i954p)n和hcol
‑ⅰ
α11(i949p)c扩增片段大小是否正确,再将hcol
‑ⅰ
α1(i954p)n、hcol
‑ⅰ
α1(i954p)c和pcdna3分别以hindⅲ+smai、 smai+xbai和hindⅲ+xbai进行酶切,纯化后进行三段式dna连接反应,可得耐酶解型重组人源ⅲ型胶原蛋白表现载体pcdna3-hcol
‑ⅰ
α1(i954p)
[0112]
(6)pcdna3-hcol
‑ⅰ
α1(i954p)表现载体可用t7引物做hcol
‑ⅰ
α1(i954p)cdna的定序,
[0113]
t7引物序列为:5
’‑
taatacgactcactataggg-3’,定序结果如下:
[0114]
[0115][0116]
其中粗体标示部分为nf和i954p-nr引物位置,底线标示为i954p-cf和cr引物位置,限制酶位点以小写标示,依序为hindⅲ、smai、xbai;
[0117]
5.野生型、耐酶解型人源ⅰ型胶原蛋白表现载体细胞转染
[0118]
(1)分别提取人源ⅰ型胶原蛋白表现载体:野生型pcdna3-hcol
‑ⅰ
α1(wt)和耐酶解
型pcdna3-hcol
‑ⅰ
α1(i954p)
[0119]
(2)将原代人类皮肤成纤维细胞(primaryhumandermalfibroblasts,以下简称phdfs)接种于含10%fbs的dmem培养基内,培养隔夜
[0120]
(3)使用电动穿法(electroporation)分别将pcdna3-hcol
‑ⅰ
α1(wt)和耐酶解型pcdna3-hcol
‑ⅰ
α1(i954p)转染进phdfs细胞内
[0121]
(4)转染48小时后,将细胞培养基更换为含1%fbs的dmem
[0122]
(5)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0123]
(6)24小时之后收取野生型与耐酶解型二组细胞培养液,加入活化胶原蛋白分解酶,置于37℃培养12小时
[0124]
(7)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0125]
(8)以10,000
×
g离心1小时,将沉淀物溶解于6mhcl
[0126]
(9)以110℃水解后,使用呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0127]
(10)以野生型组产生的羟脯氨酸含量为100%酶解,由图4可见与野生型组(图4-1)比较时,耐酶解型col1a1dr转基因使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图4-2)。
[0128]
实施例2:耐酶解型基因敲入(knock-in)试验
[0129]
使用invitrogen
tm
truedesign
tm
genomeeditor软件,设计将人类ⅰ型胶原蛋白α1链野生型基因(col1a1wt)突变为耐酶解型(col1a1dr)所需的guiderna与donordna序列;ⅰ型胶原蛋白a1链基因座(col1a1locus)、guiderna与donordna序列及位置、野生型与耐酶解型转录物序列及蛋白质产物分别标示如图15所示。
[0130]
(2)自赛默飞世尔科技(中国)有限公司采购col1a1基因敲入所需试剂
[0131]
(3)使用电动穿法将cas9nuclease、guiderna与donordna转染进phdfs,以不含cas9nuclease为阴性对照组
[0132]
(4)第一次转染24小时后,重复步骤(3)转染以提高基因敲入效率
[0133]
(5)第二次转染24小时后,将细胞培养基更换为含1%fbs的dmem
[0134]
(6)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0135]
(7)24小时之后收取实验组与阴性对照组细胞培养液,加入活化胶原蛋白分解酶,置于37℃培养12小时
[0136]
(8)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0137]
(9)以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6mhcl
[0138]
(10)以110℃水解后,使用呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0139]
(11)以阴性对照组产生的羟脯氨酸含量为100%酶解,比较col1a1dr基因敲入后对胶原酶的抗性;
[0140]
(12)由图5可见与阴性对照组(图5-1)比较时,col1a1dr基因敲入后使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图5-2)。
[0141]
实施例3:hdf-col1a2基因敲入(geneknock-in)图5
[0142]
同实施例2,设计将人类ⅰ型胶原蛋白α2链野生型基因(col1a2wt)突变为耐酶解型(col1a1dr)所需的guiderna与donordna序列;ⅰ型胶原蛋白α2链基因座(col1a2locus)、guiderna与donordna序列及位置、野生型与耐酶解型转录物序列及蛋白质产物分别标示如图16所示。
[0143]
(2)自赛默飞世尔科技(中国)有限公司采购col1a2基因敲入所需试剂
[0144]
(3)使用电动穿法将cas9nuclease、guiderna与donordna转染进phdfs,以不含cas9nuclease为阴性对照组
[0145]
(4)第一次转染24小时后,重复步骤(3)转染以提高基因敲入效率
[0146]
(5)第二次转染24小时后,将细胞培养基更换为含1%fbs的dmem
[0147]
(6)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0148]
(7)24小时之后收取实验组与阴性对照组细胞培养液,加入活化胶原蛋白分解酶,置于37℃培养12小时
[0149]
(8)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0150]
(9)以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6mhcl
[0151]
(10)以110℃水解后,使用呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0152]
(11)以阴性对照组产生的羟脯氨酸含量为100%酶解,比较col1a2dr基因敲入后对胶原酶的抗性;
[0153]
(12)由图6可见与阴性对照组(图6-1)比较时,col1a2dr基因敲入后使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图6-2)。
[0154]
实施例4:hdf-col3a1基因敲入(geneknock-in)
[0155]
同实施例2,设计将人类ⅲ型胶原蛋白α1链野生型基因(col3a1wt)突变为耐酶解型(col3a1dr)所需的guiderna与donordna序列;ⅲ型胶原蛋白a1链基因座(col3a1locus)、guiderna与donordna序列及位置、野生型与耐酶解型转录物序列及蛋白质产物分别标示如图17所示。
[0156]
(2)自赛默飞世尔科技(中国)有限公司采购col3a1dr基因敲入所需试剂
[0157]
(3)使用电动穿法将cas9nuclease、guiderna与donordna转染进phdfs,以不含cas9nuclease为阴性对照组
[0158]
(4)第一次转染24小时后,重复步骤(3)转染以提高基因敲入效率
[0159]
(5)第二次转染24小时后,将细胞培养基更换为含1%fbs的dmem
[0160]
(6)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0161]
(7)24小时之后收取实验组与阴性对照组细胞培养液,加入活化胶原蛋白分解酶,置于37℃培养12小时
[0162]
(8)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0163]
(9)以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6mhcl
[0164]
(10)以110℃水解后,使用呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含
量;
[0165]
(11)以阴性对照组产生的羟脯氨酸含量为100%酶解,比较col3a1dr基因敲入后对胶原酶的抗性;
[0166]
(12)由图7可见与阴性对照组(图7-1)比较时,col3a1dr基因敲入后使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图7-2)。
[0167]
实施例5:ipsc-col1a1基因转殖(transgenic)
[0168]
(1)将ipscs接种于含10%fbs的dmem培养基内,培养隔夜
[0169]
(2)使用电动穿法分别将pcdna3-hcol
‑ⅰ
α1(wt)和耐酶解型pcdna3-hcol
‑ⅰ
α1(i954p)转染进ipscs内
[0170]
(3)转染24小时后,将细胞培养基更换为含10%fbs、100ng/ml的重组人类结缔组织生长因子和50μg/ml ascorbic acid和200μg/ml geneticin的dmem,每三天更换培养基以将诱发为成纤维细胞,持续2~4周
[0171]
(4)将细胞培养基更换为含1%fbs的dmem
[0172]
(5)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0173]
(6)24小时之后收取野生型与耐酶解型二组细胞培养液,加入活化胶原蛋白分解酶,置于 37℃培养12小时
[0174]
(7)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0175]
(8)以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6m hcl
[0176]
(9)以110℃水解后,以呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0177]
(10)以野生型组产生的羟脯氨酸含量为100%酶解,由图8可见与野生型组(图8-1)比较时,耐酶解型col1a1dr转基因使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图 8-2)。
[0178]
实施例6:ipsc-col1a1基因敲入(gene knock-in)
[0179]
(1)同实施例2,自赛默飞世尔科技(中国)有限公司采购col1a1基因敲入所需试剂
[0180]
(2)使用电动穿法将cas9 nuclease、guide rna与donor dna转染进ipscs,以不含cas9 nuclease为阴性对照组
[0181]
(3)第一次转染24小时后,重复步骤(3)转染以提高基因敲入效率
[0182]
(4)第二次转染24小时后,将细胞培养基更换为含100ng/ml的重组人类结缔组织生长因子和50μg/ml ascorbic acid的dmem,每三天更换培养基以将诱发为成纤维细胞,持续 2~4周
[0183]
(5)将细胞培养基更换为含1%fbs的dmem
[0184]
(6)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0185]
(7)24小时之后收取实验组与阴性对照组细胞培养液,加入活化胶原蛋白分解酶,置于 37℃培养12小时
[0186]
(8)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0187]
(9以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6m hcl
[0188]
(10)以110℃水解后,以呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0189]
(11)以阴性对照组产生的羟脯氨酸含量为100%酶解,比较col1a1dr基因敲入后对胶
[0190]
原酶的抗性;
[0191]
(12)由图9可见与阴性对照组(图9-1)比较时,col1a1dr基因敲入后使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图9-2)。
[0192]
实施例7:msc-col1a1基因转殖(transgenic)
[0193]
(1)将原代人类msc接种于含10%fbs的dmem培养基内,培养隔夜
[0194]
(2)使用电动穿法分别将pcdna3-hcol
‑ⅰ
α1(wt)和耐酶解型pcdna3-hcol
‑ⅰ
α1(i954p)转染进mscs内
[0195]
(3)转染48小时后,将细胞培养基更换为含10%fbs、100ng/ml的重组人类结缔组织生长因子和50μg/mlascorbicacid和200μg/mlgeneticin的dmem,每三天更换培养基以将诱发为成纤维细胞,持续2~4周
[0196]
(4)将细胞培养基更换为含1%fbs的dmem
[0197]
(5)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0198]
(6)24小时之后收取野生型与耐酶解型二组细胞培养液,加入活化胶原蛋白分解酶,置于37℃培养12小时
[0199]
(7)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0200]
(8)以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6mhcl
[0201]
(9)以110℃水解后,以呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0202]
(10)以野生型组产生的羟脯氨酸含量为100%酶解,由图10可见与野生型组(图10-1)比较时,耐酶解型col1a1dr转基因使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图10-2)。
[0203]
实施例8:msc-col1a1基因敲入(geneknock-in)
[0204]
(1)同实施例2,自赛默飞世尔科技(中国)有限公司采购col1a1基因敲入所需试剂
[0205]
(2)使用电动穿法将cas9nuclease、guiderna与donordna转染进mscs,以不含cas9nuclease为阴性对照组
[0206]
(3)第一次转染24小时后,重复步骤(3)转染以提高基因敲入效率
[0207]
(4)第二次转染24小时后,将细胞培养基更换为含100ng/ml的重组人类结缔组织生长因子和50μg/mlascorbicacid的dmem,每三天更换培养基以将诱发为成纤维细胞,持续2~4周
[0208]
(5)将细胞培养基更换为含1%fbs的dmem
[0209]
(6)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0210]
(7)24小时之后收取实验组与阴性对照组细胞培养液,加入活化胶原蛋白分解酶,置于37℃培养12小时
[0211]
(8)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0212]
(9)以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6mhcl
[0213]
(10)以110℃水解后,以呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0214]
(11)以阴性对照组产生的羟脯氨酸含量为100%酶解,比较col1a1dr基因敲入后对胶原酶的抗性;
[0215]
(12)由图11可见与阴性对照组(图11-1)比较时,col1a1dr基因敲入后使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图11-2)。
[0216]
实施例9:hdf-col1a1基因转殖(transgenic)混合未交联透明质酸钠
[0217]
(1)将phdfs接种于含10%fbs的dmem培养基内,培养隔夜
[0218]
(2)使用电动穿法分别将pcdna3-hcol
‑ⅰ
α1(wt)和耐酶解型pcdna3-hcol
‑ⅰ
α1(i954p)转染进phdfs细胞内
[0219]
(3)转染48小时后,将细胞培养基更换为含1%fbs的dmem
[0220]
(4)隔夜培养后,将培养基更换为不含血清的dmem
[0221]
(5)隔夜培养后,将加入抗败血酸至终浓度50μm及0.5%(w/v)未交联透明质酸钠
[0222]
(6)24小时之后收取野生型与耐酶解型二组细胞培养液,加入活化胶原蛋白分解酶,置于 37℃培养12小时
[0223]
(7)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0224]
(8)以10,000
×
g离心1小时,去上清液,将沉淀物溶解于6m hcl
[0225]
(9)以110℃水解后,以呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0226]
(10)以野生型组产生的羟脯氨酸含量为100%酶解,由图12可见与野生型组(图12-1)比较时,耐酶解型col1a1dr转基因使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图 12-2)。
[0227]
实施例10:hdf-col1a1基因转殖(transgenic)成纤维细胞混合角细胞
[0228]
(1)将phdfs接种于含10%fbs的dmem培养基内,培养隔夜
[0229]
(2)使用电动穿法分别将pcdna3-hcol
‑ⅰ
α1(wt)和耐酶解型pcdna3-hcol
‑ⅰ
α1(i954p)转染进phdfs细胞内
[0230]
(3)转染24小时后,将原代人类角细胞(primary human keratinocytes,phks)接种于phdfs 上方,将细胞培养基更换为含10%fbs的epilife:dmem(1:1)
[0231]
(4)共培养后24小时后,将细胞培养基更换为含1%fbs的epilife:dmem(1:1)
[0232]
(5)隔夜培养后将培养基更换为不含血清的epilife加dmem,加入抗败血酸至终浓度 50μm
[0233]
(6)24小时之后收取野生型与耐酶解型二组细胞培养液,加入活化胶原蛋白分解酶,置于37℃培养12小时
[0234]
(7)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0235]
(8)以10,000
×
g离心1小时,将沉淀物溶解于6m hcl
[0236]
(9)以110℃水解后,以呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0237]
(10)以野生型组产生的羟脯氨酸含量为100%酶解,由图13可见与野生型组(图13-1)比较时,耐酶解型col1a1dr转基因使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图 13-2)。
[0238]
实施例11:hdf-col1a1基因转殖(transgenic)低温冻存
[0239]
(1)将phdfs接种于含10%fbs的dmem培养基内,培养隔夜
[0240]
(2)使用电动穿法分别将pcdna3-hcol
‑ⅰ
α1(wt)和耐酶解型pcdna3-hcol
‑ⅰ
α1(i954p) 转染进phdfs细胞内
[0241]
(3)转染48小时后,将phdfs以胰蛋白酶消化后加入含10%dmso的fbs,以 1x106cells/ml密度冻存于液态氮
[0242]
(4)将细胞解冻后,培养于含10%fbs的dmem
[0243]
(5)培养48小时后将细胞培养基更换为含1%fbs的dmem
[0244]
(6)隔夜培养后将培养基更换为不含血清的dmem,加入抗败血酸至终浓度50μm
[0245]
(7)24小时之后收取野生型与耐酶解型二组细胞培养液,加入活化胶原蛋白分解酶,置于 37℃培养12小时
[0246]
(8)加入硫酸铵至终浓度176mg/ml,置于4℃24小时
[0247]
(9)以10,000
×
g离心1小时,将沉淀物溶解于6m hcl
[0248]
(10)以110℃水解后,以呈色法羟脯氨酸检测法测定水解液内羟脯氨酸含量;不含胶原酶溶液内羟脯氨酸含量-含胶原酶溶液内羟脯氨酸含量=酶解产生的羟脯氨酸含量;
[0249]
(11)以野生型组产生的羟脯氨酸含量为100%酶解,由图14可见与野生型组(图14-1)比较时,耐酶解型col1a1dr转基因使细胞产生的胶原蛋白对胶原酶产生明显的抗性(图 14-2)。
[0250]
综上,本发明透过基因转殖(transgenic)或基因敲入(gene knock-in)技术进行自体成纤维细胞的改质,使其表现耐mmp酶解的胶原蛋白,与一般动物源胶原蛋白植入剂比较时,自体成纤维细胞具有更高的人体兼容性,无免疫源性或风险;可生成较稳定而大量的胶原蛋白网络,维持较长填补时效;
[0251]
可使用较少的自体成纤维细胞即可达到足够的填补效果,可以减少过多自体组织的需求或细胞扩增培养时间;
[0252]
使用自体间充质干细胞或诱导多能干细胞分化成自体成纤维细胞,可以减少过多自体组织的需求;
[0253]
可事先储存备用,以应付因意外受创时的紧急需求,应用前景广泛。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1