用于治疗水肿的组合物和方法与流程
用于治疗水肿的组合物和方法
1.本技术是申请日为2016年2月5日,申请号:201680016894.0, 发明名称为“用于治疗水肿的组合物和方法”的中国发明专利申请的 分案申请。
2.对相关申请的交叉引用
3.本技术要求2015年2月5日提交的美国临时专利申请号 62/112,273的优先权权益,其全部内容通过引用并入本文。
4.政府支持的声明
5.本发明在由国立卫生研究所授权的拨款号r01 hl111130-01、 t32 ca009685-21a1和1s10 rr028889-01,以及国立癌症研究所授 予的拨款号p30 ca008748下得到政府支持完成。政府具有本发明的 某些权利。
6.版权
7.本专利文献的公开内容的一部分含有受版权保护的材料。版权所 有者不反对任何人复制专利文献或专利公开,就像它在专利商标局专 利文件或记录中出现一样,但无论如何以其它方式保留所有版权。
8.通过引用并入
9.对于允许通过引用并入的国家,本公开中引用的所有参考文献的 全部内容通过引用并入本文。此外,任何制造商对本文中引用或提及 的任何产品的说明或目录均通过引用并入。通过引用并入本文的文献 或其中的任何教导可以用于本发明的实践中。通过引用并入本文的文 件不承认是现有技术。
背景技术:
10.淋巴水肿是一种慢性虚弱性疾病,其在美国和西方国家最常作为 癌症治疗的并发症出现。在这种背景下,淋巴水肿最常在淋巴结清除 术后由于对淋巴系统的医源性损伤,而且还由于较宽的皮肤切除和用 辐射的辅助疗法而发生。purushotham等人,j.clin.oncol. 23:4312-4321(2005);szuba等人,cancer 95:2260-2267(2002);tsai 等人,ann.surg.oncol.16:1959-72(2009)。据估计,经历淋巴结清扫 术的3名患者中的多达1名将继续发展淋巴水肿,并且保守估计提示 每年诊断出多达50,000名新患者。disipio等人,lancet oncol. 14:500-515(2013);petrek等人,cancer 83:2776-2781(1998)。由于淋 巴水肿是一种无法治愈的终身疾病,受影响的个体的数目每年都在增 加,目前的估计值在5-6百万美国人之间(rockson等人,ann.ny acad. sci.1131:147-154(2008))和全球超过2亿人。由于淋巴水肿的发展与 癌症存活几乎呈线性关系,并且因为随着淋巴水肿的已知危险因素 (如肥胖和放射)的流行日益提高,此数目在未来可能会继续增加。 erickson等人,j.natl.cancer inst.93:96-111(2001)。
11.淋巴水肿是令人难看和虚弱的;患者具有受影响肢体的慢性肿 胀、复发性感染、有限的运动性和生活质量下降。hayes等人,cancer118:2237-2249(2012)。此外,一旦淋巴水肿发展,它通常是进行性的。 尽管淋巴水肿是常见且高度病态的实情,但目前尚无治愈,并且治疗 是姑息的,其目的是预防疾病进展而不是恢复淋巴功能。velanovich 等人,
am.j.surg.177:184-187(1999);beaulac等人,arch.surg.137; 1253-1257(2002)。因此,需要患者在其生命的剩余部分穿紧身、不 舒服的衣服,以防止受影响的肢体中的淋巴液积聚,并且经受激烈和 耗时的物理疗法治疗。koul等人,int.j.radiat.oncol.biol.phys., 67:841-846(2007)。此外,尽管进行中的慢性护理,一些患者仍然有 严重的疾病进展,伴有淋巴水肿肢体的肿胀增加和频繁的感染。目前 没有可以阻止淋巴水肿进展或促进消退的已知的药理学疗法。 cormier等人,ann.surg.oncol.19:642-651(2012)。因此,淋巴水肿的 靶向治疗的开发是一个重要的目标,并且是未满足的生物医学需要。
12.最近的研究表明,纤维化不仅是淋巴水肿的临床特征,而且也是 疾病的关键病理调节物。cheville等人,semin.radiat.oncol. 13:214-225(2003);mihara等人,plos one 7:e41126(2012);rasmussen 等人,curr.opin.biotechnol.20:74-82(2009)。转化生长因子 β-1(tgf-β1)是多种器官系统中纤维化的关键调节物,通过直接机制 起作用以增加成纤维细胞的胶原产生,并且降低基质产物的周转。 willis等人,am.j.pathol.166:1321-1332(2005);sakai等人,am.j. pathol.184:2611-2617(2014);qi等人,am.j.physiol.renal physiol. 288:f800-f809(2005);bonniaud等人,j.immunol.173:2099-2108 (2004);fujimoto等人,biochem.biophys.res.commun.305:1002-1007 (2003);stramer等人,j.cell physiol.203:226-232(2005);kawakami 等人,j.invest.dermatol.110:47-51(1998);li等人,circulation96:874-881(1997);martinez等人,hepatology 21:113-119(1995); peltonen等人,j.invest.dermatol.97:240-248(1991);van laethem等 人,gastroenterology 110:576-582(1996)。此外,tgf-β1是炎性应答 的关键调节物,并且认为通过调节慢性炎症间接调节纤维化。pesce 等人,plos pathog.5:e1000371(2009)。我们最近已经显示了在淋巴水 肿组织中,在临床上以及淋巴水肿的小鼠模型中,tgf-β1的表达显 著增加。使用免疫疗法抑制tgf-β1可显著加速小鼠尾模型中的淋巴 再生,减少纤维化,减少炎症,以及改善淋巴功能。avraham等人,plast. reconstr.surg.124:438-450(2009);clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008);avraham等人,am.j.pathol. 177:3202-3214(2010)。
13.纤维化应答的抑制保留了淋巴系统输送组织液和炎性细胞的能 力。我们实验室的最近研究已经显示了,淋巴水肿的临床和动物模型 中,cd4
+
细胞在调节纤维化中起关键作用。avraham等人,am.j. pathol.177:3202-3214(2010);avraham等人,faseb j.27:1114-1126 (2013);zampell等人,am.j.physiol.cell physiol.302:c392-c404 (2012);zampell等人,plos one 7:e49940(2012)。例如,我们发现了 临床淋巴水肿活检标本和淋巴水肿的动物模型被cd4
+
细胞浸润,并 且这些细胞的数目与纤维化程度和疾病的临床严重程度相关。 avraham等人,faseb j.27:1114-1126(2013)。晚期淋巴水肿患者一般 比早期疾病患者具有显著更多的浸润性t细胞,特别是更多的cd4
+
细胞。淋巴静脉旁路(一种将阻塞性淋巴系统分流到静脉循环的过程) 后淋巴水肿临床症状的改善与组织纤维化减少和cd4
+
细胞浸润减少 有关。torrisi等人,lymphat.res.biol.13:46-53(2015)。
14.淋巴水肿中的cd4
+
细胞应答(与其它纤维增生性病症相似)特征 在于混合的th1/th2细胞群体。avraham等人,faseb j.27:1114-1126 (2013)。首次用于实验的cd4+t细胞,也称为t辅助细胞或th细 胞,巡查次级淋巴样结构,并且在激活时沿着许多不同/重叠的细
胞 类型(例如th1、th2、th17、t调节等)分化。th2细胞亚组在调节对 寄生物的应答和一些自身免疫应答中起关键作用。这些细胞也涉及包 括心脏、肺、肾和皮肤在内的许多器官系统中的纤维增生性疾病的病 理学。最近的研究已经显示了,从淋巴水肿患者获得的组织活组织检 查中th2的数目增加,并且th2分化的抑制降低了小鼠模型中淋巴 水肿的病理学。
15.cd4
+
细胞(但不包括其它炎症细胞类型,包括cd8
+
细胞或巨噬细 胞)的消耗或th2分化的抑制(但不是全身性炎症或抑制白细胞介素-6) 显著降低纤维化程度,增加淋巴管生成和淋巴液转运,并有效地治疗 临床前小鼠模型中建立的淋巴水肿。avraham等人,faseb j. 27:1114-1126(2013);zampell等人,plos one 7:e49940(2012);ghanta 等人,am.j.physiol.heart circ.physiol.308:h1065-1077(2015)。这些 发现得到最近的研究证实,所述研究证明了t细胞通过产生抗淋巴管 生成细胞因子/生长因子,包括干扰素γ(ifn-γ)、白细胞介素(il)-4、 il-13和tgf-β1,有力抑制淋巴管生成。kataru等人,immunity34:96-107(2011);shin等人,nat.commun.6:6196(2015);shao等人, j.interferon.cytokine res.26:568-574(2006);oka等人,blood111:4571-4579(2008)。这些研究结果一起表明,淋巴水肿组织中浸润 性cd4
+
细胞通过多种机制减少淋巴功能,包括诱导继发于组织纤维 化的淋巴管的结构变化和抑制侧淋巴管形成。
16.以前的用于淋巴水肿的实验性治疗集中于递送淋巴管生成性细 胞因子。skobe等人,nat.med.7:192-198(2001)。例如,以前的一些 研究集中于使用淋巴管生成性细胞因子如血管内皮生长因子 c(vegf-c)修复损伤的淋巴系统。tammela等人,nat.med. 13:1458-1466(2007);baker等人,breast cancer res.12:r70(2010)。 尽管有前景,但是这种方法的应用(特别对癌症患者)可能是站不住脚 的,因为这些相同的机制调节肿瘤生长和转移,提高癌症转移或复发 的风险。zhang等人,cancer res.70:2495-2503(2010);yu等人,j.exp. clin.cancer res.28:98(2009);sugiura等人,int.j.oncol.34:673-680 (2009);gu等人,clin.exp.metastasis 25:717-725(2008);kazama等 人,hepatogastroenterology 54:71-76(2007);hirakawa等人,blood109:1010-1017(2007)。相比之下,局部消耗cd4+t细胞可以治疗潜 在的病理学,而非仅仅促进淋巴管生成,因此可以安全得多地用于癌 症患者。因此,这种方法能够在淋巴水肿爆发/恶化期间治疗癌症幸 存者,在非手术患者中添加到保守疗法,预防高危患者中的疾病发展, 或改善淋巴水肿的手术治疗的结果。
17.他克莫司是fda批准为局部制剂并用于治疗皮肤炎症/纤维化疾 病,包括特应性皮炎(ruzicka等人,n.engl.j.med.337:816-821 (1997))、银屑病(wang等人,j.cutan.med.surg.18:8-14(2014))和局部 化硬皮病(mancuso等人,br.j.dermatol.152:180-182(2005))的抗t细 胞剂。他克莫司是由土壤细菌筑波链霉菌(streptomyces tsukubaensis) 产生的大环内酯,当用于预防移植排斥和治疗多种自身免疫性疾病 时,其是完全耐受的。它通过结合fk-506结合蛋白12(fkbp-12)发 挥其抗t细胞特性,从而抑制钙调神经磷酸酶,并最终降低il-2表 达。clipstone等人,nature 357:695-697(1992)。因为il-2对cd4
+
t 细胞的t细胞活化和分化是至关重要的,所以钙调神经磷酸酶抑制剂 具有深刻的cd4
+
细胞免疫抑制作用。liao等人,immunity 38:13-25 (2013);rautajoki等人,ann.med.40:322-335(2008)。
18.特立氟胺(teriflunomide)是减少t细胞炎症应答的免疫抑制剂。 特立氟胺的口
服施用经fda批准用于治疗多发性硬化。williamson 等人,j.biol.chem.270:22467-22472(1995);davis等人,biochem. 35:1270-1273(1996);iglesias-bregna等人,j.pharmacol.exp.ther. 347:203-211(2013)。特立氟胺是来氟米特(leflunomide)的活性代谢物, 并且通过阻断酶二氢乳清酸脱氢酶抑制从头嘧啶合成。也已经显示了 特立氟胺抑制信号转导物和转录激活物-6(stat-6)(th2分化的关键 调节物)的激活。olsan等人,proc.natl.acad.sci.usa108:18067-18072(2011)。作为这些机制的结果,特立氟胺抑制活跃分 裂的th2细胞并减少炎症应答。
19.吡非尼酮是具有抗纤维化和抗炎作用的化合物。最近的研究表 明,这种活性至少部分是由于抑制tgf-β的产生和活性。iyer等人,j. pharmacol.exp.ther.291:367-373(1999);tada等人,clin.exper. pharmacol.physiol.28:522-527(2001);oku等人,eur.j.pharmacol. 590:400-408(2008);tian等人,chin.med.sci.j.21:145-151(2006); schaefer等人,eur.respir.rev.20:85-97(2011)。目前,在1,247例ipf 患者的3项临床试验中建立其安全性和功效后,它在美国被fda批 准用于在治疗特发性肺纤维化(ipf)中口服施用。taniguchi等人,eur. respir.j.35:821-829(2010);noble等人,lancet 377:1760-1769(2011); king等人,n.engl.j.med.370:2083-2092(2014)。除了ipf的治疗之 外,吡非尼酮已被临床评估其治疗其它慢性纤维化病症(包括肾纤维 化、肝纤维化和骨髓纤维化)的安全性和功效。tada等人,clin.exper. pharmacol.physiol.28:522-527(2001);cho等人,clin.j.am.soc. nephrol.2:906-913(2007);nagai等人,intern.med.41:1118-1123 (2002);raghu等人,am.j.respir.crit.care med.159:1061-1069 (1999);gahl等人,mol.genet.metab.76:234-242(2002); armendariz-borunda等人,gut 55:1663-1665(2006);angulo等人,dig. dis.sci.47:157-161(2002);mesa等人,brit.j.haematol.114:111-113 (2001)。
20.卡托普利是血管紧张肽转换酶(ace)抑制剂,由fda批准用于在 治疗高血压和确定型心力衰竭和糖尿病肾病中口服施用。ace将血 管紧张肽i(angi)转化为血管紧张肽ii(angii)并引起血管收缩,抑制 血管扩张,并通过对肾素-血管紧张肽系统(ras)的作用间接调节血管 内液体积。因此,ace的抑制已经成为高血压的主要疗法。最近的 研究显示了angii也是各种器官系统(包括肾、肝和肺)纤维化的关键 调节物。langham等人,diabetes care 29:2670-2675(2006);alves dealbuquerque等人,kidney intl.65:846-859(2004);osterreicher等人, hepatology.50:929-938(2009);mak等人,mol.ther.23:1434-1443 (2015);wang等人,cell physiol.biochem.36:697-711(2015)。angii 的促纤维化作用由许多机制介导,包括活性氧物质的产生、趋化因子 和细胞因子的产生、粘附分子的表达增加、以及tgf-β表达/活性的 调节。相比之下,angi通过激活其细胞表面受体mas而具有抗增殖 和抗纤维化活性。clarke等人,int.j.hypertens.2012:307315(2011)。 因此,已经提出ace和/或angii的抑制剂如卡托普利、氯沙坦和其 它类似药物作为肺、肾和肝纤维化病症的潜在治疗选择。
21.目前还没有可用于治疗淋巴水肿的药物疗法。以前对淋巴水肿的 研究主要集中在全身药物治疗。例如,口腔服用的香豆素已经用于淋 巴水肿患者,取得适度的成功。casley-smith等人,bmj307:1037-1041(1993);casley-smith等人,n.engl.j.med. 329:1158-1163(1993);casley-smith等人,australas j.dermatol. 33:69-74(1992);
loprinzi等人,n.engl.j.med.340:346-350(1999)。然 而,这种药物的广泛临床应用受到显著的毒性(包括肝衰竭和死亡)的 阻碍。loprinzi等人,n.engl.j.med.340:346-350(1999)。靶向纤维化 的策略(特别是抑制全身性cd4
+
炎症应答、th2分化和/或tgf-β2途 径)具有治疗淋巴水肿的临床前景。尽管高度有效,但由于不可接受 的发病率和全身性并发症如感染、癌症复发和自身免疫性疾病,cd4+ 细胞的全身性消耗不是临床可行的。相比之下,局部递送药剂治疗与 淋巴水肿相关的病理事件是一种可能限制全身毒性的新方法。因为淋 巴水肿主要是四肢的皮肤和皮下软组织疾病,所以可以使用局部方 法,这可以是更好耐受的,并提供更有靶向性的方法,从而避免全身 并发症。因此,本领域中需要淋巴水肿的新治疗,特别是局部治疗。
技术实现要素:
22.下文总结了本发明的一些主要方面。在本公开的发明详述、实施 例、附图和权利要求书部分中描述了另外的方面。本公开的每个部分 中的描述旨在与其它部分一起阅读。此外,本公开的每个部分中描述 的各种实施方案可以以各种不同的方式组合,并且所有此类组合旨在 落入本发明的范围内。
23.在一方面,本发明提供了药物组合物,其包含抗t细胞、抗 tgf-β1和/或抗血管紧张肽剂的组合。例如,本发明提供了药物组合 物,其包含:(i)有效量的一种或多种抗t细胞剂和(ii)有效量的一种 或多种抗tgf-β1剂和/或有效量的一种或多种抗血管紧张肽剂。在具 体的实施方案中,本发明提供了药物组合物,其包含(i)有效量的一种 或多种抗t细胞剂和(ii)有效量的一种或多种抗tgf-β1剂。在另一个 实施方案中,本发明提供了药物组合物,其包含:(i)有效量的一种或 多种抗t细胞剂和(ii)有效量的一种或多种抗血管紧张肽剂。在又一 个实施方案中,本发明提供了药物组合物,其包含:(i)有效量的一种 或多种抗t细胞剂和(ii)有效量的一种或多种抗tgf-β1剂和(iii)有效 量的一种或多种抗血管紧张肽剂。
24.在一个实施方案中,抗t细胞剂选自由以下组成的组:他克莫司、 特立氟胺、来氟米特、环孢霉素、吡美莫司、地尼白介素2和巴利昔 单抗。在一个实施方案中,抗tgf-β1剂或抗血管紧张肽剂选自由以 下组成的组:吡非尼酮、卡托普利、佐芬普利、依那普利、赖诺普利、 雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、 西拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替 米沙坦、缬沙坦和非马沙坦。在具体的实施方案中,抗血管紧张肽剂 是ace激动剂,例如ace-2激动剂。组合物可以被配制用于全身施 用或局部施用。在优选的实施方案中,组合物被配制用于局部施用。
25.本发明的药物组合物可以包含抗t细胞、抗tgf-β1和/或抗血管 紧张肽剂的任何组合。例如,在一个实施方案中,组合物包含他克莫 司和吡非尼酮。在另一个实施方案中,组合物包含他克莫司、吡非尼 酮和特立氟胺。在另一个实施方案中,组合物包含他克莫司、吡非尼 酮和来氟米特。在其它方面,组合物包含他克莫司和卡托普利;或特 立氟胺和卡托普利;或来氟米特和卡托普利;或吡非尼酮和卡托普利; 或他克莫司、卡托普利和特立氟胺;或他克莫司、卡托普利和来氟米 特;或他克莫司、卡托普利和吡非尼酮。
26.在药物组合物被配制用于局部施用的药物组合物的实施方案中, 组合物可以包含约0.01%至约1%他克莫司,优选地约0.05至约0.2% 他克莫司;约0.1mg/ml至约5mg/ml
吡非尼酮,优选地约0.5mg/ml 至约2mg/ml吡非尼酮;约10mg/ml至约50mg/ml特立氟胺,优选 地约20mg/ml至约30mg/ml特立氟胺;约1%至约20%来氟米特, 优选地约5%至约15%来氟米特;和/或约1%至约20%卡托普利。药 物组合物优选地为选自以下的形式:软膏剂、乳膏、洗剂、糊剂、凝 胶、摩丝、泡沫、漆、混悬剂、液体和喷雾剂。在优选的实施方案中, 组合物为软膏剂的形式。
27.本发明的药物组合物可以用于治疗或预防水肿。
28.本发明还提供了治疗或预防水肿的方法,所述方法包括对有此需 要的受试者施用药物组合物,所述药物组合物包含有效量的一种或多 种选自由以下组成的组的药物:他克莫司、特立氟胺、来氟米特、环 孢霉素、吡美莫司、地尼白介素2、巴利昔单抗、吡非尼酮、卡托普 利、佐芬普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普 利、贝那普利、咪达普利、群多普利、西拉普利、福辛普利、氯沙坦、 厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦和非马沙坦。
29.在一方面,水肿是淋巴水肿。
30.在一方面,本发明的方法可以包括施用抗t细胞、抗tgf-β1和 /或抗血管紧张肽剂的组合。在具体的实施方案中,方法包括施用药 物组合物,其包含:(i)有效量的一种或多种抗t细胞剂,其选自由以 下组成的组:他克莫司、特立氟胺、来氟米特、环孢霉素、吡美莫司、 地尼白介素2和巴利昔单抗;和(ii)有效量的一种或多种抗tgf-β1剂 和/或抗血管紧张肽剂,其选自由以下组成的组:吡非尼酮、卡托普 利、佐芬普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普 利、贝那普利、咪达普利、群多普利、西拉普利、福辛普利、氯沙坦、 厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦和非马沙坦。方 法可以包括施用抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的任何组 合。例如,在一个实施方案中,方法包括施用包含他克莫司和吡非尼 酮的药物组合物。在另一个实施方案中,方法包括施用包含他克莫司、 吡非尼酮和特立氟胺的药物组合物。在另一个实施方案中,方法包括 施用包含他克莫司、吡非尼酮和来氟米特的药物组合物。在其它方面, 方法包括施用包含他克莫司和卡托普利;或特立氟胺和卡托普利;或 来氟米特和卡托普利;或吡非尼酮和卡托普利;或他克莫司、卡托普 利和特立氟胺;或他克莫司、卡托普利和来氟米特;或他克莫司、卡 托普利和吡非尼酮的药物组合物。
31.在本发明的方法中,可以全身或局部施用药物组合物。在优选的 方法中,局部施用药物组合物。在本发明的此方面,药物组合物可包 含约0.01%至约1%他克莫司,优选地约0.05至约0.2%他克莫司;约 0.1mg/ml至约5mg/ml吡非尼酮、优选地约0.5mg/ml至约2mg/ml 吡非尼酮;约10mg/ml至约50mg/ml特立氟胺、优选地约20mg/ml 至约30mg/ml特立氟胺;约1%至约20%来氟米特、优选地约5%至 约15%来氟米特;和/或约1%至约20%卡托普利。在局部施用的方法 中,药物组合物为选自以下的形式:软膏剂、乳膏、洗剂、糊剂、凝 胶、摩丝、泡沫、漆、混悬剂、液体和喷雾剂。优选地,药物组合物 为软膏剂的形式。
32.确定用于全身或局部施用的给药日程表和持续时间在普通技术 人员的技术范围内。在一个实施方案中,一天至少一次局部施用药物 组合物。在另一个实施方案中,一天至少两次局部施用药物组合物。 在药物组合物或方法牵涉预防水肿,特别地预防淋巴水肿的情况下, 可以在淋巴损伤的约6周,优选地在淋巴损伤的约2周内施用组合物。
附图说明
33.图1a-1e显示了局部他克莫司降低尾部淋巴水肿。图1a显示了 在手术切除浅表/深层集合淋巴系统并且在手术后2周(早期治疗)或6 周(晚期治疗)开始用或不用局部他克莫司治疗后小鼠尾部的代表性照 片。箭头指示疗法开始。图1b是与对照相比用他克莫司的早期 (*p=0.021)或晚期(*p=0.018)治疗后尾部体积变化的图示。图1c(上图) 显示了在淋巴消融后6周收获的对照和早期他克莫司治疗的小鼠尾 部的截面组织学图像。括号显示了软组织厚度。图1c(下图)显示了用 他克莫司的早期或晚期治疗后的软组织变化的量化(*p=《0.001)。图 1d显示了全血他克莫司水平的量化,证明了全身治疗动物(4mg kg-1 ip每日)中的免疫抑制浓度和局部治疗组中的非免疫抑制水平 (*p=0.007)。图1e显示了用媒介物对照、局部他克莫司或全身性他克 莫司治疗的动物中流式细胞术图(上图)和血液t细胞的量化(下图)。 流式图代表y轴上的侧向散射面积(ssa)和x轴上的cd3
+
代表t细 胞。注意仅在全身治疗的动物中t细胞的显著减少(*p=0.012)。
34.图2a-2d显示了局部他克莫司在淋巴损伤后降低炎症。图2a-2d 显示了在cd45
+
(图2ai和2a
ii
)、cd3
+
细胞(图2bi和2b
ii
)、cd4
+
细胞(图2ci和2c
ii
)和ifn-γ
+
细胞(图2di和2d
ii
)的免疫荧光局部化的情况 下手术后6周从对照和他克莫司治疗动物收获的尾部组织切片的代 表性40x图像。在每个图的右上角插图中显示更高放大率(80x)图像。 在每个图中染色淋巴管(lyve-1)。在每个图的右边显示了早期和晚期 治疗两者的细胞计数的量化(全部为p《0.001)。
35.图3a-3d显示了局部他克莫司降低淋巴水肿中的纤维化。图3ai和3a
ii
显示了在i型胶原和淋巴管的免疫荧光局部化的情况下在手术 后6周从用对照或用他克莫司的早期治疗收获的尾部组织的代表性 40x图像。在右边显示了早期和晚期治疗两者中的胶原i染色区域的 量化(两者为p《0.001)。图3bi和3b
ii
显示了从对照和早期他克莫司治 疗动物收获的尾部组织的天狼猩红(picrosirius red)染色的代表性40x 图像(胶原i和胶原iii沉积)。右边显示了瘢痕指数(红色:绿色比)的量 化(p=0.036早期;p《0.001晚期)。图3c
i/ii
和3d
i/ii
显示了手术后6周 从用对照或用他克莫司的早期治疗来治疗的动物收获的尾部组织中 tgf-β1或psmad3与淋巴管的代表性40x免疫荧光共定位。在每个 图的右边显示了两者的阳性细胞数目/0.25mm2面积的量化。
36.图4a-4g显示了他克莫司改善手术淋巴损伤后的淋巴功能。图 4a显示了用或不用他克莫司的早期治疗后手术后6周小鼠尾部的代 表性icg图像。注意在他克莫司治疗动物中创伤间近端icg的流动。 插图显示了方向上相同的小鼠的照片。图4bi和4b
ii
显示了对照和早 期他克莫司(手术后2周开始)治疗动物中的浅表/深层淋巴系统的手 术缝合后6周通过骶淋巴结对
99m
tc的衰变调节的摄取(*p=0.005)。图 4b
ii
的上图中显示的小鼠尾部的大体照片用于取向,并且显示了
99m
tc 注射部位和骶淋巴结的位置;在下图中显示了代表性热图,白色箭头 指向骶淋巴结。图4c显示了在plnd后4周用或不用他克莫司治疗 的小鼠中的远端足注射后50分钟获得的后肢的代表性icg图像。白 色箭头显示了icg的皮肤淋巴管回流。插入照片显示了方向。图4di和4d
ii
是在plnd后4周用或不用他克莫司治疗的小鼠的后肢集合管 中的淋巴管脉动的图示。右边显示了脉动频率的量化(*p=0.001)。图4e显示了plnd后4周从用对照或他克莫司治疗的动物的远端后肢 收获的组织中炎性细胞(cd45
+
;上图)、inos
+
细胞(下图)和淋巴管 (lyve-1
+
)的代表性40x荧光共定位图像。注意cd45
+
和inos
+
细胞 的外淋巴积聚。图4f和4g显示了plnd后4周收获的对照或他克 莫司治疗动物的远端后肢组织中外淋巴cd45
+
细胞(图4f)和inos
+
细胞(图4g)的量化。
37.图5a-5d显示了局部他克莫司增加淋巴损伤后的侧淋巴管形成。 图5ai显示了桥接淋巴损伤后6周收获的对照和早期治疗他克莫司小 鼠的手术创建尾部创伤的lyve-1管的代表性纵向免疫荧光40x图 像;插图显示了获得纵向切片的区域。图5a
ii
显示了对照对早期或晚 期治疗他克莫司小鼠中尾部的创伤部分中的桥接淋巴管密度(lvd) 的量化(两者都为p《0.001)。图5a
iii
显示了从淋巴损伤后6周收获的 对照和早期治疗他克莫司小鼠尾部组织收获的rna的qpcr,证明 了vegf-c(p=0.264)、tgf-β1(p=0.006)和ifn-γ(p=0.014)的相对表 达。图5b是小鼠后肢的照片,显示了在plnd之前和之后引流到腹 股沟淋巴结的侧支管形成的部位。图5c显示了plnd后4周在对照 和他克莫司治疗动物中lyve-1
+
管的代表性icg(左图)和40x免疫荧 光图像(右图显示了框中的区域)。图5d显示了用对照或他克莫司治 疗的动物的前侧腿区中的侧支淋巴lvd的量化(p《0.001)。
38.图6a-6f显示了他克莫司增加炎性淋巴管生成。(a)在缝线放置 和用媒介物对照或全身他克莫司治疗后2周收获的对淋巴管 (lyve-1
+
/弱cd31
+
)和血管(cd31
+
/lyve-1-)染色的小鼠角膜的代表 性大体(左图)和整装5x图像(右图)。框表示整装图像中显示的区域。 图6b和6c显示了角膜淋巴管(lyve-1
+
)和血管(cd31
+
/lyve-1-)的 量化。图6d显示了产生创伤后4周收获的对照或局部他克莫司治疗 动物中耳创伤定位lyve-1
+
的代表性荧光整装5x图像。插入照片显 示了获得切片的区域。图6e显示了耳皮肤中的lyve-1
+
染色区域的 量化(在创伤的400μm内),证明了他克莫司治疗动物中的淋巴管生成 的增加(p《0.001)。图6f显示了用或不用他克莫司治疗的耳创伤中每 单位面积的淋巴管分支点的量化,证明了他克莫司治疗动物中增加的 分支(p《0.001)。
39.图7显示了局部他克莫司不降低循环cd4
+
t细胞。在用局部他 克莫司、全身性他克莫司或媒介物对照的2周治疗后显示了外周血 cd4
+
细胞的代表性流式图(上图)及cd4
+
t细胞的量化(下图)。
40.图8显示了局部他克莫司在手术后淋巴水肿中减少巨噬细胞浸 润。上图中显示了在f4/80
+
细胞的免疫荧光定位的情况下手术后6周 收获的对照和早期局部他克莫司治疗动物的尾部组织切片的代表性 40x图像。下面显示了早期和晚期治疗实验两者的量化。
41.图9a-9c显示了腘淋巴结清扫术模型。图9a显示了腘淋巴结, 用依文斯蓝造影剂填充,在腘脂肪垫中可见。图9b显示了腘淋巴结, 以及传入和传出集合器与其周围的脂肪垫一起分离。图9c显示在手 术切除后在手术部位中自由溢出的依文斯蓝造影剂。
42.图10a-10b显示了与假对照肢相比,plnd导致增加的ros和 damp。图10a显示了代表性小鼠图像(左图),显示了plnd后立即 (6小时)和1周后后肢中的发光(指示ros)。发光光子的量化(右图) 显示了在1周时plnd区域中,而非假对照中显著增加的ros水平。 图10b显示了对hsp-70(上图)和hmgb1(下图)染色的来自假手术和 plnd小鼠的后肢皮肤切片的代表性免疫荧光图像。
43.图11显示了局部他克莫司减少plnd后外淋巴cd4
+
细胞浸润。 上图显示了用对照或他克莫司治疗并且在plnd后4周收获的动物中 cd4
+
细胞和淋巴管(lyve-1
+
)的免疫荧光定位的代表性图像。下面显 示了量化。
44.图12a-12b显示了局部他克莫司在plnd后减少了外淋巴f4/80
+
细胞浸润。图12a显
示了对淋巴管(lyve-1)和巨噬细胞(f4/80)染色 的他克莫司和媒介物治疗的plnd后肢皮肤组织切片的代表性免疫 荧光图像。图12b显示了外淋巴f4/80+巨噬细胞的量化。
45.图13显示了局部他克莫司在缺乏淋巴损伤或炎症的情况下不改 变集合淋巴管脉动或淋巴管生成。上图是在用对照或局部他克莫司治 疗2周后在假手术小鼠(即麻醉而无切割或plnd)中后肢淋巴系统的 nir淋巴图像的代表性图像。下面显示了用他克莫司治疗3或14天 后集合淋巴管脉动频率的量化。
46.图14a-14b显示了局部他克莫司治疗在淋巴损伤后不改变血管 通透性。图14a显示了在尾静脉伊文斯蓝注射后他克莫司或媒介物 治疗plnd小鼠后肢的代表性大体图像以测量血管通透性。图14b 显示了来自他克莫司和媒介物治疗plnd后肢组织的甲酰胺提取的 伊文斯蓝的吸光度的量化。
47.图15a-15d显示了plnd后的局部他克莫司不改变后肢淋巴集 合器的α-sma覆盖或管腔直径。图15a显示了(从左到右)小鼠后肢 的侧面的亮视野图像,截面水平以黄色椭圆形显示;小鼠后肢的nir 图像,显示了后肢淋巴管的解剖学,在侧面上有两个大管径管;小鼠 后肢的5x if图像,黄色框指示前侧腿,其中定位两个占优势的集合 淋巴管;定位有占优势的集合管的区域的20x图像(用白色箭头指示)。 图15b显示了平足蛋白(podoplanin)和α-sma的双重免疫荧光染色后 集合淋巴管的截面的代表性100x图像。图15c显示了管腔区域的量 化。图15d显示了α-sma厚度的量化。
48.图16显示了局部他克莫司在缺乏损伤/炎症的情况下不增加淋巴 管生成。上图显示了应用局部他克莫司或媒介物对照4周后无创伤的 小鼠耳中淋巴管的免疫荧光染色的代表性5x图像。下面显示了 lyve-1
+
染色区域的量化。
49.图17a-17i显示了对tgf-β的抑制改善淋巴功能并且降低腘淋 巴结清扫术后的炎性细胞的外淋巴积聚。图17a显示了在plnd后4 周用同种型对照或tgf-β单克隆抗体(mab)治疗的小鼠的远端后肢的 近红外图像的代表性照片(上图)和集合淋巴系统中的泵送频率(下 图)。注意tgf-β mab治疗描述中的后肢集合器的增加的泵送频率。 还注意对照而非tgf-β mab治疗小鼠中的皮肤淋巴管回流(白色箭 头)。图17b显示了对照和tgf-β mab治疗小鼠中的集合淋巴泵送(脉 冲)频率的量化。图17c显示了对照和tgf-β mab治疗小鼠中的皮 肤淋巴管回流的量化。图17d显示了plnd后4周来自对照和tgf-β
ꢀꢀ
mab治疗小鼠的远端后肢组织的代表性流式细胞术图。注意tgf-β
ꢀꢀ
mab治疗小鼠中cd3+cd4+细胞的减少的百分比。图17e显示了对 照和tgf-β mab治疗小鼠中外淋巴(lyve-1+)炎性细胞(cd45+;顶 部)和inos+(底部)细胞的代表性低和高(插图)放大率显微照片。图 17f显示了对照和tgf-β mab治疗小鼠中后肢组织中cd4+细胞的流 式细胞术的量化。图17g显示了对照和tgf-β mab治疗小鼠中 lyve-1+管数目的量化。图17h显示了对照和tgf-β mab治疗小鼠 中外淋巴cd45+细胞数目的量化。图17i显示了对照和tgf-β mab 治疗小鼠中外淋巴inos+细胞数目的量化。
50.图18a-18g显示了全身性吡非尼酮在手术淋巴损伤后改善后肢 中的淋巴功能。图18a(上图)显示了在plnd后4周在用或不用吡非 尼酮治疗的小鼠中icg的远端足注射后50分钟获得的后肢的代表性 nir图像。白色箭头显示了icg的皮肤淋巴管回流。插图照片是用 于取向。下图显示了plnd后4周用或不用吡非尼酮治疗的小鼠的后 肢集合管中的淋巴管脉动的图示。图18b在右侧显示了脉动频率(脉 冲/分钟)的量化(n=6只动物/组;*p《0.05)。
图18c显示了对照和吡非 尼酮治疗小鼠中的皮肤淋巴管回流的量化。图18d显示了plnd后4 周收获的对照或吡非尼酮治疗动物的远端后肢组织中lyve-1
+
管 /0.25mm2面积的量化(n=6只动物/组;对于lyve-1为*p《0.001)。图 18e显示了plnd后4周从用或不用吡非尼酮治疗的动物的远端后肢 收获的组织中炎性细胞(cd45
+
;上图)、inos
+
细胞(下图)和淋巴管 (lyve-1
+
)的代表性低和高(插图)放大率荧光共定位图像,比例尺 =100μm。在每个图的右下角插图中显示了更高放大率(80x)图像,比 例尺=20μm。注意cd45
+
和inos
+
细胞的外淋巴积聚。图18f显示了 对照和吡非尼酮治疗小鼠中的外淋巴cd45
+
细胞的量化。图18g显 示了对照和吡非尼酮治疗小鼠中的外淋巴inos
+
细胞/hpf的量化。
51.图19a-19i显示了全身性和局部吡非尼酮减少小鼠尾部淋巴水 肿和炎症。图19a显示了用吡非尼酮或媒介物对照的全身性和局部 治疗后小鼠尾部的代表性照片。在尾部淋巴损伤后7周开始治疗。注 意吡非尼酮治疗小鼠中的明显改善。图19b显示了对照、局部吡非尼 酮和全身性吡非尼酮治疗小鼠中小鼠尾部体积的量化。注意吡非尼酮 治疗小鼠中的显著降低(箭头显示了在开始吡非尼酮治疗时)。图19c 显示了对照和吡非尼酮治疗小鼠中纤维脂肪组织沉积的量化。图19d 显示了对照和吡非尼酮治疗小鼠中i型胶原沉积的量化。图19e显示 了用对照或吡非尼酮(全身性或局部)治疗的小鼠尾部的代表性截面显 微照片。图19f显示了对i型胶原和淋巴管(lyve-1)染色的尾部截面 的代表性高放大率显微照片。注意吡非尼酮治疗小鼠中减少的i型胶 原沉积。图19g显示了硫胶体缀合的
99
tc的远端尾部注射后
99
tc的 峰结节摄取。注意吡非尼酮治疗小鼠中骶淋巴结的增加的摄取。图 19h显示了远端尾部注射后
99
tc的淋巴结摄取速率。注意吡非尼酮 治疗小鼠中较快速的摄取。图19i显示了对白细胞(cd45
+
)和淋巴管 (lyve-1)染色的尾部截面的代表性高放大率显微照片。注意吡非尼酮 治疗小鼠中减少的外淋巴cd45
+
细胞积聚。
52.图20a-20k显示了吡非尼酮减少外淋巴炎症和tgf-β表达。图 20a显示了后肢切片的代表性显微照片,证明了对照和吡非尼酮治疗 动物中cd4+细胞的外淋巴积聚(左图中显示了全身性治疗;右图中显 示了局部治疗)。插图中显示了高放大率图像。图20b显示了后肢切 片的代表性显微照片,证明了对照和吡非尼酮治疗动物中tgf-β1+ 细胞的外淋巴积聚(左图中显示了全身性治疗;右图中显示了局部治 疗)。图20c显示了后肢切片的代表性显微照片,证明了对照和吡非 尼酮治疗动物中smad3+细胞的外淋巴积聚(左图中显示了全身性治 疗;右图中显示了局部治疗)。图20d显示了对照和吡非尼酮治疗小 鼠中外淋巴cd4+细胞的量化。图20e显示了对照和吡非尼酮治疗小 鼠中外淋巴tgf-β1+细胞的量化。图20f显示了对照和吡非尼酮治疗 小鼠中外淋巴smad3+细胞的量化。图20g显示了对平足蛋白、 α-sma和i型胶原染色的来自对照和吡非尼酮治疗小鼠的后肢集合 管的高放大率的显微照片。注意对照小鼠中的增厚和α-sma+细胞的 增殖。图20h显示了对照和吡非尼酮治疗小鼠中的集合淋巴系统周 围的i型胶原沉积的量化。图20i显示了对照和全身性吡非尼酮治疗 小鼠中血清tgf-β1表达。图20j显示了对照和全身性吡非尼酮治疗 小鼠中血清ifn-γ表达。图20k显示了对照和全身性吡非尼酮治疗小 鼠中血清vegf-c表达。
53.图21a-21f显示了t细胞而非髓样细胞tgf-β表达的丧失防止 淋巴损伤后的淋巴水肿的发展。图21a显示了尾部淋巴损伤后6周 从对照、t细胞
cre
和髓样
cre
动物收获的尾部组织中tgf-β1mrna的 相对表达。图21b显示了对照、髓样tgf-β1
cre
和t细胞-tgf-β1
cre
小鼠的代表性显微照片。注意t细胞
cre
小鼠中缺乏肿胀。图21c显 示了各组中小鼠尾部体积的量
化。注意与野生型对照相比t细胞
cre
小鼠中降低的尾部体积。图21d显示了各组中对h&e(顶部)、i型胶 原/lyve-1(中间)染色的尾部截面的代表性显微照片和纤维脂肪组织 沉积和i型胶原表达的量化(下部)。注意t细胞
cre
小鼠中减少的纤维 脂肪组织沉积。图21e显示了远端尾部中注射的
99
tc的峰结节摄取。 注意t细胞
cre
小鼠中增加的摄取。图21f显示了各组中
99
tc的骶结 节摄取速率。注意t细胞
cre
小鼠中较快速的摄取。
54.图22a-22f显示了缺乏表达tgf-β1的t细胞的小鼠已经降低外 淋巴炎症和tgf-β1表达。图22a显示了对cd4+细胞(顶部)、il13+ 细胞(中间)、psmad3+细胞(底部)和淋巴管(lyve-1+)染色的来自各 组的小鼠后肢的代表性显微照片。注意t细胞
cre
小鼠中减少的cd4+ 细胞积聚、减少的il13+细胞数目和减少的psmad3+细胞数目。图 22b显示了各组中的动物的后肢组织中的cd4
+
细胞的量化。图22c 显示了各组中的动物的后肢组织中的th2细胞(cd4+/il13+)的量化。 图22c显示了各组中的动物的后肢组织中的psmad3
+
细胞的量化。 图22d-22f显示了来自对照、髓样
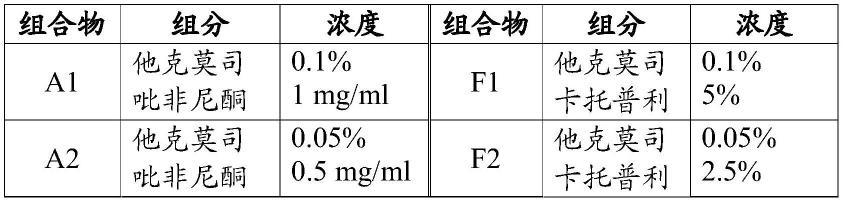
cre
和t细胞
cre
小鼠的ifn-γ(图 22d)、tgf-β1(图22e)和vegf-c(图22f)蛋白质浓度的血清水平。
55.图23a-23h显示了受损的lec tgf-β1响应性没有尾部淋巴水 肿、炎症或纤维化的变化,但是改善了淋巴管生成。图23a显示了 在psmad
+
和lyve-1的免疫荧光共定位的情况下从对照和flt4
cre
小鼠收获的淋巴结切片的代表性高放大率(80x)图像,比例尺=10μm。 箭头指示lyve-1
+
管中psmad3的共定位。图23b显示了手术后6 周对照和flt4
cre
小鼠中尾部tgf-β1蛋白浓度的量化(n=5只动物/组; 两组都为p=ns)。图23c显示了手术后6周手术切除浅表/深层集合 淋巴系统后对照和flt4
cre
小鼠尾部的代表性照片。图23d显示了与 对照相比flt4
cre
小鼠尾部的尾部体积变化的图示(n=5只动物/组; p=ns)。图23e显示了对照和flt4
cre
小鼠的软组织变化的量化(n=5 只动物/组;p=ns)。图23f显示了胶原i染色区的量化(n=5只动物/ 组;p=ns)。图23g(上图)显示了淋巴消融后6周收获的对照和flt4
cre
小鼠尾部的代表性截面组织学图像。括号指示软组织厚度。比例尺 =500μm。图23g(中间图)显示了在i型胶原和淋巴管的免疫荧光共定 位的情况下在手术后6周从对照和flt4
cre
动物收获的尾部组织的代 表性40x图像。图23g(下图)显示了psmad3和淋巴管的定位。比例 尺=100μm。图23h显示了在lyve-1的免疫荧光定位的情况下在手 术后6周从对照和flt4
cre
小鼠的尾部创伤收获的纵向尾部组织切片 的代表性较高放大率(60x)图像,比例尺=50μm。对照和flt4
cre
小鼠 的桥接lyve-1
+
管密度(lvd)(n/0.25mm2面积)的量化(n=5只动物/ 组;*p《0.01)。
56.图24a-24d显示了特立氟胺减少淋巴水肿。图24a显示了淋巴 消融后6周用媒介物(对照)或局部特立氟胺治疗的小鼠尾部的大体显 微照片。图24b显示了用媒介物或局部特立氟胺治疗的动物中淋巴消 融后6周的尾部体积变化((*p《0.0002)。图24c显示了在对照和特立 氟胺治疗小鼠中淋巴损伤区域远端1cm收获的小鼠尾部的组织学截 面。括号显示了纤维脂肪组织沉积的区域。图24d显示了用媒介物 对照或局部特立氟胺治疗的小鼠的尾部截面中的纤维脂肪组织沉积 的量化(*p《0.0001)。
57.图25a-25d显示了特立氟胺减少纤维化。图25a显示了来自对 照和特立氟胺治疗小鼠的小鼠尾部截面的代表性显微照片,定位i型 胶原纤维和皮肤淋巴系统。注意特立氟胺治疗小鼠中明显降低纤维 化。图25b显示了用媒介物对照或局部特立氟胺治疗的小鼠尾部中的 i型胶原沉积的量化(*p《0.001)。图25c显示了用对照或特立氟胺治 疗的动物中主
要后肢集合管的代表性显微照片,定位α-sma和平足 蛋白。注意特立氟胺治疗小鼠中α-sma阳性细胞的减少的增殖和集 合淋巴系统的较宽的腔。图25d显示了plnd后在对照和特立氟胺 治疗小鼠中外淋巴平滑肌厚度的量化(*p《0.05)。
58.图26a-26b显示了特立氟胺减少炎症。图26a显示了来自对照 和特立氟胺治疗小鼠的小鼠尾部截面的代表性显微照片,定位cd4+ 细胞和皮肤淋巴系统。特立氟胺治疗动物中存在有cd4+细胞浸润的 明显减少。框插入显示了高放大率视图(80x)。图26b显示了用媒介 物对照或局部特立氟胺治疗的小鼠尾部中cd4+细胞的量化 (*p《0.0001)。
59.图27a-27d显示了特立氟胺增加淋巴管生成。图27a显示了用 媒介物对照或特立氟胺治疗的动物中小鼠后肢淋巴系统和侧支管形 成(白色圆圈)的近红外成像的代表性显微照片。新形成的侧支淋巴系 统在特立氟胺治疗小鼠中绕过腘淋巴结。图27b显示了在plnd后 并且用媒介物对照或特立氟胺治疗的动物中的侧支淋巴形成的量化 (*p《0.001)。图27c显示了用媒介物对照或局部特立氟胺治疗的小鼠 中的尾部创伤的代表性显微照片,定位新形成的横断淋巴管。特立氟 胺治疗小鼠中有明显的淋巴管生成增加。图27d显示了淋巴消融后6 周的对照和特立氟胺治疗动物的小鼠尾部创伤中的侧支淋巴系统的 量化(*p《0.001)。
60.图28显示了局部特立氟胺减少淋巴泄漏。plnd后用媒介物对 照或特立氟胺治疗的小鼠的后肢中淋巴管的代表性近红外图像。注意 特立氟胺治疗小鼠中淋巴管(箭头)的减少的泄漏。
61.图29a-29b显示了局部特立氟胺增加淋巴功能。图29a显示了 plnd后用媒介物对照或特立氟胺治疗的小鼠的腹股沟淋巴结中运 输的树突细胞(dc)的代表性流式细胞术图。在远端后肢中用fitc的 局部制剂治疗小鼠以标记组织驻留dc,并且在24小时后,收获腹股 沟淋巴结,并且使用流式细胞术分析以量化已经从外周转运的dc的 数目。dc运输中的明显增加指示特立氟胺治疗动物中改善的淋巴功 能。图29b显示了对照和特立氟胺治疗动物中dc运输的量化(n=6; *p《0.0001)。
62.图30a-30b显示了局部特立氟胺增加淋巴泵送。图30a显示了 plnd后对照和特立氟胺治疗小鼠中后肢集合淋巴泵送的图。图30b 显示了plnd后对照和特立氟胺治疗小鼠中后肢集合淋巴泵送频率 的量化。注意特立氟胺治疗动物中泵送的显著增加(*p《0.002)。
63.图31a-31b显示了卡托普利治疗增加淋巴损伤后树突细胞的运 输。图31a显示了来自腹股沟淋巴结的代表性流式细胞术,证明了 plnd后对照和卡托普利治疗小鼠中的fitc+cd11c细胞。图31b 显示了plnd后对照和卡托普利治疗小鼠的腹股沟淋巴结中fitc+ cd11c细胞的百分比(左边)和绝对数目(右边)。
64.图32a-32b显示了卡托普利治疗增加后肢集合淋巴泵送。图32a 显示了集合淋巴泵送的代表性图,如通过plnd后对照和卡托普利治 疗小鼠中的icg淋巴管造影术评估。图32b显示了后肢集合淋巴系 统的包频率(泵送)的量化。
65.图33a-33c显示了卡托普利治疗减少plnd后的t细胞浸润。 显示了对cd3+(t细胞标志物)和lyve-1(淋巴标志物)染色的对照(图 33a)和卡托普利治疗(图33b)小鼠后肢切片的代表性高放大率显微照 片。用dapi显示核复染色。图33c显示了对照和卡托普利治疗小鼠 的后肢组织中的cd3+细胞的量化。
66.图34a-34c显示了卡托普利治疗减少plnd后的巨噬细胞浸润。 显示了对f4/80+
(巨噬细胞标志物)和lyve-1(淋巴标志物)染色的对 照(图34a)和卡托普利治疗(图34b)小鼠后肢切片的代表性高放大率 显微照片。用dapi显示核复染色。图34c显示了对照和卡托普利治 疗小鼠的后肢组织中的f4/80+细胞的量化。
67.图35a-35c显示了卡托普利治疗增加plnd后的淋巴管生成。 显示了对lyve-1(淋巴标志物)染色的对照(图35a)和卡托普利治疗 (图35b)小鼠后肢切片的代表性高放大率显微照片。用dapi显示核 复染色。图35c显示了对照和卡托普利治疗小鼠中lyve-1+管的量 化(*p《0.05)。
68.图36显示了卡托普利治疗减少用dt的后肢淋巴消减后的足肿 胀。在dt淋巴消减后各个时间时对照(顶部)和卡托普利治疗(底部) 组中小鼠足的代表性照片。注意卡托普利治疗小鼠中足肿胀的明显降 低。
69.图37a-37c显示了卡托普利治疗在用dt的后肢淋巴消减后减少 t细胞浸润。对cd3+(t细胞标志物)和lyve-1(淋巴标志物)染色的 对照(图37a)和卡托普利治疗(图37b)小鼠后肢切片的代表性高放大 率显微照片。从用dt治疗的肢收获同侧组织,而对侧组织来自相反 的未治疗肢。用dapi显示核复染色。图37c显示了对照和卡托普利 治疗小鼠的后肢组织中cd3+细胞的量化。注意同侧对照和同侧卡托 普利肢之间的显著差异(*p《0.05)。
70.图38a-38c显示了卡托普利治疗减少用dt的淋巴消融后的后肢 巨噬细胞浸润。显示了对f4/80(巨噬细胞标志物)和lyve-1(淋巴标 志物)染色的对照(图38a)和卡托普利治疗(图38b)小鼠后肢切片的代 表性高放大率显微照片。用dapi显示核复染色。图38c显示了对照 和卡托普利治疗小鼠的后肢组织中f4/80+细胞的量化。注意同侧对照 和同侧卡托普利肢之间的显著差异(*p《0.005)。
71.图39a-39c显示了卡托普利治疗减少dt的淋巴消融后后肢集合 管平滑肌沉积。对α平滑肌肌动蛋白(α-sma)(平滑肌标志物)和平足 蛋白(淋巴标志物)染色的对照(图39a)和卡托普利治疗(图39b)小鼠后 肢切片的代表性高放大率显微照片。用dapi显示核复染色。图39c 显示了对照和卡托普利治疗小鼠的后肢组织中α-sma+细胞的量化。 注意同侧对照和同侧卡托普利肢之间的显著差异(*p《0.005)。
72.图40a-40c显示了卡托普利治疗减少用dt的淋巴消减后后肢i 型胶原沉积。显示了对i型胶原(纤维化标志物)和lyve-1(淋巴标志 物)染色的对照(图40a)和卡托普利治疗(图40b)小鼠后肢切片的代表 性高放大率显微照片。用dapi显示核复染色。图40c显示了对照和 卡托普利治疗小鼠的后肢组织中的i型胶原的量化。注意同侧对照和 同侧卡托普利肢之间的显著差异(*p《0.0001)。
73.图41a-41c显示了卡托普利治疗减少用dt的淋巴消融后后肢血 管紧张肽转化酶(ace)表达。对ace和lyve-1(淋巴标志物)染色的 对照(图41a)和卡托普利治疗(图41b)小鼠后肢切片的代表性高放大 率显微照片。用dapi显示核复染色。图41c显示了对照和卡托普利 治疗小鼠的后肢组织中ace的量化。注意同侧对照和同侧卡托普利 肢之间的显著差异(*p《0.0001)。
74.图42显示了卡托普利治疗增加用dt的后肢淋巴消融后侧支淋 巴系统的形成。显示了对照(左图)、卡托普利(中间)和正常淋巴构造(即 无dt治疗)后肢的代表性icg照片。点圆圈代表形成侧支淋巴系统 以引流到腹股沟淋巴结中的区域。
75.图43a-43d显示了卡托普利治疗减少用dt的淋巴消融后后肢淋 巴管生成。对
ace表达。图51c显示了对照和卡托普利治疗小鼠中小鼠尾部ace 染色面积的量化。注意卡托普利治疗动物中的显著减少(*p《0.0001)。
84.图52a-52c显示了卡托普利治疗减少淋巴消融后6周的淋巴水 肿的小鼠尾部模型中的t细胞(cd3+)的外淋巴积聚。显示了对cd3、 lyve-1和dapi染色的对照(图52a)和卡托普利(图52b)治疗动物的 小鼠尾部的代表性截面。注意卡托普利治疗动物中的减少的ace表 达。图52c显示了对照和卡托普利治疗小鼠中小鼠尾部外淋巴cd3+ 细胞/管的量化。注意卡托普利治疗动物中的显著减少(*p《0.0001)。
85.图53a-53c显示了卡托普利治疗减少淋巴消融后6周的淋巴水 肿的小鼠尾部模型中的巨噬细胞(f4/80+细胞)的外淋巴积聚。显示了 对f4/80、lyve-1和dapi染色的对照(图53a)和卡托普利(图53b) 治疗动物的小鼠尾部的代表性截面。注意卡托普利治疗动物中的减少 的ace表达。图53c显示了对照和卡托普利治疗小鼠中小鼠尾部外 淋巴f4/80细胞/管的量化。注意卡托普利治疗动物中的显著减少 (*p《0.0001)。
具体实施方式
86.本发明部分涉及抗-t细胞剂和/或抗tgf-β1剂和/或抗血管紧张 肽剂作为用于水肿,特别是淋巴水肿的新颖、安全和有效的治疗的用 途。本发明部分地基于惊人的发现,即全身或局部施用抗t细胞、抗 tgf-β1和/或抗血管紧张肽剂,例如他克莫司、吡非尼酮、特立氟胺、 来氟米特和/或卡托普利,显著改善了淋巴水肿和淋巴功能,并且当 对哺乳动物受试者施用时,具有各种其它有益的生物学效应,包括刺 激淋巴管生成。此外,由于这些试剂在纤维化途径的不同步骤中起作 用,抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的组合可以比施用单 一试剂更有效,潜在地表现出协同效应。
87.因此,本发明提供用于治疗或预防水肿,例如淋巴水肿,和/或 用于产生各种其它有益的生物学效应的组合物和方法,所述生物学效 应包括但不限于:减少组织肿胀、减少淋巴液淤滞或“汇集”、减少组 织纤维化、减少组织炎症、减少白细胞浸润、减少巨噬细胞浸润、减 少初始和分化的t细胞的浸润、减少tgf-β1表达和降低下游介质(例 如psmad3)的表达和/或活化、降低的血管紧张肽和/或ace水平、减 少胶原沉积和/或瘢痕形成、改善或增加淋巴功能、改善或增加淋巴 液转运、改善或增加淋巴管生成和/或改善或增加淋巴脉动频率。
88.除非另有定义,本文使用的所有技术和科学术语具有与本发明相 关的本领域普通技术人员通常理解的相同的含义。例如,thedictionary of cell and molecular biology(第5版j.m.lackie编,2013), oxford dictionary of biochemistry and molecular biology(第2版r. cammack等人编,2008),和the concise dictionary of biomedicine andmolecular biology(第2版p-s.juo,2002)可以为技术人员提供本文使 用的一些术语的一般定义。
89.如本说明书和所附权利要求术中所使用,单数形式“一个”、“一 种”和“所述”包括复数指示物,除非上下文另有明确规定。术语“一 个”(或“一种”)以及术语“一个或多个”和“至少一个”可以互换使用。
90.此外,“和/或”将被视为明确公开两个规定特征或组分中每个,与 或不与另一个一起。因此,在诸如“a和/或b”短语中使用的术语“和/ 或”旨在包括a和b、a或b、a(单独)和b
(单独)。同样,如短语如“a、 b和/或c”中使用的术语“和/或”旨在包括a、b和c;a、b或c;a 或b;a或c;b或c;a和b;a和c;b和c;a(单独);b(单独); 和c(单独)。
91.单位、前缀和符号以其系统国际单位制(si)接受形式表示。数字 范围包括定义范围的数字。在数字术语前面有“约”的情况下,该术语 包括所述数字和所述数字的值
±
10%。本文提供的标题不是本发明的 各个方面或实施方案的限制,其可以通过参考整个说明书进行描述。 因此,下文中定义的术语通过参考整个说明书来更全面地定义。
92.无论何处使用“包括”语言描述实施方案,包括按照“由
…
组成”和 /或“基本上由...组成”所描述的其它方面类似的实施方案。
93.如本文中所用,术语“水肿”包括淋巴水肿、淋巴功能障碍、淋巴 组织纤维化、特发性水肿、外周水肿和眼水肿。如本文中所用,“水 肿”不包括肺水肿或脑水肿。水肿可包括急性水肿、慢性水肿、手术 后水肿和逐渐发作性水肿。水肿症状可以包括肿胀、饱胀或组织浮肿、 炎症、纤维化、沉重、疼痛、运动范围减少、酸痛、复发性感染、皮 肤增厚或不适。
[0094]“活性剂”是其本身具有生物活性或作为体内转化成具有生物活 性的药剂的前体或前药的药剂。用于治疗或预防水肿的活性剂可包括 免疫抑制剂、抗纤维化剂、抗t细胞剂、抗tgf-β1剂和抗血管紧张 肽剂。在一些实施方案中,药剂是小分子化合物。在其它实施方案中, 药剂是大分子,如多核苷酸(例如抑制性rna)或多肽(例如抗体)。
[0095]“抗t细胞剂”是减少t细胞介导的炎症、t细胞活化、t细胞分 化和/或t细胞增殖的分子。抗t细胞剂的类别包括钙调神经磷酸酶 抑制剂和il-2抑制剂。小分子抗t细胞剂的实例包括他克莫司、特 立氟胺、来氟米特、环孢霉素和吡美莫司。大分子抗t细胞剂的实例 包括地尼白介素2(denileukin diftitox)和巴利昔单抗(basiliximab)。
[0096]“抗tgf-β1剂”是抑制转化生长因子β1的表达、分泌、激活、信 号传导或活性的分子。吡非尼酮是小分子抗tgf-β1剂的实例。
[0097]“抗血管紧张肽剂”是抑制angi或angii的活性的分子,或抑制 angi至angii转化的分子(例如ace抑制剂或ace激动剂)。抗血管 紧张肽剂的实例包括卡托普利、佐芬普利、依那普利、赖诺普利、雷 米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、西 拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替米 沙坦、缬沙坦、非马沙坦、乙酰甘氨酸重氮氨苯脒(diminazeneaceturate)、呫吨酮和ave 099。
[0098]
术语“抑制”、“阻断”和“抑制”可互换使用,并且指生物活性的任 何统计学显著降低,包括完全阻断活性。
[0099]
一方面,本发明的方法可以包括施用抗t细胞、抗tgf-β1和/ 或抗血管紧张肽剂的组合。在一个具体实施方案中,所述方法包括施 用本发明的药物组合物,其包含:(i)有效量的一种或多种抗t细胞剂, 其选自由以下组成的组:他克莫司、特立氟胺、来氟米特、环孢霉素、 吡美莫司、地尼白介素2和巴利昔单抗;和(ii)有效量的一种或多种 抗tgf-β1剂和/或一种或多种抗血管紧张肽剂,其选自由以下组成的 组:吡非尼酮、卡托普利、佐芬普利、依那普利、赖诺普利、雷米普 利、喹那普利、培哚普利、贝那普利、咪达普利、群多普利、西拉普 利和福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙坦、替米沙坦、 缬沙坦和非马沙坦。本发明的方法可以包括施用本发明的药用化合 物,其包含抗t细胞、抗tgf-β1和/或抗血管紧张肽剂的任何组合。 例如,在一个实施方案中,方法包括施用药物组合物,其包含他克莫 司和吡非尼酮。在另一个实施方案中,方法包括施用药物组合物,其 包含他克莫司、吡非尼
3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/kg的日剂量对受试者施用 来氟米特或其类似物、变体或衍生物。
[0113]
在一些实施方案中,以约50mg/kg至约2500mg/kg的日剂量对 受试者全身性施用吡非尼酮或其类似物、变体或衍生物。更具体地, 可以以约50、55、60、65、70、75、80、85、90、95、100、110、 120、130、140、150、160、170、180、190、200、220、240、260、 280、300、325、350、375、400、450、500、550、600、650、700、 750、800、850、900、950、1000、1100、1200、1300、1400、1500、 1600、1700、1800、1900、2000、2100、2200、2300、2400或2500mg/kg 的日剂量对受试者施用吡非尼酮或其类似物、变体或衍生物。
[0114]
在一些实施方案中,以约0.1mg/kg至约10mg/kg的日剂量对受 试者全身性施用卡托普利或其类似物、变体或衍生物。更具体地,可 以以约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、 1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、 3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、 8.5、9.0、9.5或10mg/kg的日剂量对受试者施用卡托普利或其类似 物、变体或衍生物。
[0115]
在一些实施方案中,抗t细胞剂和/或抗tgf-β1剂和/或抗血管 紧张肽剂的施用可以包括以任何合适的剂量和/或根据任何合适的给 药方案的局部施用,如由本领域技术人员确定。例如,在一些实施方 案中,以包含约0.01mg/ml至约5mg/ml、或约0.1mg/ml至2mg/ml、 或约0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.045、0.05、0.055、 0.06、0.065、0.07、0.075、0.08、0.085、0.09、0.095、0.1、0.2、0.3、 0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、 1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、 4.5、4.75或5.0mg/ml他克莫司或其类似物、变体或衍生物的局部组 合物形式对受试者施用他克莫司或其类似物、变体或衍生物。在一些 实施方案中,以包含约0.01%至约1%、或约0.03%至约0.5%、或约 0.05至约0.2%或约0.01、0.015、0.02、0.025、0.03、0.035、0.04、 0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、0.09、 0.095、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95或1.0%他克莫司或其类似物、 变体或衍生物的局部组合物形式对受试者施用他克莫司或其类似物、 变体或衍生物。
[0116]
在一些实施方案中,以包含约10mg/ml至约50mg/ml、或约20 mg/ml至约30mg/ml、或约10、11、12、13、14、15、16、17、18、 19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、 34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、 49、50mg/ml特立氟胺或其类似物、变体或衍生物的局部组合物形式 对受试者施用特立氟胺或其类似物、变体或衍生物。在一些实施方案 中,以包含约1%至约20%、或约5%至约15%、或约1.0、1.1、1.2、 1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、 3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、 8.5、9.0、9.5、10、10.5、11、11.5、12、12.5、13、15、14、14.5、 15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20%特立氟胺 或其类似物、变体或衍生物的局部组合物形式对受试者施用特立氟胺 或其类似物、变体或衍生物。
[0117]
在一些实施方案中,以包含约10mg/ml至约50mg/ml、或约20 mg/ml至约30mg/ml、或约10、11、12、13、14、15、16、17、18、 19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、 34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、 49、50mg/ml来氟米特或其类似物、变体或衍生物的局部组合物形式 对受试者施用来氟米特或其类似物、变体或衍生物。在一些
实施方案 中,以包含约1%至约20%、或约5%至约15%、或约1.0、1.1、1.2、 1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、 3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、 8.5、9.0、9.5、10、10.5、11、11.5、12、12.5、13、15、14、14.5、 15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20%来氟米特 或其类似物、变体或衍生物的局部组合物形式对受试者施用来氟米特 或其类似物、变体或衍生物。
[0118]
在一些实施方案中,以包含约0.1mg/ml至约5mg/ml、或约0.5 mg/ml至2mg/ml、或约0.01、0.015、0.02、0.025、0.03、0.035、0.04、 0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、0.09、 0.095、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、 1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、 3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/ml吡非尼酮或其类似物、 变体或衍生物的局部组合物形式对受试者施用吡非尼酮或其类似物、 变体或衍生物。在一些实施方案中,以包含约0.1%至约20%、或约 1%至约10%、或约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、 1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、 3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0、5.5、6.0、6.5、7.0、 7.5、8.0、8.5、9.0、9.5、10、10.5、11、11.5、12、12.5、13、15、 14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20% 吡非尼酮或其类似物、变体或衍生物的局部组合物形式对受试者施用 吡非尼酮或其类似物、变体或衍生物。
[0119]
在一些实施方案中,以包含约0.1mg/ml至约5mg/ml、或约0.5 mg/ml至约2mg/ml、或约0.01、0.015、0.02、0.025、0.03、0.035、 0.04、0.045、0.05、0.055、0.06、0.065、0.07、0.075、0.08、0.085、 0.09、0.095、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、 1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、 3.25、3.5、3.75、4.0、4.25、4.5、4.75或5.0mg/ml卡托普利或其类 似物、变体或衍生物的局部组合物形式对受试者施用卡托普利或其类 似物、变体或衍生物。在一些实施方案中,以包含约1%至约20%、 或约5%至约15%、或约1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、 1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、 4.75、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10、10.5、 11、11.5、12、12.5、13、15、14、14.5、15、15.5、16、16.5、17、 17.5、18、18.5、19、19.5或20%卡托普利或其类似物、变体或衍生 物的局部组合物形式对受试者施用卡托普利或其类似物、变体或衍生 物。
[0120]
抗t细胞剂和/或抗tgf-β1和/或抗血管紧张肽剂可以根据任何 合适的给药方案施用,例如其中日剂量分为两个或多个单独剂量。确 定全身或局部施用的给药日程表和持续时间在普通技术人员的技能 范围内。在一些实施方案中,一天至少一次或一天至少两次口服施用 药物组合物。在一些实施方案中,一天至少一次或一天至少两次静脉 内施用药物组合物。在一些实施方案中,一天至少一次或一天至少两 次局部施用药物组合物。在一些实施方案中,一天至少一次或一天至 少两次皮下施用药物组合物。
[0121]
在其中施用多于一种活性剂的实施方案中,所述药剂可一起施用 (例如,在相同的制剂中和/或同时)或分别施用(例如,在不同制剂和/ 或不同时间)。在一些此类实施方案中,全身施用药剂。在一些此类 实施方案中,局部施用药剂。在一些此类实施方案中,全身施用一种 (或多种)药剂,并且局部(例如局部)施用一种(或多种)药剂。当使用两 种此类试剂时,与单独使用每种试剂时必需的剂量相比,可以使用更 低剂量或量的每种试剂。
[0122]
可以通过参考以下非限制性实施例进一步限定本公开的实施方 案。对于本领域
技术人员显而易见的是,在不脱离本公开的范围的情 况下,可以实施对材料和方法的许多修改。
[0123]
实施例
[0124]
实施例1:使用他克莫司治疗和预防淋巴水肿
[0125]
他克莫司在没有全身性免疫抑制的情况下降低尾部淋巴水肿
[0126]
为了研究局部他克莫司对淋巴水肿的作用,我们使用了以前描述 的淋巴水肿的小鼠尾部模型。goldman等人,circ.res.96:1193-1199 (2005);shimizu等人,j.am.heart assoc.2:e000438(2013);choi等 人,circulation 125:872-882(2012);tabibiazar等人,plos med.3:e254 (2006);yoon等人,j.clin.invest.111:717-725(2003)。小鼠尾部的浅表 和深层淋巴系统的破坏导致手术后2周尾部体积增加大于100%(图 1a,1b)。我们以前已经显示了,在这个时间点的肿胀主要是由于间 质液的积聚。avraham等人,faseb j.27:1114-1126(2013)。尾部慢性 淋巴阻塞导致纤维脂肪组织逐渐替代间质液,并在随后的4周内发生 炎性细胞的积聚。avraham等人,faseb j.27:1114-1126(2013)。这些 病理变化紧密反映了临床淋巴水肿,并且一旦建立淋巴水肿,再持续 至少6-9周。goldman等人,circ.res.96:1193-1199(2005);shimizu 等人,j.am.heart assoc.2:e000438(2013);choi等人,circulation125:872-882(2012);tabibiazar等人,plos med.3:e254(2006);yoon等 人,j.clin.invest.111:717-725(2003)。
[0127]
基于此知识,我们使用了两种不同的他莫司治疗方法。一组动物 在手术后2周开始用他克莫司治疗4周(尾部手术后总共6周),以阻 止淋巴水肿的发展(即早期治疗)。在另一组中,我们在淋巴消融后等 待6周以建立淋巴水肿,然后用他克莫司治疗直至9周,意图治疗建 立的软组织变化(即晚期治疗)。在所有研究中,我们用0.1%他克莫司 (0.05g/应用)或媒介物对照(凡士林)每天治疗动物两次。他克莫司或媒 介物对照作为薄层施加到手术部位远端(即不包括手术部位)的整个尾 部。
[0128]
用局部他克莫司的早期治疗明显减少尾部肿胀,并且阻止永久性 肿胀的发展(图1a,1b)。从实验动物的尾部的大体检查证明了淋巴 水肿的接近完全的消退,并且这种变化对应于尾部体积减少95%和软 组织厚度减少几乎50%(图1b,1c)。尽管在这些动物中尾部体积没 有恢复到术前水平,但晚期治疗在减少大体尾部肿胀、尾部体积和软 组织厚度方面也是非常有效的(图1b,1c)。
[0129]
我们还分析了他克莫司和外周t细胞计数的全身水平,以确定是 否局部应用的他克莫司以可察觉的方式被吸收。该分析证明了,局部 他克莫司(平均值为1.06ng ml-1
)的全身性吸收仍然显著低于用全身 施用(5-15ng ml-1
;图1d)达到的已知治疗免疫抑制水平。此外,与媒 介物治疗的对照相比,用局部他克莫司治疗的动物显示循环血液t细 胞或cd4
+
细胞的没有变化(图1e,图7)。
[0130]
他克莫司在淋巴损伤后减少炎症和纤维化
[0131]
慢性炎症是临床淋巴水肿的组织学特征,并且特征在于t辅助细 胞、t调节细胞和巨噬细胞的积聚增加。avraham等人,faseb j. 27:1114-1126(2013);zampell等人,plos one 7:e49940(2012);ghanta 等人,am.j.physiol.heart circ.physiol.308:h1065-1077(2015); olszewski等人,lymphology 23:23-33(1990)。与此一致,我们发现了 与对照相比,他克莫司治疗的动物具有显著降低数目的浸润真皮和皮 下脂肪的白细胞(cd45
+
细胞;
56%减少-早期治疗;49%晚期治疗;图 2a)。从对照动物收获的淋巴水肿组织中的炎性细胞位于紧邻毛细血 管和集合淋巴系统,但在他克莫司治疗的小鼠中几乎不存在。类似地, 我们注意到浸润性cd3
+
细胞(53%减少-早期;49%-晚期治疗;图2b)、 cd4
+
细胞(78%减少-早期治疗,71%晚期治疗;图2c)和产生ifn-γ 的细胞(54%减少-早期治疗,57%晚期治疗;图2d)的数目的明显减少。 此外,我们注意到巨噬细胞的软组织浸润的减少(f4/80
+
细胞;86%减 少-早期治疗;73%晚期治疗;图8)。总之,这些发现显示了在淋巴 损伤后,炎性细胞大量积聚在皮肤/皮下淋巴管附近,并且通过局部 应用他克莫司来缓解此应答。
[0132]
淋巴水肿患者具有进行性软组织纤维化,并且纤维化程度与疾病 的严重程度相关。tassenoy等人,lymphat.res.biol.7:145-151(2009)。 因此,我们分析了尾部组织中的几种纤维化标志物,以了解他克莫司 治疗对疾病的此方面的作用。我们发现与对照小鼠相比,用他克莫司 的局部治疗显著降低了皮肤和皮下i型胶原沉积和瘢痕指数(天狼猩 红双折射测量胶原i/iii的比率)(图3a,3b)。对照小鼠的淋巴管被厚 i型胶原层包围;相比之下,他克莫司治疗的动物具有基本正常的淋 巴管。与此观察结果和我们以前的报道(clavin等人,am.j.physiol. heart circ.physiol.295:h2113-2127(2008))一致,我们还发现他克莫 司治疗显著降低了促纤维化生长因子tgf-β1和其激活的下游信号传 导分子、磷酸化smad3(psmad-3;图3c,3d)的细胞表达。对于 早期和晚期他克莫司治疗,此应答的程度是相似的。
[0133]
他克莫司提高淋巴功能
[0134]
为了评估淋巴功能,我们用吲哚菁绿(icg)进行了近红外(nir)淋 巴管造影术,其已经被描述为通过实现淋巴管的实时成像、计算包频 率(或淋巴液的脉动流)、以及皮肤淋巴管回流和染色清除的分析来定 量人、猪和小鼠的淋巴功能的有效手段。kwon等人,lymphat.res.biol. 5:219-231(2007);sharma等人,am.j.physiol.heart circ.physiol. 292:h3109-3118(2007);unno等人,j.vasc.surg.52:946-952(2010)。 在淋巴结扎后6周,使用nir成像,我们注意到在淋巴损伤后2周 开始治疗的动物中的尾部创伤间在近端快速转运间质液(早期治疗; 图4a)。相比之下,对照动物表明淋巴切除部位远端的icg的合并, 未在损伤区间转运。使用锝-99m(
99m
tc)淋巴系闪烁造影术(一种将放 射性示踪剂注射在远端尾部并且随着时间测量骶淋巴结的摄取的技 术)证实了这一发现。与对照相比,早期治疗动物中骶淋巴结的衰减 调整摄取表明他克莫司治疗动物中
99m
tc摄取量增加了多于6倍(图 4b)。用他克莫司的晚期治疗类似地增加结节摄取(2倍);然而,这种 差异没有达到统计学显著性。
[0135]
鉴于他克莫司在尾部模型中预防和治疗淋巴水肿的功效,我们接 下来试图使用前述的腘淋巴结剥离模型(plnd)研究他克莫司如何在 淋巴损伤后调节淋巴功能(图9)。blum等人,breast cancer res.treat. 139:81-86(2013)。这种模式在临床上是相关的,因为癌症治疗过程中 的淋巴结剥离是发达国家中淋巴水肿的最常见原因。我们首先利用 plnd小鼠模型来更好地了解淋巴损伤后慢性炎性反应被激活的机 制。
[0136]
以前的研究已经证明,淋巴内皮细胞(lec)对活性氧物质(ros) 高度敏感(kasuya等人,sci.rep.4:4173(2014)),并且ros可以激活 慢性炎症。gorlach等人,redox biol.6:372-385(2015)。为了确定在 plnd后是否存在ros,我们根据淋巴管在去除细胞代谢产物中的已 知作用,分析损伤后1周损伤区域远端的组织中的ros积聚。实际 上,此分析证明了在
用plnd治疗的动物中,腘区域立即远端的后肢 组织中ros显著积聚(图10)。相比之下,在无淋巴结切除术的情况 下用皮肤切除治疗的对照动物几乎没有ros的积聚。ros可以激活 先天性免疫应答,包括与危险相关的分子模式分子(damp)。yin等 人,j.immunol.194:429-437(2015)。与这些研究和我们发现plnd后 增加的ros,以及与我们以前使用淋巴水肿的尾部模型的研究(其中 我们证实了淋巴组织中各种细胞类型中hmgb1的表达增 加)(zampell等人,am.j.physiol.cell physiol.300:c1107-1121(2011)) 一致,我们注意到damp,如热休克蛋白70(hsp70)和高迁移率组盒 1(hmgb-1)的表达显著增加(图10)。这些发现指示了,淋巴损伤导致 ros的产生,这又导致细胞损伤、damp的表达和炎性应答的启动。
[0137]
以前的临床和实验室研究已经将皮肤淋巴管回流描述为将icg 合并到由渗漏性功能障碍性淋巴系统引起的间质空间中。blum等人, breast cancer res.treat.139:81-86(2013);tashiro等人,ann.plast. surg.doi:10.1097/sap.599(2015);yamamoto等人,plast.reconstr. surg.128:314e-321e(2011)。与这些报道一致,我们发现单独用凡士 林局部治疗4周的对照动物显示了足垫的初始淋巴系统的明显渗漏 (白色箭头所示的明亮icg积聚的点状区域;图4c)和皮肤淋巴管回 流(icg在真皮中的全身化保留;图4c)。在用局部他克莫司治疗的动 物中,这种病理应答显著降低,导致淋巴泄漏降低和注射icg的清 除改善。
[0138]
使用时间差摄影术分析集合管中icg荧光强度的波动是以前用 于测量淋巴泵送速率的技术。sevick-muraca等人,j.clin. invest.124:905-914(2014)。该分析能够计算“icg包频率”,并且已经 用于分析plnd后的集合淋巴功能。blum等人,breast cancer res. treat.139:81-86(2013)。使用这种技术,我们发现与对照相比,局部 他克莫司疗法明显增加集合淋巴包频率(》2倍增加),表明这种治疗 增加了集合淋巴功能(图4d)。
[0139]
另外,与我们用尾部模型的发现相似,我们发现plnd后用局部 他克莫司治疗明显降低炎性细胞的外淋巴浸润(cd45
+
细胞减少 39%(图4e上图,图4f)、cd4
+
细胞的56%减少(图11)和f4/80
+
细胞 的36%减少(图12)。用局部他克莫司治疗也导致炎性细胞的诱导型一 氧化氮合酶(inos)的外淋巴表达的显著降低(inos表达细胞的数目的 42%减少)(图4e下图,图4g)。这是重要的,因为先前的研究已经显 示了外淋巴inos表达是集合淋巴泵送能力的重要调节剂。liao等人, proc.natl.acad.sci.usa 108:18784-18789(2011)。重要地,仅在淋巴 损伤的背景中观察到响应局部他克莫司的淋巴收缩性的改变,因为用 他克莫司治疗非手术动物(即仅麻醉但没有手术)没有增加炎性细胞的 淋巴收缩频率或外淋巴积聚(图13)。
[0140]
另外,为了确保他克莫司对淋巴功能观察到的作用不是血管通透 性和血管渗漏降低的结果,我们进行了一项miles测定法以测量在有 和无他克莫司的情况下plnd手术后的血管通透性。我们没有观察到 他克莫司治疗和媒介物对照之间的血管通透性差异,表明他克莫司在 增加淋巴功能中的作用确实是由于淋巴功能升高而不是血管渗漏减 少所致(图14)。
[0141]
我们接下来根据以前的临床报道显示长期存在的严重淋巴水肿 患者收缩淋巴系统及平滑肌细胞肥大的事实,在对照和他克莫司治疗 的动物中检查了plnd后后肢集合淋巴管的管腔直径和α平滑肌细胞 覆盖。mihara等人,plos one 7:e41126(2012)。不令人惊讶的是,在 淋巴损伤后的相对较早的时间段(即4周)内,当比较他克莫司和对照 治疗小鼠
时,我们未发现围绕管或后肢集合器的腔区域中α平滑肌的 数目的差异。这一发现指示,他克莫司治疗后集合淋巴包频率的增加 不受淋巴结构变化的调节,而是由于淋巴微环境的变化(例如,外淋 巴炎症或inos的表达;图15)。
[0142]
他克莫司增加侧支淋巴管形成
[0143]
由于已知t细胞有力抑制创伤修复期间的淋巴结淋巴管生成 (kataru等人,immunity 34:96-107(2011))和炎性淋巴管生成(zampell 等人,am.j.physiol.cell physiol.302:c392-c404(2012)),我们接下来 试图确定用他克莫司治疗是否增加侧支淋巴系统的形成。事实上,使 用lyve-1免疫荧光(if)染色的尾部创伤的组织学分析和淋巴系统鉴 定表明桥接淋巴损伤区域的新形成的淋巴管明显增加(早期治疗后增 加189%;晚期治疗后增加106%;图5a)。由于我们注意到对照和他 克莫司治疗的动物之间的vegf-c mrna表达没有差异,这种淋巴 管生成应答似乎与vegf-c表达无关(图5a)。然而,与我们的if染 色分析一致,我们注意到两种有力抗淋巴管生成的生长因子和细胞因 子tgf-β1(oka等人,blood 111:4571-4579(2008);clavin等人,am.j. physiol.heart circ.physiol.295:h2113-2127(2008))和ifn-γ(kataru等 人,immunity 34:96-107(2011);shao等人,j.interferon cytokine res. 26:568-574(2006))的表达的显著降低(图5a)。通过nir成像进行的 淋巴管造影分析和plnd后4周的后肢淋巴管的if染色,证实了我 们的尾部模型发现,证明用他克莫司治疗的动物一致具有明显更多的 引流到腹股沟淋巴结的侧支淋巴系统,从而绕过损伤区(图5b-5d)。
[0144]
为了在淋巴液的引流不被手术阻塞的其它炎症和创伤模型中确 定他克莫司的淋巴管生成作用,我们接下来使用另外两种炎性淋巴管 生成模型。角膜是用于研究淋巴管生成的有用组织,因为它通常不含 血管和淋巴管,而是在炎症的背景中发展。cursiefen等人,j.clin. invest.113:1040-1050(2004)。我们将缝线放在小鼠的角膜中,每天用 全身性他克莫司或媒介物对照治疗2周,并且发现他克莫司治疗导致 淋巴管(增加48%)而非血管增生的显著增加(图6a-6c)。
[0145]
我们还使用耳穿孔创伤模型研究创伤愈合过程中的淋巴管生成, 并应用局部他克莫司或对照软膏剂4周。与角膜模型类似,我们发现 与对照相比,局部他克莫司显著增加了创伤附近的耳皮肤的淋巴管密 度和分支(图6d-6f)。为了测试他克莫司的直接淋巴管生成作用的可 能性,我们将他克莫司应用于无创伤的小鼠耳4周,然后进行淋巴管 的整装共聚焦成像。我们观察到在这个未受伤的非炎性环境中淋巴管 生成没有增加(图16)。这些结果一起表明,他克莫司通常在炎症的背 景中和特别在淋巴水肿/淋巴损伤的背景中促进新的淋巴管的形成。
[0146]
方法
[0147]
研究设计
[0148]
本研究的目的是测试t细胞的局部抑制既能预防淋巴损伤后淋 巴水肿的发展又在其发展后治疗已建立的淋巴水肿的假设。使用淋巴 损伤和淋巴水肿的两种不同小鼠模型,我们分析了他克莫司(fda批 准的局部抗t细胞药物)对这些结果的功效。发现了他克莫司确实有 效预防和治疗淋巴水肿,然后我们试图分析调节这种响应的细胞和分 子机制。在这些随后的研究中,我们测试了cd4+炎性应答的抑制通 过增加侧支淋巴系统的形成,减少围绕初始淋巴系统的细胞外基质中 的胶原沉积以及增加集合淋巴系统的泵送频率来改
善淋巴功能的假 说。我们的研究都使用成年雌性(10-14周龄)c57bl/6j小鼠(jacksonlaboratories,bar harbor,me)进行,其保持在控制光和温度的无病 原体环境中并随意进食。所有研究均获得了memorial sloan ketteringcancer center的机构动物护理和使用委员会(iacuc)的批准。每个实 验使用至少6-8只动物进行,并且测定一式三份进行。所有细胞计数 由对干预不知情的审阅者进行。
[0149]
动物模型和治疗
[0150]
尾部手术和淋巴消融如以前公布的那样进行。clavin等人,am.j. physiol.heart circ.physiol.295:h2113-h2127(2008)。简言之,使用2mm圆周切除术切除尾部中部的浅表和深层集合淋巴系统。他克莫 司0.1%(astellas,tokyo,japan)/媒介物对照(凡士林)在不同组的动物 中在手术后2周(早期治疗)开始以及在手术后6周开始(晚期治疗)局 部治疗。对于这两种方法,我们用0.1%他克莫司或媒介物对照治疗 动物,每天两次,持续4周时段(早期治疗)和3周时段(晚期治疗)。 他克莫司(约0.05g)作为薄层施加到整个尾部区域。为了能够分析淋巴 集合管泵送能力,我们利用了前述的小鼠腘淋巴结切除术模型。blum 等人,breast cancer res treat 139:81-86(2013);sharma等人,am.j. physiol.heart circ.physiol.292:h3109-h3118(2007)。简言之,鉴定 后肢集合管和腘淋巴结,并且用腘脂肪垫切除淋巴结。手术后2周开 始,将动物随机化至用0.1%局部他克莫司或媒介物对照(凡士林)治 疗,每日两次,持续2周。
[0151]
如以前报道,进行角膜淋巴管生成测定。cursiefen等人,cornea25:443-447(2006)。简言之,将10-0尼龙缝线(ethicon,cincinnati, oh)以120
°
角放置在角膜中。在缝线放置后立即开始,动物用全身性 他克莫司或媒介物对照每天治疗,持续两周,然后使用共聚焦显微镜 (leica microsystems,weitziar,germany)进行分析。将全身性他克莫司 (biotang inc.,lexington,ma)溶解在具有pbs中的1%tween 80的 10%乙醇中(rozkalne等人,neurobiol.dis.41:650-654(2011);butcher 等人,j.neurosci.17:6939-6946(1997)),每日ip给药4mg kg-1
。全身 性他克莫司的媒介物对照是等体积的在pbs中的10%乙醇、1%tween80。使用先前报道的耳冲孔创伤模型评价皮肤淋巴管生成。cho等人, proc.natl.acad.sci.usa 103:4946-4951(2006)。受伤后,耳皮肤用局 部他克莫司或媒介物对照治疗4周。然后,收获耳并在1%pfa中固 定过夜。然后,分开耳皮肤的前部和后部,除去软骨,并进行lyve-1 和cd31的整装染色。使用共焦显微镜(leica microsystems,weitziar, germany)获得平铺扫描图像,并使用metamorph软件(moleculardevices,sunnyvale,ca)分析创伤边缘400μm内的皮肤。通过两名 不知情审阅者分析了标准化(200μm x 200μm)视野的单位面积存在的 分支点数。
[0152]
流式细胞术
[0153]
如前所报道对外周血样品进行流式细胞术。zampell等人,plosone 7:e49940(2012)。简言之,将红细胞用rbc裂解缓冲液 (ebioscience,san diego,ca)裂解,然后用荧光团缀合的抗体(cd45、 cd3和cd4;全部来自biolegend,san diego,ca)染色,并用 facscalibur流式细胞仪(bd biosciences,franklin lakes,nj),使用 flowjo软件(tree star,ashland,or)分析。
[0154]
通过质谱术得到的他克莫司血液水平
[0155]
在先前报道的方法的修改中使用质谱术测量他克莫司的血液水 平。donaldson等
人,meth.mol.biol.603:479-487(2010)。简言之,在 edta钠包被的管(terumo,shibuya,japan)中收集全血,然后使用与 tsq quantum ultra三重四极杆质谱仪(thermo scientific,franklin, ma)偶联的thermo scientific aria tlx-2湍流层析(tfc)分析。使用 的turboflow柱是cyclone p-50x 0.5mm,而分析柱是hypersil goldc-18柱,3x 50mm。对全血(50μl)添加200μl含有子囊霉素作为内 部标准品的0.2mm znso4。在30分钟温育和离心后,将50μl上清 液注射到tfc系统中。用含有10mm甲酸铵和0.1%甲酸的水和乙醇 溶液的梯度将分析物洗脱流过柱(0.75ml min-1
)。分析运行时间是4.5 分钟。在10天时段内在三个浓度测定测定法的日间不精确性。在3.3、 12.6和31.9ng ml-1
的浓度下,变异系数分别是9.8、7.0和7.8%。测 定具有0至40ng ml-1
的线性范围。
[0156]
淋巴功能的分析
[0157]
如先前报道(clavin等人,am.j.physiol.heart circ.physiol. 295:h2113-h2127(2008)),使用截锥公式计算尾部体积,并且使用 mirax成像软件(carl zeiss,munich,germany)以标准化方式使用皮 肤/皮下组织的软组织厚度的组织学测量确认。
[0158]
使用我们以前发表的方法进行淋巴系闪烁造影术。avraham等人, am.j.pathol.177:3202-3214(2010)。简言之,将50μl过滤的锝
ꢀ‑
99m(
99m
tc)硫胶体(nuclear diagnostic products,rockaway,nj)在远 端尾部中注射。使用x-spect照相机(gamma medica,northridge, ca)拍摄图像,并进行感兴趣区域分析以获得骶淋巴结中的衰减调整 计数,并使用asipro软件(cti molecular imaging,knoxville,tn) 计算结节摄取的峰值和速率。
[0159]
使用以前发表的结果的修改进行近红外成像(nir)。tassenoy等 人,lymphat.res.biol.7:145-151(2009)。简言之,将15μl(0.15mg ml-1
) 吲哚菁绿(icg,sigma-aldrich,saint louis,mo)皮内注射到背部后 肢的蹼空间中,并使用具有led光源(coolled,andover,unitedkingdom)的evos emccd照相机(life technologies,carlsbad,ca) 进行可视化。使用zeiss v12 stereolumar显微镜(caliper life sciences, hopkinton,ma)获得静态/视频图像,并使用fiji软件(nih,bethesda, md)通过鉴定腿的优势集合管上的感兴趣区域并减去随时间绘制的 背景荧光强度分析淋巴泵送功能。
[0160]
组织学和免疫染色
[0161]
使用我们发表的方法进行免疫组织化学染色。clavin等人,am.j. physiol.heart circ.physiol.295:h2113-h2127(2008)。简言之,将组 织在4℃下在4%多聚甲醛中固定,在5%edta钠(santa cruzbiotechnology,dallas,tx)中脱钙,在石蜡中包埋,并以5微米切片。 将切割切片再水合,并使用90℃的柠檬酸钠(sigma-aldrich)进行热介 导的抗原暴露。用2%bsa/20%动物血清封闭非特异性结合。组织在 4℃下与一抗温育过夜。用于免疫组织化学染色的一抗包括山羊抗小 鼠lyve-1、大鼠抗小鼠cd45、兔抗小鼠cd4和大鼠抗小鼠f4/80(均 来自r&d,minneapolis,mn)、兔抗小鼠cd3(来自dako,carpinteria,ca)、cy3缀合的小鼠抗αsma(来自sigma-aldrich)、兔抗人ifn-γ、 兔抗小鼠tgf-β1、兔抗小鼠p-smad3、兔抗小鼠胶原i、兔抗小鼠 inos和仓鼠-抗小鼠平足蛋白、兔抗小鼠hmgb-1和hsp-70(均来自 abcam,cambridge,ma)。
[0162]
使用alexafluor荧光团缀合的二抗(life technologies,norwalk, ct)进行免疫
荧光染色。使用mirax成像软件(carl zeiss)扫描图像。 通过在腿的每个象限中最发炎的淋巴管的50μm内计数阳性染色的细 胞来评估外淋巴cd45
+
和cd4
+
细胞计数。在四个随机选择的40x高 放大率视野中,两名不知情审阅者在每个动物的最少4个视野中计数 阳性染色细胞。使用metamorph软件(molecular devices,sunnyvale, ca)在5μm横截面的真皮区域中定量胶原i沉积。如先前报道,使用 天狼星红染色和瘢痕指数计算确认了该分析。flanders等人,am.j. pathol.163:2247-2257(2003)。在每个尾部4个不同高放大率视野的 重新上皮化手术部位中计数小鼠尾部中的桥接淋巴管。
[0163]
天狼星红染色
[0164]
用天狼星红染色试剂盒(polysciences,warrington,pa)根据制造 商的说明书对尾组织的石蜡切片进行染色。通过axiocam 2显微镜 (carl zeiss)上的偏振光获得图像,并且用metamorph软件通过计算具 有代表增加的瘢痕形成的更高数目的红-橙色:绿-黄色纤维的比率来 量化瘢痕指数。
[0165]
实时pcr
[0166]
使用trizol(invitrogen,life technologies,carlsbad,ca)根据 制造商的建议在尾部皮肤上进行rna提取。使用agilent生物分析仪 (agilent technologies,inc;santa clara,ca)评估rna质量和数量。 使用taqman逆转录酶试剂盒(roche,branchburg,nj)将分离的rna 转化为cdna,使用delta-delta ct pcr分析并且使用gapdh rna 扩增标准化基因表达进行组间的基因表达的相对表达,如先前所述。schmittgen等人,nat.protoc.3:1101-1108(2008)。使用以下公式计算 相对表达:2[-(ct感兴趣基因
–
ct内源对照)样品a
–
(ct感兴趣基因
–ꢀ
ct内源对照)样品b)]。所有样品一式三份进行。用于感兴趣的pcr 靶物的引物是针对vegf-c、tgf-β1和ifn-γ(applied biosystems, life technologies,carlsbad,ca)。
[0167]
体内检测ros和用于血管通透性的miles测定法
[0168]
如han等人(j.vis.exp.doi:10.3791/3925(2012))描述,通过 nadph氧化酶的生物发光成像进行ros的体内检测。简言之,在 plnd之后的不同时间点,对小鼠全身性注射溶解在pbs中的 l-012(鲁米诺的类似物)(20μg/g),并且对plnd手术部位处代表ros 的发光信号成像并使用ivis谱200(xenogen corporation)量化。如所 述进行血管通透性的miles测定。radu等人,j.vis.exp.doi: 10.3791/50062(2013)。简言之,通过尾静脉将200μl 0.5%无菌伊文思 蓝注射至2周他克莫司治疗的plnd小鼠。30分钟后,对plnd后 肢成像以观察伊文思蓝色渗漏。切下后肢,并在55℃在甲酰胺中温 育48小时以提取伊文思蓝。通过测量610nm处的吸光度来量化提取 的伊文思蓝。
[0169]
统计学分析
[0170]
使用graphpad prism软件(graphpad software,la jolla,ca)分 析和显示数据。除非另有说明,数值以平均值
±
标准偏差表示。统计 学显著性设定为p≤0.05,并且2组之间的差异用student's t检验进行 评估,而使用anova及事后检验进行多次分析以在组内进行比较。
[0171]
结论
[0172]
由于cd4
+
t细胞在淋巴水肿病理学中发挥关键作用,本研究的 目的是评估局部他克莫司预防和治疗淋巴水肿的功效。我们良好使用 了描述的淋巴水肿的小鼠尾部模型以
及以前描述的由腘淋巴结清扫 术(plnd)引起的淋巴损伤模型,以显示局部他克莫司通过降低慢性 炎症应答、减少组织和淋巴纤维化、增加集合淋巴泵送、并增加侧支 淋巴管形成在淋巴损伤后有力阻止淋巴水肿的发展。这些发现对淋巴 水肿的治疗具有重要含义,因为以前的实验尝试主要集中在使用外源 性淋巴管生长因子增加淋巴再生。
[0173]
我们还发现他克莫司能有效地减少淋巴损伤后的真皮和皮下t 细胞浸润和组织纤维化。这些变化阻止了淋巴水肿的发展,并且一旦 建立淋巴水肿,就可逆转病理变化。用他克莫司治疗通过增加侧支淋 巴系统的形成和通过增加集合淋巴泵送频率来增加淋巴功能。据我们 所知,这是预防和治疗手术后淋巴水肿的首选靶向局部药理学手段。
[0174]
我们发现他克莫司在手术后立即较早期应用时更有效,可能反映 出这种治疗不需要逆转已建立的病理学的实情。此发现与其它纤维增 生性病症如肝纤维化的先前研究一致,其中预防比逆转组织学变化有 效得多。friedman等人,hepatology 43:s82-s88(2006)。
[0175]
实施例2:使用吡非尼酮治疗和预防淋巴水肿
[0176]
吡非尼酮减少尾部淋巴水肿
[0177]
小鼠尾部浅表和深层淋巴系统的破坏导致手术后2周尾部体积 增加几乎80%(图19a,19b)。我们以前显示了,在这个时间点的肿 胀主要是由于间质液的积聚。avraham等人,faseb j.27:1114-1126 (2013)。尾部慢性淋巴阻塞导致纤维脂肪组织逐渐替代间质液,并在 随后的4周内积聚炎性细胞。avraham等人,faseb j.27:1114-1126 (2013)。这些病理变化紧密反映了临床淋巴水肿,并且一旦建立淋巴 水肿,再持续至少8-10周。根据这些知识,我们在手术后等待7周 以建立淋巴水肿,然后用吡非尼酮开始治疗,目的是治疗这些建立的 软组织变化。我们最初开始全身性治疗,因为大多数以前关于吡非尼 酮的研究使用这种施用途径来治疗纤维化疾病。然而,一旦我们建立 了吡非尼酮作为有效的治疗,我们就开发局部制剂,因为局部施用是 优选的,以使由于全身性疗法引起的任何潜在副作用最小化。与对照 相比,用全身性和局部吡非尼酮二者的治疗显著减少大体尾部肿胀、 尾部体积和软组织厚度(图19a-19c,19e;对于这两种治疗组,尾部 体积p《0.01而厚度p《0.05)。
[0178]
吡非尼酮增加尾部中的淋巴功能
[0179]
鉴于吡非尼酮在尾部模型中治疗淋巴水肿的功效,我们接下来尝 试研究吡非尼酮是否调节淋巴损伤后的淋巴功能。使用
99
tc淋巴系 闪烁造影术(将放射性示踪剂注射到远端尾部的技术),我们在90分钟 内测量了其被骶淋巴结的摄取。与对照相比,全身性和局部吡非尼酮 治疗的动物中骶淋巴结的衰减调整摄取表明吡非尼酮治疗的动物中 99
tc摄取增加了几乎4倍。此外,全身性和局部治疗的动物均表明峰 值结节摄取增加了几乎4倍(图19g;两者均为p《0.01)。类似地,全 身性和局部治疗的动物的摄取速率增加,如衰减调整曲线的斜率增加 所示(图19h;分别为p《0.01和p《0.05)。
[0180]
吡非尼酮减少淋巴损伤后尾部炎症和纤维化
[0181]
慢性炎症是临床淋巴水肿的组织学特征,并且特征在于炎性细 胞,特别是t辅助细胞的积聚增加。avraham等人,faseb j. 27:1114-1126(2013);zampell等人,plos one 7:e49940(2012); ghanta等人,am.j.physiol.heart circ.physiol.308:h1065-1077 (2015);olszewski等人,lymphology 23:23-33(1990)。与此一致,我们 发现与对照相比,
全身性和局部治疗的动物都具有浸润真皮和皮下脂 肪的白细胞数目的明显减少。从对照动物收获的淋巴水肿组织中的炎 症细胞位于紧邻毛细血管和集合淋巴系统,但在吡非尼酮治疗的小鼠 中几乎不存在。类似地,我们注意到浸润的cd3
+
细胞和cd4
+
细胞的 数目显著减少(图20a,20d;两者为p《0.001)。此外,我们注意到 ifn-γ蛋白(一种t辅助细胞(th)1细胞产生的细胞因子,其先前已被 发现是有力抗淋巴管生成)的积聚显著减少(图20j;p《0.01)。kataru 等人,immunity 34:96-107(2011);shao等人,j.interferon cytokine res. 26:568-574(2006)。
[0182]
此外,我们以前已经显示巨噬细胞积聚在淋巴损伤远端的组织 中。zampell等人,plos one 7:e49940(2012)。我们分析了吡非尼酮 对巨噬细胞浸润的作用,因为它们既调节纤维化(主要通过tgf-β1) 又调节淋巴管生成(通过vegf-c)。我们发现了与对照相比,使用吡 非尼酮治疗(全身性和局部两者)的淋巴水肿尾部组织中f4/80
+
细胞浸 润无差异。与此一致,我们发现用吡非尼酮治疗后vegf-c蛋白积聚 没有差异(图20k;p=ns)。总之,这些发现显示了在淋巴损伤后, 炎性细胞(特别是t细胞)大量积聚在皮肤/皮下淋巴管附近,并且通过 全身性和局部吡非尼酮治疗减轻了此应答。
[0183]
淋巴水肿患者具有进行性软组织纤维化,并且纤维化程度在临床 上与疾病严重程度相关。tassenoy等人,lymphat.res.biol.7:145-151 (2009)。与其它纤维化病症一致,我们以前已经显示了tgf-β1是淋 巴水肿中关键的促纤维化生长因子。avraham等人,am.j.pathol. 177:3202-3214(2010)。此外,我们已经显示tgf-β1对lec具有直接 的抗淋巴管生成作用。clavin等人,am.j.physiol.heart circ.physiol. 295:h2113-h2127(2008)。因此,我们分析了tgf-β1
+
细胞的浸润和 其激活的下游信号传导分子psmad3的细胞表达。在全身性和局部 吡非尼酮治疗组中,我们发现与对照相比,tgf-β1
+
细胞和psmad3
+
细胞的积聚显著降低(图20b,20c,20e,20f;全部为p《0.001)。 与这一致,我们发现了吡非尼酮治疗后,tgf-β1蛋白积聚减少(图 20i;p《0.05)。这与如与对照小鼠相比两种治疗组中的皮肤和皮下i 型胶原沉积显著减少相关(图19d,19f;对于全身性为p《0.001以及 对于局部为p《0.05)。
[0184]
由于在淋巴水肿的人患者中已经描述了集合淋巴管的结构变化 (平滑肌肥大、厚i型胶原层、管腔收缩),我们检查了我们动物的集 合淋巴系统的类似的变化。mihara等人,plos one 7:e41126(2012)。 与这些人研究一致,对照小鼠的集合淋巴系统(α-sma
+
/平足蛋白
+
)被 厚i型胶原层包围,而吡非尼酮治疗的动物具有基本正常的淋巴管(图 20h)。
[0185]
吡非尼酮增加后肢中的淋巴功能
[0186]
为了理解吡非尼酮增加淋巴功能的机制,我们利用小鼠后肢 plnd模型分析了初始淋巴系统中的皮肤淋巴管回流和集合淋巴泵 送能力。blum等人,breast cancer res.treat.139:81-86(2013)。在 plnd后4周使用nir淋巴管造影术,与媒介物治疗的对照相比,用 2周的全身性吡非尼酮治疗的动物具有明显更少的真皮淋巴管回流和 毛细血管渗漏(图18a,白色箭头)。此外,吡非尼酮治疗的动物与对 照相比具有集合淋巴管收缩的速率显著增加(增加2倍;图18a,18b; p《0.0015)。这种与我们对尾部模型的发现相似的应答与用吡非尼酮 治疗的小鼠中炎性细胞的外淋巴浸润显著减少相关(图18e(上图),图 18f;p《0.01)。此外,用吡非尼酮治疗导致炎症细胞对inos的外淋 巴细胞表达显著降低(图18e(下图),图18g;p《0.01)。这是一项关 键的发现,因为增加的外淋巴inos积聚在炎症的背景
中已显示破坏 正常一氧化氮梯度,这对于正常的、协调的淋巴管收缩性至关重要。 liao等人,proc.natl.acad.sci.usa 108:18784-18789(2011)。这提供 了吡非尼酮如何改善淋巴管收缩性的重要机制。
[0187]
吡非尼酮增加侧支淋巴管形成
[0188]
由于已知t细胞(特别是th1和th2细胞因子)在创伤修复期间有 效抑制淋巴结淋巴管生成和炎性淋巴管生成,我们接下来试图确定用 吡非尼酮治疗是否增加了侧支淋巴系统的形成。kataru等人,immunity34:96-107(2011);clavin等人,am.j.physiol.heart circ.physiol. 295:h2113-h2127(2008);zampell等人,am.j.physiol.cell physiol. 302:c392-c404(2012);savetsky等人,plos one 10:e0126908(2015)。 事实上,使用lyve-1免疫荧光染色的淋巴系统的组织学分析和鉴定 证明尾部和后肢两者中的淋巴管密度显著增加(图18d,18e;p 《0.001)。由于我们注意到,与非对照相比,吡非尼酮治疗的淋巴水肿 尾部中的vegf-c蛋白分析没有差异,因此淋巴管生成应答似乎与 vegf-c表达无关,而抗淋巴管生成t细胞细胞因子如ifn-γ和 tgf-β1深刻降低(图20e,20i,20k;tgf-β1为p《0.05,ifn-γ为p 《0.01,以及vegf-c为p=ns)。
[0189]
用吡非尼酮的tgf-β1免疫疗法不进一步改善淋巴功能
[0190]
鉴于吡非尼酮的主要作用机制是阻断tgf-β1活性,我们比较了 单独研究中吡非尼酮治疗与tgf-β1免疫疗法在plnd后的作用。 schaefer等人,eur.respir.rev.20:85-97(2011)。使用nir成像,与同 种型对照相比,我们发现单独的tgf-β1免疫疗法以及tgf-β1免疫 疗法和吡非尼酮的组合已经减少了真皮淋巴管回流,并且显著增加了 集合淋巴管收缩的速率。更重要的是,与单独的免疫疗法相比,组合 疗法没有增加益处,表明我们以我们使用的剂量最大限度地抑制 tgf-β1(图21a-21c;p=ns)。类似地,使用流式细胞术,与同种型 对照相比,我们发现单独的tgf-β1免疫疗法以及tgf-β1免疫疗法 和吡非尼酮的组合显著降低了淋巴损伤远端的t辅助细胞的组织积 聚,而与单独的免疫疗法相比,组合疗法没有额外的作用。
[0191]
来自t细胞的tgf-β1 ko在淋巴损伤后减少尾部淋巴水肿,改善淋巴功能,并且减少尾部炎症和纤维化
[0192]
为了确定淋巴水肿背景中tgf-β1的细胞来源,我们开发了具有 t细胞和髓细胞的tgf-β1产生的选择性ko的转基因小鼠。使用聚 合酶链式反应(pcr)证实这些转基因小鼠的表型确认,显示了与对照 小鼠相比,来自t细胞
cre
和髓样
cre
小鼠的分离的t和髓样细胞的 tgf-β1表达显著降低(图21a;两者都为p《0.05)。进行尾部手术, 并且手术后6周进行分析。与髓样
cre
和对照小鼠相比,t细胞
cre
具 有显著降低的大体尾部肿胀、尾部体积和纤维脂肪厚度(图21b-21d; 尾部体积为p《0.01以及厚度为p《0.05)。
99
tc淋巴系闪烁造影术分析 表明与髓样
cre
和对照小鼠相比,t细胞
cre
小鼠的骶淋巴结中示踪剂 的衰减调节摄取增加了几乎4倍。类似地,与髓样
cre
和对照小鼠相 比,t细胞
cre
小鼠中的峰结节摄取以及示踪剂摄取速率有所增加(图 21e-21f;分别p《0.05和p《0.01)。
[0193]
以前,我们已经显示了除了减少的纤维化外,在我们的淋巴水肿 尾部模型中tgf-β1免疫疗法导致减少的炎症,特别是t辅助细胞组 织浸润。avraham等人,am.j.pathol.177:3202-3214(2010)。有趣的 是,与髓样
cre
和对照小鼠相比,t细胞
cre
小鼠具有浸润真皮和皮下 脂肪的t辅助细胞数目的明显减少(图22a,22b;p《0.01)。此外, 与我
们在吡非尼酮治疗动物中的发现相似,我们注意到ifn-γ蛋白的 积聚显著减少(图22d;p《0.01)。与髓样
cre
和对照小鼠相比,发现 tgf-β1
+
细胞和蛋白质积聚的分析以及其活化的下游信号传导分子 psmad3的细胞表达在t细胞
cre
小鼠中显著降低(图22a,22c,22e; 对于psmad3为p《0.01以及对于tgf-β1蛋白为p《0.05)。我们发 现所有组之间的f4/80
+
细胞或vegf-c蛋白积聚无差异(图22f;p= ns)。与髓样
cre
和对照小鼠相比,这与t细胞
cre
小鼠中的皮肤和皮下 i型胶原沉积显著减少相关(图21d;p《0.05)。虽然髓样
cre
小鼠中似 乎有炎症、纤维化和抗淋巴管生成细胞因子表达减少的趋势,但是它 未达到显著性。这些发现是重要的,因为它们表明淋巴水肿中tgf-β1 的主要细胞来源是t细胞。
[0194]
受损的lec tgf-β1响应性在淋巴损伤后在尾部中的尾部淋巴水肿、炎症或纤维化上没有变化
[0195]
为了分析tgf-β1在淋巴水肿背景中对lec的直接作用并且将我 们以前的体外发现应用于体内模型,我们对flt4
cre
小鼠进行了尾部 手术,并在手术后6周进行了分析。avraham等人,plast.reconstr.surg. 124:438-450(2009)。通过针对lyve-1和psmad3对淋巴结染色证 实这些转基因小鼠的表型确认。flt4
cre
小鼠在lec上没有检测到psmad3染色,表明lec对tgf-β1无响应性(图23a,白色箭头表 示psmad3
+
lec)。与对照小鼠相比,flt4
cre
小鼠没有大体尾部肿 胀、尾部体积和纤维脂肪厚度的差异(图23c-23e,23g;p=ns)。 有趣地并且类似于我们以前的体外发现,我们发现创伤的桥接部分中 的淋巴管密度增加(图23h;p《0.01)。clavin等人,am.j.physiol.heartcirc.physiol.295:h2113-h2127(2008)。创伤的桥接部分是手术切除 所有皮肤淋巴管的区域。因此,这表明由于lec在淋巴水肿的背景 中对tgf-β1的无响应性,导致淋巴管生成改善。
[0196]
flt4
cre
和对照小鼠之间炎性浸润细胞和细胞因子积聚的分析揭 示,cd4
+
细胞和ifn-γ蛋白质积聚(两者均为p=ns)、f4/80
+
细胞或 vegf-c蛋白积聚(p=ns)、tgf-β1
+
细胞和蛋白质积聚(图23b;p= ns),以及其激活的下游信号传导分子psmad3的细胞表达(图23g; p=ns)无差异。类似地,flt4
cre
和对照小鼠之间胶原i沉积没有显 著差异(图23f,23g;p=ns)。这些发现表明tgf-β1在促进炎症、 纤维化和最终淋巴功能障碍中的主要作用是在细胞外基质中,而其直 接的抗淋巴管生成在淋巴水肿的背景中起相对较小的作用。
[0197]
方法
[0198]
研究设计
[0199]
我们的假设是淋巴水肿可以通过tgf-β1抑制来治疗,从而减少 炎症和纤维化二者。我们在几种不同的动物模型中探讨了此假设的不 同方面,以让我们彻底评估损伤后的肿胀、炎症、纤维化、淋巴管功 能和淋巴管生成。将成年雌性(10-14周龄)c57bl/6j小鼠(jacksonlaboratories,bar harbor,me)保持在控制光和温度的无病原体环境 中并随意进食。所有研究均获得了memorial sloan kettering cancercenter的机构动物护理和使用委员会(iacuc)的批准。在进行尾部手 术后,若它们经历远端尾部坏死,则从实验中排除动物。在将动物随 机化到治疗或对照组前进行此评估。每个实验使用最少6-8只动物进 行,并且测定一式三份进行。所有计数由对干预不知情的审阅者进行。
[0200]
动物模型和治疗
[0201]
动物使用良好描述的淋巴水肿的小鼠尾部模型进行淋巴消融,其 中尾部的浅表和深层淋巴系统通过在尾部中部的2mm的周边皮肤切 除被切除。clavin等人,
am.j.physiol.heart circ.physiol. 295:h2113-h2127(2008);avraham等人,am.j.pathol.177:3202-3214 (2010);rutkowski等人,microvasc.res.72:161-271(2006);tabibiazar 等人,plos med.3:e254(2006)。我们小组和其他人以前已经显示了, 这种模型在手术后导致远端尾部的持续淋巴水肿、淋巴功能的严重受 损和临床淋巴水肿的组织学特征(如慢性炎症、脂肪沉积、纤维化)至 少10周。clavin等人,am.j.physiol.heart circ.physiol. 295:h2113-h2127(2008);avraham等人,am.j.pathol.177:3202-3214 (2010);rutkowski等人,microvasc.res.72:161-271(2006);tabibiazar 等人,plos med.3:e254(2006)。手术后七周,当淋巴水肿建立时,将 动物随机化到实验组(吡非尼酮)或对照组,并且每日治疗一次持续3 周,随后分析,如下文概述。
[0202]
尾部模型可用于分析组织学组织变化(即纤维化和脂肪沉积);然 而,由于集合管的口径小,这种模型对于分析淋巴泵送功能并不理想。 因此,为了确定吡非尼酮在恢复集合淋巴系统的淋巴泵送能力方面的 功效以及分析这种治疗对淋巴损伤区域远端的组织中淋巴增生的作 用,我们进行了腘淋巴结清扫术(plnd),如前所述。blum等人,breastcancer res.treat.139:81-86(2013)。简言之,将50μl 3%伊文思蓝注 射入后爪后使淋巴系统可视。切除腘区中的集合淋巴系统以及腘淋巴 结。手术后两周,将动物随机化到用全身性吡非尼酮或对照每天一次 的治疗,持续2周,随后分析。
[0203]
在全身性实验中,每天用吡非尼酮(cayman chemical,ann arbor, mi)以溶解于pbs中10%dmso/0.5%羧甲基纤维素(cmc)的400mg/kg的剂量或用媒介物(在pbs中的10%dmso/0.5%cmc)口服 治疗小鼠。该剂量是根据在各种纤维化模型中显示有效治疗方案的先 前研究确定的。oku等人,eur.j.pharmacol.590:400-408(2008); kakugawa等人,eur.respir.j.24:57-65(2004);tanaka等人,chest 142:1011-1019(2012)。吡非尼酮的局部制剂是与memorial sloankettering cancer center的research pharmacy core facility合作开发 的。在这些实验中,每日用41%凡士林中1mg/ml的局部吡非尼酮 (cayman chemical,ann arbor,mi)治疗小鼠,而对照动物接受单独 的媒介物(41%凡士林)。
[0204]
为了研究淋巴水肿中tgf-β1的细胞来源,我们开发了非诱导型 转基因小鼠,从t细胞和髓细胞中选择性敲除tgf-β1产生。来自 jackson laboratories(bar harbor,me),我们购买了在lck(淋巴细胞 蛋白酪氨酸激酶)启动子控制下表达cre的 b6.cg-tg(lck-cre)548jxm/j,使得loxp侧接的目标序列的胸腺细胞特 异性切除。lck基因主要由t淋巴细胞表达,其中它磷酸化参与细胞 内信号传导途径的蛋白质的酪氨酸残基。另外,我们从jacksonlaboratories(bar harbor,me)购买了具有lysmcre敲入等位基因的 b6.129p2-lyz2tm1(cre)ifo/j转基因株,其具有插入到溶菌酶2基因 (lyz2)的第一编码atg中的核定位的cre重组酶;消除内源lyz2基 因功能,并将nls-cre表达置于内源性lyz2启动子/增强子元件的控 制下。将这些转基因小鼠中的每只与tgfb1
tm2.1doe
/j突变体小鼠 (jackson laboratories,bar harbor,me)杂交,所述突变体小鼠携带 tgf-β1基因的侧接外显子6的loxp位点。结果,cre介导的重组导 致t淋巴细胞和髓样细胞谱系(包括单核细胞、成熟巨噬细胞和粒细 胞)中靶向基因(tgf-β1)的缺失。
[0205]
为了研究tgf-β1对lec的直接作用,我们开发了在lec上具 有非功能性tgf-β受体
的诱导型转基因小鼠。我们使用flt4cre小 鼠(sagrario ortega博士的赠品),其中这些小鼠中vegfr-3的flt4启 动子处于雌激素受体2型(er2)的控制下,并且在成年小鼠中被所有lec高度表达。martinez-corral等人,proc.natl.acad.sci.usa109:6223-6228(2012)。我们将flt4cre小鼠与拥有转化生长因子β受 体ii的侧接外显子4的loxp位点的b6;129-tgfbr2tm1karl/j(jacksonlaboratories,bar harbor,me)突变体小鼠杂交。使用他莫昔芬 (300mg/kg/天皮下5天)在成年雌性flt4cre小鼠中诱导cre表达。
[0206]
对于所有转基因小鼠,通过基因型分型(transnetyx,memphis, tn)证实了这两个转基因的基因表达,并将双重纯合小鼠回交6代以 确保一致性。此外,我们的实验室使用pcr、使用酶联免疫吸附测定 (elisa)的蛋白质定量和组织学染色(见下文)对我们所有新开发的具 有基因表达的转基因模型进行了验证性表型研究。
[0207]
尾部体积、淋巴系闪烁造影术和组织学分析
[0208]
使用淋巴损伤区域远端的多个数字卡尺尾部圆周测量分析尾部 体积,并使用截锥公式计算,如前所述。clavin等人,am.j.physiol. heart circ.physiol.295:h2113-h2127(2008)。如前所述,也进行淋巴 系闪烁造影术,以通过将50μl过滤的锝(tc
99m
)硫胶体注入远端尾部, 定量到骶淋巴结的淋巴流。avraham等人,faseb j.27:1114-1126 (2013)。使用x-spect照相机(gamma medica,northridge,ca)在骶 淋巴结中记录衰减调整的摄取,并且利用asipro软件(cti molecularimaging,knoxville,tn)进行感兴趣区域分析。clavin等人,am.j. physiol.heart circ.physiol.295:h2113-h2127(2008)。
[0209]
对于组织学和免疫组织化学分析,收获尾部切片,在4%冰冷多 聚甲醛(sigma-aldrich,st.louis,mo)中短暂固定,使用5%乙二胺四 乙酸(edta;santa cruz,santa cruz,ca)脱钙,并且在石蜡中包埋。 使用标准技术制备苏木精和曙红切片,并在每组最少6只动物中由两 名不知情的审阅者通过在尾部的四个象限中测量皮肤和软组织的厚 度在标准化的组织学截面中量化皮下组织厚度。
[0210]
根据我们建立的技术进行免疫组织化学染色。avraham等人,am. j.pathol.177:3202-3214(2010)。将石蜡包埋的组织再水化,并使用沸 腾的柠檬酸钠(sigma-aldrich,st.louis,mo)进行抗原暴露,随后用 2%bsa/20%动物血清猝灭内源性过氧化物酶活性。将组织在4℃下 与一抗温育过夜。用于免疫组织化学染色的一抗包括lyve-1、cd45 和cd4(均来自r&d,minneapolis,mn)、f4/80、tgf-β1、psmad3、 平足蛋白(均来自abcam,cambridge,ma)、α-sma(sigma-aldrich, st.louis,mo)、inos(bd biosciences,san jose,ca)和cd3(dako northamerica,inc.carpinteria,ca)。所有二抗获自vector laboratories。 在使用mirax载玻片扫描仪(zeiss,munich,germany)扫描后分析载玻 片。使用针对小鼠i型胶原的抗体(abcam,cambridge,ma)进行i 型胶原免疫组织化学,并使用metamorph offline软件(moleculardevices,sunnyvale,ca)定量为固定阈值内的阳性染色真皮面积与总 计组织面积的比率。两名不知情的审阅者在高放大率切片上进行细胞 计数,每组最少4-6只动物且4-5个hpf/动物。
[0211]
蛋白质分析
[0212]
在淋巴损伤远端1.5cm收集用于蛋白质分析的尾组织,快速冷 冻,粉碎并用与磷酸酶和蛋白酶抑制剂(sigma-aldrich,st.louis,mo) 混合的组织提取蛋白质试剂(thermofisher scientific,waltham,ma) 提取。通过elisa分析来自样品(n=3-5个动物/
组)的20-30mg蛋白 质,以根据制造商的方案(ebioscience,san diego,ca)定量tgf-β1、 干扰素-γ(ifn-γ)和血管内皮生长因子c(vegf-c)。所有实验一式两份 进行。
[0213]
淋巴管功能的体内成像
[0214]
为了评估后肢集合淋巴管的收缩性,在后足的背面皮内注射15μl0.15mg/ml吲哚菁绿(icg)(sigma-aldrich,saint louis,mo)后,用近 红外成像(nir)记录视频。注射后允许20分钟以允许摄取到集合管中。 然后,使用定制的evos emccd照相机(life technologies,carlsbad,ca)和led光源(coolled,andover,uk)对动物进行成像。使用zeissv12 stereolumar显微镜(caliper life sciences,hopkinton,ma)获得 视频图像。每8秒钟获取图像30分钟。使用fiji软件(由国立卫生研 究所(national institutes of health),bethesda,md开发的免费开源数 据分析工具)分析淋巴泵送功能。在优势性集合管上选择感兴趣区域, 并且随时间绘制噪声扣除的荧光强度。为了评估内在泵送功能,由于 来自定位的淋巴刺激排除每个视频的最初10分钟,并且仅分析每个 视频的最后20分钟。泵送功能以每分钟脉动量化。
[0215]
基因表达pcr
[0216]
为了确认来自t细胞和髓细胞的tgf-β1敲除的表型,从这些小 鼠中收获脾脏。使用阳性选择cd3磁珠(miltenyi biotec,cambridge, ma)根据制造商的推荐从t细胞
cre
转基因小鼠的脾中分离t细胞。 类似地,使用阳性选择cd11b磁珠(miltenyi biotec,cambridge,ma) 根据制造商的推荐从髓样
cre
转基因小鼠的脾脏中分离髓样细胞。然 后,将分离的细胞置于trizol中。使用标准trizol提取方法分离 rna。chomczynski等人anal.biochem.162:156-159(1987);ribaudo 等人,curr.protocols immunol.,(coligan等人编)第10章,第10 11单元 (2001)。使用taqman逆转录试剂(applied biosystems,foster city, ca)进行逆转录,然后使用taqman universal mastermix(appliedbiosystems)和lightcycler thermocycler(roche diagnostics, indianapolis,in)进行定量逆转录酶聚合酶链式反应(rt-pcr)。相对 于gapdh标准化tgf-β1表达水平。实验一式三份进行。
[0217]
tgf-β1活性的调节
[0218]
由于以前的研究表明,吡非尼酮的主要作用机制是阻断tgf-β1 的活性,我们比较了在单独的研究中plnd后吡非尼酮治疗与 tgf-β1免疫疗法的作用。schaefer等人,eur.respir.rev.20:85-97 (2011)。重要的是,我们以前已经表明,针对tgf-β1的单克隆抗体 不仅有效中和tgf-β1的生物活性,而且这种治疗显著降低淋巴水肿, 改善淋巴功能。avraham等人,am.j.pathol.177:3202-3214(2010)。 动物经历plnd,如上文概述,并且手术后两周随机化到以每周腹膜 内递送三次在150μl pbs中稀释的5mg/kg剂量用单独的tgf-β单克 隆小鼠中和抗体(tgfmab;克隆1d11;bio-x-cell,west lebanon, nh)或吡非尼酮加tgfmab的治疗。ruzek等人,immunopharmacol. immunotoxicol.25:235-257(2003)。用以与tgfmab相同的日程表腹膜 内递送的吡非尼酮的媒介物对照或非特异性同种型抗体治疗对照动 物。
[0219]
统计分析
[0220]
使用graphpad prism(graphpad software,inc.,san diego,ca) 软件进行统计分析。student’s t检验用于比较两组之间的差异。使用 双因素anova及事后检验进行多个
时间点(淋巴系闪烁造影术)之间 的分析以比较各组。使用描述性分析和图形化方法对结果进行分析和 总结。除非另有说明,数据以平均值
±
标准差表示,p《0.05认为是显 著的。
[0221]
结论
[0222]
本研究的一个目的是分析吡非尼酮对淋巴水肿和淋巴损伤的临 床前小鼠模型中淋巴水肿治疗的功效。使用两种不同的小鼠模型,我 们显示全身性和局部吡非尼酮两者治疗建立的淋巴水肿,明显减少纤 维化和改善淋巴功能。用吡非尼酮治疗减少慢性炎症反应,并且显著 增加淋巴结切除术后淋巴集合管泵送能力。此外,吡非尼酮在预防淋 巴损伤后的纤维化中是高度有效的,并且这种响应可能继发于 tgf-β1的抑制。在我们的plnd模型中使用tgf-β1免疫疗法,我 们显示吡非尼酮作为tgf-β1抑制的主要作用,并且在我们使用的剂 量下实现了tgf-β1的最大抑制。此外,在我们的小鼠中使用我们的 淋巴水肿的尾部模型,我们显示t细胞,特别是cd4+细胞是淋巴水 肿背景中tgf-β1的主要来源。此外,我们显示,t细胞缺乏tgf-β1 减少了淋巴水肿引起的慢性炎症,如cd4
+
细胞以及th1和th2细胞 因子。
[0223]
实施例3:使用特立氟胺治疗和预防淋巴水肿
[0224]
为了测试特立氟胺在淋巴损伤后预防淋巴功能障碍中的功效,我 们使用了良好描述的腘淋巴结清扫术(plnd)小鼠模型,其中使用小 皮肤切口切除腘淋巴结。为了测试这种治疗在治疗已建立的淋巴水肿 中的功效,我们使用淋巴水肿的小鼠尾部模型,其中尾部的浅表和深 层淋巴系统被破坏,并且动物产生与临床疾病一致的组织学变化。
[0225]
将动物随机化到plnd或尾部淋巴水肿组,并且手术后2周用特 立氟胺的局部制剂(27mg/ml;tocris bioscience,minneapolis,mn) 或媒介物对照(aquaphor/甘油软膏剂)每日治疗一次,持续2-4周 (plnd后2周;尾部淋巴水肿后4周)。我们的局部制剂是与memorialsloan kettering cancer center的research pharmacy core facility合作 开发的。然后处死小鼠,并淋巴功能、纤维化、淋巴管生成都使用标 准测定法评估。
[0226]
在尾部淋巴消融后用局部特立氟胺治疗小鼠显著降低淋巴水肿 和纤维脂肪沉积,即疾病的组织学标志(图24)。虽然对照小鼠具有明 显的尾部肿胀和纤维化(由不对称的胶原沉积引起的固定的“j构造”), 特立氟胺治疗的小鼠在淋巴损伤后6周具有基本正常外观的尾部(图 24a)。这些大体变化对应于特立氟胺治疗的小鼠中尾部体积减少几乎 6倍(图24b)。对照小鼠尾部的组织学横截面显示出纤维脂肪组织的 显著积聚;相比之下,特立氟胺治疗的小鼠具有最小的脂肪组织沉积 (图24c,24d)。该发现通过i型胶原免疫荧光染色证实,证明在对 照动物中胶原纤维包被浅表淋巴系统并且在损伤后6周在特立氟胺 治疗的动物中胶原沉积明显减少(图25a,25b)。此外,特立氟胺减 少了围绕集合淋巴系统的α平滑肌细胞的增殖,从而维持了这些管的 更正常的解剖结构(图25c,25d)。
[0227]
为了确定特立氟胺疗法是否减少cd4+细胞的浸润,我们接下来 使用靶向cd4的免疫荧光抗体分析来自对照和治疗小鼠的组织切片 (图26a,26b)。与对照相比,该分析证明了从特立氟胺治疗的动物 收获的cd4+细胞浸润尾组织显著减少。事实上,特立氟胺疗法将 cd4+细胞浸润数减少了多于8倍(p《0.001)。
[0228]
最近的研究显示了,cd4+细胞产生有力的抗淋巴管生成细胞因 子,包括干扰素γ、白细胞介素-4(il4)和il13。与此一致,我们发现 用特立氟胺治疗经历plnd的动物显著地增加了(4.5倍;p《0.001)绕 过损伤区的侧支淋巴管的形成,如使用吲哚菁绿(icg)近红
外成像评 估(图27a)。类似地,与对照相比,在尾部淋巴消融后用特立氟胺治 疗小鼠导致跨过损伤区的新形成的淋巴系统的显著增加(图27b)。特 立氟胺动物中侧支淋巴系统的再生显著降低了真皮中淋巴管的渗漏, 使更多量的间质液体能够在近端传播(图28)。
[0229]
特立氟胺治疗小鼠现有淋巴系统中新形成的淋巴系统和减少的 病理改变转换成明显改善的淋巴功能,如通过树突细胞(dc)迁移分 析。dc通过淋巴管从外周组织迁移到局部淋巴结以呈递抗原并促进 适应性免疫应答。使用标准测定法(fitc绘画)分析plnd后的特立 氟胺动物中的dc运输证明与对照相比,已经运输到腹股沟淋巴结(腘 淋巴结后一系列中的下一淋巴结)的dc数目增加了多于5倍(图29a, 29b)。由于dc只能通过淋巴系统运输,此发现提供了特立氟胺增加 淋巴功能的实质证据。
[0230]
集合淋巴管使用通过周围平滑肌细胞的活性收缩和防止回流的 单向阀在近端使淋巴传播。与我们发现特立氟胺增加淋巴转运功能并 减少淋巴管周围的α平滑肌细胞的纤维化/增殖相一致,我们发现这 种治疗也显著增加了集合淋巴泵送(图30)。plnd后特立氟胺治疗几 乎使主要后肢集合淋巴系统的频率翻倍,从而增加淋巴液的近端传 播。
[0231]
我们第一次描述使用特立氟胺预防和治疗淋巴水肿。我们的研究 结果显示了,淋巴损伤后用特立氟胺治疗实质性降低淋巴水肿和纤维 脂肪组织沉积。此外,我们显示这种作用与cd4+t细胞的浸润减少、 增加的侧支淋巴系统形成、降低的淋巴泄漏和改善的淋巴功能相关。 这些发现是新颖的,因为它们为淋巴水肿提供了靶向疗法,所述淋巴 水肿以前仅用姑息干预治疗。
[0232]
实施例4:使用卡托普利治疗和预防淋巴水肿
[0233]
如上所述,我们使用plnd模型测试卡托普利在预防淋巴损伤后 淋巴功能障碍中以及在治疗使用小鼠尾部模型建立的淋巴水肿中的 功效。动物用卡托普利(5%)或媒介物对照(凡士林或aquaphor/甘油软 膏剂)的局部制剂每天一次治疗2-4周(plnd后2周,尾部淋巴水肿 后4周)。然后处死小鼠,并使用标准测定法评估淋巴功能、纤维化 和淋巴管生成。用局部卡托普利治疗导致plnd模型中淋巴功能改善 和尾部模型淋巴水肿减少。图31-53中显示了结果。
[0234]
实施例5:使用药物组合治疗和预防淋巴水肿
[0235]
使用plnd和小鼠尾部模型,如实施例1-4所述,对动物施用包 含抗纤维化药物或媒介物对照组合的局部制剂。治疗组合物示于表1 中。
[0236]
表1.用于治疗和预防淋巴水肿的药物组合
[0237]
[0238][0239]
小鼠每日一次治疗2-4周(plnd后2周;尾部淋巴水肿后4周)。 然后处死小鼠,并淋巴功能、纤维化、淋巴管生成都使用标准测定法 评估。在plnd模型中,与用单一抗纤维化药物治疗相比,用局部抗 纤维化药物的组合治疗导致改善的淋巴功能。同样,在尾部模型中, 与用单一抗纤维化药物治疗相比,用局部抗纤维化药物的组合治疗导 致淋巴水肿降低。除了更有效之外,组合产生协同效应,使得组合中 施用的每种药物的有效剂量低于单独施用的每种药物的有效剂量。
[0240]
***
[0241]
具体实施方案的前述描述将充分揭示本发明的一般性质,其他人 在不偏离本发明的一般构思的情况下,可以通过应用本领域技术范围 内的知识,为了各种应用而无需过度实验容易地修改和/或改变此类 具体实施方案。因此,基于本文呈现的教导和指导,此类改变和修改 旨在在所公开的实施方案的等同方案的含义和范围内。应当理解,本 文中的措词或术语是为了描述而不是限制的目的,使得本说明书的术 语或措辞将由技术人员根据教导和指导来解释。本发明由所附权利要 求书进一步描述。
[0242]
本发明提供了以下内容:
[0243]
1.一种药物组合物,所述药物组合物包含:
[0244]
(i)有效量的一种或多种抗t细胞剂;和
[0245]
(ii)有效量的一种或多种抗tgf-β1剂和/或有效量的一种或多 种抗血管紧张肽剂;
[0246]
其中所述组合物被配制用于局部施用。
[0247]
2.根据项1所述的药物组合物,其中所述抗t细胞剂选自由以 下组成的组:他克莫司、特立氟胺、来氟米特、环孢霉素、吡美莫司、 地尼白介素2和巴利昔单抗。
[0248]
3.根据前述项中任一项所述的药物组合物,其中所述抗tgf-β 1剂是吡非尼酮。
[0249]
4.根据前述项中任一项所述的药物组合物,其中所述抗血管紧 张肽剂是血管紧张肽转化酶(ace)激动剂。
[0250]
5.根据前述项中任一项所述的药物组合物,其中所述抗血管紧 张肽剂选自由以下组成的组:卡托普利、佐芬普利、依那普利、赖诺 普利、雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、群多 普利、西拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎地沙 坦、替米沙坦、缬沙坦和非马沙坦。
[0251]
6.根据前述项中任一项所述的药物组合物,所述药物组合物包 含他克莫司。
[0252]
7.根据前述项中任一项所述的药物组合物,所述药物组合物包 含约0.01%至约1%他克莫司。
[0253]
8.根据前述项中任一项所述的药物组合物,所述药物组合物包 含约0.05至约0.2%他克莫司。
[0254]
9.根据前述项中任一项所述的药物组合物,所述药物组合物包 含吡非尼酮。
[0255]
10.根据前述项中任一项所述的药物组合物,所述药物组合物包 含约0.1mg/ml至约5mg/ml吡非尼酮。
[0256]
11.根据前述项中任一项所述的药物组合物,所述药物组合物包 含约0.5mg/ml至约2mg/ml吡非尼酮。
[0257]
12.根据前述项中任一项所述的药物组合物,所述药物组合物包 含特立氟胺。
[0258]
13.根据前述项中任一项所述的药物组合物,所述药物组合物包 含约10mg/ml至约50mg/ml特立氟胺。
[0259]
14.根据前述项中任一项所述的药物组合物,所述药物组合物包 含约20mg/ml至约30mg/ml特立氟胺。
[0260]
15.根据项1至11中任一项所述的药物组合物,所述药物组合 物包含来氟米特。
[0261]
16.根据项15所述的药物组合物,所述药物组合物包含约1%至 约20%来氟米特。
[0262]
17.根据项16所述的药物组合物,所述药物组合物包含约5%至 约15%来氟米特。
[0263]
18.根据前述项中任一项所述的药物组合物,所述药物组合物包 含卡托普利。
[0264]
19.根据项18所述的药物组合物,所述药物组合物包含约1%至 约20%卡托普利。
[0265]
20.根据项19所述的药物组合物,所述药物组合物包含约5%至 约15%卡托普利。
[0266]
21.根据前述项中任一项所述的药物组合物,其中所述组合物为 选自以下的形式:软膏剂、乳膏、洗剂、糊剂、凝胶、摩丝、泡沫、 漆、混悬剂、液体和喷雾剂。
[0267]
22.根据项21所述的药物组合物,其中所述组合物为软膏剂的 形式。
[0268]
23.根据前述项中任一项所述的药物组合物,其用于治疗或预防 水肿。
[0269]
24.根据项23所述的药物组合物,其中所述水肿是淋巴水肿。
[0270]
25.一种治疗或预防水肿的方法,所述方法包括对有此需要的受 试者施用药物组合物,所述药物组合物包含有效量的一种或多种选自 由以下组成的组的药物:他克莫司、特立氟胺、来氟米特、环孢霉素、 吡美莫司、地尼白介素2、巴利昔单抗、吡非尼酮、卡托普利、佐芬 普利、依那普利、赖诺普利、雷米普利、喹那普利、培哚普利、贝那 普利、咪达普利、群多普利、西拉普利、福辛普利、氯沙坦、厄贝沙 坦、奥美沙坦、坎地沙坦、替米沙坦、缬沙坦和非马沙坦。
[0271]
26.根据项25所述的方法,其中所述药物组合物包含:
[0272]
(i)有效量的一种或多种选自由以下组成的组的抗t细胞剂:他 克莫司、特立氟胺、来氟米特、环孢霉素、吡美莫司、地尼白介素2 和巴利昔单抗;和
[0273]
(ii)有效量的一种或多种抗tgf-β1剂和/或抗血管紧张肽剂, 其选自由以下组成的组:吡非尼酮、卡托普利、佐芬普利、依那普利、 赖诺普利、雷米普利、喹那普利、培哚普利、贝那普利、咪达普利、 群多普利、西拉普利、福辛普利、氯沙坦、厄贝沙坦、奥美沙坦、坎 地沙坦、替米沙坦、缬沙坦和非马沙坦。
[0274]
27.根据项25或项26所述的方法,其中所述药物组合物包含他 克莫司。
[0275]
28.根据项25至27中任一项所述的方法,其中所述药物组合物 包含吡非尼酮。
[0276]
29.根据项25至28中任一项所述的方法,其中所述药物组合物 包含特立氟胺。
[0277]
30.根据项25至28中任一项所述的方法,其中所述药物组合物 包含来氟米特。
[0278]
31.根据项25至30中任一项所述的方法,其中所述药物组合物 包含卡托普利。
[0279]
32.根据项25至31中任一项所述的方法,其中局部施用所述药 物组合物。
[0280]
33.根据项32所述的方法,其中所述药物组合物包含0.01%至 1%他克莫司。
[0281]
34.根据项33所述的方法,其中所述药物组合物包含0.05至 0.2%他克莫司。
[0282]
35.根据项32至34中任一项所述的方法,其中所述药物组合物 包含0.1mg/ml至5mg/ml吡非尼酮。
[0283]
36.项35所述的方法,其中所述药物组合物包含0.5mg/ml至2 mg/ml吡非尼酮。
[0284]
37.根据项32至36中任一项所述的方法,其中所述药物组合物 包含10mg/ml至50mg/ml特立氟胺。
[0285]
38.根据项37所述的方法,其中所述药物组合物包含20mg/ml 至30mg/ml特立氟胺。
[0286]
39.根据项32至36中任一项所述的方法,其中所述药物组合物 包含1%至20%来氟米特。
[0287]
40.根据项39所述的方法,其中所述药物组合物包含5%至15% 来氟米特。
[0288]
41.根据项32至40中任一项所述的方法,其中所述药物组合物 为选自以下的形式:软膏剂、乳膏、洗剂、糊剂、凝胶、摩丝、泡沫、 漆、混悬剂、液体和喷雾剂。
[0289]
42.根据项41所述的方法,其中所述药物组合物为软膏剂的形 式。
[0290]
43.根据项23至42中任一项所述的药物组合物或方法,其中一 天至少一次局部施用所述药物组合物。
[0291]
44.根据项43所述的药物组合物或方法,其中一天至少两次局 部施用所述药物组合物。
[0292]
45.根据项23至44中任一项所述的药物组合物或方法,其中在 淋巴损伤的约6周内预防性施用所述药物组合物。
[0293]
46.根据项45所述的药物组合物或方法,其中在淋巴损伤的约2 周内预防性施用所述药物组合物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1