抗肿瘤药物在制备溶瘤病毒抗肿瘤增效剂或耐药逆转剂方面的应用的制作方法
抗肿瘤药物在制备溶瘤病毒抗肿瘤增效剂或耐药逆转剂方面的应用
1.本技术为申请号201810824134.3、申请日2018-07-25、发明名称“增效的抗肿瘤药物”的中国发明专利申请的分案申请。
技术领域
2.本发明属于生物医药领域,涉及抗肿瘤药物如atm抑制剂、dhfr抑制剂和/或iκb/ikk抑制剂与溶瘤病毒的联合在制备抗肿瘤药物中的应用。
背景技术:
3.溶瘤病毒(oncolytic virus)是一类选择性的感染并杀伤肿瘤细胞,而不损伤正常细胞的可复制病毒。溶瘤病毒疗法(oncolytic virotherapy)是一种创新的肿瘤靶向治疗策略,它利用天然的或经基因工程改造的病毒选择性的感染肿瘤细胞,并在肿瘤细胞中复制,达到靶向性溶解、杀伤肿瘤细胞的作用,但是对正常细胞没有损伤。
4.溶瘤病毒m1是一种披膜病毒科甲病毒属盖塔样病毒,分离于中国海南岛库蚊属蚊虫。我们前期研究表明病毒m1的选择性高,安全性良好。其在制备抗肿瘤药物方面的应用已经记载于中国发明专利申请201410425510.3。m1病毒能选择性引起肿瘤细胞死亡而不影响正常细胞存活,其在抗肿瘤方面具有非常好的应用前景。然而,不同肿瘤对m1病毒的敏感性不一,对于某些肿瘤,m1病毒单独用药时,溶瘤作用还不够理想。例如中国发明专利申请201410425510.3所记载的,m1作为抗肿瘤药物使用时,对于结直肠癌、肝癌、膀胱癌和乳腺癌的效果不如胰腺癌、鼻咽癌、前列腺癌和黑色素瘤明显;而胶质瘤、宫颈癌、肺癌则更其次;而胃癌则最不显著。
5.筛选增加溶瘤病毒肿瘤治疗效果的化合物有望增加溶瘤病毒的抗瘤谱及抗瘤强度。此前中国发明专利申请201510990705.7中,将大黄酚及其衍生物作为溶瘤病毒的抗瘤增效剂,二者组合可以将肿瘤细胞的存活率降低至39.6%,但其抗癌强度存在很大的进步空间。此外,这种联合应用的作用机制尚不明确,也未能知晓未被明确报道可增效溶瘤病毒的其他物质,有哪些可以与其产生增效作用,以及增效的幅度。
技术实现要素:
6.本发明的目的之一在于提供一种溶瘤病毒抗瘤的增效剂。
7.本发明的另一个目的在于提供能够选择性地增强溶瘤病毒对肿瘤细胞的杀伤作用,而不影响正常细胞的抗癌增效剂。
8.本发明的另一个目的在于提供一种抗肿瘤药物在制备甲病毒抗瘤增效剂方面的应用。
9.本发明的另一个目的在于提供一种抗瘤药物组合物或药品套装,其可以使得溶瘤病毒发挥更好的抗瘤效果。
10.本发明的另一个目的在于提供一种针对溶瘤病毒不敏感的肿瘤,安全有效的溶瘤
病毒增效药物。
11.发明通过以下技术方案实现上述目的:
12.发明人通过研究、筛选发现,发现了多种靶点的抗肿瘤药物,可以增强溶瘤病毒的溶瘤效果。所述的靶点可以是atm(ataxia-telangiectasia mutated)、alk(anaplastic lymphoma kinase)、akt(protein kinaseb)、bcr-abl(breakpoint cluster region gene-abelson murine leukemia viral oncogene homolog 1)、chk(checkpoint kinases)、c-met(hepatocyte growth factor receptor)、dna-pk、dna synthesis、dhfr(dihydrofolate reductase)、egfr(epidermal growth factor receptor)、fgfr(fibroblast growth factor receptor)、fak(focal adhesion kinase)、gsk-3(glycogen synthase kinase-3)、hdac(histone deacetylase)、hedgehog、hsp90(heat shock protein 90)、iκb/ikk(inhibitor of kappa b/inhibitor of kappa b kinase)、jak(janus kinase)、kinesin、mek(mitogen-activated protein kinase kinase)、mtor(the mammalian target of rapamycin)、microtubule associated、mutant pan raf、wnt/beta-catenin、pdgfr(platelet derived growth factor receptor)、proteasome、pi3k(phosphoinositde 3-kinase)、pkc(protein kinase c)、p38 mapk(p38 mitogen-activated protein kinases)、plk(polo like kinase)、syk(spleen associated tyrosine kinase)、topoisomerase、tgf-beta/smad(transforming growth factor-beta/smad)、vegfr(vascular endothelial growth factor)。不同的靶点的抗癌药物,显示出不同强度的溶瘤病毒的溶瘤增强效果。其中,增效效果最为突出的为dna依赖性蛋白激酶(dna-dependent protein kinase,dna-pk)。dna依赖性蛋白激酶(dna-dependent protein kinase,dna-pk),是由3个亚基组成的丝/苏氨酸蛋白激酶,属于磷脂酰肌醇-3激酶相关激酶家族(phosphatidylinositol 3-kinase-related kinases,pikk),是dna损伤修复的关键酶,主要参与非同源末端连接来修复断裂的dna双链,此外dna-pk还参与了电离辐射诱导的凋亡信号转导通路,免疫细胞v(d)j重组、免疫细胞分化、胰岛素刺激下的细胞应答等过程,具有维持端粒稳定性的功能。已有多篇文献报道dna-pk在肿瘤细胞中高表达,抑制dna-pk能够阻碍dna的修复从而诱导肿瘤细胞死亡。
13.发明人通过用dna-pk干扰片段(sirna)抑制这个基因的表达,降低相应蛋白的表达量,结果发现,单独干扰dna-pk和未干扰并未引起细胞形态病变,同时单独应用m1病毒也不引起细胞形态病变,只有干扰dna-pk联合应用m1病毒组引起了显著细胞形态病变。
14.发明人进一步通过抑制dna-pk可以显著增强溶瘤病毒的溶瘤效应。发明人采用了一系列抑制dna-pk活性化合物(例如nu7441、nu7026、ku-0060648等)协同溶瘤病毒尤其是m1病毒作用于肿瘤细胞,实验结果发现,这些dna-pk活性化合物可以协同溶瘤病毒增强抗肿瘤效应。
15.本发明首次发现,dna-pk抑制剂等多种靶点的抗肿瘤药物可以作为溶瘤病毒的抗瘤增效剂/耐药逆转剂。
16.本发明提供了抗肿瘤药物在制备溶瘤病毒抗瘤增效剂/耐药逆转剂方面的应用。
17.本发明还提供了溶瘤病毒在制备抗肿瘤药物增效剂或耐药逆转剂方面的应用。
18.所述的抗肿瘤药物选自atm抑制剂、alk抑制剂、akt抑制剂、bcr-abl抑制剂、chk抑制剂、c-met抑制剂、dna synthesis抑制剂、dhfr抑制剂、egfr抑制剂、fgfr抑制剂、fak抑制
剂、gsk-3抑制剂、hdac抑制剂、hedgehog抑制剂、hsp90抑制剂、iκb/ikk抑制剂、jak抑制剂、kinesin抑制剂、mek抑制剂、mtor抑制剂、microtubule associated抑制剂、mutant pan raf抑制剂、wnt/beta-catenin抑制剂、pdgfr抑制剂、proteasome抑制剂、pi3k抑制剂、pkc抑制剂、p38mapk抑制剂、plk抑制剂、syk抑制剂、topoisomerase抑制剂、tgf-beta/smad抑制剂、vegfr抑制剂和dna-pk抑制剂中的一种或多种。
19.上述这些抗肿瘤药物,可以是抑制上述所列举靶点的生成、或者抑制靶点活性、或者降解这些靶点的物质或者工具,包括化学的生物的物质或者工具等。作为示范性的实施方式,所述的atm抑制剂选自ku-60019或cp-466722;所述的alk抑制剂选自crizotinib;所述的akt抑制剂选自mk-2206;所述的bcr-abl抑制剂选自ponatinib;所述的chk抑制剂选自azd7762;所述的c-met抑制剂选自su11274;所述的dna synthesis抑制剂选自gemcitabine或oxaliplatin;所述的dhfr抑制剂选自pemetrexed;所述的egfr抑制剂选自lapatinib ditosylate或gefitinib;所述的fgfr抑制剂选自pd173074;所述的fak抑制剂选自pf-562271;所述的gsk-3抑制剂选自chir-99021 hcl;所述的hdac抑制剂选自vorinostat;所述的hedgehog抑制剂选自vismodegib;所述的hsp90抑制剂选自ganetespib或auy922;所述的iκb/ikk抑制剂选自tpca-1;所述的jak抑制剂选自tofacitinib或cyt387;所述的kinesin抑制剂选自sb743921;所述的mek抑制剂选自gsk1120212;所述的mtor抑制剂选自rapamycin;所述的microtubule associated抑制剂选自paclitaxel或docetaxel;所述的mutant pan raf抑制剂选自vemurafenib;所述的wnt/beta-catenin抑制剂选自fh535;所述的pdgfr抑制剂选自imatinib;所述的proteasome抑制剂选自bortezomib;所述的pi3k抑制剂选自cal-101或gdc-0941;所述的pkc抑制剂选自sotrastaurin;所述的p38 mapk抑制剂选自birb 796;所述的plk抑制剂选自bi6727;所述的syk抑制剂选自r935788;所述的topoisomerase抑制剂选自doxorubicin;所述的tgf-beta/smad抑制剂选自ly2157299;所述的vegfr抑制剂选自axitinib或vandetanib。
20.耐药逆转剂是指,当采用一些溶瘤病毒作为抗肿瘤药物用于治疗肿瘤时,存在着一些肿瘤对溶瘤病毒并不太敏感,或者说这些肿瘤对溶瘤病毒具有抗性,此时,可以采用与抗肿瘤药物如dna-pk抑制剂(作为耐药逆转剂)联用溶瘤病毒的方式,以逆转肿瘤对所述溶瘤病毒的抗性;或者,反过来讲,当一些抗肿瘤药物用于治疗肿瘤时,存在着一些肿瘤对药物并不太敏感,或者说这些肿瘤对该药物具有抗性,此时,可以采用溶瘤病毒(作为耐药逆转剂)与这些药物联用的方式,以逆转肿瘤对所述药物的抗性。
21.作为一种优选的实施方式,本发明尤其提供了dna-pk抑制剂在制备溶瘤病毒抗瘤增效剂/耐药逆转剂方面的应用。
22.所述dna-pk抑制剂,是指可以抑制dna-pk活性、或者抑制其中任意一个亚基(例如,dna-pkcs亚基、ku70亚基或ku80亚基)的活性或表达、或者阻断亚基的组装、或降解dna-pk的物质。
23.所述dna-pk抑制剂包括截至目前所公开的dna-pk抑制剂。可能地,未来可能会有一些其他被研究出具有类似的抑制dna-pk作用的dna-pk抑制剂,这些dna-pk抑制剂与溶瘤病毒的联用也是在本发明的范围之内。
24.作为优选的实施方式,所述的dna-pk抑制剂包括但不限于以下化合物或其具有dna-pk抑制作用的衍生物、或其药学上可接受的盐、溶剂化物、互变异构体、同分异构体:
nu7441(ku-57788)、nu7026(ly293646)、ku-0060648、lturm34、cc-115、pik-90、wortmannin(渥曼青霉素)、ly302341、m3814(nedisertib)、sf2523、compound 401。化合物的获取方式可选但不限于:自己化学分离或合成或者从商业途径购买。
25.在本发明的一些实施例中,dna-pk蛋白抑制剂为nu7441(式1)、nu7026(式2)、ku0060648(式3)或它们的组合。
[0026][0027][0028]
作为可选的方式,dna-pk蛋白抑制剂还可以是lturm34(式4)、cc-115(式5)、pik-90(式6)、wortmannin(渥曼青霉素,式7)、ly302341(式8)、m3814(nedisertib,式9)、sf2523(式10)、compound 401(式11)等。
[0029][0030][0031]
在本发明一些优选的实施例中,dna-pk抑制剂还包括针对dna-pk基因表达抑制工
具,包括但不限于基因干扰、基因编辑、基因沉默或基因敲除等工具手段或材料。
[0032]
作为一种可选的实施方式,所述dna-pk基因表达抑制工具选自dna、rna、pna、dna-rna杂合体中的一种或几种。它们可以是单链的或双链的。
[0033]
dna-pk抑制剂可包括一些小的抑制核酸分子,例如短干扰rna(sirna),双链rna(dsrna),microrna(mirna),核酶,以及小发夹rna(shrna),这些都能减弱或消除dna-pk任一亚基的基因表达。
[0034]
在本发明的一个实施例中,所述的dna-pk抑制剂选自基因干扰材料。作为更优选的实施方式,所述的dna-pk抑制剂选自seq id no:1、seq id no:2或seq id no:3中的任意一条。
[0035]
这些小的抑制核酸分子可能包括第一、第二链,二者杂交彼此形成一个或多个双链区,每条链大约18~28个核苷酸的长度,大约18~23个核苷酸的长度,或者18,19,20,21,22个核苷酸的长度。另外,单链也可能包含能够相互杂交形成双链的区域,例如在shrna分子中。
[0036]
这些小的抑制核酸分子在保持这种减弱或消除dna-pk的表达的能力时,可能包括修饰性核苷酸。修饰性核苷酸可用于改善体外或体内特性,如稳定性、活性和/或生物利用度。这些修饰性核苷酸可能含有脱氧核苷酸、2
’‑
甲基核苷酸、2
’‑
脱氧-2
’‑
氟核苷酸、4
’‑
三核苷酸、锁核酸(lna)核苷酸和/或2
’‑
o-甲氧乙基核苷酸等。小的抑制核酸分子,如短干扰rna(sirna),也可能含有5
’‑
和/或3
’‑
帽结构,以此来防止核酸外切酶对其降解。
[0037]
在一些实施例中,小抑制核酸分子组成的双链核酸含有两端钝、或悬垂的核苷酸。其他核苷酸可能包括会导致错位、凸起、循环、或摆动碱基对的核苷酸。小抑制核酸分子可以设计配方以便施用,例如,通过脂质体包裹,或掺入其他载体(如可生物降解聚合物水凝胶,或环糊精)。
[0038]
在本发明另一些优选的实施例中,所述的dna-pk抑制剂还包括抗体、抗体功能性片段、肽类、和拟肽类中的一种或几种。例如,结合至dna-pk任意亚基的任意功能结构域的抗体、抗体功能性片段、肽类、或拟肽。例如,dna-pk的dna结合区、催化功能区或ku蛋白结合区。其中,所述的抗体可能是单克隆抗体,多克隆抗体,多价抗体,多特异性抗体(例如:双特异性抗体),和/或连接在dna-pk上的抗体片段。该抗体可以是嵌合抗体、人源化抗体、cdr移植抗体或人型抗体。抗体片段可以是,例如,fab,fab’,f(ab’)2,fv,fd,单链fv(scfv),具二硫键的fv(sdfv),或vl、vh结构域。抗体可能是一个共轭的形式,例如,结合一个标签、一个可检测标记,或一种细胞毒性剂。抗体可能是同型igg(例如:igg1、igg2、igg3、igg4)、iga、igm、ige或igd。
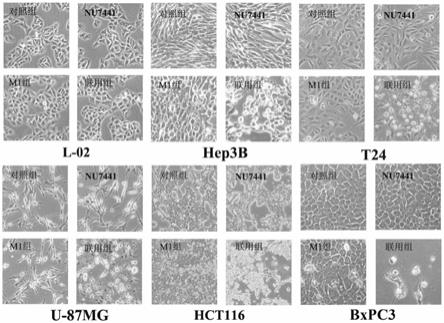
[0039]
在本发明另一优选的实施例中,dna-pk蛋白抑制剂为dna-pk的干扰rna片段。作为更优选的实施方式,所述的dna-pk抑制剂选自seq id no:1、seq id no:2或seq id no:3中的任意一条。
[0040]
所述的溶瘤病毒选自甲病毒、盖塔病毒、腺病毒、牛痘病毒、麻疹病毒、水泡口炎病毒、和单纯性疱疹病毒中的一种或多种;优选为甲病毒,更优选地,选自m1病毒、盖塔病毒或者它们的组合。
[0041]
单个溶瘤病毒株也可以施用。在其他实施方案中,也可使用多种毒株和/或类型的溶瘤病毒。
[0042]
在一些实施例中,m1病毒是保藏编号cctcc v201423(保藏于中国典型培养物保藏中心,保藏日期2014年7月17日)的m1病毒。该保藏的病毒在申请号201410425510.3的中国专利申请中也有记载。作为很可能来源于同一毒株的病毒,genbank accession no.ef011023记录了一株m1的序列。盖塔病毒作为与m1病毒具有高达97.8%(wen et al.virus genes.2007;35(3):597-603)同源性的病毒,两者具有很高的同一性,m1病毒也被一些文献归类为类盖塔病毒。本发明所述的甲病毒包括与所述m1毒株序列同一性高达97.8%或以上的m1或盖塔病毒。
[0043]
本发明所说的溶瘤病毒可以尤其地指目前已有的溶瘤病毒,但也不排除一些自然变异或者进行了突变、修饰、序列增加、减少等的病毒。这些变异、突变、修饰、序列增加或减少的病毒有可能具有类似的溶瘤作用、或甚至是稍微降低、或者增强的作用等等。这些情况同在本发明的保护范围之内。所说的抑制dna-pk抑制剂为能起到敲低或影响dna-pk任意亚基基因表达或者任一亚基蛋白量或蛋白活性,或者阻断亚基的组装,或者降解dna-pk的物质(例如化合物、或氨基酸序列、核苷酸序列等)或工具等。本领域技术人员可以对其抑制化合物或者基因工具进行修饰、替换、改变等,作为可选的方式,这些情况也属于本发明的保护范围。
[0044]
本发明还提供了抗肿瘤药物及溶瘤病毒的组合在制备治疗肿瘤药物中的应用。
[0045]
本发明还提供一种用于治疗肿瘤的药物组合物,其包含如上所述的抗肿瘤药物以及溶瘤病毒,尤其是包含dna-pk抑制剂以及溶瘤病毒。
[0046]
本发明还提供用于治疗肿瘤的药品套装,其包含如上所述的抗肿瘤药物以及溶瘤病毒,尤其是包含dna-pk抑制剂以及溶瘤病毒。
[0047]
药品套装区别于组合物的地方在于,抗肿瘤药物如dna-pk抑制剂不同于溶瘤病毒的剂型,而是独立包装(例如:药丸、或胶囊、或药片或安剖瓶中,含有抗肿瘤药物如dna-pk抑制剂;另外的药丸、或胶囊、或药片或安剖瓶中,含有溶瘤病毒)。在一些实施例中,溶瘤病毒、抗肿瘤药物如dna-pk抑制剂,以及溶瘤病毒和抗肿瘤药物如dna-pk抑制剂的组合,也可含一种或多种佐剂。所述的佐剂是指在药物组成中,可辅助药物疗效的成分。药品套装也可以包含独立包装的抗肿瘤药物如dna-pk抑制剂,以及独立包装的溶瘤病毒。药物套装中抗肿瘤药物如dna-pk抑制剂,以及溶瘤病毒的施用,可以是同时施用或者是以任意的前后顺序施用,例如在溶瘤病毒之前施用抗肿瘤药物如dna-pk抑制剂,或者在溶瘤病毒之后施用抗肿瘤药物如dna-pk抑制剂,或者两者同时施用。在各种实施例中,患者可以是哺乳动物。在一些实施例中,哺乳动物可以是人。
[0048]
作为一种实施方式,所述的药物组合物或药品套装还可以包括药学上可接受的载体。
[0049]
作为一种实施方式,所述的药物组合物或者药品套装的剂型包括但不限于冻干粉针、注射剂、片剂、胶囊、或贴剂等剂型;优选为注射剂型;更优选为静脉注射剂。
[0050]
作为优选的实施方式,所述的药品套装包含独立包装的抗肿瘤药物如dna-pk蛋白抑制剂或其衍生物或它们的组合,以及独立包装的溶瘤病毒。
[0051]
作为一种优选的实施方式,所述的抗肿瘤药物包括但不限于ku-60019、cp-466722、crizotinib、mk-2206、ponatinib、azd7762、su11274、gemcitabine、oxaliplatin、pemetrexed、lapatinibditosylate、gefitinib、pd173074、pf-562271、chir-99021hcl、
vorinostat、vismodegib、ganetespib、auy922、tpca-1、tofacitinib、cyt387、sb743921、gsk1120212、rapamycin、paclitaxel、docetaxel、vemurafenib、fh535、imatinib、bortezomib、cal-101、gdc-0941、sotrastaurin、birb796、bi6727、r935788、doxorubicin、ly2157299、axitinib、vandetanib、nu7441、nu7026、ku-0060648、lturm34、cc-115、pik-90、wortmannin、ly302341、m3814、sf2523、compound401中的一种或多种,以及或它们药学上可接受的盐、溶剂化物、互变异构体、同分异构体。
[0052]
作为优选的实施方式,所述的抗肿瘤药物包括但不限于nu7441(式1)、nu7026(式2)、ku0060648(式3)、lturm34(式4)、cc-115(式5)、pik-90(式6)、wortmannin(渥曼青霉素,式7)、ly302341(式8)、m3814(nedisertib,式9)、sf2523(式10)、compound 401(式11)等抑制dna-pk蛋白活性的化合物。或者针对dna-pk基因表达抑制工具,包括但不限于基因干扰、基因沉默、以及基因编辑或敲除等工具手段或材料。dna-pk抑制剂可优选nu7441、ku0060648、nu7026或其组合。
[0053]
在组合物或药品套装中,抗肿瘤药物(例如nu7441、ku0060648、nu7026、lturm34、cc-115、pik-90、wortmannin、ly302341、m3814、sf2523或compound 401等)与溶瘤病毒的配比可选地为:0.01~200mg:103~109pfu;优选0.1~200mg:104~109pfu;进一步优选0.1~100mg:105~109pfu;
[0054]
优选使用剂量为:抗肿瘤药物(例如nu7441、ku0060648、nu7026、lturm34、cc-115、pik-90、wortmannin、ly302341、m3814、sf2523或compound 401等)使用范围为0.01mg/kg至200mg/kg,同时溶瘤病毒使用滴度为moi从103至109(pfu/kg);更优选dna-pk抑制剂(例如nu7441、ku0060648、nu7026、lturm34、cc-115、pik-90、wortmannin、ly302341、m3814、sf2523或compound 401等)使用范围为0.1mg/kg至200mg/kg,同时溶瘤病毒使用滴度为moi从104至109(pfu/kg);还更优选dna-pk抑制剂(例如nu7441、ku0060648、nu7026、lturm34、cc-115、pik-90、wortmannin、ly302341、m3814、sf2523和compound 401等)使用范围为0.1mg/kg至100mg/kg,同时溶瘤病毒使用滴度为moi从105至109(pfu/kg)。
[0055]
在一个实施方式中,所述溶瘤病毒选自甲病毒、盖塔病毒、腺病毒、牛痘病毒、麻疹病毒、水泡口炎病毒和单纯性疱疹病毒中的一种或几种。优选地,所述溶瘤病毒为甲病毒,更优选m1病毒、盖塔病毒或者它们的组合。
[0056]
在一个实施方式中,所述肿瘤为实体瘤或血液瘤。在一个实施方式中,所述实体瘤为肝癌、结直肠癌、膀胱癌、乳腺癌、宫颈癌、前列腺癌、胶质瘤、黑色素瘤、胰腺癌、鼻咽癌、肺癌、或胃癌。在优选的实施方式中,所述肿瘤为对溶瘤病毒不敏感的肿瘤。在更优选的实施方式中,所述肿瘤为对m1溶瘤病毒不敏感的肿瘤。
[0057]
与现有技术相比,本发明具有以下有益效果:
[0058]
本发明发现了抗肿瘤药物如dna-pk抑制剂(例如nu7441或ku0060648或nu7026等)可以增加溶瘤病毒的抗肿瘤效应,以提高溶瘤病毒作为抗肿瘤药物时的治疗有效性。细胞学实验证明溶瘤病毒分别和dna-pk抑制剂,(例如nu7441或ku0060648或nu7026等)联合应用,可显著引起肿瘤细胞的形态学病变,从而显著增强对肿瘤细胞的抑制作用。
[0059]
并且出乎意料地,nu7441、ku0060648或nu7026等作为抗病毒化合物,与溶瘤病毒联用时,反而能增强病毒的溶瘤能力。例如,在实施例3中,抗病毒化合物nu7441或ku0060648或nu7026和m1病毒联合应用作用于人结直肠细胞癌hct116株,显著降低肿瘤细
胞生存率。在实施例2和3中,当m1病毒(moi=1)单独处理结直肠癌细胞时,肿瘤细胞存活率为93.8%;以1μm的nu7441处理结直肠癌细胞时,肿瘤细胞存活率为76.7%;而当以1μm的nu7441与同样滴度的m1病毒联用时,细胞形态病变的肿瘤细胞明显增加,肿瘤细胞存活率大幅下降至23.1%。与单用m1病毒的抗肿瘤效果相比,nu7441与m1联用时,溶瘤效果显著提升。可见,nu7441与m1联用时大幅提升的溶瘤效果,是得益于nu7441与m1病毒之间的协同性机制,并非通过nu7441的抗肿瘤机制发挥作用。
[0060]
发明人此前将大黄酚及其衍生物作为m1病毒的抗癌增效剂,经试验发现,50μm的大黄酚与m1病毒联用后,肿瘤细胞的存活率下降至39.6%,而本发明发现,将1μm的nu7441与m1(moi=1)病毒联用后,肿瘤细胞的存活率显著下降至23.1%。与大黄酚及其衍生物相比,本发明的m1抗肿瘤增效剂显著提高了肿瘤的杀伤率,同时,nu7441在药物有效剂量上仅为大黄酚的五十分之一,并且作用快速,用时为大黄酚的三分之二(大黄酚处理72h,nu7441处理48h),具备显著优越性。
[0061]
此外,发明人还将mtor抑制剂依维莫司作为m1病毒的抗癌增效剂参考对象,经试验发现,10μm的依维莫司与(moi=1)m1病毒联用后,肿瘤细胞的存活率下降至36.7%,而本发明发现,将1μm的nu7441与m1病毒(moi=1)联用后,肿瘤细胞的存活率显著下降至23.1%(见实施例3)。与依维莫司相比,本发明的m1抗肿瘤增效剂显著提高了肿瘤的杀伤率,同时,nu7441在药物有效剂量上仅为依维莫司的十分之一,具备显著优越性。
附图说明
[0062]
图1多靶点筛选溶瘤病毒m1增效剂nu7441;
[0063]
a.药物筛选流程图;hct116细胞种于96孔板上,细胞分成两组:单加药组:用不同剂量的化合物处理;联用组:用不同剂量的化合物加病毒共同处理,72h后用mtt法检测细胞的生存率;
[0064]
b.比较曲线下面积;利用细胞生存率绘制细胞生存曲线,计算曲线下面积;
[0065]
c.利用曲线下面积绘制散点图,排在第一位化合物是nu7441。
[0066]
图2dna-pk抑制剂nu7441增加溶瘤病毒m1在多种肿瘤细胞上的溶瘤作用,而对正常细胞无影响。
[0067]
图3多种dna-pk抑制剂协同m1溶瘤病毒的溶瘤效应。
[0068]
图4敲低dna-pkcs亚基增强m1病毒的溶瘤效应;
[0069]
a.在结直肠细胞hct116上抑制dna-pkcs增强病毒的溶瘤效应;
[0070]
b.在胰腺癌bxpc-3抑制dna-pkcs增强病毒的溶瘤效应。
[0071]
图5nu7441与m1病毒联合处理显著抑制人移植瘤生长;
[0072]
a.结直肠癌hct116动物模型上的给药时间安排;
[0073]
b.nu7441和m1病毒联合处理显著抑制人结直肠癌株移植瘤生长;
[0074]
c.nu7441和m1病毒联合处理对荷瘤(hct116)裸鼠体重无明显影响;
[0075]
d.胰腺癌bxpc-3动物给药模型上的给药时间安排;
[0076]
e.nu7441和m1病毒联合处理显著抑制人胰腺癌株移植瘤生长;
[0077]
f.nu7441和m1病毒联合处理对荷瘤(bxpc-3)裸鼠体重无明显影响;
[0078]
g.比较终点结时直肠肿瘤体积大小;
[0079]
h.比较终点结时胰腺肿瘤体积大小。
具体实施方式
[0080]
以下实施方式是对本发明作进一步说明,但本发明的实施方式不局限于以下的实施例介绍,凡依照本发明的原理或理念所作的等同的变化或变通都应视为本发明保护的范畴。
[0081]
在没有特别指明的情况下,本发明采用的材料及实验方法为常规材料及方法。
[0082]
实施例1多靶点筛选溶瘤病毒m1增效剂nu7441
[0083]
材料:
[0084]
高糖dmem培养基(购于corning公司),人结直肠癌细胞hct116(购于atcc细胞库),m1病毒(保藏编号cctccv201423),47种不同靶点的化合物(见表1,购于selleck公司),倒置相差显微镜,自动酶联检测酶标仪。
[0085]
表1不同靶点的抗癌药物
[0086]
[0087][0088]
方法:如图1a所示
[0089]
a)细胞的培养:人结直肠癌hct116生长在含10%fbs、100u/ml青霉素及0.1mg/ml链霉素的dmem完全培养基中;所有细胞株均置于5%co2,37℃恒温密闭式孵箱(相对湿度95%)内培养传代,倒置显微镜观察生长情况。大约2~3天传代一次,取处于对数生长期的细胞用于正式实验。
[0090]
b)细胞处理和形态学观察:选择对数生长期细胞,dmem完全培养液(含10%胎牛血清、1%双抗)制成细胞悬液,细胞以2.5
×
104/孔的密度接种在24孔培养板内。针对表1中的每一个化合物,用不同浓度的化合物单独处理、m1病毒(moi=1)感染细胞、m1病毒(moi=1)联合不同浓度的药物处理细胞,以不加m1病毒和化合物为对照,48小时后在倒置相差显微镜下观察细胞形态学的变化。
[0091]
c)mtt与细胞内的琥珀酸脱氢酶反应:培养至48h时,每孔加入mtt 20μl(5mg/ml),继续孵育4小时,此时镜检可观察到、活细胞内形成的颗粒状蓝紫色甲臜结晶。
[0092]
d)溶解甲臜颗粒:小心吸去上清,加dmso 100μl/孔溶解形成的结晶,在微型振荡器上震荡5min,然后在酶联检测仪上用波长570nm检测各孔的光密度(od值)。每组实验重复3次。细胞存活率=药物处理组od值/对照组od值
×
100%。
[0093]
结果:
[0094]
依据实验结果单用、联用药物各绘制一条生存率曲线,曲线与坐标轴x轴之间的区域为曲线下面积(area under curve,auc),依据公式计算曲线下面积差异dauc=(auc单用-auc联用)/auc联用(如图1b)。根据曲线下面积差异制作散点图,由图1c和表1可以看到dna-pk抑制剂nu7441的auc差异高达2.58,排名第1。nu7441增敏病毒m1的溶瘤效应最明显,可能性也最大。
[0095]
实施例2 dna-pk抑制剂nu7441增加溶瘤病毒m1在多种肿瘤细胞上的溶瘤作用,而对正常细胞无影响
[0096]
材料:
[0097]
高糖dmem培养基(购于corning),人膀胱癌细胞株t24(购于atcc细胞库),人胶质瘤细胞株u-87mg(购于atcc细胞库),人胰腺癌细胞株bxpc-3(购于上海中科院细胞库),人肝癌细胞株hep3b(购于atcc细胞库),人结直肠癌细胞hct116(购于atcc细胞库),人正常肝细胞株l-02(中山大学赠送),m1病毒(保藏编号cctcc v201423),dna-pk抑制剂nu7441(购于美国selleck公司),倒置相差显微镜。
[0098]
方法:
[0099]
接种细胞、给药处理:选择对数生长期细胞,dmem完全培养液(含10%胎牛血清、
1%双抗)制成细胞悬液,以每孔2
×
105/孔的密度接种在6孔培养板内。12小时后见细胞完全贴壁,实验分对照组,单独1μm nu7441组,m1感染组和nu7441/m1联用组或。所用剂量为:m1病毒(moi=1)感染细胞;1μm nu7441。
[0100]
结果:
[0101]
如图2所示,对于不同的肿瘤细胞(人结直肠癌细胞hct116、人肝癌细胞株hep3b、人膀胱癌细胞株t24、人胶质瘤细胞株u-87mg、人胰腺癌细胞株bxpc-3,m1病毒或nu7441单独处理具有较小的生存率抑制作用,然而,当1μm的nu7441与同样moi的m1病毒联用(nu7441+m1)时,存活的肿瘤细胞大幅下降。因此在细胞水平说明了dna-pk蛋白抑制剂可以增强m1病毒的溶瘤效应。在镜下可见正常细胞l-02上,单独m1病毒或联用药物处理细胞对细胞的存活都没有明显的差异。dna-pk抑制剂nu7441增加溶瘤病毒m1在多种肿瘤细胞上的溶瘤作用,而对正常细胞无影响。
[0102]
实施例3多种dna-pk抑制剂和m1溶瘤病毒联合处理减少细胞的存活率
[0103]
材料:
[0104]
高糖dmem培养基(购于corning),m1病毒(保藏编号cctccv201423),人结直肠癌细胞hct116(购于atcc),化合物nu7441、nu7026或ku0060648、(购于美国selleck)、自动酶联检测酶标仪,四甲基偶氮唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,mtt)
[0105]
方法:
[0106]
a)接种细胞、给药处理:选择对数生长期细胞,dmem完全培养液(含10%胎牛血清、1%双抗)制成细胞悬液,以每孔4
×
103/孔的密度接种在6孔培养板内。12小时后见细胞完全贴壁,实验分对照组,单独nu7441/nu7026/ku0060648组,m1感染组和nu7441/m1、nu7026/m1联用组或者ku0060648/m1联用组。所用剂量为:所用剂量为:m1病毒(moi=1)感染细胞;nu7026/ku0060648设不同的剂量梯度。
[0107]
b)mtt与细胞内的琥珀酸脱氢酶反应:培养至48h时,每孔加入mtt20μl(5mg/ml),继续孵育4小时,此时镜检可观察到活细胞内形成的颗粒状蓝紫色甲臜结晶。
[0108]
c)溶解甲臜颗粒:小心吸去上清,加dmso100μl/孔溶解形成的结晶,在微型振荡器上震荡5min,然后在酶联检测仪上用波长570nm检测各孔的光密度(od值)。每组实验重复3次。细胞存活率=药物处理组od值/对照组od值
×
100%。
[0109]
结果:
[0110]
如图3所示。单用m1组(moi=1)细胞抑制率较低,单用抑制剂细胞存活率相较对照组降低不超过25%;而联用组(m1+抑制剂)细胞存活率大大减少,超过50%。这说明dna-pk抑制剂nu7441、nu7026、ku0060648能增强病毒m1抗肿瘤作用。
[0111]
实施例4敲低dna-pkcs亚基促进病毒m1的溶瘤效应
[0112]
材料:
[0113]
高糖dmem培养基(购于corning),m1病毒(保藏编号cctcc v201423)、人结直肠癌细胞株hct116(购于atcc)、人胰腺癌细胞株bxpc-3(购于上海中科院细胞库)、sirna dna-pkcs的三条片段分别是:
[0114]
si-1 seq id no:1
[0115]
(cctgaatgctctagaagaa),
[0116]
si-2 seq id no:2
[0117]
(gtgttgaagtccaggttta),
[0118]
si-3 seq id no:3
[0119]
(gtacagctttaacagaaa)。
[0120]
方法:
[0121]
选择对数生长期细胞,dmem完全培养液调制成细胞悬液,细胞以1
×
105的密度接种在6孔板内。24小时后,加入脂质体包裹的si rna目标基因片段24时后,感染m1病毒。感染48小时后,处理样本。
[0122]
a)收集蛋白质样本,进行western blot检测干扰效率;
[0123]
b)mtt法计算细胞生存率,使用one way anova统计,**表示p《0.01。
[0124]
结果:
[0125]
如图4所示,使用sirna片段干扰dna-pkcs亚基之后,western blot检测发现基因dna-pkcs表达量显著下降。单独干扰dna-pkcs或应用m1病毒并未引起细胞大量减少,只有干扰dna-pkcs联合应用m1病毒组引起了人结直肠细胞hct116(图4a),以及胰腺癌细胞bxpc-3(图4b)存活率显著下降。说明抑制dna-pkcs亚基增强病毒m1的溶瘤效应。
[0126]
实施例5 nu7441与m1病毒联合应用显著抑制人结直肠癌、胰腺癌移植瘤生长。
[0127]
材料:
[0128]
高糖dmem培养基(购于corning),m1病毒(保藏编号cctcc v201423)、人结直肠癌细胞株hct116(购于atcc)、人胰腺癌细胞株bxpc-3(购于atcc)、4周龄雌性balb/c裸鼠。
[0129]
方法:
[0130]
本实验采用随机的、单盲的设计。将5
×
106hct116或者1
×
107bxpc-3细胞注入到4周龄balb/c裸鼠背侧皮下。
[0131]
给药方式如图5a和5d所示,当肿瘤大小达到50mm3时分组,包括不处理的对照组、单独应用nu7441组(腹腔注射10mg/kg/天)、单独应用m1感染组(尾静脉注射m1病毒2
×
106pfu/次)和nu7441/m1联用组(相同方式给予相同剂量的nu7441和m1病毒),连续注射4次。每两天测量肿瘤的长宽和体重,肿瘤的体积依据公式(长
×
宽2)/2。测量肿瘤体积后进行one way anova统计,**表示p《0.01。
[0132]
结果:
[0133]
在两种肿瘤细胞移植瘤动物体内,病理解剖测定肿瘤体积表明,和对照组比较,单独应用nu7441组和单独m1感染组只能引起肿瘤体积轻微的缩小,而nu7441/m1联用组能引起肿瘤体积显著地缩小(图5b、5e、5g和5h)。此外,不同处理组裸鼠体重没有明显差异(图5c和5f)。这表明在体内dna-pk抑制剂nu7441能够增强m1病毒的溶瘤效应而对裸鼠体重没有影响。
[0134]
本发明所记载的实施方式仅为阐释性例子,本发明的实施方式并不受上述的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等同的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1