氨基葡萄糖及其衍生物作为抗病毒药物的应用
氨基葡萄糖及其衍生物作为抗病毒药物的应用
1.本技术是中国专利申请“氨基葡萄糖及其衍生物作为抗病毒药物的应用”(申请号: 201910192721x,申请日:2019年3月13日)的分案申请。
技术领域
2.本发明属于医药领域,具体而言,涉及一种氨基葡萄糖及其衍生物在制备抗病毒药物中的应用及其制备方法。
背景技术:
3.n-乙酰-d-氨基葡萄糖是甲壳素成分的最小组成单位,也是生物细胞内许多重要多糖的基本组成单位。它是由葡萄糖分子内2位上的oh基被乙酰氨基取代后生成的一种氨基单糖。在化学上可以通过乙酰化氨基葡萄糖分子内2位上的氨基而容易合成,天然型 n-乙酰-d-氨基葡萄糖则可以通过生物技术水解甲壳类动物(如蟹和虾)的外壳后再经精制而获得。该物质在生物体内具有许多重要的生理功能。主要的应用功效有以下几种:
4.1.抗癌、抗肿瘤和免疫调节功效;
5.2.促进骨损愈合和质量骨关节炎的效果;和
6.3.改善皮肤保水性、缓解皮肤粗糙、抑制细纹生成等。
7.虽然n-乙酰基-氨基葡萄糖具有多种的生理功效,但是未见报道其在抗病毒领域的应用,本发明的发明人在实验的过程中发现,n-乙酰基-氨基葡萄糖及其衍生物对多种病毒具有明显的抑制作用,n-乙酰氨基葡萄糖的安全性已经在各个方面的得到了验证,因此其作为抗病毒药物的开发具有广阔的前景。
技术实现要素:
8.本发明的一方面,提供通式i所示的氨基葡萄糖化合物、其药学上可接受的盐或者溶剂合物在制备抗病毒药物中的用途:
[0009][0010]
其中,r和r’各自独立地选自氢、取代的或未取代的c1-c8烷基、取代的或未取代的c1-c8烷基羰基、取代的或未取代的c6-c15芳基、取代的或未取代的c7-c15芳烷基、取代的或未取代的c6-c15芳基羰基、取代的或未取代的c6-c15芳基磺酰基、取代的或未取代的c7-c15芳氧基羰基以及取代的或未取代的含有选自n、o和s的1至3个杂原子的饱和或不饱和5元或6元杂环基氨基羰基;
[0011]
在上述r和r’的各种取代基中,所述“取代的”是指所述取代基上还含有1至3个选
自c1-c4烷基、c1-c4烷氧基、c2-c4甲酸酯基和卤素的取代基。
[0012]
r1、r2、r3和r4各自独立地为氢、取代的或未取代的c1-c8烷基、取代的或未取代的c3-c8环烷基、取代的或未取代的c1-c8烷基羰基、取代的或未取代的氨基、取代的或未取代的c5至c12的芳基、取代的或未取代的c6至c13的芳烷基、取代的或未取代的含有选自n、o和s的1至3个杂原子的饱和或不饱和5元或6元杂环基、磷酸根、二钾磷酸根、一钾亚磷酸根、二钠磷酸根和一钠亚磷酸根。
[0013]
所述卤素选自氟、氯、溴或碘。
[0014]
优选地,所述r和r’各自独立地选自氢、取代的或未取代的c1-c6烷基、取代的或未取代的c1-c6烷基羰基、取代的或未取代的c6-c10芳基、取代的或未取代的c7-c10 芳烷基、取代的或未取代的c6-c10芳基羰基、取代的或未取代的c6-c10芳基磺酰基、取代的或未取代的c7-c10芳氧基羰基以及取代的或未取代的含有选自n、o和s的1至 3个杂原子的饱和或不饱和6元杂环基氨基羰基。
[0015]
进一步优选地,所述r和r’各自独立地选自氢、取代的或未取代的c1-c4烷基、取代的或未取代的苯基c1-c4烷基羰基、取代的或未取代的苯基、取代的或未取代的苯基c1-c4烷基、取代的或未取代的苯基羰基、取代的或未取代的苯基磺酰基、取代的或未取代的苄基羰基以及取代的或未取代的含有1至3个n的杂原子的饱和或不饱和6元杂环基氨基羰基。
[0016]
优选地,在上述r和r’的各种取代基中,所述“取代的”是指所述取代基上还含有1 或2个选自甲基、乙基、丙基、甲氧基、乙氧基、丙氧基、甲酸甲酯基、甲酸乙酯基、甲酸丙酯基、氟和氯的取代基。
[0017]
进一步优选地,所述r和r’各自独立地选自氢、甲基、乙基、丙基、丁基、甲基羰基、乙基羰基、丙基羰基、丁基羰基、一氯代甲基羰基、一氯代乙基羰基、一氯代丙基羰基、一氯代丁基羰基、二氯代甲基羰基、二氯代乙基羰基、二氯代丙基羰基、二氯代丁基羰基、一氟代甲基羰基、一氟代乙基羰基、一氟代丙基羰基、一氟代丁基羰基、二氟代甲基羰基、二氟代乙基羰基、二氟代丙基羰基、二氟代丁基羰基、苯基、苯甲基、苯乙基、苯丙基、苯丁基,甲氧基取代的苯甲基、甲氧基取代的苯乙基、甲氧基取代的苯丙基、甲氧基取代的苯丁基,乙氧基取代的苯甲基、乙氧基取代的苯乙基、乙氧基取代的苯丙基、乙氧基取代的苯丁基、甲酸甲酯基取代的苯基、甲酸乙酯基取代的苯基、甲酸丙酯基取代的苯基、吡啶基氨基羰基、苯基羰基、甲基苯基羰基、乙基苯基羰基、丙基苯基羰基、甲基苯基磺酰基、乙基苯基磺酰基、丙基苯基磺酰基和苄基羰基。
[0018]
优选地,所述r1、r2、r3和r4各自独立地为氢、取代的或未取代的c1-c6烷基、取代的或未取代的c1-c6烷基羰基、取代的或未取代的氨基、取代的或未取代的c6至 c10的芳基、取代的或未取代的c6至c10的芳烷基、磷酸根、二钾磷酸根、一钾亚磷酸根、二钠磷酸根和一钠亚磷酸根。
[0019]
进一步优选地,所述r1、r2、r3和r4各自独立地为氢、甲基、乙基、丙基、丁基、甲基羰基、乙基羰基、丙基羰基、丁基羰基、一氯代甲基羰基、一氯代乙基羰基、一氯代丙基羰基、一氯代丁基羰基、二氯代甲基羰基、二氯代乙基羰基、二氯代丙基羰基、二氯代丁基羰基、一氟代甲基羰基、一氟代乙基羰基、一氟代丙基羰基、一氟代丁基羰基、二氟代甲基羰基、二氟代乙基羰基、二氟代丙基羰基、二氟代丁基羰基、苯基、苯甲基、苯乙基、苯丙基、苯丁基,甲氧基取代的苯甲基、甲氧基取代的苯乙基、甲氧基取代的苯丙基、甲氧基取代的苯丁基,乙
氧基取代的苯甲基、乙氧基取代的苯乙基、乙氧基取代的苯丙基、乙氧基取代的苯丁基、二钾磷酸根和一钾亚磷酸根。
[0020]
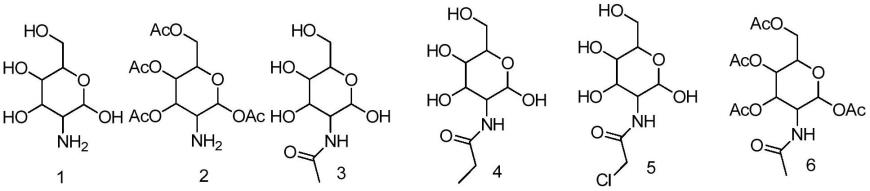
优选地,根据本发明的式i所示的化合物选自以下化合物中:
[0021][0022][0023]
本发明的另一方面,提供一种抗病毒药物组合物,其含有作为活性成分的式i所示
化合物、其药学上可接受的盐或者溶剂合物,以及药学上可接受的载体。
[0024]
根据本发明的所述抗病毒药物组合物可用于治疗和预防选自黄病毒、肠道病毒、流感病毒、冠状病毒、丝状病毒、沙粒病毒、披膜病毒、副黏病毒、弹状病毒鼻病毒、和非洲猪瘟病毒等可激活线粒体抗病毒信号蛋白(mavs)通路的rna病毒引起的病毒性疾病;
[0025]
其中,所述黄病毒选自登革病毒、寨卡病毒、日本脑炎病毒、黄热病毒、西尼罗病毒、基萨纳脑炎病毒;所述肠道病毒选自ev71、ev68、柯萨奇病毒a6、柯萨奇病毒b3、柯萨奇病毒a16,脊髓灰质炎病毒;所述流感病毒选自h1n1(wsn,ca06,pr8)、h2n3、 h5n1、h7n9、耐药性甲流、奥司他韦耐药性流感病毒、登革热病毒;所述冠状病毒选自 sars和mers;所述布尼亚病毒选自发热伴血小板减少综合症病毒(sftsv)、裂谷热病毒、汉坦病毒等病毒;所述丝状病毒选自埃博拉病毒和马尔堡病毒;所述沙粒病毒为拉沙热病毒;所述披膜病毒选自东方马脑炎病毒、西方马脑炎病毒、委内瑞拉马脑炎病毒等:所述副黏病毒选自亨尼帕病毒;所述弹状病毒选自疱疹性口炎病毒和狂犬病毒。
[0026]
根据本发明的另一方面,根据本发明的通式i所示的氨基葡萄糖化合物、其药学上可接受的盐或者溶剂合物的用途为与选自奥司他韦、帕拉米韦、扎那米韦、索非布韦和利巴韦林中的至少一种药物连用在制备抗病毒药物中的用途。
[0027]
根据本发明的所述病毒药物组合物可以制为多种制剂形式,包括但不限于胶囊剂,片剂,注射剂,栓剂,输液剂,搽剂,乳剂等。
[0028]
有益效果
[0029]
根据本发明的所述化合物具有良好的抗病毒作用,特别是抗病毒效应的广谱性非常明显,可以用于制备抗病毒药物。
附图说明
[0030]
图1为测试实施例1中针对化合物3的干扰素β(ifn-β)及干扰素诱导蛋白ifit1的表达水平差异的对照图;
[0031]
图2为测试实施例2中针对化合物3的磷酸化irf3(pirf3)的激活水平的示意图;
[0032]
图3为测试实施例2中针对不同给药量的化合物3的磷酸化irf3(pirf3)的激活水平的对照图;
[0033]
图4为测试实施例3中给药组与对照组小鼠肺组织中ifn-β及ifit1 mrna表达水平的对照图;
[0034]
图5为测试实施例3中给药组与对照组小鼠肺组织中的病毒载量的对照图;
[0035]
图6为测试实施例3中给药组与对照组肺组织中炎性细胞浸润程度的对照图;
[0036]
图7为测试实施例4中给药组与对照组iav感染小鼠的生存率的对照图;
[0037]
图8为测试实施例4中给药组与对照组iav-h274y感染小鼠的生存率的对照图;
[0038]
图9为测试实施例5中给药组与对照组感染vsv的两组小鼠生存率的对照图;
[0039]
图10为测试实施例5中给药组与对照组感染sa14的两组小鼠生存率的对照图;
[0040]
图11为测试实施例5中给药组与对照组感染sftav的两组小鼠生存率的对照图;
[0041]
图12为测试实施例5中给药组与对照组感染ca6的两组小鼠生存率的对照图;
[0042]
图13为测试实施例5中给药组与对照组感染sars的两组小鼠生存率的对照图;
[0043]
图14为测试实施例5中给药组与对照组感染ebola的两组小鼠生存率的对照图;
[0044]
图15为测试实施例5中给药组与对照组感染拉沙热病毒的两组小鼠生存率的对照图;
[0045]
图16为测试实施例5中给药组与对照组感染eee的两组小鼠生存率的对照图;
[0046]
图17为测试实施例5中给药组与对照组感染rhv的两组小鼠生存率的对照图;
[0047]
图18为测试实施例5中给药组与对照组感染亨帕尼病毒的两组小鼠生存率的对照图;
[0048]
图19为测试实施例5中给药组与对照组感染asfv的两组小鼠生存率的对照图;
[0049]
图20为测试实施例5中给药组与对照组感染hcv的两组小鼠生存率的对照图。
具体实施方式
[0050]
以下,将详细地描述本发明。在进行描述之前,应当理解的是,在本说明书和所附的权利要求书中使用的术语不应解释为限制于一般含义和字典含义,而应当在允许发明人适当定义术语以进行最佳解释的原则的基础上,根据与本发明的技术方面相应的含义和概念进行解释。因此,这里提出的描述仅仅是出于举例说明目的的优选实例,并非意图限制本发明的范围,从而应当理解的是,在不偏离本发明的精神和范围的情况下,可以由其获得其他等价方式或改进方式。
[0051]
本发明的发明人发现根据本发明的通式i所示的氨基葡萄糖化合物、其药学上可接受的盐或者溶剂合物可以有效抑制病毒性疾病的发生。
[0052]
另外根据所述通式i表示的化合物在制备抗病毒药物中的用途,本发明开发了新的药物组合物,其中含有作为活性成分的通式i所示化合物、其药学上可接受的盐或者溶剂合物,以及药学上可接受的载体。
[0053]
所述“药学上可接受的盐”为通式(i)化合物与无机酸或有机酸反应形成的常规的无毒盐。例如,所述常规的无毒盐可通过通式(i)化合物与无机酸或有机酸反应制得,所述无机酸包括盐酸、氢溴酸、硫酸、硝酸、胺基磺酸和磷酸等,以及所述有机酸包括柠檬酸、酒石酸、乳酸、丙酮酸、乙酸、苯磺酸、对甲苯磺酸、甲磺酸、萘磺酸、乙磺酸、萘二磺酸、马来酸、苹果酸、丙二酸、富马酸、琥珀酸、丙酸、草酸、三氟乙酸、硬酯酸、扑酸、羟基马来酸、苯乙酸、苯甲酸、水杨酸、谷氨酸、抗坏血酸、对胺基苯磺酸、2-乙酰氧基苯甲酸和羟乙磺酸等;或者通式(i)化合物与丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、天冬氨酸或谷氨酸形成酯后再与无机碱形成的钠盐、钾盐、钙盐、铝盐或铵盐;或者通式(i)化合物与有机碱形成的甲胺盐、乙胺盐或乙醇胺盐;或者通式(i)化合物与赖氨酸、精氨酸、鸟氨酸形成酯后再与盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸形成的对应的无机酸盐或与甲酸、乙酸、苦味酸、甲磺酸和乙磺酸形成的对应的有机酸盐。
[0054]
术语“药学上可接受的载体”是指能够递送本发明有效量活性物质、不干扰活性物质的生物活性并且对宿主或者患者无毒副作用的任何制剂或载体介质代表性的载体包括水、油、蔬菜和矿物质、膏基、洗剂基质、软膏基质等。这些基质包括悬浮剂、增粘剂、透皮促进剂等。它们的制剂为化妆品领域或局部药物领域的技术人员所周知。关于载体的其他信息,可以参考remington:the science和practice of pharmacy,21st ed.,lippincott, williams&wilkins(2005),该文献的内容通过引用的方式并入本文。
[0055]
针对药物或药理学活性剂而言,术语“有效量”或“治疗有效量”是指无毒的但能达
到预期效果的药物或药剂的足够用量。对于本发明中的口服剂型,组合物中一种活性物质的“有效量”是指与该组合物中另一种活性物质联用时为了达到预期效果所需要的用量。有效量的确定因人而异,取决于受体的年龄和一般情况,也取决于具体的活性物质,个案中合适的有效量可以由本领域技术人员根据常规试验确定。
[0056]
本发明的药物组合物的各种剂型可按照药学领域的常规制备方法制备。其制剂配方的单位剂量中包含0.05-200mg通式(i)化合物,优选地,制剂配方的单位剂量中包含 0.1mg-100mg通式(i)化合物。
[0057]
本发明的化合物和药物组合物可对哺乳动物临床使用,包括人和动物,可以通过口、鼻、皮肤、肺、或者胃肠道等的给药途径。最优选为口服。最佳优选日剂量为0.01-200mg/kg 体重,一次性服用,或0.01-100mg/kg体重分次服用。不管用何种服用方法,个人的最佳剂量应依据具体的治疗而定。通常情况下是从小剂量开始,逐渐增加剂量一直到找到最适合的剂量。
[0058]
以下实施例仅是作为本发明的实施方案的例子列举,并不对本发明构成任何限制,本领域技术人员可以理解在不偏离本发明的实质和构思的范围内的修改均落入本发明的保护范围。除非特别说明,以下实施例中使用的试剂和仪器均为市售可得产品。
[0059]
实验实施例1
[0060][0061]
市售cas:90-77-7
[0062]
实验实施例2
[0063][0064]
市售cas:10034-20-5
[0065]
实验实施例3
[0066][0067]
市售cas:10036-64-3
[0068]
实验实施例4
[0069][0070]
化合物的合成参考文献journal of biotechnology,115(2),157-166;2005
[0071]1h nmr(400mhz,d2o):0.95(3h,m),2.16(2h,m),3.29(1h,dd,),3.62(1h,dd),3.58 (1h,dd),3.61
–
3.67(2h,m),3.72(1h,dd),4.99(1h,d,j=3.5hz,h-1).esi-ms:236.5 [m+h]
+
[0072]
实验实施例5
[0073][0074]
化合物的合成参考文献journal of biotechnology,115(2),157-166;2005
[0075]1h nmr(400mhz,d2o):0.95(3h,m),1.32(2h,m),2.16(2h,m),3.29(1h,dd,), 3.62(1h,dd),3.58(1h,dd),3.61
–
3.67(2h,m),3.72(1h,dd),4.99(1h,d,j=3.5hz,h-1). esi-ms:250.1[m+h]
+
[0076]
实验实施例6
[0077][0078]
市售cas:7784-54-5
[0079]
实验实施例7
[0080][0081]
参考文献organic&biomolecular chemistry,12(45),9180-9183;2014制备得到。
[0082]1h nmr(dmso-d6,400mhz)δ:8.55(3h,s,nh3),7.48-7.45(2h,m,arch),7.42-7.27 (16h,m,arch),7.16-7.14(2h,m arch),4.89(1h,d,j=11.0hz,phchh),4.86(1h,d,j= 8.5hz,h-1),4.84(1h,d,j=12.0hz,phchh),4.81(1h,d,j=11.0hz,phchh),4.70(1h,d, j
1h,h-6a),3.61(dd,j=12.4hz,6.4hz,1h,h-6b),3.52(dd,j=10.6,8.4hz,1h,h-3),3.45 (s,3h,och3),3.39
–
3.28(m,2h,h-5,h-4),2.85(dd,j=10.6hz,8.5hz,1h,h-2),2.52(s, 3h,nch3).ms:m/z 206.1(m+h)
+
[0105]
实验实施例14
[0106][0107]
参考文献tetrahedron,46(16),5533-42;1990制备得到。
[0108]1hnmr(400mhz,d2o):4.93(ih,d.j=4.0hz,i-h).4.3-3.6(5h,m,3,4,5,6和6
’‑
h), 3.42(3h,s,-ome),2.76(ih,dd,jp10.0,4.0hz,2-h)和2.51(6h,s,nme2)。ms:m/z 222.1 (m+h)
+
[0109]
实验实施例15
[0110][0111]
参考文献tetrahedron,74(1),19-27;2018制备得到。
[0112]1h nmr(400mhz,cd3od)δ5.55(d,j=3.4hz,1h),4.05(dd,j=10.9,8.6hz,1h), 3.80-3.76(m,2h,),3.74(dd,j=12.8,7.4hz),3.45(dd,j=9.8,8.4hz,1h),3.27(dd,j=10.8, 3.4hz,1h),3.03(s,6h).ms:m/z 208.1(m+h)
+
[0113]
实验实施例16
[0114][0115]
参考文献journal of carbohydrate chemistry,32(7),411-423;2013制备得到。
[0116]1h nmr(400mhz,d2o)δ7.71-7.36(m,5h),5.02(s,0.81h),4.92-4.81(m,0.35h), 4.13(t,j=9.7hz,0.85h),4.00-3.65(m,4.15h),3.58(t,j=9.6hz,1.04h),3.53-3.31(m, 0.77h).ms:m/z 256.1(m+h)
+
[0117]
实验实施例17
[0118][0119]
参考文献journal of carbohydrate chemistry,32(7),411-423;2013制备得到。
[0120]1h nmr(400mhz,d2o)δ7.45(t,j=9.4hz,2h),7.15(d,j=8.7hz,2h),5.01(s, 0.83h),4.08(t,j=9.8hz,0.84h),3.96-3.58(m,7.45h),3.51(t,j=9.5hz,1.1h),3.35(s, 1.8h),ms:m/z 286.1(m+h)
+
[0121]
实验实施例18
[0122][0123]
参考文献journal of carbohydrate chemistry,32(7),411-423;2013制备得到。
[0124]1h nmr(400mhz,d2o)δ7.40(t,j=8.4hz,1h),6.91(d,j=8.4hz,1h),6.81(t,j= 8.4hz,1h),6.68(t,j=8.4hz,1h),5.03(s,0.83h),4.06(t,j=9.2hz,0.84h),3.95-3.54(m, 7.45h),3.53(t,j=9.4hz,1.1h),3.38(s,1.8h),ms:m/z 286.1(m+h)
+
[0125]
实验实施例19
[0126][0127]
参考文献journal of carbohydrate chemistry,32(7),411-423;2013制备得到。
[0128]1h nmr(400mhz,d2o)δ7.42(t,j=8.2hz,1h),7.39(d,j=8.2hz,1h),7.08(d,j=8.2hz,1h),7.03(s,1h),5.05(s,0.83h),4.03(t,j=9.2hz,0.84h),3.954-3.55(m,7.45h), 3.54(t,j=9.4hz,1.1h),3.39(s,1.8h),ms:m/z 314.1(m+h)
+
[0129]
实验实施例20
[0130][0131]
室温下将220mg(0.74mmol)三光气溶于10ml无水四氢呋喃中,氮气保护下,缓慢滴加溶有0.89g(2mmol)1,3,4,6-四-o-乙酰基-a-d-氨基葡萄糖和0.38ml(2.2 mmol)二异丙基乙胺的四氢呋喃溶液5ml,滴加时间约为5分钟。继续搅拌反应30分钟后,加入溶有0.18g(2mmol)4-氨基吡啶和0.38ml(2.2mmol)二异丙基乙胺的四氢呋喃溶液15ml。反应混合物搅拌5小时后,停止搅拌,减压蒸馏除去有机溶剂,加入50ml乙酸乙酯稀释,用20ml 10%nahco3洗涤3次,加入无水mgso4干燥过夜。次日减压蒸馏除去有机溶剂,得黄色浸膏。柱层析分离(硅胶300-400目,流动相为乙酸乙酯:甲醇=20:1),得白色固体。用甲醇结晶得到白色晶体0.81g,收率82%。
[0132]1h nmr(dmso-d6,400mhz)δ8.90(s,1h,nh),8.30(d,2h,j=6hz,pyh), 7.34(d,2h,j=6hz,pyh),6.53(d,j=9.2hz,1h,nh),6.02(d,j=3.2hz,1h, h-1),5.18(t,j=9.60hz,1h,h-3),5.05(t,j=10hz,1h,h-4),4.20-3.99(m,4h, h-2,h-5,h-6a,6b),2.20,2.02,2.00,1.95(12h,4ac):8.90(s,1h,nh),8.30 (d,2h,j=6hz,pyh),7.34(d,2h,j=6hz,pyh),6.53(d,j=9.2hz,1h,nh), 6.02(d,j=3.2hz,1h,h-1),5.18(t,j=9.60hz,1h,h-3),5.05(t,j=10hz,1h, h-4),4.20-3.99(m,4h,h-2,h-5,h-6a,6b),2.20,2.02,2.00,1.95(12h,4ac) esi-ms:300[m+1]
+
[0133]
实验实施例21
[0134][0135]
参考文献huaxue yanjiu yu yingyong,20(3),290-294;2008制备得到;产率:96.0%。
[0136]1hnmr(dmso-d6,400mhz)δ:7.95~7.54(m,5h,ar),7.45~7.42(m,1h,j
1,2
=7.6hz, h-1,β-),6.52(d,j
nh,2
=4.8hz,1h,nh),5.04~4.57(m,4h,4oh),3.81~3.72(m,1h,h-4), 3.73~3.71(m,1h,h-3),3.66~3.63(m,2h,h-6和h-6'),3.51~3.42(m,1h,h-5), 3.20~3.16(m,1h,h-2)。esi-ms:284[m+1]
+
[0137]
实验实施例22
[0138][0139]
参考文献huaxue yanjiu yu yingyong,20(3),290-294;2008制备得到;产率:96.0%。
[0140]1hnmr(dmso-d6,400mhz)δ:7.92~7.54(m,4h,ar),7.45~7.42(m,1h,j
1,2
=7.6hz, h-1,β-),6.52(d,j
nh,2
=4.8hz,1h,nh),5.04~4.57(m,4h,4oh),3.81~3.72(m,1h,h-4), 3.73~3.71(m,1h,h-3),3.66~3.63(m,2h,h-6和h-6'),3.51~3.42(m,1h,h-5), 3.20~3.16(m,1h,h-2),2.35(s,3h)。esi-ms:298[m+1]
+
[0141]
实验实施例23
[0142][0143]
参考文献advanced synthesis&catalysis,356(14-15),3199-3213;2014制备得到。
[0144]1h nmr(400mhz,d2o)δ5.33(h-1,dd)3.21(h-2,m),3.80(h-3,dd),3.71(h-4,dd), 3.86(h-5,dt),3.43(h-6,m),2.61(ph),1.84(3h,ch3).esi-ms:301.1[m+1]
+
[0145]
实验实施例24
[0146][0147]
参考文献advanced synthesis&catalysis,356(14-15),3199-3213;2014制备得到。
[0148]1h nmr(400mhz,d2o)δ5.38(h-1,dd)3.20(h-2,m)4 3.80(h-3,dd)3.72(h-4, dd),3.88(h-5,dt)3.45(h-6,m)2.66(ph).esi-ms:260[m+1]
+
[0149]
实验实施例25
[0150][0151]
参考文献:khimiya prirodnykh soedinenii,(6),787-90;1987制备得到。
[0152]1h nmr(400mhz,cd3od)δ:4.46(1h,d,j=8.5hz,h-1),3.67-3.65(2h,m,h-6a和h-6b),3.66(3h,s,ch3),3.56(3h,s,ch3),3.55(3h,s,ch3),3.44(1h,ddd,j=3.5,6.0和 9.5hz,h-5),3.42(3h,s,ch3),3.39(1h,dd,j=8.5和10.5hz,h-3),3.29(1h,dd,j=8.5 和9.5hz,h-4),2.85(1h,dd,j=8.5和10.5hz,h2);esi-ms:300.2[m+na]
+
[0153]
实验实施例26
[0154][0155]
参考文献:organic&biomolecular chemistry,12(45),9180-9183;2014制备得到。
[0156]1h nmr(400mhz,cd3od)δ:4.46(1h,d,j=8.5hz,h-1),3.67-3.65(2h,m,h-6a和 h-6b),3.66(3h,s,ch3),3.56(3h,s,ch3),3.55(3h,s,ch3),3.44(1h,ddd,j=3.5,6.0和9.5hz,h-5),3.42(3h,s,ch3),3.39(1h,dd,j=8.5和10.5hz,h-3),3.29(1h,dd,j=8.5 和9.5hz,h-4),2.85(1h,dd,j=8.5和10.5hz,h2);esi-ms:258.1[m+na]
+
[0157]
实验实施例27
[0158][0159]
参考文献:journal of biological chemistry,289(46),32056-32063;2014制备得到。
[0160]
1h-nmr:(400mhz,cdcl3)δ[ppm]2.03(s,3h,-n-co-ch3),2.06(s,6h,2
×ꢀ‑
o-co-ch3),3.27(s,3h,-o-ch3),3.34(s,3h,-o-ch3),3.69(dd,3jh,h=9.8,4.9hz,1h, h-3),3.83(ddd,3jh,h=10.1,5.7,2.3hz,1h,h-5),4.04(dd,2jh,h=12.2,3jh,h=2.4hz, 1h,h-6a),4.21(dd,2jh,h=12.2,3jh,h=5.7hz,1h,h-6b),4.52(ddd,3jh,h=7.6,4.9,1.5 hz,1h,h-2),4.75(d,3jh,h=1.4hz,1h,h-1),4.92(dd,3jh,h=10.0,10.0hz,1h,h-4), 5.82(d,3jh,h=7.7hz,1h,nh).esi-ms:[m+na]
+
356.1
[0161]
实验实施例28
[0162][0163]
参考文献:organic letters,19(5),1040-1043;2017制备得到。
[0164]1hnmr(dmso-d6,400mhz)δ7.74(d,2h),7.70(s,1h),7.41(d,2h),5.62(d,1h), 3.54-3.79(m,7h),2.87(s,1h),2.35(s,3h).esi-ms:334.1[m+1]
+
[0165]
实验实施例29
[0166][0167]
将d-氨基葡萄糖盐酸盐(1.0g,0.0046mol)溶于40ml甲醇与3倍量的甲醇钠溶液中,室温连续搅拌0.5-1h。苯氧乙酰氯(1.28g,0.007mol)用滴液漏斗缓慢滴入游离的氨基糖溶液中,滴加过程可观察到有白色沉淀生成,滴加完毕室温搅拌4h。反应液用 12mol/l盐酸液调ph=2-3,将生成的白色沉淀常压过滤,得白色固体,冰甲醇(2ml
×
3),冰乙醚(2ml
×
3),冰水(2ml
×
3)洗涤,红外烘干。得白色粉末状固体1.35g,收率: 68%;白色固体。
[0168]1h nmr(400mhz,dmso)δ7.59(d,j=8.3hz,1h,nh),7.29(d,j=5.3hz,2h,arh), 6.98
–
6.96(m,3h,arh),6.57(t,j=4.9hz,1h,oh),5.22(d,j=3.6hz,1h,1-h),4.99(dd, j=8.0,4.1hz,2h,oh),4.51(d,j=0.8hz,2h,och2co),4.43(s,1h,oh),3.67(d,j=1.7 hz,1h,2-h),3.60(d,j=4.9hz,2h,3-h,5-h),3.50-3.44(m,2h,6-h,6
’‑
h),3.16(d,j=9.1 hz,1h,4-h);esi-ms:300[m+1]
+
。
[0169]
测试实施例1:化合物3(n-乙酰基-氨基葡萄糖)在细胞水平上抗病毒效应评价
[0170]
在体外分化并培养小鼠的原代巨噬细胞(bmdm),分化至第七天,给予细胞终浓度为20mm的化合物3预处理3小时(给药组),以pbs处理组作为对照(对照组)。之后以1moi感染复数的流感病毒(iav)感染细胞,感染3小时、6小时后收集细胞样品,提取rna并利用实时荧光定量pcr方法检测干扰素β(ifn-β)及干扰素诱导蛋白ifit1的表达水平差异。如图1所示,iav感染后给药组细胞中的ifn-β(左)及ifit1(右)mrna的表达水平相比对照组均有显著的提高,这证明在细胞水平上化合物3可以增强病毒感染诱导的干扰素通路表达水平,进而发挥抗病毒效应。
[0171]
测试实施例2
virus,asfv),选取性别、周齡、体重一致的c57及icr小鼠,把小鼠平均分为两组,一组小鼠喂食含化合物3的鼠粮(25mg/kg)(给药组),另一组小鼠喂食不含化合物3的普通鼠粮作为对照(对照组)。喂食3天后,给小鼠分别感染iav-h274y病毒(图8)、vsv病毒(图9)、sa14病毒(图10)、sftsv病毒(图11)、ca6病毒(图12)、sars病毒(图13)、ebola病毒(图14)、拉沙热病毒(图15)、eee病毒(图16)、rhv病毒(图17)、亨尼帕病毒(图18)、asfv病毒(图19)和hcv病毒(图20)。结果显示,喂食化合物3可以显著提高上述rna病毒感染后小鼠的生存率。
[0180]
化合物1至29针对弹状病毒科水泡性病毒属的水疱性口炎病毒(vesicularstomatitisvirus,vsv)、微rna病毒科肠病毒属的柯萨奇6型病毒(coxsachievirusa6,ca6)、布尼亚病毒科白蛉病毒属的严重发热伴血小板减少综合症病毒(severefeverwiththrombocytopeniasyndromevirus,sftsv)以及黄病毒科黄病毒属的乙型脑炎病毒sa14株(japaneseencephalitisvirus,jev,sa14)的抗病毒效应的广谱性实验数据列于下表1中。
[0181]
[0182]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1