Nr-CWS处理的MSCs来源的外泌体在促进皮肤创面愈合中的应用
nr-cws处理的mscs来源的外泌体在促进皮肤创面愈合中的应用
技术领域
1.本发明属于生物医药技术领域,具体地,本发明涉及nr-cws处理的mscs来源的外泌体在促进皮肤创面愈合中的应用。
背景技术:
2.糖尿病创面是糖尿病最难治的并发症之一,糖尿病创面的特点是趋化因子和血管化不足,成纤维细胞迁移和增殖减少,以及异常的炎症反应。目前针对糖尿病创面的常规治疗方法包括定制辅料、外科清创、负压治疗以及抗生素和高压氧治疗等。但是,仍有近50%患者无法通过常规治疗方法得到治愈。糖尿病创面愈合延迟的因素众多,包括周围神经病变、免疫反应缺陷、周围微血管病、血红蛋白糖基化引起的组织氧输送不足、红细胞变化、ⅲ型和ⅰ型皮肤胶原比例改变、糖尿病皮肤的生物力学改变、成纤维细胞和角质细胞迁移、扩增能力减弱、角质细胞和内皮细胞凋亡等。另外,糖尿病创面愈合延迟与参与组织重建的生长因子不足关系密切,这些生长因子包括vegf、pdgf、fgf、nos、kgf等。导致糖尿病溃疡的重要因素是血液循环不良和伤口愈合障碍,因此,改善创面微环境和改善血管生成对于糖尿病创面的修复和愈合具有重要意义。
3.间充质干细胞(mesenchymal stem cells,mscs)是一种多能干细胞,它具有干细胞的所有共性,即自我更新和多向分化能力,被认为是各种组织再生治疗中最有希望的干细胞之一。近年来,大量的实验研究证明了多种组织来源的间充质干细胞可以促进糖尿病创面愈合,例如:骨髓、脂肪、脐带血和皮肤组织来源的间充质干细胞。目前认为间充质干细胞促进创面愈合主要是靠旁分泌途径分泌丰富的“蛋白质组”包括:生长因子、mirna、蛋白酶体和细胞外囊泡等,间充质干细胞旁分泌在损伤模型中可发挥促增殖、抗调亡和抑制炎症等重要作用,此外,这些成分比细胞疗法更适合临床应用,因为它们规避了与细胞疗法相关的安全和伦理问题。具体而言,间充质干细胞来源的外泌体(exosome,exos)是间充质干细胞旁分泌的重要成分,且已被证明是一类在伤口愈合和组织修复中发挥着重要作用的生物活性分子。
4.外泌体(exosome,exos)是由囊泡体与质膜融合形成的细胞外囊泡,含有不同种类的micrornas、蛋白质和脂质等具有生物学活性的物质,间充质干细胞来源的外泌体(msc-exos)已成为一种极具前景的治疗工具,外泌体能够通过促进血管生成和诱导细胞增殖来降低免疫原性和增加组织的再生能力。外泌体与间充质干细胞相比,具有众多优势:
①
外泌体可直接与靶细胞发生融合发挥生物学效应,作用效率高:
②
外泌体在-80℃能够长期稳定保存,内含有效成分受外泌体脂质膜保护,不易被破坏,且便于运输:
③
使用时间易于掌握,使用浓度、剂量及途径易于控制;
④
克服了间充质干细胞在体内存活率低及长期应用突变致瘤的潜在隐患;
⑤
避免了直接应用间充质干细胞造成的血管栓塞等并发症。因此,间充质干细胞来源的外泌体在组织损伤修复中的作用及机制研究就显得尤为重要,且具有潜在应用价值。
5.大量研究证据表明利用物理、化学和生物因子预处理的间充质干细胞来源的外泌体的生物活性能够得到显著提高,此外,其在组织工程和再生医学中的修复能力也得到显著提高。红色诺卡氏菌细胞壁骨架(nocardia rubra cell wall skeleton,nr-cws)是从红色诺卡氏菌(nocardia rubra)经发酵、细胞破碎、酶处理、溶媒提取等制备而成的,部分由诺卡多菌酸、阿拉伯半乳聚糖和粘肽组成,据报道,红色诺卡氏菌细胞壁骨架能够通过增强巨噬细胞的活化和血管的生成来加速皮肤伤口愈合。然而,截止到目前为止,尚未见nr-cws预处理的mscs来源的外泌体在糖尿病创面修复治疗中的应用。因此,本研究的目的是探讨从经nr-cws预处理的mscs中提取得到的外泌体是否可以促进内皮细胞在糖尿病伤口愈合中的血管生成能力。此外,本研究进一步研究了circrna在促进nr-cws-exos创面愈合中的作用及其具体机制。
技术实现要素:
6.针对目前现有技术存在的问题,本发明的目的在于提供nr-cws处理的mscs来源的外泌体在促进皮肤创面愈合中的应用,评估了nr-cws处理的mscs来源的外泌体在促进糖尿病创面愈合中的作用及其具体机制。
7.本发明的上述目的通过以下技术方案得以实现:
8.本发明的第一方面提供了抑制mir-4782-5p表达水平的试剂在制备用于促进糖尿病创面修复的药物中的应用。
9.进一步,所述抑制mir-4782-5p表达水平的试剂选自:敲除mir-4782-5p的试剂、沉默mir-4782-5p的试剂、mir-4782-5p的抑制剂。
10.进一步,所述抑制mir-4782-5p表达水平的试剂包含如seq id no:2所示的核苷酸序列;
11.优选地,所述抑制mir-4782-5p表达水平的试剂通过靶向vegfa促进内皮细胞的血管生成;
12.优选地,所述抑制mir-4782-5p表达水平的试剂通过靶向vegfa促进内皮细胞的迁移;
13.优选地,所述抑制mir-4782-5p表达水平的试剂通过靶向vegfa促进内皮细胞的增殖。
14.本发明第二方面提供了环状rna circiasr1或过表达环状rna circiasr1的质粒在制备用于促进糖尿病创面修复的药物中的应用。
15.进一步,所述环状rna circiasr1的核苷酸序列如seq id no:3所示。
16.进一步,所述过表达环状rna circiasr1的质粒含有如seq id no:3所示的核苷酸序列。
17.进一步,所述环状rna circiasr1或过表达环状rna circiasr1的质粒促进血管生成相关基因vegfa、bfgf、hgf的表达;
18.优选地,所述环状rna circiasr1或过表达环状rna circiasr1的质粒通过靶向mir-4782-5p/vegfa促进内皮细胞的血管生成;
19.优选地,所述环状rna circiasr1或过表达环状rna circiasr1的质粒通过靶向mir-4782-5p/vegfa促进内皮细胞的迁移;
20.优选地,所述环状rna circiasr1或过表达环状rna circiasr1的质粒通过靶向mir-4782-5p/vegfa促进内皮细胞的增殖。
21.进一步,本发明中所述环状rna circiasr1由来自iasr1基因的一个外显子(932bp)组成,也即iasr1基因的13-20号外显子环化形成,主要位于细胞质中,本发明通过实验研究发现环状rna circiasr1可以通过海绵化mir-4782-5p调节vegfa的表达,其核苷酸序列如seq id no:3所示。
22.本发明的第三方面提供了一种nr-cws处理的间充质干细胞来源的外泌体的制备方法。
23.进一步,所述方法包括如下步骤:待间充质干细胞的融合度达到70%-80%时,在细胞培养基中进行培养,收集上清液,离心、过滤后获得的沉淀物即为nr-cws处理的间充质干细胞来源的外泌体;优选地,所述间充质干细胞为人脐带间充质干细胞;
24.优选地,所述细胞培养基为含有10%的包含10μg/ml nr-cws的无外泌体血清培养基和10%无外泌体血清培养基;
25.优选地,所述培养的时间为48h;
26.优选地,所述离心的条件为先以300g 10min的条件进行离心、再以2000g10min的条件进行离心、再以10000g 30min的条件进行离心;
27.优选地,所述过滤的条件为采用0.22μm的过滤器进行过滤,并以100,000g离心70min。
28.进一步,所述nr-cws处理的间充质干细胞来源的外泌体的直径尺寸在80-120nm之间,且内皮细胞能够对所述外泌体进行内化。
29.本发明的第四方面提供了一种nr-cws处理的间充质干细胞来源的外泌体。
30.进一步,所述外泌体为采用本发明第三方面所述的方法制备得到;
31.优选地,所述外泌体中表达alix、tsg101、cd9;
32.优选地,所述外泌体促进血管生成相关基因vegfa、bfgf、hgf的表达;
33.优选地,所述外泌体促进内皮细胞中环状rna circiasr1的表达;
34.优选地,所述外泌体通过靶向circiasr1/mir-4782-5p/vegfa促进内皮细胞的血管生成;
35.优选地,所述外泌体通过靶向circiasr1/mir-4782-5p/vegfa促进内皮细胞的迁移;
36.优选地,所述外泌体通过靶向circiasr1/mir-4782-5p/vegfa促进内皮细胞的增殖;
37.优选地,所述外泌体通过靶向circiasr1/mir-4782-5p/vegfa促进糖尿病创面皮肤再生和厚胶原纤维沉积;
38.更优选地,所述环状rna circiasr1的核苷酸序列如seq id no:3所示。
39.在本发明的具体实施方案中,本发明通过实验研究表明了nr-cws处理的间充质干细胞来源的外泌体能够通过上调环状rna circiasr1,进而环状rna circiasr1通过海绵作用抑制mir-4782-5p的表达,进而上调促血管生成因子vegfa,显著促进内皮细胞的血管生成,加速糖尿病创面的修复和再生,能够用于糖尿病创面的治疗中。
40.本发明的第五方面提供了一种用于促进糖尿病创面修复的药物组合物。
41.进一步,所述药物组合物包含本发明第一方面中所述的抑制mir-4782-5p表达水平的试剂、和/或本发明第二方面中所述的环状rna circiasr1或过表达环状rna circiasr1的质粒、和/或本发明第四方面中所述的外泌体;优选地,所述抑制mir-4782-5p表达水平的试剂包含如seq id no:2所示的核苷酸序列。
42.进一步,所述药物组合物中还包含药学上可接受的载体和/或辅料。
43.进一步,所述药学上可接受的载体和/或辅料在remington's pharmaceutical sciences(19th ed.,1995)中有详细的记载,这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味,在这种药物组合物中可以使用的制剂可以是其原始化合物本身的形式,或任选地使用其药物学可接受的盐的形式,如此配制的药物组合物根据需要可选择本领域技术人员已知的任何适当的方式将药物进行给药。
44.进一步,所述药学上可接受的载体和/或辅料是指本领域认可的并且包括例如参与从身体的一个器官或部分携带或运输任何主题组合物至身体的另一个器官或部分的药学上可接受的材料、组合物或赋形剂,如液体或固体填充剂、稀释剂、溶剂或包囊材料。每种载体必须在与主题组合物的其他成分相容的意义上是“可接受的”并且对患者无害。在某些实施方案中,药学上可接受的载体和/或辅料是无热原的。可以用作药学上可接受的载体和/或辅料的材料的一些例子包括:(1)糖,如乳糖、葡萄糖和蔗糖;(2)淀粉,如玉米淀粉和马铃薯淀粉;(3)纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;(4)粉末状黄蓍胶;(5)麦芽;(6)明胶;(7)滑石粉;(8)可可脂和栓剂蜡;(9)油,如花生油、棉籽油、葵花籽油、芝麻油、橄榄油、玉米油和大豆油;(10)二醇,如丙二醇;(11)多元醇,如甘油、山梨醇、甘露糖醇和聚乙二醇;(12)酯,如油酸乙酯和月桂酸乙酯;(13)琼脂;(14)缓冲剂,如氢氧化镁和氢氧化铝;(15)海藻酸;(16)无热原的水;(17)等渗盐水;(18)林格氏溶液;(19)乙醇;(20)磷酸盐缓冲液;(21)药物制剂中使用的其他无毒的相容物质。
45.进一步,所述药物组合物可根据本领域已知的方法制备。用于此目的时,如果需要,可将本发明第一方面中所述的抑制mir-4782-5p表达水平的试剂、和/或本发明第二方面中所述的环状rna circiasr1或过表达环状rna circiasr1的质粒、和/或本发明第四方面中所述的外泌体与一种或多种固体或液体载体和/或辅料结合,制成可作为人用的适当的施用形式或剂量形式。
46.进一步,本发明中所述的本发明第一方面中所述的抑制mir-4782-5p表达水平的试剂、和/或本发明第二方面中所述的环状rna circiasr1或过表达环状rna circiasr1的质粒、和/或本发明第四方面中所述的外泌体或含有上述任意一种或多种的药物组合物可以单位剂量形式给药,给药途径包括但不限于非肠道或肠道,如皮肤、皮下等。给药剂型包括但不限于透皮剂、片剂、栓剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、脂质体、口含片、冻干粉针剂等。可以是普通制剂、缓释制剂、控释制剂及各种微粒给药系统。
47.本发明的第六方面提供了本发明第四方面所述的外泌体在制备用于促进糖尿病创面修复的药物中的应用。
48.相对于现有技术,本发明具有的优点和有益效果:
49.本发明首次发现并证实了红色诺卡氏菌细胞壁骨架(nr-cws)预处理的间充质干
细胞(mscs)来源的外泌体(exos)通过circiars1/mir-4782-5p/vegfa通路促进血管生成、促进糖尿病创面的愈合,此外,还进一步发现并证实了circiasr1和mir-4782-5p抑制剂均能显著促进糖尿病创面的愈合,本发明为本领域研制高效安全的创面修复或创面愈合药物提供了新的思路和方向,具有非常好的应用前景。
附图说明
50.以下,结合附图来详细说明本发明的实施方案,其中:
51.图1为msc衍生的外泌体的表征结果图,其中,a图:通过tem观察exos和nr-cws-exos的形貌,b图:通过蛋白质印迹评估exos和nr-cws-exos的特定表面标志物(alix、tsg101、cd81)的表达情况,c图和d图:通过nta检测exos和nr-cws-exos的直径和颗粒浓度,e图:通过激光扫描共聚焦显微镜验证huvec对exos和nr-cws-exos的吸收情况,外泌体、细胞骨架和细胞核分别被染成红色和蓝色;
52.图2为nr-cws-exos在体外促进内皮细胞血管生成的结果图,其中,a图-c图:用exos或nr-cws-exos处理细胞后huvec的迁移能力和伤口愈合能力结果图,d图和e图:用exos或nr-cws-exos处理细胞后huvec的小管形成结果图,f图:用lg、hg、hg+exos和hg+nr-cws-exos处理1、3和7天的huvec的增殖情况结果图,g图:elisa法测定上清液在添加了lg、hg、hg+exos和hg+nr-cws-exos的不同培养基中的浓度,h图:qrt-pcr检测huvec的vegfa、bfgf和hgf相对表达水平,**p《0.01,***p《0.001;
53.图3为nr-cws-exos加速糖尿病小鼠伤口愈合的结果图,其中,a图:动物研究的实验设计图,b图和c图:stz治疗小鼠在术后第0、7和14天接受多点注射pbs(对照)、exos和nr-cws-exos的全层缺损和伤口愈合率的代表性图像,d图和f图:h&e染色(黑色箭头表示微血管)和第14天伤口长度和小管形成的量化。比例尺=2mm,g图:masson染色在第14天的三色染色结果图,h图-j图:cd31和vegfa的ihc染色结果图,k图-m图:cd31和vegfa的if染色结果图,**p《0.01,***p《0.001;
54.图4为circiars1在nr-cws-exos处理的huvecs中上调并增强huvecs的小管形成的结果图,其中,a图和b图:用exos或nr-cws-exos处理的huvec中的circrna表达谱,c图:用exos或nr-cws-exos处理的huvec中的circiars1的表达情况,d图:通过sanger测序验证反向剪接点,e图:通过rt-pcr在huvec中验证了circiars1的存在,f图:通过qrt-pcr检测用或不用rnase r处理的huvecs中circiars1和iars1mrna的表达情况,数据以平均值
±
sd表示,n=3,**p《0.01,***p《0.001;
55.图5为circiars1在nr-cws-exos处理的huvecs中上调并增强huvecs的小管形成的结果图,其中,a图-c图:在高葡萄糖下用exos、nr-cws-exos、nr-cws-exos-circiars1或nr-cws-exos-sicirciars1处理细胞后,huvec的迁移能力和伤口愈合能力的结果图数据以平均值
±
sd表示,n=3,**p《0.01,***p《0.001;
56.图6为circiars1在nr-cws-exos处理的huvecs中上调并增强huvecs的小管形成的结果图,其中,a图和b图:在高葡萄糖下用exos、nr-cws-exos、nr-cws-exos-circiars1或nr-cws-exos-sicirciars1处理细胞后,huvec的小管形成测定结果图,c图:qrt-pcr测定经处理的huvec中vegfa、bfgf和hgf的表达,d图:经处理的huvec中vegfa、bfgf和hgf分泌的elisa检测结果图,数据以平均值
±
sd表示,n=3,**p《0.01,***p《0.001;
57.图7为circiars1作为mir-4782-5p的分子海绵吸附mir-4782-5p,其中,a图:circiars1(红色)的定位,比例尺=20μm,b图:huvecs的细胞质(cyto)和核(nuc)部分中的circiars1的相对表达情况,c图:将huvecs裂解物中的circiars1用circiars1特异性探针富集,通过qrt-pcr检测,d图:通过qrt-pcr检测huvecs裂解物中5种候选mirna的相对表达水平,e图:将生物素化的mir-4782-5p转染到细胞中,链霉亲和素捕获后,通过qrt-pcr量化circiars1的表达水平,f图:野生型(wt)和突变型(mut)的circiars1的相对荧光素酶活性结果图,g图:对与ago2相关的circiars1执行抗ago2rip的结果图,h图:用于circiars1和mir-4782-5p在huvec中定位的rna fish结果图,比例尺=20μm;
58.图8为circiars1作为mir-4782-5p的分子海绵吸附mir-4782-5p,其中,a图-c图:mir-4782-5p和vegfa载体共转染后,检测huvec的迁移能力和伤口愈合情况的结果图,d图和e图:用mir-4782-5p和vegfa载体共转染细胞后huvec的小管形成情况,f图:用mir-4782-5p和vegfa载体共转染的细胞中vegfa蛋白表达的蛋白质印迹分析结果图,数据是一式三份,以平均值
±
sd表示,**p《0.01,***p《0.001;
59.图9为circiars1通过靶向mir-4782-5p调节血管生成,其中,a图-c图:在细胞与circiars1载体和mir-4782-5p模拟物共转染后,检测了huvec的迁移能力和伤口愈合情况,d图和e图:通过小管形成实验检测血管生成能力,f图:用mir-4782-5p和vegfa载体共转染的细胞中vegfa蛋白表达水平,g图:用si-circiars1和mir-4782-5p抑制剂共转染的细胞中vegfa蛋白表达水平;
60.图10为circiars1通过靶向mir-4782-5p调节血管生成,其中,a图-c图:在si-circiars1和mir-4782-5p抑制剂共转染后,检测huvec的迁移能力和伤口愈合情况,d图和e图:通过小管形成实验检测血管生成能力,数据是一式三份,以平均值
±
sd表示,*p《0.05,**p《0.01,***p《0.001;
61.图11为mir-4782-5p通过靶向vegfa调节血管生成,其中,a图-c图:在用mir-4782-5p抑制剂和si-vegfa共转染细胞后,检测了huvec的迁移能力和伤口愈合,d图和e图:通过小管形成实验检测血管生成能力,f图:用mir-4782-5p抑制剂和si-vegfa共转染的细胞中vegfa的蛋白表达水平,数据是一式三份,以平均值
±
sd表示,**p《0.01,***p《0.001。
具体实施方式
62.下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
63.实施例
64.1、细胞培养和处理
65.人脐带间充质干细胞(huc-mscs,mscs)获自山东齐鲁细胞治疗工程技术有限公司;红色诺卡氏菌细胞壁骨架(nr-cws)获自于辽宁格瑞士特生物制药有限公司;人脐静脉内皮细胞(huvec)购自于上海生阳生物科技有限公司;mscs和huvecs在含有10%的胎牛血清(fbs)的dulbecco改良eagle培养基(dmem)中进行培养。对于高糖(hyperglycaemia,hg)
处理,mscs在实验前在含有高糖(25mm)的无血清dmem中培养48h。对于nr-cws处理,在实验前对高糖条件下的mscs进行nr-cws处理48h。
66.2、外泌体(exos)的分离与鉴定
67.当huc-mscs的融合度达到70%-80%时,取出上清液,用pbs清洗3次,然后,将培养基更换为10%的含有10μg/ml nr-cws的exosomes-free血清培养基和10%exosomes-free血清培养基中,培养48h。随后,收集两组上清液,分别以300g 10min和2000g 10min的条件进行离心,以去除死细胞和大细胞碎片。然后,将上清液以10000g离心30min,以去除细胞碎片。采用0.22μm过滤器(jet biofil,china)过滤上清液并以100,000g离心70分钟两次。随后,将获得的沉淀物重新悬浮在200μl pbs中,并使用bca试剂盒(keygen,china)测量提取的外泌体的浓度,并将样品储存在-80℃的条件下以供进一步实验。
68.为了验证制备得到的外泌体,本实施例使用透射电子显微镜(tecnai,usa)观察了外泌体的形态,此外,还通过激光粒子扫描分析仪(malvern uk)检测了外泌体的大小粒径分布。采用western blot实验检测了外泌体的特定表面标志物(tsg101、alix、cd9)的表达水平。
69.3、外泌体的内化
70.将外泌体与红色荧光染料pkh26(sigma,usa)共孵育10分钟,然后再次以100,000g离心70分钟,以获得没有染料的pkh26标记的外泌体。随后,将huvec和pkh26标记的外泌体共培养24小时,然后用4%多聚甲醛固定20分钟。然后根据制造商的说明用dapi(keygen,china)对核酸进行染色。通过激光共聚焦显微镜(olympus,usa)观察外泌体的内化。
71.4、rna干扰或过表达
72.mir-4782-5p inhibitors或mir-4782-5p mimics、circiasr1和vegfa过表达载体获自上海吉玛制药技术有限公司,通过lipofectamine stem转染试剂(thermofisher scientific)进行转染,其中,hsa-mir-4782-5p mimics和hsa-mir-4782-5p inhibitor的序列信息分别如下:
73.hsa-mir-4782-5p mimics序列如下:
74.uucuggauaugaagacaaucaagauugucuucauauccagaauu(seq id no:1)
75.hsa-mir-4782-5p inhibitor序列如下:
76.uugauugucuucauauccagaa(seq id no:2)
77.转染步骤如下:取生长良好huvecs细胞接种于6孔板中,镜下观察细胞生长至80%时进行转染。将500ng的sirna或过表达质粒0.1μg稀释于125μl无血清培养基中,在其中加入lipfectaminetm 2000转染试剂18μl,室温下共同孵育20min,之后加入含有700μl无血清培养基6孔板中,37℃孵育4h,加入1600μl的完全培养基,37℃培养48h,之后进一步进行相应的细胞功能实验。
78.5、实时定量pcr(qrt-pcr)和rnase r处理
79.使用trizol试剂(ambion,usa)从细胞中提取总rna,然后使用primescript生成cdnart master mix kit(takara,tokyo,japan)在oligo-dt引物存在下。使用powergreen pcr master mix(takara)在applied biosystems 7500序列检测系统(applied biosystem)上进行实时定量pcr检测。用rnase r进行处理(epicentre,madison,wisconsin,usa),1μg rna在37℃下用1个单位的rnase r消化20分钟。
80.6、western blot分析
81.将细胞在补充有1%pmsf的预冷的ripa裂解缓冲液(beyotime,上海,中国)中裂解,在冰上孵育30分钟,然后离心10分钟(12,000
×
g,4℃)。将通过sds-聚丙烯酰胺凝胶分离的蛋白质转移到硝酸纤维素膜上并与兔多克隆抗体一起孵育:抗vegfa和肌动蛋白(1:1000,cell signaling technology,ma,usa)。应用tanon扫描系统(tanon science&technology co.,ltd.,beijing,china)检测免疫反应蛋白条带。
82.7、细胞增殖实验(cck-8细胞增殖实验)
83.将huvec胰蛋白酶化并以3
×
103个细胞的密度接种在96孔板中。将pbs、exos或nr-cws-exos添加到细胞培养基中。然后,在第1、2、3、4和5天用cck-8试剂盒(vicmed,中国)检测细胞的增殖情况。并用酶标仪(thermo electron,usa)在450nm处测量细胞的吸光度。
84.8、细胞迁移侵袭实验(transwell实验)
85.将huvec以3
×
103个细胞/孔的密度接种到transwell的上腔室中。然后,将含有10%血清的600μl培养基加入下腔室中。在37℃的条件下,孵育24小时后,huvec用多聚甲醛固定20分钟,然后,用结晶紫(keygen,中国)染色20分钟。最后,在显微镜(olympus,japan)下观察细胞并通过imagej软件对细胞进行计数。
86.9、小管形成实验(tube formation assay)
87.将基质胶matrigel(corning,usa)以250μl/孔加入预冷的24孔板中,37℃的条件下孵育45分钟。然后,将huvec以5
×
104个细胞的密度接种到24孔板中并孵育6小时。最后,通过显微镜(olympus,japan)获得实验结果图,并通过imagej软件计数一个视图中的分支位点。
88.10、荧光素酶报告基因测定
89.在使用lipofectamine stem转染试剂进行指定处理的情况下,用启动子驱动的荧光素酶构建体或对照荧光素酶构建体在24孔板中以每孔1
×
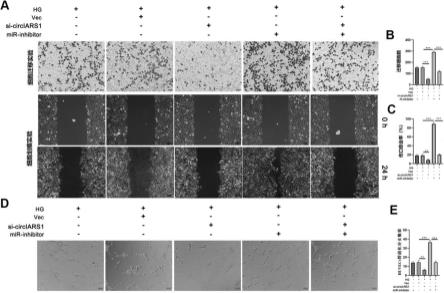
105的密度接种过夜的细胞转染24小时。根据制造商的说明,使用双荧光素酶试剂盒(promega,madison,wi)测量荧光素酶和海肾荧光素酶活性。
90.11、circrna下拉实验
91.对于circrna下拉实验,收获并裂解了107个细胞。将生物素化的circiars1探针(tsingke,武汉,中国)与链霉亲和素磁珠(invitrogen)在室温下孵育2小时以产生探针包被的珠子。洗涤珠子,并使用trizol试剂提取下拉材料中结合的mirna,并通过qrt-pcr分析进行分析。
92.12、rna结合蛋白免疫沉淀(rip)测定
93.使用magna rip rna结合蛋白免疫沉淀试剂盒(millipore,boston,ma)进行rip测定。细胞被裂解,并与人抗ago2抗体(millipore,03-110)或抗小鼠igg(millipore,03-110)缀合的磁珠共同孵育,并通过qrt-pcr测定检测免疫沉淀的rna。
94.13、荧光原位杂交(fish)
95.用于检测circiars1的cy3标记探针和用于检测mir-4782-5p的fam标记探针由genepharma(中国,上海)合成。根据制造商的说明,通过荧光原位杂交试剂盒(genepharma,中国,上海)检测探针的信号。使用蔡司lsm880显微镜以数字方式记录图像。
96.14、糖尿病伤口模型
97.糖尿病小鼠模型的构建方法如下:
98.实验所用小鼠为4-6周龄雌性小白鼠(购自于江苏华创信诺医药科技有限公司),所述小白鼠为无特定病原体级实验动物(spf级),体重从18g至24g不等,数量总共30只;
99.小鼠在spf级动物房饲养。小鼠在造模前禁食12-16h,并记录小鼠体重,以40mg/kg的2%的stz溶液(链脲佐菌素溶液)注射小鼠,连续5d。注射完成后第7天测血糖,采取小鼠尾静脉血,血糖仪测量血糖浓度并记录,当小鼠血糖浓度稳定大于16.7mmol/l,出现“多饮,多食,多尿和体重减轻”的典型糖尿病症状,视为造模成功,进行下一步动物实验。
100.糖尿病小鼠的分组和处理方式如下:
101.本研究的动物实验分组为3组,每组10只,分别是空白对照组(pbs缓冲液处理);exos处理组;nr-cws-exos处理组。
102.糖尿病小鼠模型构建成功后,以6.7mg/ml的戊巴比妥钠腹腔麻醉小鼠,麻醉后,去除小鼠毛发,在小鼠背部切取直径1.0cm的创面,分别将pbs、和提取的exos、nr-cws-exos以皮下注射方式注入各组的小鼠创缘皮肤,表面敷于无菌纱布,继续饲养观察。拍照并记录小鼠皮肤愈合情况。
103.15、伤口愈合评估
104.在收获前,用尺子测量每只小鼠背部受伤区域的大小,并记录在通过多点注射(6点)。伤口闭合率测量如下:伤口闭合指数(%)=(1-未愈合伤口面积/原始伤口面积)
×
100%。
105.16、组织学伊红和马松染色(eosin染色和masson染色)
106.治疗后14天处死动物,采集伤口和周围组织的皮肤活组织检查。通过苏木精和伊红(h&e,sigma)和马松三色(sigma)对采集的各组织进行染色。masson的三色染色用于测量小鼠伤口处新形成的真皮层厚度,h&e染色用于评估再上皮化率。
107.17、免疫荧光分析
108.cd31和tnf-α抗体(1:50,cell signaling technology)用于免疫荧光测定。dapi(abcam inc.,cambridge,uk)用于细胞核的染色。使用安装的camedia master数码相机收集免疫荧光图像(olympus,tokyo,japan)。
109.18、统计分析
110.数据表示为平均值
±
标准差(sd)。在spss 17.0软件(spss inc.,chicago,illinois,usa)中分析数据,使用t检验与对照组进行两两比较,或使用单向方差分析(anova)进行组间多重比较。p《0.05被认为具有统计学意义。
111.19、实验结果
112.(1)间充质干细胞(mscs)来源的外泌体(exos)的表征
113.收集mscs(未处理)和nr-cws处理的mscs的条件培养基,分别通过超速离心分离exos和nr-cws-exos。通过透射电子显微镜观察外泌体的形态,结果显示,每组中均观察到均质、球形和膜结合的囊泡,显示出典型的外泌体结构(见图1a);nta用于检测粒度,数据显示,exos和nr-cws-exos的尺寸分布均在约80-120nm处显示单峰(见图1b);此外,进行蛋白质印迹分析以鉴定外泌体标志物,结果显示,alix、tsg101和cd9在分离的exos和nr-cws-exos中表达(见图1c),exos和nr-cws-exos的粒径、形态和蛋白质表达相似,这一结果表明了mscs的外泌体分泌量不受nr-cws的影响,这些结果共同证实了外泌体的成功提取;此外,
本实施例研究了huvecs是否可以内吞msc-exos,pkh26标记的外泌体与huvec共培养,并通过激光扫描共聚焦显微镜观察,结果显示,在huvecs的核周区域发现了用pkh26(红色)标记的外泌体(见图1d和图1e),表明了huvecs对外泌体的内化。
114.(2)nr-cws-exos促进huvecs血管生成
115.为了研究exos对细胞血管生成的影响,本发明采用lg(低糖)、hg(高糖)、hg+exos和hg+nr-cws-exos处理了mscs。transwell用于检测细胞的迁移情况,结果显示,高糖抑制了huvecs的迁移,而exos和nr-cws-exos促进了高糖损害的huvecs的细胞迁移能力,且nr-cws-exos在细胞迁移中表现出更大的促进作用(见图2a和图2b)。小管形成实验显示了同样的实验结果,结果显示,exos和nr-cws-exos促进了受高糖损害的huvec的小管形成能力。与exos和hg组相比,在nr-cws-exos处理的huvec中观察到更多的管结构(见图2c和图2d);细胞增殖实验的结果表明,与exos和hg组相比,nr-cws-exos处理的huvec表现出很强的增殖能力(见图2e);血管生成相关基因(vegfa、bfgf、hgf)已被证明可促进血管的生成,本发明检测了这些基因的mrna相对表达水平,结果显示nr-cws-exos显著促进了vegf、bfgf和hgf的表达(见图2f)。这些结果表明了nr-cws-exos促进了huvecs血管的生成。
116.(3)nr-cws-exos加速糖尿病伤口的血管化
117.为了研究nr-cws-exos的促血管生成作用,本发明通过注射stz(链脲霉素)构建了糖尿病小鼠模型,并在每只小鼠的背部创建了两个全层皮肤伤口。在伤口部位周围多点皮下注射pbs(对照)、exos和nr-cws-exos以观察治疗伤口的效果。首先评估了糖尿病小鼠的伤口愈合过程,伤口的数码照片显示暴露于nr-cws-exos的糖尿病小鼠的伤口闭合速度最快,尽管与对照组(pbs)组相比,exos改善了伤口愈合(见图3a-图3b);进行h&e染色和masson染色以评估再上皮化和胶原形成,结果显示,exos和nr-cws-exos促进糖尿病创面皮肤再生和厚胶原纤维沉积,且nr-cws-exos组效果更好(见图3c-图3e);通过用cd31染色真皮微血管来评估nr-cws-exos在糖尿病小鼠血管生成中的作用,结果显示,与用pbs处理的伤口相比,在exos和nr-cws-exos处理的伤口中观察到大量的血管形成(见图3f和图3g);nr-cws-exos处理的伤口显示出比exos组更多的cd31阳性细胞((见图3h-图3m)。这些数据表明了nr-cws-exos加速了糖尿病伤口的血管化。
118.(4)nr-cws-exos增加huvecs的circiasr1表达
119.为了探索nr-cws-exos介导的促血管生成能力的潜在机制,本实施例采用hg、hg+exos和hg+nr-cws-exos处理huvec,并进行全转录组测序。观察到一系列变化的circrna,在变化的circrna中,circiasr1是上调最多的circrna(见图4a和图4b);qrt-pcr检测circiasr1表达情况的结果同样显示了circiasr1的高表达,nr-cws-exo显著增加了被高糖抑制的细胞中的circiasr1的表达水平(见图4c);我们通过huvec中的sanger测序证实了circiasr1的头对尾剪接(见图4d);circiasr1仅通过cdna中的不同引物扩增,但在gdna中没有扩增产物(见图4e);此外,circiasr1对rnase r具有抗性,而iasr1mrna被rnase r部分降解(见图4f),这些结果表明了nr-cws-exos增加huvecs中的circiasr1的表达。
120.所述环状rna circiasr1由来自iasr1基因的一个外显子(932bp)组成,iasr1基因的13-20号外显子环化形成,其核苷酸序列如下所示:
121.atcagacactcctctaatttacaaagcagtgcccagctggtttgtgcgagtggagaacatggtggaccagctcctaaggaacaatgacctgtgctactgggtcccagagttggtacgagaaaaacgatttggaaattggctgaa
agatgcacgtgactggacaatttccagaaacagatactggggcacccccatcccactgtgggtcagcgatgactttgaggaggtggtatgcattgggtcagtggcggaacttgaagaactgtcaggagcaaagatctcagatctccacagagagagtgttgaccacctgaccattccttcacgctgtgggaagggatccttgcaccgcatctctgaagtgtttgactgttggtttgagagtggcagcatgccctatgctcaggttcattacccgtttgaaaacaagagggagtttgaggatgcttttcctgcagatttcattgccgagggcatcgaccaaaccagaggatggttttataccctgctggtgctggccacggccctctttggacaaccgcctttcaagaacgtaattgtgaatgggcttgtcctggcaagtgatggccaaaaaatgagcaaacggaaaaagaattatccagatccagtttccatcatccagaagtatggtgctgatgccctcagattatatctgattaactcccctgtggtgagagcagaaaacctccgctttaaagaagagggtgtgcgggacgtccttaaggatgtactgctcccatggtacaatgcctatcgcttcttaatccagaacgttctgaggctccagaaggaggaagaaatagaatttctctacaatgagaacacggttagagaaagccccaacattacagaccggtggatcctgtccttcatgcagtctctcattggcttctttgagactgaaatggcag(seq id no:3)
122.(5)circiasr1介导nr-cws-exos对内皮细胞的促血管生成作用
123.本发明研究了circiasr1在nr-cws-exos诱导的内皮细胞促血管生成作用中的作用。transwell实验的结果显示,一旦nr-cws-exos中的circiasr1减少,nr-cws-exos的促细胞迁移作用就会受到抑制,相反,nr-cws-exos中增加的circiasr1能够显著促进内皮细胞的迁移(见图5a-图5c);与对照组相比,用mscs sicirciasr1-exos处理的huvec在matrigel上的管形成测定显示较少数量的毛细血管样结构,circiasr1-exos加强了nr-cws-exos对管形成的积极影响,usc-exos诱导vegf-a、bfgf和hgf的能力被显著抑制,当msc-exos中的circiasr1表达受到抑制时,显著抑制了血管的形成,当msc-exos中circiasr1表达上调时,circiasr1表达增加,显著促进了血管的形成(见图6a-图6d),这些结果表明了circiasr1是usc-exo诱导的内皮血管生成促进所必需的,circiasr1能够显著促进创面的愈合。
124.(6)circiasr1在内皮细胞中充当mir-4782-5p海绵
125.为了研究circiasr1调节血管生成的机制,本发明首先检测了它的位置,结果表明,circiasr1主要定位于细胞质(cyto)中(见图6a和图6b),表明了circiasr1可能作为mirna的分子海绵发挥作用,本发明进一步搜索了潜在的结合mirna并选择了五个候选mirna,随后,将生物素标记的探针应用于下拉测定中以探索circiasr1是否可以直接结合这些候选mirna,生物素标记的探针经验证可降低huvec中的circiasr1(见图7c);然后,将circiasr1探针用于下拉候选mirna,结果显示mir-4782-5p是唯一被circiasr1下拉的mirna(见图7d)。接下来,本发明应用生物素标记的mir-4782-5p来下拉circiasr1,数据证实biotin-mir-4782-5p捕获了更多的circiasr1(见图7e);为了证实这一预测,本发明通过将circiasr1的序列插入psicheck2质粒(野生型,wt)的3'utr中构建了一个双荧光素酶报告系统,结果显示,只有模拟mir-4782-5p组能够显著抑制荧光素酶的活性(见图7f);mirna通过以ago2依赖性方式结合其靶标来抑制翻译和降解mrna,ago2免疫沉淀结果显示,circiasr1在mir-4782-5p转染细胞中特异性富集(见图7g);rna fish测定结果显示,circiasr1和mir-301b-3p共定位于细胞质中(见图7h)。这些结果表明了circiasr1可以直接与mir-4782-5p结合。
126.(7)mir-4782-5p通过靶向vegfa抑制内皮细胞的血管生成
127.mirna通过序列引导识别在转录后调节其靶向mrna。根据mirdb的预测,发现mir-4782-5p可以与vegfa的3'-utr区域结合。本发明在mir-4782-5p结合位点构建了一个突变
的报告基因(mut)。结果显示,mir-4782-5p mimics强烈地降低了携带野生型vegfa 3'-utr的荧光素酶报告基因的活性,但mut3'-utr报告基因组中的荧光素酶报告基因活性没有变化(见图8a和图8b),mir-4782-5p mimics抑制vegfa表达,而mir-4782-5p抑制剂促进vegfa的表达(见图8c和图8d),接下来研究mir-4782-5p/vegfa在调节血管生成中的功能,结果显示,mir-4782-5p抑制血管生成和内皮细胞迁移,但上调vegfa表达挽救了细胞血管生成,相反,vegfa下调抑制了mir-4782-5p抑制剂诱导的血管生成和内皮细胞迁移(见图8e-图8f和图11a-图11f)。这些结果表明了mir-4782-5p通过靶向vegfa显著抑制内皮细胞的血管生成。
128.(8)circiasr1通过mir-4782-5p调节内皮细胞的血管生成
129.为了评估circiasr1是否通过mir-4782-5p促进内皮细胞的血管生成,通过将circiasr1和mir-4782-5p mimics共转染到huvec中进行了实验,huvec的transwell和小管形成测定结果显示,circiasr1的过表达导致迁移和血管生成能力的增加,这种效应是因mir-4782-5p的异位表达而部分减弱(见图9a-图9d);此外,发现与单独转染circiasr1的细胞相比,用circiasr1质粒和mir-4782-5p mimics共转染的huvec中vegfa的表达显著降低(见图9f-图9g),mir-4782-5p抑制剂mir-4782-5p inhibitor(mir-inhibitor)挽救了由circiasr1敲低诱导的huvecs的迁移和血管生成能力,并且vegfa的表达显示出相同的变化(见图10a-图10d),此外,结果还表明了抑制mir-4782-5p能够显著促进细胞的迁移、血管形成以及伤口愈合(见图10a-图10d),上述结果进一步证明了circiasr1和mir-4782-5p inhibitor均能显著促进创面的愈合,且来源自nr-cws预处理的msc的外泌体通过circiars1/mir-4782-5p/vegfa通路促进血管生成、促进糖尿病创面愈合。
130.上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1