一种用于治疗肺动脉高压的复方长效递药系统及其制备
1.本发明属于药物制剂领域,特别涉及一种类共晶体长效系统的制备与应用。
背景技术:
2.肺动脉高压(pulmonary arterial hypertension,pah)是环境、遗传等多种因素引起肺动脉阻力进行性增高、肺血管重塑、右室肥厚,并最终引起右心衰竭甚至死亡的一种恶性心血管疾病。近年来临床上生存期有所延长,但仍无法治愈。现阶段批准的治疗策略中,主要是靶向内皮功能的三个重要通路:前列环素途径,一氧化氮(no)途径和内皮素途径。近年来,pah的治疗进展并不在于新通路的发现,而是新的联合治疗策略开发。在临床上,单独或组合使用pah靶向疗法可改善功能能力和血液动力学,并减少住院次数。但是,这些血管扩张剂并未针对pah发病机理的关键特征,也未显示出可降低死亡率的指标,该指标在5年时仍约为50%。pah病程的开始和进展与内皮功能失调有着密切关系。内皮功能失调在肺部血管重塑中表现为抗凝和修复功能受损,促进血管收缩,细胞因子和粘附分子的释放增加等。现在已经非常清楚异常的bmpr2信号会损坏内皮屏障功能,促进细胞增殖的加速,同时可能通过增强paec对细胞凋亡的敏感性来促进疾病的发生。以此为依据,本发明提出将扩张肺动脉血管的前列环素类药物曲前列尼尔和逆转内皮功能失调的他克莫司两种药物联合递送,达到标本兼治的治疗效果。同时,曲前列尼尔的靶蛋白ip受体在pah的炎症环境下会显著下调,而他克莫司作为抗炎药物,可以显著提升ip受体的表达,从而起到协同治疗的目的。
3.同时,pah作为一种慢性进展性疾病,长效给药能有效提高患者依从性。同时,针对包含他克莫司和曲前列尼尔在内的许多药物,都存在半衰期短和疏水性差的问题。现阶段的长效给药策略存在一些明显的缺点:静脉滴注的患者依从性低,肺部吸入制剂会引起咳嗽和咽喉刺激,皮下渗透泵需要侵入性手术并可能引发炎症。纳米晶是完全由药物组成的固体纳米颗粒,外层由稳定剂覆盖包裹,适合递送疏水性药物。当通过肌内或皮下途径给药时,载有药物的纳米晶显示出数月甚至长达一年的治疗效果。能实现长效治疗效果的原因是纳米晶在注射部位形成储库,疏水性药物从中缓慢释放。但已上市的纳米晶都是一种纳米药物晶体组成,难以解决疾病存在多靶点发病机理的问题。类共晶体可以同时递送两种及以上药物,通过多种药物多靶点治疗,发挥协同作用,从而提高疾病治疗效果。但现阶段类共晶体的应用多用于纳米级领域,存在稳定性差,易沉淀,释放速度快等问题。
4.因此本发明通过制备类共晶体,通过肌肉注射途径,实现两种药物缓慢稳定有效地释放,实现肺动脉高压的长效治疗。
技术实现要素:
5.本发明的目的之一在于构建一种稳定并易于制备的类共晶体长效系统。本发明使用两种疏水性药物溶于有机相中,通过反溶剂沉淀法形成类共晶体,可以实现两种药物的有效递送。为提高稳定性,使用牛血清白蛋白作为冻干保护剂,冷冻干燥成粉末保存。
6.本发明的目的之二在于提供该类共晶体在体外缓释与体内药代动力学缓释的应用。
7.本发明的目的之三在于提供该类类共晶体在患肺动脉高压的模型大鼠体内的长效治疗应用。
8.为达到以上目的,本发明通过以下技术方案加以实现:
9.本发明提供了一种类共晶体长效体系,其特征在于:所述实现长效的类共晶体包括:两种疏水性药物或一种疏水药物+一种水溶性药物和冻干保护剂白蛋白。
10.所述的类共晶体,其特征在于:所述疏水性药物选自他克莫司、环孢素a、曲前列尼尔、依前列醇、伊洛前列素、贝前列素、马西替坦、安倍生坦、伐地那非、匹伐他汀、罗格列酮中的任意一种或两种;水溶性药物选自西地那非、伊马替尼、二氯乙酸盐、西立伐他汀。
11.所述的类共晶体制备方法,其特征在于:
12.1)疏水性药物他克莫司和曲前列尼尔的质量比为1:1到20:1;
13.2)冻干保护剂牛血清白蛋白与他克莫司的质量比为1:1到5:1;
14.3)该类共晶体大小为0.5-4μm;
15.本发明还提供了所述类共晶体长效系统的制备方法,步骤如下:
16.(1)将他克莫司和曲前列尼尔原料药加入有机试剂(甲醇、乙醇、dmso、丙酮)中,超声溶解,优选丙酮作为有机相。
17.(2)将纯净作为水相。
18.(3)搅拌下将有机相逐渐滴加入到水相中,室温下搅拌1小时。
19.(4)通过减压蒸发法除去残留的丙酮,得到他克莫司-曲前列尼尔类共晶体。
20.(5)将类共晶体制剂中加入牛血清白蛋白作为冻干保护剂,真空冷冻干燥后得到固体粉末。
21.本发明中所述的类共晶体的制备方法,其特征在于:
22.(1)步骤(3)中所述的搅拌条件为500-2000转/分钟,优选1200-1300转/分钟。
23.(2)步骤(5)中所述的牛血清白蛋白为0-5mg/ml,优选1mg/ml。
24.(3)步骤(5)中所述的制剂冻干前置于-80℃中预冻1小时。
25.本发明中的关键步骤包括:类共晶体制备过程的处方筛选与稳定性考察,反溶剂共沉淀法制备类共晶体的方法确定。
26.共晶体是指药物活性成分(active pharmaceutical ingredient,api)和共晶形成物(cocrystal former,ccf)在氢键或其他非共价键的作用下结合而成的晶体(cn108440456a);本发明专利中,类共晶体被定义为两种及以上的疏水性小分子化学药物通过疏水相互作用从而存在于同一个晶格中的纳米级晶体,被称为类共晶体。
27.本发明关键点在于,通过筛选发现冻干剂种类和冻干剂的浓度参与了类共晶体形成,形成了ttles-1,其形成片状的微米结构。牛血清白蛋白不仅是冻干保护剂,同时也参与了共晶体形成。发明人对不加冻干保护剂(ttles-2)和冻干剂保护剂(ttles-1)做了比较,结果发现ttles-2为球状纳米晶体(200nm左右),而ttles-1为2μm的片状共晶体。同样制备的方法但缺冻干保护剂制备获得无定形的冻干保护剂ttles-3与ttles-1比较,结果显示ttles-1中的冻干保护剂掩盖了药物峰,可以证明冻干保护剂对于类共晶体起到了保护作用。类共晶体中他克莫司的释放结果显示,他克莫司在ttles-1中12h时释放完全,在ttle-2
中需要7h,游离药物仅需4h。类共晶体中曲前列尼尔的释放结果显示,曲前列尼尔在ttles-1中24h时释放完全,在ttle-2和游离药物中仅需要4h。类共晶体中他克莫司在大鼠体内的血液浓度水平结果显示,类共晶体ttles-1中的他克莫司可持续释放14天,浓度明显高于ttles-2,相对生物利用度为ttles-2的2倍。类共晶体中曲前列尼尔在体内的血液浓度水平结果显示,曲前列尼尔在体内可持续释放14天,浓度明显高于ttles-2,tre-nps。ttles-1的半衰期为ttles-2的10倍,tre-nps的3.5倍。
28.体内实验结果显示,与游离药物组相比,类共晶体ttles-1可以明显改善pah引起的右心肥厚。与游离药物组相比,类共晶体ttles-1治疗的造模大鼠的平均肺动脉压力明显下降;与造模后的生理盐水组和tre-nps相比,类共晶体ttles-1可以持续地减轻pah引起的右心室游离壁肥厚和肺动脉血流速度增快。
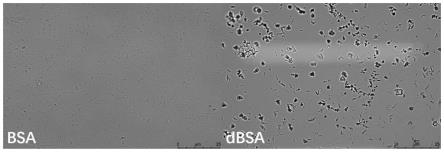
29.因此,本发明通过冻干剂选择,制备工艺选择,获得一种全新的他克莫司-曲前列尼尔类共晶体,其可以在在体内可持续释放14天,半衰期大大延长,并且具有显著的治疗效果。
30.有益效果
31.制备过程中不使用稳定剂,降低生产成本,提高安全性,通过反溶剂沉淀法同时把他克莫司和曲前列尼尔包裹制成类共晶体。该体系通过优选冻干保护剂种类、冻干保护剂浓度和制备方法,优选出在室温下可稳定储存的处方。同时与小粒径(200纳米级)的类共晶体的体内释放行为相比,本发明制备出的微米级类共晶体在体内的缓释效果更显著。与仅有一种药物的微米级晶体相比,类共晶体具有更好的长效治疗效果,体现出类共晶体递送两种药物的优势。该体系制备简单,不涉及复杂的化学合成,载药量高,毒性低,低温和室温储存条件下稳定,可实现两种药物同时缓慢释放,实现慢性疾病的长效治疗。
附图说明
32.图1为本发明中冻干保护剂分别为牛血清蛋白或变性牛血清蛋白时正置荧光显微镜下类共晶体ttles室温下保存14天后的形态图。
33.图2为本发明中牛血清蛋白含量为0,2,10mg时正置荧光显微镜下类共晶体ttles室温下保存14天后的形态图。
34.图3为本发明中不同制备方法时正置荧光显微镜下类共晶体ttles室温下保存14天后的形态图。
35.图4为本发明中类共晶体ttles-1的sem图。
36.图5为本发明中类共晶体ttles-2的粒径分布图。
37.图6为本发明中类共晶体ttles-2的tem图。
38.图7为本发明中正置荧光显微镜下纳米晶tre-nps的形态图。
39.图8为本发明中室温下储存30天后类共晶体ttles-1在正置荧光显微镜下的形态图。
40.图9为本发明中类共晶体的x射线衍射的结果图。
41.图10为本发明中类共晶体中他克莫司和曲前列尼尔的体外释放结果图。
42.其中a为他克莫司在体外的释放曲线,b为曲前列尼尔在体内的释放曲线。
43.图11为本发明中类共晶体中他克莫司在大鼠体内的血液浓度水平结果图。
44.图12为本发明中类共晶体中曲前列尼尔在大鼠体内的血液浓度水平结果图。
45.图13为本发明中类共晶体治疗的肺动脉高压造模大鼠的右心肥大指数结果图(*表示与造模后的生理盐水组的显著性差异对比,#表示与游离药物组的显著性差异对比)
46.图14为本发明中类共晶体治疗的肺动脉高压造模大鼠的平均肺动脉压力结果图。
47.图15为本发明中类共晶体治疗一周后的肺动脉高压造模大鼠的右心功能超声结果图。
48.其中a为给药一周后pah大鼠的肺动脉血流加速时间/射血时间b为给药一周后pah大鼠右心室游离壁厚。
49.图16为本发明中类共晶体治疗两周后的肺动脉高压造模大鼠的右心功能超声结果图。
50.其中a为给药两周后pah大鼠的肺动脉血流加速时间/射血时间b为给药两周后pah大鼠右心室游离壁厚。
具体实施方式
51.本发明所用的原料或试剂,均市售可得。
52.采用正置荧光显微镜、透射电镜、x射线衍射法等技术对类共晶体进行表征。
53.采用透析法进行体外释放动力学行为考察。
54.采用健康雄性大鼠。
55.以下结合具体实施实施例对本发明做进一步的阐述。
56.bsa:牛血清白蛋白
57.tre:曲前列尼尔
58.tac:他克莫司
59.mct:野百合碱
60.pah:肺动脉高压
61.实施例1:ttles-1冻干保护剂种类筛选
62.处方:
[0063][0064]
制备工艺:
[0065]
将1或5mg/ml的牛血清白蛋白溶液置于90℃水浴锅中变性30分钟,即得变性牛血清白蛋白。
[0066]
采用反溶剂沉淀法制备他克莫司-曲前列尼尔类共晶体(ttles-1)。称取2.4mg曲
前列尼尔和2mg他克莫司溶解于0.2ml丙酮中,作为有机相。量取2ml纯净水作为水相。搅拌状态下(1200-1300转/分钟),用注射器缓慢将有机相滴入水相中,并在室温下继续搅拌1小时。通过减压蒸发法将有机溶剂除去,并将制剂中加入2mg牛血清白蛋白或变性牛血清白蛋白作为冻干保护剂,在-80℃中预冻1h后,真空冷冻干燥,得到蓬松干燥的白色固体粉末。在室温下放置0,7,14天后,将粉末复溶,滴加至涂有黄原胶(10%,w/v)的载玻片上,置于正置荧光显微镜下观察类共晶体的形态。
[0067]
结果如表1和图1所示,使用bsa作为冻干保护剂比dbsa更加稳定。若冻干粉末不稳定,在显微镜下可观察到粒径变大,发生聚集;若冻干粉末稳定,在显微镜下可观察到粒径与刚制备成功时一样,分布均匀,粒径没有明显变化。
[0068]
表1.bsa与dbsa作为冻干保护剂的比较
[0069][0070]
实施例2:ttles-1冻干保护剂浓度筛选
[0071]
处方:
[0072]
曲前列尼尔2.4mg他克莫司2mg纯净水2ml牛血清白蛋白0,2,10mg
[0073]
采用反溶剂沉淀法制备他克莫司-曲前列尼尔类共晶体(ttles-1)。除使用不同浓度的bsa(0,2,10mg)以外,其余步骤同实施例2.
[0074]
结果如表2和图2所示,bsa作为冻干保护剂时,浓度为1mg/ml时最稳定。若冻干粉末不稳定,在显微镜下可观察到粒径变大,发生聚集;若冻干粉末稳定,在显微镜下可观察到粒径与刚制备成功时一样,分布均匀,粒径没有明显变化。
[0075]
表2.bsa浓度筛选
[0076][0077]
实施例3:ttles-1制备方法筛选
[0078]
处方:
[0079]
曲前列尼尔2.4mg
他克莫司2mg纯净水2ml牛血清白蛋白2mg
[0080]
采用反溶剂沉淀法制备他克莫司-曲前列尼尔类共晶体(ttles)。筛选不同的制备方法:将有机相加入水相后,室温下搅拌1小时或者冰浴下超声5分钟(50w,开2s,关2s)或者在液氮中搅拌2分钟。其余步骤同实施例1。
[0081]
结果如表3和图3所示,当在室温下搅拌1h时,制剂最为稳定。若冻干粉末不稳定,在显微镜下可观察到粒径变大,发生聚集;若冻干粉末稳定,在显微镜下可观察到粒径与刚制备成功时一样,分布均匀,粒径没有明显变化。
[0082]
表3.不同混合方式对稳定性的影响
[0083][0084]
实施例4 ttles-1制备
[0085]
处方:
[0086][0087][0088]
制备工艺:
[0089]
采用反溶剂沉淀法制备他克莫司-曲前列尼尔类共晶体(ttles-1)。称取2.4mg曲前列尼尔和2mg他克莫司溶解于0.2ml丙酮中,作为有机相。量取2ml纯净水作为水相。搅拌状态下(1200-1300转/分钟),用注射器缓慢将有机相滴入水相中,并在室温下继续搅拌1小时。通过减压蒸发法将有机溶剂除去,并将制剂中加入2mg牛血清白蛋白作为冻干保护剂,在-80℃中预冻1h后,真空冷冻干燥,得到蓬松干燥的白色固体粉末。将粉末复溶后,滴加至涂有黄原胶(10%,w/v)的载玻片上,置于正置荧光显微镜下观察类共晶体的形态。
[0090]
结果如图4所示,ttles-1为粒径在2μm左右的片状晶体。
[0091]
实施例5 ttles-2制备(纳米级类共晶体制备)
[0092]
处方:
[0093]
曲前列尼尔2.4mg他克莫司2mg纯净水2ml
[0094]
制备工艺:
[0095]
采用反溶剂沉淀-超声法制备他克莫司-曲前列尼尔类共晶体(ttles-2)。称取2.4mg曲前列尼尔和2mg他克莫司溶解于0.2ml丙酮中,作为有机相。量取2ml纯净水作为水相。4℃搅拌状态下(1200-1300转/分钟),用注射器缓慢将有机相滴入水相中,转移至探头超声,冰浴条件下超声10分钟,通过减压蒸馏法将有机溶剂除去,获得他克莫司-曲前列尼尔类共晶体(ttles-2)。
[0096]
结果如图5和图6所示,ttles-2的粒径为192.83
±
6.48nm,pdi为0.267
±
0.131,形状为球型
[0097]
实施例6 tre-nps制备(只含有曲前列尼尔的微米级晶体制备)
[0098]
处方:
[0099]
曲前列尼尔2.4mg纯净水2ml牛血清白蛋白2mg
[0100]
制备工艺:
[0101]
采用反溶剂沉淀法制备曲前列尼尔纳米晶(tre-nps)。称取2.4mg曲前列尼尔溶解于0.2ml丙酮中,作为有机相。量取2ml纯净水作为水相。搅拌状态下(1200-1300转/分钟),用注射器缓慢将有机相滴入水相中,并在室温下继续搅拌1小时。通过减压蒸发法将有机溶剂除去,并将制剂中加入2mg牛血清白蛋白作为冻干保护剂,在-80℃中预冻1h后,真空冷冻干燥,得到蓬松干燥的白色固体粉末。将粉末复溶后,滴加至涂有黄原胶(10%,w/v)的载玻片上,置于正置荧光显微镜下观察类共晶体的形态。
[0102]
结果如图7所示,tre-nps为粒径在1-3μm左右的片状晶体。
[0103]
实施例7考察他克莫司-曲前列尼尔类共晶体的包封率和载药量
[0104]
为考察他克莫司-曲前列尼尔类共晶体的包封率和载药量,采用超高速离心法分离制剂和游离药物,高效液相检测药物含量。具体步骤为:应用实施例1,实施例2制备ttles-1和ttles-2,4℃下16000r/min离心30分钟,取上清20μl进样,通过峰面积计算得游离药物含量。分别取1mlttles-1和ttles-2,加入4ml乙腈破乳,超声20min,冷却至室温后,加入乙腈定容至刻度,经0.45μm微孔滤膜,过滤后取滤液20μl进样,通过峰面积计算得制剂总的药物含量。
[0105]
包封率=游离药物的含量/制剂中总的药物含量
×
100%
ꢀꢀ
(1)
[0106]
载药量=游离药物的含量/(载体的质量+制剂中总的药物含量)
×
100%
ꢀꢀ
(2)
[0107]
按公式(1)(2)分别计算制剂的包封率和载药量。
[0108]
结果表明,ttles-1中tac的包封率为95.92%
±
4.43,载药量为49.80%
±
1.41;tre的包封率为96.62%
±
1.74,载药量为50.20%
±
1.41。ttles-2中tac的包封率为99.52%
±
0.03,载药量为50.48
±
0.06;tre的包封率为97.62
±
0.23,载药量为49.52
±
0.06。
[0109]
实施例8考察他克莫司-曲前列尼尔类共晶体的稳定性
[0110]
为考察类共晶体制剂在室温下的稳定性,应用实施例1制备ttles-1,将固体粉末置于室温下保存,于30天后用纯净水复溶,将ttles-1用正置荧光显微镜观察。
[0111]
结果如图8显示,ttles-1的形态与粒径没有发生明显变化,微粒并无聚集情况。
[0112]
实施例9验证他克莫司-曲前列尼尔类共晶体的形成
[0113]
处方
[0114]
曲前列尼尔2.4mg他克莫司2mg纯净水2ml
[0115]
制备工艺:
[0116]
采用反溶剂沉淀法制备他克莫司-曲前列尼尔类共晶体(ttles-3)。称取2.4mg曲前列尼尔和2mg他克莫司溶解于0.2ml丙酮中,作为有机相。量取2ml纯净水作为水相。搅拌状态下(1200-1300转/分钟),用注射器缓慢将有机相滴入水相中,并在室温下继续搅拌1小时。通过减压蒸发法将有机溶剂除去,4℃下16000r/min离心30分钟,将沉淀60℃真空干燥2小时,得到白色固体粉末ttles-3。
[0117]
本实施例与实施例5区别在于,本实施例采用室温搅拌,无超声过程。为研究他克莫司-曲前列尼尔类共晶体中两种药物的晶体结构,使用x射线衍射仪进行考察,并且为了减少冻干保护剂对于药物峰的掩盖,不进行冷冻干燥。
[0118]
结果如图9所示,ttles-3中存在于物理混合物相同药物特征峰,同时由于两种药物是以杂晶的形式存在,有新的衍射峰出现。对于加入了冻干保护剂的ttles-1,可以发现无定形的冻干保护剂掩盖了药物峰,可以证明冻干保护剂对于类共晶体起到了保护作用。
[0119]
实施例10考察他克莫司-曲前列尼尔类共晶体体外缓释行为
[0120]
为了验证他克莫司-曲前列尼尔类共晶体具有缓释作用,考察制剂在体外的药物释放动力学。
[0121]
具体步骤为:应用实施例1,实施例2制备ttles-1,ttles-2,精密量取1ml ttles-1,ttles-2和游离tac/tre装入透析袋(mwco 3500da),将透析袋扎紧,置于ph 7.2的30mlpbs释放介质(含20%sds)中,37℃水浴恒温120rpm振荡,于1h、2h、4h、6h、8h、12h、24h、36h和48h取出1ml释放介质,并补充相应等体积新鲜释放介质。以游离共溶药物tac/tre作为对照,采用高效液相色谱-紫外检测法(hplc-uv)测定释放介质中的tac,tre含量,计算累积释放百分率。
[0122]
类共晶体中他克莫司的释放结果如图11所示,他克莫司在ttles-1中12h时释放完全,在ttle-2中需要7h,游离药物仅需4h。
[0123]
类共晶体中曲前列尼尔的释放结果如图10所示,曲前列尼尔在ttles-1中24h时释放完全,在ttle-2和游离药物中仅需要4h。
[0124]
实施例11考察他克莫司-曲前列尼尔类共晶体的体内缓释效果
[0125]
应用实施例1制备微米级他克莫司-曲前列尼尔类共晶体(ttles-1),实施例5制备纳米级他克莫司-曲前列尼尔类共晶体(ttles-2),实施例6纳米级曲前列尼尔晶体(tre-nps),考察制剂在大鼠体内的缓释效果。将18只健康的雄性大鼠(200-250g)随机分为三组(n=6),编号;分别在第0天肌肉注射ttles-1,ttles-2和tac/tre生理盐水共溶液,于第0.02,0.04,0.125,0.208,1,3,5,9,14天进行眼眶取血,将血液离心后取上清血浆,进行前
处理。前处理步骤为:取100μl血浆中加入10μl is溶液和20μl乙酸,混合,加入300ul甲醇,涡旋5min后离心(15000r/min,10min),取1μl进样,用lc-ms/ms进行定量检测。
[0126]
类共晶体中他克莫司在大鼠体内的血液浓度水平结果如图11所示,类共晶体ttles-1中的他克莫司可持续释放14天,浓度明显高于ttles-2,相对生物利用度为ttles-2的2倍。
[0127]
类共晶体中曲前列尼尔在体内的血液浓度水平结果如图12所示,曲前列尼尔在体内可持续释放14天,浓度明显高于ttles-2,tre-nps。ttles-1的半衰期为ttles-2的10倍,tre-nps的3.5倍。
[0128]
实施例13:考察他克莫司-曲前列尼尔类共晶体的体内长效治疗效果
[0129]
应用实施例1制备他克莫司-曲前列尼尔类共晶体,考察制剂对于pah造模大鼠的长效治疗效果。将24只健康的雄性大鼠(200-250g)随机分为四组(n=6),编号;前三组皮下注射野百合碱溶液(60mg/kg),第四组皮下注射生理盐水,注射后第三周造模成功,分别注射肌肉注射ttles-1,tac/tre生理盐水共溶液和生理盐水。给药后第二周测量平均肺动脉压力(mpap)和右心肥大指数(rvhi)。
[0130]
结果如图13所示,与游离药物组相比,类共晶体ttles-1可以明显改善pah引起的右心肥厚。
[0131]
结果如图14所示,与游离药物组相比,类共晶体ttles-1治疗的造模大鼠的平均肺动脉压力明显下降。
[0132]
实施例14:考察他克莫司-曲前列尼尔类共晶体的体内长效治疗效果
[0133]
应用实施例4制备他克莫司-曲前列尼尔类共晶体,应用实施例5制备曲前列尼尔纳米晶,考察制剂对于pah造模大鼠的长效治疗效果。将24只健康的雄性大鼠(200-250g)随机分为四组(n=6),编号;前三组皮下注射野百合碱溶液(60mg/kg),第四组皮下注射生理盐水,注射后第三周造模成功,分别注射肌肉注射ttles-1,tac/tre生理盐水共溶液和生理盐水。给药后第一周和第二周用小动物超声成像系统检测大鼠的右心功能。
[0134]
结果如图15,16所示,与造模后的生理盐水组和tre-nps相比,类共晶体ttles-1可以持续地减轻pah引起的右心室游离壁肥厚和肺动脉血流速度增快。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1