红色诺卡氏菌细胞壁骨架在治疗慢性宫颈炎中的应用的制作方法
1.本公开涉及医学、生物制药领域。具体而言,本公开涉及红色诺卡氏菌细胞壁骨架在治疗慢性宫颈炎中的应用。
背景技术:
2.慢性宫颈炎为育龄期妇女最常见的疾病,常由链球菌、肠球菌、大肠杆菌和葡萄球菌引起,特殊的病原微生物包括沙眼衣原体、淋球菌。此外,分娩、机械损伤也是慢性子宫颈炎的诱发因素。
3.红色诺卡氏菌(nocardia rubra)是诺卡氏菌中的一种。红色诺卡氏菌的菌体经发酵、细胞破碎、蛋白酶降解后可制得红色诺卡氏菌细胞壁骨架。
4.现有技术中,红色诺卡氏菌细胞壁骨架可以是市售获得,具体而言由辽宁格瑞仕特生物制药有限公司生产的商品。红色诺卡氏菌细胞壁骨架已用于治疗宫颈癌前病变(cn101073583a)、抗人乳头瘤病毒(cn1935262a)、皮肤损伤或皮肤溃疡(cn101209267a)、真菌感染、单纯疱疹、带状疱疹(cn1879661a)。
技术实现要素:
5.第一方面,本公开提供了一种红色诺卡氏菌细胞壁骨架。
6.红色诺卡氏菌是指nocardia属的红色诺卡氏菌种(nocardia rubra)。
7.红色诺卡氏菌的鉴定:根据已知的或未来的微生物鉴定技术,技术人员可以对一株细菌进行分类学鉴定,例如可用的鉴定技术包括形态学、生理生化特征、16s rrna等。技术人员理解,随着科技的发展,鉴定技术涉及不同的手段,在较早的时期主要采用形态学和生化鉴定方式,但是这种方法的可靠程度不高。测序技术出现后,技术人员可以利用更为可信的方式鉴定菌株。例如,当16s rrna的dna序列被鉴定为具有97%(含)以上相似性时,判定两个菌属于相同的种。就红色诺卡氏菌而言,将保藏在国际(或国家级)菌种保藏单位中的已知菌株作为模式菌株,并与其进行比对。
8.本公开中,“红色诺卡氏菌细胞壁”既可以理解为完整的细胞壁,也可以理解为不完整的细胞壁(例如,破碎的、或部分降解的)。在本公开的教导下,技术人员将理解,显示出所需活性的成分来自红色诺卡氏菌的细胞壁(例如,是细胞壁本身或其组成成分)。因此,在临床应用中允许采用完整的细胞壁、经破碎的细胞壁、细胞壁的不完全降解产物、细胞壁的组成成分、细胞壁的提取物等各种形式,这些都包含在本公开范畴之内。
9.本公开的细胞壁骨架不能理解为仅仅表示细胞壁当中的交联网状实体,技术人员应理解该术语不排除交联网状实体上所吸附、结合、携带的其他细胞壁成分。
10.在具体的示例中,本公开的细胞壁骨架是细菌经破碎、除杂(蛋白、核酸、细胞膜、脂质)后所得的产物。
11.在具体的实施方案中,细胞壁骨架是国药准字s20030009或其等同标准对应的红色诺卡氏菌细胞壁骨架。
12.技术人员应当理解,s20030009是药监管理部门发放的行政许可初始编号,此编号随着证件的更新、法律、编号规则的调整而变化。然而,无论编号如何变化,其所代表的产品标准(产品参数和/或质量要求)是不变的。因此,本公开中s20030009应理解为还包括:s20030009本身、其等同编号、更新编号对应的细胞壁骨架,也包括与s20030009具有相同产品参数和/或质量要求的细胞壁骨架。
[0013]“具有相同产品参数和/或质量要求的细胞壁骨架”或“等同标准对应的细胞壁骨架”是指在相同的测试方法下,待测细胞壁骨架和s20030009所示细胞壁骨架具有无统计学显著差异的活性成分(胞壁酸、糖、脂质)。
[0014]
在另一些实施方案中,所述红色诺卡氏菌细胞壁骨架通过以下方法获得,所述方法包括以下步骤或由以下步骤组成:
[0015]
1)提供红色诺卡氏菌;
[0016]
2)破碎所述红色诺卡氏菌,得到破碎产物;
[0017]
3.1)对所述破碎产物去除脂质;
[0018]
3.2)对所述破碎产物去除核酸;
[0019]
3.3)对所述破碎产物去除蛋白质;
[0020]
3.4)对所述破碎产物去除细胞膜;
[0021]
3.5)得到红色诺卡氏菌细胞壁骨架;
[0022]
4)任选地,分装;
[0023]
5)任选地,对所述红色诺卡氏菌细胞壁骨架进行冷冻干燥;
[0024]
步骤3.1)、3.2)、3.3)、3.4)能够互换或并行,步骤4)和步骤5)能够互换。
[0025]
对于红色诺卡氏菌的破碎,其目的在于去除细胞内的物质。因此可以采用超声破碎、高压均质机破碎、溶菌酶等技术。技术人员理解,任何适用于破碎革兰氏阳性菌的已知或未来方法,均适用于本公开的技术方案。
[0026]
技术人员有能力根据活性成分(细胞壁及其组成成分)的后续应用(例如外敷),来调整培养、破碎、分离、收集、除杂质、分装的具体参数和设备,以免制备步骤中引入影响后续应用的因素。
[0027]
在一些实施方案中,利用有机溶剂去除破碎产物中的脂质。在一些实施方案中,利用核酸酶去除破碎产物中的dna和rna。在一些实施方案中,利用水解酶降解破碎产物中的蛋白质。在一些实施方案中,利用表面活性剂去除破碎产物中的细胞膜。
[0028]
在一些实施方案中,破碎的平均粒度为10nm至1000nm;可以提及10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190nm
±
10nm,以及上述任意两个数值之间的范围。粒度的测试方法是现有技术公知的。
[0029]
在一些具体的实施方案中,破碎的平均粒度为10nm至800nm。
[0030]
在另一些具体的实施方案中,破碎的平均粒度为10nm至500nm。
[0031]
在具体的实施方案中,所述分装是指分装至瓶或安瓿中。临用前,向瓶或安瓿中添加溶剂(如无菌水)。作为一个示例,瓶是指西林瓶(vial,由硼硅玻璃或钠钙玻璃制成)。
[0032]
第二方面,本公开提供了前述红色诺卡氏菌细胞壁骨架在制备药物中的用途,其中所述药物用于在受试者中预防或治疗伴有高危型hpv感染的慢性宫颈炎。
[0033]
所述高危型hpv选自以下的任一项或其组合:16、18、31、33、35、39、45、51、52、53、
56、58、59、66、68型。
[0034]
所述慢性宫颈炎选自以下的任一项或其组合:宫颈柱状上皮异位、宫颈息肉、宫颈粘膜炎、宫颈腺囊肿、宫颈肥大(分类可见于例如《妇产科学》人民卫生出版社出版,第七版)。
[0035]
在一些实施方案中,宫颈柱状上皮异位是慢性宫颈炎的炎性病变过程中最多见的局部特征。宫颈表面呈红色病损,是鳞状上皮脱落,为柱状上皮所代替,上皮下血管显露的结果。临床常根据病灶面积,将其分成轻i
°
(病灶面积小于子宫颈总面积1/3)、中ii
°
(1/3-1/2)、重度iii
°
(超过1/2)。
[0036]
在一些实施方案中,宫颈息肉是慢性宫颈炎表现之一。由于慢性炎症长期刺激,使宫颈管局部黏膜增生,因子宫有排除异物倾向,可使增生的黏膜逐渐自基底部向宫颈外口突出而形成息肉。
[0037]
在一些实施方案中,宫颈粘膜炎是慢性宫颈炎常见的表现之一。病变位于宫颈管粘膜及粘膜下组织。
[0038]
在一些实施方案中,宫颈腺囊肿是慢性宫颈炎常见的表现之一。宫颈柱状上皮异位恢复过程中,新生的鳞状上皮覆盖宫颈腺管口或伸入腺管,将腺管口阻塞;腺管周围的结缔组织增生或瘢痕形成压迫腺管,使腺管变窄甚至阻塞,腺体分泌物引流受阻,滞留形成的囊肿叫宫颈纳氏囊肿。宫颈腺囊肿是炎症,而非肿瘤。
[0039]
在一些实施方案中,宫颈肥大是慢性宫颈炎的一种。病原体感染宫颈粘膜引起的炎性改变。肥大的宫颈表面由于损伤或炎症刺激也会出现鳞状上皮脱落、柱状上皮增生。
[0040]
在一些实施方案中,所述药物制备成选自以下任一项的剂型:注射剂、膏剂、霜剂、乳液、混悬剂、糊剂、凝胶剂、洗剂、片剂、气雾剂、喷雾剂、搽剂、粉剂、敷料、绷带、膜、贴片、栓剂。
[0041]
第三方面,本公开提供了一种用于在受试者中预防或治疗伴有高危型hpv感染的慢性宫颈炎的药物组合物或药物,其包含:药学上可接受的载体和本公开的红色诺卡氏菌细胞壁骨架。
[0042]
本公开的药物组合物或药物可以制备成单位剂量(或单元制剂)的形式。
[0043]
在一些实施方案中,药物组合物或药物可以制备成液态的(液体制剂)。
[0044]
在另一些实施方案中,药物组合物或药物可以制备成固体的(干粉制剂或冻干粉制剂)。
[0045]
技术人员理解,液体制剂和干粉制剂(或冻干粉制剂),二者可以相互转化,差别仅在于含水量。除去液体制剂中的绝大部分或全部水,得到干粉制剂(或冻干粉制剂)。干粉制剂(或冻干粉制剂)溶解(或复溶)后得到液体制剂。
[0046]
在一些实施方案中,所述药学上可接受的载体选自,但不限于:填充剂、稳定剂(例如海藻糖、甘氨酸)、矫味剂(例如木糖醇)、崩解剂(例如羧甲基纤维素钠)、粘合剂(例如明胶)、润滑剂(例如硬脂酸镁)。
[0047]
在一些实施方案中,稳定剂选自以下的一种或组合:甘氨酸、赖氨酸、精氨酸、羟乙基淀粉、羟甲基淀粉、海藻糖、葡聚糖。
[0048]
在一些实施方案中,矫味剂选自以下的一种或组合:蔗糖、单糖、糖精钠、阿斯巴甜、山梨醇、木糖醇、甘露醇。
[0049]
在一些实施方案中,粘合剂选自以下的一种或组合:羧甲基纤维素钠、羟丙甲纤维素、明胶。
[0050]
在一些实施方案中,润滑剂选自以下的一种或组合:有滑石粉、硬脂酸镁、微粉硅胶。
[0051]
在一些具体的实施方案中,适用于本公开的药学上可接受的载体还可以提及,例如但不限于:右旋糖酐、乳糖、微晶纤维素、海藻糖、甘氨酸、木糖醇、羧甲基纤维素钠、赤藓糖醇、明胶、硬脂酸镁、抛射剂、保湿剂、溶剂、增溶剂、乳化剂、抗氧化剂、ph调节剂、防腐剂。具体而言,非限制实例还包括:白凡士林、卡波姆、羟丙甲纤维素、甲基纤维素、羟甲基纤维素钠、壳聚糖、硫糖铝壳聚糖、聚乙烯吡咯烷酮、聚乙烯醇、玻璃酸钠、二甲醚、四氟乙烷、氢氟烷烃、甘油、丙二醇、去离子水、注射用水、蒸馏水、乙醇、十六醇、十八醇、对氨基苯甲酸、乙酰胺、异丙醇、吐温、聚氧乙基氢化蓖麻油、硬脂酸、单硬脂酸甘油酯、三聚甘油单硬脂酸酯、脂肪酸蔗糖酯、蔗糖酯、乙酸异丁酸蔗糖糖酯、山梨醇酐三硬脂酸酯、肉豆蔻酸异丙酯、胆固醇、角鲨烯、角鲨烷、正丁醇、乙二醇、乙醇、丙二醇、聚甘油酯、亚硫酸盐、半胱氨酸、二叔丁基羟基甲苯、山梨酸钾、磷酸缓冲溶液、三乙醇胺、氢氧化钠、乙二胺、月桂胺、碳酸氢钠、盐酸、尼泊金类、硫柳汞、氯甲酚、三氯叔丁醇、苯甲酸及其钠盐。
[0052]
第四方面,本公开提供一种在受试者中预防或治疗伴有高危型hpv感染的慢性宫颈炎的方法,包括步骤:向受试者施用治疗有效量的本公开的红色诺卡氏菌细胞壁骨架或药物组合物。
[0053]“施用”、“提供给”、“处理”当应用于动物、人、细胞、组织、器官或生物样品时,是指药物或医疗装置与动物、人、细胞、组织、器官或生物样品接触。
[0054]“治疗”意指给予受试者内用或外用药物(治疗剂、活性成分或组合物)(如,本公开的外泌体或药物组合物)或医疗装置,在被治疗的受试者(或群体)中缓解(减轻、延迟、改善、治愈)一种或多种疾病症状,以至于达到临床可测量的程度,其中所述的受试者已经患有、疑似患有或易感于一种或多种疾病或其症状。
[0055]
有效缓解任何疾病症状的药物(治疗剂、活性成分或组合物)的量,称为治疗有效量。可根据多种因素变化,例如受试者的疾病状态、年龄和体重。应当理解,在缓解单个受试者的目标疾病或其症状时,药物(治疗剂、活性成分或组合物)可能无效,但是根据本领域已知的任何统计学检验方法(如student t检验、卡方检验、依据mann和whitney的u检验)确定,药物(治疗剂、活性成分或组合物)在统计学意义上对目标疾病或其症状是有效的。
[0056]
在一些具体的实施方案中,受试者是人以外的动物,例如用于农场动物、宠物、工作动物、观赏动物、生产动物、实验动物(如大鼠、小鼠、豚鼠、兔、犬、灵长类)。
[0057]
在一些具体的实施方案中,受试者是人。在一些具体的实施方案中,受试者疑似患有、确诊患有、已经患有、或易感于目标疾病或其症状。
[0058]
在一些实施方案中,一天施用1-3次,或一天施用一次,或二天施用一次。视患者病灶的面积及程度不同,采用不同的剂量。
[0059]
在一些实施方案中,施用周期持续2天至6月,例如,1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周或更长、以及前述任意两个数值之间的范围。
[0060]
同一药物活性成分或不同药物活性成分可一次性施用,或者可分成许多更小的单
位剂量,以一定时间间隔施用。应理解治疗的确切剂量、持续时间、间隔时间是所治疾病的函数,并且可使用动物或临床试验数据推断而确定。所述施用可包括单次施用,或者间隔适当时间间隔的两次或更多次施用。其中,相邻两次的施用可间隔30分钟、40分钟、50分钟、60分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、一天半、2天、3天、4天、5天、6天、7天、8天、9天、10天、1周、2周、3周、4周、5周、6周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或12个月。
[0061]“任选”意味着其随后所描述的事项可以发生,但不必须发生;需要视情况而定。例如,“任选地,进行分装”意味着允许对产品进行分装,但是不是必须进行分装。
[0062]“一个”、“一”、“单个”、“该”,如果没有明确说明,也包括复数形式。
[0063]
当提及数值范围时(比如60μg至120μg),这是一种简写方式,视为将范围内的每一个值被明确提及,包括小数和整数。
具体实施方式
[0064]
以下结合实施例进一步描述本公开。但这些实施例并非限制着本公开的范围。当未注明具体条件时,按照常规条件、按照原料供应商所建议的条件操作。未注明具体来源的试剂,为市场购买的常规试剂。
[0065]
实施例
[0066]
实施例1.市售的红色诺卡氏菌细胞壁骨架
[0067]
红色诺卡氏菌细胞壁骨架购自辽宁格瑞仕特生物制药有限公司,国药准字s20030009(每支中细胞壁骨架的固体含量应不少于60μg,其中胞壁酸含量不低于1.0μg,糖含量不低于4.0μg;复溶体积为2.0ml)。
[0068]
实施例2.红色诺卡氏菌细胞壁骨架的制备
[0069]
国药准字s20030009细胞壁骨架的制备方法与以下步骤本质上无显著差异,但因为生产规模不同,可进行调整。
[0070]
因而,作为一个替代,可以采用以下步骤制备细胞壁骨架:
[0071]
1.按照公知的方法培养菌体,并收集。对细胞进行破碎(例如超声波破碎或高压均质机破碎)。也允许采用本领域任何适当的公知方法对菌体进行破碎。显微镜下检查破碎的情况,每个视野有形菌不得超过5个,检查若干(10至30个)视野均达到此标准为合格。
[0072]
2.除核酸:将破碎上清液进行离心,获得的沉淀物中加入dna酶和rna酶,按照酶的供应商建议的操作去除核酸。
[0073]
3.除蛋白质:沉淀物加入常见的蛋白酶(例如胰蛋白酶),按照酶的供应商建议的操作去除蛋白质。
[0074]
4.除脂质:沉淀物中加入有机试剂(如丙酮、乙醚、乙醇中的一种或组合),按照本领域常规操作去除脂质。
[0075]
5.除细胞膜:沉淀物中加入tritonx-100,离心收集沉淀物,用pbs漂洗。
[0076]
应当理解,上述除去杂质的步骤之间,技术人员可以调整先后顺序,使得步骤之间兼容。去除非细胞壁成分后,将沉淀物复溶于注射用水,待用。任选地,可以在115℃下灭菌20-30分钟,作为细胞壁骨架的原液。
[0077]
实施例3.药物组合物的示例性制备方法
[0078]
1.将实施例1或2所得产物涂覆在敷料(例如无菌纱布)上,制备成外用药物。
[0079]
2.将实施例2所得产物制成冻干粉。
[0080]
3.也可以采用本领域公知的洗剂制备方法,例如:洗剂多以水和醇为分散介质;由活性成分、电解质、等渗调节剂等在分散介质中制成。
[0081]
4.将实施例1或2所得产物制备成胶囊。
[0082]
5.将实施例1或2所得产物溶于注射用水制成注射剂。
[0083]
6.将实施例1或2所得产物制备成阴道栓。
[0084]
效果例
[0085]
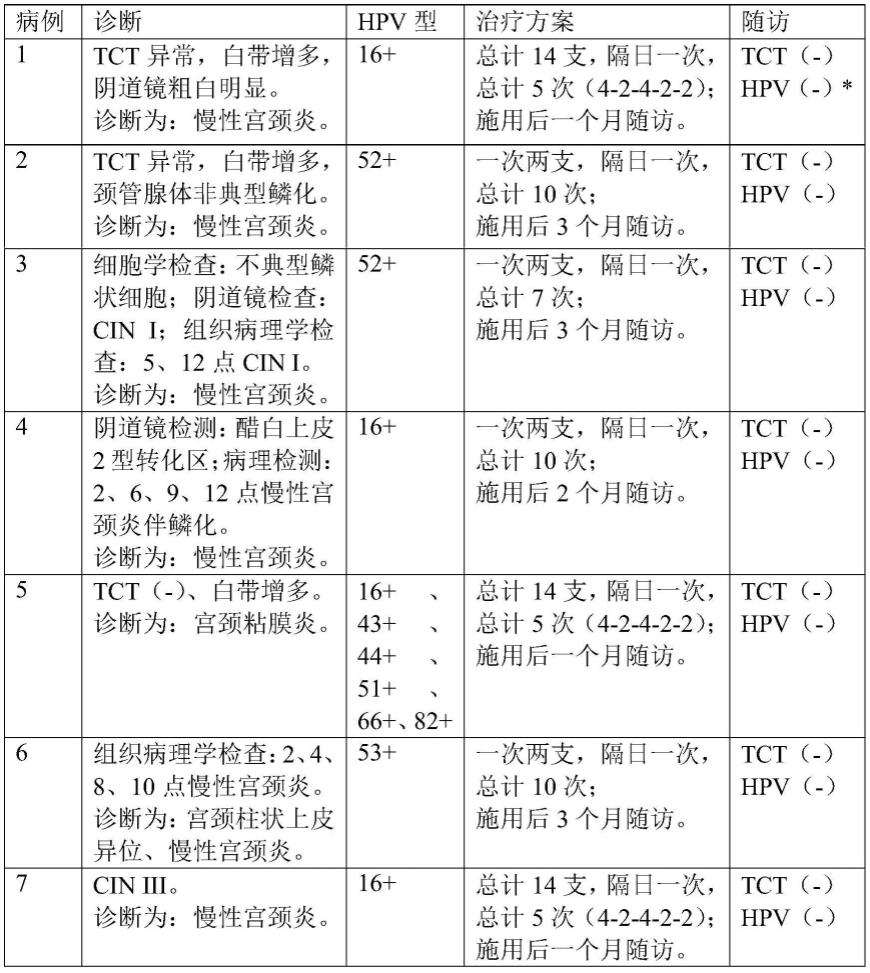
向临床确诊为慢性宫颈炎的受试者,施用实施例1的细胞壁骨架。治疗结果见表1。
[0086]
表1
[0087]
[0088][0089]
*hpv(-)是指高危型hpv测试均成阴性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1