一种从高盐酸洗液中提取锌的方法与流程
1.本发明涉及化学萃取技术领域,具体涉及一种从高盐酸洗液中提取锌的方法。
背景技术:
2.钢铁行业是我国重工业行业的代表,是我国国民经济的重要组成部分,世界领先的钢铁产量推动了我国的基建行业、汽车行业等蓬勃发展。在制备钢铁材料的过程中,需要采用表面清洗剂清洗钢材表面的金属氧化层及其余杂质,目前以高浓度的盐酸作为清洗剂的酸洗工艺是酸洗钢铁材料的主要工艺。盐酸酸洗废液中一般含有100-200g/l的fe
2+
和fe
3+
、30-50g/l 的h
+
、一定量的zn
2+
等其它金属离子。由于酸洗废液对水和土壤环境都有极大的危害,会危害水生植物和动物的正常生理的活动,金属离子的富集会二次污染水体,并改变土壤结构影响农作物生长,以及在人体内富集后发生金属中毒的现象。同时由于盐酸酸洗废液年产量大、流动性强以及高度的危害性,难以处理、危害生态环境等,而被列入我国的危害废物名录。因此酸洗液的环保处理是当前发展的热点,科研人员研发多种方法对酸洗液进行处理,目的是降低酸洗废液对环境的污染和提高资源的利用率。其中,主要包括金属离子的沉淀、酸中和以及萃取法等。由于各种分离方法的特异性,始终存在各自的缺点。如沉淀法和酸中和法,需要加入大量的碱性物质,成本较高,同时造成酸洗液中大量酸的流失以及产生大量废盐固渣,后续处理困难。萃取法根据萃取剂的种类不同具有较大的分离差异。当前市面流通的锌铁类萃取剂在处理含高铁高锌高盐酸洗液时,锌铁分离效果差或者分离成本较高,其主要原因是,部分萃取剂在高酸条件中可以实现金属离子的初步分离,但无法实现金属的彻底分离;另外一部分萃取剂能够实现整个系统中金属离子的彻底分离,但需要加入大量的碱性物质。因此,如何提升高盐酸洗液的综合回收利用价值,并实现锌的高效且简单的分离提取,是本技术领域亟待解决的问题。
技术实现要素:
3.本发明意在提供一种从高盐酸洗液中提取锌的方法,以解决现有技术难以简单高效地从高盐酸洗液中提取回收锌的技术问题。
4.为达到上述目的,本发明采用如下技术方案:
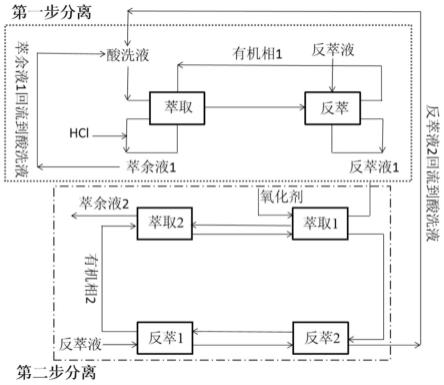
5.一种从高盐酸洗液中提取锌的方法,包括第一步分离步骤:
6.s1萃取:将有机相a与含有铁和锌的高盐酸洗液混合,经萃取获得第一负载有机相ⅰ和第一萃余液ⅰ;
7.s2反萃:将反萃剂ⅰ与第一负载有机相ⅰ混合,经反萃获得第一贫有机相ⅰ和第一反萃液ⅰ;
8.s3循环:使用第一贫有机相ⅰ对第一萃余液ⅰ进行萃取,并加入酸度恒定剂,获得第二负载有机相ⅰ和第二萃余液ⅰ;使用第一反萃液ⅰ对第二负载有机相ⅰ进行反萃,获得第二贫有机相ⅰ和第二反萃液ⅰ;
9.使用第n-1贫有机相ⅰ对第n-1萃余液ⅰ进行萃取,并加入酸度恒定剂,获得第n负载
有机相ⅰ和第n萃余液ⅰ;使用第n-1反萃液ⅰ对第n负载有机相ⅰ进行反萃,获得第n 贫有机相ⅰ和第n反萃液ⅰ;其中,n为5-7。
10.采用上述技术方案的原理以及有益效果在于:
11.在本技术方案中,高盐酸洗液中含有大量的铁离子(包括二价和三价的铁,本方案中统称为铁离子)和少量的锌离子,以及其他的少量的金属离子。洗液的酸度以及大量的铁离子的存在对锌离子富集和分离产生了较大的影响。本技术方案中采用了先使用含有吡啶羧酸酯类萃取剂的有机相a直接萃取高盐酸洗液,可以使得大量的锌和少量的铁富集在第n反萃液ⅰ,初步实现锌的富集以及锌铁的分离。本技术方案可以直接对于高盐酸洗液进行处理,不必在萃取前调节ph值,简化了工艺流程降低了成本。
12.进一步,还包括第二步分离步骤:
13.ss1萃取:使用有机相b萃取氧化处理后的第n反萃液ⅰ,获得负载有机相ⅱ和萃余液ⅱ;
14.ss2反萃:使用反萃剂ⅱ反萃负载有机相ⅱ,获得贫有机相ⅱ和反萃液ⅱ。
15.进一步,在第一步分离步骤中,所述有机相a包括稀释剂和结构式如式ⅰ所示的吡啶羧酸酯类萃取剂;
[0016][0017]
其中,r1和r2分别选自碳原子数为10-15的烷基。
[0018]
本发明的一种高盐酸洗液中锌的提取方法和工艺,采用两种萃取剂分步分离提取高盐酸体系下的锌,第一步萃取锌和一定量的杂质,第二步萃取除杂得到纯度较高的氯化锌溶液,而第一步的萃余液和第二步的反萃液则回流到酸洗段,避免了提锌后的高盐酸废液的浪费,实现酸的循环,具有良好的生态环境与经济效益。
[0019]
进一步,在第一步分离步骤中,吡啶羧酸酯类萃取剂在有机相a中的体积分数为20-40%。上述含量的有机相可以实现对锌离子的充分萃取,并在纯水反萃过程中被洗脱。
[0020]
进一步,在第一步分离步骤中,有机相a与含有铁和锌的高盐酸洗液的体积比为4-1:1;萃取混合时间为至少5min。上述o/a比以及萃取时间,可以保证锌离子的充分萃取。
[0021]
进一步,在第一步分离步骤中,反萃剂ⅰ和第一负载有机相ⅰ的体积比为1:1-4;反萃混合时间为至少5min;所述反萃剂ⅰ为水。上述o/a比以及反萃取时间,可以保证锌离子被充分反萃。
[0022]
进一步,第n萃余液ⅰ中的锌离子的含量为0.2-0.8g/l;第n反萃液ⅰ中的ph值为 0.1-0.3。
[0023]
进一步,在第二反萃步骤中,磷酸类萃取剂为mextral 204p;所述反萃剂ⅱ为3-5mol/l hcl溶液;使用过氧化氢对第n反萃液ⅰ进行氧化处理,过氧化氢的用量为第n反萃液ⅰ的质量的0.1-0.5%,获得氧化处理后的第n反萃液ⅰ。通过氧化将二价铁转换成三价铁, mextral 204p对三价铁有较好的萃取效果,可以除去锌离子中的铁,促进锌铁分离。
[0024]
进一步,在第二反萃步骤中,所述反萃液ⅱ回流至s1中的含有铁和锌的高盐酸洗
液;萃余液ⅱ的含铁量为0.005-0.01g/l。
[0025]
进一步,ss1萃取和ss2反萃均采用逆流萃取工艺,萃取以及反萃的级数均为至少2级, 单级混合时间均为至少3min;氧化处理后的第n反萃液ⅰ与有机相b的体积比为1:1-4;反萃剂ⅱ和负载有机相ⅱ的体积比为1:1-4。两萃两反可以实现锌和铁的充分分离。
具体实施方式
[0026]
下面结合实施方式对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施所用的技术手段为本领域技术人员所熟知的常规手段:所用的材料、试剂等,均可从商业途径得到。
[0027]
实施例1
[0028]
第一步分离步骤:
[0029]
s1萃取:将有机相a与含有铁和锌的高盐酸洗液(本方案的所有实施例和对比例使用的均为同一批次的高盐酸洗液,经测量其含有约150g/l的fe
2+
和fe
3+
、50g/l的h
+
、46g/l的 zn
2+
)按照体积比4:1混合,震荡5min后分相,获得第一负载有机相ⅰ和第一萃余液ⅰ。有机相a由如式ⅰ所示的吡啶羧酸酯类萃取剂和磺化煤油稀释剂组成,其中,r1和r2均为c
13h27 (该化合物的合成方法参见文献:金属萃取剂mextralclx-50的合成和萃取铜的性能研究,湿法冶金,2013)。吡啶羧酸酯类萃取剂的体积分数为20%。
[0030][0031]
s2反萃:将反萃剂ⅰ与第一负载有机相ⅰ按照体积比1:4混合,两者混合震荡3min之后,经反萃获得第一贫有机相ⅰ和第一反萃液ⅰ。反萃剂ⅰ为水,在本实施例中具体优选为纯化水。
[0032]
s3循环:第一贫有机相ⅰ返回第一萃余液ⅰ,同时加入酸度恒定剂hcl溶液(添加量为第一萃余液ⅰ体积的0.04%的hcl溶液,hcl溶液的质量分数为36%),震荡5min分相获得第二负载有机相ⅰ和第二萃余液ⅰ。将第一反萃液ⅰ和第二负载有机相ⅰ混合,震荡5min 分相获得第二贫有机相ⅰ和第二反萃液ⅰ。使用第n-1贫有机相ⅰ对第n-1萃余液ⅰ进行萃取,同时加入酸度恒定剂hcl溶液(添加量同前述),获得第n负载有机相ⅰ和第n萃余液ⅰ(第n萃余液ⅰ返回含有铁和锌的高盐酸洗液);使用第n-1反萃液ⅰ对第n负载有机相ⅰ进行反萃,获得第n贫有机相ⅰ和第n反萃液ⅰ。本步骤重复5次(n=5),获得第五贫有机相ⅰ和第五反萃液ⅰ,以及第五萃余液ⅰ。第五萃余液ⅰ中的锌离子含量为0.8g/l(此部分返回高盐酸洗液中),第五反萃液ⅰ中主要含有锌离子(用于第二步分离步骤),并含有包括铁离子在内的少量杂质。通过第一步分离步骤,实现锌铁的初步分离。
[0033]
第二步分离步骤:
[0034]
ss1萃取和ss2反萃:第五反萃液ⅰ的ph为0.1,加入过氧化氢氧化第五反萃液ⅰ中的低价铁离子,过氧化氢的用量为第五反萃液ⅰ质量的0.4%,获得氧化处理后的第五反萃液ⅰ。
[0035]
本实施例采用两萃两反逆流萃取工艺,在萃取过程中,有机相b与氧化处理后的第五反萃液ⅰ的相比(体积比)为4:1,单级混合时间为3min,经过两级萃取之后,获得负载有机相ⅱ和萃余液ⅱ。有机相b由磷酸类萃取剂和稀释剂组成,磷酸类萃取剂具体为mextral 204p(p204),稀释剂为磺化煤油,mextral 204p的体积百分数为10%。在反萃过程中,反萃剂ⅱ和负载有机相ⅱ的相比(体积比)为1:4,单级混合时间为3min,经过两级反萃取之后,获得贫有机相ⅱ和反萃液ⅱ。其中,反萃剂ⅱ为5mol/l hcl溶液。萃余液ⅱ中的主要成分为氯化锌,杂质铁离子含量为0.01g/l,用于进一步生产氯化锌。反萃液ⅱ中的锌铁比例较小,将回流到初始的高盐酸洗液。通过第二步分离步骤,实现锌铁的彻底分离。
[0036]
实施例2-实施例5基本同实施例1,不同点在于部分参数的选择,具体详见表1,流程可参见图1。图1为整体流程。
[0037]
表1:实施例1-实施例5的各项参数设置
[0038][0039][0040]
在表1中,锌铁彻底分离体现在萃余液ⅱ中铁杂质含量的多少,反萃液ⅱ循环回到酸洗液,因此其锌铁比例并不会体现分离效果。本工艺效果的主要考察指标在于第n反萃液ⅰ和萃余液ⅱ,第n反萃液ⅰ体现了酸洗液中锌的提取效果,萃余液ⅱ体现了锌铁的彻底分离效果。根据表1的实验数据,采用本工艺方法可以实现对酸洗液中的锌较为高效的分离和回收,实现了高盐酸体系下的锌的提取。
[0041]
对比例1
[0042]
本对比例基本同实施例1,不同点在于,在第二步分离步骤中,未使用过氧化氢对反萃液ⅰ进行氧化处理。萃余液ⅱ铁离子的含量大于2g/l,不能实现锌铁的彻底分离。
[0043]
对比例2
[0044]
本对比例基本同实施例1,不同点在于,在第二步分离步骤中,反萃剂ⅱ为2mol/l hcl溶液以及5.5mol/l hcl溶液,两种情况。反萃剂ⅱ酸度过高不会影响分离结果,但反萃液ⅱ在返回酸洗液后逐步增加酸洗液酸度,影响第一步分离步骤,同时增大酸耗。反萃剂ⅱ酸度过低影响有机相b的反萃效果,使得反萃不完全,有机相b在后续循环过程萃取能力降低,逐步影响第二步分离步骤中的锌铁分离效果。
[0045]
在本技术方案中,高盐酸洗液中含有大量的铁离子(包括二价和三价的铁,本方案中统称为铁离子)和少量的锌离子,以及其他的少量的金属离子。洗液的酸度以及大量的铁离子的存在对锌离子富集和分离产生了较大的影响。本技术方案中采用了先使用含有吡啶羧酸酯类萃取剂的有机相a直接萃取高盐酸洗液,可以使得大量的锌和少量的铁富集在第n反萃液ⅰ。吡啶羧酸酯类萃取剂适用于铜离子的萃取,但其是否适合进行锌离子的萃取还不得而知。进行了一定尝试,发现吡啶羧酸酯类萃取剂也可以用于锌离子的萃取。但是由于酸洗液的特殊性,即使使用了吡啶羧酸酯类萃取剂,对锌的萃取效果较好,在本工况下也无法完全实现锌和铁的有效分离。此时,发明人面临两个选择,一是在使用吡啶羧酸酯类萃取剂萃取剂前先除去铁离子,而是在使用吡啶羧酸酯类萃取剂萃取后,对第n反萃液ⅰ中的锌和铁进行分离。
[0046]
发明人首先尝试了使用各种萃取剂来进行铁离子的分离去除,以p204为例,详见对比例3。
[0047]
对比例3:
[0048]
本对比例基本同实施例1的第一步分离步骤(未进行第二步分离步骤),不同点在于,在第一步分离步骤中,使用的有机相a的萃取剂是p204,反萃剂ⅰ为4mol/l hcl,循环五次。
[0049]
第n反萃液ⅰ(第五反萃液ⅰ)中含有锌离子1g/l以及铁离子110g/l,第n萃余液ⅰ中含有锌离子45g/l以及铁离子40g/l。可见使用p204等萃取剂无法有效将锌铁分离,第n 萃余液ⅰ中,除了上述金属离子外,还含有少量镉,锰等其余金属离子,杂质含量较高,即使后续对第n萃余液ⅰ中锌离子进行萃取分离,技术难度大,分离效果差。除此之外,在很多情况下,高盐酸洗液的酸度非常高(高于本对比例使用到的一批次的高盐酸洗液),这会导致酸度达到了p204本身的极限,第n萃余液ⅰ中各种金属离子混合,无法分离。
[0050]
发明人在经过大量尝试之后,未发现适合的萃取剂以及操作工艺,于是放弃了在使用吡啶羧酸酯类萃取剂之前的分离铁离子的步骤。另外,对比例3和实施例1的第一步分离步骤相对比,也可以说明单用p204和单用吡啶羧酸酯类萃取剂,都难以实现锌的富集以及锌铁的分离。但是,将两者联合并按照一定顺序使用,可以达到将锌铁充分分离的效果。
[0051]
发明人进而尝试在使用含有吡啶羧酸酯类萃取剂的有机相a直接萃取高盐酸洗液后,进行锌铁的分离处理。在此过程中,也尝试了大量的候选萃取剂,以对比例4为例进行说明。
[0052]
对比例4
[0053]
本对比例基本同实施例1,不同点在于,在第一步分离步骤中,使用的萃取剂是实施例1中的吡啶羧酸酯类萃取剂,而在第二步分离步骤中,使用的萃取剂是p507。萃余液ⅱ中含有锌离子44.1g/l以及铁离子8.4g/l。这说明,吡啶羧酸酯类萃取剂和p204配合使用可以获得最为优异的从高盐酸环境中提取锌的效果。
[0054]
除此之外,发明人在第二步分离步骤中,还尝试了p272、292p和471p等萃取剂,发现,萃余液ⅱ中含有铁离子的量均大于5g/l,无法将锌铁有效分离。说明在本工况下,p204是与吡啶羧酸酯类萃取剂配合使用的最适合的萃取剂。
[0055]
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1