一种分离金属富勒烯M@C82及其异构体的方法与流程
本发明涉及化学领域,进一步涉及一种分离金属富勒烯m@c82及其异构体的方法。
背景技术:
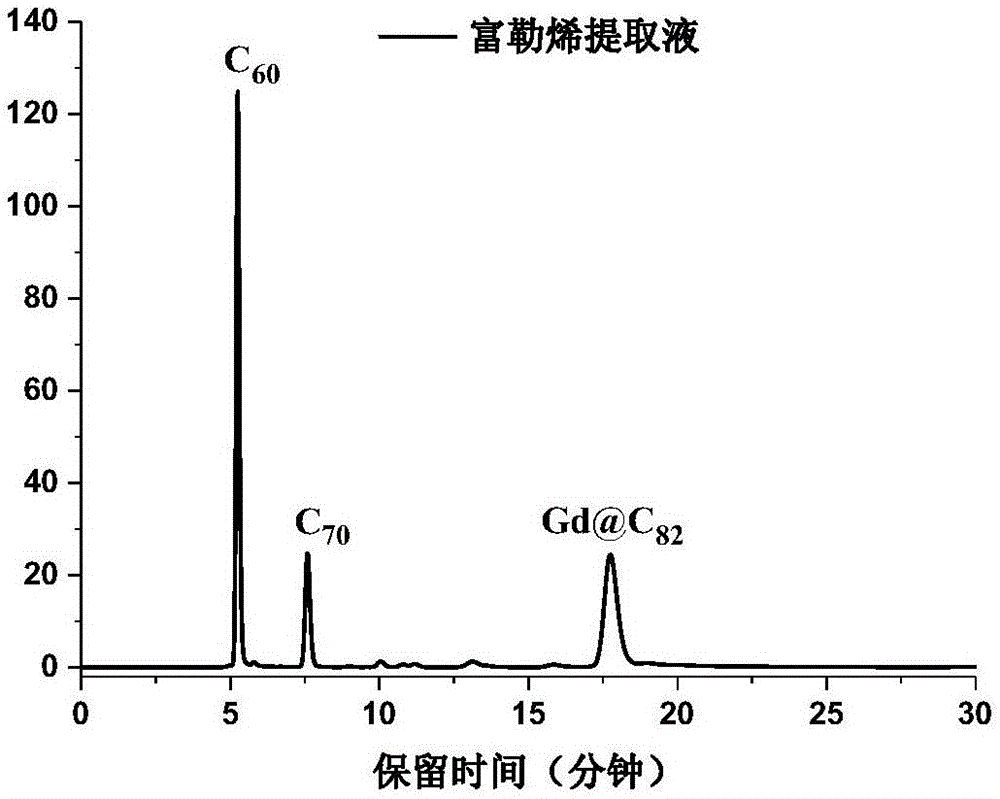
:金属富勒烯是指将金属离子或含金属的离子簇内嵌在富勒烯碳笼内的一类特殊分子。金属富勒烯既具有富勒烯碳笼的物理化学特性,又能表现出内嵌的金属或团簇优异的光、电、磁特性,在能源器件和生物医药领域有着重大的潜在应用价值。1992年,gillan等人发现大多数镧系金属可以以m@c82(m=ce,pr,nd,sm,eu,gd,tb,dy,ho,er,yb,lu)的形式内嵌到富勒烯碳笼当中。金属富勒烯,如gd@c82,在mri造影剂和抗肿瘤药物领域具有重要的潜在应用价值。随着在生物医药领域应用的不断开发,金属富勒烯的市场需求大幅度攀升,尽快提高其产量成为了亟待解决的关键技术问题。但是,金属富勒烯的合成产率低,溶解性差,分离纯化困难。随着对电弧放电法的不断改进,已经大幅度提高了其产率,但是传统的高效液相色谱分离m@c82存在耗时长、效率低、成本高等缺陷,已经成为制约其产量的关键技术瓶颈。为了解决上述问题,kazuhikoakiyama等(j.am.chem.soc.2012,134,9762-9767)利用ticl4、sncl4等路易斯酸能够可逆地并优先与低氧化电位的la@c82,ce@c82,gd@c82等金属富勒烯反应生成络合沉淀,从而实现金属富勒烯与空心富勒烯的分离。然而,发明人在实际生产中发现,ticl4、sncl4等均易潮解,且需要在惰性气体保护下操作,反应条件十分苛刻,不适于工业生产。此外,ticl4、sncl4等对富勒烯的选择性不强,无法分离得到高纯的富勒烯。本发明通过大量的实验验证,实现了一种高效、快速、强选择性地分离纯度极高的金属富勒烯分离纯化方法,该方法不仅能够简单快速的实现金属富勒烯与空心富勒烯的分离,同时在此基础上通过严格控制化学反应动力学,还可以进一步分离提取高纯金属富勒烯异构体。本发明的方法操作简单、成本低廉、可行性强、易于放大,适应于大规模的分离纯化金属富勒烯m@c82及其异构体。技术实现要素:本发明的目的在于提供一种工艺路线简单、可操作性强、成本低廉、高效、快速、强选择性分离纯度极高的金属富勒烯分离纯化方法。此外,由于传统电弧放电法制备的m@c82通常含有两个化学性质相对稳定的异构体:m@c2v-c82和m@cs-c82,本发明还提供了一种通过严格控制化学反应动力学实现特定异构体高度分离的方法。本发明的第一方面涉及一种分离金属富勒烯m@c82的方法,其包括如下步骤:a)路易斯酸络合沉淀金属富勒烯m@c82向含金属富勒烯的有机溶剂提取液中加入路易斯酸反应、过滤,收集生成的沉淀及滤液,其中所述沉淀为金属富勒烯和路易斯酸的络合物,所述滤液含有空心富勒烯;b)金属富勒烯m@c82的提取用水或碱性溶液洗涤所述沉淀除去残留的路易斯酸,再加入有机溶剂充分溶解、过滤,所得滤液即为纯化后的金属富勒烯有机溶剂提取液。根据本发明的一个实施方式,所述m选自镧系金属ce,pr,nd,sm,eu,gd,tb,dy,ho,er,yb,lu中的一种;所述路易斯酸选自氯化锌、氯化镍、氯化铜、溴化锌、溴化镍或溴化铜中的一种。根据本发明的一个实施方式,上述路易斯酸优选为氯化铜、溴化锌或溴化铜。根据本发明的一个实施方式,所述m选自镧系金属gd时,所述路易斯酸优选为氯化铜或溴化铜,更优选为溴化铜。根据本发明的一个实施方式,所述步骤(a)中的有机溶剂提取液选自苯提取液、氯苯提取液、甲苯提取液、邻二甲苯提取液、间二甲苯提取液、对二甲苯提取液、二甲苯提取液、二硫化碳提取液或n,n-二甲基甲酰胺提取液,优选为甲苯提取液。所述步骤(a)中的有机溶剂提取液是指:通过电弧放电法获得的含有空心富勒烯(如c60、c70)和金属富勒烯的产物经过dmf等常用试剂溶解并干燥从而除去不溶杂质后,再加入有机溶剂经溶解超声的步骤后得到的有机溶剂提取物。根据本发明的一个实施方式,步骤(a)中的反应条件包括但不限于搅拌或超声,所述搅拌反应时间可以为1-24小时,优选为1-8小时,最优选为2-3小时;所述超声反应时间可以为1-8小时,优选为1-3小时,最优选为1-2小时。通过充分搅拌或超声能够促进固体的路易斯酸分散于甲苯提取液中,改善路易斯酸与m@c82的表面接触,从而提高路易斯酸与m@c82的反应速率。根据本发明的一个实施方式,所述步骤(a)或(b)中沉淀及滤液的收集方式包括但不限于过滤或离心,从而选择性地将m@c82从提取液中分离出来,空心富勒烯保留在提取液中。根据本发明的一个实施方式,所述步骤(b)中的碱性溶液选自氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾、氢氧化锂、碳酸锂或碳酸氢锂的水溶液,优选为碳酸钠水溶液。所述步骤(b)中的有机溶剂选自苯基溶剂或二硫化碳,优选为甲苯、邻二甲苯、对二甲苯、间二甲苯或二硫化碳,更优选为甲苯。根据本发明的一个实施方式,所述步骤(b)中得到的金属富勒烯m@c82有机溶剂提取液可以用高效液相色谱(hplc)和基质辅助激光解吸-飞行时间质谱(maldi-tof-ms)表征。所述hplc的测试条件为:色谱柱为芘基乙基柱(以下称“pye柱”);甲苯作为流动相;uv检测波长为300nm。所述maldi-tof-ms的测试条件为:1,8,9蒽三酚作为基质;正电压模式。根据本发明的一个实施方式,还可以在上述分离金属富勒烯m@c82的方法的基础上,进一步利用路易斯酸选择性分离金属富勒烯m@c82异构体,通过利用化学反应动力学控制从而达到分离的目的,具体包括如下步骤:i)向步骤(b)所得的含有两种异构体m@c2v-c82和m@cs-c82的金属富勒烯m@c82有机溶剂提取液中加入路易斯酸搅拌或超声反应、过滤,收集沉淀及滤液1,所述沉淀为路易斯酸与gd@cs-c82的络合物,所述滤液1为仅含有m@c2v-c82的有机溶液;ii)用碱性溶液洗涤所述沉淀除去残留的路易斯酸,再加入有机溶剂充分溶解、过滤,所得滤液2为仅含有m@cs-c82的有机溶液。根据本发明的一个实施方式,所述步骤(i)中的反应时间为20-60分钟,优选为20-40分钟,最优选为40分钟;所述m选自镧系金属ce,pr,nd,sm,eu,gd,tb,dy,ho,er,yb,lu中的一种;所述路易斯酸选自氯化锌、氯化镍、氯化铜、溴化锌、溴化镍或溴化铜中的一种。根据本发明的一个实施方式,上述路易斯酸优选为氯化铜、溴化锌或溴化铜。根据本发明的一个实施方式,所述m选自镧系金属gd时,所述路易斯酸优选为氯化铜或溴化铜,更优选为溴化铜。所述碱性溶液选自氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸氢钠或碳酸氢钾的水溶液,优选为碳酸钠水溶液。根据本发明的一个实施方式,所述步骤(ii)中的有机溶剂选自苯基溶剂或二硫化碳,优选为甲苯、邻二甲苯、对二甲苯、间二甲苯或二硫化碳,更优选为甲苯。根据本发明的一个实施方式,所述滤液1和滤液2使用hplc进行表征,hplc测试条件为:甲苯为流动相,流速为1ml/min,进样20μl,300nm的uv监测波长,色谱柱为pye柱。本发明的有益效果:本发明通过使用特定的路易斯酸实现了一种高效、快速、选择性强且分离纯度极高的金属富勒烯分离提取方法,该方法不仅能够简单快速的实现金属富勒烯与空心富勒烯的分离,同时在此基础上通过严格控制化学反应动力学,还可以进一步分离提取高纯金属富勒烯异构体。该方法操作简单、成本低廉、可行性强,适应于大规模生产金属富勒烯。本发明的方法具有如下优点:1.分离速度快、效率高、成本低廉。2.分离得到金属富勒烯的纯度可达99%以上。3.实现了金属富勒烯异构体的高选择性分离,m@c2v-c82和m@cs-c82的纯度可分别达到98%~99%。4.使用特定的路易斯酸进行反应,其化学性质稳定,不易潮解,无需在手套箱中操作,反应条件均为常温常压下,可行性强。5.本发明反应条件简单,使用溶剂过滤器、搅拌设备或者超声反应器,设备简单,操作快捷,易于放大,适应于大规模生产金属富勒烯。附图说明图1使用溴化铜分离gd@c82提取液之前的高效液相色谱图;图2使用溴化铜分离gd@c82提取液3h后产物的高效液相色谱图;图3使用溴化铜分离gd@c82提取液3h后溶液的高效液相色谱图;图4使用溴化铜分离纯化后的gd@c82的maldi-tog质谱图;图5使用氯化铜分离gd@c82提取液3h后产物的高效液相色谱图;图6使用氯化铜分离gd@c82提取液8h后产物的高效液相色谱图;图7使用氯化铜分离gd@c82提取液8h后溶液的高效液相色谱图;图8使用溴化锌分离gd@c82提取液3h后产物的高效液相色谱图;图9使用溴化锌分离gd@c82提取液8h后产物的高效液相色谱图;图10使用溴化锌分离gd@c82提取液8h后溶液的高效液相色谱图;图11使用溴化铜分离gd@c82异构体溶液20分钟后产物的高效液相色谱图;图12使用溴化铜分离gd@c82异构体溶液20分钟后溶液的高效液相色谱图;图13使用溴化铜分离gd@c82异构体溶液40分钟后产物的高效液相色谱图;图14使用溴化铜分离gd@c82异构体溶液40分钟后溶液的高效液相色谱图;图15使用溴化铜分离gd@c82异构体溶液60分钟后产物的高效液相色谱图;图16使用溴化铜分离gd@c82异构体溶液60分钟后溶液的高效液相色谱图;图17使用溴化铜分离gd@c82异构体溶液后得到的2个异构体(gd@c2v-c82和gd@cs-c82)的紫外-可见-近红外光谱图。具体实施方式下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1:金属富勒烯gd@c82的分离提取(1)溴化铜(cubr2)对金属富勒烯gd@c82的分离(a)将金属gd粉末和光谱纯石墨粉末混合后填充到空心石墨管中并夯实,利用电弧放电法得到含有富勒烯产物的烟灰。将烟灰装入滤纸袋中,放入索式提取器中,以n,n-二甲基甲酰胺(dmf)为溶剂,在150℃、低真空的条件下提取24h,得到黑色溶液。(b)将上述溶液过滤除去大量悬浮颗粒,取500ml滤液于圆底烧瓶中,使用旋转蒸发仪将滤液完全蒸干。加入500ml甲苯,放入超声反应器(型号:kq-300db;功率:300w;超声频率:40khz)超声反应2h,过滤得到清亮的棕黄色滤液,即为含有空心富勒烯和金属富勒烯的甲苯提取液。对其进行高效液相色谱(hplc)分析,如图1所示。(c)取50mgcubr2加入上述甲苯提取液中,在1000rpm转速下搅拌反应3h,反应过程中产生大量棕色粉末状沉淀,使用溶剂过滤器过滤,收集沉淀,滤液中不含金属富勒烯,只剩下空心富勒烯,高效液相色谱(hplc)如图3所示。(d)使用碳酸钠水溶液在溶剂过滤器中洗涤沉淀三次,抽滤完全残留水分,将洗涤后沉淀放入1000ml的三角瓶,加入500ml的甲苯,放入超声反应器超声反应30min,让甲苯充分溶解纯化后的金属富勒烯,使用溶剂过滤器过滤,收集得到亮黄色滤液。(e)使用高效液相色谱直接(hplc)和基质辅助激光解析飞行时间质谱(maldi-tof-ms)对(d)步骤所得滤液进行表征,见图2和图4。hplc以甲苯为流动相,流速为1ml/min,进样20μl,300nm的uv监测波长,色谱柱为pye柱(5μm,4.6×250mm,cosmosil),对每个色谱峰进行自动积分。hplc和maldi-tof-ms的测试结果证明分离得到的金属富勒烯gd@c82纯度达到99%以上,分离产率可达到90%以上(本申请中的分离产率即分离回收率,计算方法为最终分离获得的产物/步骤c中有机溶剂提取液中该产物的含量)。(2)其它路易斯酸对金属富勒烯gd@c82的分离为了进一步验证路易斯酸对金属富勒烯的分离效果,参照实施例1(1)的实验条件,在不改变其它参数和步骤的基础上,相应的改变路易斯酸的种类,其结果如下表1所示:表1氯化铜和溴化锌对gd@c82的分离效果从上表可知,其他路易斯酸同样能够有效分离金属富勒烯gd@c82。其中,与溴化铜3h能分离得到纯度为99%的gd@c82并且分离产率为90%相比,氯化铜分离速率较慢且分离产率低一些,需要8小时才能分离得到纯度为97%的gd@c82,其分离产率可以达到70%。溴化锌只能分离gd@cs-c82异构体,无法分离得到另一个gd@c2v-c82异构体,因此其分离产率只能达到20%左右。(4)反应参数的影响为了确定反应时间等参数对本发明分离效果的影响,在不改变其它参数和步骤的基础上,相应的改变各反应的参数,其结果如下表3所示:表3在不同反应条件下,溴化铜对gd@c82的分离效果反应物浓度溴化铜用量反应条件反应时间分离纯度分离结果~10mg/ml50mg搅拌3h99%完全分离~10mg/ml100mg搅拌2h99%完全分离~10mg/ml50mg超声2h99%完全分离~10mg/ml100mg超声1h99%完全分离从上表可知,在不同的反应条件下,溴化铜都能够分离得到纯度高达99%的金属富勒烯gd@c82。无论是搅拌操作还是超声操作,增加路易斯酸的用量都能加快反应速率,缩短所需的反应时间。实施例2:选择性分离gd@c82异构体(1)溴化铜(cubr2)对金属富勒烯gd@c82异构体的分离(a)传统电弧放电法制备的金属富勒烯gd@c82通常含有两个化学性质相对稳定的异构体:gd@c2v-c82和gd@cs-c82,如,在实施例1(1)的步骤(d)分离得到的亮黄色滤液中即含两个gd@c82异构体,如图2所示。取500ml该溶液,加入10mg的cubr2,精确控制搅拌(转速:1000rpm)时间为40min。cubr2优先与gd@cs-c82异构体反应产生络合沉淀,使用溶剂过滤器过滤,收集沉淀,滤液中只含有另一异构体gd@c2v-c82。(b)使用碳酸钠水溶液在溶剂过滤器中洗涤只含有gd@cs-c82异构体的沉淀三次,抽滤完全残留水分,将洗涤后沉淀放入1000ml的三角瓶,加入500ml的甲苯,超声30min至金属富勒烯完全溶解,使用溶剂过滤器过滤,收集得到亮黄色的gd@cs-c82异构体溶液。(c)使用hplc进行表征,甲苯为流动相,流速为1ml/min,进样20μl,300nm的uv监测波长,色谱柱为pye(5μm,4.6×250mm)分别对(a)和(b)步骤中分离得到的gd@cs-c82和gd@c2v-c82异构体进行分析,对每个色谱峰进行自动积分,证明分离得到了纯度为的gd@cs-c82异构体的纯度为98%(图13),gd@c2v-c82异构体的纯度为99%(图14)。(d)使用紫外-可见-近红外光谱仪分别对(a)和(b)步骤中分离得到的gd@cs-c82和gd@c2v-c82异构体进行光谱表征,如图17所示,其吸收光谱与文献报道一致,从而佐证了可以通过化学反应动力学控制分离得到高纯度的gd@c82异构体。(2)反应参数的影响为了确定反应时间等参数对本发明分离效果的影响,在不改变其它参数和步骤的基础上,相应的改变各反应的参数,其结果如下表4所示:表4在不同的反应时间,溴化铜对gd@c82异构体的分离效果从上表可知,使用溴化铜对实施例1(1)种纯化后的gd@c82(如图2)进行异构体分离,可以通过严格控制溴化铜与gd@c82的反应时间来分离得到高纯度的gd@c82异构体。反应20min后,溴化铜只将部分的gd@cs-c82异构体分离出来(如图11),溶液中存在少量的gd@cs-c82异构体(5%左右)和大量的gd@c2v-c82异构体(95%左右),如图12所示。反应40min后,溴化铜将全部的gd@cs-c82异构体分离出来(如图13),溶液中只存在gd@c2v-c82异构体(如图14)。反应60min后,溴化铜将全部的gd@cs-c82异构体和部分gd@c2v-c82异构体分离出来(如图15),溶液中都是gd@c2v-c82异构体(如图16)。所以,必须严格控制溴化铜与gd@c82的反应时间,确保溴化铜只将全部的gd@cs-c82异构体分离出来,溶液中就只残留gd@c2v-c82异构体,从而通过这种化学反应动力学控制分离得到了高纯度的gd@c82异构体。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1