用于产生氢的组合物的制作方法
本发明涉及用于产生氢气的组合物,制备这种组合物的方法和使用该组合物产生氢气的方法。
背景技术:
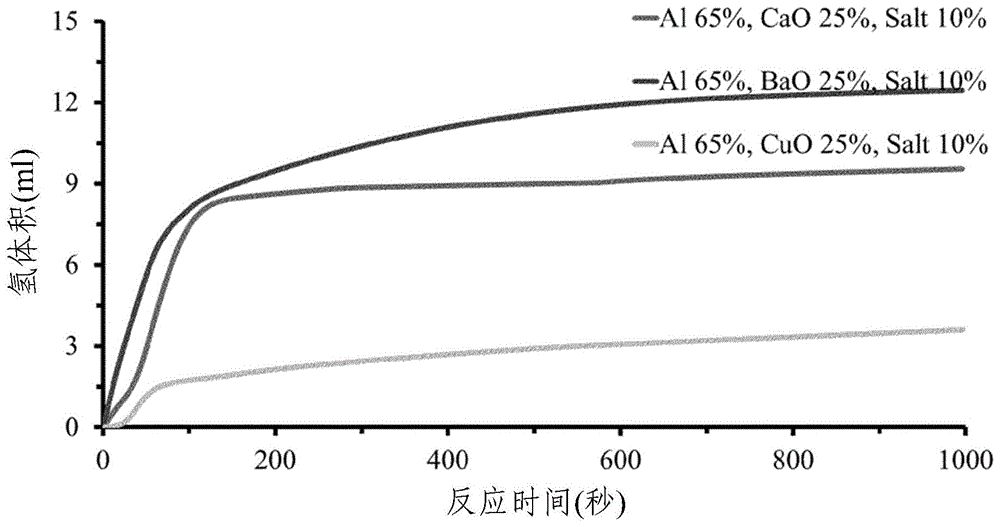
:人们对气候变化的认识不断提高,能源需求不断增长,导致大量研究和开发活动转向了替代能源,例如氢。氢可用作燃料电池的燃料以产生电能和热量。燃料电池通过与氧气的化学反应将氢的化学能转化为电能。该反应的副产物是水。尽管氢已成为一种安全、清洁的燃料,但人们仍对目前用于产生h2的技术感到担忧。蒸汽可以在金属基催化剂(通常是镍)存在下于高温(例如700-1100℃)下与甲烷反应生成氢气。在该方法中,有毒的一氧化碳作为副产物产生,并且为了产生蒸汽与甲烷反应,需要大型锅炉或蒸汽重整器。另一种制氢方法涉及电解水,通过使电流通过水,使水分解为阳极处的氧和阴极处的氢。金属与水之间的反应也得到了广泛的研究。例如,铝金属根据以下方程式与水反应生成氢气:al(s)+3h2o(g)→al(oh)3(s)+1.5h2(g)△hr=-280kj/mol。然而,铝与水之间的反应的问题在于在金属的表面上非常迅速地形成氧化铝的保护性涂层,从而抑制了进一步的反应。因此,在短暂的最初氢生成爆发之后,进一步的析氢停止或仅非常缓慢地进行。因此,已经研究了各种可以促进铝与水反应的添加剂。wang等(“preparationandhydrolysisofaluminiumbasedcompositesforhydrogenproductioninpurewater”,materialstrans.(2014),55,pp.892–898)研究了包括cao、nacl和低熔点金属(ga、in和sn)的添加剂对铝在水中的水解活性的影响。对于包含铝和cao复合物的混合物的组合物,每克铝的总氢产量(体积)为10-110ml。这远远低于1gal在25℃和1个大气压下与水完全反应的最大理论产率(1358ml)。通过向al-cao组合物中添加nacl,氢产率提高了,但最多仅为最大理论收率的54%。但是,该论文的作者发现,通过使用包含诸如ga、in和sn的金属的铝合金与cao和nacl联合,可以获得超过80%的产率。但是,即使使用ga、in和sn合金,也只能在高温(60℃)下观察到大于80%的产率。这些金属的使用和铝合金的制备是昂贵的,因此这种混合物作为燃料源的商业潜力受到限制。wang等(“generationofhydrogenfromaluminiumandwater–effectofmetaloxidenanocrystalsandwaterquality”,int.j.hydrog.energy(2011),36,pp.15136–15144)还研究了各种第一行过渡金属氧化物纳米晶体的添加对铝与水反应生成氢的影响。dupiano等(“hydrogenproductionbyreactingwaterwithmechanicallymilledcompositealuminium-metaloxidepowders”,int.j.hydrog.energy(2011),36,pp.4781–4791)研究了几种机械碾磨的铝金属氧化物粉末与水的反应。已经发现,对于含有铝和cuo的混合物的粉末,在室温下进行时,在前三天没有观察到反应。chen等(“researchofhydrogengenerationbythereactionofal-basedmaterialswithwater”,j.powersources(2013),222,pp.188–195)研究了用于制氢的通过机械球磨制备的各种含al、cao和nacl的组合物的反应。目前,仍然需要能够在环境温度下以高收率产生氢气的产氢组合物。如果将它们用于产生家庭环境中的燃料电池消耗的燃料氢,这种组合物的制造也应相对便宜并且可以在家庭环境中安全使用。特别地,该组合物应当以受控的方式产生氢,以避免可以使用该组合物的氢产生装置的过热和过压。技术实现要素:本发明的目的是提供一种与水接触时以高产率产生氢的组合物。优选地,可以控制氢的释放,以在长时间内提供低压的氢。本发明的另一个目的是提供可用于产生氢以在家庭环境中通过氢燃料电池转化成电的组合物。尽管已经研究了在铝与水之间的反应中添加单种金属氧化物和单种金属氯化物的效果,但到目前为止,尚不清楚使用金属氧化物的组合或金属氯化物的组合作为添加剂的效果。现已发现,通过使用碱土金属氧化物和过渡金属氧化物的组合,产生的氢的总体积出乎意料地大于单独使用所述氧化物中的任一种时的氢的总体积(参见下面的实施例2)。因此,在本发明的第一方面,提供了一种组合物,其与水接触时产生氢,该组合物包含以下物质的颗粒:铝;碱土金属氧化物;过渡金属氧化物;和一种或多种碱金属或碱土金属的氯化物盐。该组合物通常包含多种氯化物盐。该组合物可以包含盐,该盐包含钠离子、钾离子、钙离子和氯离子或由它们组成。在一个实施方案中,该组合物包含nacl、kcl和cacl2的混合物。在另一个实施方案中,该组合物由nacl、kcl和cacl2的混合物组成或基本上由nacl、kcl和cacl2的混合物组成。还已经发现,通过使用多种金属氯化物盐的组合,所产生的氢的总体积大于当单独使用所述氯化物盐中的任何一种时的氢的总体积(参见下面的实施例4)。因此,在本发明的第二方面,提供了一种微粒组合物,其与水接触时产生氢,该组合物包含以下物质的颗粒:铝;一种或多种金属氧化物;和nacl、kcl和cacl2的混合物。在本发明的第二方面,组合物可以有利地包含两种以上金属氧化物。在一个实施方案中,该组合物包含碱土金属氧化物和过渡金属氧化物。在本发明的第三方面,提供了一种微粒组合物,其与水接触时产生氢,该组合物包含以下物质的颗粒:铝;碱土金属氧化物;过渡金属氧化物;和nacl、kcl和cacl2的混合物。本发明的组合物可在环境温度下与水接触以高产率产生氢气。在长达10,000秒(约2.75小时)的时间内以受控方式释放氢气。本发明的组合物还具有以下优点:它们制造起来相对便宜并且在家庭环境中使用安全。所述组合物本质上是微粒状的(即,它们由颗粒形成,例如直径小于1mm或小于500μm的颗粒)。该组合物也是无水的,即它们在用于产生氢之前不包含可以与铝反应的水。铝颗粒的直径可以小于200μm,通常小于150μm,例如小于100μm。铝颗粒的直径通常大于1μm,例如大于10μm或大于20μm。在某些实施方案中,铝颗粒的直径为1μm-200μm,例如10μm-150μm,例如10μm-150μm,例如20μm-100μm。上述直径是使用筛分法测得的。因此,直径是指能够或不能通过具有一定尺寸的孔的筛的颗粒。例如,所述的直径小于200μm的颗粒能够通过直径为200μm的圆形孔,而所述的直径大于1μm的颗粒则不能通过直径为1μm的圆形孔。已经发现包含再生铝颗粒的组合物是特别有利的(参见下面的实施例7)。因此,本发明的组合物可包含再生铝的颗粒。铝颗粒可以以总组合物的40重量%至90重量%的量存在,典型地以总组合物的50重量%至80重量%的量存在,例如以总组合物的60重量%至70重量%的量存在。一种或多种金属氧化物通常以总组合物的20重量%至30重量%的量存在。一种或多种金属氧化物的量可以以相对于铝的量来限定。因此,一种或多种金属氧化物组合物可以按重量计以该金属氧化物的量的1-4倍、优选地2-3倍、例如约2.6倍的量包含铝。可选择地,一种或多种金属氧化物的量可以以相对于铝的量的重量比来限定。因此,铝和过渡金属氧化物可以以1:1至4:1的重量比,通常2:1至3:1的重量比,例如约2.6:1的重量比存在。氯化物盐通常以总组合物的5重量%至15重量%的量存在。氯化盐的量可以以相对于铝的量来限定。因此,组合物可以按重量计以氯化物盐的量的5-8倍、优选6-7倍、例如约6.5倍的量包含铝。可选择地,一种或多种金属氧化物的量可以以相对于铝的量的重量比来限定。因此,铝和盐可以以5:1-8:1的重量比,通常为7:1-6:1的重量比,例如约6.5:1的重量比存在。碱土金属氧化物可以选自氧化钙、氧化钡、氧化镁或它们的混合物。通常,碱土金属氧化物主要由氧化钙组成。例如,组合物可以包含氧化钙,其含量为碱土金属氧化物的总重量的大于70重量%、大于80重量%、大于90重量%或大于95重量%。在一个实施方案中,碱土金属是氧化钙。本发明的某些组合物还包含一种或多种过渡金属氧化物。过渡金属氧化物可以是第一行过渡金属氧化物。术语“第一行过渡金属氧化物”包括钪、钛、钒、铬、锰、铁、钴、镍、铜或锌的氧化物。通常,第一行过渡金属氧化物是其中金属处于+2氧化态的氧化物(在本文中称为“第一行过渡金属(ii)氧化物”)。这样的第一行过渡金属(ii)氧化物的实例包括氧化铜(ii)、氧化锌、氧化铁(ii)、氧化镍(ii)和氧化钴(ii)。优选地,第一行过渡金属(ii)氧化物选自氧化铜(ii)、氧化铁(ii)、氧化镍(ii)或它们的混合物。在某些实施方案中,组合物包含一种过渡金属氧化物。在一个实施方案中,第一行过渡金属氧化物主要由氧化铜(ii)(cuo)组成。例如,组合物可以以过渡金属氧化物的总重量的大于70重量%、大于80重量%、大于90重量%或大于95重量%的量包含氧化铜(ii)。在一个实施方案中,过渡金属氧化物为cuo。已经发现碱土金属氧化物和过渡金属氧化物的比例可以影响组合物的氢产率(参见下面的实施例3)。因此,碱土金属氧化物和过渡金属氧化物可以以0.65:0.35至0.35:0.65,通常为0.6:0.4至0.4:0.6,例如0.55:0.45至0.45:0.55的重量比存在。在一个实施方案中,碱土金属氧化物和过渡金属氧化物以基本上相等的重量比(即,约1:1的比例)存在于本发明的组合物中。本发明的组合物包含一种或多种碱金属或碱土金属的氯化物盐。因此,所述盐可以选自氯化钾(kcl)、氯化钠(nacl)、氯化锂(licl)、氯化镁(mgcl2)、氯化钙(cacl2)或它们的混合物。通常,组合物包含多种碱金属和/或碱土金属的氯化物盐。在一个实施方案中,盐可以选自kcl、nacl,cacl2或它们的混合物。当组合物中存在多种氯化物盐时,它们的存在比例可能会影响氢的产率。通常,nacl、kcl和cacl2的重量比可以为(3.5-4.5):(2.5-3.5):(2.5-3.5),优选为(3.75-4.25):(2.75-3.25):(2.75-3.25),例如约4:3:3。在一个实施方案中,提供了一种微粒组合物,其与水接触时产生氢,该组合物包括:60-70重量%的铝;10-15重量%的第ii族金属氧化物;10-15重量%的第一行过渡金属氧化物;3.5-4.5重量%的nacl;2.5-3.5重量%的kcl;和2.5-3.5重量%的cacl2。尽管已经显示铝颗粒、金属氧化物和/或氯化物盐的未处理混合物在与水接触时以良好的产率产生氢气(参见实施例5),但是本发明人还发现通过在用于产生氢之前处理(例如碾磨)组合物,可以进一步提高组合物的氢产率。铝与大气中的氧气迅速反应,在其表面形成氧化铝的坚固致密涂层。该氧化物层的存在阻碍了铝与水反应产生氢气,因此降低了氢气的产率。因此,存在于本发明的组合物中的铝颗粒可以为铝颗粒,其中一部分氧化铝层已经例如通过机械手段去除。可以使用包括反应性球磨或研磨的多种技术来去除或部分去除氧化铝层。或者,可以用化学品(例如碱性溶液)处理铝,以去除一些氧化铝层。可以使用扫描电子显微镜(sem)等方法研究铝的表面,以确定氧化铝层的覆盖程度。在本发明的另一方面,提供了一种制备组合物的方法,该组合物与水接触时产生氢,例如,如本文任何方面、实施方式和实施例中所定义的组合物,该方法包括碾磨以下物质的组合:铝颗粒和任选存在的一种或多种金属氧化物和/或一种或多种碱金属或碱土金属的氯化物盐。通过碾磨组合物,可以除去铝颗粒上的一些氧化铝层,从而暴露出更大的铝表面积以与水反应。在一个实施方案中,该方法包括碾磨铝颗粒、碱土金属氧化物、过渡金属氧化物和一种或多种碱金属或碱土金属的氯化物盐的组合。在另一个实施方案中,该方法包括碾磨铝颗粒、一种或多种金属氧化物和一种或多种碱金属或碱土金属的氯化物盐的组合。在又一个实施方案中,该方法包括碾磨铝颗粒、碱土金属氧化物、过渡金属氧化物、以及nacl、kcl和cacl2的混合物的组合。在本发明的方法中,铝颗粒、金属氧化物和氯化物盐、以及它们的相对量和比例可以如以上关于本发明的组合物中所定义。如本文所用,术语“碾磨”是指机械过程,其中铝颗粒的表面被改性以随后从颗粒中去除至少一些氧化铝。因此,术语“碾磨”可以包括诸如研磨的过程。铝颗粒和其他组分可以有利地使用球磨设备例如行星式球磨设备进行碾磨。球磨机包括一个罐(jar),其中放置有待碾磨的一种或多种物质以及碾磨介质(例如,球或砾石)。然后使罐高速旋转,并且在旋转期间施加于碾磨介质上的离心力发挥作用以碾磨物质。在本发明的方法中,这些球优选为不锈钢球,并且这些球的直径可以大于4mm,通常大于5mm,例如7mm,并且该球磨装置可以包含5个以上,通常为6个以上,例如8个球。碾磨装置中使用的球粉比例可以为5:1或更大,通常为7:1或更大,例如10:1。可以通过球磨设备根据包括碾磨循环的碾磨程序对铝颗粒和其他成分进行碾磨,其中:a)球磨装置沿第一方向旋转一个正向旋转时间段;b)暂停旋转一个第一中断时间段;c)装置沿与第一方向相反的方向旋转一个反向旋转时间段;d)暂停旋转一个第二中断时间段。优选重复碾磨循环。因此,例如,碾磨程序可以包括至少两个,典型地至少三个,并且更通常地至少四个碾磨循环。举例来说,碾磨程序可以包括5-50个碾磨循环,例如10-40个碾磨循环。正向或反向旋转时间段可以在30秒至2分钟之间,例如1分钟。旋转时间段通常小于5分钟,例如小于2分钟。因此,旋转周期可以在30秒至5分钟之间,例如在30秒至2分钟之间。在本发明的实施方案中,正向旋转周期与反向旋转周期相同。已经观察到使用更长的中断时间氢产率更高。第一中断时间段和第二中断时间段可以大于5秒,通常大于10秒,例如30秒。中断时间段通常小于2分钟,例如小于1分钟。因此,中断时间可以在5秒至2分钟之间,例如在10秒至1分钟之间。在本发明的实施方案中,第一中断时间与第二中断时间相同。碾磨过程可以持续至少1小时的总时间。虽然更长的碾磨周期可以提高氢产量,但实际上,所用的碾磨周期将是氢产量与长时间运行碾磨设备的成本之间的折衷。因此,总碾磨时间通常小于3小时,例如小于2小时。在一个实施方案中,碾磨程序持续1-2小时。旋转速度可以在100rpm和600rpm之间,通常在200rpm和400rpm之间,例如在210rpm和310rpm之间。在碾磨之前,铝颗粒的直径可以为200μm以下,通常为150μm以下或100μm以下,例如50μm以下。然而,铝颗粒的直径通常在微米范围内(而不是纳米范围),因此碾磨前铝颗粒的直径通常大于1μm,例如大于5μm或大于10μm。因此,在碾磨之前,铝颗粒的直径可以为1μm至200μm,通常为10μm至100μm。上述直径是使用筛分法测得的。因此,直径是指能够或不能通过具有一定尺寸的孔的筛的颗粒。例如,直径小于200μm的颗粒能够通过直径为200μm的圆形孔,而直径大于1μm的颗粒则不能通过直径为1μm的圆形孔。本发明还提供一种产生氢气的方法,该方法包括使本文所述的组合物与水接触。本发明的组合物可以与除纯水以外的液体例如盐、糖、醇或其他有机化合物的水溶液结合使用。特别地,已经表明,当本发明的组合物与乙醇、乙二醇和尿素的水溶液接触时会产生水。因此,该组合物可用于在不容易获得干净水的环境中产生氢。在另一方面,本发明提供了一种容器,其包含预定量的本发明的组合物。该容器可容纳1g至125kg的本发明的组合物。在本发明的实施方式中,容器容纳选自以下量的本发明的组合物:a)10g至10kg;b)10g至1kg;c)50g至500gd)100g至200ge)100g至5kgf)1kg至15kg;g)4kg至12kg;或h)5kg至10kg。对于某些用途,例如用于在国际专利申请wo2017/078530和wo2017/025591中描述的制氢装置中,容器可以容纳1kg至15kg,例如5kg至10kg的本发明的组合物。为了在较小的制氢装置中使用,容器可容纳10g至500g,例如50g至250g。对于本文公开的每个实施方案,其中所述组合物被陈述为包含一种或多种组分,在进一步的替代实施方案中,还提供了基本上由一种或多种所列组分组成的组合物。在另外的替代实施方案中,还提供了由一种或多种所列组分组成的组合物。可以将容器装载到用于产生氢的装置中。然后可以将装置配置为将水引入容器中以与本发明的组合物反应以产生氢。容器可以是环形的。环形容器可以具有环形的基部以及(通常是同心的)圆柱形的内壁和外壁,内壁和外壁之间的空间用于在反应形成氢的过程中保持反应物。内壁通常围绕中心通道。容器可以具有内部(例如,当内壁和外壁存在时在内壁和外壁之间的空间),该内部被划分成多个单独的隔室,每个隔室可以容纳一定剂量的本发明的组合物,该组合物可以与水反应形成氢。通过提供各自容纳一定量组合物的多个分开的隔室,可以更紧密地控制氢的产生。例如,隔室可以被配置为使得进入容器的水落入一个或选定数目的(但不是全部)隔室中,从而在一个或选定数目的所讨论的隔室中引发反应,然后流向其他隔室从而在那些隔室中引起反应。隔室可被配置成使得当一个隔室中的液体达到特定液位时,来自一个隔室的液体仅流到另一个(例如,相邻的)隔室。因此,例如,隔室之间的分隔壁可被配置成使得当一个隔室中的液体达到特定液位时,它将仅溢出到单个或选定的少量(例如一个、两个或三个)相邻隔室中,优选只有一个相邻的隔室。以这种方式,可以通过控制水流入容器的速度来控制本发明的组合物与水之间的反应程度。当容器具有同心的内壁和外壁时,同心的内壁和外壁之间的空间可以由一个或多个从内圆形壁沿径向向外延伸的分隔壁分隔成多个隔室。还可以在内壁和外壁之间设置一个或多个同心的中间圆柱壁,从而增加隔室的数量。当存在两个或更多个径向延伸的分隔壁时,一个径向延伸的分隔壁的高度可以大于另一个径向延伸的分隔壁的高度,并且可以定位液体入口使得液体最初放置在由较高的径向延伸的分隔壁所界定的一侧。随着液体被引入隔室,其最终将在远离较高的径向延伸的分隔壁的方向上溢出。取决于液体从较高的径向延伸分隔壁的哪一侧引入隔室,围绕容器的液体流动可以是顺时针方向或逆时针方向。如果在内壁和外壁之间还有一个或多个其他同心中间圆柱壁,则可以通过在相邻隔室之间配置分隔壁来提供更复杂(convoluted)的流动路径,以使第一隔室(最初接收液体的地方)具有高度减小的单个分隔壁,除一个隔室以外的所有剩余隔室都具有高度减小的两个分隔壁,以便液体可以从第一隔室顺次通过其他隔室流到流路中的最终隔室,该最终隔室只有高度减小的单个分隔壁。可替代地(或附加地),分隔隔室的分隔壁可以设置有开口,该开口被布置成以预定的方式引导液体围绕容器流动。例如,在流动路径中的第一隔室(最初接收液体的地方)和最终隔室可各自具有单个开口,其余的隔室可具有两个或更多个(通常只有两个)液体可通过的开口。在分隔壁中的开口的上下文中,术语“开口”可以表示壁中的孔或凹口或切掉的区域。当容器在内壁和外壁之间具有一个或多个其他同心中间圆柱形壁时,每个圆柱形中间壁的高度可以小于内壁和外壁的高度(例如,高度小于外壁高度的一半)。从前述内容中将认识到,借助于径向延伸的分隔壁和(当存在时)同心的中间壁,容器的内部构造成提供离散数量的隔室,在其中可以添加测定重量或体积的反应物。每个隔室可以例如包含相同重量的反应物。可替代地,但是较不常见地,可以在每个隔室中提供不同量的反应物。水可以通过容器的敞开的顶部引入容器中。可替代地,容器的侧壁可以在其上边缘附近设置有开口,通过该开口可以引入水。容器侧壁中的开口可以是仅在将容器放置在用于产生氢的装置中之前或期间刚刚形成的开口。因此,它可以具有闭合件,该闭合件可被去除以形成开口。闭合件可以采取与壁脆弱连接的断点(break-out)部分的形式。容器通常由可模制的塑料材料,更优选地由可生物降解的塑料材料一形成(例如,通过诸如注射模塑的模制技术)。可替代地,该容器可以通过机械加工或3d印刷塑料材料来形成,或者可以由金属材料(通常是对反应物基本上是惰性的金属材料)形成。选择塑料材料,以使其不透水和可用作反应物或反应介质的任何其他液体,并且对反应物和反应产物均具有抵抗力。合适的塑料材料的例子包括丙烯腈丁二烯苯乙烯(abs)、诸如尼龙的聚酰胺、诸如聚乳酸/聚丙交酯的可生物降解的聚合物、以及它们的混合物。在一个实施方案中,盒(cartridge)由尼龙和abs的混合物形成。容器可以设置有对准引导件,该对准引导件与用于产生氢的装置内部的互补引导元件啮合(engage),使得该容器只能以预定取向放置在装置中。对准引导件可以是例如凹槽、凹部、肋、脊、突起或突起组,其与装置的内壁中或从装置的内壁凸起的互补的凹槽、凹部、肋、脊、突起或突起组啮合。更特别地,对准引导件可以是例如沿着容器的外表面向下延伸的凹槽,其中该凹槽与从装置的内壁(例如下部主体部分的内壁)向内延伸的突起啮合。附图说明图1为显示改变包含铝颗粒、金属氧化物和nacl的碾磨的组合物中存在的金属氧化物对产生的氢的体积的影响的图。图2为显示在使用第一碾磨程序碾磨的、包含铝颗粒、金属氧化物和nacl的组合物中使用cao和cuo的组合作为金属氧化物时,对氢产率的影响的图。图3为显示在使用第二碾磨程序碾磨的、包含铝颗粒、金属氧化物和nacl的组合物中使用cao和cuo的组合作为金属氧化物时,对氢产率的影响的图。图4为显示当改变在包含铝颗粒、cao、cuo以及kcl、nacl和cacl2的组合的组合物中的cao和cuo的比例时对氢产率的影响的图。图5为显示当改变包含铝颗粒、cao、cuo和盐的碾磨的组合物中的盐的性质时对氢产率的影响的图。图6为显示在包含铝颗粒、cao、cuo和一种或多种盐的碾磨的组合物中,与单独使用cacl2相比,当使用nacl、kcl和cacl2的组合时,对氢产率的影响。图7为显示在包含铝颗粒、cao和cuo的碾磨的组合物中,与不加盐相比,使用nacl、kcl和cacl2的组合时,对氢产率的影响的图。图8为显示使用铝颗粒、一种或多种金属氧化物和一种或多种盐的各种碾磨和非碾磨的组合对氢产率的影响的图。图9和10为显示本发明组合物的碾磨条件对氢产率的影响的图。图11为显示铝粒度对氢产率的影响的图。图12为显示在本发明的组合物中使用再生铝和“纯”铝时氢产率的比较的图。图13为显示当与各种浓度的乙醇水溶液接触时,由本发明的组合物产生的氢的体积的图。图14为显示当与各种浓度的乙二醇水溶液接触时,由本发明的组合物产生的氢的体积的图。图15为显示当与各种浓度的尿素水溶液接触时,由本发明的组合物产生的氢的体积的图。具体实施方式实验部分方法颗粒的合成在以下实施例中,以下方法用于制备本发明的含铝组合物。碾磨之前,将所有粉末在真空炉(townsonandmercerltd)中干燥24小时,以去除任何多余的水分。干燥后,将粉末保存在无氧手套箱(saffronscientificalpha)内的干燥器中,该手套箱用99.99%的纯氩气吹扫以确保无水分和无氧环境。在手套箱内部,放置了一个氧气传感器(sybrontaylor),以在±0.01%的精度内测量氧气含量。以下是用于本发明的含铝组合物的碾磨过程中使用的组分的清单。·回收的铝(99.1重量%,用40μm、75μm和105μm筛网进一步筛分,购自ihodusa)。·纯铝(99.5重量%,阿法埃莎(alfaaesar),200目,fisherchemical)。·氧化钙(99.0重量%的cao,65μm,fisherchemical)。·氧化铜(99.0重量%的cuo,纳米颗粒,acrosorganics)。·氧化钡(90.0重量%的bao,纳米颗粒,acrosorganics)。·氯化钾(99.5重量%的kcl,65μm,fisherchemical)。·氯化钙(80重量%的cacl2,280μm,vwrchemical)。·氯化钠(98.0重量%的nacl,150μm,fisherchemical)。除非另有说明,否则使用从ihodusa获得的再生铝粉。该铝粉包含不同粒径的混合物,因此将再生铝过筛以提供3种不同粒径范围,以建立不同粒径对氢产率的影响。为此目的,使用尺寸为3μm至300μm的筛bs410/1986(endecotttestsieveshakere.f.lmarkiiwithendecott’sltd)。筛以降序排列在彼此之上,并在最上面的筛(300μm筛目)上分配铝粉。筛分过程进行48小时。分离后,选择对应于40μm、70μm和100μm粒径的筛。40μm筛中的颗粒直径在40μm和50μm之间,70μm筛中的颗粒直径在70μm和80μm之间,而100μm筛中的颗粒直径在100μm和110μm之间。用于碾磨的粉末制备在手套箱内在厌氧条件下进行,然后转移至行星式球磨设备进行碾磨。组合物组分的所有重量百分数均以相对于组合物总重量的重量百分数给出。对于球磨,使用10:1重量比的球粉比。将八个碾磨球(直径7mm的球形不锈钢球)和3g铝粉以及所选的添加剂放入手套箱内的50ml不锈钢碾磨罐中。然后将来自手套箱的密封组件转移到行星式球磨设备(retschpm-100)。碾磨罐的总重量通过在碾磨机站上的托盘天平来进行调节,以避免高速碾磨过程中的不平衡和咔嗒声(rattling)。建立了不同的碾磨程序,其中改变碾磨机的旋转方向和碾磨速度。下表1中提供了所用碾磨程序的详细信息:表1:碾磨程序程序1a-1d仅在碾磨速度和总碾磨时间上有所不同,包括1分钟的碾磨,30秒钟的间隔时间,然后再进行1分钟的沿相反的方向旋转的碾磨和另外30秒钟的间隔时间。重复该过程,直到达到总碾磨时间1小时38分钟(对于程序1a和1b)和2小时24分钟(对于程序1c和1d)。程序2a和2b用于测试中间中断时间的重要性(如果有),其中中断时间设置为5秒而不是碾磨程序1a和1b的30秒。测量氢产率在以下实施例中,以下方法用于测量本发明的含铝组合物与水(或其他选择的液体)反应时释放的氢的量。玻璃管(60ml,内径:21mm)用作反应容器。带2个孔的橡胶塞用作连接的密封件(sealant)。塞子中的一个孔为反应中释放的氢提供了出口通道,而另一个孔则用于插入热电偶(k型),该热电偶依次连接到数字数据记录器(picotech,型号:2204)以监控温度。在反应开始之前,用加压的氩气彻底吹扫容器,以保持容器中的氧气浓度尽可能低。将0.3g的含铝组合物(使用上述方法制得)添加到反应器中,然后在25℃下使用注射器添加9ml的水(或以下实施例中指定的其他液体)。反应器容器用聚苯乙烯绝缘(insulating)片包裹。水和组合物的混合通过使用小型胶囊形搅拌棒(5mm,1g)和用于将搅拌速度设定为300rpm的磁力搅拌板(ika-rh-basic2)进行搅拌来完成。搅拌器的大小和重量允许颗粒在反应器内自由移动。产生的氢气通过带有三个弯头压缩接头和一个推入配合接头的一系列不锈钢管(内径:7mm)避免任何气体泄漏。两种方法被用来测量氢的产生速率和产生的氢的总量,一种是倒柱法(invertedcolumnmethod),另一种是使用气体质量流量计。气体质量流量计在0-10ml/分钟的流量范围内具有±0.01ml的精度。气体流量计已针对氢气进行了预校准。为了确保干燥气体进入气体流量计,将容纳干燥剂(硅胶)的增强塑料管接头(5cmx3cm)连接到气体质量流量计(aalborggfm-17)。使用相关的picologger软件通过连接到pc的数据记录仪记录产生的氢,采样间隔为1秒。与数据记录仪的连接使氢流量速和温度都可以同时被读取和记录。为了分析产生的气体的质量,使用了一个气密注射器来收集气体并将其引入气体分析仪(气相色谱仪,gc)。除非另有说明,否则以下报告的氢产率%值是基于可从0.3g含65重量%的铝(即0.195g铝)的组合物中释放出的氢的理论最大量计算得出的。该量相当于20℃和1个大气压(101,325pa)下的264.8ml氢气。实施例实施例1不同金属氧化物的氢产率比较制备的组合物包含铝颗粒(直径为70μm至80μm,如上所述获得)、氯化钠(nacl)和各种金属氧化物,其含量如表2所示。用于本研究的所选金属氧化物为氧化钡(bao)、氧化钙(cao)和氧化铜(cuo)。如上文方法部分所述,使用碾磨程序1b,使用518rpm的碾磨速度和1.1小时的总碾磨时间将粉末碾磨。下图1和表2显示了1000秒后的氢产率。表2中所示的氢产率%为相对于组合物中所含铝的最大理论氢产率。粉末组合物(重量%)1000秒后的氢产率%al65%,bao25%,nacl10%4.5%al65%,cao25%,nacl10%3.8%al65%,cuo25%,nacl10%1.4%表2:具有不同金属氧化物添加剂的粉末组合物。在图1中可以看出,使用bao时,立即产生了氢气,并在1000秒内产生了总计12ml的氢(相当于4.5%的氢产率)。对于cao和cuo,氢的产率要低得多,并且分别在600和400秒后氢的产生最少。实施例2使用金属氧化物的组合制得的组合物包含铝颗粒(直径为70μm至80μm,如上所述获得)、氯化钠(nacl)和各种金属氧化物,其含量如表3所示。用于本研究的所选金属氧化物为氧化钙(cao)、氧化铜(cuo)和等比例的cao和cuo(但金属氧化物的总重量保持在总组合物的25%)。对于本研究,如上文方法部分所述,使用碾磨程序1b或1d碾磨所有粉末。表3:具有不同金属氧化物添加剂的粉末组合物。表3和图2显示了通过碾磨程序1b和1d制备的三种组合物的氢产率。对于通过碾磨程序1b碾磨的含有组合的金属氧化物的组合物,在1000秒之后产生了总共11ml的氢,这与之前使用bao添加剂的情况相当(参见实施例1)。可以看出,当同时使用两种金属氧化物(cao和cuo)时,尽管氢的生成增加较慢,但立即产生的氢更多,而当单独使用混合物中的cao或cuo时,氢的产生存在延迟。还观察到cuo在1000秒内产生较少量的氢。表3和图3显示了通过碾磨程序1d制备的三种组合物的氢产率。碾磨程序1d与碾磨程序1b的不同之处在于,总碾磨时间从1.1小时增加到2.4小时。在图3中,可以看出,包含结合的金属氧化物的组合物在1000秒后产生13ml的氢,而仅包含cao或cuo的组合物分别仅产生6ml和5ml。此外,注意到先前将cao样品碾磨1.1小时看到的高反应速率也受到影响,导致1000秒后的氢产率降低。实施例3改变金属氧化物的比例为了进一步探索当使用组合的金属氧化物添加剂时增加的氢产率,测试了不同比例的两种金属氧化物。制得的组合物包含铝颗粒(直径为70μm至80μm,如上所述获得)、和氯化钠(nacl)、氯化钾(kcl)和氯化钙(cacl2)的混合物以及各种金属氧化物,其比例如表4所示。对于本研究,所有粉末均使用碾磨程序2a进行碾磨。表4:具有不同比例的cuo和cao的粉末组合物将具有对应于65重量%:35重量%的cuo:cao比的样品(样品65-35)产生的氢体积与50重量%cuo和50重量%cao(样品50-50)进行比较。每种组合物产生的氢的氢流速和量可见于图4。样品50-50显示出比样品65-35高的流速,例如在1000秒时前者大约为后者的两倍(样本50-50的流速为0.04ml/s,样本65-35的流速为0.02ml/s)。在图4右侧y轴上也可以看到产生的氢体积的差异,其中样品50-50在10,000秒后产生220ml(85%h2产率),而样品65-35在相同的时间段后产生140ml(53%h2产率)。实施例4结合使用氯化物盐如表5所示,将nacl、kcl和cacl2中的每一种与铝粉、等比例的cao和cuo一起碾磨。cao和cuo的混合物以下称为mo。使用如上文方法部分所述的碾磨程序1a碾磨粉末。表5:样品中添加剂的组成。如图5和表5所示,显然,在反应的前1000秒钟内,与nacl和kcl相比,通过使用10重量%的cacl2可以更迅速、更大量地产生氢气。在1000秒时,cacl2样品产生了22ml氢,而nacl样品产生15ml,kcl样品产生14ml。将这三种盐混合在一起,以确定结合使用氯化物盐的效果。混合物(以下称为“po”)包含三种盐:cacl2、nacl和kcl的比例分别为3:4:3。此外,为了研究是否存在协同作用,测试了盐添加剂po相对于cacl2的效果。碾磨程序1a用于碾磨两种组合物。从表5和图6可以看出,与仅使用cacl2相比,使用三种氯化物盐的混合物时,氢产率增加。仅600秒后,含po的组合物产生了22ml氢气,而仅含cacl2的组合物产生13ml。可以将其与nacl或kcl的组合物产生的9ml相比,以证明其优于它们。为了进一步探索盐添加剂的作用,制备了两种粉末。一种包含所有添加剂,即(al+mo+po),而另一种不含盐添加剂,即粉末(al+mo)。结果中的这些分别称为“无po”和“有po”。在此有必要相应地调整重量%。通过增加金属氧化物的比例以保持al:mo比为65:35来调整不存在盐的无po样品。使用碾磨程序1a在258rpm下碾磨粉末,并在25℃下与去离子水反应10000秒。表6:从组合物中去除盐的效果。从表6和图7中可以看出,碾磨的“无po”粉末在4000秒内仅产生48ml的h2,此后停止产生任何其他的氢。另一方面,含po的粉末显示出增加的氢产率。在最初的4000秒内,“有po”样品产生130ml(50%收率),而“无po”样品仅产生48ml氢(19%收率)。另一个重要的观察结果是,对于“无po”样品,反应速率在最初的1700秒内很慢,然后迅速增加,直到3000秒反应时间,然后反应似乎停止了。实施例5金属氧化物和氯化物盐的联合作用为了研究碾磨和添加剂对产生的氢的量的重要性,决定通过碾磨制备三个样品,并在不进行碾磨的情况下制备另一个样品。表7:组合物的比较从图8中可以看出,与仅使用两种添加剂(al+po+mo)的组合物相比,仅含铝和mo(al+mo)的组合物在10,000秒后的氢总产率略高。对于含有两种添加剂的组合物,氢的生成速率在最初的6,000秒内相当恒定,此后,生成速率稳定下降。相反,对于仅包含铝和mo的组合物,在最初的2,000秒内,产生的氢的量较低。随后急剧上升,在2,000至5,000秒之间的短时间内产生大量的氢。因此,尽管al+mo组合物的总氢产率略高于al+po+mo组合物,但al+po+mo组合物具有氢产生速率更加恒定的优点。因此,设想该组合物在需要2-3小时的稳定氢产生速率的装置中将更有用。在不碾磨的情况下,相同的组合物在10000秒后每克铝仅产生700ml氢,相当于大约54%的氢产率。在相同的反应时间内,样品(al+mo+po)已经产生的氢的体积为400ml/gal。此外,当使0.3g的(al+po+mo)与9ml的水反应12000秒时,总共产生了235ml,相当于每单位量的反应的金属的氢产率为90%。当省略金属氧化物或po盐混合物时,氢产率显著降低。实施例6碾磨条件对氢产率的影响研究了改变碾磨条件对碾磨的组合物的氢产率的影响。该组合物包含65%的铝粉(40μm至50μm,如上所述获得)、12.5%的氧化钙、12.5%的氧化铜(ii)、4%的nacl、3%的kcl和3%的cacl2。从图9中可以看出,当以258rpm的速度制备的粉末与去离子水反应时,无论碾磨时间长短,在整个1000秒内氢的产生都是逐渐发生的,并且在10000秒时仍持续进行。以258rpm碾磨、总碾磨时间为1.1、1.77和2.4小时的组合物产生的氢的量分别为220ml、170ml和230ml。这分别对应于85%、65%和88%的氢产率。以518rpm碾磨的组合物的结果显示没有逐渐进行的氢产生,并且在1000秒之后仅产生约13ml的氢(对应于4.9%的产率)。10000秒后,似乎不再产生氢。此外,比较了三种碾磨程序-1a、1b和2a(在上面的方法部分中进行了描述)对氢产生的影响。与先前的研究相似,包括铝颗粒(粒径40μm)在内的添加剂的所有组成(65重量%的al、重量%的mo、10重量%的盐)保持不变。从图10中可以看出,三种不同的碾磨程序在制氢方面存在显著差异。与碾磨程序1a(220ml,产率为85%)相比,碾磨程序2a在10000秒后产生的氢少得多(总计80ml,产率为30%)。但是,碾磨程序1b产生的体积最小,只有13ml氢(5%的产率)。实施例7铝颗粒的影响还研究了使用再生铝而不是非再生铝以及本发明组合物中使用的铝粒径的效果。碾磨前,对粒度为3-200μm的再生铝(由ihodusallc提供)进行筛分,以获得直径为40μm、75μm和105μm的颗粒的代表性批次。然后将不同大小的批次与添加剂(12.5%的cao、12.5%的cuo、10%的po)混合,并使用碾磨程序1a进行碾磨。在图11中,绘制的结果显示了粒径对氢的产生的影响。可以看出,对于由再生铝制成的组合物,粒度的确对氢的产率有影响。最小的起始al颗粒尺寸40μm显示出最高的氢产生量,其次为75μm,而105μm则要慢得多,并且产生的氢的量在它们中最少。在10000秒的反应时间下,40μm批次产生了220ml,75μm批次产生了172ml,略少一些,而最大尺寸的105μm再生铝颗粒批次仅产生了90ml氢,相当于氢产率分别为85%、66%和35%。为了继续研究,将40μm的再生al批次与直径为10μm的铝颗粒(命名为“fisheral”)(从fisherchemicals获得,纯度为99.9%)进行了比较。为了比较,将粉末组合物保持与上述实验相同,即(65重量%的al、12.5重量%的cao、12.5重量%的cuo和10重量%的po),并且两种粉末均使用碾磨程序1a(258rpm)制备。从每个样品中产生的氢的量如图12所示。对于fisheral颗粒,观察到的独特的反应滞后时间高达2000秒,但是对于再生al40μm样品,观察到的滞后时间要短得多。从fisheral颗粒产生的氢的流速持续上升,直到2800秒标记,此后观察到趋向稳定。在10000秒的反应时间之后,fisheral产生的氢的量相当于85%的氢产率,而“再生al40μm”的220ml的则相当于92%的氢产率。实施例8组合物与其他液体的反应研究了本发明的组合物与乙醇、乙二醇和尿素的水溶液的反应,以确定该组合物在不易获得干净水的环境中产生氢的适用性。根据上述方法,使用直径为70-80μm的铝颗粒(65重量%)制备组合物。该组合物还包含12.5重量%的cao、12.5重量%的cao和10重量%的po盐混合物,并且使用碾磨程序1a(258rpm)制备。在图13中,显示了在不同浓度的乙醇溶液中氢形成反应的结果。可以看出,不管浓度如何,乙醇溶液都能够产生氢气。在0.68m的最高浓度下,在1000秒的反应内释放出25ml氢气,相当于9.4%的氢产率。在图14中,显示了用不同浓度的乙二醇和工业上可商购的防冻剂(q8防冻剂,根据产品规格,乙二醇含量>90%)的氢形成反应的结果。可以看出,将乙二醇的浓度增加至0.77m似乎改善了氢的形成。相反,商业防冻剂产生的氢的量最少。尿素溶液根据以下文献制得:d.f.putnam,compositionandconcentrativepropertiesofhumanurine.nasareport(1971)。将尿素(ch4n2o,mr=60.05g/mol)粉末与去离子水混合,制成浓度为0.101m(0.66g)、0.15m(0.9g)和0.05m(0.35g)的溶液。随着浓度的增加,盐的重量百分比,即nacl和kcl的重量百分比也增加,并溶解在尿素溶液中以代表人尿的实际水平。一旦混合完成,将保持溶液的烧杯紧密密封,并在17℃下在惰性气氛中储存,以避免任何氧化和氨的形成。如图15所示,最高浓度的尿素,即0.15m,在1000秒的反应内释放出43ml的氢。这对应于16%的氢产率。与使用去离子水时相比,使用0.15m尿素溶液产生的氢的量比使用去离子水时的氢的量多约10ml(3.8%)。以上所述的以及在附图和表格中示出的实施方案仅是对本发明的解释,并且不意图具有任何限制作用。显而易见的是,在不脱离本发明基础原理的情况下,可以对所示的特定实施方案进行多种修改和变更。所有这些修改和变更都应包含在本申请中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1