氧传递速率和中和剂组合调控高糖浓度高效生产L-乳酸的方法与流程
本发明属于生物发酵领域,更具体地,本发明涉及氧传递速率和中和剂组合调控高糖浓度高效生产L-乳酸的方法。
背景技术:
工业乳酸发酵过程多采用批发酵或补料批发酵模式。对批发酵来说,高产物浓度和高产率往往表现出相互矛盾,因此如何平衡两者之间的关系成为实现整体发酵过程高效生产的关键。高底物浓度是实现高产物浓度和高转化率的前提。然而,现有技术中,一般认为乳酸生产菌难以耐受200g/L以上的初始葡萄糖浓度。同时Giraud等人发现在乳酸发酵后期,胞内pH降低和乳酸根离子积累是抑制细胞生长和代谢的主要原因。而且乳酸存在形式(解离或未解离)不同以及发酵液中增加的可溶性物质和渗透压也认为是后期乳酸产率严重降低的重要因素。
合适的菌株以及优化的过程控制策略能有效促进乳酸发酵效率的提高,过程控制包括渗透压调节、保护剂的添加,pH控制等等各方面因素。
综上,本领域还需要进一步研究影响工业乳酸发酵的各种因素,找到关键性的调节因素,一起提高乳酸产量。
技术实现要素:
本发明的目的在于提供氧传递速率和中和剂组合调控高糖浓度高效生产L-乳酸的方法。
在本发明的第一方面,提供一种生产L-乳酸的方法,所述方法包括:
在初始葡萄糖浓度80~270g/L的条件下,发酵培养拟干酪乳杆菌(Lactobacillus paracasei);
其中,在拟干酪乳杆菌生长期,控制氧摄取速率(OUR)为0.21±0.04mmol/L/h,在在拟干酪乳杆菌生长期,控制氧摄取速率为0.11±0.03mmol/L/h;
其中,在发酵的前9~13小时,采用氢氧化钙控制pH为6.0±0.3,之后采用氨水控制pH为6.0±0.3。
在一个优选例中,所述的方法中,初始葡萄糖浓度为100~260g/L;更佳地为200~250g/L。
在另一优选例中,所述的方法中,在拟干酪乳杆菌生长期,控制氧摄取速率为0.21±0.02mmol/L/h,在拟干酪乳杆菌生长期,控制氧摄取速率为0.11±0.015mmol/L/h。
在另一优选例中,所述的方法中,在发酵的前10~12.5小时,采用氢氧化钙控制pH为6.0±0.3,之后采用氨水控制pH为6.0±0.3;更佳地,在发酵的前12±0.5小时,采用氢氧化钙控制pH为6.0±0.3,之后采用氨水控制pH为6.0±0.3。
在另一优选例中,所述的方法中,控制pH为6.0±0.2,更佳地为6.0±0.1。
在另一优选例中,所述的方法中,发酵液中残留葡萄糖含量为0时发酵结束(例如,发酵时间为30~60小时或为35~55小时)。
在另一优选例中,所述的方法中,发酵培养基包括:葡萄糖80~270g/L,蛋白胨13.33±3g/L,酵母提取物13.33±3g/L,乙酸钠0.67±0.2g/L,硫酸镁0.0133±0.003g/L,硫酸锰0.0133±0.003g/L,氯化钠0.0133±0.003g/L,硫酸铁0.0133±0.003g/L。
在另一优选例中,所述的方法中,调整蛋白胨和酵母提取物的比例,使得葡萄糖,蛋白胨和酵母提取物的质量比为(15±2):(1±0.1):(1±0.1)。
在另一优选例中,所述的方法中,培养温度为37±1℃;较佳地为37±0.5℃;
培养转速为150±5rpm;较佳地为150±2rpm。
在另一优选例中,所述的方法中,所述的拟干酪乳杆菌是拟干酪乳杆菌20647(也称为NCBIO-01)。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显 而易见的。
附图说明
图1、初始葡萄糖浓度对拟干酪乳杆菌生长(A),葡萄糖消耗(B)和L-乳酸生成(C)的影响。
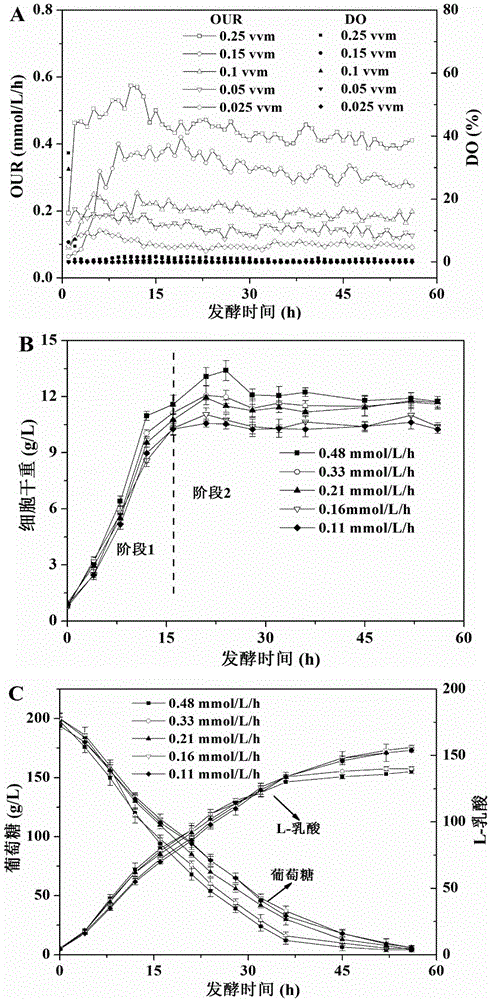
图2、不同供氧水平下,拟干酪乳杆菌发酵生产L-乳酸过程中DO和OUR(A),菌体生长(B),葡萄糖消耗和L-乳酸生成(C)的变化。
图3、中和剂组合变换时间对拟干酪乳杆菌生长,葡萄糖消耗,L-乳酸生产的影响(A),以及发酵过程中环境渗透压的变化(B)。
具体实施方式
本发明人经过深入的研究,揭示了一种优化的生产L-乳酸的方法,该方法包括:在初始葡萄糖浓度较高的条件下发酵培养拟干酪乳杆菌(Lactobacillus paracasei),在发酵的不同阶段调控氧摄取速率(OUR)和更换不同pH调节剂(中和剂)。本发明的方法实现了高效的发酵,大大提高了L-乳酸的产量。
由于需要大量的葡萄糖来转化为L-乳酸,因此,高初始葡萄糖浓度是实现L-乳酸高效生产的前提。然而,现有技术中普遍认为,高的初始葡萄糖浓度对于乳酸生产菌的生长造成影响,乳酸生产菌难以耐受高于200g/L的初始葡萄糖浓度,这大大限制了工业生产L-乳酸的效率。鉴于此,本发明人考察了较多了乳酸生产菌,意外地发现,对于拟干酪乳杆菌(如NCBIO-01)而言,初糖浓度高至250g/L对菌体生长和代谢也基本没有影响。可见拟干酪乳杆菌(如NCBIO-01)是一种潜在的高乳酸浓度生产菌株。因此,应用拟干酪乳杆菌进行L-乳酸生产,可以有效地提高发酵培养基中初始葡萄糖的浓度,从而为L-乳酸高效生产提供了基础。
在利用拟干酪乳杆菌进行高初始葡萄糖浓度发酵过程中,本发明人又进一步研究了发酵工艺中各个因素对于菌株生长、L-乳酸产量的影响,从诸多因素 中发现,氧摄取速率(OUR)以及pH调节剂(中和剂)的应用对于发酵过程的影响是非常大的。
本发明人发现,虽然不同OUR水平下,L-乳酸都是葡萄糖代谢的最主要产物,但是最终L-乳酸浓度受到OUR水平的影响。整个发酵过程中,拟干酪乳杆菌的生长期大概约为0-16h(阶段1),而16h以后基本都进入稳定期(阶段2)。高OUR水平能够在生长期促进细胞生长,当菌体进入稳定期后,此时L-乳酸产率和转化率都随OUR水平的下降而升高,适当的OUR水平在稳定期维持更高产率和转化率。因此,作为本发明的优选方式,在拟干酪乳杆菌生长期,控制氧摄取速率(OUR)为0.21±0.04mmol/L/h,在拟干酪乳杆菌生长期,控制氧摄取速率为0.11±0.03mmol/L/h。
同时,中和剂组合策略(前12h使用氢氧化钙,然后变换为氨水作为中和剂)不但能够有效缓和发酵后期高渗透应激,而且避免了乳酸钙浓度过高而导致的结晶。
本发明人还发现,当氨水作为调节pH值的中和剂时,随着发酵的进行,葡萄糖消耗和L-乳酸生成速率会呈现明显下降趋势。氢氧化钙作为pH值的中和剂时能够有效地减轻发酵后期细胞所受的高渗透应激,但产物乳酸钙随着浓度的升高会出现结晶,从而严重影响发酵液流动性,导致发酵终止,单一使用氢氧化钙作中和剂不适合于高浓度乳酸发酵。鉴于此,本发明人采用氢氧化钙和氨水组合策略,寻找到两种中和剂变换的最佳时间点,实现发酵后期高渗透应激的缓和,并且不析出乳酸钙晶体。因此,作为本发明的优选方式,在发酵的前9~13小时,采用氢氧化钙控制pH为6.0±0.3,之后采用氨水控制pH为6.0±0.3。
在上述控制条件下,拟干酪乳杆菌能够完全耗尽250g/L初始葡萄糖,生成L-乳酸230.8g/L,同时L-乳酸产率达到6.21g/L/h。相比于以前乳酸发酵报道的结果,本研究中不管是L-乳酸浓度还是产率都是最高的。
现有技术中,目前在乳酸发酵过程中,还没有关于将氧摄取速率(OUR)作为控制参数的报道。此外通过中和剂组合来缓和发酵后期高渗透应激的策略不需要其它过程控制策略那般拥有复杂理论和设备。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
材料与方法
菌种
拟干酪乳杆菌(Lactobacillus paracasei)20647,获自中国工业微生物菌种保藏管理中心(CICC),也称为NCBIO-01。
试剂
葡萄糖:上海惠兴生化试剂有限公司;
蛋白胨(Peptone):Oxoid;
酵母提取物(Yeast Extract):Oxoid;
牛肉提取物(Beef Extract):上海生工生物有限公司;
葡萄糖试剂盒:上海科华生物工程股份有限公司;
其它试剂来源于国药集团化学试剂有限公司。
仪器
5L搅拌式生物反应器:上海国强生化工程装备有限公司;
pH和溶氧(DO)电极:美国梅特勒-托勒多公司;
752紫外可见分光光度计:上海菁华科技仪器有限公司;
SBA-40D生化分析仪:山东省科学院;
冰点渗透压仪:上海医科大学仪器厂;
MAX300-LG过程质谱仪:美国Extrel质谱公司。
培养基成分
种子培养基(g/L):蛋白胨10,牛肉提取物10,酵母提取物10,柠檬酸氢二铵2,磷酸氢二钾2,乙酸钠4,硫酸镁0.2,硫酸锰0.2,氯化钠0.03, 硫酸铁0.01,碳酸钙25,吐温-801ml/L。氢氧化钠调节上述溶液pH至6.0,115℃灭菌20min。葡萄糖(40g/L)与上述其它成分分开配制,115℃灭菌20min。
发酵培养基(g/L):葡萄糖200或250或实施例中具体写明的量,蛋白胨13.33,酵母提取物13.33,乙酸钠0.67,硫酸镁0.0133,硫酸锰0.0133,氯化钠0.0133,硫酸铁0.0133。摇瓶发酵时,氢氧化钠调节上述溶液pH至6.0,115℃灭菌20min。在考察初始葡萄糖浓度实验中,葡萄糖(50g/L,100g/L,150g/L,200g/L,250g/L,300g/L,400g/L)与上述其它成分分开配制,同时调整蛋白胨和酵母提取物的比例,维持葡萄糖,蛋白胨和酵母提取物的质量比为15:1:1,115℃灭菌20min。
培养条件种子培养
用50ml无菌水将新鲜茄子瓶斜面中的菌体悬浮,取15ml悬浮液接种于85ml种子培养基中,在37℃,110r/min培养箱中培养12h。
摇瓶发酵培养
将20ml种子培养液接种于80ml发酵培养基中,接种量为20%。250ml三角摇瓶置于37℃,110r/min培养箱中,培养24和48h。发酵初始加入一定量碳酸钙(40g/L)调节过程pH在大约5.0左右(pH4.6-5.2)。
5L罐发酵培养
发酵过程中工作体积为4L,接种量为20%,温度和转速分别为37℃和150rpm。供氧水平通过不同通气水平来调节(表1)。25%(w/w)氨水或35%(w/w)氢氧化钙溶液用于控制pH在6.0。
中和剂组合实验中,发酵过程先用氢氧化钙再用氨水控制pH,变换时间为10h(策略1,发酵的前10h使用氢氧化钙,然后变换为氨水作为中和剂),12h(策略2,发酵的前12h使用氢氧化钙,然后变换为氨水作为中和剂)和14h(策略3,发酵的前14h使用氢氧化钙,然后变换为氨水作为中和剂)。
细胞生物量测定
用稀盐酸稀释发酵液一定倍数,在紫外可见分光光度计测定620nm下的吸光值。细胞生物量通过细胞干重(DCW)来表示,两者关系为:1OD相当于0.41g/L DCW。
发酵液中渗透压,L-乳酸和葡萄糖测定
取一定量发酵液在5,000rpm条件下离心10min,弃去菌体,上清稀释一定倍数后待测。渗透压按照仪器说明通过冰点渗透压仪进行测定。L-乳酸浓度通过SB-40C生物传感分析仪进行测定。葡萄糖浓度通过试剂盒进行测定。
发酵过程中OUR检测
OUR计算通过对发酵尾气的分析数据计算得到。以进气和尾气中惰性气体N2维持恒定建立平衡方程,求得OUR的计算公式如下:
Fin:进气流量l/min;V:发酵液体积L;C惰in、CO2in、CCO2in:分别为进气中惰性气体、氧气及二氧化碳的质量分率;CO2out、CCO2out:分别为排气中氧气和二氧化碳的质量分率;Pin:进气的绝对压强Pa;tin:进气的温度℃;h:进气的相对湿度(%)。
上述所有实验均进行三次平行。
实施例1、初始葡萄糖浓度对拟干酪乳杆菌发酵生产L-乳酸的影响
本实施例在250ml摇瓶中进行,并保持恒定C/N比。从图1A可以看出,经过24h培养,细胞生物量随着初始葡萄糖浓度的升高而增加(50-100g/L范围内)。当初始葡萄糖浓度超过100g/L时,细胞生物量呈下降趋势,特别是在高初始葡萄糖浓度下(大于250g/L)。培养48h后,发现初始葡萄糖在100-250g/L之间有利于细胞生物量合成,均明显高于其它浓度下的细胞生物量。结合葡萄糖消耗图(图1B)可以看到,50g/L初始葡萄糖在发酵24h时已经完全耗尽,而100g/L初始葡萄糖也在发酵48h后基本耗尽。相对应地,L-乳酸生成也表现出与葡萄糖消耗一致的趋势(图1C)。这说明50g/L条件下细胞生物量较低是由葡萄糖限制引起,而高初始葡萄糖(大于300g/L)条件下 细胞生物量低则更可能是由高底物浓度或高渗透压抑制所导致。总体来看,100g/L,200g/L和250g/L初始葡萄糖都具有良好的发酵表现。在48h发酵时间内,其葡萄糖消耗速率分别为2.08,2.21和2.08g/L/h,L-乳酸产率为1.93,2.09和1.92g/L/h。
因此,从以上结果可以得出:随着初始糖浓度从100g/L提高到250g/L,拟干酪乳杆菌的生长和代谢能力没有表现出明显变化。在接下来的5L罐实验中,本发明人选择200g/L初始葡萄糖浓度进行发酵过程控制研究。
实施例2、供氧水平(OTR)对拟干酪乳杆菌生产L-乳酸的影响
采用5L罐发酵培养。
在拟干酪乳杆菌发酵生产L-乳酸过程中,发酵一开始大概3h左右以后,DO电极测得发酵液中的DO就处于跌零水平,一直至发酵结束,这说明菌体处于氧限制状态。
因此,本实施例中,通过改变通气水平来定量调节OTR从而实现OUR调控,并研究不同OUR水平在200g/L初始糖浓度下,以氨水为中和剂时,对拟干酪乳杆菌生长、耗糖以及产酸的影响。
通过图2A可以看出,发酵过程中,OUR水平随通气量增加而增加。当通气量为0.25,0.15,0.1,0.05和0.025vvm时,相对应的OUR值分别为0.48,0.33,0.21,0.16和0.11mmol/L/h(表1)。比较不同OUR水平下细胞生长情况(图2B),发现整个发酵过程中,生长期大概为0-16h(阶段1),而16h以后基本都进入稳定期(阶段2)。此外,高OUR水平能够在生长期促进细胞生长,在稳定期维持更高细胞生物量。虽然不同OUR水平下,L-乳酸都是葡萄糖代谢的最主要产物,但是最终L-乳酸浓度受到OUR水平的影响(图2C),这说明供氧水平的不同会造成L-乳酸转化率的差异。高供氧条件下,会显著降低L-乳酸的转化率。随着OUR水平从0.11mmol/L/h上升至0.48mmol/L/h,L-乳酸转化率从94.0%下降到82.2%(表1)。
值得注意的是,在菌体生长期,虽然L-乳酸产率随OUR升高而下降,但是转化率却呈现上升趋势。控制菌体OUR为0.21mmol/L/h能够很好地平衡产率与转化率之间的矛盾,同时保持较高的L-乳酸产率和转化率(4.70g/L/h和96.8%)。当菌体进入稳定期后,此时L-乳酸产率和转化率都随OUR水平的 下降而升高,分别从1.73g/L/h和80.5%增加到2.35g/L/h和92.9%(表1)。
这些结果表明,控制低OUR水平(0.11mmol/L/h)有利于提高L-乳酸的生产效率。因此,综合考虑生长期和稳定期的L-乳酸产率和转化率,接下来的实验中将采取两阶段OUR控制策略,即分别控制生长期(0-16h)和稳定期(16h-发酵结束)的OUR为0.21和0.11mmol/L/h。
表1、不同供氧水平下L-乳酸发酵产物比较
注:表中“OUR”和“细胞干重”为稳定期的平均值,其标准偏差分别在15%和5%之内;“产率”和“转化率”为三次独立实验的平均值,其标准偏差分别在5%和2%之内。
实施例3、中和剂组合变换时间对拟干酪乳杆菌生产L-乳酸的影响
当氨水作中和剂时,如图2B和表1所示,随着发酵的进行,葡萄糖消耗和L-乳酸生成速率呈明显下降趋势。同时,在本发明人发现,环境渗透压不断升高是造成发酵后期耗糖和产酸速率迅速下降的主要原因。氢氧化钙作中和剂时能够有效地减轻发酵后期细胞所受的高渗透应激,但产物乳酸钙随着浓度的升高会出现结晶,从而严重影响发酵液流动性,导致发酵终止。因此,单一使用氢氧化钙作中和剂不适合于高浓度乳酸发酵。
鉴于此,本发明人采用氢氧化钙和氨水组合策略,寻找到两种中和剂变换的最佳时间点,实现发酵后期高渗透应激的缓和,并且不析出乳酸钙晶体。在此实验中,为了进一步提高L-乳酸浓度,控制初始葡萄糖为250g/L,并采用两阶段OUR控制策略(生长期OUR为0.21mmol/L/h,稳定期OUR为 0.11mmol/L/h)。此外,将中和剂变换时间定在10h(策略1),12h(策略2)和14h(策略3)。
结果显示(图3),在策略3下,由于乳酸钙大量结晶并析出,发酵只能进行至18h。相比之下,通过策略1和策略2,250g/L初始葡萄糖最终都能完全耗尽,同时细胞生长情况也较为相近。但是策略2整体发酵时间(葡萄糖耗尽)要比策略1缩短6h,其整体葡萄糖消耗速率和L-乳酸产率能够达到6.72和6.21g/L/h,分别比策略1提高了18.7和24.3%(表2)。结合发酵过程中环境渗透压的变化进行分析(图3B),可以得出乳酸钙产生的渗透压要大大低于乳酸铵产生的渗透压,而且发酵后期策略2渗透压比策略1低大约200mOsm/kg。这也可能是策略2发酵时间短,耗糖速率高,产酸速率快的原因。理论上,氨水越晚代替氢氧化钙,产生的环境渗透压就越低,也更有利于菌体生长、代谢和生存。但在实际发酵过程中,特别是对于拟干酪乳杆菌这种嗜温细菌来说,必须考虑产物乳酸钙的饱和以及结晶浓度。另一方面,从L-乳酸转化率上来看,策略2比策略1提高了4.8%,这说明微生物在发酵后期可能需要合成其它物质来抵抗高渗透应激,从而降低产物转化率。
表2、不同中和剂组合策略下,拟干酪乳杆菌发酵生产L-乳酸各参数比较
注:表中数据为三次独立实验的平均值±标准偏差;策略3中各参数为18h发酵时间计算所得。
本发明获得最终L-乳酸浓度(230.8g/L)和L-乳酸产率(6.21g/L/h),这充分说明了本发明的优化工艺实现了极其优异的技术效果。
结论
本发明研究了拟干酪乳杆菌在高葡萄糖浓度条件下,供氧水平和中和剂 组合策略对菌体生长,葡萄糖消耗以及L-乳酸生成的影响。通过两阶段OUR控制,并在12h变换中和剂,拟干酪乳杆菌能够完全耗尽250g/L初始葡萄糖,并生成L-乳酸230.8g/L,其产率达到6.21g/L/h。不管是L-乳酸浓度还是产率均达到非常理想的水平。本发明的菌株具有作为工业规模高效生产L-乳酸的潜力。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!