一类磷酸化精氨酸类似物及其合成方法与应用与流程
本发明涉及磷酸化精氨酸类似物,尤其是涉及一类磷酸化精氨酸类似物及其合成方法与应用。
背景技术:
蛋白质的可逆磷酸化是生物界最普遍、最重要的一种蛋白质翻译后修饰方式,也是细胞内信号转导的关键机制之一[1]。与生物学中广泛研究的发生在丝氨酸、苏氨酸和酪氨酸侧链上的O-磷酸化相比,蛋白质上精氨酸的磷酸化(pArg)作为一种新颖的翻译后修饰形式,大量存在于细菌等原核生物中[2],并被认为参与细菌内基因的转录调控[3]、蛋白质质量控制和响应外界刺激等重要的生物过程[4]。然而,由于pArg本身在抗原呈递过程中不稳定,无法通过直接免疫动物获得有效的抗体,针对蛋白中pArg的抗体还未见报道,因此对pArg生物学功能的研究进展缓慢。除此之外,pArg还具有对酸、热等条件敏感、在很多生化分析条件下不稳定等特殊的性质[5]。发展特异性识别蛋白质上磷酸化精氨酸的抗体,可以拓展科学界对pArg生物学功能的认识,促进以pArg为核心的上游激酶、下游酯酶的功能研究及相应的药物发现。
根据现有的有限的研究结果,游离状态的磷酸化精氨酸(pArg)可能参与以下重要的生物学功能:1)作为无脊椎动物体中的ATP和能量缓冲库。当细胞内ATP浓度降低时,pArg可作为高能物质和磷酸根供体,直接与ADP合成ATP。2)作为一些细胞膜离子泵的调节物质。某些细胞膜离子运输复合物是受以ATP为磷酸基团供体的磷酸化-去磷酸化过程提供能量支持和活性调控的,由于ATP可由pArg直接合成,所以pArg可以间接地调控细胞膜上离子运输复合物的活性和功能。3)作为细胞内有氧代谢供能转向无氧代谢供能的一个中介物质。在细胞活动中,只有当代谢加剧而线粒体不能及时产生足够的ATP时,pArg才充当起ATP的合成和缓冲库的功能。然而,由于pArg本身也由ATP合成,所以在机体受到较大应激条件时,pArg的缓冲能力有限,只能满足部分ATP合成所需的能量。厌氧反应(糖酵解过程)在能量需求高峰期发挥了提供ATP的主要作用,所以,pArg在一定程度上可能是有氧代谢供能转向无氧代谢供能的一个中间物质。4)调节细胞内的pH值。在动物体受到代谢应激时,pArg可以通过自发或酶促的水解过程,捕捉并束缚细胞内的H+,降低细胞液中的[H]+并提高[P3O4]3-的浓度,提高细胞液缓 冲能力,维持细胞内的pH值。5)pArg还可以影响到机体的磷酸化能力并进而影响生长。磷酸化能力的降低导致高能磷酸盐只被充分用于维持基本的细胞活动,而阻碍了机体的其他活动如生长和发育,例如一些软体动物的面盘幼体外壳将会由于高能磷酸盐的减少而变形。
最近,对蛋白质上磷酸化精氨酸的研究有了一些新进展。2009年,Tim Clausen发现并鉴定出原核生物中第一个蛋白精氨酸激酶-McsB,并研究了其可能参与的调控功能[3];2012年,在枯草芽孢杆菌中发现了第一个磷酸化精氨酸的磷酸酯酶-YwlE,并通过质谱技术,在以枯草芽孢杆菌为革兰氏阳性菌模型,鉴定出87个蛋白中121个精氨酸磷酸化位点[6]。由于目前还没有针对pArg的抗体,因此急需建立制备anti-pArg抗体的方法,进而促进对该领域进行更深入的研究。
国际上目前针对酸不稳定N-磷酸的蛋白的检测(如:磷酸化组氨酸),发展了应用与检测抗原在结构上近似的类似物进行免疫,制备识别真实抗原的抗体的策略[7-8]。
参考文献:
1.Tony Hunter.Cell,2000,100,113-127.
2.Elsholz,A.K.W.,K.Turgay,et al.Proc Natl Acad Sci U S A,2012,109(19),7451-7456.
3.Fuhrmann,J.,A.Schmidt,et al.Science,2009,324(5932),1323-1327.
4.Schmidt A.;Trentini DB.;Spiess S.;Fuhrmann J.;Ammerer G.;Mechtler K.;Clausen T.Mol Cell Proteomics,2014,13,537-550.
5.Besant,P.G.;Attwood,P.V.;Piggott,M.J.Current Protein and Peptide Science,2009,10,536-550
6.Elsholz,Alexander K.W.Turgay,Becher,Hecker,Michael.Gerth,Ulf.Proc.Nati.Acad.Sci.,2012,47,10335-10337.
7.Jung-Min Kee,Bryeanna Villani,Laura R.Carpenter,and Tom W.Muir.J.Am.Chem.Soc.,2010,132(41),14327–14329.
8.Kee,J.M.,R.C.Oslund,et al.Nature Chemical Biology.,2013.9(7):416-428.
技术实现要素:
本发明的目的在于提供一类磷酸化精氨酸类似物及其合成方法与应用。
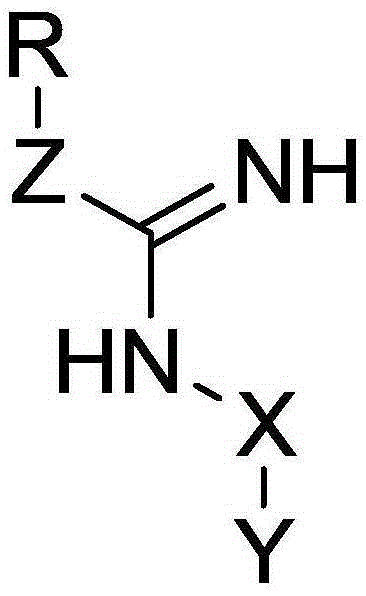
所述一类磷酸化精氨酸类似物以磷酰基乙脒结构为主体,一类磷酸化精氨酸类似物的化学结构式为:
所述一类磷酸化精氨酸类似物(pArg analog)的合成路线如下:
其中,Z基团包括
R基团包括
R2,R3,R4,R5,R6,R7,R8分别表示独立的氢,烷基,烯基,环烷基,芳基,芳烷基,杂环,杂环环烷基,或磷酸酯保护基;
X代表一种化学键或一种连接基团,范围包括烯烃,亚烯烃,亚炔烃,环烯烃,环炔烃,杂环烯,-(O-CH2-CH2)n-,或–(CH2)q,以及–(CH2)q中任意-CH2基团被-O-取代;
n取值1~100;q取值1~6;
Y包括H,-OR9,-NR9R10,-SR9,-COOR9,-C(O)NR9R10,-NHJ或者-C(O)Q;
R9和R10分别表示独立的氢,烷基,烯基,环烷基,芳基,芳烷基,杂环,杂环环烷基;
J代表一种氨基保护基团;
Q代表一种羧酸保护基团。
所述R可表示
所述R2和R3可表示H。
所述X可表示烷烃连接基团或-CH2-CH2-。
所述Y可表示-NR9R10,-NHJ;所述R9和R10可表示H。
所述R可代表R2和R3代表H;X代表-CH2-CH2-;Y代表-NR9R10而R9、R10代表H。
本发明通过上述合成方法获得与天然pArg在结构上类似、未见文献报道的新颖的一类磷 酸化精氨酸类似物(pArg类似物),所述一类磷酸化精氨酸类似物可以作为半抗原,用于制备识别蛋白上pArg的抗体;应用一类磷酸化精氨酸类似物(如pAIE)所制备的抗体,具有识别pArg的专一性,与蛋白质中常见的其他磷酸化修饰形式(如pSer\pThr\pTyr等)交叉反应性低;另外,应用一类磷酸化精氨酸类似物(如pAIE)所制备的小鼠多克隆抗体,主要为IgG2a型,可用于筛选单克隆抗体。
所述一类磷酸化精氨酸类似物还可作为蛋白磷酸化精氨酸酯酶(如YwlE)的抑制剂(inhibitor),作为研究该类酯酶生物功能的生化试剂,或针对该类酯酶进行药物开发的先导化合物。
本发明提供一种抗体的制备流程,该流程由免疫动物开始(例如,哺乳动物),通过反复用前述免疫原实施免疫,之后从免疫动物身上收集血清,并使用生物常规技术分离血清中的抗体,如实施例2所示。前述免疫原也可用于体外抗体或结合蛋白的筛选,如噬菌体展示库技术,并使用生物常规技术分离与免疫原特异性结合的噬菌体和抗体。体内或体外筛选得到的抗体可能是单克隆或多克隆抗体,如实施例2、实施例5所示。该抗体不识别非磷酸化的蛋白或氨基酸,只识别磷酸化精氨酸残基并对其他磷酸化氨基酸残基没有响应,如实施例4所示。
本发明合成了一类磷酸化精氨酸类似物,还以前述磷酰基乙脒结构式(I)组成半抗原。该半抗原可与载体偶联,为抗磷酸化精氨酸抗体(anti-pArg antibody)的产生和结合提供免疫原。该载体材料可为蛋白、蛋白片段、合成多肽或半合成多肽,如实施例2所示。
本发明进一步涉及到免疫原产生的相应抗体。该抗体在识别蛋白中磷酸化精氨酸(pArg)的同时,并不识别非磷酸化精氨酸(Arg)、非磷酸化多肽、除磷酸化精氨酸外的磷酸化氨基酸、或含其它磷酸化氨基酸残基的多肽,如实施例3、实施例4所示。
本发明所涉及半抗原还可与可检测标记物共价结合。标记物可从酶中选择,还可从发光物质、放射性物质或其混合物中选择。标记物是一种过氧化酶,例如辣根过氧化物酶。发光物质作为标记物可以是生物发光、化学发光或荧光材料。
本发明提供了一种抗体的制备流程。该流程由免疫动物开始,通过反复用前述免疫原实施免疫,之后从免疫动物身上收集血清,并使用生物常规技术分离血清中的抗体,前述免疫原也可用于体外抗体或结合蛋白的筛选,如噬菌体展示库技术,并使用生物常规技术分离与免疫原特异性结合的噬菌体和抗体。体内或体外筛选得到的抗体可能是单克隆或多克隆抗体。该抗体不识别非磷酸化的蛋白或氨基酸,只识别磷酸化精氨酸残基并对其他磷酸化氨基酸残基没有响应。
本发明通过设计合成pArg的稳定类似物,如(2-((2-aminoethyl)amino)-2-iminoethyl) phosphonic acid(pAIE),并通过将其与载体蛋白(如keyhole limpet hemocyanin,KLH)偶联、免疫动物的策略,首次获得了可特异性识别蛋白质上pArg修饰的兔和鼠多克隆抗体。通过酶联免疫分析(ELISA)、蛋白质斑点杂交(dot-blot)、蛋白质电泳(SDS-PAGE)、蛋白质免疫印迹(Western bloting)、抗体免疫分型(isotyping)等多种手段的评价,证明:1)所发展的合成方法可以获得与天然pArg在结构上类似的、未见文献报道的新颖的pArg类似物;2)所合成的pArg类似物可以作为半抗原,用于制备识别蛋白上pArg的抗体;3)应用pArg类似物(如pAIE)所制备的抗体,具有识别pArg的专一性,与蛋白质中常见的其他磷酸化修饰形式(如pSer\pThr\pTyr等)交叉反应性低;4)应用pArg类似物(如pAIE)所制备的小鼠多克隆抗体,主要为为IgG2a型,具备筛选单克隆抗体的条件。
本发明通过分子设计,合成了一类化学性质稳定、与pArg结构类似的pArg类似物,并将此类类似物与载体蛋白偶联免疫动物的方法,建立了制备能识别蛋白质中磷酸化精氨酸抗体的方法并制备了多克隆抗体,此外还涉及所制备的多克隆抗体在生物检测、蛋白富集等生物分析领域中的应用。本发明合成的以磷酰基乙脒结构为主体的磷酸化精氨酸类似物(pArganalog),可以有效作为半抗原生成专一性识别磷酸化精氨酸(pArg)的抗体。本发明中所合成的磷酸化精氨酸类似物(pArg analog)由于与天然存在的pArg具有相似的结构,还可能作为蛋白磷酸化精氨酸酯酶(如YwlE)的抑制剂(inhibitor),作为研究该类酯酶生物功能的生化试剂,或针对该类酯酶进行药物开发的先导化合物。
附图说明
图1是本发明所述一类磷酸化精氨酸类似物的结构通式。
图2是本发明所述一类磷酸化精氨酸类似物的通用合成路线。
图3是合成示例及抗体制备中所用精氨酸类似物pAIE的分子结构式。
图4是实施例1中合成精氨酸类似物pAIE的合成路线图。
图5是实施例2中pAIE与KLH偶联制备免疫抗原的示意图。
图6是实施例2中用于血清滴度检测的精氨酸磷酸化多肽色谱制备图。
图7是实施例2中用于血清滴度检测的精氨酸磷酸化多肽的一级质谱鉴定图。
图8是实施例2中用于血清滴度检测的精氨酸磷酸化多肽的二级质谱图。
图9是实施例2中应用pAIE为半抗原,免疫小鼠后的血清滴度图。
图10是实施例3中免疫血清经蛋白A亲和纯化后,各组份的ELISA测定图。
图11是实施例3中是实施例3中免疫血清经蛋白A亲和纯化后,各组份的电泳图。
图12是实施例4中纯化抗体的斑点印迹(dot-blot)特异性评价图。
图13是实施例5中免疫血清ELISA抗体亚型分析图。
具体实施方式
下面结合附图和实施例对本发明作进一步说明。
除非另外定义,所有使用的技术及科学词汇含义与一般专业技术词汇的通用理解相同。
图1是本发明所述一类磷酸化精氨酸类似物的结构通式。
图2是本发明所述一类磷酸化精氨酸类似物的通用合成路线。
本发明所述制备识别蛋白质中磷酸化精氨酸抗体的技术路线如下:
1.通过计算模拟磷酸化精氨酸半抗原的电子云结构,设计合成磷酸化精氨酸类似物,如N-(2-乙胺)-2-膦酸乙脒(pAIE)(图3),并通过逆合成分析,设计合成步骤(图4),最终合成精氨酸类似物pAIE,具体合成路线见实施例1。
2.利用化学偶联的方法制备免疫原,将设计合成的磷酸化精氨酸类似物(pAIE)与钥孔戚血蓝素蛋白(KLH)通过戊二醛法偶联,经透析、浓缩,得到pAIE-KLH抗原(图5)。多次使用pAIE-KLH抗原免疫注射小鼠或兔子,静脉采血,并使用pAIE-BSA,pArg-BSA或得到磷酸化精氨酸肽段(pArg-pep)筛选抗原验证血清中所含抗体确实为pAIE半抗原产生,多次免疫并测定抗体滴度,当抗体滴度增长至平台期后,采血,分离抗血清(图9)。
3.筛选抗体所使用的pAIE-BSA利用化学偶联方法获得,筛选抗体所使用的磷酸化精氨酸肽段(pArg-pep)设计自蛋白精氨酸激酶McsB天然底物CtsR,通过固相多肽合成方法获得未磷酸化肽段(pep)后,利用蛋白精氨酸激酶McsB进行体外酶促磷酸化,并经色谱制备分离后,获得pArg-pep(参见图6~8和表1,表1给出b、y离子匹配结果)。
表1
4.抗血清经蛋白A偶联填料纯化后,得到抗磷酸化精氨酸多克隆抗体,利用合成的磷酸化精氨酸肽段(pArg-pep)进行ELISA实验测试亲和纯化组份是否识别磷酸化精氨酸(图10),并利用蛋白电泳,测定各个亲和纯化组份中的蛋白纯度(图11)。使用合成的含磷酸化精氨 酸,磷酸化丝氨酸,磷酸化苏氨酸,磷酸化酪氨酸多肽(pArg-pep,pSer-pep,pThr-pep,pTyr-pep),通过dot-blot实验测试亲和纯化抗体的特异性(图12)。最后,利用山羊抗鼠分型二抗(IgG1,IgG2a,IgG2b,IgG3,IgM),通过ELISA实验测试亲和纯化抗体亚型(图13)。
以下给出具体实施例。
实施例1:磷酸化精氨酸类似物N-(2-乙胺)-2-膦酸乙脒(pAIE)的合成
总体合成路线如图4所示。
化合物1(2-二乙基膦酰基-硫代乙酰胺)的合成:
圆底烧瓶中加入氰甲基膦酸二乙酯(5.30g,30mmol),三乙胺(6.05g,60mmol),四丁基溴化铵(125mg),甲苯(25mL)。在氩气保护条件下,向反应瓶中通入干燥的硫化氢(H2S)气体,10℃下搅拌反应5h,随后常温反应12h。反应结束后,向反应液中通入过量氮气,4℃冷却3h后,过滤得到黄色固体。过滤所得黄色固体在氮气保护条件下,用甲苯洗涤,得到产物化合物1(2.34g,产率37%)。
1H NMR(500MHz,CDCl3):δ8.45(s,1H,NH protons)and 7.73(s,1H,NH protons),4.19(dq,J=14.2,7.1Hz,4H,-OCH2CH3),3.44(d,J=20.7Hz,2H,-PCH2),1.38(dt,J=7.1Hz,6H,-OCH2CH3)ppm.
13C NMR(126MHz,CDCl3):δ198.07(d,J=6.5Hz,-C=S),63.24(d,J=6.7Hz,-OCH2CH3),43.05(d,J=125.4Hz,-PCH2),16.30(d,J=6.1Hz,-OCH2CH3)ppm.
31P NMR(200MHz,CDCl3):δ21.03ppm.
ESI-MS:234.2(理论值[MW+Na]+),234.25(实测值).
化合物2(2-二乙基膦酰基-S-甲基硫代乙酰胺碘盐)的合成:
氩气保护下,将化合物1(470mg,2.23mmol)的溶解于2.5mL丙酮中,室温搅拌下加入碘甲烷(1.26g,8.91mmol)。反应30min后,过滤得到白色固体,产物用无水乙醚洗涤2-3次后,真空干燥,得到化合物2(666mg,产率83%)。
1H NMR(500MHz,CDCl3):δ4.50-4.16(m,4H,-OCH2CH3),3.96(d,J=22.5Hz,2H,-PCH2),3.04(d,J=0.9Hz,3H,-SCH3),2.67(s,2H,-NH2),1.41(dt,J=7.0Hz,6H,-OCH2CH3)ppm.
31P NMR(200MHz,CDCl3):δ15.81ppm.
化合物3(N-(2-乙胺基甲酸叔丁酯)-2-二乙基膦酰基-乙脒)的合成:
将化合物2(611mg,1.73mmol)及N-叔丁氧羰基-1,2-乙二胺(277mg,1.73mmol)溶解于甲醇(5mL),在氩气保护下,室温搅拌反应3h。反应液减压条件下除去溶剂,得到白 色固体。将固体用乙醚洗涤两次,得到化合物3(628mg,产率78%)。
1H NMR(400MHz,D2O):δ4.16(p,J=7.2Hz,4H,-OCH2CH3),3.39(d,J=5.8Hz,2H,-C(O)NHCH2CH2),3.28(d,J=5.0Hz,-C(O)NHCH2CH2),1.35(s,9H,-(CH3)3C),1.28(t,J=7.0Hz,6H,-OCH2CH3)ppm.(-CH2P,exchange in D2O)
13C NMR(101MHz,D2O):δ160.21(d,J=6.1Hz,-C=NH),158.15(s,-C=O),81.42(s,-(CH3)3C),65.01(d,J=6.9Hz,-OCH2CH3),42.39(s,-C(O)NHCH2CH2),37.86(s,-C(O)NHCH2CH2),27.70(s,-(CH3)3C),15.69(d,J=5.7Hz,-OCH2CH3)ppm.
31P NMR(162MHz,D2O):δ20.51ppm.
ESI-MS:339.2(理论值[MW+H]+),339.3(实测值).
化合物4(N-(2-乙胺)-2-膦酸乙脒)的合成
化合物3(370mg,0.80mmol)溶解于10mL 33%氢溴酸醋酸溶液,氩气保护下室温搅拌48h。减压浓缩反应混合物,去除溶剂后得到油状粗产物。粗产物溶于2mL 0.1%醋酸后,用0.1%醋酸平衡后的阳离子交换柱(型号AG 50W-X8)纯化,经6mL 0.1%醋酸洗去杂质后,产物用500mM醋酸铵洗脱,多次冷冻干燥后,得到白色固体化合物4(117mg,产率81%)。
1H NMR(500MHz,D2O):δ3.64(t,J=5.8Hz,2H,-C(NH)NHCH2CH2),3.28(t,J=5.9Hz,2H,-CNHCH2CH2),2.90(dd,J=20.0,6.7Hz,2H,-CH2P)ppm.
13C NMR(126MHz,D2O):δ164.39(d,J=4.2Hz,-C=NH),39.73(s,-C(NH)NHCH2CH2),37.15(s,-C(NH)NHCH2CH2),34.57(d,J=117.4Hz,-CH2P)ppm.
31P NMR(200MHz,D2O):δ10.53ppm.
ESI-MS:182.1(理论值[MW+H]+),182.0(实测值).
实施例2:应用磷酸化精氨酸类似物pAIE为半抗原,制备抗磷酸化精氨酸的抗体
pAIE与载体蛋白的化学偶联及免疫:
如图5所示,将pAIE和钥孔血蓝蛋白(KLH)分别溶解于偶联缓冲液(0.1M Na2CO3,0.15M NaCl,pH 8.5)中并按比例混合,其中pAIE终浓度为15mM,KLH终浓度为2mg/mL,缓慢加入25%的戊二醛至终浓度为0.5%,室温孵育2h后,加入NaBH4固体至终浓度10mg/mL,室温反应2h后于PBS 7.4中透析过夜,用Bradford法测定蛋白浓度。
制备的pAIE-KLH作为免疫抗原,通过与等体积的弗氏完全佐剂或弗氏不完全佐剂混合乳化后,按200μg/小鼠/次,400μg/兔/次,皮下多点或腋窝注射于6周龄的洁净级小鼠(BALB/C)或6周龄新西兰白兔。免疫间隔14~1天,重复2~次后,静脉采血,分离血清。
检测抗原的制备:
检测抗原使用化学合成的多肽(序列:Ac-KRGGGGYIKIIKV-NH2),经蛋白精氨酸激酶(McsB)体外磷酸化后,得到含有磷酸化精氨酸的多肽(序列:Ac-KpRGGGGYIKIIKV-NH2),经色谱分离制备,具体方法如下。首先包含精氨酸激酶McsB-His6基因的质粒(质粒由Tim Clausen课题组提供)转入到包含pLys基因的大肠杆菌BL21(DE3)菌株中,挑取单克隆。在1L LB培养基中接种1mL过夜培养的菌液37℃、250rpm条件下培养至至OD600=0.8。加入0.5mM IPTG,在18℃、200rpm的条件下诱导表达12h。菌体在4℃、8000rpm离心收集后,加入15mL裂解液(裂解液:50mM KH2PO4,500mM KCl,1mMβ-巯基乙醇,5%甘油),150μL 100mM PMSF储备液,4℃下超声破碎10min,14000g离心10min,保留上清溶液。将上清液通过镍柱分离,经咪唑梯度洗脱后得到McsB,蛋白纯度经电泳验证,蛋白浓度用Bradford法测定。利用得到的McsB对化学合成的底物多肽(Ac-KRGGGGYIKIIKV-NH2)进行体外磷酸化反应。反应条件为:20mM Tris(pH=8.0),5mM MgCl2,1mM ATP,15μM McsB,40μM多肽,30℃保温1h。
磷酸化的多肽通过HPLC分离纯化后(A相:超纯水0.1%甲酸B相:95%乙腈5%超纯水0.1%甲酸;柱子:TC-C18:4.6um x 15cm;流速:1mL/min。)(图6),纯度和修饰位点分别经过一级质谱(图7)和二级质谱(nano LC-MS/MS)(图8)鉴定。
免疫血清滴度的测定:
每个免疫间隔后获得的小鼠血清,使用含有磷酸化精氨酸的多肽(序列:Ac-KpRGGGGYIKIIKV-NH2)为包被抗原,通过倍比稀释和酶联免疫吸附(ELISA)的方法,进行滴度测定和评价(图9)。具体ELISA条件见实施例3。
实施例3:小鼠抗磷酸化精氨酸多克隆抗体的纯化
结合/洗涤缓冲液:0.15M NaCl,20mM Na2HPO4,pH 8.0。
洗脱缓冲液:0.1M glycine,pH 2.5。
中和缓冲液:1M Tris-HCl,pH 8.5。
取20μL protein A琼脂糖微珠(50%悬浊液)于微型纯化柱中,自然流干,分别用5倍柱体积(50μL)ddH2O和5倍柱体积(50μL)结合缓冲液洗涤。小鼠抗磷酸化精氨酸血清(10μL)用9倍(90μL)结合缓冲液稀释后小心加于柱胶上方,收集流穿,之后用10倍柱体积(100μL)洗涤缓冲液洗涤微珠,以每管20μL接收洗涤组份;之后用10柱体积(100μL)洗脱缓冲液洗涤树脂,以每管20μL接收洗脱组份,收集的洗脱组份立刻用2μL的中和缓冲液中和。
纯化获得的各组分(包含未纯化组分、流穿组分、洗涤组分、洗脱组分)分别用含有磷酸化精氨酸的多肽(序列:Ac-KpRGGGGYIKIIKV-NH2)为包被抗原,通过ELISA进行功能验证 (图10),并用SDS-PAGE及银染进行纯度评价。(图11)
ELISA条件:
包被缓冲液:0.032M Na2CO3,0.068M NaHCO3,pH 9.6。
洗涤缓冲液:25mM Tris pH 8.5,137mM NaCl,2.7mM KCl,0.1%(v/v)Tween 20。
在96孔酶标板中,每孔加入50μL(1μM)用包被缓冲液稀释的实施例2中所述多肽(负对照)及磷酸化多肽,室温震荡孵育包被2h;除去溶液后用洗涤缓冲液洗涤1次,随后每孔加入200μL含1%BSA的洗涤缓冲液,室温震荡封闭1h后,除去封闭液。抗体纯化步骤中的上样样品,流穿,洗涤及洗脱各组份,用洗涤缓冲液稀释100倍,以每孔100μL加入酶标板中,每个样品设置3组平行,室温震荡孵育45min。除去溶液后用洗涤缓冲液洗涤3次。山羊抗鼠二抗(GAM-HRP)用洗涤缓冲液稀释5000倍,按每孔100μL加入,室温震荡孵育45min,除去二抗溶液后用洗涤缓冲液洗涤3次。每孔加入Ultra TMB底物100μL,室温孵育5min之后加入50μL2N硫酸终止显色,测定样品在450nm的OD值,并作图。(图10)
实施例4:小鼠抗磷酸化精氨酸多克隆抗体的特异性表征方法
洗涤缓冲液:25mM Tris pH 8.5,137mM NaCl,2.7Mm KCl,0.1%(v/v)Tween 20
将通过固相合成获得的模型多肽pep(序列Ac-KRGGGGYIKIIKV-NH2)、磷酸化丝氨酸多肽pSer-pep(序列Ac-KpSGGGGYIKIIKV-NH2)、磷酸化苏氨酸多肽pThr-pep(序列Ac-KpTGGGGYIKIIKV-NH2)、磷酸化酪氨酸多肽pTyr-pep(序列Ac-KpYGGGGYIKIIKV-NH2)及实施例2中酶促合成的磷酸化精氨酸多肽pArg-pep(序列Ac-KpRGGGGYIKIIKV-NH2)溶解于PBS(pH=7.4),分别取0.2μL(667μM)点于硝酸纤维素膜上,自然干燥后用于随后的蛋白斑点印迹(dot-blot)分析;将干燥的硝酸纤维素膜浸泡于1%BSA的洗涤缓冲液中,室温震荡1h进行封闭后,与1∶100稀释的纯化的小鼠多抗室温震荡孵育45min,随后用洗涤缓冲液洗涤3次(3×5min)。山羊抗鼠二抗(GAM-HRP)用洗涤缓冲液稀释5000倍,加入硝酸纤维素膜,室温震荡孵育45min,除去溶液后用洗涤缓冲液洗涤3次(3×5min)。加入ECL发光底物后,用GE Amersham Imager 600化学发光模式扫描成像,结果如图12所示。
实施例5:小鼠抗磷酸化精氨酸多克隆抗体的免疫分型
包被缓冲液:0.032M Na2CO3,0.068M NaHCO3,pH 9.6。
洗涤缓冲液:25mM Tris pH 8.5,137mM NaCl,2.7Mm KCl,0.1%(v/v)Tween 20。
在96孔酶标板中,每孔加入50μL(1μM)用包被缓冲液稀释的pep(负对照)和pArg-pep,室温震荡孵育包被2h,除去溶液后用洗涤缓冲液洗涤1次。除去溶液后用洗涤缓冲液洗涤1次,随后每孔加入200μL含1%BSA的洗涤缓冲液,室温震荡封闭1h后,除去封闭液。 将免疫后获得的小鼠抗血清用洗涤缓冲液稀释100倍,以每孔100μL加入在96孔酶标板中,室温震荡孵育45min,除去溶液后用洗涤缓冲液洗涤3次。每空依次加入100μL 5000倍稀释的山羊抗小鼠分型二抗(IgG1,IgG2a,IgG2b,IgG3,IgM),室温震荡孵育45min,除去溶液后用洗涤缓冲液洗涤3次。每孔加入100μL Ultra TMB底物,室温孵育5min,之后加入50μL 2N硫酸终止液,测定样品在450nm的OD值,实验结果如图13所示。
在此实施例1中磷酰基乙脒结构式I如图3所示。
- 还没有人留言评论。精彩留言会获得点赞!