抑制嘌呤吸收的乳酸菌及其用途的制作方法
本发明涉及抑制嘌呤吸收的乳酸菌及其用途。
背景技术:
最近几年在日本,随着饮食的改变,患有痛风的患者或高尿酸血症个体的数目每年增加。高尿酸血症包括尿酸的减少的排泄或过量尿酸的产生,并且血清尿酸水平的增加经常诱发痛风,其发展成伴随剧痛的急性关节炎。当前在日本,估计患有痛风的患者的数目是一百万,并且估计高尿酸血症个体的数目是一千万。现在,主要通过饮食疗法、运动疗法和药物治疗的组合,控制血清尿酸水平预防或治疗高尿酸血症。饮食疗法中,通过限制卡路里的摄取量减少最终降解形成尿酸的膳食嘌呤的摄取量。然而,继续严格限制卡路里的摄取量不一定容易。因此,需要用于痛风或高尿酸血症的更加有效的治疗方法。对于痛风或高尿酸血症,还需要对症状的预防或缓解有效的食物产品的开发。
已经报道了在减少高尿酸血症中的血清尿酸水平中示出疗效的微生物和发酵产品(专利文献1至5)。专利文献1,例如,公开了,乳酸菌具有将嘌呤核苷降解成嘌呤碱基的高的能力。专利文献4和5,例如,公开了,乳酸菌具有降解嘌呤的能力。已经相信这些具有减少血清尿酸水平作用的常规的微生物和发酵产品,通过促进肠道中的嘌呤核苷转化成嘌呤碱基,抑制嘌呤吸收或促进嘌呤排泄,即将易于从肠道吸收的嘌呤核苷转化成从肠道吸收不良的嘌呤碱基。然而,对人类测试结果几乎没有可得的报道,并且获得具有减少血清尿酸水平作用的乳酸菌的有效的方法是未知的。
引用列表
专利文献
专利文献1:日本专利公布(Kokai)号2008-005834A
专利文献2:国际公布号WO 2011/102310
专利文献3:国际公布号WO 2004/112809
专利文献4:国际公布号WO 2008/129802
专利文献5:日本专利公布(Kokai)号2013-048636A
发明概述
技术问题
本发明的目标是提供抑制嘌呤吸收的乳酸菌及其用途。
问题解决方案
为了解决以上描述的问题,作为本发明人的深入研究的结果,他们发现,乳杆菌属(Lactobacillus)属的某些细菌物种具有将嘌呤碱基转化成嘌呤核苷酸的高能力,从而完成了本发明。
即,本发明包括以下。
[1]筛选具有将嘌呤碱基转化成嘌呤核苷酸的增强的能力的乳酸菌的方法,所述方法包括在含有腺嘌呤、5-磷酸-D-核糖-1-二磷酸和Mg2+的溶液中培养乳酸菌,以及将产生的将腺嘌呤转化成腺苷酸的活性与加氏乳杆菌(Lactobacillus gasseri)ATCC 33323菌株的活性比较作为所述能力的指标。
[2]根据以上[1]所述的方法,所述方法还包括测量5’-核苷酸酶活性,及选择与加氏乳杆菌ATCC 33323菌株相比具有降低的5’-核苷酸酶活性的乳酸菌。
[3]根据以上[1]或[2]所述的方法,其中所述乳酸菌是乳杆菌属(Lactobacillus)细菌。
[4]根据以上[1]至[3]中任一项所述的方法,其中所述溶液是缓冲溶液。
[5]用于将嘌呤碱基转化成嘌呤核苷酸的转化剂,所述转化剂包括通过根据以上[1]至[4]中任一项所述的方法可获得的乳酸菌作为活性组分。
[6]根据以上[5]所述的转化剂,其用于在将腺嘌呤转化成腺苷酸或将鸟嘌呤转化成鸟苷酸中使用。
[7]根据以上[5]或[6]所述的转化剂,其中所述乳酸菌是加氏乳杆菌OLL2959菌株(登录号:NITE BP-224)。
[8]一种食物或饮料产品或药物制剂,所述食物或饮料产品或药物制剂包含根据以上[5]至[7]中任一项所述的转化剂。
[9]根据以上[8]所述的食物或饮料产品或药物制剂,其用于在降低血清尿酸水平中使用。
[10]根据以上[9]所述的食物或饮料产品或药物制剂,其中降低血清尿酸水平包括在肠道中促进腺嘌呤到腺苷酸的转化和促进鸟嘌呤到鸟苷酸的转化。
[11]根据以上[9]或[10]所述的食物或饮料产品或药物制剂,其用于在向具有6至8mg/dL血清尿酸水平的人类受试者施用中使用。
[12]根据以上[8]至[11]中任一项所述的食物或饮料产品或药物制剂,包含每剂量1x 108至1010cfu的以上描述的乳酸菌。
[13]从嘌呤碱基产生嘌呤核苷酸的方法,包括在5-磷酸-D-核糖-1-二磷酸和Mg2+的存在下,将根据以上[5]至[7]中任一项所述的转化剂与嘌呤碱基反应。
[14]根据以上[13]所述的方法,其用于从腺嘌呤产生腺苷酸或用于从鸟嘌呤产生鸟苷酸。
发明的有益效果
通过使用根据本发明的乳酸菌或转化剂,可将嘌呤碱基有效地转化成嘌呤核苷酸,从而降低向其施用乳酸菌或转化剂的受试者中的血清尿酸水平。
本说明书包括日本专利申请号2014-134973、2014-234050和2015-064201的内容,本申请从其要求优先权。
附图简述
[图1]图1是示出用加氏乳杆菌OLL2959菌株获得的从腺嘌呤到AMP的转化率(AMP/腺嘌呤转化率)随着时间变化的图。
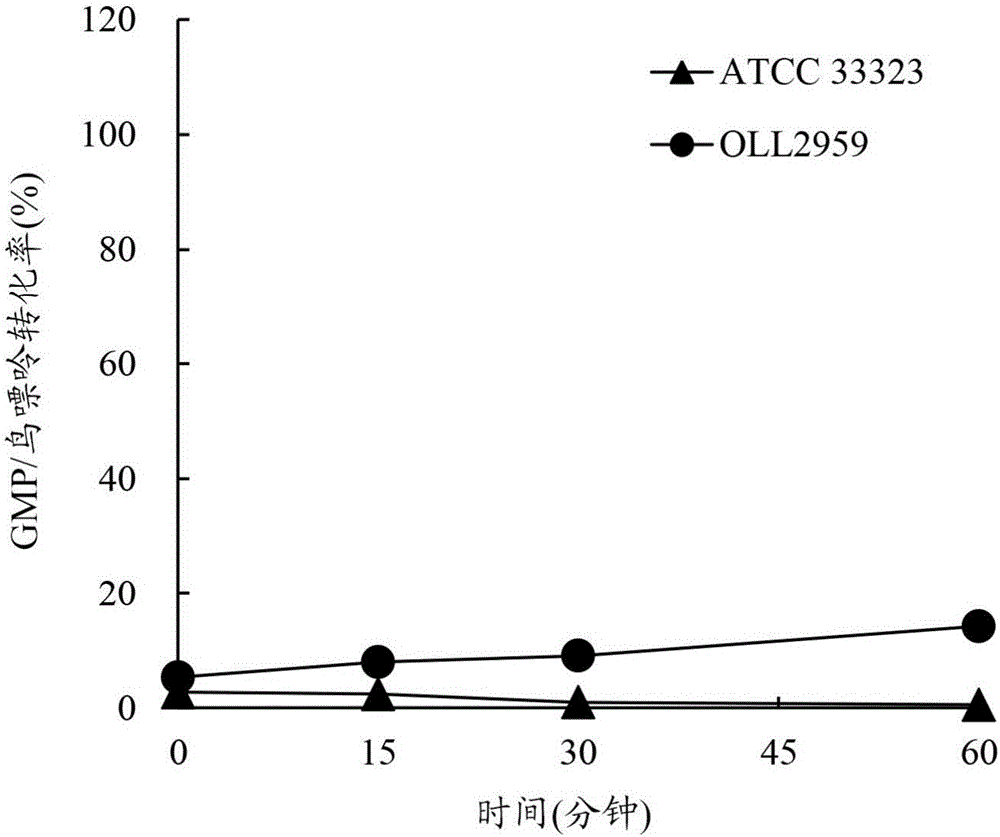
[图2]图2是示出用加氏乳杆菌OLL2959菌株获得的从鸟嘌呤到GMP的转化率(GMP/鸟嘌呤转化率)随着时间变化的图。
[图3]图3是示出加氏乳杆菌OLL2959菌株的嘌呤核苷酶活性的图。左侧柱示出从腺苷到腺嘌呤的转化率,中央柱示出从肌苷到次黄嘌呤的转化率,及右侧柱示出从鸟苷到鸟嘌呤的转化率。
[图4]图4是示出加氏乳杆菌OLL2959菌株的5'-核苷酸酶活性的图。左侧柱示出从AMP到腺苷的转化率,中央柱示出从IMP到肌苷的转化率,及右侧柱示出从GMP到鸟苷的转化率。
[图5]图5是示出连续摄取加氏乳杆菌OLL2959菌株的人类受试者中血清尿酸水平随着时间变化的图。
[图6]图6示出摄取用于研究的食物产品之后(从摄取前检查到在第8周的检查),每个受试者中血清尿酸水平的变化率。
[图7]图7是示出加氏乳杆菌OLL2959菌株的嘌呤摄取能力的图。
[图8]图8是示出在嘌呤的存在下加氏乳杆菌OLL2959菌株的增殖能力的图。
[图9]图9示出多个乳酸菌菌株的腺嘌呤摄取能力。
[图10]图10是示出在腺嘌呤的存在下多个乳酸菌菌株的增殖能力的图。
[图11]图11是示出在向其同时施用加氏乳杆菌OLL2959菌株和嘌呤的动物中加氏乳杆菌OLL2959菌株的嘌呤摄取能力的图。
[图12]图12是示出比较乳酸菌菌株的物种间的腺嘌呤摄取能力的结果的图。
[图13]图13是示出比较乳酸菌菌株的物种间在腺嘌呤的存在下乳酸菌菌株的增殖能力的结果的图。
实施方案的描述
在下文中,将详细描述本发明。
“嘌呤”共同地指具有嘌呤骨架并且被分类为嘌呤碱基、嘌呤核苷和嘌呤核苷酸的物质。嘌呤主要在活体细胞中起着多种功能,并且作为核酸的成分发挥例如传递遗传信息的作用。主要的嘌呤碱基的实例包括腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤。嘌呤核苷是其中糖与嘌呤碱基结合的化合物,并且其实例包括其中核糖与嘌呤碱基结合的腺苷、鸟苷、肌苷和黄苷;和其中脱氧核糖与嘌呤碱基结合的脱氧腺苷、脱氧鸟苷、脱氧肌苷和脱氧黄苷。嘌呤核苷酸是其中磷酸与嘌呤核苷结合的化合物,并且其实例包括腺苷酸(AMP)、鸟苷酸(GMP)、肌苷酸(IMP)和黄苷酸(XMP)。
嘌呤从食物通过肠道吸收供给身体作为饮食嘌呤,或是从氨基酸等经由从头途径从头生物合成。嘌呤还经由补救途径生物合成,通过其由嘌呤核苷酸的降解产生的嘌呤碱基被循环利用以合成嘌呤核苷酸。
在人类的情况中,嘌呤核苷酸最终代谢成尿酸。例如,腺苷酸通过5’-核苷酸酶(5’-NT)活性代谢成腺苷,且腺苷经过肌苷代谢成次黄嘌呤。次黄嘌呤通过黄嘌呤脱氢酶(XDH)和黄嘌呤氧化酶(XO)活性转化成黄嘌呤。鸟苷酸通过5’-核苷酸酶活性转化成鸟苷,并且通过嘌呤核苷磷酸化酶(PNP)活性进一步转化成鸟嘌呤。鸟嘌呤通过鸟嘌呤脱氨酶(GDA)转化成黄嘌呤。黄嘌呤通过黄嘌呤脱氢酶(XDH)和黄嘌呤氧化酶(XO)活性代谢成尿酸。在另一方面,嘌呤核苷(腺苷、肌苷、黄苷和鸟苷)通过嘌呤核苷磷酸化酶(PNP)活性分别转化成嘌呤碱基(腺嘌呤、次黄嘌呤、黄嘌呤和鸟嘌呤)。腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤通过补救酶活性(补救途径)主要被循环利用分别用于腺苷酸、鸟苷酸、肌苷酸和黄苷酸的生物合成。
乳酸菌具有与人类类似的嘌呤代谢途径;然而,所述嘌呤代谢途径与人类的代谢途径有些不同。例如,大多数乳酸菌将嘌呤核苷最终代谢成碱基。此外,在加氏乳杆菌的情况中,嘌呤核苷被嘌呤核苷酶转化成嘌呤碱基。
本发明中,使用将腺嘌呤转化成腺苷酸的活性作为能力的指标,通过选择此类乳酸菌可以获得具有将嘌呤碱基转化成为核苷酸的高能力的乳酸菌。本发明涉及筛选方法,所述筛选方法通过将作为底物的腺嘌呤与溶液中的乳酸菌接触,以及使用将通过培养其产生的溶液中的腺嘌呤转化成腺苷酸的活性作为指标,筛选具有增强的将嘌呤碱基转化成核苷酸的能力的乳酸菌。
要经历本发明的筛选方法的乳酸菌是但不特定地限于乳杆菌属细菌。乳杆菌属细菌包括加氏乳杆菌(Lactobacillus gasseri)、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.burgalicus)、德氏乳杆菌乳亚种(Lactobacillus delbrueckii subsp.lactis)、副干酪乳杆菌副干酪亚种(Lactobacillus paracasei subsp.paracasei)、嗜酸乳杆菌(Lactobacillus acidophilus)、瑞士乳杆菌(Lactobacillus helveticus)、瑞士乳杆菌约古特亚种(Lactobacillus helveticus subsp.jugurti)、卷曲乳杆菌(Lactobacillus crispatus)、噬淀粉乳杆菌(Lactobacillus amylovorus)、鸡乳杆菌(Lactobacillus gallinarum)、口乳杆菌(Lactobacillus oris)、干酪乳杆菌鼠李糖亚种(Lactobacillus casei subsp.rhamnosus)、约氏乳杆菌(Lactobacillus johnsonii)、发酵乳杆菌(Lactobacillus fermentum)、短乳杆菌(Lactobacillus brevis)、植物乳杆菌(Lactobacillus plantarum)和罗伊氏乳杆菌(Lactobacillus reuteri);并且特别优选的是加氏乳杆菌。优选地,在合适的培养基(例如,MRS培养基)中培养并且调整浓度之后,在筛选中使用乳酸菌。
本发明的筛选方法中,在含有腺嘌呤、5-磷酸-D-核糖-1-二磷酸和Mg2+的溶液中培养乳酸菌。这是因为将腺嘌呤转化成腺苷酸的反应(基于AMP的补救活性)由腺嘌呤磷酸核糖基转移酶(APRT)催化,使用腺嘌呤和在Mg2+的存在下由5-磷酸-D-核糖-1-二磷酸(PRPP,还被称作磷酸核糖基焦磷酸)形成的Mg2+-PRPP作为底物。PRPP可以通过以PRPP的任何盐(任何盐,例如,钠盐诸如5-磷酸-D-核糖-1-二磷酸五钠盐、钾盐或钙盐)形式添加进入溶液而混合入溶液。Mg2+也可以通过以其任何盐(例如,MgCl2)形式添加进入溶液而混合入溶液。用于在筛选中使用的溶液优选的是缓冲溶液,但是其可以是任何溶液,只要乳酸菌可以在该溶液中生存并且该溶液不抑制乳酸菌的酶活性。缓冲溶液的实例包括,但不限于,磷酸盐缓冲液、Tris缓冲液、Tris-HCl缓冲液和HEPES缓冲液。溶液的pH是但不特定的限于,通常优选地pH 6至8。
用于在筛选中使用的溶液(反应溶液)中的腺嘌呤、5-磷酸-D-核糖-1-二磷酸(PRPP)、Mg2+和乳酸菌的浓度可以是适合被乳酸菌用于将腺嘌呤转化成腺苷酸的反应的任何水平。例如,溶液可以含有0.1mM至1mM(优选地,0.1mM至0.3mM)的腺嘌呤、1mM至15mM(优选地,1mM至5mM)的PRPP和4mM至40mM(优选地,4mM至15mM)的Mg2+,作为反应起始时的终浓度。反应溶液还可以含有5x 108cfu/ml至5x 1010cfu/ml的乳酸菌,例如5x 109cfu/ml的乳酸菌,但是乳酸菌的浓度不限于此。以上描述的溶液可以另外含有基本不影响通过乳酸菌将腺嘌呤转化成腺苷酸的反应的任何物质。
在筛选时,优选地在含有腺嘌呤、5-磷酸-D-核糖-1-二磷酸(PRPP)和Mg2+的溶液中悬浮和培养乳酸菌。优选地通过在适合培养乳酸菌的温度通常在20至50℃,并且优选地30至40℃,例如在大约37℃孵育培养乳酸菌。例如,通过在摇动的水浴中孵育,可以合适地培养乳酸菌。将乳酸菌培养一定时间,通常持续至少15分钟或更多,优选地持续30分钟或更多,而且更优选地60分钟或更多。
将乳酸菌在以上描述的溶液中培养一定时间后,终止将腺嘌呤转化成腺苷酸的反应。优选地通过向溶液添加TFA(三氟乙酸)终止该转化反应。例如,可以将等量的5%TFA添加到溶液中。为了检查转化反应的时间进程,优选地当逐渐改变乳酸菌的培养时间的长度时终止反应。
转化反应已被终止的反应溶液中的腺嘌呤和腺苷酸随后被定量。反应溶液中的其他嘌呤(例如,嘌呤核苷)也可以被定量。可通过任何测量方法例如HPLC方法进行定量。优选地,收集和过滤反应溶液的上清液,并且使滤液经历测量用于定量确定。
例如,可以在以下的条件下进行通过HPLC方法的测量:
-流动相:A,20mM磷酸盐缓冲溶液(pH 7.5)
B,40mM磷酸盐缓冲溶液(pH 7.5)/乙腈(1:1)
-柱:SHISEIDO CAPCELL PAK C18MG2(2.0mm id x 150mm)
-流速:0.2mL/分钟
-温度:40℃
-进样体积:5μl
-检测波长:254nm(UV)
-梯度A/B(分钟):100/0(0分钟)-100/0(5分钟)-80/20(20分钟)[%]
在通过HPLC方法定量的情况中,通过测量在HPLC图中的峰下的面积,反应溶液中的腺嘌呤和腺苷酸的量可以计算为相对值。当反应终止时,每个时间点的腺嘌呤到腺苷酸(AMP)的转化率可通过以下的公式计算:
转化率(%)=(测试样品的在AMP的峰下的面积-对照样品的在AMP的峰下的面积)/测试样品的在零分钟时间点的腺嘌呤的峰下的面积-对照样品的在零分钟时间点的腺嘌呤的峰下的面积)
本文使用的“对照”以使用等量的缓冲液溶液代替添加腺嘌呤作为底物制备的溶液类似地测量。
在本发明的筛选方法中,腺嘌呤到腺苷酸(AMP)的转化率可被用作指示将腺嘌呤转化成腺苷酸的活性的值。即,在本发明的筛选方法中,不论乳酸菌是否具有将腺嘌呤转化成腺苷酸(AMP)的活性,可以使用腺嘌呤到腺苷酸(AMP)的转化率作为活性指标确定转化活性水平。例如,根据本发明,如果随着时间测量的腺嘌呤到腺苷酸(AMP)的转化率达到最大30%或更多,可以确定乳酸菌具有将腺嘌呤转化成腺苷酸(AMP)的活性。在本发明的筛选方法中,优选地选择具有随着时间测量的优选地最大40%或更多、更优选地50%或更多、还更优选地70%或更多、并且特别优选地的90%或更多的腺嘌呤到腺苷酸(AMP)的转化率的乳酸菌。在本发明的筛选方法的优选的实施方案中,到随时间测量的腺嘌呤到腺苷酸(AMP)的转化率达到最大水平(优选的平台期)的时间点,当腺嘌呤到腺苷酸(AMP)的转化率增加到高于以例如ATCC 33323菌株(即加氏乳杆菌参考菌株)获得的,例如,不少于5倍、优选的不少于7倍、更优选的不少于10倍、还更优选的不少于13倍、和特别优选的不少于20倍时,由于具有显著增强的将腺嘌呤转化成腺苷酸的能力,乳酸菌可以被确定为具有“增强的将嘌呤碱基转化成嘌呤核苷酸的能力”。
如此选择的乳酸菌不仅可以具有高的将腺嘌呤转化成腺苷酸的能力(基于AMP的补救活性),而且具有高的通过补救活性将其他嘌呤碱基转化成嘌呤核苷酸的能力。具体地,乳酸菌可以具有增强的将鸟嘌呤转化成鸟苷酸的能力。因此,选择为具有增强的将腺嘌呤转化成腺苷酸的能力的乳酸菌,被类似地检查将其他嘌呤碱基转化成嘌呤核苷酸的活性也是优选的。具体地,可以在含有鸟嘌呤、5-磷酸-D-核糖-1-二磷酸和Mg2+的溶液中培养乳酸菌,并且使用如此产生的将鸟嘌呤转化成鸟苷酸的能力作为指标,检查其将鸟嘌呤转化成鸟苷酸的能力是否已增强。可以用与以上对腺嘌呤到腺苷酸的转化描述的相同的方式进行将鸟嘌呤转化成鸟苷酸的活性的测量和转化率的计算,除了使用鸟嘌呤代替腺嘌呤和使用鸟苷酸代替腺苷酸。本发明中,到随时间测量的鸟嘌呤到鸟苷酸(GMP)的转化率达到最大水平(优选的平台期)的时间点,当鸟嘌呤到鸟苷酸(GMP)的转化率增加到高于以例如ATCC 33323菌株(即加氏乳杆菌参考菌株)获得的,例如不少于5倍、优选的不少于7倍、更优选的不少于10倍、还更优选的不少于13倍、和特别优选的不少于20倍时,乳酸菌同样可以被确定为具有显著增强的将鸟嘌呤转化成鸟苷酸的能力。
本发明中,可以用该方式筛选具有增强的将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌。通过本发明的筛选方法可获得的乳酸菌具有高的将嘌呤碱基转化成嘌呤核苷酸的能力,特别是,高的将腺嘌呤转化成腺苷酸的能力,和高的将鸟嘌呤转化成鸟苷酸的能力。
通过本发明的筛选方法可获得的乳酸菌优选地具有比将嘌呤核苷酸降解成嘌呤核苷的活性高的将嘌呤碱基转化成嘌呤核苷酸的活性(补救活性)。因此,本发明的筛选方法可还包括以下的步骤:测量将作为底物的嘌呤核苷酸降解成嘌呤核苷的活性和选择呈现活性减少的乳酸菌。具体地,可以使用嘌呤核苷酸(例如,腺苷酸)作为底物测量乳酸菌中催化嘌呤核苷酸降解成嘌呤核苷的5’-核苷酸酶(5’-NT)活性。
可通过常规方法测量乳酸菌的5’-核苷酸酶(5’-NT)活性。例如,在含有嘌呤核苷酸(例如,腺苷酸)和Mg2+的溶液中培养乳酸菌。Mg2+可以通过以其任何盐(例如,MgCl2)形式添加进入溶液而混合入溶液。用于在筛选中使用的溶液优选的是缓冲溶液,但是其可以是任何溶液,只要乳酸菌可以在该溶液中生存并且该溶液不抑制乳酸菌的酶活性。缓冲溶液的实例包括,但不限于,磷酸盐缓冲液、Tris缓冲液、Tris-HCl缓冲液和HEPES缓冲液。溶液的pH是但不特定的限于,通常优选地pH 6至8。优选地使用是加氏乳杆菌参考菌株的ATCC 33323菌株作为对照。
反应溶液中嘌呤核苷酸、Mg2+和乳酸菌的浓度可以是任何适合通过ATCC 33323菌株将嘌呤核苷酸转化成嘌呤核苷的反应的水平。例如,反应溶液可以含有0.1mM至1mM(优选地,0.1mM至0.3mM)的嘌呤核苷酸和4mM至40mM(优选地,4mM至15mM)的Mg2+作为反应起始时的终浓度。反应溶液还可以含有5x 108cfu/ml至5x 1010cfu/ml的乳酸菌,例如5x 109cfu/ml的乳酸菌,但是乳酸菌的浓度不特定的限于此。以上描述的溶液可以另外含有基本不影响通过乳酸菌将嘌呤核苷酸转化成嘌呤核苷的反应的任何物质。用于乳酸菌的培养条件可以是与在以上描述的将腺嘌呤转化成腺苷酸的测试中的那些相同的条件。
将嘌呤核苷酸转化成嘌呤核苷的活性(即,5’-核苷酸酶活性)的测量和转化率的计算可以用与以上描述的用于腺嘌呤到腺苷酸的转化率的测试相同的方式进行,除了使用嘌呤核苷酸(例如,腺苷酸)代替腺嘌呤和使用嘌呤核苷(例如,腺苷,当使用腺苷酸作为底物时)代替腺苷酸。反应时间是,但不特定地限于,优选地设为长于用于将腺嘌呤转化成腺苷酸的反应时间(例如,120分钟)。本发明中,当嘌呤核苷酸到嘌呤核苷的转化率(作为优选的实例,腺苷酸到腺苷的转化率)降低到用例如ATCC 33323菌株(即加氏乳杆菌参考菌株)获得的例如不超过1/5、优选地不超过1/7、更优选地不超过1/10、还更优选地不超过1/13、和特别优选地不超过1/20,可以确定乳酸菌具有显著地降低的5'-核苷酸酶活性。在具有显著地降低的5’-核苷酸酶活性的乳酸菌中,嘌呤碱基到嘌呤核苷酸的转化比嘌呤核苷酸到嘌呤核苷的转化更占优势。这进一步导致哺乳动物体内从肠道吸收以促进尿酸产生的嘌呤核苷的降低。
本发明还提供了用于将嘌呤碱基转化成嘌呤核苷酸的转化剂,其包含乳酸菌作为活性组分,所述乳酸菌可通过以上描述的筛选方法获得,并且具有高的将嘌呤碱基转化成嘌呤核苷酸的能力。该转化剂还优选地例如用于将腺嘌呤转化成腺苷酸或用于将鸟嘌呤转化成鸟苷酸。使用该转化剂,作为底物的嘌呤碱基在体内或体外反应系统可被有效地转化成嘌呤核苷酸。
具有高的将嘌呤碱基转化成嘌呤核苷酸的能力和具有如以上描述的降低的5’-核苷酸酶活性的乳酸菌的优选的实例包括加氏乳杆菌OLL2959菌株。加氏乳杆菌OLL2959菌株是同型乳酸发酵的,并且缺少产气能力。加氏乳杆菌OLL2959菌株于2006年3月31日(原始保藏日期)以登录号NITE P-224保藏在国家技术评估学会,专利微生物保藏中心(NPMD)(#122,2-5-8Kazusakamatari,Kisarazu-shi,Chiba 292-0818,日本),并且随后以登录号NITE BP-224(原始的登录号改变)于2007年11月21日被转移到布达佩斯条约规定的保藏处(国际保藏处)。
加氏乳杆菌OLL2959菌株具有高的将嘌呤碱基转化成嘌呤核苷酸的能力(补救能力),同时具有低的将嘌呤核苷酸转化成嘌呤核苷的能力。因此认为,当向人类施用加氏乳杆菌OLL2959菌株时,嘌呤核苷酸通过微生物从嘌呤的再循环比通过人类的嘌呤碱基或嘌呤核苷的吸收/代谢占优势,这有助于减少尿酸产生量。
本发明还提供了包含以上描述的用于将嘌呤碱基转化成嘌呤核苷酸的转化剂的食物或饮料产品或药物制剂。本发明的转化剂可以是含有本发明的具有将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌的细胞的药物或组合物;或转化剂可以是用乳酸菌制备的发酵产品或培养物,或其浓缩物,或含有所述发酵产品或培养物或其浓缩物的药物或组合物。被包含在本发明的转化剂中的根据本发明的乳酸菌可以是被杀死的细胞或处理的细胞,只要其示出其酶活性,但优选地是活细胞。本发明的转化剂能够赋予食物或饮料产品或药物制剂在活体中(通常在肠道中)将嘌呤碱基转化成嘌呤核苷酸的活性。含有本发明的转化剂的食物或饮料产品或药物制剂通过乳酸菌和其酶活性,可以促进嘌呤碱基到嘌呤核苷酸的转化,例如在施用食物或饮料产品或药物制剂的受试者的肠道中,促进腺嘌呤到腺苷酸的转化和促进鸟嘌呤到鸟苷酸的转化,从而有效地降低血清尿酸水平。即,本发明的食物或饮料产品或药物制剂可以用于在降低血清尿酸水平中使用,伴随促进腺嘌呤到腺苷酸的转化和促进鸟嘌呤到鸟苷酸的转化。含有本发明的转化剂的食物或饮料产品或药物制剂可以优选地用于,例如,用于在预防、治疗、或改善痛风或高尿酸血症、或缓解痛风或高尿酸血症的症状中使用。
如本文使用的,“食物或饮料产品”包括但不特定地限于饮料、食物产品和功能性食品。含有本发明的转化剂的食物或饮料产品的类型不受特定限制。含有本发明的转化剂的饮料的实例包括饮料诸如发酵牛奶(酸奶饮料等)、乳酸菌饮料、牛奶饮料(咖啡口味的牛奶、水果口味的牛奶等)、基于茶的饮料(绿茶、红茶、乌龙茶等)、基于水果/蔬菜的饮料(含有水果汁诸如桔子、苹果、或葡萄,或蔬菜汁诸如西红柿或胡萝卜的饮料)、酒精饮料(啤酒、发泡酒(low-malt beer)、葡萄酒等)、碳酸饮料、软饮料和基于水的饮料。优选的饮料的实例包括酸奶饮料、乳酸菌饮料、牛奶饮料和基于水的饮料,并且特别优选的饮料的实例包括酸奶饮料。对于多种饮料的生产方法等,现有的手册诸如“Latest Soft Drinks”(2003)(Korin Corporation)例如可以提供参考。食物产品的实例包括发酵牛奶(凝固型酸奶、软酸奶、奶酪等)、乳制品、糕点糖果和即食食品。优选的食物产品的实例包括酸奶诸如凝固型酸奶或软酸奶、糕点糖果和奶酪,并且特别优选的食物产品的实例包括酸奶,例如凝固型酸奶或软酸奶。对于多种食物产品的生产方法等,现有的手册可以提供参考。
含有具有将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌的发酵牛奶诸如酸奶,还可以通过例如,添加本发明的具有将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌,到使用发酵剂(starter)产生的乳制品或发酵牛奶中生产,所述发酵剂可含有可能具有或可能不具有将嘌呤碱基转化成嘌呤核苷酸的能力的其他微生物诸如乳酸菌。可选地,使用通过混合以上描述的发酵剂和本发明的具有将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌获得的发酵剂,可以生产乳制品或发酵牛奶。可根据常规方法生产使用发酵剂的乳制品或发酵牛奶。例如,可以通过例如将发酵剂混合进入加热、混合、均化和巴氏消毒法处理后冷却的牛奶或乳制品,以及随后的发酵和将其冷却生产原味酸奶。本发明优选地提供本发明的具有高的将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌在生产乳制品或发酵牛奶诸如酸奶或奶酪中的用途(其优选地包括添加(混合)乳酸菌到乳制品或发酵牛奶、或其原材料),并且特别优选地提供乳酸菌在酸奶生产中的用途。此外,本发明优选地提供增强乳制品或发酵牛奶诸如酸奶或奶酪将嘌呤碱基转化成嘌呤核苷酸的能力的方法,所述方法使用本发明的具有高的将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌作为活性组分。本发明特别优选地提供增强酸奶中将嘌呤碱基转化成嘌呤核苷酸的能力的方法。
功能性食品作为含有本发明的转化剂的食物或饮料产品是特别优选的。本发明的“功能性食品”指对身体具有某些功能的食物并且涵盖通常所谓的健康食品,例如,具有健康要求的食物,包括用于指定的健康用途的食物(包括用于指定的健康用途的合格的食物)和具有营养功能要求的食物、具有功能要求的食物、用于指定膳食用途的食物、营养补充品、健康补充品、补充品(例如,呈多种剂型诸如片剂、包衣片剂、糖衣片剂、胶囊和液体)和用于美容的食物(例如,减肥食品)。本发明的功能性食品还涵盖健康食品,对其适用基于通过法规(FAO/WHO联合食品法规委员会)的食物标准的健康要求。
作为本发明的功能性食品的更具体地优选的实例包括用于指定的膳食用途的食品,诸如用于病人的食品、用于孕妇和泌乳母亲的奶粉、用于婴儿的改良的奶粉、用于老年人的食品和护理食品。
本发明的功能性食品对于降低血清尿酸水平有用。本发明的功能性食品可优选地用于降低血清尿酸水平,特别是用于伴随促进嘌呤碱基到嘌呤核苷酸的转化,降低血清尿酸水平。本发明的功能性食品可以优选地用于例如伴随促进腺嘌呤到腺苷酸的转化和促进鸟嘌呤到鸟苷酸的转化,降低血清尿酸水平。
本发明的食物或饮料产品诸如功能性食品(在日本,优选地用于指定的健康用途的食物或用于指定的健康用途的合格食物)可用于在降低血清尿酸水平或抑制或缓解血清尿酸水平的增加中使用,并且可包括说明书或其指示。本发明优选地提供本发明的具有高的将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌在生产功能性食品中的用途(其优选地包括添加(混合)乳酸菌到功能性食品或其原材料),并且特别优选地提供乳酸菌在生产用于指定健康用途的食物中的用途。此外,本发明优选地提供增强功能性食品的将嘌呤碱基转化成嘌呤核苷酸的能力的方法,所述方法使用本发明的具有高的将嘌呤碱基转化成嘌呤核苷酸的能力的乳酸菌作为活性组分。本发明特别优选地提供增强用于指定的健康用途的食物将嘌呤碱基转化成嘌呤核苷酸的能力的方法。
本发明的功能性食品可以是固体制剂诸如片剂、颗粒剂、粉末、药丸和胶囊,液体制剂诸如液体、悬浮液和糖浆、凝胶或糊剂,或可以呈通常的食物或饮料产品的形式(例如,饮料、酸奶和糕点糖果)。
本发明的食物或饮料产品可含有不特别限定的任何食物组分。本发明的食物或饮料产品除了本发明的乳酸菌或转化剂之外,可含有水、蛋白质、糖类、脂类、维生素、矿物质、有机酸、有机碱、果汁、香料等。蛋白的实例包括动物和植物性蛋白诸如全脂奶粉、脱脂奶粉、部分脱脂奶粉、酪蛋白、乳清粉、乳清蛋白、乳清浓缩蛋白、乳清分离蛋白、α-酪蛋白、β-酪蛋白、κ-酪蛋白、β-乳球蛋白、α-乳白蛋白、乳铁蛋白、大豆蛋白、鸡蛋的蛋白质、和肉类蛋白质和其水解产物;和多种牛奶来源的组分诸如黄油、乳清矿物质(whey mineral)、奶油、乳清、非蛋白氮、唾液酸、磷脂和乳糖。糖类的实例包括一般的糖类、改性淀粉(糊精、可溶性淀粉、英国淀粉、氧化淀粉、淀粉酯、淀粉醚等)和膳食纤维。脂类的实例包括动物脂肪和油如猪油和鱼油、以及分馏油、氢化油、和其交酯化油(interesterified oil);植物性脂肪和油诸如棕榈油、红花油、玉米油、菜籽油、和椰子油、以及分馏油、氢化油、和其交酯化油。维生素的实例包括维生素A、胡萝卜素、维生素B族、维生素C、维生素D族、维生素E、维生素K族、维生素P、维生素Q、烟酸(niacin)、烟酸(nicotinic acid)、泛酸、生物素、肌醇、胆碱和叶酸;和矿物质的实例包括钙、钾、镁、钠、铜、铁、锰、锌、硒、和乳清矿物质。有机酸的实例包括苹果酸、柠檬酸、乳酸和酒石酸。这些组分可以单独或以两种或更多种的组合使用,并且可使用含有大量的这些组分的合成的产品和/或食物产品被添加。
含有本发明的转化剂的药物制剂(药物组合物)除了本发明的乳酸菌或转化剂之外,可含有药学上可接受的载体或添加剂。可用的载体的实例包括水、药学上可接受的有机溶剂、胶原、聚乙烯醇、聚乙烯吡咯烷酮、聚羧乙烯、精氨酸钠、水溶性右旋糖酐、水溶性糊精、羧甲基淀粉钠、果胶、黄原胶、阿拉伯胶、酪蛋白、明胶、琼脂、甘油、丙二醇、聚乙二醇、凡士林、石蜡、硬脂醇、硬脂酸、人血清白蛋白、甘露醇、山梨醇、乳糖、药学上可接受的表面活性剂和人工细胞结构诸如脂质体。添加剂的实例包括粘结剂、赋形剂、润滑剂、崩解剂、润湿剂、稳定剂、缓冲剂、调味剂、防腐剂和着色剂。根据制剂的剂型,可以适当地或组合地选择载体或添加剂。本发明的药物制剂可另外含有其他药物组分。
本发明的药物制剂优选地口服施用。本发明的药物制剂可采取任何剂型,例如,固体制剂诸如片剂、颗粒剂、粉末、丸剂、或胶囊、凝胶、或液体制剂诸如液体、悬浮液或糖浆。
本发明的食物或饮料产品或药物制剂的剂量不特别限定,并且可以在熟练的技术人员的自由裁量的宽的范围上改变,考虑到用于施用的受试者的年龄和体重、施用途径、剂量数等等。例如,本发明的食物或饮料产品或药物制剂优选地以每剂量1x 105到1x 1011cfu、更优选地1x 108到1x1010cfu、和还更优选地1x 109到1x 1010cfu,和例如优选地4x 109到6x1010cfu的本发明的乳酸菌的量施用。本发明的食物或饮料产品或药物制剂优选地含有每剂量这样的量的本发明的乳酸菌。本发明的食物或饮料产品或药物制剂优选地一天一次或一天更多次向受试者施用,优选地一天两次或更多次,且通常一天两次。本发明的食物或饮料产品或药物制剂优选地持续施用,并且更优选地例如每天施用。本发明的食物或饮料产品或药物制剂优选地施用持续至少一周,并且优选地持续2周或更多,例如持续4周或更多。本发明的食物或饮料产品或药物制剂优选地口服施用。本发明中,“施用”包括“摄取”食物或饮料产品及“施用”药物制剂。本发明中,“口服施用”还包括通过鼻管、胃管等经由管饲的施用。
施用本发明的食物或饮料产品或药物制剂的受试者是哺乳动物,包括人类、家畜、宠物和实验室(实验)动物。特别是,受试者优选地是人类受试者,更优选地患有痛风和/或高尿酸血症的人类受试者,和还更优选地,但不限于具有6mg/dL或更多,例如6至10mg/dL的血清尿酸水平的人类受试者。在一个实施方案中,受试者优选地是具有6至8mg/dL的血清尿酸水平的患有轻微到边缘高尿酸血症的人类受试者。在另一个实施方案中,受试者优选地是具有7mg/dL或更多的血清尿酸水平,并且优选的7至11mg/dL(在一个实例中,在7.6mg/dL和9.5mg/dL之间)的人类受试者,并且在以上之中,受试者更优选地是经受高尿酸血症和痛风的人类受试者。此外,示出血清尿酸水平和在测量血清尿酸水平之前从食物摄取的嘌呤的量(例如,持续3天摄取的嘌呤的总量)间的关联性的受试者更优选地作为施用(喂食)的受试者。本发明的食物或饮料产品或药物制剂适合向其中将嘌呤碱基转化成嘌呤核苷酸的活性(补救活性)已经降低的受试者施用,所述将嘌呤碱基转化成嘌呤核苷酸的活性例如,将腺嘌呤转化成腺苷酸的活性,并且特别是发挥将腺嘌呤转化成腺苷酸作用的腺嘌呤磷酸核糖基转移酶活性。
本发明还提供从嘌呤碱基产生嘌呤核苷酸的方法,通过在5-磷酸-D-核糖-1-二磷酸和Mg2+的存在下,将本发明的转化剂与嘌呤碱基反应。方法可在体内或体外实施。在体内实施的情况中,使用本发明的转化剂的方法可以使用含有本发明的转化剂的食物或饮料产品,并且可以不包括医疗实践。在体外实施的情况中,本发明的方法是使用溶液中的嘌呤碱基作为底物合成(产生)嘌呤核苷酸的方法。具体地,本发明的方法还优选地是从腺嘌呤产生腺苷酸的方法。本发明的方法可以是从鸟嘌呤产生鸟苷酸的方法。在5-磷酸-D-核糖-1-二磷酸和Mg2+的存在下,通过乳酸菌的嘌呤碱基的转化,可以以与以上描述的针对腺嘌呤到腺苷酸的转化率的测试相同的方式进行。
此外,本发明人发现,乳酸菌的一些物种诸如加氏乳杆菌,例如加氏乳杆菌OLL2959菌株在嘌呤的存在下具有嘌呤摄取能力和高的增殖能力,并且在嘌呤的存在下,在嘌呤摄取能力和增殖能力间存在关联,并且还发现,施用(摄取)此类乳酸菌抑制嘌呤吸收,因此有助于血清中尿酸水平的降低。基于该发现,乳酸菌的嘌呤捕获作用还可以被用于降低血清尿酸水平。
本发明因此通过使用摄取嘌呤进入细胞的能力作为指标选择(筛选)乳酸菌,使得能够有效地获得(选择)具有嘌呤捕获作用的乳酸菌。提供了筛选乳酸菌的方法,包括测量含有嘌呤的培养基中被乳酸菌摄取的嘌呤的量,和使用摄取的嘌呤的量作为指标,获得(选择)具有嘌呤捕获作用的乳酸菌。更具体地,根据本发明,可以通过以下筛选乳酸菌:在含有嘌呤的培养基中培养乳酸菌,优选地随着时间,测量摄取的嘌呤进入细胞的量,和使用摄取的嘌呤的量作为指标,获得(选择)具有嘌呤捕获作用的乳酸菌。如此获得的具有嘌呤捕获作用的乳酸菌很可能具有降低血清尿酸水平的作用。在本文,乳酸菌具有大量摄取的嘌呤的事实,即,乳酸菌的细胞具有嘌呤捕获作用,意味着,活体中特别是肠道中的嘌呤被乳酸菌大量捕获,并且从肠道中的环境移除,因此导致抑制嘌呤从肠道吸收。已知乳酸菌被排泄而不从胃肠道被吸收,并且因此,被乳酸菌捕获的从肠道吸收逃脱的嘌呤将与乳酸菌一起被排出身体。根据本发明,因此,筛选具有降低血清尿酸水平的作用的乳酸菌可以通过如下进行:在含有嘌呤的培养基中培养乳酸菌,测量摄取的嘌呤进入细胞的量,使用摄取的嘌呤的量作为指标,选择具有嘌呤捕获作用的乳酸菌,和获得(选择)获得的具有嘌呤捕获作用的乳酸菌作为具有降低血清尿酸水平的作用的乳酸菌。
本发明中,具有嘌呤摄取能力的乳酸菌在嘌呤的存在下示出高度增殖能力,该能力与高的嘌呤摄取能力相关联。本发明中,因此,除了以上描述的使用嘌呤摄取能力作为指标选择之外,可以在嘌呤的存在下检查选择的乳酸菌的增殖能力的增强,并且增殖能力的增强可用作指标,从而使得能够更准确地获得(选择)具有嘌呤捕获作用的乳酸菌。即,根据本发明,可以通过以下筛选乳酸菌:在含有嘌呤的培养基中测量具有嘌呤摄取能力的乳酸菌的增殖的量,和使用增殖的量与如以上描述的测量的嘌呤的摄取量一起作为指标,获得(选择)具有嘌呤捕获作用的乳酸菌。此外,根据本发明,筛选具有降低血清尿酸水平的作用的乳酸菌可以通过如下进行:在含有嘌呤的培养基中培养乳酸菌,测量细菌细胞随着时间增殖的量,使用增殖的量与如以上描述的测量的嘌呤的摄取量一起作为指标,选择具有嘌呤捕获作用的乳酸菌,和获得(选择)获得的具有嘌呤捕获作用的乳酸菌作为具有降低血清尿酸水平的作用的乳酸菌。然而,在该方法中,可以进行或可以不进行在嘌呤的存在下增殖量的测量和使用增殖的量作为指标的选择。
尽管要经历本发明的筛选方法的乳酸菌是不特定地限定的,它们优选地是乳杆菌属细菌。乳杆菌属细菌的实例与以上阐明的那些相同,并且加氏乳杆菌细菌是特别优选的。在合适的培养基(例如,MRS培养基)中培养并且调整其浓度之后,筛选中优选地使用要经历本发明的筛选方法的乳酸菌的任何菌株。尽管筛选中使用的培养基是允许加氏乳杆菌细菌增殖的任何培养基,其优选地是已用嘌呤补充的或其中的一些组分已用嘌呤替换的基本培养基或基于基本培养基的培养基。表5示出了特别优选的基本培养基的实例。
尽管要经历本发明的筛选方法的乳酸菌不受特定限定,它们优选地是乳杆菌属细菌。乳杆菌属细菌的实例与以上阐明的那些相同,并且加氏乳杆菌细菌是特别优选的。在合适的培养基(例如,MRS培养基)中培养并且调整其浓度之后,筛选中优选地使用这些乳酸菌的任何菌株。尽管筛选中使用的培养基是允许使用的乳酸菌(例如,加氏乳杆菌细菌)增殖的任何培养基,其优选的是已用嘌呤补充的或其中的一些组分已用嘌呤替换的基本培养基或基于基本培养基的培养基。表5示出了特别优选的基本培养基的实例。
要掺入培养基的嘌呤可以是嘌呤碱基、嘌呤核苷、和/或嘌呤核苷酸。嘌呤碱基的实例包括但不限于腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤,并且腺嘌呤是特别优选的。嘌呤核苷的实例包括但不限于腺苷、鸟苷、肌苷和黄苷,并且腺苷是特别优选的。嘌呤核苷酸的实例包括但不限于腺苷酸(AMP)、鸟苷酸(GMP)、肌苷酸(IMP)和黄苷酸(XMP),并且腺苷酸是特别优选的。嘌呤可用放射性同位素标记。
为了测量被乳酸菌摄取的嘌呤的量,可以优选地使用其中被能够定量检测的标记物质标记的嘌呤,例如,用放射性同位素或荧光物质标记的嘌呤作为培养基中含有的嘌呤的一些或全部的培养基。例如,优选的放射性同位素是14C。被乳酸菌摄取的嘌呤的量可被通过以下测量或评价:例如,在含有嘌呤的培养基中培养乳酸菌,培养一段时间之后通过添加TFA(三氟乙酸)或类似物终止反应,在培养的细胞中基于标记物质的活性的检测定量标记的嘌呤,和将其与细胞在培养起始时的活性比较。如果乳酸菌的嘌呤的摄取量相比于在培养起始时显著地增加,可以确定乳酸菌具有摄取嘌呤进入细胞的能力(嘌呤摄取能力)。本发明中,可以获得(选择)如此确定的具有嘌呤摄取能力的乳酸菌作为具有嘌呤捕获作用的乳酸菌。选作具有嘌呤捕获作用的乳酸菌的乳酸菌然后可被获得(选择)作为具有降低血清尿酸水平的作用的乳酸菌,或其候选物。乳酸菌的培养时期优选地持续直到生长曲线的延滞期或对数期中的任何时间点。例如,可以培养乳酸菌直到从培养起始之后的30分钟和60分钟,然后可以测量嘌呤摄取能力等。在该测量中,通常,可以使用液体闪烁计数器测量放射性同位素标记的嘌呤的放射性。
通过以下可以测量或确定在嘌呤的存在下乳酸菌的增殖的量:例如,在含有嘌呤的培养基中培养乳酸菌,测量在培养的起始和培养持续一段时间之后的培养基的浊度(通常在650nm的吸光度),以及计算二者间的差别。如果培养在嘌呤的存在下的培养基的浊度增加的水平相比于培养在不存在嘌呤下的培养基的浊度增加的水平显著增加,可以确定培养中使用的乳酸菌在嘌呤的存在下示出增强的增殖能力。乳酸菌具有嘌呤摄取能力并且在嘌呤的存在下示出增强的增殖能力的事实意味着,乳酸菌能够高度同化嘌呤。即,这支持乳酸菌能够高度捕获嘌呤,并且因此支持乳酸菌具有降低血清尿酸水平的作用的可能性。乳酸菌的培养时期优选地持续直到生长曲线的对数期中的任何时间点。例如,可以培养乳酸菌直到从培养起始之后的4小时和6小时,并且例如可以测量其在嘌呤的存在下的增殖能力。
在以上描述的测量中,优选地,以0.8x 107至3x 107cfu每1mL培养基接种和培养乳酸菌。尽管乳酸菌的培养条件不特别限定,优选地在30至39℃、优选地36至38℃厌氧地培养乳酸菌。
本发明中,如以上描述的选择的乳酸菌对于其是否具有降低血清尿酸水平的作用被进一步测试也是优选的,例如,根据在下面描述的实施例中描述的方法。例如,可以通过以下确定如以上描述的选择的乳酸菌是否具有降低血清尿酸水平的作用:向受试者以单剂量或多剂量施用如此选择的乳酸菌,测量血清尿酸水平,和检查血清尿酸水平中存在或不存在变化(血清尿酸水平的降低)。
如以上描述的选择的乳酸菌具有嘌呤摄取能力,并且优选地在嘌呤的存在下的高的增殖能力,和,即,具有高的嘌呤捕获作用。此类乳酸菌通常具有降低血清尿酸水平的作用。如以上描述的选择的乳酸菌在活体中(通常在肠道中)的嘌呤的存在下,可以发挥嘌呤摄取能力和高的增殖能力(即,高的同化嘌呤的能力),和随后捕获和降低活体中(通常在肠道中)的大量的嘌呤,以及减少嘌呤吸收的量,从而降低血清尿酸水平。
此外,使用可以通过以上描述的筛选方法获得的具有嘌呤捕获作用的乳酸菌,可以提供用于捕获嘌呤的剂,和优选地用于捕获嘌呤的用于在口服施用中使用的剂,包括乳酸菌作为活性组分。用于捕获嘌呤的剂除了具有嘌呤捕获作用的乳酸菌(优选地是加氏乳杆菌细菌)之外,可以含有口服施用可接受的载体或添加剂。用于捕获嘌呤的剂可以是含有具有嘌呤捕获作用的乳酸菌的细胞的药物或组合物,或用于捕获嘌呤的剂可以是发酵产品或使用细菌产生的培养物,或其浓缩物或干产品,或含有发酵产品或使用细菌产生的培养物或其浓缩物或干产品的药物或组合物。用于捕获嘌呤的剂中含有的具有嘌呤捕获作用的乳酸菌优选地是活细胞。如以上描述的,用于捕获嘌呤的剂通过乳酸菌对嘌呤的摄取,具有降低肠道中的嘌呤的作用,并且因此可以优选地用于降低肠道中的嘌呤,并且因此用于降低血清尿酸水平。
如以上描述的具有嘌呤捕获作用的乳酸菌的优选的实例,包括但不限于,加氏乳杆菌细菌诸如加氏乳杆菌OLL2959菌株和加氏乳杆菌P14054ME002菌株。加氏乳杆菌OLL2959菌株是同型乳酸发酵的,并且缺少产气能力。加氏乳杆菌OLL2959菌株于2006年3月31日(原始保藏日期)以登录号NITE P-224保藏在国家技术评估学会,专利微生物保藏中心(NPMD)(#122,2-5-8Kazusakamatari,Kisarazu-shi,Chiba 292-0818,Japan),并且随后以登录号NITE BP-224(原始的登录号改变)于2007年11月21日被转移到布达佩斯条约规定的保藏处(国际保藏处)。
用于捕获嘌呤的剂还可以与食物或饮料产品或药物制剂组合使用。因此,还提供了用于与食物或饮料产品或药物制剂组合使用的用于捕获嘌呤的剂。
使用以上描述的用于捕获嘌呤的剂,还可以提供包含以上描述的用于捕获嘌呤的食物或饮料产品或药物制剂。该食物或饮料产品或药物制剂通过在施用其的(或摄取其的)受试者中使嘌呤主动摄取进入细胞及使其同化,提供肠道中嘌呤的减少和血清尿酸水平的有效减少。因此,食物和饮料产品和药物制剂可以用于在降低肠道中的嘌呤中使用。本文的“肠道中的嘌呤”不包括被存在于肠道中的细菌(例如,乳酸菌)、真菌、病毒、受试者的细胞等等携带的嘌呤。食物和饮料产品和药物制剂还可以基于肠道中的嘌呤的减少,用于在降低血清尿酸水平中使用。含有用于捕获嘌呤的剂的食物或饮料产品或药物制剂可以优选地用于,例如,预防、治疗、改善或缓解痛风或高尿酸血症的症状。
本文的“食物或饮料产品”包括但不特别地限于饮料、食物产品和功能性食品。食物或饮料产品的类型不特别限定,并且饮料的实例包括发酵牛奶(酸奶饮料等)、乳酸菌饮料、牛奶饮料(咖啡口味的牛奶、水果口味的牛奶等)、基于茶的饮料(绿茶、红茶、乌龙茶等)、基于水果/蔬菜的饮料(含有水果汁诸如桔子、苹果、或葡萄,或蔬菜汁诸如西红柿或胡萝卜的饮料)、酒精饮料(啤酒、发泡酒、葡萄酒等)、碳酸饮料、软饮料和基于水的饮料。优选的饮料的实例包括酸奶饮料、乳酸菌饮料、牛奶饮料和基于水的饮料,并且特别优选的饮料的实例包括酸奶饮料。对于多种饮料的生产方法等,现有的手册诸如“Latest Soft Drinks”(2003)(Korin Corporation)例如可以提供参考。食物产品的实例包括发酵牛奶(凝固型酸奶、软酸奶、奶酪等)、乳制品、糕点糖果和即食食品。优选的食物产品的实例包括酸奶诸如凝固型酸奶或软酸奶、糕点糖果和奶酪,并且特别优选的饮料的实例包括酸奶,例如凝固型酸奶或软酸奶。对于多种食物产品的生产方法等,现有的手册可以提供参考。
含有具有嘌呤捕获作用的乳酸菌的发酵牛奶诸如酸奶,还可以通过例如,添加具有嘌呤捕获作用的乳酸菌,到使用发酵剂产生的乳制品或发酵牛奶中生产,所述发酵剂可含有可能具有或可能不具有嘌呤捕获作用的其他微生物诸如乳酸菌。可根据常规方法生产使用发酵剂的乳制品或发酵牛奶。例如,可以通过将发酵剂混合进入在加热、混合、均化和巴氏消毒法处理后冷却的牛奶或乳制品,以及随后的发酵和将其冷却生产酸奶。在优选的方面,提供了具有嘌呤捕获作用的乳酸菌在生产乳制品或发酵牛奶诸如酸奶或奶酪中的用途(其优选地包括添加(混合)乳酸菌到乳制品或发酵牛奶、或其原材料)。在特别优选的发明中,提供了乳酸菌在生产酸奶中的用途。此外,还提供了在发酵牛奶或乳制品诸如酸奶或奶酪中基于乳酸菌的嘌呤捕获作用降低嘌呤的方法,该方法使用具有嘌呤捕获作用的乳酸菌作为活性组分。
功能性食品特别优选地作为食物或饮料产品。功能性食品的类型、优选的实例等与对与以上描述的其中使用以上提到的转化剂的食物或饮料产品关联的功能性食品描述的那些相同。
该功能性食品通过降低肠道中的嘌呤,对于降低血清尿酸水平特别有用。功能性食品可以优选地用于降低血清尿酸水平,特别是随着肠道中嘌呤的减少(通过乳酸菌摄取嘌呤和乳酸菌的促进的增殖),用于降低血清尿酸水平,以及导致的肠道中的嘌呤吸收的降低。
食物或饮料产品诸如该功能性食品(在日本,优选地用于指定的健康用途的食物、用于指定的健康用途的合格食物或具有功能要求的食物)可用于在降低肠道中的嘌呤中使用,或用于在降低血清尿酸水平或抑制或缓解血清尿酸水平的增加中使用,并且可包括说明书或其指示。还提供了具有嘌呤捕获作用的乳酸菌在生产此类功能性食品中的用途(其优选地包括添加(混合)乳酸菌到功能性食品或其原材料)。
该功能性食品的剂型或形状与对与以上描述的其中使用以上提到的转化剂的食物或饮料产品关联的功能性食品描述的那些相同。
食物或饮料产品中含有的除了以上描述的乳酸菌之外的食物组分也与以上描述的其中使用以上提到的转化剂的食物或饮料产品关联地描述的那些相同。
以上描述的含有具有嘌呤捕获作用的乳酸菌或用于捕获嘌呤的剂的功能性食品除了乳酸菌或用于捕获嘌呤的剂之外,还可含有口服施用可接受的载体或添加剂。载体的实例包括水、口服施用可接受的有机溶剂、胶原、聚乙烯醇、聚乙烯吡咯烷酮、聚羧乙烯、精氨酸钠、水溶性右旋糖酐、水溶性糊精、羧甲基淀粉钠、果胶、黄原胶、阿拉伯胶、酪蛋白、明胶、琼脂、甘油、丙二醇、聚乙二醇、凡士林、石蜡、硬脂醇、硬脂酸、人血清白蛋白、甘露醇、山梨醇、乳糖、和口服施用可接受的表面活性剂。添加剂的实例包括粘结剂、赋形剂、润滑剂、崩解剂、润湿剂、稳定剂、缓冲剂、调味剂、防腐剂和着色剂。这些载体或添加剂可单独或以两种或更多种的组合使用,并且可根据制剂的剂型适当地使用。本发明的功能性食品可另外含有其他功能组分。
此外,含有具有嘌呤捕获作用的乳酸菌或用于捕获嘌呤的剂的药物制剂(药物组合物),除了本发明的乳酸菌或用于捕获嘌呤的剂之外,可含有药学上可接受的载体或添加剂,特别是口服施用可接受的载体或添加剂。载体和添加剂的实例与以上描述的其中使用以上提到的转化剂的药物制剂关联地描述的那些相同。这些载体或添加剂可单独或以两种或更多种的组合使用,并且可根据制剂的剂型适当地使用。该药物制剂可另外含有其他药物组分。
以上描述的药物制剂优选地口服施用。药物制剂可采取任何剂型,例如,固体制剂诸如片剂、颗粒剂、粉末、丸剂、或胶囊、凝胶、或液体制剂诸如液体、悬浮液或糖浆。
具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂、或食物或饮料产品或药物制剂的剂量(摄取的量)可以在熟练的技术人员的自由裁量的宽的范围上改变,考虑到用于施用(喂食)的受试者的年龄和体重、施用途径、剂量数等等。尽管具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂、或食物或饮料产品或药物制剂的剂量不被特别限定,剂量是使得以每剂量以下量施用乳酸菌(例如加氏乳杆菌细菌)的量:例如,优选地以1x 105至1x1011cfu的量,更优选地以1x 108至1x 1010cfu的量,还更优选地以1x 109至1x 1010cfu的量,及特别优选地以4x 109至6x 1010cfu的量。用于捕获嘌呤的剂、或食物或饮料产品或药物制剂优选地以1x 105至1x 1011cfu的量,更优选地以1x 108至1x 1010cfu的量,还更优选地以1x 109至1x1010cfu的量,及特别优选地以例如,4x 109至6x 1010cfu的量含有具有嘌呤捕获作用的乳酸菌。
在一个实施方案中,具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂、或食物或饮料产品或药物制剂被一天一次或更多次,优选地一天两次或更多次,及更优选的一天两次向受试者施用(被消费者摄取)。具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂、或食物或饮料产品或药物制剂可持续地向受试者施用,并且例如可每天施用。在该情况中,具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂、或食物或饮料产品或药物制剂被向受试者施用持续至少一周,优选地2周或更多,及更优选地4周或更多。当持续地向受试者施用用于捕获嘌呤的剂、或食物或饮料产品或药物制剂时,其优选地以每剂量1x 105至1x 1011cfu的量,更优选地以1x 108至1x 1010cfu的量,还更优选地以1x 109至1x 1010cfu的量,及特别优选地以例如,4x 109至6x 1010cfu的本发明的乳酸菌的量施用。
在另一个实施方案中,具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂、或食物或饮料产品或药物制剂可以以单剂量施用。当用于捕获嘌呤的剂、或食物或饮料产品或药物制剂以单剂量向受试者施用时,其优选地以每剂量1x 105至1x 1011cfu的量,更优选地以1x 108至1x 1010cfu的量,还更优选地以1x 109至1x 1010cfu的量,及特别优选地以例如,4x 109至6x 1010cfu的具有嘌呤捕获作用的乳酸菌的量施用。具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂、或食物或饮料产品或药物制剂优选地口服施用(口服摄取)。
本文“施用”包括通常用于食物和饮料产品的“摄取”和用于药物制剂的“施用”二者。“口服施用”除了通过口的施用或摄取之外,还包括通过鼻管、胃管等经由管饲的施用。因此,还提供了可用于此类口服施用的口服制剂。在优选的实施方案中,因此,还提供了包含具有嘌呤捕获作用的乳酸菌或用于捕获嘌呤的剂的口服制剂,用于在减少肠道中的嘌呤及降低血清尿酸水平中使用。
向其施用具有嘌呤捕获作用的乳酸菌、用于捕获嘌呤的剂或食物或饮料产品或药物制剂的受试者是哺乳动物,包括人类、家畜、宠物和实验室(实验)动物。受试者优选地是人类受试者,更优选地是患有痛风和/或高尿酸血症的人类受试者,和还更优选地,但不限于具有6mg/dL或更多,例如6至10mg/dL的血清尿酸水平的人类受试者。在一个实施方案中,受试者优选地是具有6至8mg/dL的血清尿酸水平的患有轻微到边缘高尿酸血症的人类受试者。在另一个实施方案中,受试者优选地是具有7mg/dL或更多的血清尿酸水平,并且优选地7至11mg/dL(在一个实例中,在7.6mg/dL和9.5mg/dL之间)的人类受试者,并且在以上之中,受试者更优选地是经受高尿酸血症和痛风的人类受试者。此外,示出血清尿酸水平和在测量血清尿酸水平之前从食物摄取的嘌呤的量(例如,持续3天摄取的嘌呤的总量)间的关联的受试者更优选地作为施用(喂食)的受试者。
即,也提供以下的方面。
[a1]筛选乳酸菌的方法,包括测量含有嘌呤的培养基中被乳酸菌摄取的嘌呤的量,和使用嘌呤的摄取量作为指标选择具有嘌呤捕获作用的乳酸菌。
[a2]根据[a1]所述的方法,其中嘌呤是选自以下组成的组的至少一种:腺嘌呤、腺苷和腺苷酸。
[a3]根据[a1]或[a2]所述的方法,其中嘌呤是腺嘌呤。
[a4]根据[a1]至[a3]中的任一项所述的方法,其中嘌呤用放射性同位素标记。
[a5]根据[a1]至[a4]中的任一项所述的方法,包括在包含嘌呤的培养基中测量所述乳酸菌的增殖的量,和使用增殖的量与所述嘌呤的摄取量一起作为指标选择具有嘌呤捕获作用的乳酸菌。
[a6]根据[a1]至[a5]中的任一项所述的方法,其中乳酸菌是加氏乳杆菌细菌。
[a7]具有嘌呤捕获作用的乳酸菌,通过根据[a1]至[a6]中的任一项所述的方法可得。
[a8]包含具有嘌呤捕获作用的乳酸菌作为活性组分的用于捕获嘌呤的剂,通过根据[a1]至[a6]中的任一项所述的方法可获得。
[a9]根据[a8]所述的用于捕获嘌呤的剂,其用于在降低血清尿酸水平中使用。
[a10]根据[a8]或[a9]所述的用于捕获嘌呤的剂,其中乳酸菌是加氏乳杆菌OLL2959菌株(登录号:NITE AP-224)。
[a11]食物或饮料产品或药物制剂,包含根据[a8]至[a10]中的任一项所述的用于捕获嘌呤的剂。
[a12]根据[a11]所述的食物或饮料产品或药物制剂,其用于在降低肠道中的嘌呤中使用。
[a13]根据[a11]或[a12]所述的食物或饮料产品或药物制剂,其用于在向具有6至8mg/dL血清尿酸水平的人类受试者施用中使用。
[a14]根据[a11]至[a13]中任一项所述的食物或饮料产品或药物制剂,包含每剂量1x 108至1010cfu的所述乳酸菌。
实施例
在下文中,本发明将更具体地参考实施例描述。然而,本发明的技术范围并不局限于这些实施例。
[实施例1]
(1)乳酸菌的制备
使用加氏乳杆菌OLL2959菌株和加氏乳杆菌ATCC 33323菌株作为乳酸菌。ATCC 33323菌株,其是加氏乳杆菌的参考菌株,以目录号:ATCC33323从ATCC(美国典型培养物保藏中心(American Type Culture Collection))可得;或以目录号:JCM 1131T从日本微生物保藏中心(Japan Collection of Microorganisms),RIKEN生物资源中心(RIKEN BRC)(RIKEN BRC-JCM)可得。
将乳酸菌加氏乳杆菌OLL2959菌株和加氏乳杆菌ATCC 33323菌株的每种接种到在两个Falcon管中的MRS培养基中,并且在37℃培养持续16至20小时。将每种培养物在4℃和6,000rpm离心10分钟并且收获,然后合并得到的乳酸菌。以下面的方式洗涤乳酸菌两次:向其中添加10mL的缓冲溶液,悬浮乳酸菌,随后在4℃和6,000rpm离心10分钟并且收获。然后添加缓冲溶液以制备稀释到近似1x 1010cfu/mL的细胞悬浮液(活细胞),及在下面使用细胞悬浮液。
(2)将腺嘌呤转化成腺苷酸(AMP)的补救活性的测量
使用腺嘌呤作为底物,对(1)中制备的乳酸菌测量其将腺嘌呤转化成腺苷酸(AMP)的活性。
对加氏乳杆菌OLL2959菌株和ATCC 33323菌株的每种制备具有下面示出的组成的反应溶液(各100μL)。将乳酸菌悬浮在制备后的含有MgCl2、PRPP、腺嘌呤和Tris-HCl的溶液(缓冲溶液)中。反应溶液中乳酸菌的浓度是近似5x 109cfu/mL。
[表1]
30mM PRPP:与5-磷酸-D-核糖-1-二磷酸五钠盐(SIGMA)一起制备
反应溶液的制备之后,通过在37℃伴随摇动的水浴中孵育培养乳酸菌,通过在0分钟、15分钟、30分钟和60分钟的时间点添加等量的5%TFA(三氟乙酸)终止转化反应。
反应终止后,将反应溶液在4℃和15,000rpm离心10分钟。收集上清液,并且再次在4℃和15,000rpm离心10分钟,使用离心过滤装置0.22-μm Ultrafree-MC(micon)用于微量过滤。
得到的滤液经历HPLC分析。使用的HPLC分析条件如下:
-流动相:A,20mM磷酸盐缓冲液(pH 7.5)
B,40mM磷酸盐缓冲液(pH 7.5)/乙腈(1:1)
-柱:SHISEIDO CAPCELL PAK C18MG2(2.0mm id x 150mm)
-流:0.2mL/min
-温度:40℃
-进样体积:5μl
-检测波长:254nm(UV)
-梯度A/B(分钟):100/0(0分钟)-100/0(5分钟)-80/20(20分钟)[%]
通过测量在HPLC图的峰下的面积定量反应溶液中的腺嘌呤和AMP。当反应终止时,在每个时间点的腺嘌呤到AMP的转化率通过以下的公式计算:
转化率(%)=(测试样品的在AMP的峰下的面积-对照样品的在AMP的峰下的面积)/(测试样品的在零分钟时间点的腺嘌呤的峰下的面积-对照样品的在零分钟时间点的腺嘌呤的峰下的面积)
获得的转化率随着时间的变化示出在表2和图1中。当ATCC 33323菌株被用于反应时,示出非常小的将腺嘌呤转化成AMP的活性。在另一方面,当使用OLL2959菌株时,腺嘌呤的量随着AMP的量的快速增加下降,60分钟后大多数腺嘌呤转化成AMP。如表2和图1中示出的,OLL2959菌株示出显著地高于ATCC 33323菌株的将腺嘌呤转化成AMP的活性。
[表2]
从腺嘌呤到AMP的转化率(%)
这些结果揭示,加氏乳杆菌OLL2959菌株具有非常高的将腺嘌呤转化成AMP的能力。即,认为加氏乳杆菌OLL2959菌株具有高的将腺嘌呤催化成AMP的转化(补救途径)的腺嘌呤磷酸核糖基转移酶(APRT)活性。
(3)将鸟嘌呤转化成鸟苷(GMP)的活性的测量
补救途径除了将腺嘌呤转化成AMP的途径之外,包括将鸟嘌呤转化成鸟苷酸(GMP)的途径、将次黄嘌呤转化成肌苷酸(IMP)的途径和将黄嘌呤转化成黄苷酸(XMP)的途径。在哺乳动物中诸如人类和在乳酸菌中,认为将腺嘌呤催化成AMP的转化的酶APRT也参与鸟嘌呤到GMP的转化。在另一方面,在哺乳动物和在乳酸菌中,次黄嘌呤-鸟嘌呤磷酸核糖基转移酶参与次黄嘌呤到IMP的转化和黄嘌呤到XMP的转化。乳酸菌中,已知黄嘌呤磷酸核糖基转移酶还参与黄嘌呤到XMP的转化和鸟嘌呤到GMP的转化。
因此,还测量了将鸟嘌呤转化成GMP的活性。该测量中,如以上(2)中所述的测量将鸟嘌呤转化成GMP的活性,除了使用鸟嘌呤代替腺嘌呤,和使用GMP代替AMP。结果示于表3和图2中。示出,尽管ATCC 33323菌株具有非常低的将鸟嘌呤转化成GMP的活性,OLL2959菌株还具有相对高的将鸟嘌呤转化成GMP的能力(图2)。
[表3]
从鸟嘌呤到GMP的转化率(%)
[实施例2]
(1)嘌呤核苷酶活性的测量
如专利文献1中示出的,加氏乳杆菌OLL2959菌株具有高的降解嘌呤核苷诸如肌苷和鸟苷的能力。因此,测量了嘌呤核苷酶活性作为将嘌呤核苷降解成嘌呤碱基的活性。
具体地,在使用100mM磷酸盐缓冲液(pH 7.0)制备的具有0.2mM的终浓度的腺苷溶液中,以近似5x 109cfu/ml悬浮OLL2959菌株细胞来制备反应溶液。允许反应溶液在37℃反应持续120分钟,并且通过HPLC分析作为面积测量腺苷和腺嘌呤。作为比较对照,以与以上描述的相同的方式测试ATCC 33323菌株。测量结果表示为腺苷(嘌呤核苷)到腺嘌呤(嘌呤碱基)的转化率(通过面积的比较)。如实施例1(2)中描述的计算该转化率。
此外,如以上描述的进行相同的测试,除了各自使用肌苷和鸟苷代替腺苷。结果示于图3中。相比于加氏乳杆菌ATCC 33323菌株,加氏乳杆菌OLL2959菌株具有显著更高的从所有嘌呤核苷到嘌呤碱基的转化率,即,具有更高的嘌呤核苷酶活性。
(2)5’-核苷酸酶(5’-NT)活性的测量
通过补救活性从嘌呤碱基转化的嘌呤核苷酸通过5’-核苷酸酶活性转化成核苷。因此,对加氏乳杆菌OLL2959菌株测量了5’-核苷酸酶活性。
将OLL2959菌株细胞以近似5x 109cfu/ml悬浮在使用25mM Tris-HCl缓冲液(pH 7.5)制备的具有5mM MgCl2和0.2mM AMP的终浓度的溶液中来制备反应溶液(测试样品)。作为对照样品,使用以上描述的缓冲液代替0.2mM AMP制备反应溶液。允许反应溶液在37℃反应持续120分钟,并且通过HPLC分析作为面积测量AMP和腺苷。作为比较对照,以与以上描述的相同的方式测试ATCC 33323菌株。测量结果表示为从AMP(嘌呤核苷酸)到腺苷(核苷)的转化率(通过面积的比较)。如实施例1(2)中描述的,计算该转化率。
此外,如以上描述的进行相同的测试,除了各自使用IMP和GMP代替AMP。结果示于在表4和图4中。相比于加氏乳杆菌ATCC 33323菌株,加氏乳杆菌OLL2959菌株具有显著更低的从所有嘌呤核苷酸到嘌呤核苷的转化率。即,加氏乳杆菌OLL2959菌株具有显著低的5’-核苷酸酶活性。
[表4]
从嘌呤核苷酸到嘌呤核苷(%)的转化率(%)
从5’-核苷酸酶活性的测量结果及实施例1中的补救活性的测量结果和以上描述的实施例2(1)中的嘌呤核苷酶活性的测量结果,示出,加氏乳杆菌OLL2959菌株通常具有高的嘌呤代谢活性,并且代谢活性特别偏向于可被用作能量的核苷酸的积极产生和积累。
[实施例3]
怀疑具有轻微到边缘高尿酸血症的人类受试者被持续喂食加氏乳杆菌OLL2959菌株,使用安慰剂对照双盲比较研究分析其对尿酸水平的影响(使用人类受试者的测试)。
将在测试起始之前的检查中具有6至8mg/dL的尿酸水平的14名35岁及以上的成年男性(平均年龄:44.3岁)分配成两组:即,安慰剂组和活性组,以在尿酸水平和年龄方面不产生显著差异。安慰剂组每天摄取两杯(85g/杯)不含有加氏乳杆菌OLL2959菌株的酸奶,持续4周。活性组每天摄取两杯(85g/杯)酸奶,持续4周,其中将1x 108cfu/g的加氏乳杆菌OLL2959菌株添加到与对安慰剂组提供的相同的酸奶中。在早餐、午餐和晚餐中的任何两餐后喂食每天两杯的酸奶。
对每个受试者测试其在测试起始(摄取测试食物之前)、及2周和4周之后(测试食物摄取时期)的血液,并且测量血清尿酸水平。计算相比于在测试起始的血清尿酸水平,在每个时间点血清尿酸水平中变化的量,并且使用双因子重复量度ANOVA统计分析测试时期期间血清尿酸水平中变化的量的时间过程。结果示于图5中。
如图5中示出的,相比于安慰剂组,活性组具有显著更低的血清尿酸水平(p=0.042)。即,示出加氏乳杆菌OLL2959菌株具有降低血清尿酸水平的作用。
[实施例4]
在该实施例中,正在经历门诊治疗的患有高尿酸血症和痛风的患者,作为受试者被喂食加氏乳杆菌OLL2959菌株,并且评价其对血清尿酸水平的作用。进行随机的安慰剂对照双盲平行组比较研究。
(1)用于研究的食物产品的产生
如下产生用于研究的要被受试者摄取的食物产品(测试食物产品或对照食物产品)。作为含有加氏乳杆菌OLL2959菌株的测试食物产品,制备含有两种细菌物种即保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜热链球菌(Streptococcus thermophilus)作为酸奶发酵剂,和加氏乳杆菌OLL2959菌株(8.5x 107cfu/mL)作为活性组分的酸奶,然后产生每瓶装有100g的酸奶的瓶装饮料。
作为不含有加氏乳杆菌OLL2959菌株的对照食物产品,以相同的方式制备含有两种细菌物种即保加利亚乳杆菌和嗜热链球菌作为酸奶发酵剂,且不含有加氏乳杆菌OLL2959菌株的酸奶,然后产生每瓶装有100g的酸奶的瓶装饮料。通过组合加氏乳杆菌OLL2959菌株(仅用于测试食物产品)、以上描述的酸奶发酵剂、乳制品、稳定剂(果胶)、香料、水等等作为成分制备每种食物产品中的酸奶。
产生用于研究的食物产品后,对每种产品的随机选择的食物产品的一杯确定细菌数。具体地,在BL培养基上接种用于研究的作为食物产品的酸奶并有氧培养持续3天,然后计数培养基上的菌落的数目以证实,细菌数满足以上描述的水平。
(2)摄取测试
正在服用抗高尿酸血症药物且同意参加该研究的20岁及以上的患有高尿酸血症和痛风的患者(受试者)接受初步检查,包括测量血清尿酸水平和停止抗高尿酸血症药物持续4周。
药物停止4周之后,受试者接受包括测量血清尿酸水平的摄取前检查。在摄取前检查之前,还对受试者进行饮食调查持续3天。
选择药物停止后具有高于7mg/dL的血清尿酸水平的受试者,并且基于药物停止后的血清尿酸水平,将受试者分配成测试食物产品摄取组和对照食物产品摄取组,以不在年龄和摄取前检查中测量的血清尿酸水平方面产生显著差异。两组间的身高、体重、BMI、收缩压阶段、舒张压阶段和脉搏的测量的值方面也没有发现显著差异。
根据该分配,在摄取前检查之后,受试者每天摄取两瓶用于研究的食物产品(含有8.5x 107cfu/mL的OLL2959菌株的测试食物产品或不含有OLL2959菌株的对照食物产品)持续8周(研究食物产品摄取阶段)。受试者在研究食物产品摄取阶段仍停止药物。从摄取起始8周后,进行包括测量血清尿酸水平的检查(第8周检查)。在第8周检查之前,还进行饮食调查持续3天。
在每个摄取前检查(第0周)和第8周检查之前,对全部受试者进行饮食调查持续3天。要求受试者通过将其写在日记和/或将其拍照,报告早餐、午餐和晚餐和餐间的零食的内容持续3天。国家注册营养师基于报告的餐内容,计算能量、蛋白质、脂类、碳水化合物和盐的摄取。还基于来自每个受试者的报告计算嘌呤的量。
对排除以下受试者的群体进行差示分析:在摄取时期期间退出的受试者和摄取90%或更少的用于研究的食物产品的受试者,及未示出在血清尿酸水平和嘌呤摄取间的相关性的受试者(17名受试者;测试食物产品摄取组的9名受试者和对照食物产品摄取组的8名受试者(药物停止后的血清尿酸水平:7.6mg/dL至9.5mg/dL))。直到第8周检查的结果揭示:测试食物产品摄取组示出甚至在药物停止期间(图6),不经历血清尿酸水平的实质增加的倾向,并且相比于对照食物产品摄取组,测试食物产品摄取组以p<0.05示出血清尿酸水平的显著降低(p=0.0342,Mann-Whitney U检验)。
前面的结果示出,加氏乳杆菌OLL2959菌株的摄取同样地抑制患有高尿酸血症和痛风的患者中由于食物来源的嘌呤导致的血清尿酸水平的增加。
[实施例5]评价嘌呤摄取能力的测试
使用用放射性同位素(RI)标记的嘌呤,评价加氏乳杆菌OLL2959菌株的嘌呤摄取能力。
加氏乳杆菌OLL2959菌株于2006年3月31日(原始保藏日期)以登录号NITE P-224保藏在国家技术评估学会,专利微生物保藏中心(NPMD)(#122,2-5-8Kazusakamatari,Kisarazu-shi,Chiba 292-0818,日本),并且随后以登录号NITE BP-224(改变了原始的登录号)于2007年11月21日被转移到布达佩斯条约规定的保藏处(国际保藏处)。将加氏乳杆菌OLL2959菌株接种到MRS培养基中(乳酸菌MRS肉汤,Difco Co.,Ltd.),并且在37℃培养持续16至20小时,下面使用得到的培养物(4至7x 108cfu/ml)。
向0.1mL的基本培养基(DM培养基;表5)添加用放射性同位素14C标记的腺苷酸(AMP)、腺苷、或腺嘌呤(分别是14C-AMP、14C-腺苷、或14C-腺嘌呤)到20μM的终浓度,然后以2wt%(0.002mL:0.8至1.4x 106cfu)接种以上制备的加氏乳杆菌OLL2959菌株的培养物,并在37℃厌氧培养持续30分钟。
随后将TFA溶液(5%的三氟乙酸)添加到这些培养基,然后用生理盐水洗涤细胞,之后使用液体闪烁计数器(由Aloka Co.,Ltd.制造,LSC-6100)测量放射性。作为对照(0分钟),在样品的制备之后立即添加TFA溶液(5%),然后用生理盐水洗涤细胞,之后如以上描述的测量放射性。结果示于图7中。图7中,表示细胞中14C标记的嘌呤的量的放射性的单位(纵轴)是每分钟衰变量(dpm),其代表放射性物质每分钟的衰变的数目。证实,在使用DM培养基培养持续60分钟的情况中,活细胞计数在测试的起始和测试结束间不显著地改变。
前面的结果示出,加氏乳杆菌OLL2959菌株具有摄取腺苷酸(AMP)、腺苷和腺嘌呤(其是嘌呤)进入细胞的能力(嘌呤摄取能力),特别具有高的摄取腺嘌呤进入细胞的能力(嘌呤摄取能力)(图7)。
[表5]
基本培养基组成
[实施例6]评价在嘌呤的存在下的增殖能力的测试
在嘌呤的存在下培养加氏杆菌OLL2959菌株,并且评价其在嘌呤的存在下的增殖能力。
向1mL的DM培养基(表5)添加腺苷酸(AMP)、腺苷、或作为嘌呤的腺嘌呤到400μM的终浓度,然后将在实施例5中制备的加氏乳杆菌OLL2959菌株的培养物以4wt%(0.04mL:1.6至2.8x 107cfu)接种,并在37℃厌氧培养。从该培养的起始的0小时、4小时和6小时后,测量培养基的浊度(在650nm的吸光度)。作为用于比较的对照,以相同的方式培养加氏乳杆菌OLL2959菌株,除了不将嘌呤添加到基本培养基之外,并测量培养基的浊度。结果示于图8中。
前面的结果示出,在腺苷酸(AMP)、腺苷或腺嘌呤的存在下,加氏乳杆菌OLL2959菌株的增殖能力增强,特别是在腺嘌呤的存在下,增殖能力被进一步增强(图8)。
[实施例7]在腺嘌呤的存在下腺嘌呤摄取能力和增殖能力的比较测试
在腺嘌呤的存在下,培养加氏乳杆菌OLL2959菌株和其他加氏乳杆菌菌株,并且比较在腺嘌呤的存在下各自菌株的腺嘌呤摄取能力和增殖能力。
使用加氏乳杆菌P14054ME001菌株和P14054ME002菌株作为其他的加氏乳杆菌菌株。当在不含有嘌呤的MRS培养基(乳酸菌MRS肉汤,Difco,Co.,Ltd.)中培养加氏乳杆菌P14054ME001菌株和P14054ME002菌株持续20小时时,每种菌株的增殖能力与加氏乳杆菌OLL2959菌株相当(表6)。
[表6]
如实施例5中描述的评价腺嘌呤的摄取能力,除了仅使用腺嘌呤(14C-腺嘌呤)作为用放射性同位素14C标记的嘌呤。结果示于图9中。发现,加氏乳杆菌P14054ME002菌株还具有高的腺嘌呤摄取能力(图9),但是加氏乳杆菌P14054ME002菌株不具有与加氏乳杆菌OLL2959菌株一样高的腺嘌呤摄取能力。发现,加氏乳杆菌P14054ME001菌株具有低于加氏乳杆菌OLL2959菌株和P14054ME002菌株的腺嘌呤摄取能力(图9)。
为了评价在腺嘌呤的存在下的增殖能力,将腺嘌呤添加到1mL的DM培养基(表5)中到400μM的终浓度,然后将在实施例5中制备的加氏乳杆菌OLL2959菌株的培养物和以与实施例5中描述的相同的方式制备的P14054ME001菌株和P14054ME002菌株的培养物中的任一个以4wt%(0.04mL:1.6至2.8x 107cfu)接种,并在37℃厌氧培养。从该培养的起始的0小时、4小时和6小时后,测量培养基的浊度(在650nm的吸光度)。结果示于图10中。如同加氏乳杆菌OLL2959菌株,加氏乳杆菌P14054ME001菌株和P14054ME002菌株在腺嘌呤的存在下还示出增强的增殖能力。此外,加氏乳杆菌OLL2959菌株示出远远高于加氏乳杆菌P14054ME001菌株和P14054ME002菌株的增殖能力的增强程度。加氏乳杆菌P14054ME002菌株具有高于加氏乳杆菌P14054ME001菌株的增殖能力的增强程度。
前面的结果示出,加氏乳杆菌细菌中,在腺嘌呤的存在下的增殖能力的增强与腺嘌呤摄取能力的程度相关联。此外,乳酸菌的一些物种示出具有高的同化腺嘌呤的能力。
[实施例8]加氏乳杆菌细菌的嘌呤摄取能力(动物测试)
认为,如果乳酸菌的嘌呤摄取能力高,相比于仅用嘌呤喂食受试者的情况,同时施用(摄取)乳酸菌和嘌呤进入(被)动物受试者抑制受试者中的嘌呤吸收。因此,为了测试加氏乳杆菌细菌的嘌呤摄取能力,使用下面的程序进行动物实验。
最初,购买14只8周龄Wistar大鼠(雄性,190g至210g)并且使其适应环境持续一周。从测试前一天使这些大鼠禁食持续约16小时,测量禁食后的体重。基于禁食后的体重,通过随机取样,使用分组程序将大鼠总计分成三组,即,阴性组(生理盐水处理组)、AMP(放射性同位素14C-AMP)处理组和AMP+OLL2959菌株(放射性同位素14C-AMP和OLL2959菌株)处理组。阴性组仅包括四只大鼠,而其他组的每个包括五只大鼠。将在麻醉状态的所有这些大鼠放在固定器上,用手术刀割破尾静脉,用红细胞压积管收集60μL的从尾静脉渗出的血液。该血液用作施用测试物质之前在0分钟时间点收集的血液样品。将等量的2mg/mL EDTA-2Na溶液(EDTA-2Na溶于生理盐水中)添加到这些收集的血液样品中。
然后强迫口服施用测试物质。作为此处的测试物质,对阴性组使用生理盐水,对AMP处理组使用用放射性同位素14C标记的腺苷酸(14C-AMP:57.6mCi/mmol,0.1mCi/ml),和对AMP+OLL2959菌株处理组使用14C-AMP和加氏乳杆菌OLL2959菌株(1x 1010cfu/个体)。用生理盐水(Otsuka Pharmaceutical Co.,Ltd.)稀释14C-AMP和OLL2959菌株,并使用。对AMP组和AMP+OLL2959组,施用10μCi/个体的14C-AMP。所有个体(所有组)中的剂量体积是2mL/个体。
在施用测试物质15、30、45、60、90、120和180分钟后,将在麻醉状态的所有这些大鼠放在固定器上,用手术刀割破尾静脉,用红细胞压积管收集60μL的从尾静脉渗出的血液。将等量的2mg/mL EDTA-2Na溶液(EDTA-2Na溶于生理盐水中)添加到这些收集的血液样品中。完成这些测试之后,立即通过吸入二氧化碳将这些大鼠处死。
使用液体闪烁计数器(由Aloka Co.,Ltd.制造,LSC-6100)测量这些收集的血液样品中的放射性。结果示于图11中。如图11中示出的,在施用30、45和60分钟后,观察到嘌呤吸收量中的显著差异,即,当达到血液浓度的峰时(*p<0.05,**p<0.01;t-检验)。这些结果示出,嘌呤从肠道吸收的量可通过摄取加氏乳杆菌OLL2959菌株被抑制。
[实施例9]乳酸菌菌株的物种间的比较测试
(1)腺嘌呤摄取能力的比较测试
在含有用放射性同位素(RI)标记的腺嘌呤(14C-腺嘌呤)的培养基中培养加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株,并且比较乳酸菌菌株的物种对腺嘌呤摄取能力的影响。加氏乳杆菌JCM1130菌株以JCM1130从日本微生物保藏中心(Japan Collection of Microorganisms),RIKEN生物资源中心(RIKEN BRC JCM;Tsukuba City,Ibaragi Prefecture,Japan)可得。
使用MRS培养基培养加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株中的每种,并且提前评价其增殖能力。即,在37℃使用MRS培养基,厌氧培养加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株中的每种持续20小时。厌氧培养20小时之后,加氏乳杆菌JCM1130菌株的细菌数比加氏乳杆菌OLL2959菌株的高不少于2.5倍。这揭示,当在相同的培养基中培养加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株时,加氏乳杆菌JCM1130菌株相比于另一个,基本上具有更高的增殖能力(表7)。
[表7]
在腺嘌呤摄取能力的比较测试中,最初,通过添加14C-腺嘌呤到基本培养基(表5)到20μM的终浓度制备用于该测试的培养基。然后使用MRS培养基培养加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株中的每种,并且将这些培养物以2wt%接种到用于该测试的培养基中,并且在37℃厌氧培养。使用MRS培养基,调整这些培养物中的每种以给出相等的细菌数。
在培养的起始(0分钟)、和从培养的起始的30或60分钟后,添加5%TFA溶液以终止培养,并且随后用生理盐水洗涤细胞,之后,使用液体闪烁计数器(由Aloka Co.,Ltd.制造,LSC-6100)测量其放射性。结果示于图12中。图12中的放射性(纵轴)表示为放射性物质每分钟衰变的数目(每分钟衰变;dpm)。
如图12中示出的,加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株二者都发挥腺嘌呤摄取能力,但从培养的起始的30和60分钟后,加氏乳杆菌OLL2959菌株相比于加氏乳杆菌JCM1130菌株,摄取更高量的腺嘌呤并且在腺嘌呤摄取的量中示出显著差异(p<0.05,t-检验)。
前面的结果示出,加氏乳杆菌OLL2959菌株相比于在MRS培养基中具有高的增殖能力的加氏乳杆菌JCM1130菌株,能够摄取显著更高量的嘌呤。
(2)在腺嘌呤的存在下增殖能力的比较测试
在腺嘌呤的存在下培养加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株,并且比较乳酸菌菌株的物种对细胞的增殖能力的影响。
将腺嘌呤添加到基本培养基(表5)到400μM的终浓度,且制备用于该测试的培养基。然后,使用MRS培养基培养加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株中的每种,并且将这些培养物以4wt%接种到用于该测试的培养基中,并且在37℃厌氧培养。在培养的起始(0小时)和从培养的起始4小时和6小时后,测量浊度(在650nm的吸光度)。结果示于图13中。
如图13中示出的,揭示,加氏乳杆菌OLL2959菌株和加氏乳杆菌JCM1130菌株二者在腺嘌呤的存在下都具有增强的增殖能力,但加氏乳杆菌OLL2959菌株的增殖能力的增强的程度显著高于在MRS培养基中具有高的增殖能力的加氏乳杆菌JCM1130菌株(p<0.05,t-检验)。因此揭示,在加氏乳杆菌OLL2959菌株中,在嘌呤存在下的增殖能力被大大地增强。
本说明书中引用的全部出版物、专利和专利申请将通过引用以其整体并入本文。
工业实用性
本发明的乳酸菌可以在体内或体外有效地将作为底物的嘌呤碱基转化成嘌呤核苷酸。使用包含本发明的用于将嘌呤碱基转化成嘌呤核苷酸的乳酸菌的转化剂可以促进肠道中嘌呤碱基到嘌呤核苷酸的转化,甚至在具有高的血清尿酸水平的受试者中,或在具有降低的补救活性的受试者中,从而降低血清尿酸水平。因此,包含本发明的用于将嘌呤碱基转化成嘌呤核苷酸的乳酸菌的转化剂,及含有本发明的用于将嘌呤碱基转化成嘌呤核苷酸的乳酸菌的转化剂的食物或饮料产品和药物制剂对于例如预防和/或治疗痛风和高尿酸血症是有效的。
PCT/RO/134表
- 还没有人留言评论。精彩留言会获得点赞!
- 一锅法合成托匹司他的方法
- 草本水杨梅在制备黄嘌呤氧化酶抑制剂中的应用
- 5-芳基吡唑并嘧啶衍生物的合成方法
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 2-(5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺)戊二酸二乙酯的合成方法
- 一种黄嘌呤脱氢酶截断体及其应用
- 5-(4-氟苯基)-N–(3-(二甲基氨基)丙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 一种5-芳基吡唑并[1,5-a]嘧啶衍生物的合成方法
- 一锅法合成托匹司他的方法
- 草本水杨梅在制备黄嘌呤氧化酶抑制剂中的应用
- 5-芳基吡唑并嘧啶衍生物的合成方法
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 2-(5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺)戊二酸二乙酯的合成方法
- 一种黄嘌呤脱氢酶截断体及其应用
- 5-(4-氟苯基)-N–(3-(二甲基氨基)丙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 一种5-芳基吡唑并[1,5-a]嘧啶衍生物的合成方法
- 一锅法合成托匹司他的方法
- 草本水杨梅在制备黄嘌呤氧化酶抑制剂中的应用
- 5-芳基吡唑并嘧啶衍生物的合成方法
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 2-(5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺)戊二酸二乙酯的合成方法
- 一种黄嘌呤脱氢酶截断体及其应用
- 5-(4-氟苯基)-N–(3-(二甲基氨基)丙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 一种5-芳基吡唑并[1,5-a]嘧啶衍生物的合成方法