具有改善的生长特性的木本植物的制作方法
本发明涉及用于产生与对应的未经基因修饰的野生型植物或木本植物相比具有改善生长特性(在生物量(biomass)和木材质量方面)的经基因修饰的植物或木本植物的方法、植物或木本植物或者其一部分,所述方法包括改变植物或木本植物细胞中多肽的表达水平。
背景技术:
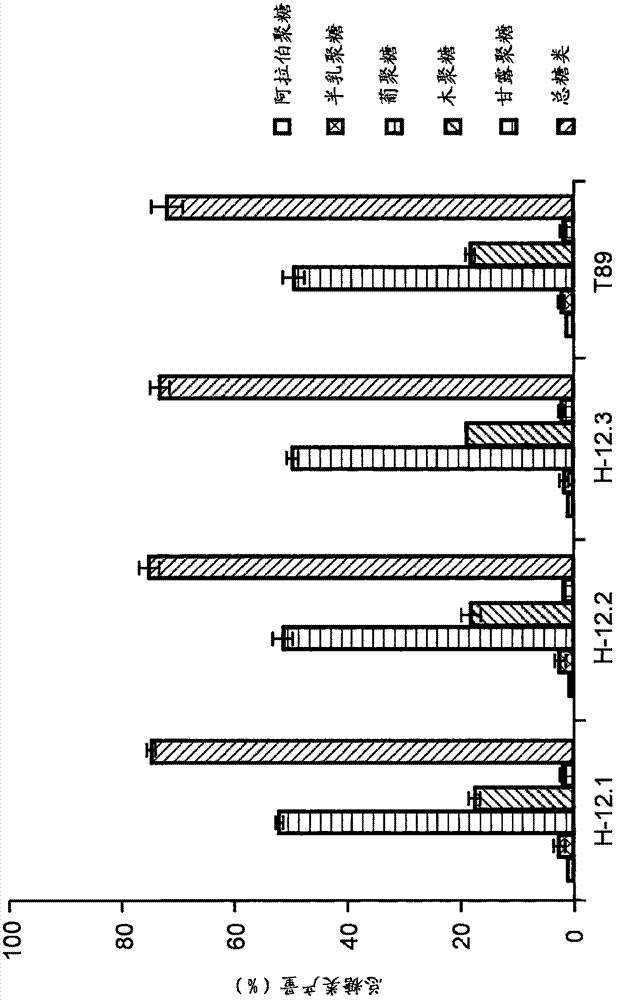
:多年生植物(例如长寿命的树木和木本植物)具有与一年生植物(例如拟南芥属(arabidopsis))显著不同的生活方式,因为多年生植物(例如树木)具有无限生长,而例如拟南芥属的植物则在植物开花时终止生长。多年生植物还可以在活跃生长期与休眠期之间循环。长寿命的树木和木本植物的生命周期与一年生作物显著不同,一年生作物常常将碳和氮转移到种子中。由于一年生作物与多年生植物(例如树木)之间的这些差异,在许多情况下,已经发现模式系统例如欧洲山杨×美洲山杨(populustremula×tremuloides)是用于可靠地发现基因的优越系统,其可用于提高木本植物中的生物量产生。顶端分生组织处的植物生长导致一系列初生组织的发育以及茎和根的伸长。除了这种初生生长之外,树木经历次生生长并由形成层产生次生组织“木材”。这种次生生长提高了茎和根的周长。为了增强树木中的生物量产生,存在若干种可能需要改变的因素,例如不同的基因产物。对于提高的生长和生物量产生,高度、直径、茎体积和木材密度的增长是要追随的重要特征。鉴于需要提供能够在一系列不同的环境条件以及变化的环境条件中增强生长和生物量的多年生植物,则不断需要为植物提供使植物适应在这些条件下生长的不同遗传特性(包含不同组的活性基因)。通常来说,高产率植物可以通过以下产生:使不同的品系杂交,选择具有最佳生长特性的植物,其中可随后选择来自这些植物的种子并且可以进行新的杂交。在这个过程中,可以鉴定出具有较好生长特性的植物。树木和木本植物的一个问题在于它们在开花并可用于传统杂交之前需要到若干年树龄。这可以通过使用多种分子生物学技术来克服。本发明描述了如何可以改变一组基因的表达以产生转基因木本植物,其与对应的未经基因修饰的野生型木本植物相比具有改善的生长特性、改善的生物量和更高的产率。发明概述本发明提供了用于产生与相同物种的对应的未经基因修饰的植物或木本植物相比具有提高的生物量和/或木材质量(木材密度和/或木材生物可降解性)的经基因修饰之植物或木本植物的方法,所述方法包括:(a)增强具有选自seqidno.:2、28和38的氨基酸序列的至少一种多肽或其种间同源体(ortholog)的表达水平,和/或降低木本植物、木本植物细胞或其一部分中具有选自seqidno.:58、74、88、98、106和128的氨基酸序列的至少一种多肽或者其种间同源体或种内同源体(paralog)的表达;(b)产生和/或选择与对应的未经基因修饰的木本植物相比具有提高的生物量和/或木材密度的木本植物、木本植物细胞或其一部分;以及(c)在允许木本植物发育的条件下培养所述木本植物、所述木本植物细胞或所述其一部分。在所述方法的一个实施方案中,所述至少一种多肽选自:(a)具有选自seqidno:2、28、38、58、74、88、98、106和128的氨基酸序列的多肽;(b)具有seqidno:2的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:2、4、6、8、10、12、14、16、18、20、22、24和26的序列具有至少70%的氨基酸序列同一性;(c)具有seqidno:28的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:28、30、32、34和36的序列具有至少70%的氨基酸序列同一性;(d)具有seqidno:38的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:38、40、42、44、46、48、52、54和56的序列具有至少70%的氨基酸序列同一性;(e)具有seqidno:58的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:58、60、62、64、66、68、70和72的序列具有至少70%的氨基酸序列同一性;(f)具有seqidno:74的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:74、76、78、80、82、84和86的序列具有至少70%的氨基酸序列同一性;(g)具有seqidno:88的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:88、90、92、94和96的序列具有至少70%的氨基酸序列同一性;(h)具有seqidno:98的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:98、100、102和104的序列具有至少70%的氨基酸序列同一性;(i)具有seqidno:106的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:106、108、110、112、114、116、118、120、122、124和126的序列具有至少70%的氨基酸序列同一性;以及(j)具有seqidno:128的多肽的种间同源多肽,所述种间同源多肽与选自seqidno:128、130、132、134、136和138的序列具有至少70%的氨基酸序列同一性。在所述方法的一个实施方案中,所述经基因修饰的木本植物是选自以下的硬木树(hardwoodtree):金合欢树(acacia)、桉树(eucalyptus)、角树(hornbeam)、山毛榉(beech)、桃花心木(mahogany)、胡桃树(walnut)、橡树(oak)、白蜡树(ash)、柳树(willow)、山胡桃树(hickory)、桦树(birch)、栗树(chestnut)、杨树(poplar)、赤杨(alder)、山杨(aspen)、枫树(maple)、悬铃木(sycamore)、银杏树(ginkgo)、棕榈树(palmtree)和枫香树(sweetgum)。在所述方法的一个替代实施方案中,所述方法的经基因修饰的木本植物是选自以下的针叶树(conifer):柏树(cypress)、道格拉斯冷杉(douglasfir)、冷杉(fir)、红杉(sequoia)、铁杉(hemlock)、雪松(cedar)、杜松(juniper)、落叶松(larch)、松树(pine)、红杉(redwood)、云杉(spruce)和紫杉(yew)。在所述方法的一个实施方案中,所述方法的经基因修饰的植物是作物植物,例如甘蔗、南瓜、玉米(maize、corn)、小麦、水稻、大麦、黑麦、油菜、饲草(foragegrass)、甜菜、木薯、大豆、马铃薯和棉花。本发明提供了通过本发明的方法产生的经基因修饰的木本植物,其与相同物种的对应的未经基因修饰的木本植物相比具有提高的生物量和/或木材质量(木材密度和/或木材生物可降解性)。本发明还提供了与相同物种的对应的未经基因修饰的木本植物相比具有提高的生物量和/或木材密度的经基因修饰的木本植物,所述植物具有增强表达水平的具有选自seqidno.:2、28和38的氨基酸序列的至少一种多肽或其种间同源体/种内同源体,和/或降低具有选自seqidno.:58、74、88、98、106和128的氨基酸序列的至少一种多肽或种间同源体/种内同源体的表达。在一个实施方案中,所述经基因修饰的木本植物是选自以下的硬木树:金合欢树、桉树、角树、山毛榉、桃花心木、胡桃、橡树、白蜡树、柳树、山胡桃树、桦树、栗树、杨树、赤杨、山杨、枫树、悬铃木、银杏树、棕榈树和枫香树。在一个替代的实施方案中,所述方法的经基因修饰的木本植物是选自以下的针叶树:柏树、道格拉斯冷杉、冷杉、红杉、铁杉、雪松、杜松、落叶松、松树、红杉、云杉和紫杉。在所述方法的一个实施方案中,所述方法的经基因修饰的植物是作物植物,例如甘蔗、南瓜、玉米、小麦、水稻、大麦、黑麦、油菜、饲草、甜菜、木薯、大豆、马铃薯和棉花。附图简述图1:从表达构建体35s022的转基因山杨和野生型山杨获得的木材样品的葡萄糖产生速率,其中在不具有[wp]或具有[ap]酸预处理步骤的情况下制备样品。图2:从表达构建体35s022的转基因山杨和野生型山杨获得的木材样品的糖类组成。定义术语“改善生长特性”应理解为木本植物的初生生长(包括茎和根的伸长)以及次生生长(包括由形成层产生次生组织“木材”以及茎和根的周长的提高)。监测生长的一种方式是通过测量茎的高度和直径,并且任选地计算茎的体积并将其与目的木本植物的野生型群体或亲本对照进行比较。改善的生长产生具有提高的生物量的植物。木材密度是木材质量的正性量度(positivemeasure)。术语“改善的木材质量”在一方面应理解为提高的木材生物可降解性;特别是可从来自于本发明的木本植物的木材获得的糖化产率。特别地,来自于木本植物的木材中的纤维素对聚合物木材结构的酶切割和解构(deconstruction)的敏感性(如通过切割和解构时释放的可溶性糖的产率可测量的)是木材质量的量度。木材质量的另一个方面是木材密度,其影响例如纤维产品和实木产品的强度的因素。木材密度还影响纸张产率和性能。木材密度是牛皮纸浆(kraftpulp)生产的关键因素。“允许树木发育的条件”意指未经基因修饰的木本植物的正常生长,即,木本植物应在木本植物的正常气候带中生长。温度、日光以及获得水分和营养物质应当是生长区的标准。经基因修饰的木本植物之改善的生长的优势在于改善还可影响经基因修饰的木本植物在未经基因修饰的木本植物不生长的环境中的存活。从商业角度来看,这是非常重要的。多肽的“生物活性变体”意指多肽、蛋白质或一段氨基酸,其与所选择的多肽具有相同的活性,但具有不同的氨基酸序列,即,多肽的生物活性变体可以进行相同的酶促反应以产生相同的活性。“种间同源体”或“种间同源多肽”意指由具有相似核酸序列的进化上相关的基因所表达的多肽,其中所述多肽具有相似的功能特性。种间同源基因是来自通过物种形成事件(speciationevent)来自于祖先基因的来自不同物种的结构上相关的基因。与种间同源体相关的是种内同源体。种内同源基因是最可能通过基因的复制来源的单一植物物种中结构上相关的基因。词语种间同源体和种内同源体在整个文本中可互换使用,并且在难以区分种间同源体和种内同源体的情况下,文本可使用术语种间同源体/种内同源体。本领域技术人员已知若干种不同的方法用于鉴定和限定这些功能性同源序列。种间同源体、种内同源体或同源基因可通过以下所述的一种或更多种方法来鉴定。来自不同生物体的“种间同源基因”具有高度保守的功能并且可用于鉴定可以以与本文提供的基因相同的方式实施本发明的基因。已通过基因复制分歧的种内同源基因可编码保留相似功能的蛋白质。种间同源基因是物种形成的产物,由亲本物种产生新物种,产生具有共同祖先和具有相似序列和相似功能的两个或更多个基因。这些基因称为种间同源基因,它们在其宿主植物中常常具有相同的功能并且常常在物种之间可互换而不失去功能。“种间同源”基因的鉴定可通过使用软件工具blast与由基因编码的多肽之一鉴定公共数据库中的多肽来进行。随后使用另外的软件程序来比对和分析祖先。两个种间同源基因之间的序列同一性可能较低。在实施例的介绍中举例说明这样的鉴定和分析方法的实施。术语“基本上相同”或“序列同一性”可表示相等长度的两个氨基酸序列或两个核酸(dna或rna)之间的同源程度的定量量度。当待比较的两个序列不是等长时,通过允许插入空位或者作为替代地在多肽序列或核苷酸序列的末端处截短来对其进行比对以得出最佳的可能匹配。“序列同一性”可表示为百分数,例如当进行最大对应性的比较和比对时,如使用序列比较算法或通过目视检查测量的,整个长度的至少40%、50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%的氨基酸序列同一性。在某些方面,在至少约50个核酸残基,例如至少约100、150、200、250、300、330、360、375、400、425、450、460、480、500、600、700、800个核酸残基,例如至少约900个核苷酸,或例如至少约1kb、2kb,或例如至少约3kb的核酸序列区域中存在实质同一性(substantialidentity)。在一些方面,在具有如上定义的“序列同一性”的多肽中在10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、250、300、350、400、450、500、600、700个氨基酸的多肽序列长度上存在氨基酸实质同一性。本发明的多肽的序列同一性可以作为(nref-ndif)100/nref计算,其中ndif是当比对时两个序列中的不相同残基的总数,并且其中nref是序列之一中的残基的数目。一个或更多个序列之间的序列同一性还可基于使用clustalw软件的总体比对。在本发明的一个实施方案中,用具有默认参数的序列比对方法clustalw进行比对。优选使用的参数设置为:对于成对比对:空位开放罚分(gapopenpenalty):10;空位延伸罚分(gapextensionpenalty):0.1,对于多重比对,空位开放罚分为10且空位延伸罚分为0.2。蛋白质权重矩阵设置为同一性(identity)。残基特异性和疏水性罚分均为“开启”,空位间隔距离为4且末端空位间隔为“关闭”。不使用负矩阵,并最后将延迟分歧截止值(delaydivergentcut-off)设置为30%。优选地,与其比较物多肽相比,多肽中一个或更多个氨基酸残基的替换、插入、添加或缺失的数目是有限的,即,不超过1、2、3、4、5、6、7、8、9或10个替换,不超过1、2、3、4、5、6、7、8、9或10个插入,不超过1、2、3、4、5、6、7、8、9或10个添加,以及不超过1、2、3、4、5、6、7、8、9或10个缺失。优选地,替换是保守氨基酸替换:限于以下组的成员中的互换:第1组:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸;第2组:丝氨酸、半胱氨酸、硒代半胱氨酸、苏氨酸、甲硫氨酸;第3组:脯氨酸;第4组:苯丙氨酸、酪氨酸、色氨酸;第5组:天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺。术语“杂交(hybridization)”和“杂交(hybridize)”被广泛用来指示互补或部分互补的核酸序列之间的缔合。在“严格杂交条件”下,核酸碱基配对将仅在具有高频率互补碱基序列的核酸片段之间发生。多核苷酸片段的长度也影响杂交。“严格杂交条件”的实例可以是使用至少15、20、25、30、35、40、45、50、100或至少200个连续核苷酸残基的多核苷酸序列,其于40℃下在5×盐水柠檬酸钠(ssc)中杂交,随后于65℃下在2×ssc、0.2%十二烷基硫酸钠(sds)中进行一次或更多次洗涤。较低的温度会降低严格性。关于杂交方法的更多细节见于本领域中。“改变”意指改变基因产物的水平或活性。以这种方式,“改变”用于修饰、提高、减小、降低但不消除植物中的基因产物的水平或活性。其也可指改变本文提供的基因的表达;其可用于修饰期望的特性。获得改变水平或活性的基因产物的方法可以通过使用如所述用于鉴定与野生型相比具有改变的生长特性的植物的核酸构建体来进行。这样的植物例如可以是天然存在的变体或经基因修饰从而表现出改变的生长特性的植物。为了这样的目的,根据本发明的核酸序列可用作靶标以鉴定可以用作育种程序中的标记的遗传变异,例如,作为常规杂交测定中的探针或者作为核酸片段的特异性扩增的引物。短语“调节性核酸序列”是指调节性结合位点、启动子、poly-a信号等。“降低多肽的量或活性”意指mrna的转录和/或加工可能降低,由此随后mrna翻译成功能性多肽可导致较低量的多肽。多肽可以是蛋白质或酶。当酶的量降低时,活性可能降低。“提高多肽的量或活性”意指mrna的转录可能提高,mrna加工可能受到影响,导致mrna提高,由此mrna翻译成功能性多肽可导致较高量的多肽。多肽可以是蛋白质或者更具体地是酶。当酶的量提高时,活性可能提高。提高多肽的量或活性也可通过将核酸序列引入宿主细胞中,表达所述核酸序列并将其翻译成功能性多肽来实现。功能性多肽通常可能不存在或通常仅由处于较低水平的内源基因表达,在这种情况下,多肽/酶的量或活性提高。“过表达”或“提高的表达”意指核酸序列在其引入宿主细胞后以与由编码所述多肽或蛋白质的内源宿主基因正常表达的水平相比更高的水平表达。发明详述1.用于提高植物或木本植物的生物量产率和/或木材密度的方法本发明提供了用于产生具有提高的生长的基因修饰之植物或木本植物的方法;由此木本植物产品产生提高的生物量和/或提高的木材密度。当与用作对照的未经基因修饰(non-geneticallymodified,non-gm)的野生型群体或亲本植物或木本植物相比,本发明所提供的经基因修饰(geneticallymodified,gm)的植物或木本植物的特征在于提高的高度、直径、茎体积、木材密度或其任意组合。木本植物的提高的生长可由提高的初生生长(包括茎和根的伸长)以及提高的次生生长(包括由形成层产生次生组织“木材”,导致茎和根的周长提高)引起。已出人意料地发现,植物或木本植物的基因修饰引起选自stt74、stt681、stt632、stt153、stt258、stt387、stt543、stt793和tt795中的一种或更多种多肽或者其种间同源体或种内同源体之改变的表达水平,其中所述多肽的氨基酸分别为seqidno:2、28、38、58、74、88、98、106和128,并且其中所述一种或更多种多肽的改变的表达产生具有提高的生物量和/或提高的木材密度和/或木材质量的植物。多肽的种间同源体或种内同源体是与seqidno:2、28、38、58、74、88、98、106和128中的任一种或seqidno:2、28、38、58、74、88、98、106和128中的任一种的一部分(关于每个序列如下文所定义)具有至少40%、45%、50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、至少99%或100%的氨基酸序列同一性的多肽。本领域已知,由种间同源基因编码的多肽当在异源植物或木本植物中转基因表达时保留其功能特性。例如,烟草和树木中来自于拟南芥(arabidopsisthaliana)的基因的表达赋予经转化植物相同的表型特性。因此,期望为本文中所述的那些(例如stt74、stt681、stt632)之一的种间同源体的多肽当在木本植物中过表达时以相同的方式发挥作用并改善生长特性。根据本发明,由木本植物中的种间同源基因编码的多肽的表达具有特殊价值,因为其使得能够改善具有高经济价值的木本植物的生长特性,但是其中编码待表达的多肽的天然基因是未知的。类似地,期望本发明的gm木本植物中由种间同源基因编码的多肽(其为本文中所述的那些(例如stt153、stt258、stt387、stt543、stt793和stt795)之一的种间同源体)的降低的表达由于其保守的功能特性而改善gm木本植物的生长特性。在一个实施方案中,本发明提供了用于提高植物或木本植物的生物量和/或木材密度和/或木材质量的方法;其中对所述植物或木本植物进行基因修饰以提高一种或更多种多肽或者其种间同源体或种内同源体的表达水平,其中所述多肽的氨基酸序列与选自seqidno:2、28、38(分别对应于stt74、stt681和stt632)的序列具有至少70%的序列同一性,关于每个序列如下文中所定义。在另一个实施方案中,本发明提供了用于提高植物或木本植物的生物量产率和/或木材密度和/或木材质量的方法;其中对所述植物或木本植物进行基因修饰以降低一种或更多种多肽或者种间同源体或种内同源体的表达水平,其中所述多肽的氨基酸序列与选自seqidno:58、74、88、98、106、128(分别对应于stt153、stt258、stt387、stt543、stt793和stt795)的序列具有至少70%的序列同一性,关于每个序列如下文所定义。1.1植物或木本植物中具有seqidno2的多肽(stt74)或者其种间同源体或种内同源体的增强表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中增强具有seqidno:2的多肽(stt74)或者其种间同源体或种内同源体的表达赋予增强的生长(如以植物的高度和直径以及体积所测量的);以及提高的木材密度(参见实施例1)和木材质量(参见实施例11)。所表达多肽具有的功能特性是囊泡相关膜蛋白的功能特性。在一个实施方案中,所述多肽的氨基酸序列与seqidno:2具有至少70%的序列同一性,并且选自:seqidno:2(对应于由基因poptr_0019s13890编码的毛果杨(populustrichocarpa)多肽);seqidno:4(对应于由基因potri.013g147800.2编码的毛果杨多肽);或seqidno:6(对应于由基因potri.019g116400编码的毛果杨多肽)。或者,所述多肽与seqidno2的第60至267位氨基酸残基具有至少70%的序列同一性,并且选自:seqidno:8(对应于由基因potri.001g408200.1编码的毛果杨多肽);seqidno:10(对应于由基因potri.004g033500编码的毛果杨多肽);seqidno:12(对应于由基因potri.011g041900.1编码的毛果杨多肽);seqidno:14(对应于由基因potri.011g126200.2编码的毛果杨多肽);seqidno:16(对应于由基因f01073编码的巨桉(eucalyptusgrandis)多肽);seqidno:18(对应于由基因k00911编码的巨桉多肽);seqidno:20(对应于由基因d00750编码的巨桉多肽);seqidno:22(对应于由基因at4g05060编码的拟南芥多肽);seqidno:24(对应于由基因at4g21450编码的拟南芥多肽);和seqidno:26(对应于由基因at5g54110编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno2的第60至267位氨基酸残基具有至少70%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,用于在gm植物或木本植物中表达以增强生长)的特征在于包括表1中列出的所有肽,其中肽stt74pep1的氨基酸序列与seqidno:2中的对应区域具有至少70%的序列同一性,肽stt74pep2的氨基酸序列与seqidno:2中的对应区域具有至少80%的序列同一性,以及肽stt74pep3的氨基酸序列与seqidno:2中的对应区域具有至少90%的序列同一性。表1定义stt74多肽的肽1.2植物或木本植物中具有seqidno28的多肽(stt681)或者其种间同源体或种内同源体的增强表达在一个实施方案中,当与用作对照的未经基因修饰(gm)的木本植物相比时,在gm植物或木本植物中增强具有seqidno:28的多肽(stt681)或者其种间同源体或种内同源体的表达赋予增强的生长(如以植物的高度和直径以及体积所测量的);以及提高的木材密度(参见实施例2)。所表达多肽具有的功能特性是gtp酶活化蛋白的功能特性。在一个实施方案中,多肽的氨基酸序列与seqidno:28具有至少70%的序列同一性,并且选自:seqidno:28(对应于由基因poptr_0001s38090编码的毛果杨多肽);seqidno:30(对应于由基因potri.011g098500编码的毛果杨多肽);seqidno:32(对应于由基因eucgr.d00176编码的巨桉多肽);seqidno:34(对应于由at4g21160基因编码的拟南芥多肽);和seqidno:36(对应于由at4g05330基因编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:28具有至少70%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,用于在gm植物或木本植物中表达以增强生长)的特征在于包括表2中列出的所有肽,其中肽stt681pep1、肽stt681pep2、肽stt681pep3和肽stt681pep4中每一种的氨基酸序列分别与seqidno:28中的对应区域具有实质序列同一性或相同。表2定义stt681多肽的肽1.3植物或木本植物中具有seqidno:38的多肽(stt632)或者其种间同源体或种内同源体的增强表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中增强具有seqidno:38的多肽(stt632)或者其种间同源体或种内同源体的表达赋予增强的生长(如以植物的高度和直径以及体积所测量的);以及增强的木材密度(参见实施例3)。所表达多肽作为转录因子发挥作用并属于所谓的wrky家族,其特征在于具有氨基酸wrky的保守区域。虽然不希望受理论束缚,但wrky家族多肽具有的功能特性(其导致木本植物生长和密度方面观察到的提高)包括增强耐逆性(stresstolerance),例如耐热耐盐性。在一个实施方案中,多肽的氨基酸序列与选自以下的序列具有至少70%的序列同一性:seqidno:38(对应于由基因poptr_0013s14960基因编码的毛果杨多肽);seqidno:40(对应于由基因potri.013g153400.1编码的毛果杨多肽);seqidno:42(对应于由基因potri.006g105300.1编码的毛果杨多肽);seqidno:44(对应于由基因potri.016g128300.1编码的毛果杨多肽);seqidno:46(对应于由基因potri.019g123500.2编码的毛果杨多肽);seqidno:48(对应于由基因eucgr.b04010编码的巨桉多肽);seqidno:50(对应于由基因eucgr.k02940编码的巨桉多肽);seqidno:52(对应于由基因atwrky25(at2g30250)编码的拟南芥多肽);seqidno:54(对应于由基因atwrky33(at2g38470)编码的拟南芥多肽);和seqidno:56(对应于由基因atwrky26(at5g07100)编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:38具有至少50%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,用于在gm植物或木本植物中表达以增强生长)的特征在于包括表3中列出的所有肽,其中肽stt632pep1、肽stt632pep2、肽stt632pep3、肽stt632pep4、肽stt632pep5和肽stt632pep6中每一种的氨基酸序列分别与seqidno:38中的对应区域具有实质序列同一性或相同。表3定义st632多肽的肽1.4植物或木本植物中具有seqidno:58的多肽(stt153)或者其种间同源体或种内同源体的降低表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,gm植物或木本植物中具有seqidno:58的多肽(stt153)或者其种间同源体或种内同源体的降低表达赋予增强的生长(如以植物的高度和直径以及体积所测量的),以及提高的木材密度(参见实施例4)。所表达多肽具有的功能特性是锌指蛋白的功能特性。在一个实施方案中,表达降低的多肽的氨基酸序列与选自以下的序列具有至少70%的序列同一性:seqidno:58(对应于由基因poptr_0018s01490(v3.0更新为potri.018g029900)编码的毛果杨多肽);seqidno:60(对应于由基因potri.006g251300.1编码的毛果杨多肽);seqidno:62(对应于由基因potri.001g172700.1编码的毛果杨多肽);seqidno:64(对应于由基因eucgr.f02548.1基因编码的巨桉多肽);seqidno:66(对应于由基因eucgr.c02807.1编码的巨桉多肽);seqidno:68(对应于由基因eucgr.c01779.1编码的巨桉多肽);seqidno:70(对应于由基因at5g25490.1编码的拟南芥多肽);和seqidno:72(对应于由基因at3g15680.1编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:58具有至少65%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中其表达降低以增强生长)的特征在于包括表4中列出的所有肽,其中肽stt153pep1、肽stt153pep2、肽stt153pep3、肽stt153pep4、肽stt153pep5、肽stt153pep6和肽stt153pep7的氨基酸序列分别与seqidno:58中的对应区域具有实质序列同一性或相同。表4定义stt153多肽的肽1.5植物或木本植物中具有seqidno:74的多肽(stt258)或者其种间同源体或种内同源体的降低表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,gm植物或木本植物中具有seqidno:74的多肽或者其种间同源体或种内同源体的降低表达赋予增强的生长(如以植物的高度和直径以及体积进行测量的),以及提高的木材密度(参见实施例5)。所表达多肽具有的功能特性是钙调素结合蛋白的功能特性。在一个实施方案中,表达降低的多肽的氨基酸序列与选自以下的序列具有至少70%的序列同一性:seqidno:74(对应于毛果杨基因poptr_0013s13090(或v3.0更新为potri.013g127200));seqidno:76(对应于由基因potri.019g095700编码的毛果杨多肽);seqidno:78(对应于由基因potri.019g112400.1编码的毛果杨多肽);seqidno:80(对应于由基因eucgr.h00308.1编码的巨桉多肽);seqidno:82(对应于由基因eucgr.l00007.2编码的巨桉多肽);seqidno:84(对应于由基因at3g59690.1编码的拟南芥多肽);和seqidno:86(对应于由基因at2g43680.3编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:74具有至少60%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中其表达降低以增强生长)的特征在于包括表5中列出的所有肽,其中肽stt258pep1、肽stt258pep2、肽stt258pep3、肽stt258pep4、肽stt258pep5、肽stt258pep6、肽stt258pep7、肽stt258pep8、肽stt258pep9和肽stt258pep10中每一种的氨基酸序列分别与seqidno:74中的对应区域具有实质序列同一性或相同。表5定义stt258多肽的肽1.6植物或木本植物中具有seqidno:88的多肽(stt387)或者其种间同源体或种内同源体的降低表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,gm植物或木本植物中具有seqidno:88的多肽或者其种间同源体或种内同源体的降低表达赋予增强的生长(如以植物的高度和直径以及体积所测量的);以及提高的木材密度(参见实施例6)。所表达多肽具有的功能特性是酶莽草酸脱氢酶(shikimatedehydrogenase)的功能特性。在一个实施方案中,表达降低的多肽的氨基酸序列与选自以下的序列具有至少70%的序列同一性:seqidno:88(对应于毛果杨基因potri.013g029900基因);seqidno:90(对应于由基因potri.005g043400.1编码的毛果杨多肽);seqidno:92(对应于由基因eucgr.b01770.1编码的巨桉多肽);seqidno:94(对应于由基因eucgr.h01214.1编码的巨桉多肽);和seqidno:96(对应于由基因at3g06350.1编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:88具有至少55%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中其表达降低以增强生长)的特征在于包括表6中列出的所有肽,其中肽stt387pep1、肽stt387pep2、肽stt387pep3、肽stt387pep4、肽stt387pep5、肽stt387pep6、肽stt387pep7、肽stt387pep8和肽stt387pep9中每一种的氨基酸序列与seqidno:88中的对应区域具有实质序列同一性或相同。表6定义stt387多肽的肽1.7植物或木本植物中具有seqidno:98的多肽(stt543)或者其种间同源体或种内同源体的降低表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,gm植物或木本植物中具有seqidno:98的多肽或者其种间同源体或种内同源体的降低表达赋予增强的生长(如以植物的高度和直径以及体积所测量的);以及提高的木材密度(参见实施例7)。所表达多肽具有的功能特性是2-氧代酮戊二酸和fe(ii)依赖性加氧酶的功能特性。在一个实施方案中,表达降低的多肽的氨基酸序列与选自以下的序列具有至少70%的序列同一性:seqidno:98(对应于毛果杨基因potri.009g107600);seqidno:100(对应于由基因eucgr.i01206.1编码的巨桉多肽);seqidno:102(对应于由基因at3g19000.1编码的拟南芥多肽);和seqidno:104(对应于由基因at3g19010.1编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:98具有至少65%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中其表达降低以增强生长)的特征在于包括表7中列出的所有肽,其中肽stt543pep1、肽stt543pep2、肽stt543pep3、肽stt543pep4、肽stt543pep5、肽stt543pep6、肽stt543pep7和肽stt543pep8中每一种的氨基酸序列与seqidno:98中的对应区域具有实质序列同一性或相同。表7定义stt543多肽的肽1.8植物或木本植物中具有seqidno:106的多肽(stt793)或者其种间同源体或种内同源体的降低表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,gm植物或木本植物中具有seqidno:106的多肽或者其种间同源体或种内同源体的降低表达赋予增强的生长(如以植物的高度和直径以及体积所测量的);以及提高的木材密度(参见实施例8)。所表达多肽具有的功能特性是参与细胞信号转导的小gtp结合蛋白的功能特性。在一个实施方案中,表达降低的多肽的氨基酸序列与seqidno8具有至少70%的序列同一性,并且选自:seqidno:106(对应于毛果杨potri.004g153400);seqidno:108(对应于由基因potri.009g115000.1编码的毛果杨多肽);seqidno:110(对应于由基因potri.003g053400.1编码的毛果杨多肽);seqidno:112(对应于由基因potri.001g182900.1编码的毛果杨多肽);seqidno:114(对应于由基因eucgr.g00442.1编码的巨桉多肽);seqidno:116(对应于由基因eucgr.f03029.1编码的巨桉多肽);seqidno:118(对应于由基因eucgr.j02962.1编码的巨桉多肽);seqidno:120(对应于基因eucgr.c03821.1编码的巨桉多肽);seqidno:122(对应于由基因at3g18820编码的拟南芥多肽);seqidno:124(对应于由基因at1g49300.2编码的拟南芥多肽);和seqidno:126(对应于由基因at3g16100.1编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:106具有至少70%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中其表达降低以增强生长)的特征在于包括表8中列出的所有肽,其中肽stt793pep1、肽stt793pep2、肽stt793pep3、肽stt793pep4和肽stt793pep5中每一种的氨基酸序列与seqidno:106中的对应区域具有实质序列同一性或相同。表8定义stt793多肽的肽1.9植物或木本植物中具有seqidno:128的多肽(stt795)或者其种间同源体或种内同源体的降低表达在一个实施方案中,当与用作对照的非gm植物或木本植物相比时,gm植物或木本植物中具有seqidno:128的多肽或者其种间同源体或种内同源体的降低表达赋予增强的生长(如以植物的高度和直径以及体积所测量的);以及提高的木材密度(参见实施例9)。所表达多肽具有的功能特性是具有ef-手型基序的钙结合蛋白的功能特性。在一个实施方案中,表达降低的多肽的氨基酸序列与选自以下的序列具有至少70%的序列同一性:seqidno:128(对应于毛果杨potri.002g008600);seqidno:130(对应于毛果杨potri.t102700.1);seqidno:132(对应于毛果杨potri.005g253000.1);seqidno:134(对应于由基因eucgr.f01786.1编码的巨桉多肽);seqidno:136(对应于由基因at1g20760.1编码的拟南芥多肽);和seqidno:138(对应于由基因at1g21630.1编码的拟南芥多肽)。在一个优选的实施方案中,与seqidno:128具有至少55%序列同一性的多肽(当与用作对照的非gm植物或木本植物相比时,在gm植物或木本植物中其表达降低以增强生长)的特征在于包括表9中列出的所有肽,其中肽stt795pep1、肽stt795pep2、肽stt795pep3、肽stt795pep4、stt795pep5、stt795pep6、肽stt795pep7、肽stt795pep8、肽stt795pep9和肽stt795pep10中每一种的氨基酸序列与seqidno:128中的对应区域具有实质序列同一性或相同。表9定义stt795多肽的肽2.0用于对本发明的木本植物中的多肽的表达进行基因修饰的方法2.1用于增强本发明植物或木本植物中的多肽之表达的遗传构建体和方法可合成产生具有编码在植物或木本植物中其表达待增强的多肽(参见1.1-1.3)的核酸序列的核酸分子。核酸分子的序列将包含各自多肽的编码序列;并且优选对其核苷酸序列进行优化以在各自的植物或木本植物中表达。在序列表中提供了编码根据本发明的用于在植物或木本植物中增强表达的多肽之合适核酸分子的实例。编码本发明中使用的多肽的核酸分子与包含启动子核酸分子以及优选还有终止子核酸分子的顺式调节区可操作地连接(融合)。启动子例如可以是组成型启动子(例如,camv35s启动子)或编码本发明多肽的天然植物基因的植物启动子或组织特异性启动子。终止子核酸分子可以是camv35s终止子。将与顺式调节区可操作地连接的编码本发明中使用的多肽的核酸分子引入核酸构建体(载体)中以确保大肠杆菌(e.coli)或农杆菌(agrobacterium)菌株中的高效克隆,并且这使得可以稳定地转化植物。这样的载体包括适用于t-dna介导的转化的多种二元和共整合载体系统。载体系统的特征通常在于至少具有农杆菌介导的转化所需的vir基因以及t-dna边界序列。2.2用于降低本发明植物或木本植物中的多肽之表达的遗传构建体和方法以下方法用于举例说明用于使植物或木本植物的植物细胞中的多肽(stt153、stt258、stt387、stt543、stt793和stt795或者其种间同源体或种内同源体,如1.4-1.9中所定义)的功能活性下调或沉默的替代方法,其中所述多肽由植物细胞基因组中的核酸分子编码。-用于沉默多肽表达的反义转基因下调或沉默宿主植物中表达根据本发明的多肽(stt153、stt258、stt387、stt543、stt793和stt795)或者其种间同源体或种内同源体(如1.4-1.9中所定义)的天然存在的基因之表达可以通过将包含如下的转基因转化到宿主植物中来获得:编码所述多肽或其一部分的核酸分子(如1.5至1.8中所定义),或者其核酸序列是编码所述多肽或其一部分的核酸分子的反义序列的分子。-用于沉默多肽表达的rnai转基因下调或沉默宿主植物中编码根据本发明的多肽(stt153、stt258、stt387、stt543、stt793和stt795或者其种间同源体或种内同源体,如1.5-1.8中所定义)的天然存在的基因可以通过“rna干扰”或“rnai”来获得:rnai采用双链rna分子或短发夹rna来改变与其共享基本上或完全同源性的核酸序列的表达。通过rna干扰抑制天然存在的基因可以使用包含用作启动子的核酸分子的转基因来实现,所述启动子与包含天然存在基因的基因组dna或cdna区段(片段)的有义和反义元件的核酸分子(包含如上述第1部分所定义的核酸分子)可操作地连接。有义和反义dna组分可以通过内含子或人工dna区段直接连接或接合,所述内含子或人工dna区段可在所转录的rna杂交形成发夹结构时形成环。可优选的是,在用于下调靶序列表达的序列和靶序列中存在完全序列同一性,尽管序列的完全互补性或相似性不是必需的。给定核酸分子每25个核苷酸的一个或更多个核苷酸可与靶基因中的对应序列不同。因此,根据本发明在下调基因表达中使用的序列可以是选自可用的那些的野生型序列(例如,基因),或这样序列的变体,例如所提供的基因的种间同源基因或种内同源基因。重要的是注意,存在具有20个核苷酸长的大量片段,其将在rna干扰过程中发挥作用以降低靶基因的表达或活性。例如,对于468个核苷酸长的基因stt153,存在约448个不同的20个核苷酸长的片段,并且预期这些20个核苷酸长的片段中的大多数将通过rna干扰过程降低靶基因的表达或活性。从实际角度来看,干扰rna分子必须是双链分子,其可通过头对头或尾对尾克隆目的片段形成反向重复序列来实现。此外,形成干扰rna的克隆的dna片段应为至少17、18、19、20、21、22、23、24或25个核苷酸长。形成干扰rna的克隆的dna片段也可以是50、100、150、200、250、300、350、400、450、500、550、600或650最长至全长核苷酸长。形成干扰rna的克隆的dna片段可比基因的mrna的翻译部分长。本发明表明较短的dna片段和较长的dna片段二者在rna干扰过程中出乎意料地发挥良好作用以降低靶基因的表达或活性,参见表11。-用于沉默多肽的表达的人工微rna(microrna)在另一个实例中,人工微rna的构建是用启动子驱动模拟微rna功能的rna分子的表达,而设定基因特异性的序列是重组引入的。在本发明的一个具体实施方案中,核酸构建体或重组dna构建体还包含位于转录盒之前的强组成型启动子,所述转录盒由靶基因部分及随后的植物功能性内含子以及再后的方向相反的靶基因的相同部分组成。该转录盒后面是终止子序列。优选的载体是其中本发明的核苷酸序列之一以反向重复方向插入的这种类型。-用于修饰多肽表达的诱导突变和tilling下调或沉默植物或木本植物细胞中根据本发明多肽(stt153、stt258、stt387、stt543、stt793和stt795或者其种间同源体或种内同源体,如1.5-1.8中所定义)的表达可以通过在编码多肽的基因中进行突变(例如点突变)获得。可将突变随机引入植物细胞的基因组中,然后可以通过特定方法例如tilling(靶向诱导的基因组局部突变,targetinginducedlocallesionsingenomes)来选择经诱变的植物细胞。由于其基因组中的化学诱导突变而导致的各基因的表达下调或沉默的植物和植物细胞被认为是“经基因修饰的”,并且由于它们不包含引入到其基因组中的转基因,所以不认为它们是重组植物或植物细胞。-用于沉默多肽表达的基因中的t-dna插入下调或沉默植物细胞中编码根据本发明的多肽(stt153、stt258、stt387、stt543、stt793和stt795或者其种间同源体或种内同源体,如1.5-1.8中所定义)的基因的表达也可以通过t-dna诱变获得,由此使用t-dna以在植物基因组中随机引入突变,随后选择在内源基因中包含(非沉默)沉默突变的植物。随后,其中内源基因产生突变的植物或植物细胞可以通过使用一系列跨越各基因的pcr引物对的pcr或其他高通量技术鉴定。-用于修饰多肽表达的定点诱变修饰编码根据本发明的多肽(stt153、stt258、stt387、stt543、stt793和stt795或者其种间同源体或种内同源体,如1.1-1.9中所定义)的基因的表达可以通过使用定点核酸酶的定点诱变方法使基因调节序列的部分产生突变来进行。这样的三种不同的技术是talen’s、工程化锌指核酸酶和crisper-cas。基本机制是对核酸酶进行修饰,使得将其引导至靶基因中独特的靶dna序列处或接近独特的靶dna序列,然后将该技术引入细胞中,并在靶序列处或其附近切割核酸酶,然后植物自身的dna修复机制将修复经切割的dna,并且在一些情况下这样做将产生突变。然后将鉴定具有突变的个体植物,并且将对选定植物的期望效果(例如,提高生物量生产)进行测试。2.3用于通过转化将遗传构建体引入植物或木本植物中的方法-植物细胞的转化根据本发明,所述方法包括用核酸构建体或重组dna构建体(如2.1和2.2中所述)转化植物的可再生细胞,并从所述经转化的细胞再生转基因植物。目前常规方法是产生稳定的可育转基因植物。已知多种方法用于将构建体转运到待转化的细胞中。农杆菌介导的转化被本领域技术人员广泛用于转化树种,特别是硬木树种例如杨树和桉树。在农杆菌转化效率低或无效的情况下,例如在一些裸子植物物种中,可以使用其他方法,例如微粒或粒子轰击、电穿孔、显微注射、直接dna摄取、脂质体介导的dna摄取或涡旋法。本领域技术人员将认识到,可以使用很多种宿主细胞作为根据本发明的dna构建体和载体的接受者。宿主细胞的非限制性实例包括胚胎组织、i、ii和iii型愈伤组织、下胚轴、分生组织、根组织以及在韧皮部、叶盘(leafdiscs)、叶柄和茎节间中表达的组织中的细胞。一旦dna构建体或载体在细胞内,则可发生整合到内源基因组中。-经转化植物细胞的选择和植物或木本植物的再生转化后,优选使用并入转化载体中的显性选择标记来选择转基因植物。通常来说,这样的标记将赋予经转化植物抗生素或除草剂抗性,并且可通过使植物暴露于适当浓度的抗生素或除草剂来实现转化子的选择。使用d形(d-form)氨基酸的选择标记以及基于植物只可耐受l形的事实提供了快速、高效且环境友好的选择体系。随后,如本领域中的标准一样,可从例如单个细胞、愈伤组织或叶盘再生植物。几乎任何植物都可以从植物的细胞、组织和器官完全再生。在选定转化的植物并将其培养至成熟后,鉴定出表现出改变的生长特性表型的那些植物。2.4用于检测本发明植物或木本植物中编码多肽的基因的修饰表达的方法可以使用实时rt-pcr来比较gm植物或木本植物与对应的非gm植物或木本植物中的基因表达(即,mrna表达)水平。本文中公开的多核苷酸的量可以通过使用northern印迹、测序、rt-pcr或微阵列分析来确定。可以使用具有免疫检测的western印迹或凝胶迁移测定来测量在本发明的gm木本植物中表达的多肽的表达水平或量。针对各个多肽获得的抗体可用于来自于木本植物的组织中的表达的多肽的特异性免疫检测。3.0本发明的经基因修饰的植物或木本植物具有提高的生长的gm植物或木本植物(由此所述植物或木本植物产品产生提高的生物量和/或提高的木材密度)的特征在于一种或更多种多肽或者其种间同源体或种内同源体(如第1.0部分中所定义)的表达水平改变,其中所述多肽具有选自分别具有seqidno:1-18的stt74、stt681、stt632、stt153、stt258、stt387、stt543、stt793和stt795的氨基酸。在一个实施方案中,gm木本植物是树木;例如选自以下的硬木植物:金合欢树、桉树、角树、山毛榉、桃花心木、胡桃树、橡树、白蜡树、柳树、山胡桃树、桦树、栗树、杨树、赤杨、山杨、枫树、悬铃木、银杏树、棕榈树和枫香树。在另一个实施方案中,gm木本植物属于桃金娘科(myrtaceae)和杨柳科(salicaceae)。来自杨柳科的硬木植物(例如柳树、杨树和山杨)包括其变体是特别令人关注的,因为这两组包括为提供木材和生物燃料而专门培育的快速生长的树种或木本灌木。桉树树种也是这样的快速生长树木的实例。在另一个实施方案中,gm木本植物是针叶树,例如选自以下的针叶树:柏树、道格拉斯冷杉、冷杉、红杉、铁杉、雪松、杜松、落叶松、松树、红杉、云杉和紫杉。在一个替代实施方案中,gm木本植物是结实植物(fruitbearingplant),例如选自以下之一:苹果树、李子树、梨树、香蕉树、柑橘树、猕猴桃树、柠檬树、樱桃树、葡萄树和无花果树。在一个替代实施方案中,gm木本植物选自棉花、竹子和橡胶植物。在另一个实施方案中,本发明提供了基因stt74、stt681、stt632、stt153、stt258、stt387、stt543、stt793和stt795在标记辅助育种中作为候选基因的用途。4.0用于测量植物或木本植物中增强的生长、木材密度和生物量产率的方法提高的生长可通过高度、直径和茎体积来测量。可以计算密度并且可将其用作木材质量的度量。如以下实施例所示,与非gm树木相比,本发明的gm木本植物的高度提高了6%至15%;与非gm树木相比,gm木本植物的直径提高了2%至22%。与非gm树木相比,在gm树木中,提高的茎体积从3%提高至73%。与非gm树木相比,提高的木材密度提高茎密度的1%至15%。改善生长特性的总结见于以下实施例中的表13。为了验证在经修饰的树木中木材质量未发生变化,用ftir分析来自树木的木材。使用多变量分析工具评价数据;并且未注意到显著性差异。总之,可以改善生长特性而不损失木材质量。实施例方法:克隆、转化、表达水平的建立、种间同源基因的鉴定和生长特性的计算详述如下。i基因的选择和种间同源体的选择从来自于毛果杨的基因组测序的数据中提取用于改变和/或修饰关于生长的植物表型的候选基因。将选定的基因(表10)与拟南芥和其他植物物种中的同源基因的序列进行比较,并在一些情况下基于所述序列进行校正。表10.本发明中使用的基因、对应的核苷酸和蛋白质序列及给定的构建体名称的总结鉴定推定的种间同源体和种内同源体基因的方法是分析相同的和不同的植物物种中基因与其相关基因之间的关系。实现这一点的普遍接受和广泛使用的方法是构建系统发生树。系统发生树将揭示相关蛋白质的分组(进化枝),并且根据所使用的算法,其还可显示出进化距离。常常使用blast检索从公共可用的基因组资源(例如phytozome和ncbi)中挑选用于构建树的蛋白质序列。任何给定的检索将为用户提供以由与蛋白质序列的保守区域的序列相似性确定的得分排序的多个命中。为了构建稳健的树,通常的做法是包含来自若干个相关物种的序列。根据查询序列和检索参数(设置),命中数差别很大。通常通过寻找得分/序列相似性的显著下降,为每次检索单独地确定得分截止值。重要的是,还包含与目的基因密切相关但不与其种间同源的基因。使用多重序列比对软件(例如clustalw)将所有选定的序列进行比对。然后可以使用用于系统进化分析的软件(例如mega)使用比对来构建系统发生树。系统发生树将显示对应基因的蛋白质关系的视觉表示。可以预期,种间同源体和种内同源体将形成不同的组并因此被鉴定。例如,使用上述方法来鉴定35s022(stt74)的种间同源基因。对于该实例,检索的数据库是populustrichocarpav3.0、eucalyptusgrandisv1(phytozome数据库的两个部分)以及arabidopsisthalianatair10数据库。从上述检索中选择同源基因并进行进一步分析。将clustalw用作比对算法,并使用mega和邻接法(neighbourjoiningmethod)构建系统发生树。从该分析中,以下基因被鉴定为种内同源和/或种间同源基因:具有氨基酸序列seqidno:22的at4g05060;具有氨基酸序列seqidno:24的at4g21450;具有氨基酸序列seqidno:26的at5g54110;具有氨基酸序列seqidno:16的eucgr.f01073;具有氨基酸序列seqidno:18的eucgr.k00911;具有氨基酸序列seqidno:20的eucgr.d00750;具有氨基酸序列seqidno:8的potri.001g408200;具有氨基酸序列seqidno:10的potri.004g033500;具有氨基酸序列seqidno:12的potri.011g041900;具有氨基酸序列seqidno:14的potri.011g126200;具有氨基酸序列seqidno:4的potri.013g147800;以及具有氨基酸序列seqidno:6的potri.019g116400。与植物中天然存在以及由此通过进化产生的其他同源基因相比,基于氨基酸同一性,对这些基因进行进一步分析以鉴定可用于定义种间同源基因的编码多肽的氨基酸子序列的氨基酸序列同一性水平。为此所选择的区域是这样的区域:与鉴定为不是种间同源基因的基因相比,在系统进化分析中鉴定为种间同源基因的基因之间的同一性水平显示出明显下降。氨基酸同一性分析的结果表明,编码包含如下肽的多肽的基因可以被鉴定为编码与seqidno2的多肽种间同源的多肽的种间同源基因:所述肽分别与seqidno2的第72至267位氨基酸具有高于75%的序列同一性,以及与seqidno2的第84至153位氨基酸具有高于80%的同一性,以及与seqidno2的第122至132位氨基酸具有高于90%的同一性。然后通过使用ncbi非冗余蛋白质序列数据库和上述同一性水平鉴定其他物种的更多种间同源体来测试结果。然后,这些经鉴定的种间同源基因通过将其添加到系统进化分析来证实。ii用于表达stt74多肽的基因的克隆将具有核酸序列seqidno:10(对应于由基因poptr_0019s13890编码的毛果杨多肽)的基因克隆到camv35s启动子控制下的过表达载体中,得到构建体35s022。为了产生cdna模板,从杂交山杨(欧洲山杨×美洲山杨)克隆t89植物取样的茎、叶和树皮组织中分离总rna,并使用superscriptiii第一链合成系统(invitrogen)逆转录成cdna。然后使用phusion高保真dna聚合酶(finnzymes)用基因特异性正向和反向引物通过pcr扩增基因stt74。使用bp重组克隆(invitrogen)将扩增的基因亚克隆到gateway进入载体(pdonr201)中,然后使用gatewaylr重组克隆(invitrogen)进一步亚克隆到二元过表达载体pk2gw7中,其中将基因置于camv35s启动子的控制下。使用具有插入片段的最终pk2gw7载体的限制性酶切来验证克隆的基因。iii用于表达stt632和stt681多肽的基因的克隆如上所述获得cdna。由cdna扩增转录因子基因并通过topo克隆(invitrogen)将其亚克隆到gateway进入载体(pentr/d-topo)中,然后使用gatewaylr重组克隆系统(invitrogen)将所述基因进一步亚克隆到二元过表达载体pk2gw7中,其中将基因置于camv35s启动子的控制下。质粒构建体tfstt052包含具有核酸序列seqidno:27的基因stt681,其对应于类似的毛果杨基因poptr_0001s38090(v3.0更新为potri.001g37200)。质粒构建体tf0137包含具有核酸序列seqidno:37的基因stt632;其对应于毛果杨中的poptr_0013s14960(v3.0更新为potri.013g153400)基因。对克隆的基因进行5’和3’末端测序,并在随后亚克隆到pk2gw7载体中之前使用标准技术进行验证。iv克隆用于制备rnai构建体的基因片段鉴定表11中列出的编码stt153、stt258、stt387、stt543、stt793和stt795的每个选定基因的片段,所述片段位于相关基因的低同源性区域中以提高rnai特异性。由est序列数据设计基因特异性引物以扩增所述基因片段。将est文库克隆用作pcr扩增的模板。根据制造商的推荐,使用bp重组克隆(invitrogen)将扩增的基因片段亚克隆到gateway进入载体(pdonr201)中,随后使用gatewaylr重组克隆(invitrogen)亚克隆到二元rna干扰载体pk7gwiwg2(i)中。可以示意性地描述最终的rnai构建体:[camv35s启动子]-[基因片段(反义方向)]-[内含子]-[基因片段(有义方向)]-[35s终止子]。当转录时,由内含子分开的反向重复序列将形成双链发夹形rna分子。使用具有插入片段的最终pk7gwiwg2(i)载体的限制性酶酶切验证构建体。表11用于rnai构建体的片段基因克隆的rnai片段的序列克隆的rnai片段的长度stt153seqidno.139515stt258seqidno.140313stt387seqidno.141254stt543seqidno.142258stt793seqidno.143274stt795seqidno.144261每个rnai构建体的更多细节如下:ivi用于降低stt153表达的rnai构建体(kr458)在质粒构建体kr458中插入两个拷贝的515个核苷酸长的dna片段(seqidno:139)作为反向重复序列。该片段来自于来自est克隆ub11cpc10的杂交山杨cdna。杨树中通过rnai构建体kr458下调的基因对应于密切相关的毛果杨中编码seqidno:58的多肽的基因poptr_0018s01490(v3.0更新为potri.018g029900)。ivii用于降低stt258表达的rnai构建体(kr546)在质粒构建体kr546中插入两个拷贝的313个核苷酸长的dna片段(seqidno:140)作为反向重复序列。该片段来自于来自est克隆g079p71的杂交山杨cdna。杨树中通过rnai构建体kr546下调的基因对应于密切相关的毛果杨中编码具有seqidno:74的多肽的基因poptr_0013s13090(或v3.0更新为potri.013g127200)。iviii用于降低stt387表达的rnai构建体(kr675)在质粒构建体kr675中插入两个拷贝的254个核苷酸长的dna片段(seqidno:141)作为反向重复序列。该片段来自于来自est克隆a044p01的杂交山杨cdna。杨树中通过rnai构建体kr675下调的基因对应于密切相关的毛果杨中编码seqidno.:88的多肽的基因potri.013g029900基因。iviv用于降低stt543表达的rnai构建体(kr831)在质粒构建体kr831中插入两个拷贝的254个核苷酸长的dna片段(seqidno:142)作为反向重复序列。该片段来自于来自est克隆f129p33的杂交山杨cdna。杨树中通过rnai构建体kr831下调的基因对应于密切相关的毛果杨中编码seqidno:98的多肽的基因potri.009g107600。ivv用于降低stt793表达的rnai构建体(kr892)在质粒构建体kr892中插入两个拷贝的274个核苷酸长的dna片段(seqidno:143)作为反向重复序列。该片段来自于来自est克隆ub30cpg09的杂交山杨cdna。杨树中通过rnai构建体kr892下调的基因对应于密切相关的毛果杨中编码seqidno:106的多肽的基因potri.004g153400。ivvi用于降低stt795表达的rnai构建体(kr894)在质粒构建体kr894中插入两个拷贝的261个核苷酸长的dna片段(seqidno:144)作为反向重复序列。该片段来自于来自est克隆ub30cpg09的杂交山杨cdna。杨树中通过rnai构建体kr894下调的基因对应于密切相关的毛果杨中编码seqidno:128的多肽的基因potri.002g008600。v植物转化将dna构建体转化到农杆菌中并随后转化到杂交山杨中,其中将欧洲山杨×美洲山杨克隆t89(也称为“杨树”)转化和再生。对每个构建体产生约3至8个独立的品系。使用一种构建体产生的一组这样的转基因树在下文中称为“构建组”,例如,来自于一种构建体的不同转基因树。每个构建组中的各转基因品系来自于于不同的转化事件并且很可能在植物基因组中的独特位置插入重组dna。这使得一个构建组内的不同转基因品系部分地不同。例如,已知不同的转化事件将产生具有不同表达水平基因产物的植物。还已知基因的不同表达水平将导致不同的表型效应水平。vi植物培养将转基因杨树品系与其野生型对照(wt)树一起在18小时光周期和22℃/15℃(白天/夜晚)的温度下于温室中进行培养。每周为植物施肥。植物在收获前培养8-9周。在此期间,每周对其高度和直径进行一至两次测量。在培养组中,在相同条件下于温室中平行培养多株野生型树(通常35-45株树)和多株包括若干构建组(通常6-20个构建组)的转基因树。野生型树与构建组之间的所有比较均在每个栽培组内进行。vii生长分析为了鉴定与野生型群体相比表现出显著性差异的构建组,对来自每个构建组的数据进行生长/生物量和木材密度测量的多种生长数据分析。在温室中经过8至9周的生长后,收获树并取样。使用两种主要类型的收获;设计用于例如化学分析、木材形态学分析、基因表达分析、木材密度分析和代谢组学分析的一般设置,或设计用于树皮、木材、叶和根的干重测量的第二设置。在栽培期间以及在植物收获前每周对植物高度和直径的测量值记录一至两次。随后使用最终高度和直径测量值来鉴定具有改变的生长特征的构建组。使用圆锥体体积公式由最终高度和最终直径测量值近似为每个个体植物的茎体积。茎体积近似:其中:v=体积;h=高度(最终高度),r=半径(最终直径/2)随后计算每个构建组群体和对应的野生型群体的最终平均体积。viii再种植和再培养为了验证数据重现性和用于进一步分析,基于来自温室中第一次栽培的生长数据选择具有额外感兴趣的生长特性的构建组品系的全部或亚组,在与第一次温室栽培相同的条件下进行再种植和再培养。所有选定转基因杨树品系一式三份地进行再培养。将表示再种植轮和转基因品系重复的后缀添加到构建组转基因品系的名称中以保持其唯一。ix木材密度分析木材密度是提高生物量产生的重要特征。木材密度的提高提高了每立方米的能量含量,减小了固定量的生物量的体积,并因此例如减小了运输固定量的生物量所需的体积。相应地,每体积可运输更多的生物量。因此,密度提高是令人感兴趣的,即使总生物量不提高。密度提高也可有利地与纸浆和纸生产结合。使用5cm长的茎段(从每个收获植物的土壤的36cm至41cm之间取样,并在收获后储存在冷冻器(-20℃)中)用于密度测量。将待分析的样品解冻,随后除去树皮和髓心。使用天平测量重量(w),并使用阿基米德原理(principleofarchimedes)测定体积(v),其中将木材样品浸入(使用针)具有水的烧杯(置于天平上)中。记录的重量提高等同于木材样品排开的水的重量。由于水的密度为1g/cm3,因此也等同于木材样品的体积。然后将样品于60℃下在烘箱中干燥>48小时。测量干重(dw)并根据计算密度(d)。将来自每个构建组的样品与来自相同栽培的野生型样品进行比较。x表达水平的分析使用实时rt-pcr比较构建组与对应的野生型组的构建体基因表达水平。将26s蛋白酶体调节亚基s2的表达水平用作将构建体基因表达归一化的参考。使用比较性ct方法计算相对构建体基因表达水平,其中构建体与参考基因表达水平之间的比值由(1+e靶标)-ct靶标/(1+e参考)-ct参考描述,其中e靶标和e参考分别为构建体和参考基因pcr扩增的效率,以及ct靶标和ct参考分别为如对于构建体和参考基因扩增所计算的阈值循环。每个经转化品系中上调或下调的基因的mrna表达水平总结于表12中。表12.mrna表达水平的总结xi温室测试结果如上所述分析基因/构建体/构建组。在以下实施例中给出来自用选定基因转化的转基因树的数据以及生长和木材特性特征。对于一些构建组,已测量木材密度,并且对于一些构建组,已基于ft-ir分析进行密度预测(参见表头)。此处应注意并且适用于所有以下数据,转基因与野生型群体之间的比值示出了这些植物组之间的平均差异。然而,其通常不表示修饰基因表达的全部潜力。这是因为计算是基于不同的转基因事件。为了简单的概述,转基因欧洲山杨×美洲山杨克隆t89植物(用表10中的质粒构建体转化,导致由各基因编码的蛋白质的表达增强或降低)的改善生长特性总结于表13中。百分比值是来自以下实施例的分析的构建体与野生型树之间的比值。表13.gm木本植物的改善的生长特性的总结。所提供的值是每个构建体的所有测试品系的平均值。表现最佳的品系可能更好。用于调节木本植物中每个基因的表达的生长结果单独地作为本发明的实施例提供。实施例1:stt74在构建体35s022的不同品系中分析来自基因stt74的mrna的表达水平。如上所述,当用rt-pcr分析时,提高的表达水平是野生型表达水平的16.5至95倍高。35s022构建体已培养三次,并产生了具有显著改善的高度、直径、茎体积和密度值的转基因树。与野生型树相比,在第一栽培中,高度、直径、茎体积和密度分别平均提高15%、22%、73%和15%。与野生型树相比,在第二栽培中,高度平均提高14%。与野生型树相比,在第三栽培中,高度和茎体积分别平均提高12%和25%。与野生型树相比,转基因品系35s022bio-1b的高度和茎体积分别提高10%和25%。与野生型树相比,转基因品系35s022bio-2b的高度和茎体积分别提高24%和46%。实施例2:stt681在构建体tfstt052的不同品系中分析来自基因stt681的mrna的表达水平。如上所述,当用rt-pcr分析时,提高的表达水平是野生型表达水平的9.9至38倍。与野生型树相比,tfstt052构建体产生了密度显著提高15%的转基因树。实施例3:stt632在构建体tf0137的不同品系中分析了来自基因stt632的mrna的表达水平。如上所述,当用rt-pcr分析时,提高的表达水平是野生型表达水平的1.5至1.8倍。与野生型树相比,tf0137构建体产生了高度平均显著提高15%的转基因树。实施例4:stt153在构建体kr458的不同品系中分析来自基因stt153的mrna的表达水平。如上所述,当用rt-pcr分析时,降低的表达水平为野生型表达水平的42.3%至85.7%。与野生型树相比,kr458构建体产生了具有显著改善的直径和茎体积值的转基因树,其中直径和茎体积分别平均提高10%和31%。实施例5:stt258在构建体kr546的不同品系中分析来自基因stt258的mrna的表达水平。如上所述,当用rt-pcr分析时,降低的表达水平为野生型表达水平的6.5%至97.5%。与野生型树相比,kr546构建体产生了具有显著改善的高度和茎体积值的转基因树,其中高度和茎体积分别平均提高16%和35%。实施例6:stt387在构建体kr675的不同品系中分析来自基因stt387的mrna的表达水平。如上所述,当用rt-pcr分析时,降低的表达水平为野生型表达水平的37.0%至74.4%。kr675构建体已培养两次,并产生了具有显著改善的高度、直径和茎体积值的转基因树。与野生型相比,在第一栽培中,高度、直径和茎体积值分别平均提高11%、21%和59%。在与野生型树相比,在第二栽培中,高度提高8%。实施例7:stt543在构建体kr831的不同品系中分析来自基因stt543的mrna的表达水平。如上所述,当用rt-pcr分析时,降低的表达水平为野生型表达水平的7.0%至66.2%。与野生型树相比,kr831构建体已产生密度平均显著提高11%的转基因树。实施例8:stt793在构建体kr892的不同品系中分析来自基因stt793的mrna的表达水平。如上所述,当用rt-pcr分析时,降低的表达水平为野生型表达水平的18.2%至94.1%。与野生型群体平均值相比,kr892构建体产生了高度和茎体积提高高至17%和55%的转基因品系。实施例9:stt795在构建体kr894的不同品系中分析来自基因stt795的mrna的表达水平。如上所述,当用rt-pcr分析时,降低的表达水平为野生型表达水平的33.6%至35.1%。与野生型树相比,kr894构建体产生了具有显著改善的高度、直径和茎体积值的转基因树,其中高度、直径和茎体积分别平均提高7%、8%和24%。实施例10:具有包含具有seqidno:1并编码stt74多肽的转基因之品系的杂交山杨的田间试验建立杂交山杨田间试验以进一步研究转基因树在田间条件下的改善的生长特性。每个田间试验包括来自7至16种基因构建体的植物和约20%野生型(wt)参考植物。对于每种基因构建体,选择3至6个转基因植物品系(各自来自于于不同的转化事件)进行田间试验。转基因植物品系各自以8至20次重复进行繁殖。按照随机区组设计将转基因植物品系分布在田间。在田间中,将所有植物在3×3米坐标系中分离以进行单个细胞植物设计。只要有可能,将田间试验分成两个单独的实验地点(experimentalsite),其彼此远离并且在环境特征上略有不同。根据标准农业操作(例如盘式耙地(discharrowing)和基于草甘膦的除草剂处理),准备田间场地并使其均质化。杂交山杨田间试验开始于2011年并计划继续进行5年。在此期间,应定期监测和分析生长特性。在两个生长季之后,初步结果示出转基因植物品系与野生型之间高至29%的提高的高度,另参见表14。表14.两个生长季后杂交白杨的提高的生长高度2012年8月高度2013年9月实施例11:表达编码stt74多肽的构建体35s022的gm木本植物的木材的性质对来自用表达具有seqidno:1的多肽(stt74)之35s022构建体转化的三株gm山杨品系的木材样品进行分析以确定它们对预处理和酶促糖化的敏感性。转基因品系被称为1a、1b和2b,或者h12.1、h12.2和h12.3。作为对照,使用称为“野生型”的t89杂交山杨。使用酸水解(用于木材生物质的现有技术方法)进行预处理。实验方案预处理:将野生型和转基因山杨品系(t89和转基因品系1a、1b和2b)的木材研磨成粉末。使用酸催化剂[1%(w/w)硫酸],使用单模式微波系统(initiatorexp,biotage,uppsala,sweden)对总重量为1000mg的反应混合物中的50mg木材粉末进行预处理。预处理在165℃下进行10分钟。在预先称重的微量离心管中,通过在14,100g下离心15分钟来分离固体和液体级分。收集称为预处理液的液体级分进行分析,同时在酶水解之前将固体级分用1ml去离子水洗涤两次,并用1ml柠檬酸钠缓冲液(50mm,ph5.2)洗涤一次。测定来自预处理的残留经洗涤固体的重量。酶水解:将柠檬酸钠缓冲液(50mm,ph5.2)和由相等比例的celluclast1.5l和novozyme188[获自sigma-aldrich(st.louis,mo,usa)]组成的50mg酶混合物添加至经预处理或未经预处理的木材,使得反应混合物的总重量为1000mg。具有未经预处理的木材的反应混合物由50mg磨碎木材、900mg柠檬酸钠缓冲液和50mg酶混合物组成。将反应混合物在45℃下于设定为170rpm的定轨振荡器(ecotron培养箱振荡器,infors,bottmingen,switzerland)中孵育72小时。2小时后,取出用于分析反应早期期间葡萄糖形成(葡萄糖产生速率,glucoseproductionrate,gpr)的样品。使用高效阴离子交换层色谱法(high-performanceanion-exchangechromatography,hpaec)分析72小时后剩余的液体。水解产物的分析:使用葡萄糖计测量酶促反应早期(前2小时)期间的葡萄糖浓度。通过使用hpaec测定预处理液和酶水解72小时后采集的样品中的单糖(阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖)的产率。hpaec系统(离子色谱系统ics-3000,dionex,sunnyvale,ca,usa)配备有pad(脉冲电流检测,pulsedamperometricdetection)单元。使用配备有carbopacpa20保护柱(3×30mm)(dionex)的carbopacpa20柱(3×150mm)(dionex)进行分离。注射前,将样品通过0.2μm尼龙过滤器过滤。装载10μl的体积。在27分钟期间用2mm氢氧化钠溶液进行糖的洗脱,随后用100mm氢氧化钠再生5分钟,并用2mm氢氧化钠平衡15分钟。流速为0.4ml分钟-1。用设置在金标准pad波形上的检测器并用ag/agcl作为参比电极进行单糖的脉冲电流检测。通过比较含有阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖(sigma-aldrich)的标准物来鉴定和量化峰。预处理液和酶水解产物中的糖产率分别报告为预处理后和酶水解72小时后的g糖/g木材。乙酸分析:通过使用ics-3000系统和电导率检测器(dionex)测定乙酸(预处理液中的乙酸和酶水解产物中的乙酸)的浓度。用配备有ag15(4×50mm)保护柱(dionex)的as15(4×250mm)分离柱进行分离。流动相由35mm氢氧化钠溶液(ic,sigma-aldrich的氢氧化钠溶液)组成,并且流速为1.2ml分钟-1。碳水化合物分析:在30℃下,用硫酸[3ml,72%(w/w)]将100mg(干重)的木材粉末水解1小时。使用去离子水将反应混合物稀释至2.5%硫酸,并在120℃下高压灭菌1小时。离心(14,000g,20分钟)后,收集上清液并使用ics-3000系统对单糖含量进行分析。结果葡萄糖产生速率:葡萄糖产生速率(gpr)(即,在酶促反应的初始阶段期间形成的葡萄糖)示于图1中。在没有预处理的情况下,转基因品系的平均gpr(3.23gl-1小时-1)比野生型的gpr(2.87gl-1小时-1)高13%,但差异不具有统计学显著性(p<0.05)。在预处理的情况下,三个转基因品系的平均gpr为8.65gl-1小时-1,而野生型的gpr仅为7.45gl-1小时-1。转基因品系的gpr的该16%提高显著(p<0.05)高于野生型的gpr。单糖和乙酸的产率:图1示出了酶水解物和预处理液中的单糖和乙酸的产率。该表还示出了当将不同分数的糖添加到一起(即,单独地)总计时以及分为戊糖(阿拉伯糖和木糖)和己糖(半乳糖、葡萄糖和甘露糖)时的单糖产率。在没有预处理的情况下,h12.1显示出葡萄糖产率较野生型高43%且甘露糖产率较野生型高28%(p<0.05)。品系h12.3显示出甘露糖产率较野生型高23%(p<0.05)。转基因品系的平均葡萄糖产率比野生型葡萄糖产率高28%(p<0.06)。预处理后的产率差异不显著(表15)。这可以归因于以下事实:与在经预处理的样品的产率的测量中相比,在gpr(均对于未经预处理和经预处理的样品)的测量中以及在未经预处理的样品的产率的测量中水解较少的糖类。糖类含量分析:图2示出了转基因和野生型杂交山杨的糖类含量。转基因品系与野生型之间的差异很小。这与py-gc-ms数据一致,该数据还示出了转基因品系与野生型之间的微小差异(表16)。总之,由于化学组成的差异很小,所以转基因品系的纤维素对聚合物木材结构的酶切割和解构显著更敏感。表16转基因品系和野生型的py-gc/ms分析实施例12:通过表达编码stt632种间同源体的转基因来增强拟南芥的生长基于系统进化分析,stt632(tf0137)的种间同源体对应于具有核酸序列seqidno:53的拟南芥中的基因at2g38470。编码氨基酸序列seqidno:54的该种间同源体基因克隆为在产生构建体attf0137(其在植物中过表达)的35s启动子的控制下。方法克隆at2g38470基因:基于其已知序列,合成拟南芥at2g38470基因的编码序列(genseript),侧翼为用于随后的gateway克隆的重组位点。使用gatewaylr重组克隆(invitrogen)将合成的基因亚克隆到二元过表达载体pk2gw7中,其中将基因置于camv35s启动子的控制下。使用具有插入片段的最终pk2gw7载体的限制性酶切以及通过测序来验证克隆的基因。植物转化:用转化方法花浸蘸(floraldip)将构建体attf0137转化到拟南芥col-0中。植物培养:将attf0137的转基因拟南芥品系与其野生型对照(col-0)植物一起在生长室中短日照(8小时)培养。每周为植物施肥。植物在收获前培养3周。在此期间,每周测量一次莲座(rosette)的直径。结果在下表中提供了用选定基因转化的转基因拟南芥植物的莲座的所测量直径。与wtcol-0植物相比,两种品系attf0137-品系2和品系4表现出显著提高的生长。表17.拟南芥的提高的生长当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1