用于治疗威尔森病的核酸构建体和基因治疗载体的制作方法
本发明涉及用于治疗威尔森病和其他病症的核酸构建体和基因治疗载体。
背景技术:
关于威尔森病的基因治疗的技术现状由merle等(currentgenetherapy2007;7:217-220)综述,在本文中总结并用之后公开的文献完善。
威尔森病(wd)是铜代谢的常染色体隐性遗传性,其平均患病率为1:30,000。wd由编码位于13号染色体上的p型铜转运atpase的atp7b基因的突变引起。atp7b主要在肝细胞中表达,并在铜的跨膜转运中起作用。atp7b蛋白的缺乏或功能降低导致肝细胞排入胆汁中的铜减少,并导致铜主要在肝脏中积聚,随后在神经系统和其他组织中积聚。失去功能性atp7b蛋白的另一个后果是无法将铜整合入铜蓝蛋白。
wd临床上可以呈现为肝病、进行性神经疾病或精神病。肝wd患者通常在儿童期或青春期后期呈现,表现出急性肝炎、暴发性肝衰竭或进行性慢性肝病的特征。wd的神经病学表现通常晚于肝病,最常见于第二十年或第三十年,包括与锥体外系、小脑和脑相关的症状。
wd药物治疗的目的是除去体内的有毒铜沉积,并预防其再积聚。目前已经批准了用于wd的三种抗铜药:d-青霉胺、三文胺和锌盐。药物疗法在大多数但不是所有wd患者中有效。肝移植是出现暴发性肝衰竭或进行性肝衰竭的wd患者的一个治疗选择。已经表明它可以纠正wd表型,并提供优异的长期生存期。
然而,治疗中断或治疗不足可能导致几个月内死亡。由于wd药物必须定期服用,因此一些患者,特别是青少年wd患者的治疗依从性较差。
在治疗过程中,残留神经症状相对较常见,甚至可能发生进行性症状。因为目前的药物治疗选择并不是对所有wd患者都有效且治疗依从性是一个问题,更全面的解决方案可能涉及基因治疗。
理论上,在肝细胞中表达野生型atp7b将逆转所有疾病相关的异常,并拯救肝脏和神经症状。wd的理想基因治疗的最终目标是在终身持续的时间内将足够量的atp7b特异性递送至肝细胞。
所有公开的关于wd的腺病毒基因转移的研究均使用仅产生瞬时转基因表达的早代腺病毒载体。terada等[terada等j.biol.chem.1998;273:1815-1820;terada等febslett.1999;448:53-56]通过在lec大鼠模型中腺病毒介导的基因递送证明了成功的基因转移。显示恢复了全血铜蓝蛋白合成、血清铜蓝蛋白氧化酶活性和铜排入胆汁中,表明了基因转移的治疗效果。这些效果的持续时间非常有限,在第三天水平最高,此后下降。ha-hao等[z.gastroenterol.2002;40:209-216]也证明了腺病毒介导的atp7b基因转移后,lec大鼠的粪便中铜含量增加,表明排入胆汁中的铜增加。全血铜蓝蛋白及其铁氧化酶活性的恢复也证明了治疗效果。然而,再一次,这些实验中的治疗效果的持续时间仅仅是瞬时的,有限的持续几天。
目前为止还没有测试用于该应用的无肠腺病毒载体。
迄今为止,其他常用的非整合病毒载体系统腺相关病毒(aav)也没有测试用于wd,主要是因为在aav载体内(其包装能力为4.4-4.7kb)atp7b基因(约4.4kb大)留下用于分配其余所需序列(例如启动子、聚a信号序列等)的空间最小。德国专利申请de100156121a1(公开于2003)提出了一种用于wd基因治疗的重组腺相关病毒载体,其具有缩短的金属敏感启动子(金属硫蛋白-i启动子)以产生铜或锌可诱导的atp7b转基因表达。然而,该文献没有提供,之后也没有公开关于该载体的疗效和性能的任何信息。
另一方面,已经在wd的动物模型中测试了几种携带野生型atp7b的慢病毒载体。merle等[scan.j.gastroenterol.2006;41:974-982]报道了具有慢病毒载体的lec大鼠中的系统性基因治疗,所述慢病毒载体在磷酸甘油激酶启动子控制下表达atp7b。与未处理对照相比,基因转移24周后,经处理大鼠中的肝脏铜含量显著降低且肝组织学改善,但效果仅仅是部分的。与对照相比,基因转移2周后,血清铜蓝蛋白氧化酶活性增加,但在处理后24周降低至较低水平。最近,roybal等[genetherapy2012;19:1085-1094]报告了在肝特异性启动子的转录控制下携带人atp7b的慢病毒在atp7b-/-小鼠中的早期妊娠基因转移,其含有载脂蛋白e和α-1抗胰蛋白酶元件。子宫内施用该载体提供肝铜水平的降低、正常肝脏组织学的保留、铜整合入铜蓝蛋白中的恢复以及胆固醇生物合成的改善。然而,治疗的功效在不同小鼠间是非常可变的,随着时间而下降,且从未完全纠正不同病理改变的参数。
发明简述
发明人已经工程化并测试了几种携带编码不同截短形式的酶atp7b的转基因的病毒载体:例如编码atp7b(d223-366)[atp7b-t1]的载体aav2/8aat-atp7b(d223-366);和编码atp7b(d57-486)[atp7b-t2]的载体aav2/8aat-atp7b(d57-486)。当向atp7b敲除小鼠(一种威尔森病的公认动物模型)施用时,在处理至少24周后,携带atp7b-t2的aav载体纠正了威尔森病的主要病理特征,而携带atp7b-t1的aav载体仅具有部分效果。在用aav2/8aat-atp7b(d57-486)载体处理的威尔森病小鼠中,cu排出(cu尿含量)和肝cu含量显著降低,且铜蓝蛋白活性显著恢复。另一方面,施用载体导致血清转氨酶水平和肝组织学正常化,同时炎性浸润、胆管增生和纤维化明显降低。
此外,已经表明对于获得血清铜蓝蛋白活性的正常化和肝脏中cu积聚的降低两者,每只小鼠1x1010vgaav2/8-aat-wtatp7b载体的剂量是wt构建体的“次优剂量”(图10a和11a);且已经表明所述次优剂量的携带截短形式的载体提供统计学显著的治疗效果(vs未处理)(图10b和11b)。并且,还表明对于这两种治疗效果而言,在剂量为1x1010vg/小鼠的全长atp7b和t2构建体之间观察到的活性差异是统计学显著的(图12和图14)。
这些观察结果表明,编码截短形式的atp7b(d57-486)的核酸构建体和携带它的载体(尤其是aav载体)均能够克服与atp7b缺乏或功能障碍相关的铜积聚的最相关的病理作用,因而非常适于用于以下的基因治疗:由铜转运atpase2缺乏或功能障碍引起的病症,例如威尔森病,或与atp7b依赖性溶酶体胞吐作用减少和铜积聚相关的疾病和/或病症。此外,出乎意料地,已经表明一定剂量的截短形式的atp7b(d57-486)和携带它的载体实现了这些疾病的病理学表现的一些的正常化,而所述剂量的全长atp7b蛋白和编码该蛋白的载体证明效果较差。
因此,本发明的第一个方面涉及核酸构建体(以下也称为“本发明的核酸构建体”),其包含:a)真核启动子的核苷酸序列;b)编码截短的铜转运atpase2(atp7b)的核苷酸序列,其中n末端重金属相关位点hma1、hma2、hma3和hma4完全缺失,且hma5和hma6保持不缺失;和c)聚腺苷酸化信号序列。
在另一个反面,本发明涉及包含本发明的核酸构建体的表达载体(以下也称为“本发明的表达载体”)。
在另一个方面,本发明涉及包含本发明的核酸构建体或表达载体的宿主细胞。
在另一个方面,本发明涉及包含本发明的核酸构建体或表达载体的病毒颗粒(以下也称为“本发明的病毒颗粒”)。优选地,核酸构建体组成病毒载体的基因组序列。
在另一个方面,本发明涉及包含本发明的产品(即包含本发明的核酸构建体的产品)和药学上可接受的载体的药物组合物。如本文所用,术语“本发明的产品”是指且无区别地涵盖任何以下:a)本发明的核酸构建体;b)本发明的表达载体;c)本发明的宿主细胞和d)本发明的病毒颗粒。
在另一个方面,本发明还涉及在一个或多个容器中包含本发明的核酸构建体、载体、宿主细胞、病毒颗粒或药物组合物的试剂盒。
在另一个方面,本发明涉及用于医药的本发明的产品(用作药物或医药组合物)。这种在医药中的用途包括治疗由铜转运atpase2缺乏或功能障碍引起的病症。换言之,本发明涉及:本发明的产品在制备用于治疗由铜转运atpase2缺乏或功能障碍引起的病症的药物中的用途;和用于治疗受试者或患者中由铜转运atpase2缺乏或功能障碍引起的病症的方法,包括向所述受试者或患者施用治疗有效量的本发明的产品。在一个更具体的方面,本发明的产品用于治疗威尔森病。
在另一个方面,本发明进一步涉及包含如上所述的本发明的产品的药物组合物在如上所述的医药和治疗方法中提议的用途。
甚至在进一步的方面,本发明涉及生产本发明的病毒颗粒的方法,包括以下步骤:
a)在培养基中培养含有本发明的核酸构建体或表达载体的宿主细胞;和
b)在细胞培养上清液和/或细胞内收获病毒颗粒。
在一个相关的方面,本发明涉及本发明的核酸构建体或本发明的表达载体在生产病毒颗粒中的用途。
附图说明
图1:以下核酸构建体的示意图:携带人atp7b的载体aav2/8aatwtatp7b;携带截短形式的atp7b(d223-366)[atp7b-t1]的载体aav2/8aat-atp7b(d223-366);和携带截短的atp7b(d57-486)[atp7b-t2]的载体aav2/8aat-atp7b(d57-486)。构建体的元件是:a)α-1-抗胰蛋白酶基因启动子(aat);b)分别编码人atp7b、atp7b-t1或atp7b-t2的核苷酸序列;c)聚腺苷酸化信号(pa);和载体基因组侧翼的d)aav2的反向末端重复序列(itr)。
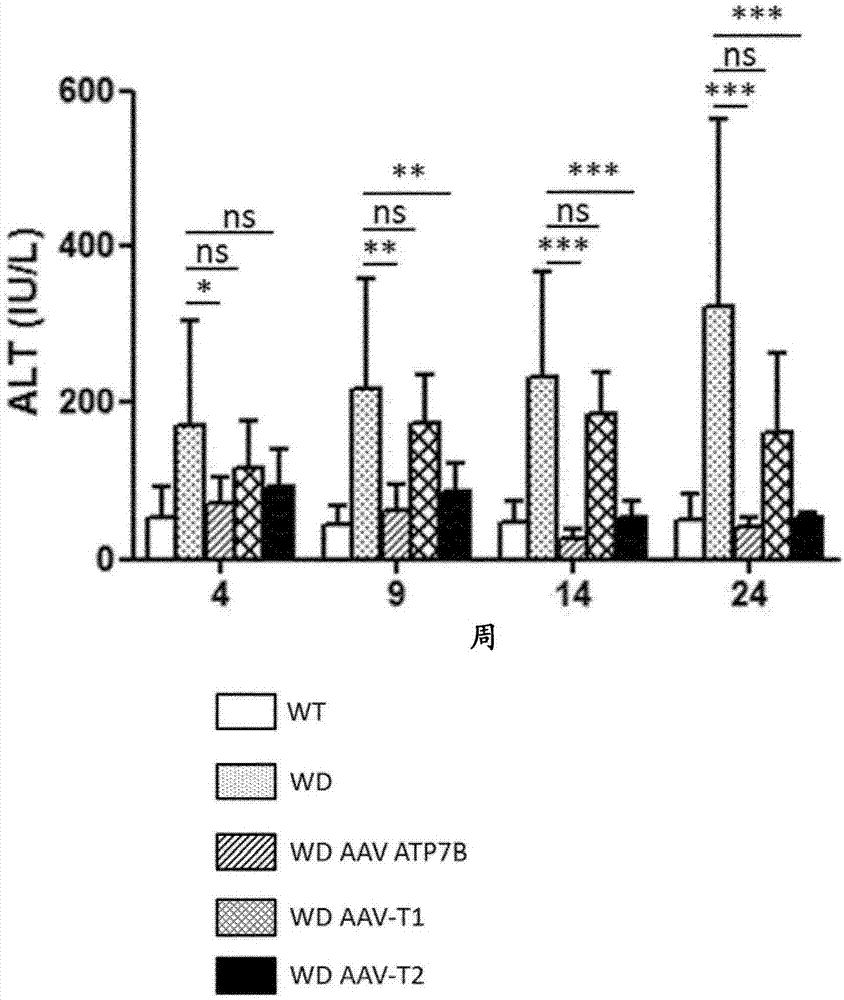
图2::野生型雄性小鼠[wt]、atp7b缺乏雄性小鼠[威尔森病小鼠,wd]和用载体aav2/8-aat-wtatp7b[wdaav-atp7b]、aav2/8-aat-atp7b(d223-366)[wdaav-t1]或aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雄性小鼠的血清丙氨酸转氨酶(alt)水平。当动物6周大时,以3x1010vg/小鼠的剂量施用载体。在处理后4、9、14和24周[周]测量alt水平,并表示为iu/l(iu:国际单位)。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图3:野生型雄性小鼠[wt]、威尔森病雄性小鼠[wd]和用载体aav2/8-aat-wtatp7b[wdaav-atp7b]、aav2/8-aat-atp7b(d223-366)[wdaav-t1]或aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雄性小鼠的总尿铜含量。载体剂量:3x1010vg/小鼠。在处理后4、9、14和24周[周]测量24小时尿中的铜含量,并表示为纳克铜(ngr/24h)。
图4:野生型雄性小鼠[wt]、威尔森病雄性小鼠[wd]和用载体aav2/8-aat-wtatp7b[wdaav-atp7b]、aav2/8-aat-atp7b(d223-366)[wdaav-t1]或aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雄性小鼠的血清铜蓝蛋白活性。载体剂量:3x1010vg/小鼠。在处理后4周测量铜蓝蛋白活性,并表示为570nm波长处的吸光度[abs(570nm)]。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图5:野生型雄性小鼠[wt]、威尔森病雄性小鼠[wd]和用载体aav2/8-aat-wtatp7b[wdaav-atp7b]、aav2/8-aat-atp7b(d223-366)[wdaav-t1]或aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雄性小鼠的肝cu含量。载体剂量:3x1010vg/小鼠。处理后24小时处死动物,并通过原子吸收光谱法测定铜含量;并表示为μg/g(cuμg/g干燥干组织)。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图6:野生型动物雄性小鼠[wt]、威尔森病雄性小鼠[wd]和用载体aav2/8-aat-wtatp7b[wdaav-atp7b]、aav2/8-aat-atp7b(d223-366)[wdaav-t1]或aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雄性小鼠的肝脏组织学图像。载体剂量:3x1010vg/小鼠。处死小鼠后(30周龄)拍摄图像。a:用苏木精和曙红染色的肝切片图像。b:用检测铜沉积的timm硫化银技术染色的组织学样品的图像。
图7:肝脏炎症、胆管增生和纤维化的分析。野生型雄性小鼠[wt]、威尔森病雄性小鼠[wd]和用载体aav2/8-aat-wtatp7b[wdaav-atp7b]、aav2/8-aat-atp7b(d223-366)[wdaav-t1]或aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雄性小鼠的肝脏图像。载体剂量:3x1010vg/小鼠。处死小鼠后(30周龄)进行分析。cd45:用检测肝脏炎性浸润的抗cd45免疫染色的肝切片图像。panck:用检测胆管增生的抗panck免疫染色的肝切片图像。sr:用检测纤维化的天狼星红染色的肝切片图像。
图8:野生型雌性小鼠[wt]、wd雌性小鼠[wd]和用载体aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雌性小鼠的血清丙氨酸转氨酶(alt)水平。向不同组的6周大wd雌性小鼠施用不同剂量的载体(分别为1x1010、3x1010、1x1011vg/小鼠)。在处理后4、9、14和24周[周]测量alt水平,并表示为iu/l(iu:国际单位)。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图9:野生型雌性小鼠[wt]、wd雌性小鼠[wd]和用载体aav2/8-aat-atp7b(d57-486)[wdaav-t2]处理的wd雌性小鼠的尿cu含量水平。向不同组的6周大wd雌性小鼠施用不同剂量的载体(分别为1x1010、3x1010、1x1011vg/小鼠)。在处理后4、9、14和24周[周]测量尿铜含量水平,并表示为24小时尿中的纳克铜(ngr/24h)。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图10:测量野生型雌性小鼠[wt]、wd雌性小鼠[wd]和用载体aav2/8-aat-atp7b(d57-486)[wd+aav-t2]或载体aav2/8-aat-wtatp7b[wd+aav-atp7b]处理的wd雌性小鼠的血清中的铜蓝蛋白活性。对于各实验组,向不同组的6周大wd雌性小鼠施用不同剂量的载体(分别为1x1010、3x1010、1x1011vg/小鼠)。在处理后4周测量铜蓝蛋白活性,并表示为570nm波长处的吸光度[abs(570nm)]。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图11:测量野生型雌性小鼠[wt]、wd雌性小鼠[wd]和用载体aav2/8-aat-wtatp7b[wdaavatp7b]或载体aav2/8-aat-atp7b(d57-486)[wdaavt2]处理的wd雌性小鼠的肝cu含量。对于各实验组,向不同组的6周大wd雌性小鼠施用不同剂量的载体(分别为1x1010、3x1010、1x1011vg/小鼠)。在处理后24周测量铜浓度;并表示为μg/g干燥组织。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图12:野生型雄性小鼠[wt,n=15]、wd雄性小鼠[wd,n=25]和用载体aav2/8-aat-wtatp7b[wdaavatp7b,n=7]或载体aav2/8-aat-atp7b(d57-486)[wdaavt2,n=7]处理的wd雄性小鼠的肝cu含量。对于各实验组,当动物6周大时,向wd小鼠施用次优剂量的载体(1x1010vg/小鼠)。在处理后24周测量铜浓度,并表示为μg/g干燥组织。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图13:野生型雄性小鼠[wt,n=15]、wd雄性小鼠[wd,n=25]和用载体aav2/8-aat-atp7b(d57-486)[wdaavt2,n=13]或载体aav2/8-aat-coatp7b(d57-486)[wdaavcot2,n=4]处理的wd雄性小鼠的肝cu含量。对于各实验组,向6周龄wd雄性小鼠施用次优剂量的载体(1x1010vg/小鼠)。在处理后24周测量铜浓度,并表示为μg/g干燥组织。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
图14:野生型雄性小鼠[wt,n=15]、wd雄性小鼠[wd,n=25]和用载体aav2/8-aat-wtatp7b[wdaavatp7b;n=10]、aav2/8-aat-coatp7b[wdaavcoatp7b;n=8]、aav2/8-aat-atp7b(d57-486)[wdaavt2;n=13]和aav2/8-aat-coatp7b(d57-486)[wdaavcot2;n=4]处理的wd雄性小鼠的血清中的铜蓝蛋白活性。对于各实验组,向6周龄wd雄性小鼠施用次优剂量的载体(1x1010vg/小鼠)。在处理后4周测量铜蓝蛋白的氧化酶活性,并表示为570nm波长处的吸光度[abs(570nm)]。。ns:不显著;*:p<0.05,**:p<0.01;***:p<0.001[mann-whitney非配对检验]。
发明详述
除非另有说明,在本申请中使用的所有术语应当理解为本领域中已知的其通常含义。本申请中所用的一些术语的其他更具体的定义如下所述,且意欲适用于说明书全文和权利要求,除非明确规定的定义提供更广泛的定义。
术语“核酸序列”和“核苷酸序列”可以交替使用,是指由单体核苷酸组成或包含单体核苷酸的任何分子。核酸可以是寡核苷酸或多核苷酸。核苷酸序列可以是dna或rna。核苷酸序列可以是化学修饰的或人工的。核苷酸序列包括肽核酸(pna)、吗啉代锁核酸(lna)以及乙二醇核酸(gna)和苏糖核酸(tna)。这些序列中的每一个与天然存在的dna或rna的区别在于分子骨架的变化。也可以使用硫代磷酸核苷酸。其他脱氧核苷酸类似物包括甲基磷酸酯、氨基磷酸酯、二硫代磷酸酯、n3'p5'-氨基磷酸酯和寡核糖核苷酸硫代磷酸酯以及可以用于本发明的核苷酸的它们的2'-o-烯丙基类似物和2'-o-甲基核糖核苷酸甲基磷酸酯。
如本文所用,术语“核酸构建体”是指由使用重组dna技术产生的人造核酸分子。核酸构建体是单链或双链核酸分子,其已经被修饰为包含以一种方式组合和并列的核酸序列区段,并且在自然界中不存在。核酸构建体一般是“载体”,即用于将外源产生的dna递送至宿主细胞的核酸分子。
如本文所用,术语“表达载体”或“载体”是指能够在与重组核苷酸序列相容的宿主细胞或宿主生物中影响基因(转基因)表达的重组核苷酸序列。与转基因一起,表达载体通常包括至少合适的转录调控序列和任选的3’转录终止信号。也可以存在影响表达所需的或有助于影响表达的其他因子,例如能够响应精确诱导信号(内源或嵌合转录因子)或对某些细胞、器官或组织具有特异性的表达增强元件。
如本文所用,术语“受试者”或“患者”是指哺乳动物。可以受益于公开的治疗方法的哺乳动物物种包括但不限于:人、非人灵长类如类人猿、黑猩猩、猴子和猩猩、驯养动物包括狗和猫、以及家畜如马、牛、猪、绵羊和山羊,或其他哺乳动物物种,包括但不限于小鼠、大鼠、豚鼠、兔、仓鼠等。
如本文所用,术语“包装细胞”是指可以用辅助载体或病毒或dna构建体转染,并且反式提供病毒载体的完整复制和包装所需的所有缺失功能的细胞或细胞系。通常,包装细胞以组成型或可诱导的方式表达一种或多种所述缺失的病毒功能。
本发明的核酸构建体
真核启动子的核苷酸序列
如本文所用,术语“真核启动子”是指在真核细胞中启动特定基因、或一个或多个编码序列的转录的dna序列区域。启动子可以与其他调控区域或元件协同作用以指导基因或编码序列的转录水平。这些调控元件包括但不限于:转录因子结合位点、抑制子和激活子蛋白结合位点和本领域技术人员已知的直接或间接作用于调控从启动子转录的量的任何其他核苷酸序列,包括例如衰减子、增强子和沉默子。启动子位于与其可操作连接的基因或编码序列的转录起始位点附近,并且位于dna序列的相同链和上游(向着有义链的5区’)。启动子的长度可以为约100-1000个碱基对。对于特定基因,启动子中的位置相对于转录起始位点命名(即,上游位置是从-1开始计数的负数,例如-100是指上游100个碱基对的位置)。
术语“核心启动子”或“最小启动子”是指正确启动转录所需的最少部分的启动子序列。它包括转录起始位点(tss)和直接上游的元件;rna聚合酶(rna聚合酶ii)的结合位点;和一般转录因子结合位点。通常,启动子还包含近端启动子序列(核心启动子上游),其包含其他主要调控元件(例如增强子、沉默子、边界元件/绝缘子);和远端启动子序列(核心启动子下游),其可以包含额外的调控元件,通常对于基因的转录水平的影响较弱。
根据本发明,真核启动子序列与编码截短的铜转运atpase2的核苷酸序列可操作连接。如本文所用,术语“可操作连接”是指以功能性关系连接多核苷酸(或多肽)元件。当核酸与另一个核酸序列置于功能性关系时,它是“可操作连接”的。例如,如果启动子或转录调控序列影响编码序列的转录,则它与所述编码序列可操作连接。可操作连接意味着连接的dna序列通常是连续的;当需要连接两个蛋白编码区时,它们是连续的且在阅读框中。
根据本发明,核酸构建体的真核启动子序列包含至少核心启动子和任选的相同基因或不同基因的其他调控区或元件(即杂合或嵌合启动子)。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,真核启动子是组成型启动子、组织特异性启动子或诱导型启动子。
如本文所用,术语“组成型”启动子是在大多数真核组织中,在大多数生理和发育条件下具有活性的启动子。
“组织特异性启动子”是仅在特定类型的组织或细胞中具有活性的启动子。换言之,在本发明的上下文中,组织特异性启动子是在一种或几种特定组织(例如两种、三种或四种)比在其他组织中更有活性的启动子(即,启动子能够在其具有特异性的组织中比在其他组织中驱动与其可操作连接的编码序列的更高表达)。通常,“组织特异性”启动子下游的基因在该启动子具有特异性的组织中的活性程度比在任何其他组织中高得多。这种情况下,启动子在除了其具有特异性的组织之外的任何其他组织中的活性非常小或基本上没有。
“诱导型”启动子是例如通过应用化学诱导剂生理或发育调控的启动子。
很多启动子是本领域已知的[sambrookandrussell(molecularcloning:alaboratorymanual;thirdedition;2001coldspringharborlaboratorypress);andgreenandsambrook(molecularcloning:alaboratorymanual,cuartaedición,2012coldspringharborlaboratorypress)]。
合适的组织特异性启动子可发现于组织特异性启动子数据库,tiprod(nucleicacidsresearch2006;j4:d104-d107)。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,真核启动子是肝特异性启动子。在本发明上下文中,“肝特异性启动子”是在肝脏中比在机体的任何其他组织中更有活性的启动子。通常,肝特异性启动子在肝脏中的活性比在其他组织中大得多。例如,这种启动子可以是至少2倍、至少3倍、至少4倍、至少5倍或至少10倍更有活性(例如与其在其他细胞或组织中驱动表达的能力相比,测定其在给定组织中驱动表达的能力)。因此,肝特异性启动子允许与其连接的基因在肝脏中的活性表达,并防止其在其他细胞或组织中表达。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,真核启动子是α1-抗胰蛋白酶基因启动子(aat)的核苷酸序列或包含与白蛋白基因增强子元件(ealb)组合的α1-抗胰蛋白酶基因启动子序列(aat或pa1at)的嵌合启动子序列ealbpa1at。两个启动子序列均具有肝特异性启动子的性能。
在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,真核启动子序列是seqidno:1(aat)的碱基156-460;或seqidno:5(ealbpa1at)限定的序列。
截短的铜转运atpase2(atp7b)
铜转运atpase2(atp7b)是在将铜输出细胞中发挥功能的p型阳离子转运atpase。
编码人酶的基因位于13号染色体(染色体位置13q14.3;基因名称atp7b)。关于人atp7b多肽的信息(氨基酸序列、结构、结构域和其他特征)例如可从uniprot通过登录号p35670获得(http://www.uniprot.org/uniprot/p35670;entryversion168(03sep2014),sequenceversion4(16jun2009))。关于编码该酶的atp7b基因的信息可从entrez通过登录号基因id:540获得(http://www.ncbi.nlm.nih.gov/gene/540;2014年9月19日更新)。已经描述了atp7b选择性剪切产生的4种亚型;选择亚型1(鉴定号p35670-1,1465个氨基酸长)作为标准序列。
在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,本发明的核酸构建体包含编码截短形式的人atp7b,优选其氨基酸序列是标准序列(seqidno:2)的人atp7b(本文也称为wtatp7b)的核苷酸序列。
atp7b中存在p型atpase蛋白家族特征性的几个保守基序。这些基序是atp催化所必需的,包括核苷酸结合结构域(n-结构域)、磷酸化结构域(p-结构域)和执行结构域(a-结构域)。在这些基序中存在高度保守的特征残基;n-结构域中的sehpl、p-结构域中的dktg和a-结构域中的tge。人atp7b的氨基末端尾包括“6个金属结合位点”(mbs),也无区别地命名为“重金属相关(hma)”位点或结构域,其中每一个包含核心序列mxcxxc。这些hma以每hma一个cu(i)原子的化学计量结合cu(i)。atp7b的这些氨基末端hma是其几个功能方面所需的,包括铜的易位、铜整合入铜绿蛋白、atpase活性、定位和运输以及蛋白质-蛋白质相互作用。从氨基末端开始,hma位点鉴定为结构域hma1(标准序列中的氨基酸59-125)、hma2(氨基酸144-210)、hma3(258-327)、hma4(360-426)、hma5(489-555)和hma6(565-631)。
根据本发明,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核酸构建体包含编码截短atp7b的核苷酸序列,其中n末端重金属相关位点hma1、hma2、hma3和hma4全部或部分缺失。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,编码截短atp7b的核苷酸序列保留atp7b的n末端信号序列的56个氨基酸。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,截短atp7b中的缺失包含标准序列的氨基酸57-486。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核苷酸序列编码其氨基酸序列为seqidno:7的截短atp7b。
由于密码子冗余,可以产生编码具有相同氨基酸序列的atp7b多肽的许多核苷酸序列。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,编码截短铜转运atpase2的核苷酸序列是seqidno:6的编码序列cds,碱基473-3580。
在另一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,编码截短铜转运atpase2的核苷酸序列是seqidno:8,其是用于人细胞的优化密码子使用偏差的序列。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,编码截短铜转运atpase2的核苷酸序列是其中编码截短铜转运atpase2的至少827个、至少879个、至少931个或至少983个密码子与编码序列seqidno:8的密码子相同的序列。
聚腺苷酸化信号序列
如本文所用,术语“聚腺苷酸化信号”或“聚(a)信号”是指基因的3'非翻译区(3'utr)内的特定识别序列,其转录为前体mrna分子并引导基因转录的终止。聚(a)信号是新形成的前体mrna在其3'末端的内切核酸切割的信号,以及向其3'末端添加仅由腺嘌呤碱基组成的rna延伸的信号(聚腺苷酸化过程;聚(a)尾)。聚(a)尾对于mrna的细胞核输出、翻译和稳定性非常重要。在本发明的上下文中,聚腺苷酸化信号是能够在哺乳动物细胞中引导哺乳动物基因和/或病毒基因的聚腺苷酸化的识别序列。
聚(a)信号通常由以下组成:a)共识序列aauaaa,其被证明是前体信使rna(前体mrna)的3'末端切割和聚腺苷酸化以及促进下游转录终止所需,和b)在aauaaa上游和下游的控制使用aauaaa作为聚(a)信号的效率的其他元件。在哺乳动物基因中,这些基序具有相当大的变化。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,本发明的核酸构建体的聚腺苷酸化信号序列是哺乳动物基因或病毒基因的聚腺苷酸化信号序列。合适的聚腺苷酸化信号包括sv40早期聚腺苷酸化信号、sv40晚期聚腺苷酸化信号、hsv胸苷激酶聚腺苷酸化信号、鱼精蛋白基因聚腺苷酸化信号、腺病毒5eib腺苷酸化信号、生长激素聚腺苷酸化信号、pbgd聚腺苷酸化信号、电子设计的聚腺苷酸化信号(合成的)等等。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核酸构建体的聚腺苷酸化信号序列是合成的聚(a)信号,其也能够指导并影响前体mrna的内切核酸切割和聚腺苷酸化,所述前体mrna来自编码截短atp7b的核苷酸序列的转录。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核酸构建体的聚腺苷酸化信号序列是由seqidno:1的碱基4877-4932限定的合成聚(a)信号序列。
其他核苷酸元件
在一个实施方案中,本发明的核酸构建体构成用于基因治疗的表达载体(本发明的表达载体),更具体地用于基因治疗的病毒载体的重组基因组。
因此,在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,本发明的核酸构建体进一步包含病毒的5'itr和3'itr。
如本文所用,术语“反向末端重复序列(itr)”是指位于病毒5'末端的核苷酸序列(5'itr)和位于病毒3'末端的核苷酸序列(3'itr),其包含回文序列并且能够折叠形成在启动dna复制中作为引物发挥功能的t型发夹结构。它们在病毒基因组整合入宿主基因组中、在拯救宿主基因组中以及在将病毒核酸装入成熟病毒粒子中也是需要的。itr需要顺式用于载体基因组复制和将其包装入病毒颗粒。
在一个实施方案中,核酸构建体包含病毒的5'itr、ψ包装信号和3'itr。“ψ包装信号”是病毒基因组的顺式作用核苷酸序列,其在一些病毒中(例如腺病毒、慢病毒…)对于在复制期间将病毒基因组包装入病毒衣壳的过程而言是必须的。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核酸构建体包含选自以下的病毒的5'itr和3'itr:细小病毒(特别是腺相关病毒)、腺病毒,甲病毒、逆转录病毒(特别是γ逆转录病毒和慢病毒)、疱疹病毒和sv40;在一个优选的实施方案中,病毒是腺相关病毒(aav)、腺病毒(ad)或慢病毒。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核酸构建体包含aav的5'itr和3'itr。
aav基因组由包含4681个碱基的线性单链dna分子组成(bernsandbohenzky,(1987)advancesinvirusresearch(academicpress,inc.)32:243-307)。基因组在两端包含反向末端重复序列(itr),其作为dna复制起点和病毒的包装信号顺式发挥功能。itr的长度约为145bp。基因组的内部非重复部分包括两个大的开放阅读框,分别称为aavrep和cap基因。这些基因编码参与复制和包装病毒粒子的病毒蛋白。具体地,至少四个病毒蛋白从aavrep基因合成,根据其表观分子量命名为rep78、rep68、rep52和rep40。aavcap基因编码至少三个蛋白,vp1、vp2和vp3。关于aav基因组的详细描述,参见例如muzyczka,n.(1992)currenttopicsinmicrobiol.andimmunol.158:97-129。
重组aav病毒粒子的构建通常是本领域已知的,且描述于例如us5,173,414和us5,139,941;wo92/01070、wo93/03769、(lebkowski等(1988)molec.cell.biol.8:3988-3996;vincent等(1990)vaccines90(coldspringharborlaboratorypress);carter,b.j.(1992)currentopinioninbiotechnology3:533-539;muzyczka,n.(1992)currenttopicsinmicrobiol.andimmunol.158:97-129;和kotin,r.m.(1994)humangenetherapy5:793-801。
可以使用任何aav血清型,包括aav1、aav2、aav3(包括3a和3b型)、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、鸟aav、牛aav、犬aav、马aav、羊aav和目前已知的或之后发现的任何其他aav血清型的itr来进行本发明。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核酸构建体包含选自以下的aav血清型的5'itr和3'itr:aav1、aav2和aav4。在一个优选的实施方案中,核酸构建体包含由seqidno:1的碱基1-141和碱基4968-5107限定的itr序列,其是aav2的itr序列。
itr是aav基因组复制和将其包装到病毒颗粒中所需的唯一顺式aav病毒元件。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,核酸构建体包含任何分类亚组(a-f)内的任何血清型腺病毒的5'itr、ψ包装信号和3'itr。在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,这些5'itr、ψ信号和3'itr序列来自亚组c腺病毒,更优选来自血清型2(ad2)或血清型5(ad5)的腺病毒。
另一个方面,在其他实施方案中,本发明可以使用合成的5'itr和/或3'itr来进行,且也可以使用来自不同血清型的病毒的5'itr和3'itr来进行。
病毒载体复制所需的所有其他病毒基因可以如下所述在病毒产生细胞(包装细胞)内反式提供。因此,在根据本发明的病毒载体基因组的核酸构建体中包括它们是任选的。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,表达载体是aav载体。
在一个具体的实施方案中,本发明的核酸构建体构成选自以下组合的aav载体:
a)包含aav2的5'itr和3'itr核苷酸序列、aat启动子序列和编码截短人atp7b(d57-486)的核苷酸序列的载体;
b)包含aav2的5'itr和3'itr核苷酸序列、aat启动子序列和编码截短人atp7b(d57-486)的密码子优化的核苷酸序列seqidno:8的载体;
c)包含aav2的5'itr和3'itr核苷酸序列、ealbpa1at杂合启动子序列和编码截短人atp7b(d57-486)的核苷酸序列的载体;和
d)包含aav2的5'itr和3'itr核苷酸序列、ealbpa1at杂合启动子序列和编码截短人atp7b(d57-486)的密码子优化的核苷酸序列seqidno:8的载体。
这些aat载体实施方案中的每一个还包括聚腺苷酸化信号序列,例如合成的聚(a)信号序列seqidno:1或任何其他合适的聚(a)信号;与或不与其他任选的核苷酸元件一起。
在另一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,表达载体是腺病毒载体。根据本发明的该腺病毒载体尤其可以是第一代、第二代或第三代腺病毒[参见adenovirus.methodsandprotocols.chillónm.andboscha.(eds);thirdedition;2014springer],或已知的或之后描述的任何其他腺病毒载体系统。
在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,本发明的病毒载体是“第三代腺病毒”,其也可以称为“无肠腺病毒”、“辅助依赖性腺病毒(hd-ad)”或“高能力腺病毒(hc-ad)”。第三代腺病毒的所有病毒编码区被去除(无肠);它依赖辅助腺病毒来复制(辅助依赖性);并且它能够携带并将外源遗传物质的长达36kbp的插入物递送入宿主细胞(高能力)。无肠腺病毒保留反向末端重复序列itr(5'和3')和包装信号(ψ)。
本文所述的本发明的核酸构建体和表达载体可以通过本领域技术人员已知的常规方法来制备和获得:sambrook和russell(molecularcloning:alaboratorymanual;thirdedition;2001coldspringharborlaboratorypress);以及green和sambrook(molecularcloning:alaboratorymanual;fourthedition;2012coldspringharborlaboratorypress)。
用于基因治疗的本发明的病毒颗粒
术语“病毒颗粒”和“病毒粒子”在本文中交替使用,涉及包装在衣壳内的包含病毒基因组的感染性和通常复制缺陷型病毒颗粒(即,表达病毒载体的核酸构建体),视情况可以是衣壳周围的脂质包膜。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,本发明的病毒粒子是通过将根据本发明的aav载体的核酸构建体包装入蛋白质壳获得的“重组aav病毒粒子”或“raav病毒粒子”。
腺相关病毒的病毒衣壳蛋白质(衣壳蛋白vp1、vp2和vp3)从单个病毒基因(cap基因)产生。各种aav血清型的衣壳蛋白序列之间的差异导致用于进入细胞的细胞表面受体不同。与不同的细胞内加工通路一起,这导致各aav血清型的不同组织向性。
在一个具体的实施方案中,根据本发明的重组aav病毒粒子可以通过以下来制备:将衍生自特定aav血清型的aav载体/基因组的核酸构建体装入通过与相同的特定血清型aav对应的天然cap蛋白形成的病毒颗粒。然而,已经开发了数种技术来修饰并改进天然存在的aav病毒颗粒的结构和功能性质(bünningh等jgenemed2008;10:717–733)。因此,在根据本发明的另一种aav病毒颗粒中,可以将侧翼是给定aav血清型的itr的病毒载体的核苷酸构建体包装入例如:a)由源自相同或不同aav血清型的衣壳蛋白构成的病毒颗粒[例如aav2itr和aav5衣壳蛋白;aav2itr和aav8衣壳蛋白;等等];b)由来自不同aav血清型或突变体的衣壳蛋白的混合物构成的镶嵌病毒颗粒[例如aav2itr和aav1和aav5衣壳蛋白];c)由通过不同aav血清型或变体之间的结构域交换而截短的衣壳蛋白构成的嵌合病毒颗粒[例如aav2itr和具有aav3结构域的aav5衣壳蛋白];或d)工程化以显示选择性结合结构域的靶向病毒颗粒,其能够与靶细胞特异性受体进行严格的相互作用[例如aav4itr和通过插入肽配体而遗传性截短的aav2衣壳蛋白;或通过将肽配体偶联至衣壳表面而非遗传性修饰的aav2衣壳蛋白]。
本领域技术人员将理解,根据本发明的aav病毒粒子可以包含来自任何aav血清型的衣壳蛋白。在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,病毒颗粒包含aav的衣壳蛋白。在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,aav病毒颗粒包含来自选自以下的血清型的衣壳蛋白:aav1、aav5、aav7、aav8和aav9,其更适用于递送至肝细胞(nathwani等blood2007;109:1414–1421;kitajimaetal.atherosclerosis2006;186:65-73)。在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,病毒颗粒包含本发明的核酸构建体,其中核酸构建体的5'itr和3'itr是aav2血清型,且衣壳蛋白是aav8血清型。
在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,aav病毒颗粒包含来自anc80的衣壳蛋白,所述anc80是病毒aav血清型1、2、8和9的预测祖先,并且表现为靶向肝、肌肉和视网膜的高效基因治疗载体(zinn等cellreports2015;12:1–13)。在一个更具体的实施方案中,病毒颗粒包含anc80l65vp3衣壳蛋白(genbank登录号:kt235804)。
病毒-聚糖相互作用是侵袭宿主细胞的决定因素。在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,aav病毒颗粒包括含有一个或多个氨基酸取代的衣壳蛋白,其中所述取代将新的聚糖结合位点引入aav衣壳蛋白。在一个更具体的实施方案中,氨基酸取代在aav2的氨基酸266、氨基酸463-475和氨基酸499-502,或在aav1、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10或任何其他aav血清型,也包括anc80和anc80l65中的对应氨基酸位置。
引入的新聚糖结合位点可以是己糖结合位点[例如半乳糖(gal)、甘露糖(man)、葡萄糖(glu)或岩藻糖(fuc)结合位点];唾液酸(sia)结合位点[例如sia残基,如n-乙酰神经氨酸(neusac)或n-糖基神经氨酸(neusgc)];或二糖结合位点,其中二糖是与半乳糖连接的唾液酸,例如以sia(α2,3)gal或sia(α2,6)gal的形式。国际专利申请wo2014144229和shen等(j.biol.chem.2013;288(40):28814–28823)提供了将来自一种aav血清型的新结合位点引入另一种avv血清型的衣壳蛋白的详细指导。在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,将来自aav9的gal结合位点引入aav2vp3骨架,产生能够使用hs和gal受体用于细胞进入的双重聚糖-结合aav菌株。优选地,所述双重聚糖-结合aav菌株aav2g9。shen等通过将直接参与并紧邻aav9vp3衣壳蛋白亚基上的gal识别位点的氨基酸残基取代至aav2vp3亚基编码区的对应残基(aav2vp3编号q464v、a467p、d469n、i470m、r471a、d472v、s474g、y500f和s501a)上产生aav2g9。
在另一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,本发明的病毒粒子是腺病毒的病毒粒子,例如ad5病毒粒子。在aav病毒粒子的情况下,也可以工程化ad病毒粒子的衣壳蛋白以改变其向性和细胞内靶向性能,也可以使用其他的腺病毒血清型。
生产病毒颗粒
可以考虑为待产生的核酸构建体和载体的病毒颗粒的实际实施方案所选择的结构特征,选择常规方法和实验方案来生产携带本发明的表达病毒载体的核酸构建体的病毒颗粒。
简言之,可以在特异性病毒产生细胞(包装细胞)中产生病毒颗粒,所述病毒产生细胞在辅助载体或病毒或其他dna构建体存在下用待包装的载体的核酸构建体转染。
因此,在一个方面,本发明涉及本发明的核酸构建体或表达载体在生产病毒颗粒中的用途。
在一个相关的方面,本发明涉及用于生产本发明的病毒颗粒的方法,包括以下步骤:
a)在培养基中培养含有本发明的核酸构建体或表达载体的宿主细胞;和
b)从细胞培养上清液和/或细胞内收获病毒颗粒。
优选地,所述宿主细胞是包装细胞,如下文所述。合适的培养基是本领域技术人员已知的。组成这种培养基的成分可以根据待培养的细胞类型而变。除了营养组分,渗透压和ph也被认为是培养基的重要参数。细胞生长培养基包含本领域技术人员已知的许多成分,包括氨基酸、微生物、有机盐和无机盐、碳水化合物来源、脂质、微量元素(cuso4、feso4、fe(no3)3、znso4...),各成分以支持体外细胞培养(即细胞的存活和生长)的量存在。成分也可以包括不同的辅助物质,例如缓冲物质(如碳酸氢钠、hepes、tris...)、氧化稳定剂、用于抵抗机械应力的稳定剂、蛋白酶抑制剂、动物生长因子、植物水解物、抗凝结剂、消泡剂。细胞生长培养基的特征和组成根据具体的细胞要求而变。可商购的细胞生长培养基的实例有:mem(最低基础培养基)、bme(eagle基本培养基)、dmem(dulbecco改进的eagle培养基)、iscovedmem(iscove改进的dulbecco培养基)、gmem、rpmi1640、leibovitzl-15、cho、mccoy’s、medium199、hek293、ham(ham培养基)f10及其衍生物、hamf12、dmem/f12等。
本发明的宿主细胞
在另一个方面,本发明涉及包含本发明的核酸构建体或表达载体的宿主细胞。
如本文所用,术语“宿主细胞”是指任何易受目标病毒感染并且适合体外培养的细胞系。
本发明的宿主细胞可以用于离体基因治疗目的。在这种实施方案中,用本发明的核酸构建体或病毒载体转染细胞,随后将其移植入患者或受试者。移植的细胞可以是自体、同种异体或异源来源。对于临床使用,一般在良好操作规范(gmp)条件下进行细胞分离。在移植前,通常检查细胞质量及不存在微生物或其他污染,且可以例如用照射和/或免疫抑制治疗进行肝脏预调节。除此外,宿主细胞可以与生长因子(例如肝细胞生长因子,hgf)一起移植以刺激细胞增殖和/或分化。
在一个具体的实施方案中,宿主细胞用于肝脏的离体基因治疗。优选地,所述细胞是真核细胞例如哺乳动物细胞,其包括人、非人灵长类如类人猿、黑猩猩、猴子和猩猩、驯养动物包括狗和猫、以及家畜如马、牛、猪、绵羊和山羊,或其他哺乳动物物种,包括但不限于小鼠、大鼠、豚鼠、兔、仓鼠等。本领域技术人员将根据待移植的患者或受试者选择更合适的细胞。
所述宿主细胞可以是具有自我更新和多能性质的细胞,例如干细胞或诱导多能干细胞。干细胞优选间充质干细胞。间充质干细胞(msc)能够分为至少一种成骨细胞、软骨细胞、脂肪细胞或肌细胞,且可以从任何类型的组织分离。通常,从骨髓、脂肪组织、脐带或外周血分离msc。用于获得它们的方法是本领域技术人员熟知的。诱导多能干细胞(也称为ips细胞或ipsc)是一种能够从成人细胞直接产生的多能干细胞。yamanaka等通过将oct3/4、sox2、klf4和c-myc基因转入小鼠和人成纤维细胞,并迫使细胞表达该基因诱导了ips细胞(wo2007/069666)。thomson等随后用nanog和lin28替代klf4和c-myc产生了人ips细胞(wo2008/118820)。
所述宿主细胞也可以是肝细胞。肝细胞移植程序,包括细胞分离和随后移植入人或小鼠受体描述于例如filippi和dhawan,annnyacadsci.2014,131550-55;yoshida等,gastroenterology1996,111:1654-1660;irani等moleculartherapy2001,3:3,302-309;和vogel等jinheritmetabdis2014,37:165-176。将病毒载体离体转导入肝细胞中的方法描述于例如merle等,scandinavianjournalofgastroenterology2006,41:8,974-982。
在另一个具体的实施方案中,宿主细胞是包装细胞。所述细胞可以是粘附或悬浮细胞。包装细胞和辅助载体或dna构建体一起顺式提供病毒载体完整复制和包装所需的所有缺失功能。
优选地,所述包装细胞是真核细胞例如哺乳动物细胞,包括猴、人、狗和啮齿动物细胞。人细胞的实例有per.c6细胞(wo01/38362)、mrc-5(atccccl-171)、wi-38(atccccl-75)、hek-293细胞(atcccrl-1573)、hela细胞(atccccl2)和胎儿恒河猴肺细胞(atcccl-160)。非人灵长类细胞的实例有vero细胞(atccccl81)、cos-1细胞(atcccrl-1650)或cos-7细胞(atcccrl-1651)。狗细胞的实例是mdck细胞(atccccl-34)。啮齿动物细胞的实例是仓鼠细胞,例如bhk21-f、hkcc细胞或cho细胞。
作为哺乳动物来源的替代,用于本发明的细胞可以来自禽类来源,例如鸡、鸭,鹅、鹌鹑或雉鸡。禽类细胞系的实例包括禽类胚胎干细胞(wo01/85938和wo03/076601)、永生鸭视网膜细胞(wo2005/042728)和禽类胚胎干细胞的衍生细胞,包括鸡细胞(wo2006/108846)或鸭细胞,如eb66细胞系(wo2008/129058&wo2008/142124)。
在另一个实施方案中,宿主细胞是昆虫细胞,例如sf9细胞(atcccrl-1711)、sf21细胞(iplb-sf21)、mg1细胞(bti-tn-mg1)或highfivetm细胞(bti-tn-5b1-4)。
因此,在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,宿主细胞包含:
a)本发明的核酸构建体或表达载体(即重组aav基因组),通常是质粒;
b)编码aavrep和/或cap基因且不携带itr序列的核酸构建体,通常是质粒;和/或
c)包含病毒辅助基因的核酸构建体,通常是质粒或病毒。
aav复制所需的病毒基因在本文中称为病毒辅助基因。通常,所述aav复制所需的基因是腺病毒辅助基因,例如e1a、e1b、e2a、e4或varna。优选地,腺病毒辅助基因是ad5或ad2血清型。
可用常规方法来生产aav载体的病毒颗粒,其在于使用以下的瞬时细胞共转染:携带本发明的重组aav载体/基因组的核酸构建体(例如质粒);编码rep和cap基因但不携带itr序列的核酸构建体(例如aav辅助质粒);和提供aav复制所需的腺病毒功能的第三个核酸构建体(例如质粒)。
因此,在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,所述宿主细胞的特征在于包含:
a)本发明的核酸构建体或表达载体(即重组aav基因组);
b)编码aavrep和/或cap基因且不携带itr序列的核酸构建体;和
c)包含腺病毒辅助基因的核酸构建体。
或者,可以将rep、cap和腺病毒辅助基因组合在单个质粒上(blouinv等jgenemed.2004;6(suppl):s223-s228;grimmd.等hum.genether.2003;7:839-850)。因此,在另一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,所述宿主细胞的特征在于包含:
i)本发明的核酸构建体或表达载体(即重组aav基因组);和
ii)编码aavrep和/或cap基因且不携带itr序列,并且进一步包含腺病毒辅助基因的质粒。
在进一步具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,所述宿主细胞包含:
a)本发明的核酸构建体或表达载体(即重组aav基因组);
b)编码aavrep和/或cap基因且不携带itr序列的质粒;和
c)包含腺病毒辅助基因e2a、e4和varna的质粒,
其中共转染在细胞,优选哺乳动物细胞(例如hek-293细胞,atcccrl-1573)中进行,所述细胞组成型表达并反式补充腺病毒e1基因。
大规模生产根据本发明的aav载体也可以通过例如用重组杆状病毒的组合感染昆虫细胞来进行(urabe等hum.genether.2002;13:1935-1943)。用分别表达aavrep、aavcap和待包装的aav载体的三个杆状病毒共转染sf9细胞。重组杆状病毒载体将提供病毒复制和/或包装所需的病毒辅助基因功能。
通过使用编码aav血清型的reporf(开放阅读框)和不同血清型aav的caporf的辅助质粒,将给定aav血清型的itr侧翼的载体包装到由不同血清型的衣壳结构蛋白组装的病毒粒子中是可行的。也可以用该相同方法包装镶嵌、嵌合或靶向载体。
另一方面,根据本发明的hc-ad载体的生产可以通过组成型表达和反式补充腺病毒e1基因以及cre重组酶的哺乳动物细胞(例如293cre细胞)来进行。这些细胞用hc-ad载体基因组转染,并用其中包装信号侧翼是loxp序列的第一代腺病毒辅助病毒(缺失e1)感染[parksrj等proc.natl.acad.sci.usa1996;13565-13570;对于293crecells,参见palmerandengel.mol.ther.2003;8:846-852]。已经描述了可以用于包装hc-ad载体的数种基于cre/loxp的辅助病毒细胞,例如adadlc8cluc或优化的自我灭活的adtetcre辅助病毒(ep2295591;gonzalez-aparicio等genetherapy2011;18:1025-1033)。
用于构建和生产根据本发明的用于基因治疗的病毒载体的进一步指导可以在以下中发现:
viralvectorsforgenetherapy,methodsandprotocols.series:methodsinmolecularbiology,vol.737.mertenandal-rubeai(eds.);2011humanapress(springer).
genetherapy.m.giacca.2010springer-verlag.
heilbronnr.andwegers.viralvectorsforgenetransfer:currentstatusofgenetherapeutics.in:drugdelivery,handbookofexperimentalpharmacology197;m.
adeno-associatedvirus:methodsandprotocols.r.o.snyderandp.moulllier(eds).2011humanapress(springer).
bünningh.等.recentdevelopmentsinadeno-associatedvirustechnology.j.genemed.2008;10:717-733.
adenovirus:methodsandprotocols.m.chillónanda.bosch(eds.);thirdedition.2014humanapress(springer)。
治疗用途
在进一步方面,本发明涉及在发明简述中定义的本发明的产品用作药物的用途。
在另一个方面,本发明涉及在发明简述中定义的本发明的产品用于治疗由铜转运atpase2缺乏或功能障碍引起的病症,以及其中铜转运atpase2表达和活性上调可以产生治疗益处或改善的任何其他病症或疾病,尤其是与atp7b依赖性溶酶体胞吐作用减少和溶酶体中铜积聚相关的疾病或病症,例如胆汁淤积性疾病,阿尔茨海默病和/或癌症的用途(polishchuck等devcell.2014,29(6),686-700;guptaandlutsenko,futuremed.chem.2009,1,1125-1142)。
待治疗的受试者可以是哺乳动物,尤其是人患者。
在一个具体的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,由铜转运atpase2缺乏或功能障碍引起的病症是威尔森病(wd,onlinemendelianinheritanceinmancatalogaccessionnumberomin277900;http://www.omim.org/entry/277900)。
在一个相关的方面,本发明涉及在发明简述中定义的本发明的产品在制备用于治疗由铜转运atpase2缺乏或功能障碍引起的病症,以及其中铜转运atpase2表达和活性上调可以产生治疗益处或改善的任何其他病症和疾病,优选用于治疗威尔森病的药物中的用途。
在进一步的方面,本发明涉及治疗患者中由铜转运atpase2缺乏或功能障碍引起的病症,以及其中铜转运atpase2表达和活性上调可以产生治疗益处或改善的任何其他病症和疾病,优选用于治疗威尔森病,包括向所述患者施用治疗有效量的本发明的核酸构建体、表达载体、宿主细胞、病毒颗粒或药物组合物。
用本发明的产品治疗可以缓和、改善或减轻wd的一种或多种症状的严重程度。例如,治疗可以增加和/或恢复全血铜蓝蛋白合成、铜蓝蛋白氧化酶活性和/或胆汁中的铜排出(从而减少血清、肝、脑和尿中的铜积聚);从而可以缓和、改善或减轻腹痛、疲劳、黄疸、不受控制运动的频率、肌肉僵硬、语言问题、吞咽或身体协调。
本发明的产品通常将包括于药物组合物或药物中,任选与药物载体、稀释剂和/或佐剂组合。这种组合物或医药产品包括足以提供所需疗效的有效量的本发明的产品和药学上可接受的载体或赋形剂。
因此,在进一步的方面,本发明涉及药物组合物,其包含本发明的核酸构建体、表达载体、宿主细胞或病毒颗粒和药学上可接受的载体。
任何合适的药学上可接受的载体或赋形剂可用于制备根据本发明的药物组合物(参见例如,remington:thescienceandpracticeofpharmacy,alfonsor.gennaro(editor)mackpublishingcompany,april1997)。药物组合物通常在制备和储存条件是无菌且稳定的。药物组合物可以配制为溶液(例如盐水、葡聚糖溶液或缓冲溶液,或其他药学上可接受的无菌流体)、微乳剂、脂质体或其他适合于容纳高产品浓度的有序结构(例如微粒或纳米颗粒)。载体可以是溶剂或分散介质,其包含例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其合适的混合物。可以通过使用包衣例如卵磷脂,在分散体的情况下通过维持所需的粒径和通过使用表面活性剂来维持适当的流动性。在很多情况下,优选在组合物中包括等渗剂,例如糖、多元醇如甘露醇、山梨糖醇或氯化钠。可以通过在组合物中包括延迟吸收的试剂,例如单硬脂酸盐和明胶来实现可注射组合物的延长吸收。本发明的产品可以受控释放的制剂施用,例如在包括缓释聚合物或保护产品不快速释放的其他载体的组合物中,包括植入物和微包封的递送系统。例如可以使用生物可降解和生物相容的聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯、聚乳酸和聚乳酸/聚乙醇酸共聚物(plg)。优选地,所述药物组合物配制为溶液,更优选为任选缓冲的盐水溶液。
也可以在本发明的药物组合物中加入补充的活性化合物。共施用额外治疗的指导可以例如发现于加拿大药剂师协会的药剂专业概要(cps)。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,本发明的药物组合物是肠胃外药物组合物,包括适用于静脉内、动脉内、皮下、腹膜内或肌内施用的组合物。这些药物组合物仅仅是示例性的,并不限制适用于其他肠胃外和非肠胃外施用途径的药物组合物。
在本发明上下文中,“有效量”是指治疗有效量。
如本文所用,“治疗有效量”是指以一定剂量和一段时间,实现期望的治疗结果,例如铜易位活动的升高,从而增加胆汁中的铜并减少血清、肝、脑和尿中的铜所需的量。本发明的产品或包含它的药物组合物的治疗有效量可以根据以下因素变化:个体的疾病状态、年龄、性别和体重,以及产品或药物组合物在个体中引起期望反应的能力。可以调节剂量方案以提供最佳治疗反应。治疗有效量也通常是产品或药物组合物的治疗有益效果超过任何有毒或有害作用的量。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,通过肠胃外途径向受试者或患者施用携带本发明的产品的药物组合物。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,药物组合物通过静脉内、动脉内、皮下、腹膜内或肌内施用。
在一个实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,包含本发明的产品的药物组合物通过间质途径施用,即通过注射至或注射入组织的间隙。组织靶标可以是特异性的,例如肝组织,或也可以是几个组织的组合,例如肌肉和肝组织。示例性的组织靶标可以包括肝、骨骼肌、心肌、脂肪沉积物、肾、肺、血管内皮、上皮细胞和/或造血细胞。在一个优选的实施方案中,任选与如上文或如下文所述的各种实施方案的一个或多个特征组合,它通过肝内注射施用,即注射入肝组织的间质空间。
向受试者或患者施用的本发明的产品的量可以根据个体受试者或患者的具体情况变化,包括个体的年龄、性别和体重;疾病的性质和阶段,疾病的侵袭性;施用途径;和/或为受试者或患者开的伴随药物。可以调节剂量方案以提供最佳治疗反应。
对于任何特定的受试者,可以根据个体需要和施用或监督组合物施用的人的专业判断来调节特定的剂量方案。本文所述的剂量范围仅仅是示例性的,不限制医生可以选择的剂量范围。
在一个实施方案中,为治疗威尔森病,可以向受试者或患者以5x1011-1x1014vg/kg(vg:病毒基因组;kg:受试者或患者的体重)的量或剂量施用根据本发明的aav载体。在一个更具体的实施方案中,aav载体以1x1012-1x1013vg/kg的量施用。
在另一个实施方案中,为治疗威尔森病,可以向受试者或患者以1x109-1x1011vg/kgiu/kg(iu:载体的感染单位)的量或剂量施用根据本发明的hc-ad载体。
在另一个方面,本发明进一步涉及在一个或多个容器中包含本发明的核酸构建体、载体、病毒颗粒或药物组合物的试剂盒。本发明的试剂盒可以包括如何向患者施用试剂盒中包含的本发明的核酸构建体、载体、宿主细胞或病毒颗粒的说明书或包装材料。试剂盒的容器可以是任何合适的材料,例如玻璃、塑料、金属等,和可以是任何尺寸、形状或构象。在某些实施方案中,试剂盒可以包括一个或多个安瓿或注射器,其包含合适的液体或溶液形式的本发明的核酸构建体、载体、宿主细胞、病毒颗粒或药物组合物。
贯穿说明书和权利要求,词语“包含”及其变体不意欲排除其他技术特征、添加剂、成分或步骤。此外,词语“包含”涵盖“由…组成”的情况。本发明的其他目的、优势和特征对于本领域技术人员而言在阅读本说明书时将变得明显,或可以通过实施本发明来学习。以下实施例以说明性的方式提供,它们并与意欲限制本发明。此外,本发明覆盖本文所述的具体和优选实施方案的所有可能组合。
具体实施方式
实施例1.构建重组表达载体
为进行威尔森病(wd)的基因治疗,设计并产生五个不同的携带且表达人atp7b、或人atp7b的截短形式的aav载体:aav2/8aat-wtatp7b、aav2/8-aat-coatp7b、aav2/8-aat-atp7b(d223-366)、aav2/8aat-atp7b(d57-486)和aav2/8aat-coatp7b(d57-486)。
1.1载体aav2/8aat-wtatp7b[本文也称为aav-wtatp7b]
该载体的基因组序列鉴定为seqidno:1。
首先,根据要求(genscript)通过将核酸构建体克隆到puc57质粒中组装质粒puc-atp7b。核酸构建体包含编码人atp7b(转基因)和转基因下游的合成聚腺苷酸化信号序列(levittn.等genes&development1989;3(7):1019-1025)。
然后,将α1抗胰蛋白酶基因(aat)的最小启动子引入质粒puc-atp7b,在atp7b基因的上游。最小启动子由相对于aat启动子的cap位点而言核苷酸-261至核苷酸+44的序列组成,且包含肝功能所需的组织特异性元件(tse)和完整启动子活性所需的远端区(dri)。使用penhalbaat-荧光素酶质粒(由m.g.kramer提供)作为模板并用以下引物通过pcr扩增获得aat启动子:
引物aat-正向
5’ctggtctagaacgcgtcgccaccccctccaccttgg3’(seqidno:10);和
引物aat-反向
5’atcatgatgcggccgcttcactgtcccaggtcagtg3’(seqidno:11)。
aat正向引物具有xbai和mlui的限制性位点;3’aat反向引物具有noti的限制性位点。
因此,为获得质粒puc-aat-atp7b,用xbai和noti消化质粒puc-atp7b,并将其与之前用相同酶消化的aat启动子连接。
然后通过用限制性酶pmli和mlui消化将表达盒亚克隆入aav转移质粒(agilenttechnologies),从而产生质粒paav2-aat-wtatp7b。
一旦构建质粒,通过将质粒paav2-aat-atp7b和质粒pdp8(从plasmidfactory,bielefeld,germany获得;质粒pdp8表达aav8衣壳蛋白、aav2rep蛋白和aav产生和包装所需的腺病毒分子)双重转染入293个细胞来制备aav载体。
最后通过碘克沙醇梯度纯化载体,并通过定量pcr滴定。
1.2载体aav2/8-aat-coatp7b[本文也称为aav-coatp7b]
该载体的基因组序列鉴定为seqidno:3。
为获得表达密码子优化版本的atp7b基因(coatp7b)的aav载体,首先根据要求(genscript)通过将核酸构建体克隆到puc57质粒中组装质粒puc-coatp7b。然后,通过用限制性酶noti和kpni消化从puc-coatp7b切出coatp7b,并将其亚克隆入之前用相同酶noti和kpni消化的paav2-aat-wtatp7b质粒,获得质粒paav2-aat-coatp7b。
一旦构建质粒,如之前对于载体aav2/8-aat-wtatp7b所述一样,产生载体基因组并包装病毒颗粒:与质粒pdp8一起双重转染之前获得的质粒paav2-aat-coatp7b,纯化(碘克沙醇梯度)并滴定。
1.3载体aav2/8aat-atp7b(d223-366)[本文也称为aav-t1]
该载体携带的转基因是编码atp7b(d223-366)的核酸序列(seqidno:12),其是其中氨基酸223-366缺失的人atp7b的截短形式。缺失序列包括hma3结构域和hma4结构域的7个氨基酸。
为获得载体,用限制性酶mfei和naei消化质粒puc57-wtatp7b以获得质粒puc57-atp7b-t1。如此,编码区的大小减少432个核苷酸,蛋白的大小减少144个氨基酸。
一旦构建质粒,如之前对于载体aav2/8-aat-wtatp7b所述一样,产生载体基因组并包装病毒颗粒:与aat启动子连接,亚克隆入质粒paav-mcs,与质粒pdp8一起双重转染之前获得的质粒paav2-aat-t1,病毒纯化(碘克沙醇梯度)并滴定。
1.4载体aav2/8-aat-atp7b(d57-486)[本文也称为aav-t2]
该载体的基因组序列鉴定为seqidno:6。
该载体携带的转基因是编码atp7b(d57-486)的核酸序列(也称为atp7b-t2),所述atp7b(d57-486)是其中氨基酸57-486缺失的人atp7b的截短形式。如此,开始的4个hma结构域被消除,同时保留了包含氨基末端区域的56个氨基酸的信号序列,编码区的大小减少1.29kb,蛋白的大小减少430个氨基酸。
用puc57-wtatp7b作为模板并用以下两组引物通过pcr扩增获得atp7b(d57-486)的核苷酸序列:
扩增氨基末端序列的第一组引物:
引物f1:
5’ctagatgcggccgccaccatgcctg3’(seqidno:14),
和
引物r1:
5’ctgagaagaagggcccaggcc3’(seqidno:15);和
扩增羧基末端区的第二组引物:
引物f2:
5’ggcccttcttctcagccgcagaagtgcttcttacag3’(seqidno:16),和
引物r2:
5’accaaaatcgataaaaccgattacaatcc3’(seqidno:17)。
引物r1和f2的5’末端序列是互补的。用等摩尔量的两个pcr的纯化片段作为模板和引物f1和r2,进行pcr来获得编码atp7b(d57-486)的核苷酸序列。然后将pcr产物用noti和clai消化,并克隆入之前用两种酶消化的puc57-aat-wtatp7b质粒,从而获得质粒puc57-atp7b-t2。
一旦构建质粒puc57-atp7b-t2,如之前对于载体aav2/8-aat-wtatp7b所述一样,产生载体基因组并包装病毒颗粒:与aat启动子连接,亚克隆入质粒paav-mcs,与质粒pdp8一起双重转染之前获得的质粒paav2-aat-t2,病毒纯化(碘克沙醇梯度)并滴定。
1.5载体aav2/8aat-coatp7b(d57-486)[本文也称为aav-aat-cot2]
该载体携带的转基因是也编码atp7b(d57-486)的密码子优化的核酸序列[seqidno:8;coatp7b(d57-486)或coatp7b-t2]。
用puc57-coatp7b作为模板并用以下两组引物通过pcr扩增获得coatp7b(d57-486)的核苷酸序列:
扩增氨基末端序列的第一组引物:
引物f3:
5’acgcgtgcggccgccaccatgccag3’(seqidno:18),
和
引物r3:
5’ctgggagctaggtcccagtcc3’(seqidno:19);和
扩增羧基末端区的第二组引物:
引物f4:
5’ggacctagctcccagcctcagaagtgttttctgcag3’(seqidno:20),和
引物r4:
5’tgttcctcgcgaatgatcaggttgtcctc3’(seqidno:21)。
引物r3和f4的5’末端序列是互补的。用等摩尔量的两个pcr的纯化片段作为模板和引物f3和r4,进行pcr来获得编码atp7b(d57-486)的密码子优化的核苷酸序列。然后将pcr产物用noti和nrui消化,并克隆入之前用两种酶消化的puc57-aat-wtatp7b质粒,从而获得质粒puc57-coatp7b-t2。
一旦构建质粒puc57-coatp7b-t2,如之前对于载体aav2/8-aat-wtatp7b所述一样,产生载体基因组并包装病毒颗粒:与aat启动子连接,亚克隆入质粒paav-mcs,与质粒pdp8一起双重转染之前获得的质粒paav2-aat-cot2,病毒纯化(碘克沙醇梯度)并滴定。
实施例2.威尔森病动物模型:atp7bko
在wd的代表性动物模型atp7b敲除小鼠(atp7bko、atp7b-/-或wd小鼠)中测试载体aav2/8-aat-atp7b-t1和aav2/8-aat-atp7b-t2的治疗性能。该动物模型由buiakova等通过以下开发:通过用方向相反的转录框中的新霉素盒来替代一部分atp7b外显子2在小鼠atp7bmrna中引入提前终止密码子(buikovao.i.等humanmoleculargenetics1999;8(9):1665-1671)。atp7b敲除小鼠显示atp7b在肝中不表达、尿中cu排出高、血清中全血铜蓝蛋白水平低、转氨酶水平高、肝中cu浓度高和病理性肝组织学。这些小鼠显示除了神经系统影响之外的人威尔森病的典型生化特征(lutsenkos.biochemicalsocietytransactions2008;36(pt6):1233-1238)。
实施例3.测定病毒载体aav2/8-aat-atp7b-t1和aav2/8-aat-atp7b-t2在威尔森病小鼠中的疗效
将六周(6w)龄雄性atp7b-/-小鼠分为4组,每组5只小鼠:一组用剂量为3x1010vg/小鼠(vg:病毒基因组)的载体aav2/8-aat-wtatp7b静脉内处理;第二组用相同剂量的载体aav2/8-aat-atp7b-t1;第三组用相同剂量的载体aav2/8-aat-atp7b-t2;第四组未处理。另一组野生型小鼠保持未处理作为对照组(对照)。施用载体24周后(30w)处死动物。
施用载体4周后且之后每五周直到第30周;测定所有组中的血清转氨酶(alt)水平和尿cu含量。处理4周后测量血清铜蓝蛋白活性。
血清转氨酶(alt)水平通过dgkc方法(rochediagnostics,mannheim,germany)用hitachi747临床分析仪(hitachi,tokyo,japan)测定。
如schosinsky和cols.(clinicalchemistry1974;20(12):1556-1563)所述,血清铜蓝蛋白活性用ο-二茴香胺二盐酸盐(4,4'-二氨基-3,3'-二甲氧基-联苯)作为底物(sigma-aldrich,sanlouis,mo,unitedstates)进行测定。在分光光度计中测量540nm的吸光度。
尿铜含量通过原子吸收光谱(simaa6000,fromperkin-elmergmbh,bodenseewerk)测定。
处死后,切除肝脏用于组织学分析。
通过原子吸收光谱(simaa6000,fromperkin-elmergmbh,bodenseewerk),并通过timm硫化银染色(danscherg.andzimmerj.histochemistry1978;55(1):27-40)测定干燥肝组织中的肝铜含量。
在用苏木精和伊红染色的切片中评估肝脏结构。
用抗小鼠cd45抗体(biolegend,sandiego,usa;catalognumber103102)的免疫组化来检测肝脏中的炎症浸润。
还用抗小鼠panck抗体(invitrogen/lifetechnologies,18-0132,clonae1/ae3)的免疫组化来检测胆管细胞。
为测定纤维化,我们使用常规天狼猩红染色作为胶原测定方法。
如图2所示,转氨酶水平在接受aav2/8-aat-wtatp7b或aav2/8-aat-atp7b-t2的小鼠中正常,但在用aav2/8-aat-atp7b-t1处理的动物中不正常。此外,接受aav2/8-aat-wtatp7b、aav2/8-aat-atp7b-t1或aav2/8-aat-atp7b-t2的动物的尿中的cu浓度显著更低;然而aav2/8-aat-atp7b-t1在降低尿中的cu浓度方面效率较低(图3)。在接受aav2/8-aat-wtatp7b或aav2/8-aat-atp7b-t2的动物中,铜蓝蛋白活性在处理四周后恢复,但在用aav2/8-aat-atp7b-t1处理的动物中并没有(图4)。该结果通过蛋白质印迹分析证实。在用aav2/8-aat-wtatp7b或aav2/8-aat-atp7b-t2处理的小鼠中检测到全血铜蓝蛋白,但在用aav2/8-aat-atp7b-t1处理的动物中没有,其中在未处理wd小鼠中仅检测到载脂蛋白铜蓝蛋白形式。
另一方面,施用av2/8-aat-wtatp7b、aav2/8-aat-atp7b-t1或aav2/8-aat-atp7b-t2显著降低肝脏中的cu含量;然而,aav2/8-aat-atp7b-t1在降低肝脏中的cu浓度方面效率较低(图5)。该结果在timm染色后所得图像中得到证实(图6b)。关于肝脏组织学,未处理动物显示肝结构异常,其具有含有巨大核的巨大肝细胞。施用载体aav2/8-aat-wtatp7b或aav2/8-aat-atp7b-t2而不是aav2/8-aat-atp7b-t1导致肝脏组织学正常化(图6a)。此外,wd动物显示主要由cd45阳性细胞组成的强肝脏浸润;用重组病毒载体处理后浸润消失(图7)。因此,施用aav载体导致炎症浸润明显降低。此外,在aav2/8-aat-wtatp7b、aav2/8-aat-atp7b-t2和aav2/8-aat-atp7b-t1处理的wd小鼠中,胆道增生和肝纤维化也显著降低。
实施例4.病毒载体aav2/8-aat-atp7b(d57-486)在威尔森病雌性小鼠中的疗效
将六周(6w)龄雌性atp7b-/-小鼠分为4组,每组5只小鼠:第1-3组动物用病毒载体aav2/8-aat-atp7b(d57-486)静脉内处理,各组接受不同剂量(分别为1x1010、3x1010和1x1011vg/小鼠);第四组未处理。另一组野生型小鼠保持未处理作为对照组(wt)。
施用载体4周后且之后每五周直到处理后第24周(当小鼠为30周龄时),通过实施例3中所述的相同方法,测定所有组中的血清转氨酶(alt)水平和尿cu含量。
如图8所示,两个最高剂量(3x1010和1x1011vg/小鼠)的aav2/8-aat-atp7b(d57-486)使wd雌性小鼠的转氨酶水平正常化;最低剂量1x1010vg/小鼠显著降低转氨酶水平但不能消除肝脏损伤。然而,用三个不同剂量处理显著降低cu尿排出,达到wt小鼠中发现的水平(图9)。
实施例5.病毒载体aav2/8-aat-wtatp7b和aav2/8-aat-atp7b(d57-486)在威尔森病雌性小鼠中的疗效的比较
建立两个实验组。对于各实验组,将六周(6w)龄雌性atp7b-/-小鼠分为4组,每组5只小鼠:3组动物用待测试的病毒载体静脉内处理,各组接受不同剂量(分别为1x1010、3x1010和1x1011vg/小鼠);第四组未处理。另一组野生型小鼠保持未处理作为对照组(wt)。
在第一个实验组中(实验组1),向接受治疗的wd小鼠施用载体aav2/8-aat-wtatp7b;在第二个实验组中(实验组2),向它们施用载体aav2/8-aat-atp7b(d57-486)。
通过实施例3所述的相同方法,在处理后4周测定血清铜蓝蛋白活性,在处理后24周测定肝cu含量。
血清铜蓝蛋白活性
血清铜蓝蛋白活性仅通过施用最高剂量的aav2/8-aat-wtatp7b载体得到纠正(图10a,实验组1);在施用两个最低剂量后没有观察到效果。
相反,aav2/8-aat-atp7b(d57-486)载体在最低剂量1x1010vg/小鼠显著增加铜蓝蛋白水平;施用中等剂量的载体使铜蓝蛋白水平正常化,最高剂量增加铜蓝蛋白活性超过正常水平(图10b,实验组2)。
肝脏中的cu浓度
此外,施用两个最高剂量的aav2/8-aat-wtatp7b降低了肝脏中的cu浓度,但没有使其正常化;在最低剂量没有观察到效果(图11a,实验组1)。相反,以所有测试剂量施用aav2/8-aat-atp7b(d57-486)载体后均降低了cu浓度,且在最高剂量的水平接近正常(图11b,实验组2)。
因此,对于获得血清铜蓝蛋白活性的正常化和肝脏中cu积聚的降低,表明wt构建体的“次优剂量”是剂量为1x1010vg/小鼠的aav2/8-aat-wtatp7b载体;而携带截短形式的载体在所述次优剂量出乎意料地提供统计学显著的疗效。
实施例6.病毒载体aav2/8-aat-wtatp7b和aav2/8-aat-atp7b(d57-486)在wd小鼠中的疗效的比较
将六周(6w)龄雄性atp7b-/-小鼠分为3组小鼠:2组动物分别用次优静脉内剂量(1x1010vg/小鼠)的载体aav2/8-aat-wtatp7b或载体aav2/8-aat-atp7b(d57-486)处理;第3组未处理。另一组野生型小鼠保持未处理作为对照组(wt)。
通过实施例3所述的相同方法测量肝cu含量。
如图12所示,尽管次优剂量的两个载体aav2/8-aat-wtatp7b和aav2/8-aat-atp7b(d57-486)均降低了wd小鼠肝脏中的铜积聚,aav2/8-aat-atp7b(d57-486)提供的肝铜含量降低显著大于aav2/8-aat-wtatp7b提供的降低。
实施例7.病毒载体aav2/8-aat-atp7b(d57-486)和aav-aat-coatp7b(d57-486)在wd小鼠中的疗效的比较
将六周(6w)龄雄性atp7b-/-小鼠分为3组小鼠:2组动物分别用次优静脉内剂量(1x1010vg/小鼠)的载体aav2/8-aat-atp7b(d57-486)和aav-aat-coatp7b(d57-486)处理;第3组未处理。另一组野生型小鼠保持未处理作为对照组(wt)。
通过实施例3所述的相同方法测量肝cu含量。
如图13所示,尽管次优剂量的两个载体aav2/8-aat-atp7b(d57-486)和aav2/8-aat-coatp7b(d57-486)均降低了wd小鼠肝脏中的铜积聚,aav2/8-aat-coatp7b(d57-486)提供的肝铜含量降低显著大于aav2/8-aat-atp7b(d57-486)提供的降低。
实施例8.密码子优化的病毒载体aav2/8-aat-coatp7b(d57-486)在wd小鼠中的疗效
将六周(6w)龄雄性atp7b-/-小鼠分为5组小鼠:4组动物分别用次优静脉内剂量(1x1010vg/小鼠)的载体aav2/8-aat-wtatp7b、aav2/8-aat-coatp7b、aav2/8-aat-atp7b(d57-486)或aav2/8-aat-coatp7b(d57-486)处理;第5组未处理。另一组野生型小鼠保持未处理作为对照组(wt)。
通过实施例3所述的相同方法测量血清铜蓝蛋白活性。
如图14所示,当以次优剂量向wd小鼠施用时,携带截短atp7b-t2的核苷酸序列的两个载体恢复了铜蓝蛋白氧化酶活性,而当以相同处理条件施用时,携带编码完整人atp7b的核苷酸序列的载体没有提供任何铜蓝蛋白活性的显著改进。
- 还没有人留言评论。精彩留言会获得点赞!