一种阿达木单抗的阳离子交换色谱纯化方法与流程
本发明涉及单克隆抗体制备,具体涉及一种阿达木单抗的阳离子交换色谱纯化方法。
背景技术:
阿达木单抗是全球首个被批准的抗肿瘤坏死因子α(TNFα)全人源单克隆抗体。阿达木单抗可阻止TNFα与其细胞表面受体结合,从而阻断TNFα的生物学活性,最终减轻炎症反应并减少破骨细胞激活,达到控制并缓解症状体征的目的。
传统纯化方法如中国专利CN 102257006 A,公开了通过亲和层析捕获步骤分离和纯化抗体的方法,Protein A柱由于选择性高和去污染物能力强,经常被首选进行抗体捕获,但其价格昂贵、洗脱的低pH易导致高分子聚合物形成、Protein A配基掉落等缺点,使越来越多的研究开始关注用非ProteinA工艺来解决现有问题。中国专利CN 103998469 A公开了用阳离子交换柱、疏水相互作用柱和阴离子交换柱来替代Protein A柱去除抗体污染物。其中,具有改进载量的阳离子填料可用来处理发酵后处理的料液,但料液在加载到特定柱上后,由于污染物含量较高,吸附到色谱柱产生竞争会影响层析中多聚体去除,给后续纯化中多聚体的去除带来不便。中国专利CN 102119168 A公开了一种使用非离子聚合物的层析步骤去除蛋白质聚集物,随后使用强化溶解的添加剂进行离子交换层析,但使用的添加剂浓度偏高,用在抗体纯化过程中,有导致抗体变性失活的风险。
技术实现要素:
本发明的目的是针对上述现有技术的缺陷,提出一种能够有效去除多聚体等污染物和稳定样品的阿达木单抗的纯化方法。申请人在研究中发现,在复性过程中添加的辅助因子(如尿素和表面活性剂等低浓度变性剂)能够通过提高折叠中间体或伸展肽链的延展度来抑制聚集体生成。而这些辅助因子除了能更好地去除多聚体,本身还有稳定抗体高级结构的作用,抑制多聚体的形成。因此,在色谱操作中引入多步冲洗和洗脱,并在洗脱缓冲液中加入适当的添加剂,能够有助于去除多聚体等污染物和稳定样品。根据上述发现,申请人提出了如下技术方案:
本发明的技术方案提供了一种纯化阿达木单抗的方法,包括对CHO细胞发酵表达的抗体进行阳离子交换色谱洗脱、疏水作用色谱洗脱。阳离子交换色谱的洗脱液是pH 5.5-6.5的缓冲液,共进行2次洗脱,其中第一次阳离子交换色谱的洗脱液中含有0.1-0.5mol/L尿素;第二次阳离子交换色谱的洗脱液中含有质量分数0.1%-1.0%的甜菜碱类表面活性剂;所述的疏水作用色谱洗脱分为2步洗脱,其中,第一步洗脱的洗脱液为pH5.5-6.5、0.15-0.4mol/L(NH4)2SO4的45mmol/L PBS缓冲液,第二步洗脱的洗脱液为pH5.5-6.5的45mmol/L PBS缓冲液。
根据上述技术方案提供的方法,在一些实施方式中,所述的甜菜碱类表面活性剂选自十二烷基二羟乙基甜菜碱、十八烷基二羟乙基甜菜碱或椰油酰胺丙基甜菜碱。
本发明在阳离子交换色谱的洗脱液中引入了低浓度尿素和甜菜碱。尿素一般用于包涵体复性时溶解包涵体的作用(8M),而低浓度的尿素可使蛋白复性,有利于折叠成天然构象。同时适当浓度表面活性剂能与吸附剂及蛋白的疏水部位结合,从而减弱蛋白质的疏水性吸附,甜菜碱类两性离子表面活性剂,表面含有两性离子基团或阴阳离子端基基团混合物,带电两性离子官能团的溶剂化作用和氢键作用能使两性离子化合物表面形成水合层,这种基于静电作用形成的水合层表面可有效阻抗非特异性蛋白吸附。
HIC(疏水相互作用层析)是一类根据层析填料表面配基与蛋白质表面疏水残基之间的疏水性差异而对蛋白质进行分离的层析方法。蛋白质的疏水性表面残基能够与HIC基质上的配基相互作用,而结合强度会根据表面所暴露残基的疏水性不同而有所差别。一般情况下,疏水性作用随离子强度提高而增强,因此在HIC过程中通常采用“高盐吸附,低盐洗脱”。在合适的条件下,结合的蛋白质按照疏水性逐渐增加的趋势洗脱。多聚体通常是多个单体蛋白质的聚合或者涉及变性蛋白,其疏水性比单体更强,因而HIC可用于多聚体的去除使其在洗脱过程中更晚出峰而与单体分离。
本发明中的数字均为近似值,无论有否使用“大约”或“约”等字眼。数字的数值有可能会出现1%、2%、5%、7%、8%、10%等差异。每当公开一个具有N值的数字时,任何具有N+/-1%,N+/-2%,N+/-3%,N+/-5%,N+/-7%,N+/-8%或N+/-10%值的数字会被明确地公开,其中“+/-”是指加或减,并且N-10%到N+10%之间的范围也被公开。例如,对于“第一次洗脱的洗脱液含0.2mol/L尿素”,则有0.2mol/L+/-1%,0.2mol/L+/-2%,0.2mol/L+/-3%,0.2mol/L+/-5%,0.2mol/L+/-7%,0.2mol/L+/-8%和0.2mol/L+/-10%的值被同时公开,同时,0.2mol/L-10%到0.2mol/L+10%之间的浓度范围也属于公开的范围,亦即0.18-0.22mol/L及其之间的值,都在第一次洗脱的洗脱液的包含范围内。
本发明的定义“抗体”是指任何免疫球蛋白,复合物或者其片段形式。该术语包括但不限于IgA,IgD,IgE,IgG和IgM的单克隆或多克隆抗体,包括自然或通过人源、嵌合、合成、重组、杂交、突变等基因工程修饰的形式。在本发明的实施方式中,抗体可以是全人源的单克隆抗体IgG。
本发明的定义“单克隆抗体”或“单抗”是指由单一效应B细胞合成的针对某一种特定抗原决定簇的抗体。其根据发展阶段的不同,可以是鼠源性、嵌合性、人源化和全人源单克隆抗体。在本发明的实施方式中,单克隆抗体可以是全人源单克隆抗体,其抗体的可变区和恒定区都是人源的。
本发明的定义“阿达木单抗”或“阿达木单克隆抗体”是一种抗肿瘤坏死因子α(TNFα)的全人源单克隆抗体。阿达木单抗可阻止TNFα与其细胞表面受体结合,从而阻断TNFα的生物学活性。在本发明的实施方式中,阿达木单抗可以是通过CHO细胞发酵得到的形式。其中,“单抗”或“单克隆抗体”遵循前述定义。
本发明的定义“高分子量聚集物”或“HWM”是指多个蛋白质单体的聚集形式,通常为五聚体及更高级聚集体。该流出部分通常观察为SEC-HPLC色谱图中主峰之前的一种或多种峰。
本发明的定义“CHO细胞”是指哺乳动物中国仓鼠卵巢细胞,它是用来表达外源蛋白最多也最成功的一类细胞,是常用的哺乳动物宿主细胞。当编码抗体基因的重组表达载体被引入CHO细胞内时,通过合适的条件培养宿主细胞可以使其表达或分泌抗体到培养基中,得到含有目标抗体的混合物。在本发明的实施方式中,“CHO细胞”可以是用来表达阿达木单抗的中国仓鼠卵巢细胞。
术语“污染物”指与期望的抗体产物不同的物质。污染物包括但不限于:宿主细胞物质,诸如宿主细胞蛋白(HCP);期望抗体的变体、片段、聚集物或衍生物;细胞培养基成分。
术语“清洗缓冲液”在本文中用于指在加载组合物之后且在洗脱感兴趣蛋白质之前流过层析材料的缓冲液。清洗缓冲液可用于合层析材料清除一种或多种污染物,基本上不洗脱期望抗体产物。依照本文中发明的优选实施方案,使用“第一清洗缓冲液”和“第二清洗缓冲液”。
术语“洗脱缓冲液”用于自固相洗脱感兴趣抗体。在本文中,洗脱缓冲液具有相对于第二清洗缓冲液更低pH,使得期望抗体产物自层析介质中洗脱。
术语“离子交换”或“离子交换层析”是指利用离子交换剂为固定相,根据带点溶质与离子交换剂之间静电相互作用力的差别进行溶质分离的层析方法。根据离子交换剂的性质不同,可将其分为阴离子交换剂和阳离子交换剂。前者对阴离子具有交换能力,活性基团为碱性;后者对阳离子有交换作用,活性基团为酸性。根据其具有离子交换能力的pH范围大小,离子交换剂又有强、弱之分:强离子交换剂具有离子交换作用的pH值范围大,离子化率受pH影响较小;弱离子交换剂离子交换作用的pH值范围小,离子化率受pH影响大。在本发明的实施方式中“阳离子层析”或“阳离子交换层析”均指利用阳离子交换剂进行的层析。在上述步骤中,由于抗体的等电点较高,在pH低于等电点的缓冲液中带正电荷,阳离子交换剂可以通过与溶液中不同阳离子结合强弱不同而将目标产物进行分离。本发明所述的阳离子交换剂典型的有含磺酸基(SO32-),磺丙基(SP),膦酸基(P)等基团的强阳离子交换剂和含羧甲基(CM),羧基(COO-)等离子交换基团的弱阳离子交换剂;优选为含CM或COO-等基团的弱阳离子交换剂,更优选地,为Toyopearl CM或Fractogel COO-。
术语“多聚体”(D/A)可以理解为相同抗体的非共价结合,由两个以上的抗体结合而成的分子。所述抗体可以由单链抗体共价结合(例如二硫键)的均质或异质多条多肽构成。本发明的多聚体可溶于水溶液。例如,二聚体是两个IgG分子的非特异性结合。多聚体的形成与对天然抗体折叠和抗体结构的变形影响因素紧密相关。例如,高盐与极端pH诱导抗体变性形成多聚体。
本发明的定义“上样”是指将待分离的样品加入到层析柱内,使之与层析填料相接触的操作。在本发明的实施方式中,上样可以是将经过适当处理后的阿达木单抗发酵液加入到CEX或HIC层析柱内的操作。
本发明使用的定义“或”表示备选方案,如果合适的话,可以将它们组合,也就是说,术语“或”包括每个所列出的单独备选方案以及它们的组合。例如,“甜菜碱类表面活性剂选自十二烷基二羟乙基甜菜碱、十八烷基二羟乙基甜菜碱或椰油酰胺丙基甜菜碱”表示在一些实施方式中,甜菜碱类表面活性剂可以是十二烷基二羟乙基甜菜碱、十八烷基二羟乙基甜菜碱、椰油酰胺丙基甜菜碱之中的一种,也可以是其一种以上的组合。
附图说明
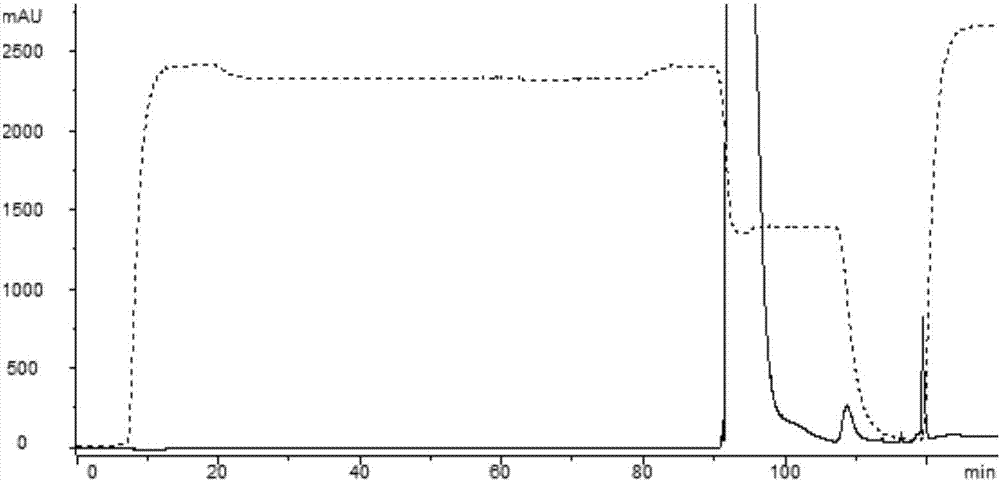
图1为实施例1中Toyopearl CM 650M捕获抗体的层析色谱图。
图2为实施例1中Phenyl Sepharose FF精细纯化层析紫外检测图。
图3为实施例1和对比例1中CEX纯化产物的SEC-HPLC体积排阻层析紫外检测图。
图4为实施例1和对比例1中HIC纯化产物的SEC-HPLC体积排阻层析紫外检测图。
具体实施方式
本发明的具体实施方式包括如下步骤:
1)将CHO细胞发酵表达后进行菌液分离;
2)将发酵液用水稀释,调节pH至6.00±0.10;
3)过阳离子交换柱,用pH 5.5-6.5、含有0.1-0.5mol/L尿素的缓冲液进行第一次洗脱,然后用pH5.5-6.5、含有质量分数0.1%-1.0%的甜菜碱类表面活性剂的缓冲液进行第二次洗脱,收集洗脱组分;
4)将收集的组份通过疏水作用色谱洗脱,收集洗脱组分。
在一些实施方式中,所述的甜菜碱类表面活性剂选自十二烷基二羟乙基甜菜碱、十八烷基二羟乙基甜菜碱或椰油酰胺丙基甜菜碱。
在一些实施方式中,步骤1)所述的分离为将发酵液进行4000-8000g离心,然后对上清液进行6000-8000g离心。在本发明实施例中,所述离心在SIGMA 6K15离心机上进行,离心时间以10-15min为宜。离心的作用是分离细胞和发酵液以及去除细胞碎片。
在一些实施方式中,步骤2)所述的调节pH是用柠檬酸溶液调节至电导率7.0±0.20mS/cm。在一些实施方式中,步骤2)所述的调节pH前,将发酵液用0.45μm滤膜进行过滤,取上清液。
在一些实施方式中,步骤3)中阳离子交换色谱的填料为Tosoh公司的Toyopearl CM 650M,载样量≤60g蛋白质/L填料。可以用20mmol/L PBS,10m mol/L氯化钠,pH 6.0平衡填料,满载好抗体后,用平衡缓冲溶液进行冲洗。在一些实施方式中,采用分段收集,从280nm紫外吸收值上升到总高度的1%开始收集,直到上升到最高值的80%为第一段;接着收集,直到吸收值降低到最高峰的10%为第二段,其中第二段收集物为阳离子纯化物。
在一些实施方式中,步骤4)疏水作用色谱的填料为GE Healthcare的Phenyl Sepharose FF,载样量40mg/mL填料。可以用pH5.5-6.5的20-50mmol/L PBS与1mol/L(NH4)2SO4混合液平衡填料,满载好抗体后,用平衡缓冲溶液进行冲洗,洗脱完毕后,用1mol/L NaOH进行再生。
根据上述技术方案提供的方法,在一些实施方式中,步骤3)所述的第一次洗脱的洗脱液为pH 6.0的含0.2mol/L尿素的20mmol/L PBS缓冲液,在一些更优的实施方式中,所述缓冲液为20mmol/L PBS缓冲液。
在一些实施方式中,步骤3)所述的第二次洗脱的洗脱液为20-60mmol/L柠檬酸盐缓冲液,在一些更优的实施方式中,步骤3)所述的第二次洗脱的洗脱液中含有150-200mmol/L氯化钠。在一些更优的实施方式中,步骤3)所述的第二次洗脱的洗脱液为45mmol/L柠檬酸盐缓冲液;步骤3)所述的第二次洗脱的洗脱液中含有180mmol/L氯化钠、1%质量份的甜菜碱类表面活性剂和2%体积份的乙醇。
上述柠檬酸盐缓冲液也可以是磷酸氢二钠-磷酸二氢钠缓冲液、醋酸钠-醋酸缓冲液,或磷酸氢二钠-磷酸二氢钾缓冲液。在一些优选的实施方式中,其为柠檬酸钠-柠檬酸缓冲液。
根据前述技术方案提供的方法,在一些实施方式中,步骤4)所述的疏水作用色谱洗脱分为2步洗脱,其中,第一步洗脱的洗脱液为pH5.5-6.5、0.15-0.4mol/L(NH4)2SO4的45mmol/LPBS缓冲液,第二步洗脱的洗脱液为pH5.5-6.5的45mmol/L PBS缓冲液。在更优的实施方式中,步骤4)所述的疏水作用色谱洗脱分为2步洗脱,其中,第一步洗脱的洗脱液为pH6.3、0.2mol/L(NH4)2SO4的45mmol/L PBS缓冲液,第二步洗脱的洗脱液为pH6.3的45mmol/L PBS缓冲液。
本发明实施例中所用水均为去离子水。
本发明共提供了4个特定的实施例和1个对比例。实施例1显示了在低上样量时,较优洗脱条件下在阳离子层析步骤添加了有助于多聚体污染物去除和样品稳定的添加剂对纯化效果的影响。对比例1则是在实施例1相同条件下不加添加剂洗脱的纯化结果。接下来,纯化了3批样品,其中实施例2是在较优的纯化条件下增大样品处理量的纯化结果;实施例3和4分别是增大样品处理量的基础上,改变纯化工艺参数的抗体纯化结果。
以下所述的是本发明的优选实施方式,本发明所保护的不限于以下优选实施方式。应当指出,对于本领域的技术人员来说在此发明创造构思的基础上,做出的若干变形和改进,都属于本发明的保护范围。实施例中所用的原料或耗材均可以通过商业途径获得。
实施例1
一)发酵液获取
对表达全人源阿达木单抗的CHO细胞(中国仓鼠卵巢细胞)进行培养并表达阿达木单抗,将表达的抗体进行离心,在SIGMA 6K15离心机上进行4000-8000g离心10-15min,分离细胞和发酵液,将上清进行第二次离心,6000-8000g离心10-15min去除细胞碎片,将上清液转入下一步。
过滤:两次离心后的上清通过0.45μm滤膜进行过滤,过滤完的料液调节后可直接上阳离子柱。
二)过阳离子交换柱(CEX)
1)样品调节:将澄清后的料液稀释1倍,用0.5M柠檬酸调节pH至6.0,此时体积约为210ml;
2)平衡:使用GE公司的层析系统AKTA purifer,选用XK 16/20柱,内含20ml Toyopearl CM 650M填料。保持流速为5mL/min,用20mM PBS,10mM氯化钠,pH6.0的平衡缓冲液平衡。用去约50ml平衡液;
3)上样:保持流速为5mL/min,开始上样;上样体积约200ml;抗体的上样量约600mg;用20mMPBS,10mM氯化钠,pH6.0的缓冲液冲洗至基线平稳。用去约50ml。
4)洗脱1:用20mM PBS,0.2M尿素,pH6.0的平衡缓冲液去冲洗至基线平稳。收集到一个峰(第一步洗脱峰),经检测主要为污染物,用去缓冲液约70ml;
5)洗脱2:用45mM柠檬酸盐缓冲液+180mM NaCl+0.5%十二烷基二羟乙基甜菜碱+2%乙醇,pH6.3,进行洗脱,收集到两部分洗脱峰,第一部分从紫外280nm吸收达到最高值的1%开始收集,到80%最高吸收值停止(第二步洗脱收集1)开始第二段收集(第二步洗脱收集2),至A280在最高峰的10%处停止。经检测第一部分洗脱峰为污染物峰,第二部分为目的峰。第二部分洗脱用去约70ml缓冲液,洗脱峰收集体积约45ml。
6)再生、保存:用1M氯化钠清洗再生。用去离子水降低电导率至零,加20%乙醇保存。
三)过疏水相互作用柱(HIC)
1)样品调节:将阳离子交换柱的洗脱收集峰用2M(NH4)2SO4调节至1M(NH4)2SO4,体积约95ml。
2)平衡:使用GE公司的层析系统AKTA purifer,选用GE的XK 16/20柱,内含20ml Phenyl Sepharose FF填料。保持流速2mL/min,平衡缓冲液为45mM PBS,1M(NH4)2SO4,pH6.3,用去约45ml平衡液。
3)上样:保持流速为2mL/min,开始上样。上样体积95ml。
4)冲洗:用平衡缓冲液冲洗大约30ml。
5)洗脱1:流速2ml/min,用45mM PBS,0.2M(NH4)2SO4,pH6.3,收集洗脱峰,用去洗脱缓冲液约45ml;
6)洗脱2:保持流速2ml/min,用45mM PBS,pH 6.3洗脱,经检测洗脱峰为污染物峰,用去洗脱缓冲液约25ml。
7)再生、保存:用1M NaOH进行柱再生,流速2ml/min。用去离子水降低电导率至零,加20%乙醇保存。
四)结果检测
将收集到的经过纯化的抗体进行检测,项目包括回收率、多聚体。检测方法和条件如下:
通过Poros A(A蛋白)HPLC测定抗体浓度。应用样品稀释物,以达到在校准范围内的读数。Shimadzu HPLC系统配置有Poros A ImmunoDetection传感器药液筒(Applied Biosystems,Foster City,CA)。柱维持在环境温度。系统以2mL/分钟运行。自动进样器托盘温度设为4℃。在280nm监控吸光度。缓冲液A是40mM PBS和400mM NaCl。缓冲液B是50mM磷酸二氢钾和150mM氯化钠。注射样品且使用0-100%缓冲液B洗脱阿达木单抗。
执行尺寸排阻层析(SEC)-HPLC用于样品多聚体的分析。应用样品稀释物,以达到在标准曲线内的读数。Shimadzu HPLC系统配置有SuperoseTM6 10/300GL柱(GE Healthcare)。柱维持在环境温度。系统以0.5mL/分钟运行。自动进样器托盘温度设为4℃。在280nm监控吸光度。缓冲液A是20mM磷酸氢二钠/150mM氯化钠。注射样品且使用100%缓冲液A等度运行阿达木单抗。
检测结果见表1。实施例1中CEX和HIC的AKTA层析图分别见图1和图2。图中,虚线表示电导率,实现表示280nm下的紫外吸收值。图1中,100min前后的峰为洗脱1出峰,120min前后的峰为洗脱2出峰。图2中,95min左右的峰是洗脱1出峰,而110min左右的峰为洗脱2出峰。CEX和HIC目标收集物的SEC-HPLC图分别见附图3和附图4。其中,12.5-15.5min的峰是高分子量聚合物(即多聚体,HMW),15.5-18min内出的峰是主峰(MP),18min之后为低分子量物质(LMW)。
图1显示了采用Toyopearl CM 650M进行CEX纯化的AKTA法。如图中UV峰所示,在上样后的洗脱步骤1和洗脱步骤2的第一部分收集中,主要为污染物峰,而在洗脱步骤2的第二部分收集峰中主要为目标产物。如图3中SEC-HPLC图可见,在去除了大量的多聚体等污染物后,收集的所需抗体,其对于目标污染物多聚体的去除量比对照例1(不加添加剂)要多大概2%。说明这样的添加剂组合对多聚体的去除效果好。
图2显示了采用Phenyl Sepharose FF对CEX收集的所需抗体进行进一步HIC纯化的AKTA法。如图所示,按洗脱1步骤中所述的收集方法,收集到的为所需的抗体纯化物,洗脱2得到的主要为污染物。
实施例2
一)发酵液获取
对表达全人源阿达木单抗的CHO细胞(中国仓鼠卵巢细胞)进行培养并表达阿达木单抗,将表达的抗体进行离心,在SIGMA 6K15离心机上进行4000-8000g离心10-15min,分离细胞和发酵液,将上清进行第二次离心,6000-8000g离心10-15min去除细胞碎片,将上清液转入下一步。
过滤:两次离心后的上清通过0.45μm滤膜进行过滤,过滤完的料液调节后可直接上阳离子柱。
二)过阳离子交换柱(CEX)
1)样品调节:将澄清后的料液稀释1倍,用0.5M柠檬酸调节pH至6.0,此时体积约为400ml;
2)平衡:使用GE公司的层析系统AKTA purifer,选用XK 16/20柱,内含20ml Toyopearl CM 650M填料。保持流速为5mL/min,用20mM PBS,10mM氯化钠,pH6.0的平衡缓冲液平衡。用去约60ml平衡液;
3)上样:保持流速为5mL/min,开始上样;上样体积约400ml;抗体的上样量约1200mg;
4)冲洗:用20mM PBS,10mM氯化钠,pH6.0的缓冲液冲洗至基线平稳。用去约50ml。
5)洗脱1:用20mM PBS,0.2M尿素,pH6.0的平衡缓冲液去冲洗至基线平稳。收集到一个峰,经检测主要为污染物,用去缓冲液约60ml;
6)洗脱2:用45mM柠檬酸盐缓冲液+180mM NaCl+0.5%十二烷基二羟乙基甜菜碱+2%乙醇,pH6.3,进行洗脱,收集到两部分洗脱峰,第一部分从紫外280nm吸收达到最高值的1%开始收集,到80%最高吸收值停止开始第二段收集,至A280在最高峰的10%处停止。经检测第一部分洗脱峰为污染物峰,第二部分为目的峰。第二部分洗脱用去约70ml缓冲液,洗脱峰峰收集体积约70ml。
7)再生、保存:用1M氯化钠清洗再生。用去离子水降低电导至零,加20%乙醇保存。
三)过疏水相互作用柱(HIC)
1)样品调节:将阳离子交换柱的洗脱收集峰用2M(NH4)2SO4调节至1M(NH4)2SO4,体积约140ml。
2)平衡:使用GE公司的层析系统AKTA purifer,选用GE的XK 16/20柱,内含20ml Phenyl Sepharose FF填料。保持流速2mL/min,平衡缓冲液为45mM PBS,1M(NH4)2SO4,pH6.3,用去约50ml平衡液。
3)上样:保持流速为2mL/min,开始上样。上样体积140ml。
4)冲洗:用平衡缓冲液冲洗大约30ml。
5)洗脱1:流速2ml/min,用45mM PBS,0.2M(NH4)2SO4,pH6.3,收集洗脱峰,用去洗脱缓冲液约45ml;
6)洗脱2:保持流速2ml/min,用45mM PBS,pH 6.3洗脱,经检测洗脱峰为污染物峰,用去洗脱缓冲液约25ml。
7)再生、保存:用1M NaOH进行柱再生,流速2ml/min。用去离子水降低电导至零,加20%乙醇保存。
四)结果检测
将收集到的经过纯化的抗体进行检测,项目包括回收率、多聚体。检测方法和条件同实施例1。结果见表1。
实施例3
一)发酵液获取
对表达全人源阿达木单抗的CHO细胞(中国仓鼠卵巢细胞)进行培养并表达阿达木单抗,将表达的抗体进行离心,在SIGMA 6K15离心机上进行4000-8000g离心10-15min,分离细胞和发酵液,将上清进行第二次离心,6000-8000g离心10-15min去除细胞碎片,将上清液转入下一步。
过滤:两次离心后的上清通过0.45μm滤膜进行过滤,过滤完的料液调节后可直接上阳离子柱。
二)过阳离子交换柱(CEX)
1)样品调节:将澄清后的料液稀释1倍,用0.5M柠檬酸调节pH至6.0,此时体积约为400ml;
2)平衡:使用GE公司的层析系统AKTA purifer,选用XK 16/20柱,内含20ml Toyopearl CM 650M填料。保持流速为5mL/min,用20mM PBS,10mM氯化钠,pH6.0的平衡缓冲液平衡。用去约60ml平衡液;
3)上样:保持流速为5mL/min,开始上样;上样体积约400ml;抗体的上样量约1200mg;
4)冲洗:用20mM PBS,10mM氯化钠,pH6.0的缓冲液冲洗至基线平稳。用去约50ml。
5)洗脱1:用20mM PBS,0.5M尿素,pH5.5的平衡缓冲液去冲洗至基线平稳。收集到一个峰,经检测主要为污染物,用去缓冲液约60ml;
6)洗脱2:用45mM柠檬酸盐缓冲液+200mM NaCl+0.1%十二烷基二羟乙基甜菜碱+2%乙醇,pH5.5,进行洗脱,收集到两部分洗脱峰,第一部分从紫外280nm吸收达到最高值的1%开始收集,到80%最高吸收值停止开始第二段收集,至A280在最高峰的10%处停止。经检测第一部分洗脱峰为污染物峰,第二部分为目的峰。第二部分洗脱峰峰收集体积约70ml。
7)再生、保存:用1M氯化钠清洗再生。用去离子水降低电导率至零,加20%乙醇保存。
三)过疏水相互作用柱(HIC)
1)样品调节:将阳离子交换柱的洗脱收集峰用2M(NH4)2SO4调节至1M(NH4)2SO4,体积约140ml。
2)平衡:使用GE公司的层析系统AKTA purifer,选用GE的XK 16/20柱,内含20ml Phenyl Sepharose FF填料。保持流速2mL/min,平衡缓冲液为45mM PBS,1M(NH4)2SO4,pH5.5,用去约50ml平衡液。
3)上样:保持流速为2mL/min,开始上样。上样体积140ml。
4)冲洗:用平衡缓冲液冲洗大约30ml。
5)洗脱1:流速2ml/min,用45mM PBS,0.2M(NH4)2SO4,pH6.0,收集洗脱峰,用去洗脱缓冲液约60ml;
6)洗脱2:保持流速2ml/min,用45mM PBS,pH6.0洗脱,经检测洗脱峰为污染物峰,用去洗脱缓冲液约40ml。
7)再生、保存:用1M NaOH进行柱再生,流速2ml/min。用去离子水降低电导至零,加20%乙醇保存。
四)结果检测
将收集到的经过纯化的抗体进行检测,项目包括回收率、多聚体。检测方法和条件见实施例1。结果见表1。
实施例4
一)发酵液获取
对表达全人源阿达木单抗的CHO细胞(中国仓鼠卵巢细胞)进行培养并表达阿达木单抗,将表达的抗体进行离心,在SIGMA6K15离心机上进行4000-8000g离心10-15min,分离细胞和发酵液,将上清进行第二次离心,6000-8000g离心10-15min去除细胞碎片,将上清液转入下一步。
过滤:两次离心后的上清通过0.45μm滤膜进行过滤,过滤完的料液调节后可直接上阳离子柱。
二)过阳离子交换柱(CEX)
1)样品调节:将澄清后的料液稀释1倍,用0.5M柠檬酸调节pH至6.0,此时体积约为400ml;
2)平衡:使用GE公司的层析系统AKTApurifer,选用XK 16/20柱,内含20ml Toyopearl CM 650M填料。保持流速为5mL/min,用20mM PBS,10mM氯化钠,pH6.0的平衡缓冲液平衡。用去约60ml平衡液;
3)上样:保持流速为5mL/min,开始上样;上样体积约400ml;抗体的上样量约1200mg;
4)冲洗:用20mM PBS,10mM氯化钠,pH6.0的缓冲液冲洗至基线平稳。用去约50ml。
5)洗脱1:用50mM PBS,0.1M尿素,pH6.5的平衡缓冲液去冲洗至基线平稳。收集到一个峰,经检测主要为污染物,用去缓冲液约60ml;
6)洗脱2:用20mM柠檬酸盐缓冲液+150mM NaCl+1.0%十二烷基二羟乙基甜菜碱+2%乙醇,pH6.5,进行洗脱,收集到两部分洗脱峰,第一部分从紫外280nm吸收达到最高值的1%开始收集,到80%最高吸收值停止开始第二段收集,至A280在最高峰的10%处停止。经检测第一部分洗脱峰为污染物峰,第二部分为目的峰。第二部分洗脱峰峰收集体积约70ml。
7)再生、保存:用1M氯化钠清洗再生。用去离子水降低电导率至零,加20%乙醇保存。
三)过疏水相互作用柱(HIC)
1)样品调节:将阳离子交换柱的洗脱收集峰用2M(NH4)2SO4调节至1M(NH4)2SO4,体积约140ml。
2)平衡:使用GE公司的层析系统AKTA purifer,选用GE的XK 16/20柱,内含20ml Phenyl Sepharose FF填料。保持流速2mL/min,平衡缓冲液为45mM PBS,1M(NH4)2SO4,pH6.5,用去约50ml平衡液。
3)上样:保持流速为2mL/min,开始上样。上样体积140ml。
4)冲洗:用平衡缓冲液冲洗大约30ml。
5)洗脱1:流速2ml/min,用45mM PBS,0.2M(NH4)2SO4,pH6.5,收集洗脱峰,用去洗脱缓冲液约60ml;
6)洗脱2:保持流速2ml/min,用45mM PBS,pH6.0洗脱,经检测洗脱峰为污染物峰,用去洗脱缓冲液约40ml。
7)再生、保存:用1M NaOH进行柱再生,流速2ml/min。用去离子水降低电导率至零,加20%乙醇保存。
四)结果检测
将收集到的经过纯化的抗体进行检测,项目包括回收率、多聚体。检测方法和条件同实施例1。结果见表1。
对比例1
一)发酵液获取
对表达全人源阿达木单抗的CHO细胞(中国仓鼠卵巢细胞)进行培养并表达阿达木单抗,将表达的抗体进行离心,在SIGMA 6K15离心机上进行4000-8000g离心10-15min,分离细胞和发酵液,将上清进行第二次离心,6000-8000g离心10-15min去除细胞碎片,将上清液转入下一步。
过滤:两次离心后的上清通过0.45μm滤膜进行过滤,过滤完的料液调节后可直接上阳离子柱。
二)过阳离子交换柱(CEX)
1)样品调节:将澄清后的料液稀释1倍,用0.5M柠檬酸调节pH至6.0,此时体积约为210ml;
2)平衡:使用GE公司的层析系统AKTA purifer,选用XK 16/20柱,内含20ml Toyopearl CM 650M填料。保持流速为5mL/min,用20mM PBS,10mM氯化钠,pH6.0的平衡缓冲液平衡。用去约60ml平衡液;
3)上样:保持流速为5mL/min,开始上样;上样体积约200ml;抗体的上样量约600mg;
4)冲洗:用20mM PBS,10mM氯化钠,pH6.0的缓冲液冲洗至基线平稳。用去约50ml。
5)洗脱:用45mM柠檬酸盐缓冲液+250mM NaCl,pH6.3,进行洗脱,收集到两部分洗脱峰,第一部分从紫外280nm吸收达到最高值的1%开始收集,到80%最高吸收值停止开始第二段收集,至A280在最高峰的10%处停止。经检测第一部分洗脱峰为污染物峰,第二部分为目的峰。第二部分洗脱峰收集体积约45ml。
6)再生:用1M氯化钠清洗再生。
7)保存:用去离子水降低电导率至零,加20%乙醇保护柱子。
三)过疏水相互作用柱(HIC)
1)样品调节:将阳离子交换柱的洗脱收集峰用2M(NH4)2SO4调节至1M(NH4)2SO4,体积约95ml。
2)平衡:使用GE公司的层析系统AKTA purifer,选用GE的XK 16/20柱,内含20ml Phenyl Sepharose FF填料。保持流速2mL/min,平衡缓冲液为45mM PBS,1M(NH4)2SO4,pH6.3,用去约50ml平衡液。
3)上样:保持流速为2mL/min,开始上样。上样体积95ml。
4)冲洗:用平衡缓冲液冲洗,用去约30ml。
5)洗脱1:流速2ml/min,用45mM PBS,0.2M(NH4)2SO4,pH6.3,收集洗脱峰,用去洗脱缓冲液约45ml;
6)洗脱2:保持流速2ml/min,用45mM PBS,pH 6.3洗脱,经检测洗脱峰为污染物峰,用去洗脱缓冲液约25ml。
7)再生、保存:用1M NaOH进行柱再生,流速2ml/min。用去离子水降低电导率至零,加20%乙醇保存。
四)结果检测
将收集到的经过纯化的抗体进行检测,项目包括回收率、多聚体。检测方法和条件同实施例1。结果见表1。
由表1和图4可知,HIC对多聚体有较好的去除效果,其中对照例进行过疏水柱后多聚体从2.727%降低到0.895%,实施例1中多聚体含量从0.778%降低到0.143%,多聚体含量较低,后者达到原料药对该污染物的要求。
表1检测结果
由实施例1和对比例1的结果可以得知,CEX捕获的洗脱过程中添加剂的使用导致实施例1中多聚体含量比不加添加剂的对比例1中含量显著降低。并且在后续的HIC纯化中,实施例1由于在捕获阶段使用了添加剂,导致最终得到的纯化产物中多聚体含量较低,满足原料药对该污染物含量的要求;而对比例1中的CEX纯化样品继续通过HIC层析,多聚体含量并没有降低到原料药要求的水平。实施例2-4的结果显示,三批次的回收率均在91%以上,且通过在第一步层析中加入添加剂,纯化产物中多聚体的含量较低,通过第二步HIC层析,最终都能达到原料药标准。
- 还没有人留言评论。精彩留言会获得点赞!