基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片的制作方法
本发明涉及一种基于电场诱惑的感应电荷电渗的微流控芯片。
背景技术:
细胞是构成生面的基本单元。为了更好的理解生物化学和基因遗传的相关问题,往往需要在培养皿或者复杂的生物反应器中对大量的细胞进行培养分析。然而在分析中,单个细胞的表现会被隐藏,无法得到反应器环境与细胞活动之间相互影响的复杂关系。因而对单个细胞或者颗粒进行捕捉和检测,不仅仅可以对单个细胞的行为进行更好的理解和分析,而且在基因遗传和新陈代谢工程领域具有极其重要的价值。
目前针对单个细胞行为进行操作和分析的方法中,荧光激活细胞分选技术可以对细胞进行高通量的筛选和分类;但是荧光激活细胞分选技术在前期需要大量的、繁琐的和复杂的样品处理过程,而且不能得到单个细胞随时间变化的行为和表现。近年来快速发展的微流控技术是把生物和化学领域中所涉及的样品制备、反应、分离和检测基本操作单元集成或基本集成到一块几平方厘米甚至更小的芯片上,由微通道形成网络,自动完成分析全过程,大大促进了对单细胞的捕捉分析的发展。常用的捕捉方法有微孔、光学、声场、磁场以及电场捕捉的方法,但微孔捕捉法容易带来潜在的剪切应力以及细胞容易被流动的流体冲走;光学捕捉法、声学捕捉法和磁场捕捉法一般将细胞捕获至能量最高的位置;因此,微孔捕捉法、光学捕捉法、声场捕捉法、磁场捕捉法均不利于细胞捕捉。而在电场捕捉法中,尽管基于负介电泳力捕获细胞时,细胞将被捕获至电场最低的位置,但是容易产生焦耳热,同时电场捕捉法不适合捕捉尺寸较小的细胞。
技术实现要素:
本发明的目的是为了解决介电泳捕捉法不适合捕捉尺寸较小的细胞和在捕获细胞时容易产生焦耳热的问题,提出一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片。
本发明所述的一种基于电场诱导的感应电荷电渗的细胞捕捉芯片包括玻璃基底、PDMS盖片、第一激发电极、第二激发电极、第三激发电极、第四激发电极和悬浮电极阵列;
所述PDMS盖片固定在玻璃基底上;在PDMS盖片上开有两条相互垂直的PDMS通道;一条PDMS通道的一端设置有主通道入口,另一端设置有主通道出口;另一条PDMS通道的一端设置有副通道入口,另一端设置有副通道出口;
所述悬浮电极阵列设置在所述两条相互垂直的PDMS通道的交点处;
所述第一激发电极、第二激发电极、第三激发电极和第四激发电极均固定在玻璃基底上,第一激发电极的内端部、第二激发电极的内端部、第三激发电极的内端部和第四激发电极的内端部分别位于悬浮电极阵列的四个不同方向,并且第一激发电极的内端部与第四激发电极的内端部相对设置,第二激发电极的内端部与第三激发电极的内端部相对设置。
本发明的工作原理为:含有单个细胞的溶液由主通道入口注入,经主通道出口排出,营养物质由副通道入口注入,细胞的代谢产物经副通道出口排出;在第一激发电极、第二激发电极、第三激发电极和第四激发电极上施加电位差分别为0°、90°、180°和270°的行波信号后,在悬浮电极阵列处产生感应电荷,形成双电层,在行波信号后的作用下,双电层中的粒子被驱动,然后产生电渗流,依靠电渗流将悬浮电极阵列周围的细胞捕获至悬浮电极阵列。
本发明的有益效果是依靠电渗流进行细胞捕获,溶液的电导率比较低,不容易产生焦耳热;由于细胞捕获悬浮电极阵列,捕捉细胞的尺寸由悬浮电极的尺寸决定的,因此更适合捕捉不同尺寸和形状的细胞;副通道入口能注入营养物质以供细胞代谢,能让细胞长时间存活;同时,该芯片易于操作,施加的电压小,能够实现高效单个捕捉,单个捕捉的效率能够达到75%。
附图说明
图1为具体实施方式一所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片结构示意图;
图2为具体实施方式二中悬浮电极阵列的排布结构示意图;
图3为具体实施方式二中单个PS微球的捕获实验示意图;
图4为具体实施方式二中单个酵母菌的捕获实验示意图。
具体实施方式
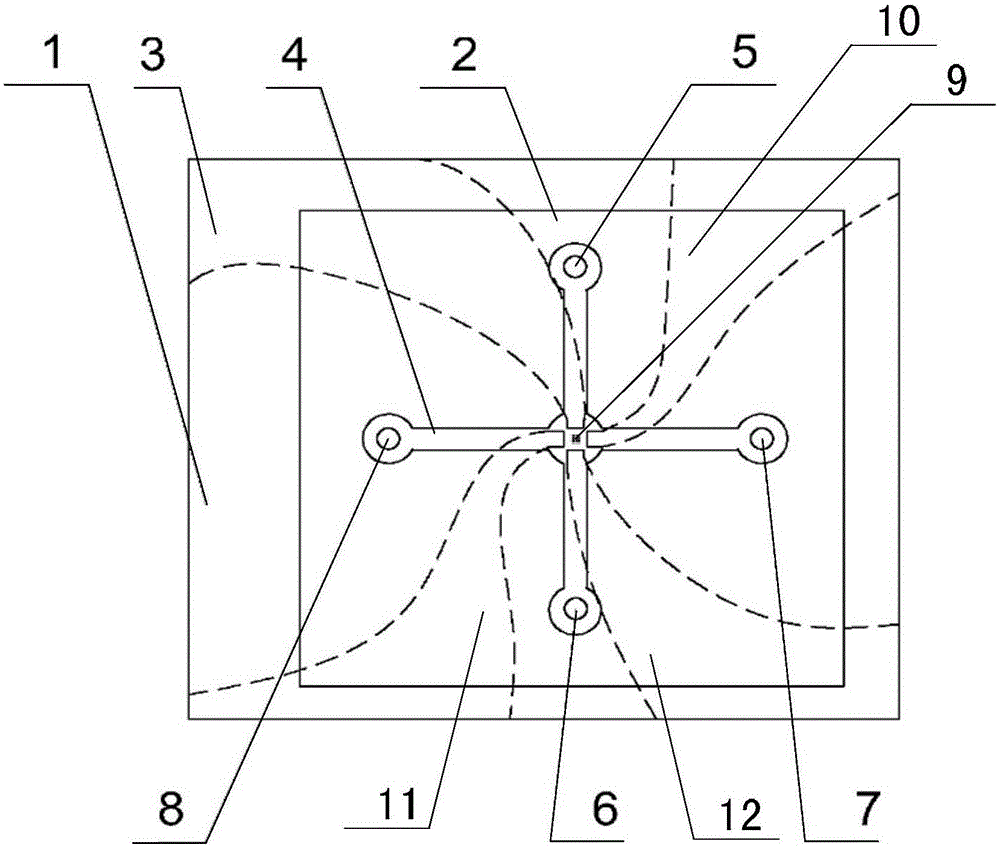
具体实施方式一:结合图1说明本实施方式,本实施方式所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片包括玻璃基底1、PDMS盖片2、第一激发电极3、第二激发电极10、第三激发电极11、第四激发电极12和悬浮电极阵列9;
所述PDMS盖片2固定在玻璃基底1上,玻璃基底1用于承载PDMS盖片2、第一激发电极3、第二激发电极10、第三激发电极11、第四激发电极12和悬浮电极阵列9;在PDMS盖片2上开有两条相互垂直的PDMS通道4;一条PDMS通道的一端设置有主通道入口5,主通道入口5用于注入含有单个细胞的溶液,另一端设置有主通道出口6,主通道出口6用于排出经由主通道入口5注入的含有单个细胞的溶液;另一条PDMS通道4的一端设置有副通道入口7,副通道入口7用于注入营养物质以供细胞代谢,另一端设置有副通道出口8,副通道出口8用于排出细胞代谢产生的废物;
所述悬浮电极阵列9设置在所述两条相互垂直的PDMS通道4的交点处,悬浮电极阵列9用于捕捉单个细胞;
所述第一激发电极3、第二激发电极10、第三激发电极11和第四激发电极12均固定在玻璃基底1上,第一激发电极3的内端部、第二激发电极10的内端部、第三激发电极11的内端部和第四激发电极12的内端部分别位于悬浮电极阵列9的四个不同方向,并且第一激发电极3的内端部与第四激发电极12的内端部相对设置,第二激发电极10的内端部与第三激发电极11的内端部相对设置;第一激发电极3、第二激发电极10、第三激发电极11和第四激发电极12上施加电位差分别为0°、90°、180°和270°的行波信号,在悬浮电极阵列9处产生感应电荷,形成双电层,在行波信号后的作用下,双电层中的粒子被驱动,然后产生电渗流,依靠电渗流将悬浮电极阵列9周围的细胞捕获至悬浮电极阵列9;所述悬浮电极阵列9周围的电渗流滑移的时均流速:
其中,<vs>为电渗流滑移的时均流速,ε为溶液的介电常数,η为溶液的粘度,为诱导的zeta电势,为激发电极表面电势,为双电层外侧电势,E为产生行波信号的电场强度,Et为产生行波信号电场的切线分量,*为共轭复数,波浪线为复振幅,n为法向量,δ为双电层中的扩散层电容与双电层中的Stern层电容之比。
具体实施方式二:结合图2和图3说明本实施方式,本实施方式是对具体实施方式一所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片进一步限定,在本实施方式中,所述悬浮电极阵列9包括N×N个悬浮电极,N×N个悬浮电极以N排N列的形式排列,并且悬浮电极阵列9为正方形;
所述N均为大于3的整数。
在本实施方式中,如图2所示,悬浮电极为圆柱体,圆柱体的直径d为20μm,两个同排或同列相邻的两个圆柱体的轴心距D为40μm。
在捕获细胞的实验过程中,首先,在烧杯中加入一定量的去离子水,不断缓慢的加入氯化钾,并用电导率仪实时监测溶液电导率,得到电导率为1mS/m缓冲液II;利用缓冲液II配制出800-2500个/微升的不同浓度的细胞溶液;将无水乙醇和吐温溶液以9:1的体积比进行配置,得到A溶液,A溶液的作用主要是可以减少粒子在通道或者基底表面粘结;随后,将A溶液分别和配制好的不同浓度的细胞溶液以1:99的体积比进行配置,得到F溶液。
其次,进行实验操作;步骤一、打开计算机、信号发生器、信号放大器、示波器、显微镜、CCD以及荧光灯开关,观察设备运转是否正常;随后打击开电脑上的Q-CapturePro图像采集软件,实时观察显微镜载物台上的情景。
步骤二、将本实施方式所述的一种基于电场诱导的感应电荷电渗的细胞捕捉芯片固定在载物台上,调好芯片位置和焦距,在出口处滴入少量的A溶液,润湿整个主通道,可以保证细胞不沾在通道壁上;在显微镜下观察,保证PDMS通道4完全润湿。随后将一个25微升的微量进样器固定在注射泵上,并吸入一定量F溶液,再将吸入一定量F溶液注射泵的注射头插入主通道入口5,并保证密封良好;同样再将一个25微升的微量进样器固定在注射泵上,并吸入一定量营养液,再将吸入一定量营养液注射泵的注射头插入副通道入口7,并保证密封良好。
步骤三、将第一激发电极3、第二激发电极10、第三激发电极11和第四激发电极12分别与信号放大器连接好,并调整好信号发生器上的信号电压、相位差和频率等参数以及注射泵上的流量控制参数。
步骤四、同时启动两个注射泵,让F溶液按照控制好的流速在主通道入口5流入,让营养液按照控制好的流速在副通道入口7流入,当通道内流体流动稳定时,按下信号发生器上的施加信号按钮。
步骤五、在显微镜下进行观察,并再次调整好焦距和本实施方式所述的捕捉芯片的位置,选择粒子最清晰时,记录结果;
为了更好捕获酵母菌细胞,鉴于酵母菌直径与5μmPS微球相近,首先采用PS微球进行以上实验操作,记录结果如图3所示,在图3中能够清晰的看到本实施方式所述的捕捉芯片对单个PS微球的捕捉效率为75%。
然后采用酵母菌进行以上实验操作,记录结果如图4所示,在图4中能够清晰的看到本实施方式所述的捕捉芯片对单个细胞的捕捉效率为75%。
具体实施方式三:本实施方式是对具体实施方式二所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片进一步限定,在本实施方式中,所述第一激发电极3的内端部与第四激发电极12的内端部相距的距离大于悬正方形浮电极阵列9边长,第二激发电极10的内端部与第三激发电极11的内端部相距的距离大于正方形悬浮电极阵列9边长,以保证F溶液能够正常通过PDMS通道4。
在本实施方式中,第一激发电极3的内端部与第四激发电极12的内端部相距的距离与第二激发电极10的内端部与第三激发电极11的内端部相距的距离L均为2580μm,第一激发电极3的内端部宽度、第二激发电极10的内端部宽度、第三激发电极11的内端部宽度和第四激发电极12内端部宽度W均为2300μm。
具体实施方式四:本实施方式是对具体实施方式三所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片进一步限定,在本实施方式中,所述玻璃基底1与第一激发电极3、第二激发电极10、第三激发电极11和第四激发电极12为一体结构,并且,第一激发电极3、第二激发电极10、第三激发电极11和第四激发电极12均为ITO电极。
在本实施方式中,玻璃基底1表面具有一层ITO导电膜,通过对玻璃基底1表面的ITO导电膜腐蚀后留存得到第一激发电极3、第二激发电极10、第三激发电极11和第四激发电极12,这样能够更好的保证玻璃基底1和PDMS盖片2的密封性。
具体实施方式五:本实施方式是对具体实施方式四所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片进一步限定,在本实施方式中,所述两条相互垂直的PDMS通道4的交点处设置有圆形反应腔,圆形反应腔直径范围把第一激发电极3、第二激发电极10、第三激发电极11和第四激发电极12的内端部包容在内,圆形反应腔用于保证F溶液和营养液的充分混合,用时又能保证F溶液正常通过PDMS通道4。
具体实施方式六:本实施方式是对具体实施方式五所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片进一步限定,在本实施方式中,所述主通道入口5、主通道出口6、副通道入口7和副通道出口8均为圆形,并且主通道入口5处、主通道出口6出、副通道入口7处和副通道出口8处均设置有金属连接器;金属连接器用于连接注射泵的注射头,保证注射泵的注射头与主通道入口5和副通道入口7的密封性良好。
所述金属连接器为圆环状,金属连接器的内径为0.8mm-1mm。
具体实施方式七:本实施方式是基于具体实施方式六所述的一种基于旋转电场诱导的感应电荷电渗的细胞捕捉芯片的制备方法,该方法是基于以下步骤实现的:
一、PDMS通道加工:(1)、模具硅基底的前期处理:首先,使用清洗剂手洗,然后依次置于丙酮和异丙醇中超声清洗10分钟,其次,再用等离子水冲洗,用氮气吹干;最后,将吹干后的硅基底置于烘烤箱中,在80度下,加热15分钟。
(2)、光刻胶的平铺:首先,甩胶;采用负光刻胶SU-8 2050在甩胶机上以1500r/s的速度旋转30秒;其次,前烘;在热板上从60℃递增到95℃后,在95℃保持1小时。
(3)、曝光:在UV灯下,将通道MASK放置在光刻胶上面,注意,让MASK带有墨的那一侧紧贴光刻胶;然后用透光板将其压紧,置于UV灯下,进行曝光。
(4)、显影:显影之前,需要进行后烘,即在热板上加热,从60℃递增到95℃后,在95℃保持35分钟;接下来将冷却后的SU-8模具放置于专用的SU-8显影液中进行显影。显影十分钟后取出。再用等离子水清洗,氮气吹干,随后烘烤箱中80℃下烘烤10~20分钟。
(5)、浇筑PDMS:将PDMS与固化剂按照10:1的质量比配好,用洁净的玻璃棒搅拌15~20分钟,抽真空30分钟保证搅拌均匀的混合物中气泡完全消失,然后将通道干膜硅烷化处理,使通道模子表面沉积一层硅烷,有助于PDMS与通道模子不粘连,容易将PDMS通道从模子上脱离;最后,在浇筑硅烷处理后的通道模子上浇筑PDMS;再抽真空20分钟,保证无气泡后,置于烘烤箱中,在80℃下加热2小时;即可固化。
(6)、PDMS通道处理:将固化后的PDMS从模子上缓慢揭下,并用刀片将其切割成规则的形状,根据具体实施方式六所述的捕捉芯片的结构,用打孔器开出主通道入口、主通道出口、副通道入口和副通道出口。
二、ITO电极加工:(1)、清洗具有一层ITO导电膜的玻璃基底1:首先,使用清洗剂手洗,然后依次置于丙酮和异丙醇中超声清洗10分钟,其次,再用等离子水冲洗,用氮气吹干;最后,将吹干后的硅基底置于烘烤箱中,在80度下,加热15分钟。
(2)、光刻胶的平铺:首先,甩胶;采用安智光刻胶AZ4620在甩胶机上以3100转/秒的速度旋转40秒,所述光刻胶AZ4620用于保护ITO导电膜不被腐蚀;其次,软烘,在热板上以100度加热6分钟。
(3)、曝光:根据具体实施方式六所述的捕捉芯片的参数,在UV灯下曝光。
(4)、显影:将曝光后的玻璃基底1放置于专用的AZ显影液(NMD-W,2.38%)中,显影4-5分钟。
(5)、腐蚀ITO导电膜:将曝光显影后的ITO置于质量比为60%的盐酸溶液中,并加入一定的催化剂氯化铁,浸泡40min,进行腐蚀(此过程中固化的正光刻胶起保护作用,没有覆盖光刻胶的ITO导电膜将被腐蚀掉)。
(6)、去除光刻胶:腐蚀完成后,在质量比为5%的NaOH溶液中浸泡,去除固化的光刻胶,得到完整的ITO电极结构。
三、玻璃基底1和PDMS盖片2的键合:将玻璃基底1设有ITO电极的一侧和PDMS盖片2设有PDMS通道4的一侧朝上,并列放在等离子机的腔室内,按照等离子机的相应步骤进行等离子化处理;随后取出,在显微镜下,进行对准;对准后,用力按压几分钟,接着放置在烘烤箱中在80度下加热30分钟。所述在对准的过程中需要微调整时,不要用力按压,尽量轻拿轻放,以免键合住无法移动。键合是十分关键的一步,键合的好与坏直接影响到最后的PDMS通道4的密封效果,进而影响到实验结果的可靠性和准确性。
- 还没有人留言评论。精彩留言会获得点赞!