一种卤虫雄性化因子及其应用的制作方法
本发明属于动物性别和生殖调控的技术领域,具体涉及一种卤虫雄性化因子及其应用。
背景技术:
卤虫也称盐水丰年虫,分类上属于节肢动物门,甲壳亚门,鳃足纲,无甲目,盐水丰年虫科,卤虫属。卤虫繁殖周期短,生长迅速,作为一种重要的饵料生物和良好的实验动物材料,一直受到人们的广泛重视。卤虫具有特殊的生殖方式,可分为两性生殖卤虫和孤雌生殖卤虫两大类。同时,卤虫在生长过程中存在两种发育方式:一种是卵胎生,即雌性卤虫交配受精后,受精卵在雌性卵囊内发育成无节幼体,并从母体中释放出来。在正常的生活条件下或实验室人工培养条件下,卤虫都是卵胎生以这种途径发育的。卤虫另一种发育方式是卵生,即形成被囊包被的卵。这种卵中大约有4000个细胞,包被在一层极性分子不能透过的壳中,形成所谓的休眠卵。卤虫因其具有的独特生殖方式和不同的发育方式,逐渐成为非模式动物性别和生殖研究的良好实验材料。
性别决定是物种进化选择的结果,也是生物生命活动的基本特征。两性生物的性别决定与分化不仅是个体正常发育和生存所不可或缺的,也是种族繁衍延续的物质基础。动物性别决定机制存在复杂性和多样性,主要内因是性别决定基因级联互作调控的结果。除在性染色体上存在性别决定相关基因之外,在常染色体上也发现不少动物重要性别决定相关基因,且部分基因之间存在紧密的级联互作,如sxl,tra,dsx,csd和fem基因等。近年来,模式动物的性别决定机制取得了一定进展,但对非模式动物的研究还处于起步阶段,但却越来越受到重视。
因此,通过对卤虫体内的雄性化基因进行克隆、表达特征分析和基因功能等研究,进而在动物水平层面阐明雄性化因子在性别调控方面的功能及其在高雌性群体诱导中的生产操作实践,提供雄性化基因在调控动物雌雄性别和培育高雌性后代中的应用,将对动物性别和生殖领域研究提供极佳的实验思路和技术提升。
技术实现要素:
本发明提供一种卤虫雄性化因子及其应用,具体就是一种编码卤虫雄性化基因的核酸分子和多肽,并提供一种基于雄性化基因沉默的RNA干扰方法,实现卤虫高雌性群体的生产技术,阐明雄性化基因在调控动物雌雄性别和培育高雌性后代中的应用。
本发明提供一种卤虫雄性化因子,其编码的蛋白包含有:
1)氨基酸序列为SEQ ID NO:2的蛋白;
2)与SEQ ID NO:2的蛋白具有至少70%的氨基酸序列同一性,且与1)中蛋白功能相一致的蛋白。
上述雄性化因子,其核苷酸序列为SEQ ID NO:1;
本发明再一个方面提供一种下调卤虫雄性化基因表达的双链RNA分子,所述双链RNA分子包括正义链和反义链,其中反义链或正义链为SEQ ID NO:1所述的核苷酸序列的片段,或与选定的片段具有至少70%互补的核苷酸序列。
作为实施例的优选,所述的双链RNA分子的正义链或反义链的核酸序列为SEQ ID NO:3;
本发明还提供一种用于产生能够下调卤虫的雄性化基因表达的双链RNA分子的DNA构建体,所述DNA构建体用于转录上述的双链RNA分子。
本发明还提供一种降低上述卤虫雄性化因子表达量的方法,是将上述的双链RNA分子转化或转染到生物体内;
本发明进一步提供一种获得雌性卤虫子代或假雌性卤虫子代的方法,是通过降低或去除上述雄性化基因表达量的卤虫作为亲本来交配产卵获得的;
所述的降低或去除上述雄性化基因表达量,是通过引入上述的双链RNA或DNA构建体来完成的;
根据一些实施案例,引入所述双链RNA或DNA构建体是通过注射、浸入、经皮或喂食来进行。根据某一实施方案,所述双链RNA或DNA构建体是通过注射来施用。
本发明基于雄性化基因的核酸和蛋白序列信息,综合运用RNA干扰技术和基因表达调控等生物技术,实现卤虫类雄性化基因的有效沉默,进而在动物水平层面阐明雄性化因子在性别调控方面的功能及其在高雌性群体诱导中的生产操作实践,提供雄性化基因在调控动物雌雄性别和培育高雌性后代中的应用,将对动物性别和生殖领域提供极佳的实验思路和技术提升。
附图说明
图1:雄性化因子锌指蛋白结构域的氨基酸序列相似性比对结果图;
图2:雄性化基因的雌雄差异表达
图3:胚胎发育时期的雄性化基因表达特征
图4:休眠卵孵化过程的雄性化基因表达特征
图5:雄性化基因的RNA干扰样品制备
图6:雄性化基因的RNA干扰效率测定
图7:卤虫(双线期雌性)雄性化基因沉默后的子代雌雄统计
图8:卤虫(成体)雄性化基因沉默后的子代雌雄统计
具体实施方式
本发明提供基于卤虫的雄性化基因表达沉默的方法,特别是通过RNA干扰的方法。通常,RNA干扰(RNAi)是指由小干扰RNA(siRNA)介导的序列特异性转录后基因沉默过程,是指一种分子生物学上由双链RNA诱发的序列特异性基因沉默现象,其机制是通过阻碍特定基因的翻译或转录来抑制基因表达。当细胞中导入与内源性mRNA编码区同源的双链RNA时,该mRNA发生降解而导致基因表达沉默。因此,本发明包含各自能够下调节肢动物,特别是卤虫雄性化因子表达的双链RNA、微小RNA、反义寡核苷酸、小发夹RNA(shRNA)等。
根据本发明,RNA干扰剂或RNAi剂是工程化为能够在靶细胞中转录双链RNA的双链RNA或DNA构建体,该双链RNA包含与SEQID NO:1的核苷酸序列或与其同系物或片段或部分至少70%互补的RNA链。
应理解的是,可对本发明的dsRNA进行化学修饰。可用于本发明的修饰
dsRNA化合物的具体实施包括修饰的骨架或非天然核苷键的寡核苷酸。另外,根据本发明的修饰的核苷酸还可以包含一个或多个取代的糖部分。另外,本发明的寡核苷酸可化学连接于增强寡核苷酸的活性、细胞分布或细胞摄取的一个或多个部分或共轭物。这些部分或共轭物可包括共价结合于功能基团诸如伯羟基或仲羟基的共轭基团。本发明的共轭基团包括嵌入剂、报告分子、聚胺、聚酰胺、聚乙二醇、聚醚、增强寡聚物的药效学特性的基团以及增强寡聚物的药代动力学特性的基团。典型的共轭基团包括胆固醇、脂质、磷脂、生物素、吩嗪、叶酸酯、菲啶、蒽醌、吖啶、荧光素、罗丹明、香豆素类和染料。
RNAi剂可通过包括但不限于以下技术向本发明的靶水生生物体施用:电穿孔、注射、微注射、快速注射、进入、摄食(喂食)、磷酸钙-DNA共沉淀、DEAE-葡聚糖介导的转染、聚凝胺介导的转染、脂质体融合、脂质转染法、原生质体融合、逆转录病毒注射、生物弹法(粒子轰击,如使用基因枪)或病毒载体直接转染细胞。对于节肢动物,注射、微注射、经由浸入或摄食(喂食)而口服、或经皮方法是优选。RNAi剂可以裸形式引入靶生物体。裸形式是指RNAi剂不含有可作用以促进浸入靶细胞的任何递送媒介物,诸如脂质体制剂、带电荷的脂质或沉淀剂。如有需要,可使用递送剂。RNAi剂可以组合物递送,组合物进一步包含核酸凝聚剂诸如亚精胺、硫酸鱼精蛋白、聚赖氨酸、壳聚糖或本领域已知的其他核酸凝聚剂。雄性化基因的“基因递送”或“基因转移”是指用于可靠地将外源核酸插入靶细胞的方法或系统,且可导致目的基因的瞬时或长期表达。
RNAi剂可在生命周期的任何阶段施用于节肢动物,包括未受精的卵或受精卵、或胚胎、或未成熟阶段幼体、或幼虫阶段、或成熟阶段。出于实践考虑,如果RNAi剂将通过注射或微注射向动物体递送,动物是肉眼可见将是优选的。在卤虫中,最有利的实施阶段是在卵细胞形成阶段、胚胎阶段、幼虫阶段之前或期间施用RNAi剂。
在向靶生物体施用RNAi剂的方法的一个方式中,使用携带RNAi剂的饲料活生物体。例如,幼体和成体阶段消耗单细胞和多细胞食物源,诸如浮游生物、类似浮游生物的滤食生物、藻类和酵母。这些食物源可以在水产养殖中采用,可用RNAi剂转化这些食物源以使靶生物体通过摄食食物源最终获得RNAi剂。螺旋藻属、水蚤属、小球藻属、细菌和小型原生动物等是用于喂养养殖的小卤虫和成卤虫的饲料活源的实例,其可被遗传改造以向卤虫递送RNAi。饲料活生物体可以是活体的,也可制备为冷冻干燥、冷藏或冷冻形式。
本发明的组合物可以是固体、半固体或液体形式。取决于施用方式和RNAi剂的性质,组合物可为了向靶生物体递送而适当地配制。组合物可进一步包含载体。RNAi剂可与之混合的载体包括常规赋形剂,并可以是水性溶剂(诸如水、盐水或PBS)、油、右旋糖、甘油、润湿剂或乳化剂、增溶剂、稳定剂、抗氧化剂、防腐剂、包衣剂、粘合剂、填充剂、崩解剂、稀释剂、润滑剂、pH缓冲剂及类似物。
对于跨粘膜或经皮施用,在制剂中使用适于将被穿透的屏障的渗透剂。这样的渗透剂通常是本领域已知的,包括如去垢剂、胆酸盐和呋西地酸衍生物。本发明的dsRNA制剂包括但不限于溶液、乳剂、泡沫和含脂质体的制剂等。本发明包含的RNAi剂在制备用于抑制雄性化因子在节肢动物,特别是包含但不限于卤虫在内的表达组合物的用途。
本发明的组合物包含能够减少靶RNA的量至少30%,优选的40%、50%、60%、70%、80%或90%或更高的RNAi剂的量。最佳剂量随着施用途径变化,RNAi剂的施用频率和施用时间可由本领域技术人员通过简单的实验最佳的确定。
根据进一步的实施方案,本发明提供与SEQ ID NO:1中所列的核苷酸序列或其同系物或片段互补的反义寡核苷酸序列,其中反义寡核苷酸序列能够与SEQ ID NO:1或其同系物或片段特异性杂交,从而抑制节肢动物中雄性化蛋白的表达。
根据一些实施方案,核苷酸的区域选自5’非翻译区、密码子区、终止密码子区和3’非翻译区组成的组。根据某些实施方案,反义寡核苷酸序列包含至少20个核苷酸。应理解的是,寡核苷酸序列可优选的包括从约290-1100个核苷酸构成。
沉默的雄性和雌性卤虫用于子代幼体的培育。进一步公开,雌雄亲本体内的雄性化基因的表达沉默,导致其子代群体中部分雄性个体性别发生逆转变成雌性个体,使群体中呈现71.4%-93.3%高雌性比例的卤虫分布。通过下调卤虫雄性化基因表达,高达42.9%-86.7%的雄性卤虫呈现雌性化。
下面结合实施例对本发明进行详细的描述。
实施例1雄性化基因和多肽的鉴定
通过从卤虫基因库中获得完整的卤虫雄性化基因的序列,利用ExPASx蛋白组学服务器(http://ca.expasy.org/tools/dna.html)计算机翻译,并选择最可能的框架。由SMART和CBS预测服务器(http://www.cbs.dtu.dk/services/)进一步评价推定的氨基酸和多肽序列。卤虫的雄性化因子(Artemiafranciscana masculinization gene,AfrMasc)的基因开放阅读框1077bp(SEQ ID NO:1),推演生成含358个氨基酸的多肽序列(SEQ ID NO:2),推演的开放阅读框中存在一个串联的含CCCH的锌指结构(WKEDSLCRDFLRNSCQRGERCKFVHAFG和IKELQFCHDFQNTGCPRRLCKFVHCTI)。
将卤虫雄性化因子锌指蛋白结构域的氨基酸序列与节肢动物门其他物种的进行相似性比对,结果表明无甲目的卤虫、十足目的罗氏沼虾和鳞翅目的家蚕三个物种中的锌指蛋白结构域中都含有保守的C-C-C-H氨基酸序列,且在两个结构域中分别含有若干个保守的氨基酸组成(图1)。
实施例2雄性化基因的时空表达特征鉴定
(1)雄性化基因在雌雄个体中的表达情况
挑取健康、成熟的雌性和雄性卤虫,并利用Trizol试剂盒的方法进行总RNA抽提。随后通过分光光度法在260nm对RNA定量。第一链cDNA通过从1ug总RNA在42℃的逆转录反应(Reverse Transcriptase MMLV(RNase H-))30分钟,以Oligod(T)作为引物来合成,根据M-MLV逆转录酶的逆转录酶反应制造商的说明书制备。卤虫雄性化基因的雌雄个体表达通过荧光定量PCR扩增检测,通过利用正向引物5’-CAACAGTCCCAACAGTTCA-3’和反向引物5’-CTAAGGGTATGCCAAAGAA-3’特异性引物证明。卤虫的Tubulin微管蛋白基因用作阳性对照(AF078670.1),选用恒定表达的基因18S作为内参,通过利用正向引物5’-GGACATAGAGCGCCCAACTT-3’和反向引物5’-GACAGGCGCATAGGTAACCA-3’特异性引物证明。将雄性化基因的相对定量通过利用上述雄性化基因引物和SRYBGreen PCR Master混合物(ApplliedBiosystem)按照制造商的说明书(SYBR Premix Ex TaqTM(TliRNaseH Plus),Takara)进行。将获得的数据根据各组织和18S核糖体RNA水平标准化两次,然后将标准化的数据表示为2-△△ct。
由荧光实时定量PCR结果显示,卤虫的雄性化基因的转录物在性成熟的卤虫雌雄个体中差异分布,雌性卤虫体内雄性化基因的含量明显高于雄性卤虫中的含量(图2)。
(2)雄性化基因在卵细胞和胚胎发育时期的表达特征
卤虫在生长过程中存在两种发育方式:一种是卵胎生,即在温度适宜、光照、氧气和食物充足的有利生存条件下,卤虫以无节幼体的方式排出母体。在此过程中,雌性卤虫的卵母细胞堆积在两侧输卵管中,形成肉眼可见的“双线”期;随后卵母细胞迁移到两侧输卵管末端膨大的侧袋中,形成“双卵”期;待雌性卤虫交配受精后,受精卵转移至腹部膨大的卵囊袋中,形成肉眼可见的“单卵”期;最后,胚胎在雌性卵囊内经历约4-5天的发育,变成无节幼体,并从母体中释放出来。
根据雌性卤虫的卵细胞和胚胎发育的不同时期,分别选取含双线期和双卵期卵细胞的卵囊,及含单卵期第一天至第四天的卵囊样品,进行胚胎发育时期的雄性化基因表达特征分析。荧光实时定量PCR操作同上所示,研究结构表明,雄性化基因在卵细胞的形成和单卵胚胎发育早期呈现高量的表达,随着胚胎发育的进行,雄性化基因的表达逐渐降低(图3)。因此,推测雄性基因在卤虫胚胎早期的性别决定和调控过程具有重要作用。
(3)雄性化基因在休眠卵孵化过程的表达特征
卤虫在生长过程中除了卵胎生的方式之外,另一种方式是卵生,即在生存环境比较恶劣的状况下,卤虫会以卵生的方式产生休眠卵。休眠卵包含约4000个发育停滞与原肠胚期的细胞,包被在一层极性分子不能透过的厚壳。休眠卵需要经过一定的激活条件,如脱水、缺氧和冷冻等处理后,在适宜的环境条件中,才可以孵化出无节幼虫。因此,利用荧光实时定量PCR检测休眠卵孵化过程的雄性化基因表达特征,分别对休眠卵及孵化过程的0小时、12小时、24小时、36小时、48小时和72小时的孵化胚胎进行取样检测。研究结果表明,雄性化基因在休眠卵中高量表达,随着休眠卵孵化的进行,其表达量逐渐降低(图4)。
实施例3雄性化基因的表达沉默
RNA干扰样品的制备
构建包含GFP或卤虫雄性化基因的dsRNA表达载体。通过一对雄性化基因特异性引物进行PCR扩增。根据卤虫雄性化基因的cDNA序列设计带有酶切位点的正向引物5’-GCTCTAGAAATCGAAACGCAGGAAA-3’(下划线处为XbaI酶切位点)和反向引物5’-CGGGATCCCCCAGACACAACTGATGACA-3’(下划线处为BamHI酶切位点)。将包含卤虫雄性化基因的cDNA为模板,进行PCR扩增(94℃持续3分钟,随后是94℃持续30秒、55℃持续30秒、72℃持续30秒的35个循环,随后是72℃持续10分钟),克隆雄性化基因片段,获得目的基因序列(SEQ ID NO:3)。
PCR扩增产物在1.2%琼脂糖凝胶上进行电泳,利用UV光在溴化乙锭中显现,从凝胶切下并利用QIAquick RCR纯化试剂盒(QIAGEN)纯化。根据制造商的说明书,利用pET-T7质粒构建含有目的基因片段的表达载体,并将含有基因片段插入的pET-T7表达载体转化到表达型菌株E.coli HT115中。利用双链RNA表达载体pET-T7诱导表达合成dsRNA,随后根据制造商的说明书利用Trizol试剂盒抽提菌体总RNA,通过加热到65℃持续20分钟来使两条链杂交,然后自然冷却至室温,使其冷却复性。随后加入RNase A进行酶切处理,去除单链RNA,苯酚和氯仿纯化双链RNA,乙醇沉淀。溶解纯化后的双链RNA样品并定量(图5),将其保存在-20℃直到使用。
卤虫体内雄性化基因沉默
选取体质健壮的成体卤虫进行RNA干扰。利用显微注射的方法,向每只动物的生殖体节处注射1μg雄性化基因的双链RNA或GFP基因的双链RNA,放回水系统中继续饲养。RNA干扰10天后,检测雄性化基因的表达水平。抽提含目的基因的组织RNA,逆转录合成cDNA。利用荧光定量PCR的方法,以18S基因作为内参,检测雄性化基因的表达水平,荧光定量PCR放上同上所述。结果表明,RNA干扰后,卤虫体内雄性化基因的核酸表达水平显著下调,与GFP对照组相比,雄性化基因的表达水平降低80%以上(图6),有效地沉默卤虫体内雄性化基因的表达。
实施例4基于雄性化基因沉默的性别调控
(1)成体雌性和雄性卤虫的雄性化基因沉默
对于雄性化基因长期沉默的RNAi实验,选取体质健壮的雌性和雄性成体卤虫分别进行雄性化基因的RNA干扰,RNA干扰的显微注射和操作流程如上所述。注射后的卤虫正常培养,置于28℃,添加1%乙二胺四乙酸二钠铁的海水中进行养殖,小球藻干粉配置的溶液每一天喂食一次。卵胎生卤虫光照周期设定为光照16小时、黑暗8小时,海水盐度4%,光照强度为2000勒克斯。
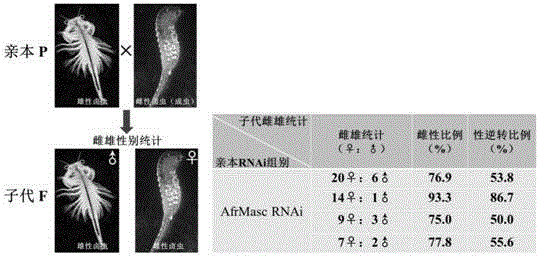
雄性化基因沉默后的雌虫和雄虫分别作为母本和父本,使其交配产卵生产子代。子代卤虫继续在水系统中养至成体,从外观形态上鉴定雌雄性别。从外观上观察,雌性卤虫的第二触角仅呈一小突起,而雄性卤虫的第二触角变成执握器,宽扁,外观上呈明显的斧状。因此,在显微镜下或肉眼观察时,根据卤虫是否具有斧状触角即可判定雌雄,鉴定卤虫的雌雄性别。通常,卤虫群体中雌性和雄性的比例接近1:1。雄性化基因RNA干扰组中,子代卤虫雌雄性别统计数据显示,在雄性化基因沉默的4个平行组中,雌性比例占群体总数的75.0%-93.3%,呈现高雌性现象。进一步数据分析结果表明,雄性化基因沉默的子代群体中50.0%-86.7%雄性个体性发生性别逆转变成雌性个体(图7)。以上实验结果表明,亲本体内雄性化基因的沉默将导致胚胎和子代个体的性别发生逆转,部分雄性个体转变成新雌性(假雌个体)。
(2)双线期雌性卤虫和雄性卤虫的雄性化基因沉默
根据雄性化基因在胚胎发育时期的表达特征结果表明,雄性基因在卤虫胚胎早期的性别决定和调控过程具有重要作用。由于卵胎生卤虫的卵母细胞其发育过程始于“双线”期,即雌性卤虫的卵母细胞堆积在两侧输卵管中,形成肉眼可见的“双线”期。因此,选择雌性卤虫卵母细胞刚开始发育的“双线”期进行雄性化基因的RNA干扰。
分别选取体质健壮的双线期雌性和雄性成体卤虫分别进行雄性化基因的RNA干扰,RNA干扰的显微注射和操作流程如上所述。雄性化基因沉默后的雌虫和雄虫分别作为母本和父本,使其交配产卵产生子代。子代卤虫继续在水系统中养至成体,从外观形态方面鉴定雌雄性别,鉴定方法如上所述。GFP对照组卤虫子代群体中,雌性和雄性的比例接近1:1,雌性比例占群体总数的45.0%-56.5%,呈自然的雌雄比例分布。另一方面,雄性化基因RNA干扰组的子代卤虫雌雄性别统计数据则显示,雌性比例占群体总数的71.4%-85.7%,呈现高雌性现象。进一步数据分析结果表明,雄性化基因沉默的子代群体中42.9%-71.4%雄性个体性发生性别逆转变成雌性个体(图8)。以上实验结果表明,亲本体内雄性化基因的沉默,尤其是雌性卵细胞形成时期的雄性化基因沉默,将导致其胚胎和子代个体的性别发生逆转,部分雄性个体转变成新雌性(假雌个体)。
以上实验结果表明,亲本体内雄性化基因沉默可导致其胚胎和子代个体性别发生逆转,变成新雌性(假雌个体)。所谓的假雌个体是指其体内携带雄性遗传信息,而表型(外观特征和生殖系统)则体现为雌性性征。因此,通过调节雄性化基因在体内的核酸和蛋白表达,可以进一步调控卤虫类的雌雄性别分化,尤其是调控卤虫群体的性别分化,诱导雄性个体性别逆转形成假雌个体。同时,因假雌个体同时兼有雄性的内在遗传背景和雌性的外在表型,可与正常雄性个体交配、受精和产卵,培育生产全雄子代群体,用于全雄单性养殖。
动物具有良好的雄性/雌性特征优势,对这些种类进行定向性别控制,开展单性化养殖,不但可以产生巨大的经济效益,而且具有重要的理论价值。本发明方法攻克目前低等动物性别调控领域中遇到的技术难题,通过RNA干扰技术和基因表达调控技术,进行定向性别控制,诱导节肢动物尤其是卤虫类动物性别逆转,不仅构建卤虫类性别控制体系和平台,并可实现基于卤虫雄性化基因的高雌性的生产。本发明操作方法具有原创性,实施步骤清晰。
SEQUENCE LISTING
<110> 浙江万里学院
<120> 一种卤虫雄性化因子及其应用
<130>
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 1077
<212> DNA
<213> 1
<400> 1
atgaacacaa atgaagaaaa agactctatg aagtggaaag aggacagttt atgtagagac 60
tttcttcgaa attcttgtca aagaggggaa agatgtaaat ttgttcatgc ttttggggat 120
ttaaaaaaag acctttctat taaggaatta caattttgcc atgattttca gaacactggt 180
tgtcctagaa gattatgcaa gtttgtccat tgtacaatcg aagaagaaca acaatacctt 240
gataaaggta tgttgccatc gcatgttata cagtctttca ttcagcgtgg cataattcct 300
gatgcaatcg taactgagcc cggtgaaaca ccaatttgta aagatttctt aaaaaatgac 360
tgttttagag gggataaatg caagtttcga catgtacaaa tcgaaacgca ggaaaaaaaa 420
ggggccagtg agttcaagcg cttggatcag gatcttgaac ctaggctaaa acgaatgaag 480
tcagataatt atatccctga tcaacaatgt gtggttgtat gtgaacccag tatctctaca 540
gaaagctcga atgaaataag acttgttcga gaagaaaaca atatcctaaa acaaaagctt 600
gaagaaatga aaaggcagct ttataattta atggcaacca atgagttcct tctggaacaa 660
aatgcccatt taagacttgg taaaatgtca tcagttgtgt ctgggattta tcacccaatt 720
aaccagctat cgtctgctgg tggcaacctt ggtgtaatta ctcaaccggc acaaagtgta 780
tcagttatta cacagaatgg acaacctgca gtatctgtct caacagtccc aacagttcaa 840
actcttgcaa caatgtccct accaactatg actgtacctg taactcttcc tcaagtggca 900
acctatccaa ataccctcaa atcctcttac aataaacact gctgcaacct ccttaggaat 960
aaccaatgtg ccatgctctc ttgcatactc ggttatgtct caaccaacta cttctttggc 1020
atacccttag ctcttttgtt atatgcaaat atattaaagt atgcttctca agcttag 1077
<210> 2
<211> 358
<212> PRT
<213> 2
<400> 2
Met Asn Thr Asn Glu Glu Lys Asp Ser Met Lys Trp Lys Glu Asp Ser
1 5 10 15
Leu Cys Arg Asp Phe Leu Arg Asn Ser Cys Gln Arg Gly Glu Arg Cys
20 25 30
Lys Phe Val His Ala Phe Gly Asp Leu Lys Lys Asp Leu Ser Ile Lys
35 40 45
Glu Leu Gln Phe Cys His Asp Phe Gln Asn Thr Gly Cys Pro Arg Arg
50 55 60
Leu Cys Lys Phe Val His Cys Thr Ile Glu Glu Glu Gln Gln Tyr Leu
65 70 75 80
Asp Lys Gly Met Leu Pro Ser His Val Ile Gln Ser Phe Ile Gln Arg
85 90 95
Gly Ile Ile Pro Asp Ala Ile Val Thr Glu Pro Gly Glu Thr Pro Ile
100 105 110
Cys Lys Asp Phe Leu Lys Asn Asp Cys Phe Arg Gly Asp Lys Cys Lys
115 120 125
Phe Arg His Val Gln Ile Glu Thr Gln Glu Lys Lys Gly Ala Ser Glu
130 135 140
Phe Lys Arg Leu Asp Gln Asp Leu Glu Pro Arg Leu Lys Arg Met Lys
145 150 155 160
Ser Asp Asn Tyr Ile Pro Asp Gln Gln Cys Val Val Val Cys Glu Pro
165 170 175
Ser Ile Ser Thr Glu Ser Ser Asn Glu Ile Arg Leu Val Arg Glu Glu
180 185 190
Asn Asn Ile Leu Lys Gln Lys Leu Glu Glu Met Lys Arg Gln Leu Tyr
195 200 205
Asn Leu Met Ala Thr Asn Glu Phe Leu Leu Glu Gln Asn Ala His Leu
210 215 220
Arg Leu Gly Lys Met Ser Ser Val Val Ser Gly Ile Tyr His Pro Ile
225 230 235 240
Asn Gln Leu Ser Ser Ala Gly Gly Asn Leu Gly Val Ile Thr Gln Pro
245 250 255
Ala Gln Ser Val Ser Val Ile Thr Gln Asn Gly Gln Pro Ala Val Ser
260 265 270
Val Ser Thr Val Pro Thr Val Gln Thr Leu Ala Thr Met Ser Leu Pro
275 280 285
Thr Met Thr Val Pro Val Thr Leu Pro Gln Val Ala Thr Tyr Pro Asn
290 295 300
Thr Leu Lys Ser Ser Tyr Asn Lys His Cys Cys Asn Leu Leu Arg Asn
305 310 315 320
Asn Gln Cys Ala Met Leu Ser Cys Ile Leu Gly Tyr Val Ser Thr Asn
325 330 335
Tyr Phe Phe Gly Ile Pro Leu Ala Leu Leu Leu Tyr Ala Asn Ile Leu
340 345 350
Lys Tyr Ala Ser Gln Ala
355
<210> 3
<211> 290
<212> DNA
<213> 3
<400> 3
aaaaaggggc cagtgagttc aagcgcttgg atcaggatct tgaacctagg ctaaaacgaa 60
tgaagtcaga taattatatc cctgatcaac aatgtgtggt tgtatgtgaa cccagtatct 120
ctacagaaag ctcgaatgaa ataagacttg ttcgagaaga aaacaatatc ctaaaacaaa 180
agcttgaaga aatgaaaagg cagctttata atttaatggc aaccaatgag ttccttctgg 240
aacaaaatgc ccatttaaga cttggtaaaa tgtcatcagt tgtgtctggg 290
- 还没有人留言评论。精彩留言会获得点赞!