一种用于PHA积累的双菌体系构建方法与流程
本发明涉及一种用于PHA积累的双菌体系构建方法,其属于微生物学中混合菌群研究领域。
背景技术:
聚羟基烷酸酯(PHA)由于其良好的生物相容性、环境友好性、原料可再生性等特点,可作为传统塑料的优良替代品而受到广泛关注[1],且在生物医药领域也有广泛应用。然而,现有方法生产的PHA成本远高于传统塑料,限制了其规模化生产和应用[1]。据清华大学调研,底物消耗占PHA成本的50%,为降低底物成本,人们将目光从葡萄糖等昂贵底物转向了非粮原料,如占自然界木质纤维素含量18-30%的木糖。
从1990年代起,人们已广泛开展利用木糖产PHA菌种筛选和过程优化等研究,但始终未能取得重大突破,木糖转化效率、PHA产量等均低于以葡萄糖为底物。即使流加营养物质或前体物质,PHA产量也仅为4g/L左右[2,3]。其原因在于目前PHA主要采用传统的微生物单一菌种发酵生产[4],木糖本身不能被微生物迅速利用[5],再期望其高效积累PHA,将给菌种带来沉重的代谢负担[6],因此微生物单菌代谢能力的限制是木糖高效转化PHA的瓶颈。
而自然界中,在相互依存中发挥作用的混菌体系可以很好地解决代谢负担等问题[6]。与单菌相比,双菌利用木糖产PHA体系具有如下优势:将木糖利用与PHA合成等任务分配到不同菌株中执行,可避免单菌代谢负荷过重的问题;PHA的胞内积累是在环境恶劣条件下形成的,双菌体系可在环境波动情况下维持整个体系的相对稳定。
研究证实,酿酒酵母经改造后可以具备良好的木糖利用能力[5],而恶臭假单胞菌是常见的PHA积累的菌株[7],且二者共培养时酵母可有效延长假单胞菌的稳定期[8],因此,通过设计中间代谢交流物质,将木糖利用与PHA合成途径分别设计在酿酒酵母与恶臭假单胞菌中构建的双菌体系,分流了代谢负担,增强了体系稳定型,最终成功获得了能够利用木糖生物转化为PHA的人工微生物混合菌群,证实了方法的可行性。
[1]Sang Y.Lee,Deciphering bioplastic production.Nature Biotechnology,24(10):1227-1229(2006).
[2]Sang Y.Lee,Poly(3-hydroxybutyrate)production from xylose by recombinant Escherichia coli.Bioprocess Engineering,18(5):397-399(1998).
[3]Thomas M.Keenan,Stuart W.Tanenbaum,Arthur J.Stipanovic,et al.,Production and characterization of poly-β-hydroxyalkanoate copolymers from Burkholderia cepacia utilizing xylose and levulinic acid.Biotechnology Progress,20(6):1697-1704(2004).
[4]Kumar Sudesh,Kesaven Bhubalan,Jo A.Chuah,et al.,Synthesis of polyhydroxyalkanoate from palm oil and some new applications.Applied Microbiology and Biotechnology,89(5):1373-1386(2011).
[5]Jian Zha,Minghua Shen,Menglong Hu,et al.,Enhanced expression of genes involved in initial xylose metabolism and the oxidative pentose phosphate pathway in the improved xylose-utilizing Saccharomyces cerevisiae through evolutionary engineering.Journal of Industrial Microbiology&Biotechnology,41(1):27-39(2014).
[6]Katie Brenner,Lingchong You,Frances H.Arnold,Engineering microbial consortia:a new frontier in synthetic biology.Trends in Biotechnology,26(9):483-489(2008).
[7]Sylvaine L.Meur,Manfred Zinn,Thomas Egli,et al.,Production of medium-chain-length polyhydroxyalkanoates by sequential feeding of xylose and octanoic acid in engineered Pseudomonas putida KT2440.BMC Biotechnology,12(1):53(2012).
[8]Julia D.Romano,Roberto Kolter,Pseudomonas-Saccharomyces interactions:influence of fungal metabolism on bacterial physiology and survival.Journal of Bacteriology,187(3):940-948(2005).
技术实现要素:
鉴于上述,本发提出一种用于PHA积累的双菌体系构建方法,并验证其可行性,具体技术如下:
一种用于PHA积累的双菌体系构建方法,双菌体系采用酿酒酵母(Saccharomyces cerevisiae)实现木糖利用;采用恶臭假单胞菌(Pseudomonas putida)实现PHA积累。
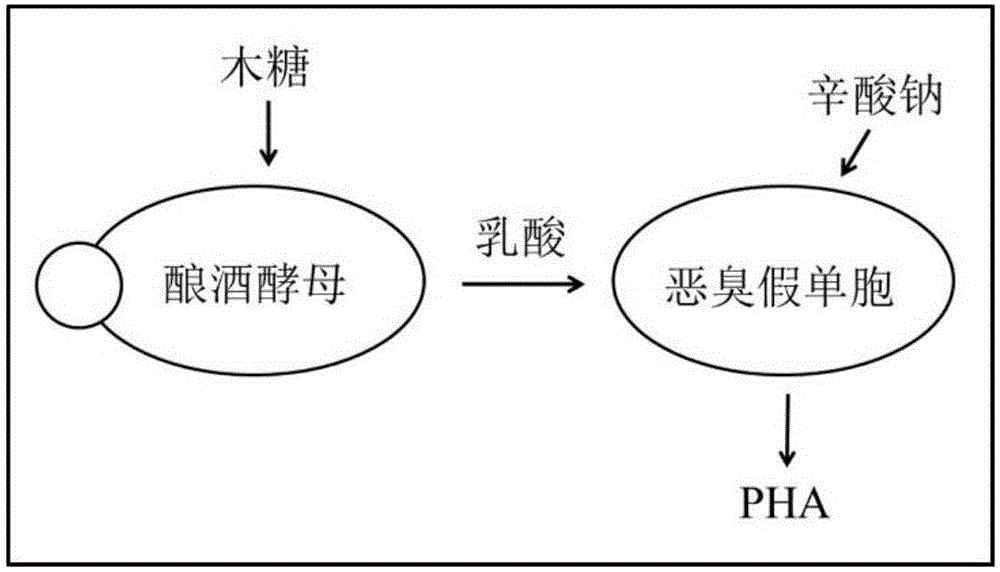
本发明由酿酒酵母Saccharomyces cerevisiae BY 4741与恶臭假单胞菌Pseudomonas putida NBRC 14164组成双菌体系,S.cerevisiae利用木糖产生乳酸,P.putida利用乳酸做底物、辛酸钠做前体产生PHA。
用于PHA积累的双菌体系构建方法方法,步骤如下:
1)P.putida最适碳源确定;
2)双菌合适接种比例确定;
3)PHA积累条件确定。
本发明的双菌体系采用S.cerevisiae与P.putida,前者实现木糖利用,后者实现PHA积累。对该体系的研究主要为:确定恶臭假单胞菌的最适碳源以设计双菌的中间交流代谢物;探索双菌最适接种比例以达到木糖有效利用与生物量最大化;探索PHA前体物质加入时间点以达到PHA有效积累。
具体说明如下:
酿酒酵母为天津大学元英进教授惠赠,其出发菌株为Saccharomyces cerevisiae BY 4741;积累PHA的恶臭假单胞菌Pseudomonas putida NBRC 14164,购买自中国工业微生物菌种保藏管理中心。
1.P.putida最适碳源确定
以酿酒酵母常见的发酵产物乙醇、乙酸、甘油、乳酸为P.putida测试碳源,同时以木糖为对比,筛选出P.putida最适底物,并以此为依据设计双菌体系的中间交流代谢物。
2.双菌合适接种比例确定
双菌在无机盐-木糖培养基中的接种比例采用两种方法:第一种在总接种质量恒定的条件下改变接种比例;第二种在P.putida接种质量恒定的条件下改变接种比例。
(1)以每200mL接种4g总菌液为标准,设计S.cerevisiae与P.putida接种比例分别为1:10、1:1、10:1,并以两株单菌做对比。
(2)以每200mL接种2g P.putida菌液为标准,设计S.cerevisiae与P.putida接种比例分别为1:10、1:1、10:1,并以两株单菌做对比。
3.PHA积累条件确定
PHA积累需额外加入前体物质辛酸钠,其加入量设计为5g/L,加入时间点设计为发酵开始、发酵12h、发酵24h。
双菌接种量为每200mL无机盐-木糖培养基中接种2g P.putida菌液为标准的S.cerevisiae与P.putida接种比例为10:1时,菌体的生长最快且生物量最高。
PHA前体物质为辛酸钠,在辛酸钠加入时间点为发酵开始且终浓度为5g/L时,实现PHA胞内积累量最大。
本发明提出了一种用于PHA积累的双菌体系构建方法,将木糖利用与PHA合成任务分配到不同菌株中执行,避免了单菌代谢负荷过重的问题。双菌比单菌的木糖利用效率更高,发酵结束时的生物量更多,因此PHA积累量也更大。该体系填补了PHA相关研究中涉猎较少的人工混菌体系研究;同时也为非粮低值原料生产高附加值生物产品提供新思路和新方法。
附图说明
图1:双菌体系构建示意图
双菌体系中,改造的S.cerevisiae利用木糖的能力远大于P.putida,在体系中负责底物利用,其产生的乳酸又为P.putida的偏好底物,被P.putida用作菌体生长,同时在外加前体辛酸钠的情况下,即使不经过条件优化,P.putida也能实现一定程度的PHA积累。
图2:P.putida对不同底物利用情况
P.putida最适碳源为乳酸,在72h内已将乳酸几乎完全耗尽;相比之下,P.putida利用木糖能力较弱,72h仅为2.5g/L左右。
图3:不同接种比例下双菌的生长情况
以每200mL无机盐-木糖培养基中接种2g P.putida菌液为标准的S.cerevisiae与P.putida接种比例为10:1(即20g:2g)时,菌体的生长最快且生物量最高达OD 13.5,远优于单菌培养。
具体实施方式
下面结合附图和具体实施例,对本发明做进一步的详细说明:
酿酒酵母为天津大学元英进教授惠赠,其出发菌株为酿酒酵母BY 4741;积累PHA的恶臭假单胞菌NBRC 14164,购买自中国工业微生物菌种保藏管理中心。双菌关系的设计如图1所示。
1.培养基与溶液配方
YPX培养基:蛋白胨20g/L、酵母粉10g/L、木糖20g/L;
LB培养基:蛋白胨10g/L、酵母粉5g/L、氯化钠10g/L;
无机盐培养基:硫酸铵3g/L、硫酸镁0.5g/L、磷酸氢二钾3g/L、磷酸二氢钾1.5g/L、碳源20g/L、微量元素1mL/L;
微量元素:硫酸亚铁2.78g/L、氯化钙1.47g/L、氯化锰1.98g/L、氯化钴2.38g/L、氯化铜0.17g/L、硫酸锌0.29g/L,溶解于1M盐酸;
PHA酯化液:485mL分析纯无水甲醇、15mL浓硫酸(质量分数98%)、0.5g苯甲酸。
2.P.putida最适碳源确定
(1)P.putida于LB培养基中活化18h后,以1%的比例接种到200mL无机盐培养基中,乙醇、乙酸、甘油、乳酸、木糖终浓度为20g/L。
(2)每12h取样一次,每次2mL,发酵时长72h。
(3)样品12000rpm离心3min,上清液过滤后用于高效液相色谱检测残余底物浓度,菌体沉淀冷冻干燥后用于测量细胞干重。
P.putida对不同底物利用情况如图2所示。
3.双菌合适接种比例确定
利用木糖产乳酸的S.cerevisiae的改造自BY 4741,为天津大学元英进教授惠赠。
(1)S.cerevisiae于YPX培养基中活化,P.putida于LB培养基中活化。18h后将二者用无菌水洗涤一次,并重悬菌体。称取菌液,测量并计算菌液质量浓度。
(2)以每200mL无机盐-木糖培养基中接种4g总菌液为标准,设计S.cerevisiae与P.putida接种比例分别为1:10、1:1、10:1,即接种质量分别为0.363g:3.63g、2g:2g、3.63g:0.363g,并以两株单菌做对比。
(3)以每200mL无机盐-木糖培养基中接种2g P.putida菌液为标准,设计S.cerevisiae与P.putida接种比例分别为1:10、1:1、10:1,即接种质量分别为0.2g:2g、2g:2g、20g:2g,并以两株单菌做对比。
(4)每12h取样一次,发酵时长72h。每次取样3mL,1mL用于测量残糖浓度,2mL用于测量OD600。发酵结束后取10mL菌液冷冻干燥后用于测量细胞干重。
不同接种比例下双菌的生长情况如图3所示。
4.PHA积累条件确定
以每200mL无机盐-木糖培养基中接种2g P.putida菌液为标准的S.cerevisiae与P.putida接种比例为10:1的体系,向其中加入辛酸钠作为PHA积累的前体物质,其加入时间点如下:
(1)发酵开始时加入辛酸钠,终浓度为5g/L;
(2)发酵开始与发酵12h时分别加入辛酸钠,终浓度为均5g/L;
(3)发酵开始与发酵24h时分别加入辛酸钠,终浓度为均5g/L;
(4)发酵12h与发酵24h时分别加入辛酸钠,终浓度为均5g/L;
72h后停止发酵,取50mL发酵液10000rpm离心3min,蒸馏水洗涤一次后冷冻干燥24h。取50mg干燥的细胞样品,精确称重后置于酯化管中,分别加入2mL分析纯氯仿和2mL酯化液。密封酯化管,震荡混合均匀后100℃恒温酯化4h。冷却至室温,加入1mL去离子水,震荡至完全混匀后,静置分层。待水相和有机相分离完全后,取下层(氯仿相)溶液进行气相色谱分析。
分析结果为,在发酵开始时加入辛酸钠能在一定程度上促进菌体生长,但在12h与24h菌体正处于生长延迟期或对数初期时,加入辛酸钠会极大抑制菌体生长,PHA积累也受到消极影响。因此只有在发酵开始时加入终浓度为5g/L的辛酸钠,才可实现PHA胞内积累量最大,达细胞干重的13.5%。
- 还没有人留言评论。精彩留言会获得点赞!