一种产玉米黄素和β‑胡萝卜素的小球藻突变藻株及其培养方法与流程
本发明属于微生物工程领域,具体涉及利用亚硝基胍诱变产生的一株高产玉米黄素和β-胡萝卜素的突变小球藻株及其培养方法。
技术背景
玉米黄素是一种黄色的羟基化类胡萝卜素,其学名为3,3’-二羟基-β-胡萝卜素,和β-胡萝卜素一样,玉米黄素具有很强的着色和抗氧化功能。玉米黄素与其同分异构体叶黄素是眼睛视网膜黄斑的主要色素成分,它们在黄斑中的含量比为2:1。近年来的研究表明玉米黄素有助于预防白内障、老年性黄斑退变、癌症以及低密度脂蛋白的氧化,此外玉米黄素还被作为饲料添加剂而广泛运用于家禽和鱼类养殖中。目前市场上玉米黄素的主要来源是生物提取,天然来源的玉米黄素主要从红椒、黄玉米等植物中提取。但是这些植物中玉米黄素的含量最高仅为400μg/g,而且植物生长周期长、利用植物生产玉米黄素还会占用较多的土地和水资源。微生物资源尤其是植物祖先单细胞绿藻,生长周期短,生物量高,是理想的类胡萝卜素资源。如杜氏盐藻用于商业化生产天然β-胡萝卜素,雨生红球藻用于生产虾青素。植物和绿藻通常含有较高量的叶黄素但不积累高量的玉米黄素。杜氏盐藻突变体zea1因催化玉米黄素成下游类胡萝卜素的基因失去功能而能积累玉米黄素高达6mg/g细胞干重,是具有商业化应用价值的绿藻。然而光合自养的杜氏盐藻生物量低(约1g/L),限制了该藻的应用潜能。研发高产玉米黄素以及其他人体必需类胡萝卜素的绿藻新资源具有重大的商业应用意义。
迄今为止,现有技术中未见有一种产玉米黄素和β-胡萝卜素的,为小球藻(Chlorella zofingiensis,ATCC 30412)的诱变藻株ZEA1的报道。
技术实现要素:
本发明的目的在于提供一种产玉米黄素和β-胡萝卜素的藻株,其为小球藻(Chlorella zofingiensis,ATCC 30412)的诱变藻株ZEA1,以及所述玉米黄素和β-胡萝卜素高产藻株ZEA1的培养方法。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
一种产玉米黄素和β-胡萝卜素的突变小球藻株,其为小球藻Chlorella zofingiensis,ATCC 30412的诱变藻株ZEA1,保藏机构和保藏号为CGMCC No.12948。
如所述的一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCC No.12948,该突变小球藻株在30g/L的葡萄糖诱导条件下,生长速率高于野生型,其生物量为野生型的1.2倍,达12.95g/L,玉米黄素、叶黄素和β-胡萝卜素的含量分别为2.176mg/g,1.10mg/g和1.211mg/g。
如所述的一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCC No.12948,该突变小球藻株属绿藻可食用藻种,含有高量的和最佳比例的玉米黄素:叶黄素2∶1的人体必需类胡萝卜素,以及自然资源稀缺的玉米黄素。
如所述的一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCC No.12948,该突变小球藻株中催化β-胡萝卜素成角黄质和玉米黄素成虾青素的酮化酶基因BKT1基因74位的碱基由胸腺嘧啶T置换成了鸟嘌呤G,致使其发生无义突变。
如所述的一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCC No.12948,该突变小球藻株经HPLC测定,在Kuhl+30g/L葡萄糖的培养条件下积累高达2.176mg/g和1.17mg/g的玉米黄素和叶黄素,它们的比例1.86∶1非常接近眼睛黄斑中这两种色素的比例2∶1。
如所述的一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCC No.12948,该突变小球藻株含有1.211mg/g人体必需的β-胡萝卜素,且各种类胡萝卜素的含量和比例在不同代数的藻体中均表现出高度稳定,其玉米黄素、叶黄素和β-胡萝卜素的产量分别达到36.79mg/L、28.65mg/L和26.18mg/L。
本发明还提供了所述的任一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCCNo.12948,其是由下述方法所得到的:先将小球藻Chlorella zofingiensisATCC 30412进行亚硝基胍诱变处理,处理后的藻细胞涂布于含DPA的Kuhl固体培养基上培养,挑选培养基上的单藻落于Kuhl液体培养基中,培养至对数中后期时加入葡萄糖进行类胡萝卜素合成诱导,检测藻体中类胡萝卜素种类变化和含量,所述的Kuhl培养基的成分为(L):1.01g KNO3;0.62g NaH2PO4·H2O;0.089g Na2HPO4·2H2O;0.247g MgSO4·7H2O;14.7mg CaCl2·2H2O;6.95mg FeSO4·7H2O;0.061mg H3BO3;0.169mg MnSO4·H2O;0.287mg ZnSO4·7H2O;0.0025mg CuSO4·5H2O;and 0.01235mg(NH4)6MO7O24·4H2O;pH为6.8。
如所述的任一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCC No.12948,其是由下述方法所得到的:
1)取对数生长期的小球藻Chlorella zofingiensisATCC 30412藻液稀释至105个细胞/ml,取藻液5ml,2000rpm离心10min,弃上清,用20mL 50mM PBS,pH 7.0缓冲液重悬,2000rpm离心10min;
2)弃上清,加10mL 50mM PBS,pH为7.0和100μl 20mg/mL MNNG重悬细胞,混匀后于25℃恒温摇床遮光处理1h;
3)将步骤2)中处理后的细胞2000rpm离心10min,弃上清,藻细胞沉淀用PBS清洗2次,藻细胞加新鲜Kuhl液体培养基,于恒温摇床遮光孵育24h;所述的Kuhl培养基的成分为(L):1.01g KNO3;0.62g NaH2PO4·H2O;0.089g Na2HPO4·2H2O;0.247g MgSO4·7H2O;14.7mg CaCl2·2H2O;6.95mg FeSO4·7H2O;0.061mg H3BO3;0.169mg MnSO4·H2O;0.287mg ZnSO4·7H2O;0.0025mg CuSO4·5H2O;and 0.01235mg(NH4)6MO7O24·4H2O;pH为6.8;
4)将步骤3)的藻细胞2000rpm离心10min,藻细胞用新鲜培养基稀释并涂布于诱变筛选的含30μM二苯胺的Kuhl平板,于25℃恒温光照培养箱培养;
5)从步骤4)诱变筛选平板上挑取小球藻单克隆并编号,接种于装有3mL含30μM二苯胺的Kuhl液体培养基的12mL培养管中,置于恒温摇床培养10天,之后将藻液以10%的接种量接种于含10mL含30μM二苯胺的Kuhl培养基的100mL锥形瓶中,于恒温光照摇床培养4天;
6)取步骤5)的藻细胞以10%的接种量接种于含50mL Kuhl培养基的250mL锥形瓶中,于恒温光照摇床培养4天至对数中期,随后添加不同浓度0g/L、10g/L、15g/L、30g/L、50g/L、60g/L的葡萄糖进行诱导,通过HPLC检测其色素成分和含量的变化,HPLC检测出在诱导条件下能积累高含量的玉米黄素、叶黄素和β-胡萝卜素的保藏号为CGMCC No.12948的藻株。
如所述的任一种产玉米黄素和β-胡萝卜素的突变小球藻株CGMCC No.12948,所述的突变小球藻株CGMCC No.12948是以小球藻为出发藻株,经亚硝基胍诱变、二苯胺筛选获得,是由下述方法培养所得:
1)藻种准备:以小球藻Chlorella zofingiensisATCC 30412为出发藻株,将小球藻接种到Kuhl琼脂斜面培养基上培养,从斜面上挑一环藻体接种至摇瓶培养;所述的Kuhl培养基的成分为(L):1.01g KNO3;0.62g NaH2PO4·H2O;0.089g Na2HPO4·2H2O;0.247g MgSO4·7H2O;14.7mg CaCl2·2H2O;6.95mg FeSO4·7H2O;0.061mg H3BO3;0.169mg MnSO4·H2O;0.287mg ZnSO4·7H2O;0.0025mg CuSO4·5H2O;and 0.01235mg(NH4)6MO7O24·4H2O;pH为6.8;
2)诱变细胞的准备:摇瓶中的藻细胞培养4天后,以1∶10的体积比接种到新的Kuhl液体培养基的摇瓶中,培养至对数中后期;
3)亚硝基胍诱变:取对数生长期的小球藻藻液,稀释至105个细胞/ml,离心并用PBS缓冲液洗2遍,所述PBS缓冲液为K2HPO4·3H20 6.82g/L,KH2PO4 2.6g/L,PH为7.0,之后重悬于PBS中,向该PBS缓冲液中加入MNNG,混匀后于恒温摇床遮光处理;
4)二苯胺的筛选:将诱变剂处理后的藻液离心,并用PBS缓冲液洗3遍,并将最终的藻体重悬于Kuhl液体培养基中,经梯度稀释后取涂布于含二苯胺的Kuhl固体培养基上培养筛选,挑选颜色变化比较大的藻落;
5)色素测定:将挑选到的单克隆藻落接种到Kuhl液体培养基中培养,培养至对数中期后加入不同浓度的葡萄糖诱导,并测定相关色素的含量,取玉米黄素含量最高的藻株CGMCC No.12948,连续培养多代之后,测定色素含量,验证其继代的稳定性。
本发明所述一种玉米黄素和β-胡萝卜素高产藻株为小球藻(Chlorella zofingiensis,ATCC30412)的诱变藻株ZEA1,该藻株已保存于中国微生物菌种保藏管理委员会普通微生物中心,编号为CGMCC No.12948。
与现有技术相比,本发明的优益性在于:
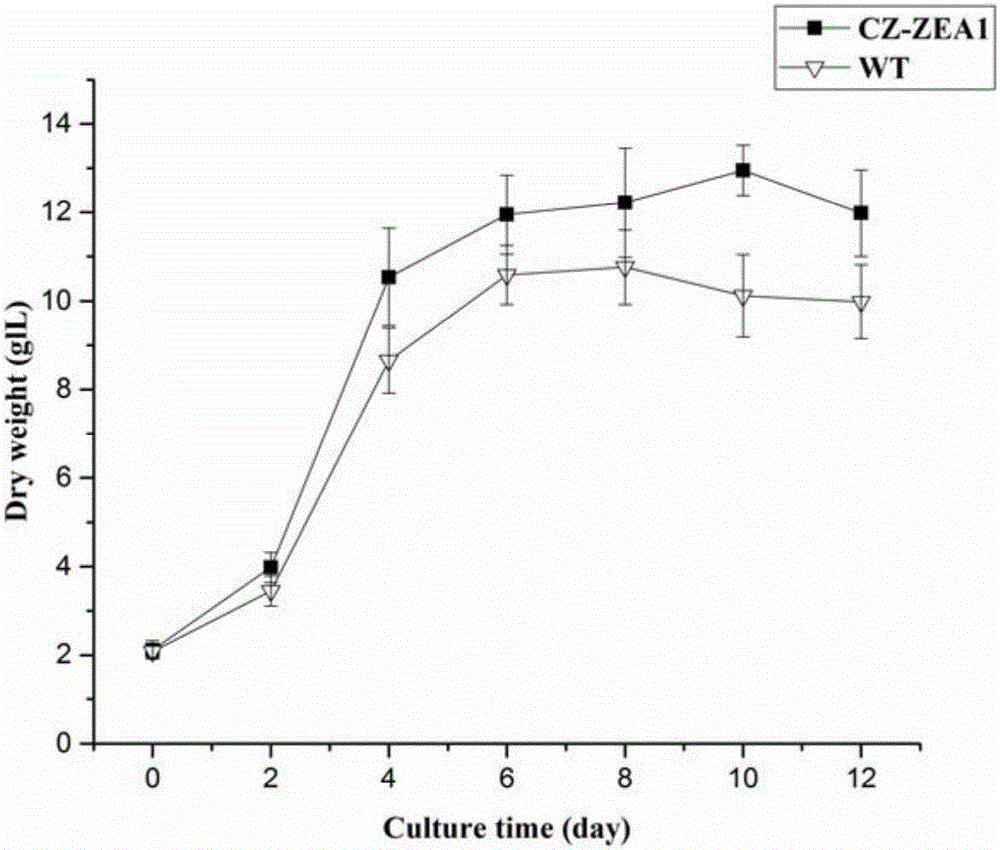
本发明通过对小球藻Chlorella zofingiensisATCC30412进行亚硝基胍诱变筛选到能积累玉米黄素的突变株CZ-ZEA1(生物材料名:ZEAl,分类名:Chlorella zofingienesis)(该突变株已于2016年9月7日保存于中国微生物菌种保藏管理委员会普通微生物中心,中国科学院微生物研究所,编号为CGMCC No.12948,地址:北京市朝阳区北辰西路1号院3号,电话:010-64807355,邮编:100101)。该突变株在Kuhl+30g/L葡萄糖的培养基中的生长速率高于野生型,其生物量为野生型的1.2倍,达12.95g/L(图1,2)。发现CZ-ZEA1中催化β-胡萝卜素成角黄质和玉米黄素成虾青素的酮化酶基因BKT1基因74位的碱基由胸腺嘧啶(T)置换成了鸟嘌呤(G),致使其发生无义突变(图3)。HPLC测定CZ-ZEA1在Kuhl+30g/L葡萄糖的的培养条件下可积累高达2.176mg/g和1.17mg/g的玉米黄素和叶黄素(图4,5),它们的比例(1.86∶1)非常接近眼睛黄斑中这两种色素的比例(2∶1)。此外该藻还含有1.211mg/g人体必需的β-胡萝卜素(图4,5),且各种类胡萝卜素的含量和比例在不同代数的藻体中均表现出高度稳定。
附图说明
图1.野生型WT与诱变株CZ-ZEA1在Kuhl培养基条件下的生长曲线,横坐标表示培养天数,纵坐标表示细胞浓度(cells/ml)。
图2.野生型WT与诱变株CZ-ZEA1的细胞干重。横坐标表示培养天数,纵坐标表示细胞干重(g/L)。
图3.小球藻WT和突变株ZEA1的BKT1基因序列比对,黑色内显示了突变的碱基。
图4.小球藻WT和突变株ZEA1HPLC类胡萝卜素分析图谱。1-虾青素(自由体),2-叶黄素,3-玉米黄素,4-β-胡萝卜素,5-虾青素(酯化体)。
图5.野生型WT与诱变株CZ-ZEA1在30g/L葡萄糖的Kuhl培养基的条件下体内积累的玉米黄素(Zeaxanthin)、叶黄素(Lutein)以及β-胡萝卜素(β-carotene)的含量(mg/g);上图为野生型藻株,下图为诱变株CZ-ZEA1;横坐标为培养天数,纵坐标为色素含量(mg/g)。
图6.诱变株CZ-ZEA1在30g/L葡萄糖的Kuhl培养基的条件下玉米黄素(Zeaxanthin)、叶黄素(Lutein)以及β-胡萝卜素(β-carotene)的产量(mg/L);横坐标为培养天数,纵坐标为色素产量(mg/L)。
具体实施方式
下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
实施例1
1)将出发藻株小球藻(Chlorella zofingiensis,ATCC 30412)(American Type Culture Collection,ATCC,Rockville,MD,USA)从Kuhl琼脂斜面培养基(含3g/L的葡萄糖和1.5%琼脂)上接种到含10ml的Kuhl液体培养基中培养4天。培养条件为:温度25摄氏度,摇床转速150rpm,光照强度30umol m-2s-1。Kuhl培养基的成分为(L):1.01g KNO3;0.62g NaH2PO4·H2O;0.089g Na2HPO4·2H2O;0.247g MgSO4·7H2O;14.7mg CaCl2·2H2O;6.95mg FeSO4·7H2O;0.061mg H3BO3;0.169mg MnSO4·H2O;0.287mg ZnSO4·7H2O;0.0025mg CuSO4·5H2O;and 0.01235mg(NH4)6MO7O24·4H2O;pH为6.8。
2)将上述瓶中培养了4天的藻细胞以1∶10的比例接种到新鲜的50ml Kuhl液体培养基中培养4天。
3)将2)步骤培养4天后的藻细胞离心收集,并用PBS缓冲液洗2遍离心收集,重悬于PBS缓冲液中,使得细胞浓度为105个细胞/ml,预实验表明100μl 20mg/mL MNNG诱变效果最好,因此向该PBS重悬液中加入的100μl 20mg/mL的MNNG,混匀后于恒温摇床遮光处理1h。
4)离心收集藻细胞,用PBS缓冲液洗藻细胞3遍后将藻细胞重悬于1ml的Kuhl液体培养基中,经梯度稀释后涂布于不同浓度(0,10,20,30,60,100μM)二苯胺的Kuhl+3g/L葡萄糖培养基上筛选。从筛选培养基上长出的藻落数目确定最适合的二苯胺的浓度为30μM。
5)挑取4)步骤筛选培养基上颜色有变化(从红色变为黄色或橙色或绿色)的藻落,接种到10ml Kuhl液体培养基中培养,培养4天后按1∶10的比例接种到50ml Kuhl液体培养基中培养,4天后加入不同浓度(0,10,15,30,50,60g/L)的葡萄糖处理,每隔48h测定色素的含量和组分。
6)色素含量的测定:取2ml藻细胞,2000rpm离心5min,用ddH2O洗2遍后离心,重悬于1ml丙酮中提取色素。提取液过0.22μm Millipore有机膜,过滤后的提取液用安捷伦的1290超高效液相色谱仪分析检测,色谱柱用的是Waters的YMC Carotenoid柱(4.6×250mm)。色谱分析用的流动相为:A,甲醇;B,甲基叔丁基醚。柱子洗脱的条件为:70%A相和30%B相,进样量为10μl,流速为1ml/min。
7)生物量和生长曲线的测定:取生长至对数中后期的野生型和诱变的藻株,稀释到1.5x106细胞/ml,于50ml Kuhl液体培养基中培养,每隔24小时测定细胞数目,每隔48h测定生物量。细胞数目的测定是使用血球计数法;生物量的测定是取4ml的藻液,离心收集藻体,重悬并用ddH2O洗2遍,抽滤干燥后称干重。
8)用HPLC和测干重的方法测定突变株(生物材料名:ZEAl,分类名:Chlorella zofingienesis)(该突变株已于2016年9月7日保存于中国微生物菌种保藏管理委员会普通微生物中心,中国科学院微生物研究所,编号为CGMCC No.12948,地址:北京市朝阳区北辰西路1号院3号,电话:010-64807355,邮编:100101)经过连续继代20次后每一代的色素和生物量,突变株达到最大玉米黄素产量的条件为培养至稳定期后在Kuhl液体培养基中加入30g/L的葡萄糖。培养8天后,突变株的玉米黄素的含量和产量分别为2.176mg/g和36.79mg/L,β-胡萝卜素含量和产量分别为1.211mg/g和26.18mg/L。
<110>中国科学院昆明植物研究所
<120>一种产玉米黄素和β-胡萝卜素的小球藻突变藻株及其培养方法
<160> 2
<210> 1
<211> 936
<212> DNA
<213>小球藻诱变株ZEA1(Chlorella zofingiensis ZEA1)
<400> 1
ATGGCGCCAG ATGTGACACA TGTGCAGCCA CGTGTACAGT CCCCGGCTGG CCCCGATGAT 60
GAGGATGACG CGTGAAGCTT GTGGAAAGCC CAATATCCTA TGCCGGAGGA GAAGGGTACA 120
GTATCCAAAC CTCAAGCCGC ACTCAAATAC AGGCCACCAC GCAGTGACTG GAAGGGTGTA 180
TCAATTGCAT GCACTGTCAT CACCCTATGG ACAGCTGTCT TTTACCATGG CTGCTGGCAA 240
ATCAAACTCA CAGGCCCTGA TAAGTCAGCC TGGTGGGACG TTGTTGCAAC GTTTCTGGCA 300
CTGGAGTTCC TCAACACTGG GCTTTTCATC ACCACGCATG ATGCCATGCA TGGGACTATT 360
GCCATCAGGA ACCGTCGTTT GAATGACCTA CTTGGCAATA TAGCCATCAG CCTATATGCC 420
TGGTTTGACT ATGACATGCT GCACAAGAAG CACTGGGAGC ATCACAACTT CACTGGGTTA 480
CCACATAAAG ACCCAGACTT CCATCGAGGC GATCCTGCGC TACATAAGTG GTTTGGCAGG 540
TTTATGTGGG AGTATGCAAC ACCACTCCAG TTTGCCAAGA TCTTCGCATA CACCTTCTTC 600
CTACAATCCT TACGGGTGCA ATACCCCAAT TTATGCGTCT TTCTGGCGGC TGCACCCCTG 660
GTCAGTGCGT TCCGATTGTT CTATTTTGGC ACCTATTTAC CCCACCTCCC CTCCAATGCT 720
CAGGAGACAA TGCCCTGGGA GAAATCTCAC AGTGCTGATG ACCCTCGGCC GCTGTCATTC 780
TTGAAATGTT ATCACTTTGA TTATCACTGG GAGCATCACA GGTGGCCTTA TGCCCCTTGG 840
TGGGAGTTAC CCGTGTGTAA GCGCATCACA AAGACACTGG ATGCTGCAGT TCCAGGAGTA 900
CAGTCAGACG GCACGAAGAA GAGTCAGTTG GTGAAC 936
<210> 1
<211> 312
<212> PRT
<213>小球藻诱变株ZEA1(Chlorella zofingiensis ZEA1)
<400> 2
Met Ala Pro Asp Val Thr His Val Gln Pro Arg Val Gln Ser Pro
5 10 15
Ala Gly Pro Asp Asp Glu Asp Asp Ala * Ser Leu Trp Lys Ala
20 25 30
Gln Tyr Pro Met Pro Glu Glu Lys Gly Thr Val Ser Lys Pro Gln
35 40 45
Ala Ala Leu Lys Tyr Arg Pro Pro Arg Ser Asp Trp Lys Gly Val
50 55 60
Ser Ile Ala Cys Thr Val Ile Thr Leu Trp Thr Ala Val Phe Tyr
65 70 75
His Gly Cys Trp Gln Ile Lys Leu Thr Gly Pro Asp Lys Ser Ala
80 85 90
Trp Trp Asp Val Val Ala Thr Phe Leu Ala Leu Glu Phe Leu Asn
95 100 105
Thr Gly Leu Phe Ile Thr Thr His Asp Ala Met His Gly Thr Ile
110 115 120
Ala Ile Arg Asn Arg Arg Leu Asn Asp Leu Leu Gly Asn Ile Ala
125 130 135
Ile Ser Leu Tyr Ala Trp Phe Asp Tyr Asp Met Leu His Lys Lys
140 145 150
His Trp Glu His His Asn Phe Thr Gly Leu Pro His Lys Asp Pro
155 160 165
Asp Phe His Arg Gly Asp Pro Ala Leu His Lys Trp Phe Gly Arg
170 175 180
Phe Met Trp Glu Tyr Ala Thr Pro Leu Gln Phe Ala Lys Ile Phe
185 190 195
Ala Tyr Thr Phe Phe Leu Gln Ser Leu Arg Val Gln Tyr Pro Asn
200 205 210
Leu Cys Val Phe Leu Ala Ala Ala Pro Leu Val Ser Ala Phe Arg
215 220 225
Leu Phe Tyr Phe Gly Thr Tyr Leu Pro His Leu Pro Ser Asn Ala
230 235 240
Gln Glu Thr Met Pro Trp Glu Lys Ser His Ser Ala Asp Asp Pro
245 250 255
Arg Pro Leu Ser Phe Leu Lys Cys Tyr His Phe Asp Tyr His Trp
260 265 270
Glu His His Arg Trp Pro Tyr Ala Pro Trp Trp Glu Leu Pro Val
275 280 285
Cys Lys Arg Ile Thr Lys Thr Leu Asp Ala Ala Val Pro Gly Val
290 295 300
Gln Ser Asp Gly Thr Lys Lys Ser Gln Leu Val Asn
305 310 312
- 还没有人留言评论。精彩留言会获得点赞!