一种提高衣藻产氢量的方法与流程
本发明涉及微生物领域,具体涉及一种提高衣藻产氢量的方法。
背景技术:
能源是人类生存与发展的物质基础,人类所用的能源主要是石油、天然气和煤炭等化石燃料。化石燃料是不可再生能源,其储量有限;化石燃料的燃烧产物CO2会造成温室效应,燃烧副产物氮氧化物、硫氧化物等既可导致空气污染。
氢是比较好的能量载体,具有高效、无污染、适用范围广等显著优点。目前氢的制备主要包括化石原料制氢和电解水制氢两种途径,成本昂贵。前者需要消耗大量的石油、天然气和煤炭等宝贵的不可再生资源;后者则以消耗大量的电能为代价。
生物制氢特别是微藻制氢是近年来制氢领域的研究热点。生物制氢包括发酵制氢和光合作用制氢。前者利用异养型的厌氧菌或固氮菌分解小分子的有机物制氢,而后者则利用光合细菌或微藻直接转化太阳能为氢能,是目前国际上生物制氢领域的研究热点。
因此,本领域技术人员需要开发一种微藻制氢的方法,尤其是提高衣藻产氢量的方法。
技术实现要素:
本发明提供了一种提高衣藻产氢量的方法。在一个具体的实施方式中,该方法将衣藻与固氮菌进行共培养,其中,共培养前,衣藻培养至饱和期,固氮菌培养至对数生长期。
进一步地,固氮菌为圆褐固氮菌。
进一步地,衣藻为莱茵衣藻cc849和/或莱茵衣藻cc124。
进一步地,共培养时,衣藻的起始叶绿素浓度为0.5mg/L,固氮菌的起始浓度为OD600=0.8-1.2,衣藻与所述固氮菌的体积比为1:40。
进一步地,共培养为,将衣藻和固氮菌混合后,置于黑暗处培养22-26小时,然后在200μE·m-2·s-1光照下培养。
优选地,衣藻为莱茵衣藻cc849时,莱茵衣藻cc849的起始叶绿素浓度为0.4-0.6mg/L,固氮菌的起始浓度为OD600=0.8-1.2,衣藻与固氮菌的体积比为1:20;将所茵衣藻cc849和固氮菌混合后,置于黑暗处培养22-26小时,然后在60μE·m-2·s-1光照下培养。
优选地,衣藻为莱茵衣藻cc124时,莱茵衣藻cc124的起始叶绿素浓度为0.5mg/L,固氮菌的起始浓度为OD600=1,衣藻与所述固氮菌的体积比为1:80;将莱茵衣藻cc124和固氮菌混合后,置于黑暗处培养22-26小时,然后在200μE·m-2·s-1光照下培养。
进一步地,衣藻的所述饱和期浓度为OD750=2.8-3.2;固氮菌的所述对数生长期浓度为OD600=0.8-1.2。
进一步地,共培养使用缺硫TAP培养基。
提高衣藻产氢效率是衣藻产氢应用的关键。衣藻产氢是体内的氢化酶催化的,但是氢化酶是氧气敏感的,在自然情况下,衣藻的产氢量极低,这是制约衣藻产氢的瓶颈问题。另外,衣藻产氢与其生物量也具有相关性。圆褐固氮菌属于厌氧性细菌,具有固氮作用,可以利用空气中的氮转化成氮肥,在缺氮培养基中可以产生氢气。圆褐固氮菌可以通过植物生长激素通过矿化作用促进植物的生长。固氮菌一般用于农业肥料的研究,衣藻一般用于光合作用及产氢作用研究,一个生活于土壤中,一个属于淡水藻类。
本发明利用圆褐固氮菌消耗衣藻体系内的氧气达到降低氧气浓度的效果来提高氢化酶的活性,另外,将其与衣藻共培养达到提高衣藻生物量的效果,最终达到提高衣藻的氢气产量的作用。
本发明采用了细胞壁缺陷型衣藻cc849及具细胞壁衣藻cc124分别与圆褐固氮菌按照不同的比例混合,在不同的光照条件下进行产氢培养,筛选出最优产氢条件,并检测共培养过程中衣藻和固氮菌的生长情况、在培养基中的分布情况、产氢和氧气消耗情况、氢化酶活性等,从生理生态学角度揭示衣藻与固氮菌共培养提高产氢效率的机理。
通过实验发现固氮菌可以促进衣藻产氢,而且还发现共培养过程中固氮菌向衣藻聚集、促进培养体系内淀粉含量增加、彼此促进生长的新现象;通过设置对照组实验可知,衣藻与固氮菌共培养体系中对产氢的贡献是衣藻、而不是固氮菌。通过对培养体系中产氢量和耗氧量、氢化酶活性、一些代谢产物含量的动态检测,发现固氮菌使衣藻产氢量提高的原因不仅是加速诱导培养基内缺氧状态、提高氢化酶活性来提高的产氢效率,而且也通过促进衣藻的细胞数量和提高了系统内淀粉含量等生理和生长变化而提高了衣藻的产氢量。
本发明在生理生态学及生化水平揭示固氮菌与衣藻共培养提高产氢量的原因机理,为实现固氮菌的应用和探索新的微藻光合生物制氢技术奠定理论和实验基础。本发明也表明固氮菌促进了衣藻的生长及氢气产量,两者存在着阶段性互惠共生关系,这进一步拓宽了固氮菌的共生对象范围,为充分利用可再生生物能源、解决经济效益与环境代价之间的矛盾提供了新思路。
附图说明
图1是本发明一个实施例中纯的氢气和氧气的气相色谱出峰时间图,左:氢气;右:氧气。
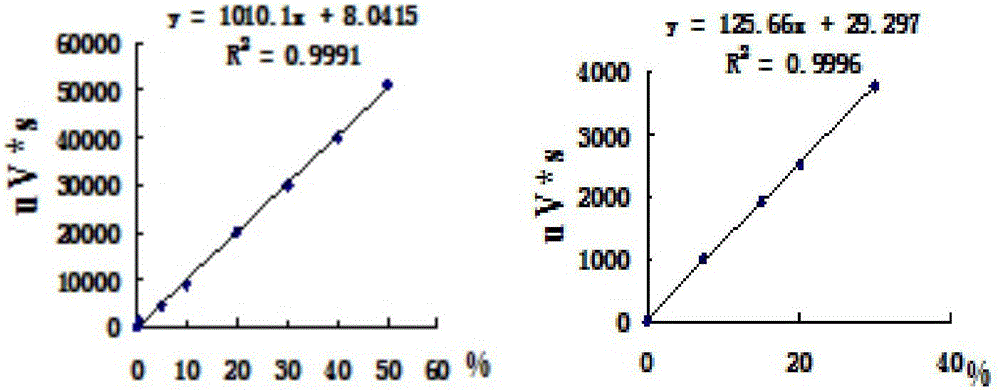
图2是本发明一个实施例中纯的氢气和氧气的体积与气相色谱得到的峰面积之间的标准曲线,左:氢气的标准曲线;右:氧气的标准曲线。
图3是本发明一个实施例中不同光照条件下衣藻cc849与不同比例的固氮菌混合培养后氢气的产量图。
图4是本发明一个实施例中不同光照条件下衣藻cc124与不同比例的固氮菌混合培养后氢气的产量图。
图5是本发明一个实施例中不同共培养体系中藻菌混合物产氢气含量测定。
图6是本发明一个实施例中衣藻cc849单独或与固氮菌按照最佳产氢条件下的藻菌比例混合后在TAP培养基中的生长情况及叶绿素含量检测图。
图7是本发明一个实施例中衣藻cc124单独或与固氮菌按照最佳产氢条件下的藻菌比例混合后在TAP培养基中的生长情况及叶绿素含量检测图。
图8是本发明一个实施例中衣藻cc849单独或与固氮菌按照最佳产氢条件下的藻菌比例混合后在TAP-S培养基中的生长情况及叶绿素含量检测图。
图9是本发明一个实施例中衣藻cc124单独或与固氮菌按照最佳产氢条件下的藻菌比例混合后在TAP-S培养基中的生长情况及叶绿素含量检测图。
图10是本发明一个实施例中固氮菌与衣藻按照最佳产氢条件下的藻菌比例混合后在TAP培养基中的生长情况检测图。
图11是本发明一个实施例中固氮菌与衣藻按照最佳产氢条件下的藻菌比例混合后在TAP-S培养基中的生长情况检测图。
图12是本发明一个实施例中固氮菌与衣藻cc849共培养产氢时的形态变化及分布格局。
图13是本发明一个实施例中固氮菌与衣藻cc124共培养产氢时的形态变化及分布格局。
图14是本发明一个实施例中衣藻cc849单独或和固氮菌共培养产氢时体外及体内氢化酶的活性图。
图15是本发明一个实施例中衣藻cc124单独或和固氮菌共培养产氢时体外及体内氢化酶的活性图。
图16是本发明一个实施例中衣藻cc849和cc124单独或与固氮菌共培养产氢的淀粉含量变化图。
图17是本发明的一个实施例中提高衣藻产氢量的基本思路。
具体实施方式
以下将结合实施例对本发明作进一步地说明,应理解这些实施例仅作为例证的目的,不用于限制本发明的保护范围。
莱茵衣藻cc849、莱茵cc124购自美国衣藻中心;圆褐固氮菌(Azotobacter chroococcum)购自中国普通微生物菌种保藏管理中心,编号:1.233。
实施例中使用的材料,若无特殊说明,可以直接购买获得。高效气相色谱仪(Agilant7890),购自安捷伦有限公司。
莱茵衣藻的培养
选取衣藻藻株cc849(细胞壁缺陷型)和cc124(具细胞壁)。
衣藻的正常培养方法相同:选用Tris-Acetate-Phosphate培养基(简称为TAP,配方如表1所示),用适量的盐酸调pH到7.0,光照强度为60~100μE.m-2.s-1,培养温度为25±1℃。液体培养可以静置或者200r/min的转速震荡培养,大约5天继代一次。固体培养时选用含1%的琼脂粉培养基倒平板,用接种环在平板划线接种培养,每两周继代一次。
产氢培养所用培养基都是缺硫培养基(简称TAP-S),缺硫培养基是把TAP培养基内的硫酸铁、硫酸镁、硫酸锌和硫酸铜分别换为等摩尔的氯化铁、氯化镁、氯化锌和氯化铜。
表1 TAP培养基配方
(说明:培养基总体积定容到1000ml。固体培养基另加1%的琼脂,121℃高压灭菌20min,室温冷却,备用。)
固氮菌的培养
固氮菌培养条件为:黑暗,温度28℃,培养基为固氮菌培养基,培养基成分如表2所示,可以放于200r/min的摇床,培养基液体培养,每周继代一次;可以固体培养,液体培养基里加1%的琼脂灭菌倒平板,超净台里用接种环划线接种,大约2~3周继代一次。
圆褐固氮菌(Azotobacter chroococcum)属于固氮菌的一种,厌氧性细菌,具有固氮作用,可以利用空气中的氮转化成氮肥,在缺氮培养基中可以产生氢气。由于圆褐固氮菌易于培养,因此在一般的生化研究、单子传递及铁离子的贮存等方面担任主要角色,圆褐固氮菌主要用于研究固氮作用及产氢作用的生理生化过程及遗传过程。研究表明,圆褐固氮菌可以通过植物生长激素通过矿化作用促进植物的生长。
在实施例中使用的固氮菌均为圆褐固氮菌。
表2固氮菌培养基配方
(说明:培养基pH=7.2,固体培养基另加1%琼脂,121℃高压灭菌20min,室温冷却,备用。)
衣藻及固氮菌细胞数的测定
取适量的藻(一般是液体接种3天内的藻直接取1ml,3天后的藻由于其浓度太高稀释5倍,取200μl然后补加800μl的培养基混匀)放于比色皿中,测量750nm吸光度的数值,衣藻的细胞数和750nm吸光度的数值是正相关的。
取1ml(如果浓度过大可以用培养基稀释)的固氮菌放入比色皿,测量600nm处的吸光值,固氮菌600nm处的吸光值和细胞数是成正比的。
衣藻叶绿素浓度的测定
取适量的藻(一般是液体接种3天内的藻直接取1ml,3天后的藻由于其浓度太高稀释5倍,取200μl然后补加800μl的培养基混匀),用12000rpm离心1min后去上清,加入95%的乙醇,用移液器吹吸均匀,12000rpm离心1min后取上清于新的EP管中,测定处理好的样品的665nm和649nm的吸光度,根据公式算出叶绿素的浓度:Chl(mg/L)=OD665*6.1+OD649*20.04。
氢气和氧气的出峰时间和标准曲线
将纯的氢气和氧气分别注入气相色谱仪,得到H2的出峰时间为0.6min,O2出峰时间为1.4min,如图1所示。将不同体积的氢气和氧气分别注入气相色谱得到不同的峰面积,分别绘制出H2和O2的体积与峰面积之间的标准曲线如图2所示。
藻菌的形态观察
用移液器吸取10μl样品滴到载坡片的中央,将盖玻片的一侧先接触载玻片上的样品,然后缓慢放下盖玻片,使盖玻片完全盖在载玻片上。将做好的水封片拿到显微镜下观察,先用低倍镜观察然后再用高倍镜观察。
衣藻体内氢化酶活性测定
1.将产氢培养所用的60ml的玻璃管冲入氩气5min,迅速用橡胶塞塞住瓶口,以去除玻璃管中的氧气。
2.将产氢样品冲入氩气5min以除去培养系统内的氧气,用取样器取5ml藻样,快速注入冲氩厌氧处理过的产氢玻璃管中,用蜡封住针口。
3.将玻璃管放置在摇床上,25℃,100μE·m-2·s-1光照下,160r/min的转速震荡反应1小时。
4.用气密性较好的进样器从玻璃管中的藻液上方抽取500μl气体打入气相色谱中,进行气体成分及含量测定。
5.计算每小时每毫克叶绿素的衣藻的氢气产量,即为体内氢化酶的活性。
衣藻体外氢化酶活性测定
1.将产氢培养所用的60ml的玻璃管冲入氩气5min,迅速用橡胶塞塞住瓶口。
2.用厌氧管配制反应母液A,甲基紫精10mmol/L;Tris 50nmol/L;Triton-X100 0.02%,配好后冲氩气5min,迅速用橡胶塞封住瓶口,用锡纸包裹遮光待用。
3.用厌氧管配制反应母液B,NaOH 0.03mol/L;连二亚硫酸钠10mmol/L,配好后冲氩气5min以去除体系内的氧气,迅速用橡胶塞封住瓶口,用锡纸包裹遮光待用。
4.将待测藻液冲入氩气5min以去除培养体系内的氧气,用进样器吸取1ml藻液注射到步骤1处理过的玻璃管中,然后再加入1ml母液A,200μl母液B。
5.将玻璃管用锡纸包裹遮光,放入37℃水浴锅震荡反应1小时。
6.反应完毕,用气密性较好的进样针抽取500μl反应液上方的气体打入气相色谱仪测量氢气产量。
7.计算出每小时每毫克叶绿素的衣藻产生氢气的量,即为体外氢化酶的活性。
注:步骤1-5均在黑暗条件下操作,连二亚硫酸钠和甲基紫精称量时要迅速并注意避光,以防止氧化失活。
在一个实施例中,使用如图17所示的基本思路,进行衣藻产氢量的研究。
实施例1藻菌的产氢培养
将衣藻培养至饱和期(OD750大约为3.0左右),用离心机5000rpm离心5min后上清去掉,加入适量的缺硫培养基重悬3次,以彻底去除原培养基中的硫。将缺硫处理过的衣藻按照0.5mg/L的叶绿素浓度转移到60ml的产氢培养瓶中,用缺硫培养基定容至45ml。将培养至对数期的固氮菌(OD600=1)分别按照菌藻1:80,1:40,3:80,1:20的体积比例加入到已加有衣藻的产氢瓶中,最后用橡胶塞密封瓶口。只有衣藻和只有固氮菌的培养体系作为对照组,将产氢瓶遮光黑暗处理24小时,以消耗培养体系内的氧气。加橡胶塞密封之前的所有步骤都在无菌操作台操作以避免实验过程中杂菌污染影响实验结果。黑暗处理过的产氢瓶分别放到30μE·m-2·s-1、60μE·m-2·s-1、100μE·m-2·s-1、200μE·m-2·s-1的光照下,每隔一定时间进行生理数据测量、电子显微镜观察。
用气密性较好的进样针从产氢瓶液面上方抽取0.5ml气体迅速注入高效气相色谱仪(Agilent Technoloies GC 7890A,USA)中,培养瓶的瓶塞立即用蜡封上以防漏气影响后续实验数据。高效气相色谱仪参数:柱子为分子筛,柱长2m,柱子内径3mm,使用后检测器TCD,所用载气为氩气,柱温设置为50℃,前进样口温度为200℃,TCD温度300℃。按照标准曲线计算出样品的氢气和氧气体积。
衣藻cc849与固氮菌产氢最优条件的筛选
25℃条件下,培养至饱和期的衣藻cc849和OD600为1.0的固氮菌以不同的体积比例共培养后、在不同光照条件下的氢气产量和氧气消耗结果如图3所示。从图中的结果可以看到:在任何光照条件下,单独的固氮菌培养体系都检测不到氢气的产生。
在30μE·m-2·s-1光照下,固氮菌与衣藻按照体积比1:80,1:40,3:80,1:20的比例共培养后,氢气最大产量分别约为39μmol·mg-1Chl、43μmol·mg-1Chl、45μmol·mg-1Chl、55μmol·mg-1Chl,分别是对照组(纯衣藻的培养体系)最大产氢量(20μmol·mg-1Chl)的2.0倍、2.2倍、2.31倍、2.8倍(图3A)。黑暗培养后各体系内氧气含量迅速下降,在产氢培养第4天迅速降低到5.1%、9.6%、10.8%和10.8%,之后保持在较低水平,为4.1%~4.9%;而对照组的氧气含量在产氢培养的第8天降为较低水平14.3%,之后继续逐步下降,达到最低值为7.3%(图3B)。
在60μE·m-2·s-1光照下,固氮菌与衣藻按照体积比为1:80,1:40,3:80,1:20的比例共培养后,氢气累积量的最大值分别为24μmol·mg-1Chl、38μmol·mg-1Chl、50μmol·mg-1Chl、57μmol·mg-1Chl,分别是对照组最大产氢量(14μmol·mg-1Chl)的1.7倍、2.7倍、3.6倍、4.1倍(图3C);在产氢培养4天后,各体系内的氧气含量分别迅速下降到8.6%、6.8%、7.5%和4.7%,之后保持在较低的水平,分别为5.3%、4.9%,4.2%,4.3%,而对照组的氧气含量在产氢培养的第10天下降到一个较低值15%,以后才逐渐降到9.1%的水平(图3D)。
在100μE·m-2·s-1光照下,固氮菌与衣藻按照体积比为1:80,1:40,3:80,1:20的比例共培养后,氢气累积量的最大值分别为68μmol·mg-1Chl、40μmol·mg-1Chl、28μmol·mg-1Chl、54μmol·mg-1Chl,是对照组最大产氢量(19μmol·mg-1Chl)的3.6倍、2.1倍、1.5倍、2.8倍(图3E)。在产氢培养4天后,各体系的氧气含量迅速下降,分别为5.8%,6.1%,6.0%,6.5%,之后保持在较低水平,分别为5.4%,4.7%,5.3%,5.0%,而对照组的的氧气含量在产氢培养的第6天下降到14.6%,以后才逐渐降到10.4%的水平(图3F)。
在200μE·m-2·s-1光照下,固氮菌与衣藻按照体积比为1:80,1:40,3:80,1:20的比例共培养后,氢气累积量的最大值分别为69μmol·mg-1Chl、139μmol·mg-1Chl、87μmol·mg-1Chl、58μmol·mg-1Chl,是对照组最大产氢量(30μmol·mg-1Chl)的2.3倍、4.6倍、2.9倍和1.9倍(图3G)。在产氢培养第4天后,各体系内氧气含量迅速下降,分别为5.3%,5.4%,5.0%,4.6%,之后继续下降保持在3.0%~4.2%的水平,而对照组的氧气含量在产氢培养第8天后只下降到12.5%,以后才逐渐降到9.4%的较低水平(图3H)。
综上所述,固氮菌(OD600=1.0)与培养至接近饱和期的衣藻共培养以后,都能提高衣藻的产氢量(图3A,C,E,G),而且都能促进培养体系内氧气的消耗(图3B,D,F,H)。尤其在200μE·m-2·s-1光照下、体积比为1:40时,其氢气产量为最大值139μmol·mg-1Chl,是纯衣藻培养体系最大产氢量(30μmol·mg-1Chl)的4.6倍(图3G),这是衣藻cc849与固氮菌共培养的最佳产氢条件。
衣藻cc124与固氮菌产氢最优条件的筛选
25℃条件下,培养至饱和期的衣藻cc124和OD600为1.0的固氮菌以不同的体积比例共培养后、在不同光照条件下的氢气产量和氧气消耗结果如图4所示。从图中的结果可以看到:在任何光照条件下,单独的固氮菌培养体系都检测不到氢气的产生。
在30μE·m-2·s-1光照下,固氮菌与衣藻按照体积比1:80,1:40,3:80,1:20的比例共培养后,氢气最大产量分别约为39μmol·mg-1Chl、40μmol·mg-1Chl、16μmol·mg-1Chl、46μmol·mg-1Chl,分别是对照组(纯衣藻的培养体系)最大产氢量(14μmol·mg-1Chl)的2.8倍、2.9倍、1.1倍、3.3倍(图4A)。产氢培养6天后,各体系内氧气含量迅速下降,分别保持在稳定水平约为3.5%、4.1%、5.6%和5.8%;而对照组的氧气含量在产氢培养的第8天降为10.8%,之后达到一个稳定值(图4B)。
在60μE·m-2·s-1光照下,固氮菌与衣藻按照体积比为1:80,1:40,3:80,1:20的比例共培养后,氢气累积量的最大值分别为55μmol·mg-1Chl、40μmol·mg-1Chl、38μmol·mg-1Chl、58μmol·mg-1Chl,分别是对照组最大产氢量(28μmol·mg-1Chl)的2.0倍、1.4倍、1.4倍、2.1倍(图4C);在产氢培养6天后,各体系内的氧气含量分别迅速下降到6.1%、5.3%、5.1%和5.7%,之后维持在一个较稳定的水平,而对照组的氧气含量在产氢培养的第10天以后才逐渐稳定,降到10.5%的水平(图4D)。
在100μE·m-2·s-1光照下,固氮菌与衣藻按照体积比为1:80,1:40,3:80,1:20的比例共培养后,氢气累积量的最大值分别为61μmol·mg-1Chl、68μmol·mg-1Chl、49μmol·mg-1Chl、47μmol·mg-1Chl,是对照组最大产氢量(23μmol·mg-1Chl)的2.7倍、3.0倍、2.1倍、2.0倍(图4E)。在产氢培养6天后,各体系的氧气含量迅速下降,分别为5.4%,4.9%,4.8%,5.2%,之后保持在一个稳定水平,而对照组的的氧气含量在产氢培养的第6天只下降到9.8%以后维持在这一稳定水平(图4F)。
在200μE·m-2·s-1光照下,固氮菌与衣藻按照体积比为1:80,1:40,3:80,1:20的比例共培养后,氢气累积量的最大值分别为103μmol·mg-1Chl、255μmol·mg-1Chl、78μmol·mg-1Chl、87μmol·mg-1Chl,是对照组最大产氢量(16μmol·mg-1Chl)的6.4倍、16.0倍、4.9倍和5.4倍(图4G)。在产氢培养6天后,各体系内氧气含量迅速下降,并维持在一个稳定水平,其值分别为5.3%,6.0%,7.6%,6.3%,而对照组的氧气含量在6天后下降到9.8%,之后维持在这一水平(图4H)。
综上所述,固氮菌(OD600=1.0)与培养至接近饱和期的衣藻共培养以后,都能提高衣藻的产氢量(图4A,C,E,G),而且都能促进培养体系内氧气的消耗(图4B,D,F,H)。尤其在200μE·m-2·s-1光照下、体积比为1:40时,其氢气产量为最大值255μmol·mg-1Chl,是纯衣藻培养体系最大产氢量(16μmol·mg-1Chl)的16.0倍(图4G),这是衣藻cc124与固氮菌共培养的最佳产氢条件。
以下实施例中,若没有特别指明,则衣藻和固氮菌的培养都是在上述最佳产氢条件下进行。
实施例2莱茵衣藻与固氮菌对共培养体系产氢的贡献
为了了解衣藻和固氮菌混合共培养体系中,藻和菌分别对产氢量提高的贡献,将纯衣藻培养系统、纯固氮菌培养系统、最佳产氢条件的衣藻-固氮菌共培养系统和最优混合比例的衣藻裂解物(即液氮冻融处理的藻)-固氮菌共培养系统(共4种不同培养体系)经过24小时黑暗后分别连续进行氢气测定,结果如图5所示。
由结果可知,纯固氮菌培养系统和衣藻裂解物-固氮菌共培养系统在所有的时间点都未检测到氢气的产生,而纯衣藻培养系统和按照最佳产氢条件混合的衣藻-固氮菌共培养系统都有氢气的产生。纯衣藻cc849的氢气产量最大值为30μmol·mg-1Chl,其最佳产氢条件藻菌共培养系统的氢气产量最大值为139μmol·mg-1Chl,产氢量提高了4.6倍(图5A)。衣藻cc124的纯衣藻系统的氢气产量最大值为17μmol·mg-1Chl,最佳产氢条件藻菌共培养系统氢气产量最大值为260μmol·mg-1Chl,产氢量也提高了15.3倍之多(图5B)。
由以上结果可知,纯固氮菌培养系统和最优混合比例的衣藻裂解物(即液氮冻融处理的藻)-固氮菌共培养系统并未产生氢气,只有纯衣藻培养系统和最佳产氢条件的衣藻-固氮菌共培养系统检测到了氢气产生。在藻菌共培养系统中,只有衣藻能产生氢气,固氮菌并不产生氢气,但是固氮菌对衣藻氢气的产生有促进的作用,能显著增加衣藻氢气产量,特别是藻种cc124,在最优产氢条件下,使其产氢量增加了十多倍。
上述结果与之前将衣藻与光合细菌和发酵产氢细菌共培养提高氢气产量的报道中藻菌对产氢的贡献完全不同。1992年,Miura将莱茵衣藻藻株MGA161与分离到的一株光合细菌W-1S共培养来进行产氢效率提高的研究,在他的研究中光合细菌W-1S利用衣藻MGA161分泌的乙酸和乙醇作为光合产氢的电子供体,衣藻MGA161培养基中的发酵产物刺激光合细菌产生氢气,这个藻-菌混合系统产氢贡献的是光合细菌,而衣藻只是作为发酵底物。2001年,Kawaguchi将光合细菌海虹菌A-501、发酵细菌食淀粉乳杆菌与绿藻(杜氏盐藻和莱茵衣藻)共培养产氢,在这个共培养系统中,食淀粉乳杆菌分解藻类提供的淀粉产生乳酸,海虹菌A-501在光照条件下,利用乳酸作为电子供体产生氢气,产氢贡献的是海虹菌,而衣藻同样也是为产氢细菌提供了有机质。2006年,Kim将莱茵衣藻UTEX90与拜氏梭菌厌氧发酵产生氢气和有机酸,发酵产生的有机酸又供给球形红细菌KD131光合发酵产生氢气,这样衣藻的生物量经过了厌氧发酵和光合发酵两个过程的充分利用放出氢气,提高了衣藻生物量产生氢气的转化率;2006年,Melis将莱茵衣藻与光合细菌梭状芽孢杆菌共培养,提高系统内的生物量和氢气产量,系统中衣藻生物量供给厌氧发酵细菌红螺菌产氢,同时红螺菌产生的有机酸又可以供给衣藻和光合细菌利用,这样形成一个良性产氢循环。吴双秀等在莱茵衣藻cc849中分离出3株衣藻共栖细菌,研究表明这三种细菌在一定浓度范围内对衣藻的生长并无显著影响,但是在低浓度时可以促进衣藻的产氢,共培养时最大产氢量提高了4倍之多,而高浓度时却抑制衣藻产氢,可能是浓度较高时细菌分泌了某些物质影响了衣藻的产氢。
以上研究中,藻菌共培养后,氢气都是由光合细菌或者产氢细菌产生的,而微藻只是作为有机质供给细菌利用。而本研究的结果与之前报道的结果具有很大的不同,本研究的固氮菌与衣藻共培养后,衣藻产生氢气,而固氮菌并未产生氢气,只是起到促进产氢的作用,是衣藻产氢代谢调控和固氮菌应用的一个新发现。
实施例3藻菌共培养系统中衣藻和固氮菌的生长状况及分布格局
1.为了检测衣藻与固氮菌共培养后的衣藻的生长情况,分别在正常TAP培养基中和在产氢的TAP-S培养基中,检测了在最佳产氢量的共培养条件下两种藻的生长情况。
正常培养条件下藻菌的共培养操作如下:培养至对数期的固氮菌(OD600大约为1.0),5000rpm离心5min后去掉上清,用同等体积的TAP重悬3次,以彻底去除固氮菌培养基,将重悬处理好的固氮菌按照最优产氢条件下的菌藻比例与衣藻混合,加入到培养至对数期的衣藻培养瓶中。以上操作都在无菌操作台操作。
衣藻的生长状况分别用其在750nm处的最大吸光度值(OD750)和叶绿素含量表示。结果如图6、7、8、9所示。随着培养时间的增加,在正常TAP培养基中,衣藻与固氮菌共培养体系中两种衣藻的生长速率(OD750值和叶绿素含量值)都明显增加。在TAP-S培养基中,因为缺少硫元素,所以衣藻生物量降低,加入固氮菌后衣藻OD750值和叶绿素含量基本保持不变,但是未加入固氮菌的衣藻其值却逐渐下降,所以,相对于单独衣藻培养的对照,共培养时两种衣藻的生长速率增加了。
在TAP培养基中共培养时衣藻的生长状况
衣藻与固氮菌在TAP培养基中共培养时,无论是加入固氮菌还是未加入固氮菌的衣藻,在培养过程中其OD750值都增加,但是加入固氮菌的衣藻增加得更快。如:衣藻cc849与固氮菌共培养前衣藻cc849的OD750值约为0.4,加入固氮菌后在共培养的第15天达到最大值,约为4.0,是未加入固氮菌的衣藻在第11天的最大值2.0的2.0倍(图6A);衣藻cc124与固氮菌共培养前衣藻cc124的OD750值约为1.1,加入固氮菌的衣藻最大值约为4.5,是未加固氮菌衣藻最大值2.6的1.7倍(图7A)。
叶绿素的检测结果也显示相似的结果,即在正常TAP培养基中,无论是加入固氮菌还是未加入固氮菌,衣藻的叶绿素含量都有所增加,但是加入固氮菌的衣藻增加的更快。如:衣藻cc849与固氮菌共培养前衣藻叶绿素含量都约为7.0mg/L,加入固氮菌共培养后第11天达到最大值为52.5mg/L,是未加固氮菌的衣藻最大值16.5mg/L的3.2倍(图6B);衣藻cc124与固氮菌共培养前衣藻cc124叶绿素含量都约为7.0mg/L,加入固氮菌共培养和未加固氮菌的衣藻cc124同样都在第9天达到最大值,分别为58.5mg/L和22.0mg/L,加入固氮菌的衣藻的叶绿素含量最大值是未加入固氮菌衣藻的2.7倍(图7B)。
在TAP-S培养基中共培养时衣藻的生长状况
在TAP-S培养基中,加入固氮菌后衣藻OD750值和叶绿素含量基本保持不变,但是未加入固氮菌的衣藻其值却逐渐下降。如:衣藻cc849与固氮菌在TAP-S共培养前衣藻cc849的OD750值约为0.43,加入固氮菌共培养后一直保持在1.32~1.64之间,是纯衣藻培养体系最大值0.62的2.65倍;而未加入固氮菌的衣藻cc849逐渐下降,最后下降到最低值0.51(图8A)。衣藻cc124与固氮菌在TAP-S共培养前衣藻cc849的OD750值约为0.63,加入固氮菌共培养后一直保持在0.63~0.65之间,是纯衣藻培养体系最大值0.55的1.15倍,此后一直保持在0.65左右;而未加入固氮菌的衣藻cc124逐渐下降,最后下降到最低值0.45(图9A)。
叶绿素的检测结果也显示相似的结果,即加入固氮菌的衣藻叶绿素含量基本保持不变,而未加入固氮菌的纯衣藻培养体系的叶绿素含量有所降低。结果如下:衣藻cc849与固氮菌在TAP-S共培养产氢前的衣藻叶绿素含量约为10.0mg/L,加入固氮菌共培养后第11天达到最大值为14.51mg/L,是纯衣藻培养体系的1.5倍,此后一直维持在14.0mg/L左右,未加固氮菌的纯衣藻培养体系其叶绿素含量一直维持在9.0~10.5mg/L之间,基本变化不大(图8B)。衣藻cc124与固氮菌在TAP-S产氢共培养前衣藻叶绿素含量都约为9.21mg/L,加入固氮菌共培养后基本保持在8.67~9.21mg/L,是纯衣藻培养体系的1.45倍;未加固氮菌的纯衣藻培养体系叶绿素含量反而略有降低,一直维持在5.49~6.61mg/L之间(图9B)。
2.为了确定衣藻与固氮菌共培养后的固氮菌的生长,进一步检测了固氮菌的生长状况(用OD600表示),结果如图10和11所示。由结果可知,无论是在正常的TAP培养基还是TAP-S产氢培养时,与衣藻共培养的固氮菌的生长都明显增长。
在TAP培养基中共培养时固氮菌的生长状况
如图10所示,固氮菌与衣藻cc849在TAP培养基中共培养后,固氮菌的生长速度比纯固氮菌培养生长得快。如:固氮菌与衣藻cc849共培养前OD600值为0.02,共培养后逐渐增加,到第7天达到最大值1.93,此后保持在1.43~1.61,而纯固氮菌系统OD600值也略有上升,在第3天达到最大值0.11(图10A);固氮菌与衣藻cc124共培养前OD600值为0.08,共培养后逐渐增加,到第5天达到最大值2.00,此后保持在1.63~1.99,而纯固氮菌系统OD600值也略有上升,在第5天达到最大值0.13(图10B)。
由以上可知,固氮菌与衣藻在TAP培养基中共培养时,固氮菌的生长也受到了促进,比在纯固氮菌系统中快。
在TAP-S培养基中共培养产氢时固氮菌的生长状况
固氮菌与衣藻在TAP-S培养基中共培养后结果如图11所示,由结果可知,固氮菌与衣藻在TAP-S培养基中共培养后生长比纯固氮菌系统快,即固氮菌与衣藻cc849共培养前OD600值为0.02,共培养后逐渐增加,到第13天达到最大值1.22,是纯固氮菌体系第5天最大值0.11的11.1倍(图11A);固氮菌与衣藻cc124共培养前OD600值为0.08,共培养后逐渐增加,到第11天达到最大值1.32,是纯固氮菌系统在第13天最大值0.12的11.0倍(图11B)。
由以上可知,固氮菌与衣藻在TAP-S培养基中共培养产氢时,固氮菌的生长也比在纯固氮菌系统中快。
3.藻菌共培养后的分布格局
为了了解衣藻与固氮菌共培养产氢过程中,衣藻与固氮菌的相互影响、相互作用的情况,我们在共培养的产氢过程中用光学显微镜(×100倍)连续观察了衣藻与固氮菌在共培养体系中细胞的分布情况,结果如图12和13所示,分别显示了固氮菌与衣藻cc849、固氮菌与衣藻cc124共培养后的细胞分布格局。
在未加入固氮菌之前(图12A,图13A),衣藻cc849藻和cc124藻都是规则的圆形,颜色是鲜绿色,衣藻细胞内的结构(如叶绿体、淀粉粒、线粒体、高尔基体等细胞器结构)清晰完整;刚加入固氮菌后(图12B,图13B),固氮菌和衣藻在共培养体系中也是均匀分布的,两者间还没有发生相互作用,衣藻还是鲜艳的亮绿色,保持了较好的生理活性;固氮菌在显微镜下呈杆状的半透明状态,可以游动,这个阶段也是藻类产氢的初始阶段。
衣藻cc849和衣藻cc124与固氮菌混合培养7天后,显微镜下都能观察到固氮菌在衣藻细胞周围聚集、形成特殊的“藻菌团聚物”并且在这个阶段固氮菌的数量和藻的数量都明显增多(图12C,图13C),衣藻细胞体积也明显增大,这个状态维持4天左右,这个时期也是藻类产氢速率迅速增长的产氢高峰阶段。
衣藻cc849与固氮菌、衣藻cc124与固氮菌混合培养11天后,固氮菌还是聚集在衣藻细胞周围呈现“团聚物”状,固氮菌的数量进一步增多,衣藻的数量逐渐降低(图12D,图13D),衣藻细胞的体积进一步增大、形状更圆,里面的内容物在显微镜下清楚可见。大部分的藻细胞还是维持完整的细胞状态,但是,部分衣藻细胞开始有破裂现象,其细胞结构不再完整,内容物溢出。此时衣藻的产氢还在继续,但是产氢的速率已经远远低于之前的阶段。
衣藻cc849与固氮菌衣藻、cc124与固氮菌混合培养13天后,此时的固氮菌仍然聚集在衣藻细胞周围生长,但是固氮菌的数量基本没有增长,衣藻的数量降低(图12E,图13E),而且培养体系中绝大部分衣藻破裂后出现了“泡状物”,此时系统中的藻类氢气速率已经特别低。
衣藻cc849与固氮菌衣藻、cc124与固氮菌混合培养15天后(图12F,图13F),培养体系中的衣藻细胞几乎全部出现破裂现象,很多衰亡的藻细胞只剩下了“泡状物”,固氮菌聚集或者游离在破碎的衣藻周围,其数量也不再增加(图12F,图13F),游动活性也降低,此时培养体系中的衣藻类不再产生氢气,处于产氢累积的稳定时期。
由以上观察情况可以发现,两种衣藻与固氮菌共培养一段时间后,固氮菌会向衣藻细胞聚集、形成特殊的“团聚体”聚集在一起,此时产氢开始启动并迅速进入快速增长期;在这个阶段,衣藻与固氮菌的数量也迅速增加,因此可以推测,可能是两者间产生的营养物质或者是分泌的信号分子促使二者聚集在一起。
衣藻与固氮菌依靠营养物质聚集:衣藻与固氮菌共培养后固氮菌逐渐向衣藻聚集,形成特殊“藻-菌团聚体”。圆褐固氮菌属于固氮细菌,因此,推测可能是由于其在与衣藻共培养时进行固氮作用为衣藻提供了氮源,衣藻还可能产生了氨基酸等有机物供固氮菌利用,这种代谢补偿作用促使固氮菌与衣藻聚集在一起,并且彼此提供所需营养,使得固氮菌与衣藻聚集后二者的细胞数量都迅速增加。它们之间依靠营养物质相互吸引聚集在一起产生互惠共生关系。
衣藻与固氮菌间依靠信号分子聚集:推测衣藻和固氮菌间除了通过营养物质的“交流”外,可能还存在着信号分子的相互影响,即固氮菌作为一种革兰氏阴性菌,可能分泌具有群体感应效应的信号分子,而衣藻也可能分泌直接信号分子或类似物,使得二者之间发生相互作用和相互影响。衣藻分泌的某些信号物质很可能影响了固氮菌的生理特性促使其生长增快,数量增加,同时固氮菌分泌的信号分子也可能对衣藻的形态等生理特征也产生了一些影响,如细胞的数量增多,细胞内的内容物更加清晰,一些代谢物(如淀粉)含量发生了变化。
另外,由于在产氢高峰时期会出现“藻菌团聚物”,为了能进一步提高衣藻的产氢量,在将衣藻cc849或衣藻cc124分别与固氮菌混合培养3天时,加入一定量的聚乙二醇,观察产氢量的变化。实验发现,当在藻菌共培养3天时,加入终浓度为0.05%(质量体积比)的PEG-200进行共培养,衣藻cc849与固氮菌共培养15天的氢气产量最大值达到了248μmol·mg-1Chl,是纯衣藻培养体系最大产氢量(30μmol·mg-1Chl)的8.2倍。衣藻cc124与固氮菌共培养15天的氢气产量最大值达到了374μmol·mg-1Chl,是纯衣藻培养体系最大产氢量(16μmol·mg-1Chl)的23倍。
实施例4藻菌共培养产氢时衣藻的氢化酶活性
为了进一步确定衣藻与固氮菌共培养后产氢量增加的原因,我们分别检测了两种衣藻与固氮菌共培养产氢过程中不同衣藻藻种的体内氢化酶活性和体外氢化酶活性,结果如图14、15所示。
由结果可知,衣藻cc849与固氮菌共培养产氢后无论是体外还是体内氢化酶都比未加入固氮菌的高,未加入固氮菌的衣藻体外氢化酶最高活性约为21.6nmol H2μgChl-1·h-1,与固氮菌共培养的衣藻的体外氢化酶最高活性提高了2.5倍,约为75.0nmol H2μgChl-1·h-1(图14A);未加入固氮菌的衣藻体内氢化酶最高活性约为24.0nmol H2μgChl-1·h-1,而与固氮菌共培养的衣藻体内氢化酶最高活性约为39.9nmol H2μgChl-1·h-1,是纯藻培养的1.7倍(图14B)。
衣藻cc124与固氮菌共培养产氢后体外和体内的氢化酶活性都比对照组(纯衣藻系统)高,其最大值分别为110.0nmol H2μgChl-1·h-1和62.0nmol H2μgChl-1·h-1,分别是对照组29.0nmol H2μgChl-1·h-1、33.0nmol H2μgChl-1·h-1的3.8倍和1.9倍(图15A,15B)。
衣藻的氢化酶是氧气敏感的,只有在厌氧的条件下氢化酶才能被诱导表达,运输到叶绿体中,接受来自类囊体膜的光合电子产生氢气,氢气产量的高低与氧气含量是密切相关的。结合以上结果可知,加入固氮菌后,衣藻的体外氢化酶活性和体内氢化酶活性都比未加入固氮菌的衣藻增加,这可能是加入固氮菌促进衣藻产氢增加的直接原因。
实施例5藻菌共培养产氢时衣藻中淀粉含量的测定
衣藻产氢时氢化酶主要有两个电子来源途径,一个是接受“光合电子传递链”的电子,另一个是接受无氧条件下糖酵解和三羧酸循环产生的还原剂导致的NAD(P)H脱氢为NAD(P)+释放的电子。因此淀粉的含量与衣藻产氢效率有密切联系。对藻菌共培养前后衣藻的淀粉含量进行了测定,结果如图16所示。
由结果可知,纯衣藻cc849或cc124在产氢阶段的淀粉含量是逐渐增加的,但是增加的不显著,其最大值分别为0.25μg/ml、1.32μg/ml。加入固氮菌的两种衣藻在产氢阶段,淀粉的含量都随着培养时间的增加显著增加,其最大值分别为2.11μg/ml、3.05μg/ml,分别是对照组(未加入固氮菌的衣藻)的8.4倍、2.3倍。
由以上可知,加入固氮菌后,两种衣藻的淀粉含量都有显著增高,每个藻种的变化规律是相同的,即:衣藻cc849和cc124在加入固氮菌后其淀粉含量随着培养时间一直显著增长,产氢的饱和期即第15天达到最大值。高的淀粉含量可以使衣藻在缺氧条件下依靠淀粉水解生成更多葡萄糖,而葡萄糖经过糖酵解分解过程中产生更多的电子供给氢化酶,最终使淀粉含量高的衣藻的氢气产量增高,这是共培养过程中固氮菌促进莱茵衣藻产氢量提高的一个重要原因。另一方面,衣藻淀粉的积累增加,也会促进衣藻的生长,这也可能是共培养过程中固氮菌促进衣藻生长的一个原因。
- 还没有人留言评论。精彩留言会获得点赞!