检测人体CYP3A4代谢酶表达用的LncRNAs生物标志物及其检测引物和检测方法与流程
本发明涉及基因治疗和医学诊断领域,具体涉及检测人体cyp3a4代谢酶表达用的lncrnas生物标志物及其检测引物、检测方法和用途。
背景技术
药物代谢酶是药物在肝脏代谢最重要的酶类,其表达水平和活性的改变会导致药物疗效和安全性的变化。其中,细胞色素p4503a4(cyp3a4)是肝脏中最重要的药物代谢酶,50%以上的临床药物经其代谢(zangerum,turpeinenm,kleinkandschwabm.functionalpharmacogenetics/genomicsofhumancytochromesp450involvedindrugbiotransformation.analbioanalchem.2008;392(6):1093-1108.)。cyp3a4的表达和活性在不同个体间存在高达几十倍的差异,而这种巨大的差异在临床上经常引起严重的药物相互作用和不良反应(zangerumandschwabm.cytochromep450enzymesindrugmetabolism:regulationofgeneexpression,enzymeactivities,andimpactofgeneticvariation.pharmacolther.2013;138(1):103-141.)。cyp3a4的表达差异受遗传因素和环境因素的双重影响(zangerum,kleink,thomasm,riegerjk,tremmelr,kandelba,kleinmandmagdyt.genetics,epigenetics,andregulationofdrug-metabolizingcytochromep450enzymes.clinpharmacolther.2014;95(3):258-261.)。过去十几年的研究结果表明,cyp3a4基因多态性由于其较低的分布频率和种族差异并不能充分解释和预测cyp3a4活性的个体差异。因此,目前cyp3a4表达的调控机制仍未被完全阐明,而找出cyp3a4活性个体差异的主要原因对推动临床个体化用药和精准医疗有着非常重要的意义。
长链非编码rna(longnon-codingrnas,lncrnas),是一类长度大于200个核苷酸的非编码rna,它们因缺少相应特异的开放阅读框而不具有编码蛋白质的功能。lncrnas在基因组转录本中占有很大比例且具有多种形式,根据其在基因组的位置可以分为:双向lncrna(bidirectionallncrna)、外显子lncrna(exonlncrna)、内含子lncrna(introniclncrna)、基因间lncrna(intergeniclncrna)、正义链lncrna(senselncrna)以及反义链lncrna(antisenselncrna)(mal,bajicvb,zhangz.ontheclassificationoflongnon-codingrnas.rnabiol.2013;10(6):925-933.)。lncrnas在胞核内可作为辅激活因子与转录因子发生直接相互作用而共同调控基因表达(zhaoxy,lis,wanggx,yuqandlinjd.alongnoncodingrnatranscriptionalregulatorycircuitdrivesthermogenicadipocytedifferentiation.molcell.2014;55(3):372-382.)。此外,lncrns也能够通过募集一些染色质重塑复合物而抑制基因的表达(kanekos,bonasior,saldana-meyerr,yoshidat,sonj,nishinok,umezawaaandreinbergd.lnteractionsbetweenjarid2andnoncodingrnasregulateprc2recruitmenttochromatin.molcell.2014;53(2):290-300.)。lncrnas可以在转录调控、转录后调控及表观遗传学调控等多个方面调控基因的表达。然而,lncrnas对人体cyp3a4代谢酶表达的调控还处于未知阶段。
技术实现要素:
本发明的目的在于:通过研究lncrnas对人体cyp3a4代谢酶表达的影响,提供2个检测人体cyp3a4代谢酶表达用的lncrnas生物标志物,以及这2个lncrnas生物标志物的检测方法和用途。
为了实现上述目标,本发明采用如下的技术方案:
检测人体cyp3a4代谢酶表达用的lncrnas生物标志物,其特征在于,前述lncrnas生物标志物包括:hnf1a-as1和nonhsat031260,其中,
前述hnf1a-as1的核苷酸序列如序列表中seqno.4所示;
nonhsat031260的核苷酸序列如序列表中seqno.5所示。
检测前述的lncrnas生物标志物的方法,其特征在于,包括以下步骤:
step1:抽提肝脏组织总rna;
step2:将mrna反转录成cdna;
step3:以gapdh为内参基因,进行qpcr反应,具体如下
(1)引物设计如下:
(2)反应体系如下:
反应程序设置为:50℃2min,95℃2min;95℃15s,60℃1min,循环数为40;
溶解曲线反应为:95℃15s,60℃1min,95℃15s,60℃15s;
在每个循环退火与延伸时读取荧光强度;
step4:对real-timepcr数据进行分析,real-timepcr数据以荧光强度δrn与循环数表示,logδrn对循环数函数的中间值设为阈值,当某个样品的δrn值与该阈值有交点时,交点处的循环数记为ct,采用相对定量的方法检测成人肝脏组织中hnf1a-as1和nonhsat031260的表达水平,目的基因cdna相对于内参gapdh增加的倍数用下面的公式表示:
变化倍数=2-δδct,
δδct=(ct目的-ctgapdh)tx-(ct目的-ctgapdh)t0
其中,tx表示任意时间点,t0表示起始时间点;
step5:用标准曲线来检测用2-δδct方法表示的相对定量和基因绝对量的平行关系。
检测前述的lncrnas生物标志物的引物,其特征在于,序列如下:
本发明的有益之处在于:
(1)首次发现2个与人体代谢酶cyp3a4表达高度正相关的lncrnas生物标志物hnf1a-as1和nonhsat031260,并提出了此标志物的检测引物和检测方法;
(2)通过检测hnf1a-as1和nonhsat031260的表达,我们可以评估机体cyp3a4代谢酶的活性,从而可以指导临床药师调节患者使用药物剂量。
附图说明
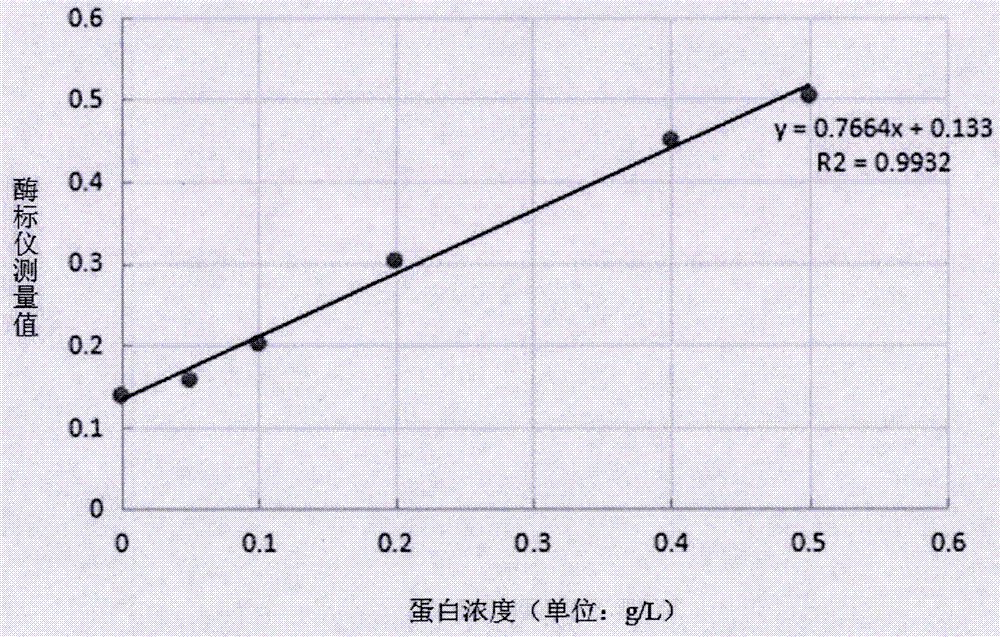
图1是肝微粒体蛋白含量的标准曲线图;
图2是以3号为例双倒数作图得到的线性回归方程曲线图;
图3是芯片实验流程图;
图4(a)是p<0.05时6例成人肝脏中差异表达lncrnas的聚类热图;
图4(b)是p<0.01时6例成人肝脏中差异表达lncrnas的聚类热图;
图5是筛选出的lncrnas与hnf1a的相对位置关系图;
图6是hnf1a-as1与cyp3a4mrna表达的相关性分析图;
图7是nonhsat031260与cyp3a4mrna表达的相关性分析图;
图8是hnf1a-as1与cyp3a4蛋白表达的相关性分析图;
图9是nonhsat031260与cyp3a4蛋白表达的相关性分析图。
具体实施方式
若未特别指明,具体实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
以下结合附图和具体实施例对本发明作具体的介绍。
第一部分:测定肝脏组织标本中cyp3a4代谢酶的活性
一、收集与保存肝脏标本
标本取自郑州大学第一附属医院肝胆外科的6例住院患者。患者进行肝胆切除手术时取边缘正常的肝脏组织,经病理学检验为正常肝脏组织,无肝炎、肝癌病变,肝脏组织离体后立即用预冷的pbs清洗数次,然后保存于液氮中用准备好的冻存管装载包裹,记录编号及日期并迅速投入液氮中冷却保存,备份对应病历。
本研究得到郑州大学第一附属医院医学伦理委员会的批准,所有标本的收集均已得到患者的同意并在手术前签署了知情同意书。
二、制备肝微粒体
采用差速离心法制备肝微粒体,制备过程具体如下:
(1)取0.2g-1.0g人肝组织放入研磨器中,加入2ml重悬液研磨,直至成为肝匀浆;
(2)将制备好的肝匀浆在超速离心机上离心10000g,4℃,20min;
(3)吸出上清液放入10ml离心管中,再加重悬液,两两配平(误差<0.05g),离心,100000g,4℃,60min;
(4)离心结束后弃上清,加0.15m的tris-hcl4ml,打散,然后再次离心,100000g,4℃,60min;
(5)弃上清,每克肝脏组织加蔗糖悬液2ml,打散,分装,-80℃保存。
三、测定肝微粒体的蛋白含量
采用bca蛋白测定法(碧云天试剂公司)测定肝微粒体的蛋白含量。
实验前将所用试剂和用具均置于4℃预冷,所有操作均在冰上进行。
肝微粒体蛋白含量的测定过程具体如下:
(1)根据样品数量,按50体积bca试剂a加1体积bca试剂b(50∶1)配置bca工作液,充分混匀;
(2)完全溶解蛋白标准品,取10μl稀释至100μl,使终浓度为0.5mg/ml;
(3)将标准品按0μl、1μl、2μl、4μl、8μl、12μl、16μl、20μl加到96孔板的标准品孔中,加用于稀释标准品的溶液补足至20μl;
(4)加适量体积(5μl)样品到96孔板中的样品孔中,加用于稀释标准品的溶液至20μl;
(5)各孔加入200μlbca工作液,60℃摇床放置30min;
(6)使用酶标仪,检测波长为595nm,根据标准曲线计算出蛋白浓度。
肝微粒体蛋白含量的标准曲线如图1所示。
经计算,6例人肝脏组织标本中的肝微粒体蛋白含量如下:
表16例人肝脏组织标本中的肝微粒体蛋白含量
四、孵育肝微粒体
影响酶活性的因素主要有反应时间、酶浓度、底物浓度。根据影响酶活性的因素,我们先利用单因素实验对孵育条件进行优化,其中,反应时间、酶浓度分别定位20min、0.25mg/ml(体系浓度),设置5个不同浓度点,咪达唑仑(mdz)浓度为1μm、2μm、3μm、4μm和5μm,在线性较好的范围内取点作为样品孵育浓度。
优化后的孵育条件以及孵育过程具体如下:
(1)依次加入100mmol/l、ph=7.4的pbs50μl、100μmol/l咪达唑仑(mdz)2μl、4μl、6μl、8μl、10μl,浓度均为初始浓度,肝微粒体体积若干,使其终浓度为0.25g/l;
(2)超净水补足至150μl,混匀;
(3)37℃预孵育10min后,加入nadph生成系统(10mmol/l、nadpna210μl,200mmol/lg-6-pna210μl,1u/μlg-6-pdh20μl,200mmol/lmgcl210μl,共计50μl)50μl,混匀,37℃孵育20min;
(4)加入冰甲醇(含1.25μg/ml地西泮)中止反应。
五、检测人体cyp3a4代谢酶的活性
1、样品处理
加入冰甲醇(含1.25μg/ml地西泮)中止孵育反应后,涡旋3min,13000g离心10min,取上清(200μl)用于进样。
2、高效液相色谱条件
(1)高效液相色谱仪:waterse2695;
(2)色谱柱:watersc-18(4.6×250mm,5μm);
(3)波长:210nm;
(4)柱温:35℃;
(5)室温25℃2;
(6)流动相:甲醇∶水∶乙腈=46∶34∶20;
(7)流速:1ml/min;
(8)进样量:10μl。
3、制作标准曲线
制作过程如下:
(1)用超净水代替nadhp生成系统,用1-羟基咪达唑仑(1-ohmdz)代替mdz,按空白孵育体系处理样品,标准曲线设置6个点,体系中1-ohmdz浓度分别100ng/ml、200ng/ml、500ng/ml、1000ng/ml、2000ng/ml和5000ng/ml,每个点设置3个平行样品,记录色谱图;
(2)以待测物1-ohmdz峰面积与地西泮峰面积比值平均值为纵坐标,以待测物1-ohmdz浓度为横坐标,用加权(1/x2)最小二乘法进行线性回归运算,得出直线回归方程。
经运算,得到的直线回归方程如图2所示。
4、数据处理
人体cyp3a4代谢酶的活性用1-ohmdz生成量速度表示,以1/[s]为横坐标(s代表1-ohmdz的生成量),以1/v为纵坐标(v代表1-ohmdz的生成速度),采用lineweaver-burk双倒数作图并进行线性回归。纵轴截距=1/vmax,斜率=km/vmax,由回归方程求出vmax、km。
表26例人肝脏组织标本vmax和km值
经处理,6例人肝脏组织标本中的cyp3a4代谢酶的活性如下:
表36例人肝脏组织标本中的cyp3a4代谢酶的活性
第二部分:筛选调控cyp3a4的lncrnas
一、提取肝脏组织总rna
选取上述6例肝脏标本,按照罗氏tripureisolationreagent的操作步骤提取肝组织标本总rna,具体的操作步骤如下:
(1)冰上取0.5g肝脏组织置于-20℃预冷过的研砵中,加入液氮迅速研磨直至肝组织成粉末状,迅速将组织粉末转移至1.5ml去除rna酶的离心管中,加入1.0mltrizol,用一次性研磨小杵在离心管内再次研磨,使其充分裂解10min;
(2)取出1.5ml离心管置于冰上,加入氯仿200μl/管,上下颠倒混匀15s,冰上静置15min后,离心,4℃,12000×g,15min;
(3)取上清于新的1.5ml离心管中,加入0.5ml的异丙醇,轻柔混匀,冰上静置10min后,离心,4℃,12000×g,15min;
(4)弃上清,加入75%乙醇1ml,轻弹管壁使沉淀rna漂浮,室温静置5min后离心,4℃,7500×g,5min;
(5)枪头小心吸取上清并丢弃,管内沉淀室温静置至完全干燥;
(6)加入适量depc水溶解,轻柔混匀后于-80℃冰箱保存。
我们对提取的总rna进行了鉴定,具体如下:
(1)用nanodrop2000分光光度计检测230nm、260nm和280nm处吸光度,并计算rna浓度;
(2)利用普通琼脂糖凝胶电泳检测rna的完整性,将1μlrna与5μl6×上样缓冲液(loadingbuffer)充分混匀,加入1%琼脂糖凝胶上样孔,150v、15min快速电泳,紫外观察条带是否完整,凝胶成像系统拍照分析,经观察,凝胶上呈现出了清晰的三个条带:28s、18s与5s,其中,28s和18s核糖体rna的条带亮而浓,28srna条带的密度大约是18srna的2倍,5srna条带更小并且稍微扩散(因为该条带主要由低分子量的trna和5srna组成),这说明我们提取到的rna保持了较好的完整性。
二、芯片实验
本实验所用芯片为6张sbc-lncrna(人4x180k)芯片(上海伯豪提供)。实验样品6例成人肝脏组织rna采用agilent表达谱芯片配套试剂盒和标准操作流程对样品totalrna进行放大和标记,并用rneasyminikit纯化标记后的crna。然后按照agilent表达谱芯片配套提供的杂交标准流程和配套试剂盒进行芯片杂交实验,在滚动杂交炉中65℃,10rpm,滚动杂交17h,杂交crna上样量1.65μg,并在洗缸中洗片,洗片所用的试剂为washbufferkit。完成杂交的芯片采用agilentmicroarrayscanner进行扫描,用featureextractionsoftware10.7读取数据,最后采用genespringsoftware11.0进行归一化处理,所用的算法为quantile。
芯片实验流程如图3所示。
三、筛选调控cyp3a4的lncrnas
完成芯片实验流程后,芯片扫描得到的原始数据由genespringsoftwaregx11.0(agilenttechnologies,santaclara,ca,us)来进行归一化处理,所用的算法为quantile。原始数据用软件genespringsoftware归一化后,采用fold-change(表达差异倍数)以及t检验(student′st-test)统计学方法对差异lncrna进行筛选,挑选条件如下:
(1)表达差异倍数foldchange(linear)≤0.5或表达差异倍数foldchange(linear)≥2;
(2)t-testp-value<0.05或t-testp-value<0.01。
表达差异倍数foldchange值越大,说明两组样品之间差异越大;t-testp-value值越小,说明筛选出差异基因的可靠性越高。
按照上述原则筛选出差异表达lncrnas数据做聚类热图分析:
当p<0.05时,如图4(a)所示,表达差异在2倍以上或0.5倍以下的lncrnas有112个,其中上调的lncrnas有89个,下调的lncrnas有23个;
当p<0.01时,如图4(b)所示,表达差异在2倍以上或0.5倍以下的lncrnas有20个,其中上调的lncrnas有17个,下调的lncrnas有3个。
具体信息见表4。
表4表达差异倍数≥2或者≤0.5的lncrnas
图4(a)和图4(b)两幅差异表达lncrnas的聚类热图直观的反映了lncrnas在cyp3a4差异表达肝脏组织中的表达情况:80%左右差异表达的lncrnas与cyp3a4表达正相关,即cyp3a4表达高组相应lncrnas表达也高。
本研究继续对上述差异表达的lncrnas的靶基因进行预测。由于大多数lncrnas定位在细胞核内,并且通过cis调控或者trans调控从而影响靶基因的表达。所以本研究选取与lncrnas距离小于10kb的基因作为cis作用的靶基因。trans调控的预测按下列原则:采用的数据库是物种对应的基因序列数据库。在数据库中先采用blast选择出序列上具有互补性或相似性的序列,再利用rnaplex计算两序列之间的互补能量,选择e≤-30的序列。
很遗憾的是,从上述差异表达的lncrnas中并未筛选出直接靶向cyp3a4的lncrnas。但我们筛选出了两个能够靶向肝细胞核因子hnf1a的lncrnas,它们分别是hnf1a-as1和nonhsat031260(在本专利中),具体信息如表5和图5所示。
表5芯片结果筛选出lncrnas的具体信息
由图5可知,这两个lncrnas均位于hnf1a基因反义链上且与其相邻,极有可能能够调控hnf1a的表达。
而本课题组前期也发现肝细胞核因子hnf1a能够调控cyp3a4的表达,并且已有文献报道hnf1a作为肝脏特异性转录因子能够增强cyp3a4的表达(chiangts,yangkc,chioull,etal.enhancementofcyp3a4activityinhepg2cellsbylentiviraltransfectionofhepatocytenuclearfactor-1alpha[j].plosone,2014,9(4):e94885.)。所以我们推测lnc-hnf1as极有可能通过与其临近基因hnf1a之间相互作用从而影响cyp3a4的表达。
第三部分:在肝脏组织水平分析hnf1a-as1和nonhsat031260与代谢酶cyp3a4的mrna和蛋白表达的关系
在30例肝脏组织中检测hnf1a-as1、nonhsat031260和cyp3a4的表达,并对hnf1a-as1、nonhsat031260与cyp3a4代谢酶的mrna和蛋白表达进行相关性分析,从肝脏组织水平进一步验证hnf1a-as1、nonhsat031260与cyp3a4代谢酶的相关性。
一、收集与保存肝脏标本
本研究所用人肝脏标本均取自郑州大学第一附属医院的患者。标本来源为肝血管瘤、胆囊癌、肝胆管结石等患者进行切除术所取得的肝脏组织,研究所取部位为正常肝脏组织。收集标本后即刻将标本置于备好的冻存管中迅速放入液氮罐内储存备用。本研究得到郑州大学第一附属医院医学伦理委员会的批准,共收集人肝脏组织标本30例,所有标本的收集均已得到患者的同意并在手术前签署了知情同意书。
二、quantitivereal-timepcr检测肝脏组织hnf1a-as1、nonhsat031260及cyp3a4mrna表达水平
1、肝脏组织抽提总rna
按照罗氏tripureisolationreagent的操作步骤提取肝组织标本总rna,具体操作步骤参考第一部分。
2、mrna反转录成cdna
本研究采用日本takara公司的
(1)去除基因组dna
采用试剂盒中的gdnaeraser去除抽提总rna中的基因组dna。反应体系如下:
反应条件为42℃,2min。
(2)反转录
反转录体系如下:
pcr反应程序为:37℃15min,85℃5s,4℃pause。所得cdna-20℃长期储存。
3、real-timepcr反应
本研究按照abiprism7500real-timepcrsystem的操作说明进行qpcr反应。采用美国thermofisherscientific公司的realtimepcrmastermix(sybrgreeni)染料,gapdh为内参基因,以相对定量的方法检测成人肝脏组织中hnf1a-as1、nonhsat031260及cyp3a4mrna表达水平。
(1)引物设计如下:
(2)反应体系如下:
反应程序设置为:50℃2min,95℃2min;95℃15s,60℃1min,循环数为40。溶解曲线反应为:95℃15s,60℃1min,95℃15s,60℃15s。在每个循环退火与延伸时读取荧光强度。
(3)real-timepcr数据分析
real-timepcr数据以荧光强度δrn与循环数表示。系统δrn用以下公式表示:
δrn=(rn+)-(rn-)
其中,rn+指产物在任意时间的荧光强度,rn-指系统基底荧光强度(大约是在第6循环至第15循环时的荧光强度)。
阈值一般设定为logδrn对循环数函数的中间值。当某个样品的δrn值与该阈值有交点时,交点处的循环数记为ct。
该实验采用相对定量,目的基因edna相对于内参gapdh增加的倍数用下面的公式表示:
变化倍数=2-δδct,
δδct=(ct目的-ctgapdh)tx-(ct目的-ctgapdh)t0
其中,tx表示任意时间点,t0表示起始时间点。
用标准曲线来检测用2-δδct方法表示的相对定量和基因绝对量的平行关系。
通过real-timepcr检测30例人肝脏组织标本中hnf1a-as1、nonhsat031260与cyp3a4的表达并进行spearman关联性分析的结果如下:
(1)如图6所示,hnf1a-as1表达与cyp3a4代谢酶mrna表达呈高度正性相关(r=0.713p<0.001):
(2)如图7所示,nonhsat031260表达与cyp3a4代谢酶mrna表达呈中度正性相关(r=0.551,p<0.01)。
三、westernblot检测hnf1a-as1、nonhsat031260与代谢酶cyp3a4蛋白表达的相关性
1、提取/30例成人肝脏标本组织的总蛋白
采用武汉博士德生物工程有限公司提供的哺乳动物组织总蛋白提取液提取肝脏组织的总蛋白。剪取适量(约100mg)液氮中冻存的成人肝脏组织,置于-20℃预冷过的研钵中,加入液氮迅速研磨直至成粉末状。向研钵中加入500μl组织裂解液(裂解液∶pmsf∶cocktail=100∶1∶10),冰上裂解30min,在裂解过程中应在冰上间断性研磨组织,确保组织裂解完全。用移液器将组织裂解液转移至ep管中,4℃12000×g离心15min,小心吸取上清液置于新的ep管中,取2μl用bca试剂盒检测蛋白浓度,其余分装,-80℃长期储存。
用前按比例加入5×上样缓冲液(loadingbuffer),100℃煮沸5-10min,瞬时离心备用。
2、bca法测定蛋白浓度
采用上海碧云天生物技术有限公司提供的bca蛋白浓度测定试剂盒测定抽提总蛋白的浓度。具体操作步骤如下:
(1)bsa标准品工作液的配制:用灭菌水完全溶解牛血清白蛋白标准品bsa(5mg/ml),取20μl稀释至200μl,使其终浓度为0.5mg/ml备用(-20℃长期储存);
(2)bca工作液的配制:每个孔需要200μlbca工作液,按照体积比a液∶b液=50∶1配制所需用量;
(3)将牛血清白蛋白标准品bsa按下表梯度稀释配制加样到96孔板的标准品孔中:
(4)取待测样品2μl,加入18μl超纯水补足20μl体系,每孔加入200μlbca工作液,37℃恒温摇床孵育30min;
(5)冷却至室温后,用imark型酶标仪测定吸光度(595nm),然后以蛋白浓度为横坐标,以od值为纵坐标绘制标准曲线,并根据标准曲线得到样品蛋白的浓度。
3、westernblot检测肝脏组织cyp3a4蛋白表达
(1)sds-page电泳
10%分离胶(ph=8.8)的制备:
无水乙醇液封,静置20-30min,待无水乙醇与分离胶形成一条明显折现则说明分离胶凝固完全,移除液封的无水乙醇,配置浓缩胶。
5%浓缩胶(ph=6.8)的制备:
灌胶后即刻缓慢平稳地插入上样梳,注意不要带入气泡,静置20-30min,待浓缩胶完全凝固缓缓拔出上样梳,清水冲洗后备用。
采用等体积等量上样原则,根据bca试剂盒测定样品蛋白浓度,计算上样50μg总蛋白所需上样体积,用1×上样缓冲液(loadingbuffer)补齐20μl上样终体积。电泳条件:90v恒压电泳30min,调整为120v恒压电泳60min左右。
(2)转膜
本研究采用湿转法进行转膜,整个过程在电转缓冲液中进行,具体如下:
取出凝胶,根据上样marker的位置切取相应所需凝胶条带(gapdh36kda、cyp3a457kda),并置于电转缓冲液中;
剪取适当大小的pvdf膜,置于甲醇溶液中活化30s后,放入电转缓冲液中平衡5min备用;
按“三明治”结构夹好凝胶条带和滤纸,白面在上,黑面在下,按顺序放上海绵、滤纸、凝胶条带、pvdf膜、滤纸、海绵,整个操作过程在电转液中进行,排除气泡,最后夹紧夹子;
将“三明治”夹子和冰袋放入电转槽中(黑面对黑面),加入电转缓冲液至电转槽所需电转刻度,将电转槽置于冰盒中,四周以冰块包围减少电转产热。电转条件:300ma恒流电转90min。
(3)封闭
转膜后,取出pvdf膜,标记正反面,放入新鲜配置的5%脱脂奶粉封闭液中,37℃恒温摇床中封闭1.5-2h。
(4)一抗二抗孵育
用1×tbst洗涤封闭后的pvdf膜,每次5min,洗涤6次。用滤纸将pvdf膜上洗涤液吸干,放入配置好的一抗中,4℃过夜孵育。本研究所用gapdh抗体由美国proteintech公司提供,小鼠抗人单克隆抗体,效价1∶10000;所用cyp3a4抗体由英国abcam公司提供,兔抗人单克隆抗体,效价1∶20000。抗体均由5%bsa稀释。次日,取出pvdf膜,用1×tbst洗涤,每次5min,洗涤6次。用滤纸将pvdf膜上洗涤液吸干后,放入配置好的二抗中,37℃恒温摇床中孵育120min。二抗由美国proteintech公司提供,hrp标记的山羊抗兔igg和hrp标记的山羊抗小鼠igg抗体,效价1∶5000使用。
(5)化学发光成像
本研究采用美国millipore公司提供的milliporewesternblot化学发光hrp底物ecl发光液进行化学发光成像。按照说明书取体积比为1∶1的a试剂和b试剂混合均匀制成反应液,在美国proteinsimple公司的fc-e型化学发光成像系统中成像。采用alphaviewsa软件进行光密度积分值分析。以gapdh为内参,同一样品的目的蛋白与内参蛋白的比值来表示该样品目的蛋白的相对表达量。
通过westernblot检测代谢酶cyp3a4蛋白表达,采用spearman相关性分析hnf1a-as1、nonhsat031260与cyp3a4蛋白表达的相关性,具体如下:
(1)如图8所示,hnf1a-as1表达与cyp3a4蛋白表达呈中度正性相关(r=0.456,p<0.05);
(2)如图9所示,nonhsat031260表达与cyp3a4蛋白表达呈中度正性相关(r=0.605,p<0.001)。
通过上述研究我们发现,机体肝组织中的两种lncrnas(nahnf1a-as1和nonhsat031260)表达与机体cyp3a4代谢酶的表达呈正相关,这为了解机体cyp3a4代谢酶表达的个体差异、为临床个体化用药和精准医疗提供了新的思路。
通过检测hnf1a-as1和nonhsat031260的表达,我们可以评估机体cyp3a4代谢酶的活性,从而可以指导临床药师调节患者使用药物剂量。
因此,hnf1a-as1和nonhsat031260可以应用在检测机体cyp3a4代谢酶表达的试剂盒中。
第四部分:hnf1a-as1和nonhsat031260的应用
hnf1a-as1的上游引物的核苷酸序列如序列表中seqno.6所示,下游引物的核苷酸序列如序列表中seqno.7所示。
nonhsat031260的上游引物的核苷酸序列如序列表中seqno.8所示,下游引物的核苷酸序列如序列表中seqno.9所示。
为方便检测,可将gapdh作为内参,其核苷酸序列如序列表中seqno.10所示。gapdh的上游引物的核苷酸序列如序列表中seqno.11所示,下游引物的核苷酸序列如序列表中seqno.12所示。
本发明的所提供的检测hnf1a-as1和nonhsat031260表达量的试剂盒,包括上述两个标记物的引物和用于检测gapdh内参的引物。
具体来讲,该试剂盒包括以下用于20μlqpcr反应体系的试剂:
具体检测操作方法参考上述第三部分quantitivereal-timepcr检测肝脏组织hnf1a-as1和nonhsat031260的表达水平。
通过检测hnf1a-as1和nonhsat031260的表达,我们可以评估机体cyp3a4代谢酶的活性,从而可以指导临床药师调节患者使用药物剂量,例如:
(1)如果hnf1a-as1的表达高,则机体cyp3a4代谢酶的活性高,此时临床药师应该提高患者使用药物剂量;反之,临床药师应该降低患者使用药物剂量;
(2)如果nonhsat031260的表达高,则机体cyp3a4代谢酶的活性高,此时临床药师应该提高患者使用药物剂量;反之,临床药师应该降低患者使用药物剂量。
需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!